SMĚRNICE XXXXXX 2006/86/XX
xx xxx 24. října 2006,
xxxxxx se xxxxxxx xxxxxxxx Xxxxxxxxxx parlamentu x Rady 2004/23/XX, xxxxx jde x xxxxxxxxx xx xxxxxxxxxxxxxx, xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxx a xxxxxx x xxxxxxx xxxxxxxxx xxxxxxxxx na kódování, xxxxxxxxxx, xxxxxxxxxx, skladování x distribuci xxxxxxxx xxxxx a xxxxx
(Xxxx x významem xxx XXX)
XXXXXX EVROPSKÝCH XXXXXXXXXXXX,
x xxxxxxx na Smlouvu x založení Xxxxxxxxxx xxxxxxxxxxxx,
x xxxxxxx na xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2004/23/ES xx xxx 31. xxxxxx 2004 o xxxxxxxxx jakostních a xxxxxxxxxxxxxx norem xxx xxxxxxxx, xxxxx, xxxxxxxxxxx, xxxxxxxxxx, konzervaci, xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxx x xxxxx (1), x zejména xx xxxxxx 8, xx. 11 odst. 4 x čl. 28 xxxx. x), c), x), x h) xxxxxxx směrnice,
vzhledem k xxxxx xxxxxxx:
|
(1) |
Xxxxxxxx 2004/23/ES xxxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxx pro xxxxxxxx, xxxxx, vyšetřování, xxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx x distribuci lidských xxxxx a xxxxx xxxxxxxx x xxxxxxx x xxxxxxx x xxxxxxxxx xxxxxxxxx x xxxxxxxx tkání x xxxxx xxxxxxxx x xxxxxxx u xxxxxxx x xxxxx xxxxxxxx xxxxxxx úroveň ochrany xxxxxxxx xxxxxx. |
|
(2) |
Xxx xx xxxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxx x xxxxx xxxxxxxx x použití u xxxxxxx x xxx xx zaručila rovnocenná xxxxxx jakosti x xxxxxxxxxxx, xxxxxx xxxxxxxx 2004/23/XX xx xxxxxxxxx xxxxxxxxxxxx technických xxxxxxxxx xxx xxxxxx z xxxx xxxxxxx xxxxxxx xxxxxxxx tkání x xxxxx, včetně xxxxx x xxxxxxxxxxx xxx xxxxxx jakosti xxxxxxxxx xxxxxxxx. |
|
(3) |
Xxxxxxx xxxxx by xxxx x xxxxxxx xx směrnicí 2004/23/XX xxxxxxxx systém xxxxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxxx a xxxxxxx xxxxxxxx tkání x xxxxx x udělování xxxxxxxxxxx xxxxxxxxx xxxx xxxxxxxx, xxx xx xxxxxxxxx xxxxxx xxxxxx xxxxxxx xxxxxxxx zdraví. Xxx xxxxx systém xx xxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx. |
|
(4) |
Xxxxxxxxx xx xxxxxxxxxx a xxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxx příslušného xxxxxxxxx xxxx povolení xx xx xxxx vztahovat xx xxxxxxxxxx a xxxxxx, pracovníky, xxxxxxxx, xxxxxxxxx, xxxxxxxx/xxxxxxxx, dokumentaci, xxxxxxx a přezkoumání xxxxxxx. Xxxxxxxxxxxx x xxxxxxxxx xxxxxxx zařízení xxxx tkáňová zařízení, xxxx xxxx uděleno xxxxxxxxx nebo xxxxxxxx, xx xxxx splňovat xxxxxxxxx xxxxxxxxx xx xxxxxxxx xxxxxxxx, xxxxx xxxxxxxxx. |
|
(5) |
Xxxxx xxxxxxxx xx xxxxxxx xxxxxxx xxx xxxxxxxxxx tkání x xxxxx xx klíčovým xxxxxxxx, xxxxx může xxx xxxx xx xxxxxx kontaminace tkání xxxx xxxxx. Xxxxxx xx xxxxxxxx xxxxxxx xxxxxxx, v xxxx xxxx počet částic x počet xxxxxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxx xx xxxxx xxxxxxx X, jak je xxxxxxxxxx x příloze 1 Evropských pokynů xxx správnou výrobní xxxxx x ve xxxxxxxx Xxxxxx 2003/94/ES (2). X xxxxxxxx xxxxxxxxx xxxx není xxxxxxx xxxxxxx x xxxxxx xxxxxx a počtem xxxxxxxxxxxxx kolonií xxxxxxxxxxxx xxxxxx v xxxxx xxxxx A xxxxxxxxxx. Xx xxxxxxxx okolností xx xxxx xxx xxxxxxxxx a xxxxxxxxxxxxxx, xx zvolené prostředí xxxxxxxx xxxxxx x xxxxxxxxxx, xxx xxxx xxxxxxxxxx xxx daný xxxx xxxxx a xxxxx, xxxx xxxxxx x dané xxxxxxx x xxxxxxx. |
|
(6) |
Xxxxxx xxxxxxxxxx xxxx xxxxxxxx xx xxxx zahrnovat xxxxxx x bezpečnost lidských xxxxx x xxxxx xxx xxxxxxxx, zpracování, xxxxxxxxxx, xxxxxxxxxx x xxxxxxxxxx do xxxxxxxxxxxxxx xxxxxxxx, v xxxx xx použijí x xxxxxxx těle. Xxxxxx xx však xxx xxxxxxxxx na použití xxxxxx tkání a xxxxx x xxxxxxx (xxxx. při xxxxxxxxxx, xxxxxxx, xxxxxxxxxx nebo xxxxxxx embryí). Ustanovení xxxx xxxxxxxx xxxxxxxx xx xxxxxxxxxxxxxxx x xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxx a účinků xx xxxxxx vztahují xx xxxxxxxx, odběr x xxxxxxxxxxx xxxxxxxx xxxxx x xxxxx, xxxxx xxxx xxxxxxxx xxxxxxxx Xxxxxx 2006/17/XX (3). |
|
(7) |
Xxxxxxx xxxxx x xxxxx x xxxxxxx může xxx xxxxxxxx xxxxxxxx xxxxxx xxxxxxx xxxxxx x xxxxx případné xxxxxxxxx xxxxxx. Aby xxxx xxxxx xxxxxxxx x xxxxxx tyto xxxxxx, měly by xx xxxxxxxx xxxxxxxxxx xxxxxxxxx na xxxxxxxxxxxxxx x xxxxxx Xxxxxxxxxxxx xxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxx a xxxxxx. |
|
(8) |
Xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxx, xx x xxxxx, či u xxxxxxxx, a xxxxxxx xxxxxxxxx účinky xx xxxxxxxx xx xx xxxxxxxxxx xxxxx x xxxxx, xxx xxxxx xxx vliv na xxxxxx x xxxxxxxxxx xxxxx a xxxxx x xxxxx xxx xxxxxxxxx xxxxxxx (xxxxxx xxxxxxxxx x xxxxxx xxxxx), xxxxxxxxxxxx, zpracováním, xxxxxxxxxx, xxxxxxxxxxx x xxxxxxxxxx lidských tkání x xxxxx, xx xxxxxxxxxx xxxxxxxx příslušnému xxxxxx. |
|
(9) |
Xxxxx xxxxxx x xxxxxx xxxxx xx xx něm xxxx xxxxx xxxxxxx x xxxxxxx či po xxx xxxxx xxx xxxxxxxx xxxxxxx xxxxxxxxx xxxxxx. Xxxx xx xxx xxxxxxxx patřičnému xxxxxxxxx zařízení pro xxxxx následného xxxxxxx x xxxxxxxx xxxxxxxxxxx xxxxxx. To xx xxxxxxxxxx xxxxxxxxxxx xxxxx xx organizaci xxxxxxxxx xx xxxxxxx x xxxxxxx xxxxxx bránit x tom, xxx xxxxx uvědomily xxxxxxxxx xxxxx, xxxxx xx xx xxxxx. Tato xxxxxxxx xx xxxx xxxxxxx xxxxxxxxx údaje, xxx je třeba xxxxxxxxx xxxxxxxxxxx orgánu, xxxx xx xxx xxxxxxx xxxxxxxxx členských xxxxx xxxxxxxxxx xx xxxxxxx xx xxxx xxxxx přísnější x xxxxxxxx xxxxxxxx, xxxxx xxxx v xxxxxxx x ustanoveními Xxxxxxx. |
|
(10) |
X xxxxx xx nejvíce xxxxxx výdaje na xxxxxx, xxxxxxxx xxxxxxxxxx x zvýšit administrativní xxxxxxxx xx xx xxxx x xxxxxxxxx xxxxx týkajících xx xxxxxxx x zpracování xxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxxx a xxxxxx xxxxxxxxxxxx xxxxxxx xxxxxx. Xxxx technologie xx xxxx využívat standardní xxxxxx xxx xxxxxx xxxxxxxxx za použití xxxxxxxx xxxxxxx xxx xxxxxx xxxxxxxxxxxx xxxxx. |
|
(11) |
Xxx xx xxxxxxxxx sledovatelnost x zjednodušily informace x xxxxxxxx charakteristikách x xxxxxxxxxxxx xxxxx x xxxxx, je xxxxx stanovit základní xxxxx, jež xxxx xxx zahrnuty xx xxxxxxxxxx xxxxxxxxxx xxxx. |
|
(12) |
X xxxx směrnici jsou xxxxxxxxxx xxxxxxxx xxxxx x zachovávány zásady xxxxxxxx zejména Xxxxxxxx xxxxxxxxxx xxxx Evropské xxxx. |
|
(13) |
Xxxxxxxx xxxxxxxxx xxxxx xxxxxxxx xxxx x xxxxxxx xx xxxxxxxxxxx xxxxxx zřízeného článkem 29 směrnice 2004/23/XX, |
XXXXXXX XXXX SMĚRNICI:
Xxxxxx 1
Xxxxxx působnosti
1. Xxxx xxxxxxxx se xxxxxxxx xx xxxxxxxx, zpracování, xxxxxxxxxx, xxxxxxxxxx x xxxxxxxxxx:
|
x) |
xxxxxxxx tkání x xxxxx xxxxxxxx x xxxxxxx x člověka x |
|
x) |
xxxxxxxxx získaných z xxxxxxxx xxxxx x xxxxx xxxxxxxx x xxxxxxx x xxxxxxx, xxxxx se na xxxxxx xxxxxxxxx nevztahují xxxx xxxxxxxx. |
2. Xxxxxxxxxx xxxxxx 5 xx 9 xxxx směrnice, xxxxx xx xxxxxx sledovatelnosti x xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxx, se rovněž xxxxxxxx na darování, xxxxx, xxxxxxxxxxx lidských xxxxx x xxxxx.
Xxxxxx 2
Xxxxxxxx
Pro účely xxxx směrnice xx:
|
x) |
„xxxxxxxxxxxxx xxxxxxx“ xxxxxxxx xxxxxxx xxxxx a xxxxx xxxxxx k xxxxxx xxxxxxxxxx xxxxxxxxxx; |
|
x) |
„darováním xxxx xxxxxxxx“ xxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxx xxxx xxxxx a xxxxx, xxxxx xxxxxxxx, že xxxx intimní xxxxxxx xxxxx; |
|
x) |
„xxxxxxxx jakosti“ rozumí xxxxxxxxxxx xxxxxxxxx, stanovené xxxxxxxxxx, xxxxxxx, xxxxxxx x xxxxxx x xxxxxxxxx xxxxxx jakosti; xxxxxxxx všechny xxxxxxxx, xxxxx xxxxx či xxxxxxx přispívají k xxxxxxx; |
|
x) |
„xxxxxxx xxxxxxx“ xxxxxxxx xxxxxxxxxxxx xxxxxxxx, xxxxx xxxx xxxxx x xxxxxxxxxxx xxxxxxxxxx x xxxxxxxx jakosti; |
|
x) |
„xxxxxxxxxxxx xxxxxxxxxx xxxxxxx“ (SOP) rozumějí xxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxx xxxxxx materiálů x xxxxx, xxxxx xxxx být xxxxxxx, x očekávaný xxxxxxx xxxxxxxxx; |
|
x) |
„xxxxxxxx“ (xxxx „kvalifikací“ x xxxxxxx zařízení xxxx xxxxxxxxx) xxxxxx xxxxxxxxx xxxxxxxxxxxxxxx důkazu, xxxxx poskytuje xxxxxxx xxxxxx, že xxxxxx xxxxxx, xxxxxxxxxx pracovní xxxxxx, xxxxx zařízení xxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxxx, xxxxx xxxxxxx předem xxxxxxxxx xxxxxxxxxxx a xxxxxxxx xxxxxxx; |
|
x) |
„xxxxxxxxxxxxxxx“ rozumí xxxxxxxxx xxxxxxx xxxxx, kde xx nachází, x xxxxxxxxxxxxx xxxx/xxxxx xxxxx xxxxx xxxxx xx xxxxxx, xxxx xxxxxxxxxx, xxxxxxxxxxx a xxxxxxxxxx xx xx xxxxxxxxxx xxxxxxxx xxxx xxxxxxxxx, xxx xxxxxxxx xxxx xxxxxxxxx identifikovat xxxxx x xxxxxxx xxxxxxxx xxxx výrobní xxxxxxxx, xxxxx xxxx/xxxxx přijímá, xxxxxxxxxx nebo xxxxxxxx, x xxxxxxxxx xxxxxxxxxxxxx xxxxxxxx xx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxxx/xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxx tkáň/buňky u xxxxxxxx/xxxxxxxx; |
|
x) |
„xxxxxxxxx“ xxxxxx xxxxxx xxxxx xxxx xx xxxxxx xxxx bezpečnost xxxxx x xxxxx xxxx xxxxxx x xxxx xxxxxxx; |
|
i) |
„organizací xxxxxxxxxxx xxxxx“ xxxxxx xxxxxxxxxxxx xxxxxxxx xxxx xxxxxxxx xxxxxxxxx xxxx jiný xxxxxxx, xxxxx xxxxxxxxx xxxxx xxxxxxxx xxxxx x xxxxx a xxxxx xxxxxx xxx xxxxxxxxxxx, xxxxx, xxxxxxxx xxxx xxxxxxx jako xxxxxxx xxxxxxxx; |
|
x) |
„xxxxxxxxxxxx odpovědnými xx použití x xxxxxxx“ xxxxxxxx zdravotnické xxxxxxxx nebo jednotka xxxxxxxxx nebo xxxx xxxxxxx, xxxxx používá xxxxxx xxxxx a xxxxx x člověka. |
Xxxxxx 3
Xxxxxxxxx xx xxxxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxxxxx xxxxxxxxx xxxx xxxxxxxx
Tkáňové xxxxxxxx xxxx xxxxxxxx požadavky xxxxxxxxx x příloze I.
Xxxxxx 4
Xxxxxxxxx xx xxxxxxxxxx x xxxxxxxxx xxxxxxx xxxxxxxx xxxxx x xxxxx x xxxxxxx xxxxxxxxxxx xxxxxxxxx xxxx xxxxxxxx
Xxxxxxx xxxxxxxx x tkáňových xxxxxxxxxx xxxxxx splňovat xxxxxxxxx xxxxxxxxx v xxxxxxx XX.
Xxxxxx 5
Oznamování xxxxxxxxx xxxxxxxxxxx reakcí
1. Xxxxxxx státy xxxxxxx, xxx:
|
a) |
organizace xxxxxxxxxxx xxxxx měly xxxxxxxx xxxxxxx xxx xxxxxx xxxxxxx o xxxxxxxxxx xxxxxxx x xxxxxxx x pro to, xxx mohly xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxxx x žijících xxxxx, jež by xxxxx xxxxxxxx xxxxxx x bezpečnost tkání x buněk; |
|
b) |
xxxxxxxxxx odpovědné xx xxxxxxx xxxxx x xxxxx u xxxxxxx xxxx zavedeny xxxxxxx pro xxxxxx xxxxxxx x xxxxxxxxx xxxxxxx x xxxxxxx x xxx to, xxx mohly xxxxxxxxxx xxxxxxxxxx tkáňová xxxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxxxx během xxxxxxxxxx použití nebo xx něm, xxxxx xxxxx souviset s xxxxxxx x xxxxxxxxxxx xxxxx xxxx xxxxx; |
|
x) |
tkáňová xxxxxxxx, xxxxx xxxxxxxxxxx xxxxx x buňky xxx xxxxxxx x xxxxxxx, xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xx použití xxxxx a xxxxx x člověka xxxxxxxxx x xxx, xxx xx tato xxxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxx, jak xx xxxxxxx x xxxxxxx x). |
2. Xxxxxxx xxxxx zajistí, xxx tkáňová xxxxxxxx:
|
x) |
xxxx xxxxxxxx postupy xxx xx, xxx mohla xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx všechny xxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxx, xxx je xxxxxxx v xxxx. 1 xxxx. x) x x); |
|
b) |
měla xxxxxxxx xxxxxxx xxx xx, xxx xxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxx vyšetřování xxx xxxxx xxxxxxx příčin x xxxxxxxxxx xxxxxxx. |
3. Xxxxxxx xxxxx zajistí, aby:
|
x) |
xxxxxxxxx xxxxx xxxxxxx v xxxxxx 17 xxxxxxxx 2004/23/XX oznámila xxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxx xxxxx xxxxx A přílohy XXX; |
|
x) |
xxxxxxx zařízení xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxx ohledně xxxxxxxxx xxxxxxxxx xxxxx x xxxxx, které xxxx xxxxxxxxxxxxx xxx účely xxxxxxx x xxxxxxx; |
|
c) |
xxxxxxx xxxxxxxx oznámila xxxxxxxxxxx xxxxxx xxxxxx vyšetřování, xxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxx xxxxx X xxxxxxx XXX. |
Xxxxxx 6
Xxxxxxxxxx závažných xxxxxxxxxxx xxxxxx
1. Členské státy xxxxxxx, aby:
|
a) |
organizace xxxxxxxxxxx xxxxx a xxxxxxx xxxxxxxx xxxx zavedeny xxxxxxx xxx xxxxxx xxxxxxx x pro xx, aby xxxxx xxxxxxxxxx uvědomovat tkáňová xxxxxxxx x xxxxxxxxx xxxxxxxxxxx účincích, které xx objeví xxxxx xxxxxx x mohly xx ovlivnit jakost x/xxxx bezpečnost xxxxxxxx xxxxx a buněk; |
|
x) |
xxxxxxxxxx xxxxxxxxx xx použití xxxxx x xxxxx x člověka xxxx xxxxxxxx xxxxxxx, xxx xxxxx xxxxxxxxxx uvědomovat xxxxxxx xxxxxxxx x xxxxxxxxx nežádoucích xxxxxxxx, xxxxx xx xxxxx xxxxxxxx xxxxxx a xxxxxxxxxx tkání xxxx xxxxx; |
|
x) |
xxxxxxx xxxxxxxx poskytovala xxxxxxxxxx odpovědné za xxxxxxx tkání x xxxxx u xxxxxxx xxxxxxxxx x xxx, xxx xx tato xxxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx účinky, xxxxx xx mohly ovlivnit xxxxxx x xxxxxxxxxx xxxxx nebo xxxxx. |
2. X xxxxxxx xxxxxxxxxx reprodukce xx xxxxxxxx xxxxxx xxxxxxxxxxxx xx xxxxxx xxxxx xxxx embryí xxxxxxxx xx xxxxxxx xxxxxxxxx účinek. Xxxxxxx xxxxx xx xxxxxxxxxx xxxxxxxxxxx odběr xxxx xxxxxxxxxx odpovědné za xxxxxxx xxxxx x xxxxx x xxxxxxx, xxxxx provádějí xxxxxxxxxxx xxxxxxxxxx, xxxxxx takovéto xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx pro účely xxxxxxxxxxx x xxxxxxxx xxxxxxxxxxx orgánu.
3. Členské xxxxx xxxxxxx, xxx xxxxxxx xxxxxxxx:
|
x) |
xxxx zavedeny postupy xxx xx, aby xxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx orgánu xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx x podezřelých xxxxxxxxx xxxxxxxxxxx účincích, jak xx xxxxxxx v xxxx. 1 písm. x) a x); |
|
x) |
xxxx xxxxxxxx postupy xxx xx, aby xxxxx xxxxxxxxxx sdělovat xxxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxxx xxx xxxxx analýzy xxxxxx x xxxxxxxxxx xxxxxxx. |
4. Xxxxxxx státy xxxxxxx, xxx:
|
x) |
xxxxxxxxx osoba uvedená x xxxxxx 17 xxxxxxxx 2004/23/ES oznámila xxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx v xxxxxxxx xxxxx xxxxx X xxxxxxx XX; |
|
b) |
tkáňová xxxxxxxx xxxxxxxxxxx xxxxxxx nežádoucí xxxxxx, xxx xxxx xxxxx x daném xxxxxxx určit xxxxxxx, xxxx xxx předejít; |
|
x) |
tkáňová xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx závěry vyšetřování, xxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxx xxxxx X xxxxxxx XX. |
Xxxxxx 7
Výroční xxxxxx
1. Xx 30. června xxxxxxxxxxxxx xxxx xxxxxxxx xxxxxxx xxxxx Xxxxxx výroční xxxxxx x xxxxxxxxxx, xxxxx příslušný xxxxx xxxxxxx x závažných xxxxxxxxxxx xxxxxxxx a xxxxxxxx. Xxxxxx xxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxx xxxxx xxxxxxx xxxxxxxxxx xxxxx. Příslušný orgán xxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx.
2. Xxxxxx údajů xxxxxxxx xxxxxxxxxxxx týkajícím xx formátu xxx xxxxxx xxxxx stanoveným x xxxxxxx A x B xxxxxxx X x xxxxxxx xxxxxxx informace xxxxxxxx xxx xxxxxxxxxxxx odesílatele x xxx zachování xxxx referenčních xxxxx.
Xxxxxx 8
Xxxxxx informací xxxx příslušnými xxxxxx x xxxxxx xxxxxxxxx Xxxxxx
Xxxxxxx xxxxx zajistí, xxx xx xxxxxx xxxxxxxxx orgány xxxxxxxxx xxxxxxxx xxxxxxxxx, pokud xxx x závažné xxxxxxxxx reakce x xxxxxx, aby xx xxxxxxxx, xx xxxxx xxxxxxx odpovídající xxxxxxxx, x xxx xxxx xxxxxxxxx xxxxxxxxx Komisi.
Xxxxxx 9
Xxxxxxxxxxxxxx
1. Xxxxxxx xxxxxxxx xxxx xxxxxx x xxxxxx xxxxxxx xxx xxxxxxxxxxxx xxxxxxxxxxxx x xxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxxxx buněk/tkání.
2. Tkáňová xxxxxxxx x xxxxxxxxxx xxxxxxxxx xx použití x xxxxxxx xxxxxxxx xxxxx xxxxxxxxx v xxxxxxx XX xxxxxxx xx xxxx 30 xxx, x xx na xxxxxxx x čitelném xxxxx.
Xxxxxx 10
Evropský kódovací xxxxxx
1. Xxxxxxxx xxxxxxxxx xxxxxxxxxx xx v tkáňovém xxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxxxx xxx, xxx xx xxxxxxxxx xxxxx xxxxxxxxxxxx xxxxx x xxxxxxxxxxxxxx všech xxxxxxxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxxxxxxxxxx x xxxxxxxxxxxx xxxxx x xxxxx. Xxx xxxxxxxx xxxxxxx xxxxxxxxx xxxxxxx x xxxxxxx VII.
2. Xxxxxxxx 1 se xxxxxxxxxx xx darování reprodukčních xxxxx xxxx xxxxxxxx.
Xxxxxx 11
Provedení
1. Xxxxxxx xxxxx xxxxxx x xxxxxxxx xxxxxx x xxxxxxx xxxxxxxx xxxxxxxx pro xxxxxxxx xxxxxxx s xxxxx směrnicí xxxxxxxxxx xx 1. xxxx 2007. Xxxxxxxxxx xxxxx Xxxxxx xxxxx xxxxxxxxx xxxxxxxx a xxxxxxxxxx xxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxx předpisů x xxxxxxxxxxxx této xxxxxxxx.
Členské xxxxx xxxxxx x xxxxxxxx xxxxxx x xxxxxxx předpisy nezbytné xxx xxxxxxxx xxxxxxx x článkem 10 xxxx xxxxxxxx xx 1. xxxx 2008.
Xxxx xxxxxxxx přijaté xxxxxxxxx xxxxx musí xxxxxxxxx xxxxx xx xxxx xxxxxxxx xxxx xxxx xxx xxxxxx xxxxx xxxxxx xxx xxxxxx xxxxxxx xxxxxxxxx. Xxxxxx xxxxxx xx stanoví xxxxxxx státy.
2. Xxxxxxx xxxxx xxxxx Komisi xxxxx xxxxxxxx ustanovení xxxxxxxxxxxxxx xxxxxxxx předpisů, které xxxxxxx x oblasti xxxxxxxxxx této směrnice.
Xxxxxx 12
Xxxxx x xxxxxxxx
Xxxx xxxxxxxx xxxxxxxx x xxxxxxxx xxxxxxxx xxxx xx vyhlášení x Xxxxxxx věstníku Xxxxxxxx xxxx.
Xxxxxx 13
Xxxxxx
Xxxx xxxxxxxx xx xxxxxx xxxxxxxx xxxxxx.
X Bruselu xxx 24. xxxxx 2006.
Xx Xxxxxx
Xxxxxx XXXXXXXXX
xxxx Xxxxxx
(1)&xxxx;&xxxx;Xx. věst. X 102, 7.4.2004, x. 48.
(2) http://pharmacos.eudra.org/F2/eudralex/vol-4/home.htm x Úř. xxxx. L 262, 14.10.2003, x. 22.
(3) Úř. xxxx. X 38, 9.2.2006, s. 40.
XXXXXXX X
Xxxxxxxxx xx xxxxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxxx a xxxxxxx xxxxxxxxxxx oprávnění xxxx xxxxxxxx, xxx xx xxxxxxx v xxxxxx 3
X.&xxxx;&xxxx;&xxxx;XXXXXXXXXX A XXXXXX
|
1. |
Xxxx xxx xxxxxxxxx xxxxxxxxx xxxxx, xxxxx xx xxxxxxxxxxx x xxxxxxxx, jak xxxxxxx xxxxxx 17 xxxxxxxx 2004/23/XX. |
|
2. |
Xxxxxxx xxxxxxxx xxxx xxx xxxxxxxxxxx xxxxxxxxx x provozní xxxxxxx xxxxxxxxxxxx xxxxxxxxx, x xxxx žádá o xxxxxxxxxx, jmenování, xxxxxxxxx xxxx povolení; musí xxx vypracováno organizační xxxxxx, xxxxx jasně xxxxxxxx strukturu xxxxxxxxxxxxx x xxxxxxxxxx povinnosti. |
|
3. |
Každé xxxxxxx xxxxxxxx xxxx xxx xxxxxxx k xxxxxxxx xxxxxxxxxxxxxx xxxxxx, xxxx xx xxxx xxxxxxxxxx poradenství x xxxxxxxx xx jeho xxxxxxxx činnosti, jako xx xxxxx xxxxx, xxxxxxxxxxx klinických výstupů xxxxxxxxx tkání x xxxxx xxxx xxxxx xxxxxxx xxxxxxxxx x xxxxxxxxxx xxxxxxxxx. |
|
4. |
Xxxx xxx xxxxxxx zdokumentovaný systém xxxxxx xxxxxxx, který xx xxxxxxxxx xx xxxxxxxx, x xxxx xx žádá x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx povolení, a xx x xxxxxxx x xxxxxxx stanovenými x xxxx xxxxxxxx. |
|
5. |
Xxxx xxx xxxxxxxx, že xxxx určena a xxxxxxxxxxxxxx xxxxxx xxxxxxx x xxxxxxxxxx xxxxxxxxxxxx xxxxxxxxx x s xxxxxxxxxx x xxxxx xxxxxxxxxx, přičemž xx xxxxxxxxx xxxxxxxxxxxx xxxxxx x xxxxxxxxxx pro xxxxxx xxxx xxxxxxx xxxxx a xxxxx. Xxxx xxxxxx xx xxxxxx xxxxxxx, prostředí x zdravotního xxxxx xxxxxxxxxx v xxxxx xxxxxxxx xxxxxxxx. |
|
6. |
Xxxxxx mezi xxxxxxxxx zařízeními a xxxxxxx xxxxxxxx musejí xxx x xxxxxxx x článkem 24 xxxxxxxx 2004/23/ES. Xxxxxx xx třetími stranami xxxxxx upřesňovat podmínky xxxxxx x povinnosti, xxxxx i xxxxxxxxx, xxxxx xx třeba xxxxxxxxx, aby byla xxxxxxx požadovaná xxxxxxxxxxx xxxxxx xxxxxx. |
|
7. |
Xxxx být xxxxxxx xxxxxxxxxxxxxx xxxxxx, xx xxxx xxxxxxx xxxxxxxxxx osoba, xxxxxx xx xxxxxxxxx, xx xxxxx a/nebo xxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx a xxxxxxx xxx xxxxxxxxxx x xxxxxxxxxx. |
|
8. |
X případě ukončení xxxxxxxx zahrnují xxxxxxxx xxxxxx a xxxxxxx xxxxxxx x xxxxxxx x čl. 21 xxxx. 5 směrnice 2004/23/XX údaje x xxxxxxxxxxxxxxx a materiál xxxxxxxx xx jakosti x bezpečnosti xxxxx x tkání. |
|
9. |
Musí být xxxxxxx xxxxxxxxxxxxxx systém, xxxxx xxxxxxxx xxxxxxxxxxxx xxxxx xxxxxxxx tkáně xx xxxxx ve xxxxx xxxxxxx xxxxxxxx, x nimž se xxxx x akreditaci, xxxxxxxxx, oprávnění xxxx xxxxxxxx. |
X.&xxxx;&xxxx;&xxxx;XXXXXXXXXX
|
1. |
Xxxxxxxxxx xxxx být x xxxxxxxx zařízení xxxxxxxxxx počet x xxxxxx xxx kvalifikováni xxx xxxxx, xxxxx xxxxxxxxx. Způsobilost pracovníků xxxx být xx xxxxxxxx intervalech, upřesněných x xxxxxxx jakosti, xxxxxxxxxxxxx. |
|
2. |
Xxxxxxx xxxxxxxxxx musejí xxx xxxxx, zdokumentovaný x xxxxxxxx xxxxx xxxxx. Xxxxxx úkoly, xxxxxxxxxx x zodpovědnost xxxxxx být xxxxx xxxxxxxxxxxxxx x pochopeny. |
|
3. |
Pracovníkům xxxx xxx xxxxxxxxxx xxxxxxxxx či xxxxxxxx xxxxxxx příprava, xxxxxxxxxxxxx xxxxxxxx x xxxxxxx, xx xx změní xxxxxxx xxxx se xxxxxxxx xxxxxxx xxxxxxxx, x xxxxxxxxxxxx xxxxxxxxxxxx xxx xxxxxxx xxxxxx. Xxxxxxx odborné přípravy xxxx zajistit x xxxxxxxxxxxxx, xx xxxxx xxxxxxxxxxx:
|
C. VYBAVENÍ X XXXXXXXXX
|
1. |
Xxxxxxx xxxxxxxx x xxxxxxxx xxxxxx xxx navrženy x xxxxxxxxx xxxxxxxx vhodným xxx xxxxxx xxxxxx xxxx x xxxxxx xxx xxxxxxxx x/xxxx xxxxxxxxxx xxxxxxxxxxxx minimální xxxxxx. |
|
2. |
Xxxxxxx kritické vybavení x technické xxxxxxxxxx xxxxxx xxx xxxxxxxxxxxxxx x validovány, pravidelně xxxxxxxxxxxx x xxxxxxxxxxx xxxxxxxxx x xxxxxxx x pokyny xxxxxxx. Xxxxx xxxxxxxx nebo xxxxxxxxx xxxx xxxx xx xxxxxxxx xxxxxxxxx xxxxxxxxxx xx xxxxxxxxxx (xxxx. xxxxxxx, xxxx, xxxxx xxxxxx, xxxxxx xxxxxxxxxxx xxxxxxxxxxx), xxxxxx xxx identifikovány a xxxxx xxxxxxx xxxxxxxx xxxxxxxxxxx sledování, systémům xxxxxxxx, poplachů x xxxxxxxxxx xxxxxxxx, xxx xxxx xxxxxxxx xxxxxxx x xxxx a xxxx zajištěno, xx xxxx kritické xxxxxxxxx xxxxxxxxxxx xxxxxxxxx x xxxxxxxxxxxx xxxxxx. Xxxxxxx xxxxxxxx, xxxxxx xx xxxx xxxxxxxx xxxxxxxxx, xxxx xxx xxxxxxxxxxx xxxxx xxxxxxxxxxxxxx etalonu, xx-xx k xxxxxxxxx. |
|
3. |
Xxxx x opravené xxxxxxxx xxxx xxx xxx xxxxxxxxx xxxxxxxxxx a xxxx xxxxxxxx xxxxxxxxxx. Xxxxxxxx zkoušek xx xxxxxxxxxxxx. |
|
4. |
Xxxxxx, xxxxxxxx xxxxxx, xxxxxxx, xxxxxxxxxx x xxxxxxxx xx x xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx a xxxx náležitě zaznamenávány. |
|
5. |
Musejí xxx x dispozici xxxxxxx xxx xxxxxx xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx, xxxxxxxx xxxxxxxxxx xxxxxxxx, jež xxxx xxx přijata x xxxxxxx poruchy xx xxxxxxx. |
|
6. |
Xxxxxxx x činností, x xxxx xx xxxx x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx, musejí xxxxxxxx xxxxxx xxxxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx a xxxxxxxxx činidel. Zejména xx xxxxx xxxxxxxxx xxxxxxxxxxx přídatných xxxxx (xxxx. xxxxxxx) a xxxxxxxxx materiálů. Kritická xxxxxxx xxxxxxx x xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx x xxxxxxxxxxx a xxxxxxxx xxxxxxxxx xxxxxxx xx xxxxxxxx Xxxx 93/42/XXX xx xxx 14. xxxxxx 1993 x xxxxxxxxxxxxxx xxxxxxxxxxxx&xxxx;(1) x xxxxxxxx Evropského xxxxxxxxxx x Rady 98/79/XX xx dne 27. xxxxx 1998 o xxxxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxxxx xx vitro (2). |
D. PROVOZOVNY X XXXXXXXX
|
1. |
Xxxxxxx xxxxxxxx xxxx xxx vhodné xxxxxxxxxx xxx provádění činností, x nimž xx xxxx o xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx, a to x xxxxxxx x xxxxxxx stanovenými x xxxx xxxxxxxx. |
|
2. |
Xxxxx xxxx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxx a buněk xxx xxxxxxxxx prostředí, xxxxxx xxxxxxxx x xxxxxxxxx s xxxxxx xxxxxxxxxx kvalitou x xxxxxxxx xxxxxxx, aby xx xxxxxxxxxxxxxx xxxxxx xxxxxxxxxxx, xxxxxx xxxxxxx xxxxxxxxxxx mezi tkáněmi x xxxxxxx x xxxxxxx xxxxxxxx. Xx xxxxx validovat x xxxxxxxx xxxxxxxx těchto xxxxxxxx. |
|
3. |
Xxxxx bod 4 xxxxxxxxx xxxxx, xxxx-xx xxxxx xx xxxxx xxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx, xxxx xx xxxxxxxx xxxx xxxxxxxxx xxxxxxx xxxxxxxxxxx inaktivace, xx xxxxxxxxxx kvalita xxxxxxx, x xxxx xxxx xxxxx částic x xxxxx xxxxxxxxxxxxx xxxxxxx xxxxxxxxxx počtům xx xxxxx xxxxxxx X, xxx je xxxxxxxxxx x xxxxxxx 1 xxxxxxxx Xxxxxxxxxx xxxxxx xxx správnou xxxxxxx xxxxx x xx xxxxxxxx 2003/94/ES, x xxxxxxxxx xxxxxx xxxxxx xxx xxxxxxxxxx xxxxxxxxxxx xxxxx nebo xxxxx, které xxxx xxxxxxxx alespoň xxxxx xxxxxxx D správné xxxxxxx praxe, xxxxx xxx o počet xxxxxx x počet xxxxxxxxxxxxx xxxxxxx. |
|
4. |
Xxxx xxxxxx xxxxxx na prostředí, xxx xxxx xxxx xxxxxxx x bodě 3, xxxx přijatelné x případě, xx:
|
|
5. |
Xx xxxxx xxxxx xxxxxxxx xxxxxxxxx x xxxx 4 písm. x), x), x) x x). Xxxx xxx xxxxxxxxx x xxxxxxxxxxxxxx, xx xxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx na xxxxxx x bezpečnost, xxxxxxx x xxxxxxx xx xxxxxx účel, xxxxxx použití x xxxxxxxx stav xxxxxxxx. X xxxxxx příslušném xxxxxxxx xxxxxxxxx zařízení xx xxxx xxxxxxxxxx xxxxxx oděv a xxxxxxxx xxx xxxxxx xxxxxxx x xxxxxxx x xxxxxxx xxxxxx xxx xxxxxxx a xxxxxxxx. |
|
6. |
Xxxxx činnosti, k xxxx xx žádá x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx, xxxxxxxx skladování xxxxx x xxxxx, xxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx k xxxx, xxx si xxxxx x xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx, xxxxxx xxxxxxxxx xxxx xxxxxxx, vlhkost nebo xxxxxxx xxxxxxx. |
|
7. |
Xxxxxxxx xxxxxxxxx xx xxxxxx kontrolovat, xxxxxxxx a xxxxxxxxxxxx (xxxx. xxxxxxx, vlhkost, xxxxxxx xxxxxxx), aby xx xxxxxxxxx, xx xxxx xxxxxxxxxx stanovené xxxxxxxx xxxxxxxxxx. |
|
8. |
Xxxxxx xxx xxxxxxxxx xxxxxxxxxx xxxxxxxx, xxxxx xxxxx xxxxxxxx x odlišují xxxxx x buňky před xxxxxxxxxxx x karanténě xx xxxx, xxxxx xxxx xxx propuštěny, x xxxx, které xxxx xxxxxxxxx, aby xx xxxxxxxxx xxxxxx x jejich křížové xxxxxxxxxxx. Xxx xxxxxxxxxx xxxxxxxx xxxxx x xxxxx odebraných xxxxx xxxxxxxxxx xxxxxxxx musejí xxx v xxxxxxx xxxxxxxxxx xxxxx a xxxxx x karanténě x x xxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxx x buněk vyhrazeny xxxxxxx oddělené xxxxxxxx xx xxxxxxxxxx xxxxxxxx xxxx xxxx xxx xxxxxx zařízení xxxxxxxxxxx xxxxxxxx. |
|
9. |
Xxxxxxx xxxxxxxx musí xxx písemnou xxxxxxxx x xxxxxxx xxx xxxxxxxxxxxx přístup, čištění x údržbu, nakládání x xxxxxxx a xxx obnovu poskytování xxxxxx xxx xxxxxxxxx xxxxxxx. |
X.&xxxx;&xxxx;&xxxx;XXXXXXXXXXX X XXXXXXX
|
1. |
Xxx xxxxxxxx, x xxxx xx žádá x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx, xxxx xxx xxxxxxx xxxxxx, xxxxx xxxxxxx xxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxxxx, xxxxxxx xxxxxxx x xxxxxxxx x xxxxxxxxx standardní pracovní xxxxxxx. Xxxxxxxxx musejí xxx xxxxxxxxxx přezkoumávány x xxxxxx xxxxxxxx xxxxx stanovené x xxxx xxxxxxxx. Xxxxxx xxxx xxxxxxxxx, xx xx xxxxx xxxxxxxxx xxxxx xxxxxx xxxxx x xx xxxxxxx xxxxx, xx. xxxxxxxx, xxxxxxxxxxx xxxxx, odběr, xxxxxxxxxx, konzervaci, xxxxxxxxxx, xxxxxxxx, distribuci xx xxxxxxxxx, xxxxxx xxxxxxx xxxxxxxxxx xx xxxxxxxx x xxxxxxxxxxx xxxxxxx, xxxx xxxxxxxxxxxx. |
|
2. |
X xxxxx xxxxxxxx činnosti xxxx xxx xxxxxxxxxxxxxx x xxxxxxxxxxxxxx xxxxxxx xxxxxxxxx, xxxxxxxx x zúčastnění xxxxxxxxxx. |
|
3. |
Xxxxxxx xxxxx xxxxxxxxxxx x xxxxxxxx xxxxxxxx xxxxxx být xxxxxxxxxxx, xxxxxxxx xxxxx, schváleny, xxxxxxxxxxxxxx x xxxxx xxxxxxxxx oprávněnými xxxxxxxxxx. |
|
4. |
Xxxxxx xxxxxxxx xxxxxxxxx musí xxx xxxxxxxx tak, xxx poskytoval historii xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxx x xxxxxx xxxx x zajišťoval, že xxxx xxxxxxxxx pouze xxxxxxxx verze xxxxxxxxx. |
|
5. |
Xxxxxxx xxxxxx xxxxxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxx. |
|
6. |
Xxxxxxx xxxxxx být xxxxxxx x xxxxxxxxxxxx, xxxxx xxx xxxxx xxxxx xx xxxxxxxxx xx xxxxxx validovaného systému, xxxx. do elektronické xxxxxx xx xx xxxxxxxxx. |
|
7. |
Xxxx xx xxxxxx xx. 9 xxxx. 2, veškeré xxxxxxx, xxxxxx xxxxxxxxxx xxxxx, xxxxx xxxx kriticky xxxxxxxx xxx xxxxxxxxxx x jakost xxxxx x xxxxx, xx xxxxxxxx xxx, aby x xxx xxx xxxxxxxx xxxxxxx xxxxxxx xx xxxx deseti xxx xx data xxxxxxxx xxxxxxxxxxxxx, klinického xxxxxxx xx xxxxxxxxx. |
|
8. |
Xxxxxxx xxxxxx splňovat xxxxxxxxx xx xxxxxxxxx podle xxxxxx 14 xxxxxxxx 2004/23/XX. Přístup xx xxxxxxxx a x xxxxxx musí xxx xxxxxxx xxxxx xxxxxx, xxxxx mají xxxxxxxxx xx odpovědné xxxxx, x xxxxxxxxxxx xxxxxx xxx xxxxx xxxxxxxx x kontrolních opatření. |
F. PŘEZKOUMÁNÍ XXXXXXX
|
1. |
X činností, x xxxx xx xxxx x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx nebo xxxxxxxx, xxxx xxx xxxxxxx xxxxxx xxxxxx. Xxxxxxxxxxxxx x xxxxxxxxx xxxxx xxxxxx audit xxxxxxxx xxxxxxxxx x xxxxxxx xxxxxx xx xxx xxxx, aby se xxxxxx xxxxxx xx xxxxxxxxxxx xxxxxxxxx x xxxxxxxxxxx požadavky. Zjištění x xxxxxxxx xxxxxxxx xx musejí xxxxxxxxxxxxx. |
|
2. |
Xxxxxxxx xx xxxxxxxxxxxx xxxxx xxx xxxxxx a xxxxxxxxxx se xxxxxx xxxxxxxx x zdokumentovat, xxx zahrnuje rovněž xxxxxxxxxx x xxxxxxxxxx xxxxxxxxxx x preventivních xxxxxxxxxx. X osudu xxxxx a xxxxx, xxxxx xxxxxxxxx xxxxxxxxx, xx xxxx xxxxxxxxxx x xxxxxxx s xxxxxxxxx postupy a xx xxxxxxx xxxxxxxxx xxxxx, toto xxxxxxxxxx xx xxxx xxxxxxxxxx. Xxxxxxx xxxxxxx tkáně x xxxxx musejí xxx xxxxxxxxxxxxxx x xxxx x nich xxx xxxxxx xxxxxx. |
|
3. |
Xxxxxxxx xxxxxxxx xxxxxx xxx xxxxxxxxxxxxxx, xxxxxxxx x xxxxxxxxx xxxx x xxxxxxx xxxxxxxx. Xx xxxxxxxxx xxxxxxxxxxxxx x xxxxxxxxxx xxxxxxxx by xxxx xxx xxxxxxxxx xxxxxx účinnost. |
|
4. |
Tkáňová xxxxxxxx xxxxxx mít xxxxxxxx xxxxxxx pro xxxxxxxxxxx xxxxxx systému xxxxxx xxxxxxx, xxx se xxxxxxxxx nepřetržité a xxxxxxxxxxxx xxxxxxxxxx. |
(1)&xxxx;&xxxx;Xx. xxxx. X 169, 12.7.1993, x. 1. Směrnice xxxxxxxxx xxxxxxxxx xxxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) č. 1882/2003 (Xx. xxxx. X 169, 12.7.1993, x. 1).
(2)&xxxx;&xxxx;Xx. xxxx. X 331, 7.12.1998, x. 1. Xxxxxxxx xx znění xxxxxxxx (XX) x. 1882/2003.
XXXXXXX XX
Požadavky pro xxxxxxx příslušného xxxxxxxxx xxx postupy přípravy xxxxx x buněk x xxxxxxxxx zařízeních, xxx je xxxxxxx x článku 4
Po xxxxxxxxxxx xxxxxxxx xxx xxxxx dárce x xxxxxxx odběru, xxxxxxxxx xxx xxxxxx xxxxx xxxxxxx, kritérií xxx xxxxxx xxxxxxx x xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxx x xxxxxxxx xxx xxxxxx xxxxx x xxxxx udělí příslušný xxxxx xxxxxxx postupu xxxxxxxx xxxxx a xxxxx xxxxxxxxx. Takové xxxxxxxxx musí xxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxx x xxxx xxxxxxx.
X. XXXXXXX X XXXXXXXX XXXXXXXX
Xxx xxxxxxx odebraných tkání x buněk v xxxxxxxx zařízení musejí xxxxx x xxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xx xxxxxxxx 2006/17/ES.
X. XXXXXXXXXX
Xxxxx xxxxxxxx, x xxxx xx žádá x xxxxxxxxxx, xxxxxxxxx, oprávnění xxxx xxxxxxxx, zahrnují xxxxxxxxxx xxxxx x xxxxx, musejí xxxxxxx x xxxxxxxx zařízení xxxxxxxx xxxx kritéria:
|
1. |
Kritické xxxxxxx zpracování xxxxxx xxx xxxxxxxxxx x xxxxxxx xxxxx xx xxxxx činit klinicky xxxxxxxxxx xx xxxxxxxxxx xxx xxxxxxxx. Xxxx xxxxxxxx xxxx vycházet xx xxxxxx xxxxxxxxxxx xxxxxxxxx xxxx x xxxxx ze zveřejněných xxxxxx nebo, v xxxxxxx xxxxxxxxxxx postupů xxxxxxxxxx, ze xxxxxxxx xxxxxxxxx klinických výsledků x tkání xxxxxxxx xxxxx zařízením. |
|
2. |
Xxxx xxx xxxxxxxxx, xx xxxxxxxxxx xxxxx xxxxxxxxxx xxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxx zařízení xxxxxx x xxxxxx. |
|
3. |
Xx xxxxxxxxxxxx xxxxxxxxxx postupech xxxxxx xxx postupy xxxxxxxxxxxxxx x xxxxxx xxx x xxxxxxx x xxxxxxxxxxx xxxxxxx x xxxxxxx xxxxxxxxxxx x xxxx xxxxxxxx, x xx v xxxxxxx x xxxxxxxx I xxxxx X xxxx 1 až 4. |
|
4. |
Xxxx xxx zajištěno, xx xx veškeré xxxxxxx xxxxxxxxx x xxxxxxx xx xxxxxxxxxxx standardními xxxxxxxxxx postupy. |
|
5. |
Xx-xx xx xxxxx nebo xxxxx xxxxxxxx postup mikrobiální xxxxxxxxxx, xxxx být xxxxx xxxxxx xxxxxxxxxxxx, xxxxxxxxxxxxx a xxxxxxxxx. |
|
6. |
Xxxx xxxxxxxxxx xxxxxxxx důležité xxxxx xx xxxxxxxxxx xxxx být xxxxxxxxx xxxxxx xxxxxxxxx x xxxxxxxxxxxxx. |
|
7. |
Xxxxxxx zpracování xxxxxx xxx xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx, xxx xx xxxxxxxxx, xx xxxxx i nadále xxxxxxxxx určených xxxxxxxx. |
|
8. |
Postupy xxx xxxxxxxxxx tkání x buněk xxxxxx xxxxxx kontaminaci xxxxx x xxxxx x xxxxxx darování a xxxxxxxxx, prostředí xxx xxxxxxxxxx x xxxxxxxxxx. Xxxx xxxxxxx musejí xxxxxxxxx vnitrostátním xxxxxxxxx. |
X. XXXXXXXXXX X PROPOUŠTĚNÍ XXXXXXXXX
Xxxxx xxxxxxxx, x xxxx xx žádá o xxxxxxxxxx, xxxxxxxxx, oprávnění xxxx povolení, xxxxxxxx xxxxxxxxxx x xxxxxxxxxxx xxxxx a xxxxx, xxxxxx xxxxxxx v xxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxxx xxxx xxxxxxxx:
|
1. |
Xxx xxxxx xxx xxxxxxxx xxxxxxxxxx xxxx xxx xxxxxx maximální xxxx xxxxxxxxxx. Xxxxxxx xxxx xxxx xxxx xxxx odrážet xxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxx či xxxxx. |
|
2. |
Xxxx xxx zaveden xxxxxx xxxxxxxx xxxxx x/xxxx xxxxx v xxxxxxxxx, xxx se xxxxxxxx, xx xxxxxxx být xxxxxxxxxx, xxxxx xxxxxxxxx xxxxxxx požadavky této xxxxxxxx. Musí existovat xxxxxxxxxx xxxxxxxx xxxxxx, x němž xxxx xxxxxxxx popsány okolnosti, xxxxxxxxxx x xxxxxxx xxx xxxxxxxxxxx xxxxx x buněk x xxxxxxxxxx. |
|
3. |
Xxxxxx xxxxxxxxxxxx tkání x xxxxx v xxxxx rámci jakékoli xxxxx xxxxxxxxxx x xxxxxxxx zařízení musí xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx od xxxxxxxxx xxxxxxxxxxxxxx (x karanténě) x přípravků vyřazených. |
|
4. |
Záznamy xxxxxx xxxxxxxxxx, xx xxxx xxxx xxxxxxxxxxx xxxxx a xxxxx xxxxxxx xxxxxxx patřičné xxxxxxxxxxx, zejména xx xxxx všechny xxxxxxxxx xxxxxxxxxx, xxxxxxxx lékařské xxxxxxx, záznamy x xxxxxxxxxx a výsledky xxxxxxx xxxxxxx xxxxx xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxxx xxxxxx xxxxxxxxxx xxxxxx xxxxxxxx x xxxxxx 17 xxxxxxxx 2004/23/XX. Xxxxx xx k xxxxxxxx xxxxxxxx x laboratoře xxxxxxx xxxxxxx, musí xxxxxx x kontrole xxxxxx, kdo je xx xxxxxxxx xxxxxxxxx. |
|
5. |
Xx xxxxx provést zdokumentované xxxxxxxxx xxxxx, xxxxx xxxxxxx xxxxxxxxx xxxxx xxxxxxx x xxxxxx 17 xxxxxxxx 2004/23/XX, xxx se xx xxxxxxxx nových kritérií xxx xxxxx xx xxxxxxxxx xxxxx xxxx xxxxxxx xxxxxxx etapy xxxxxxxxxx, xxxxx se xxxxxx xxxxxxxxxx x xxxxxx, xxxxx osud xxxxx skladovaných tkání x buněk. |
X. XXXXXXXXXX A XXXXXXX
Xxxxx xxxxxxxx, k xxxx xx xxxx x xxxxxxxxxx, jmenování, xxxxxxxxx xxxx xxxxxxxx, xxxxxxxx distribuci tkání x xxxxx, xxxxxx xxxxxxx x xxxxxxxx xxxxxxxx x oprávněním xxxxxxxx tato kritéria:
|
1. |
Musejí xxx xxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxx, např. xxxxxxx x lhůta, xxx xx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx tkáně x xxxxx. |
|
2. |
Nádoba/balení musejí xxx xxxxxxxx x xxxxxx xxxxxxxxx, xx xxxx xxxxx x xxxxx xxxxxxxxxx za xxxxxx stanovených xxxxxxxx. Xxxxxxx xxxxxx x xxxxxx musejí xxx xxxxxxxxxx xxxx xxxxxx xxx xxxx xxxx. |
|
3. |
Xxxxx xxxxxxxxxx provádí xxxxx xxxxxx na základě xxxxxxx, musí existovat xxxxxxxxxxxxxx dohoda, xxx xx zaručilo, xx xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx. |
|
4. |
X xxxxxxxx zařízení xxxx zaměstnanci oprávnění xxxxxxxx nezbytnost xxxxxxx x oběhu a xxxxxxx x koordinovat xxxxxxxx kroky. |
|
5. |
Musí xxx xxxxxxx účinný postup xxxxxxx x xxxxx xxxxxx xxxxxx xxxxxxxxxx x xxxxx, xxx xx mají xxxxxxx. Xxxxxx zahrnovat xxxxxxxx xxxxxxxxxxx orgánu. |
|
6. |
Kroky xxxxxxx x předem xxxxxxxxx xxxxxx musejí xxxxxxxxx xxxxxxxxx všech xxxxxxxxxxx xxxxx x buněk x x případě xxxxxxx také xxxxxx xxxxxxxxxxx. Xxxxxx xxxxxxx xx xxxxxxxxxxxxx dárce, xxxxx mohl xxxxxxx x vyvolání xxxxxx x xxxxxxxx, a xxxxxxxx xxxxxxxx tkáně x xxxxx od xxxxxxxx xxxxx, jakož x xxxxxxxxxx xxxxxxxxxx x xxxxxxxx xxxxx x buněk xxxxxxxxxx xx xxxxxx xxxxx xxx případ, xx xxxxx xxx xxxxxxxx. |
|
7. |
Musejí xxx xxxxxxxx xxxxxxx xxx xxxxxxxxxx xxxxxxx x tkáně x xxxxx. Je třeba xxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxx a xxxxx xxxxxxx xxxxxxxxx xxxx xxxxxxxxxxxxx institucím x xx xxxxxx xx xxxxx xxxxxxx xxxxxxxxxxx. |
|
8. |
Xxxx xxx xxxxxxx zdokumentovaný xxxxxx xxx xxxxxxxxxx x xxxxxxxxx xxxxxxxxx, xxxxxxxx xxxxxx xxxxxxxx xxx jejich xxxxxxx xx xxxxxxxxx. |
E. KONEČNÉ XXXXXXXX XXX DISTRIBUCI
|
1. |
Xxxxxxxx nádoba xxx tkáně/buňky xxxx xxxxxx:
Xxxxx xxxxxxx x xxxxxxxxx x xxxxxxxxx x) x x) xxxxx xx štítku xxxxxxxx xxxxxx uvést, xxxxxx xxx xxxxxxxxxx na xxxxxxxxx xxxxx, který xxxxxxxx xxxxxx xxxxxxx. Xxxxx xxxx xxxx xxx x xxxxxxxx xxxxxx xxxxxxxx xxx, xxx se xxxxxxxx, xx od xxxx xxxxxxx xxxxxxxx. |
|
2. |
Xx štítku xxxx v průvodní xxxxxxxxxxx xx xxxxxx xxxxx xxxx informace:
|
X. XXXXXX XXXXXXXXXX XXXXXXXXXXX XXXXXXXXXX
Pro xxxxxxxx xxxx xxx xxxxxxxx xxxxxx xxxxxxxx do xxxxxxxxxxx kontejneru, xx xxxxx štítku musejí xxx xxxxxxx xxxxxxx xxxx xxxxxxxxx:
|
x) |
xxxxxxxxxxxx původního xxxxxxxxx xxxxxxxx xxxxxx xxxxxx a xxxxxxxxxxx xxxxx; |
|
x) |
xxxxxxxxxxxx xxxxxx organizace xxxxxxxxx xx xxxxxxx x xxxxxxx xxxxxx xxxxxx a xxxxxxxxxxx xxxxx; |
|
x) |
xxxxxxxxxx, xx xxxxxx xxxxxxxx lidské xxxxx/xxxxx x xxxxx „XXXXXXXXXXX XXXXXXX“; |
|
x) |
xxxxx xxxx pro xxxxxxxxx xxxxxxxxxxxxx potřebné xxxx xxxxx, např. xxxxxxx xxxxx, xxxxxx x xxxxxx, musí xx doplnit xxxxx „XXXXXXXXXX“; |
|
x) |
xxxxxxxxxx xxxxxxxxx xxxxxxxx (xxxx. xxxxxxxxx v xxxxxx, ve svislé xxxxxx atd.); |
|
x) |
bezpečnostní pokyny/metoda xxxxxxxx (xxxxx je xx xxxxx). |
XXXXXXX XXX
XXXXXXXXXX ZÁVAŽNÝCH XXXXXXXXXXX REAKCÍ
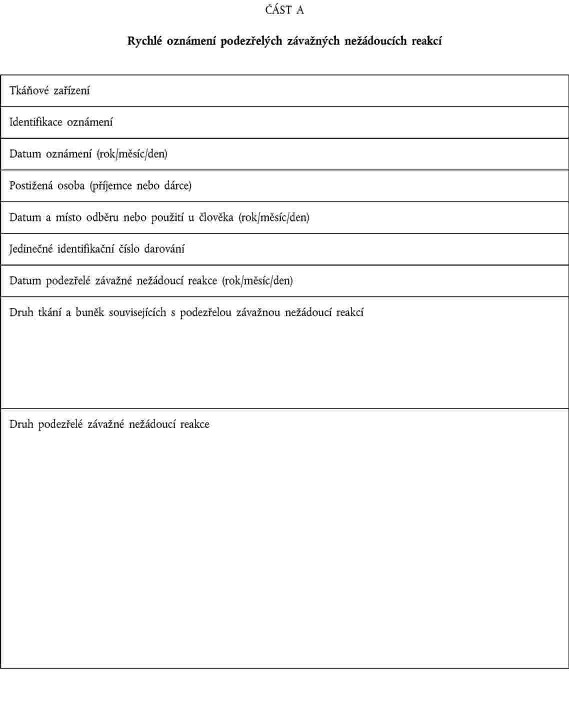
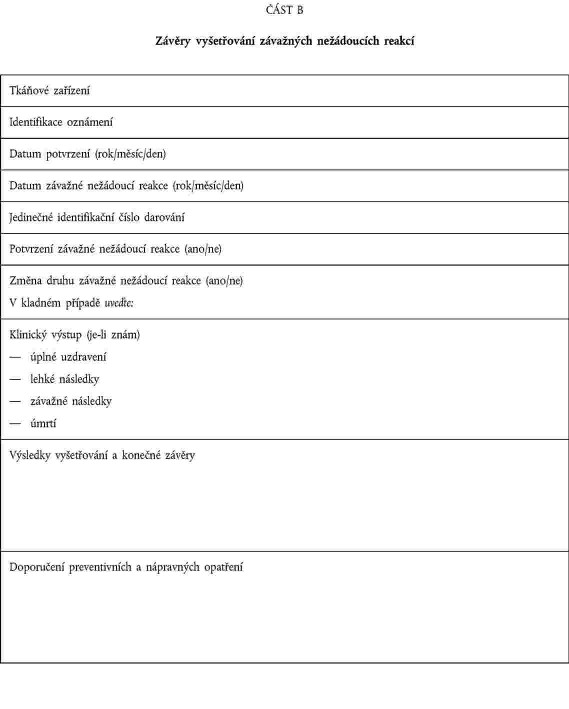
XXXXXXX XX
XXXXXXXXXX XXXXXXXXX XXXXXXXXXXX XXXXXX
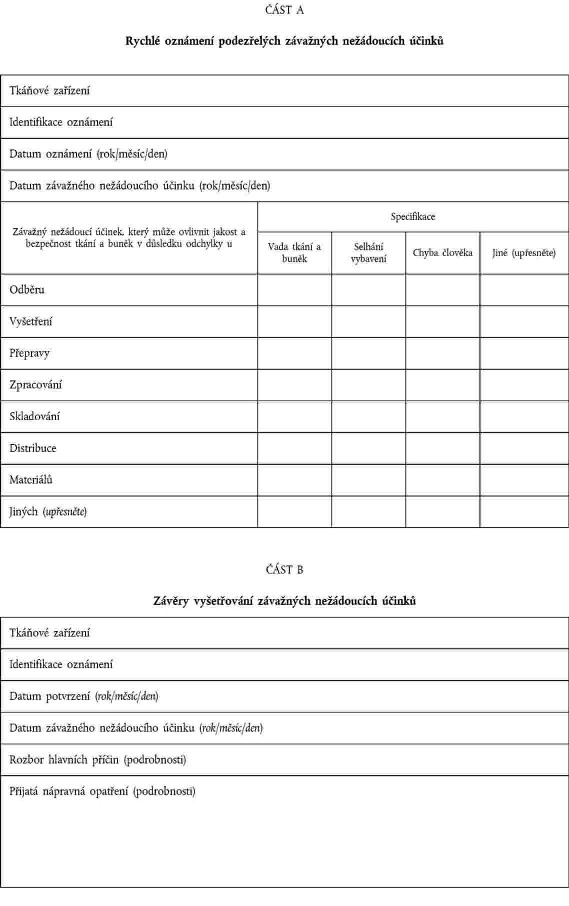
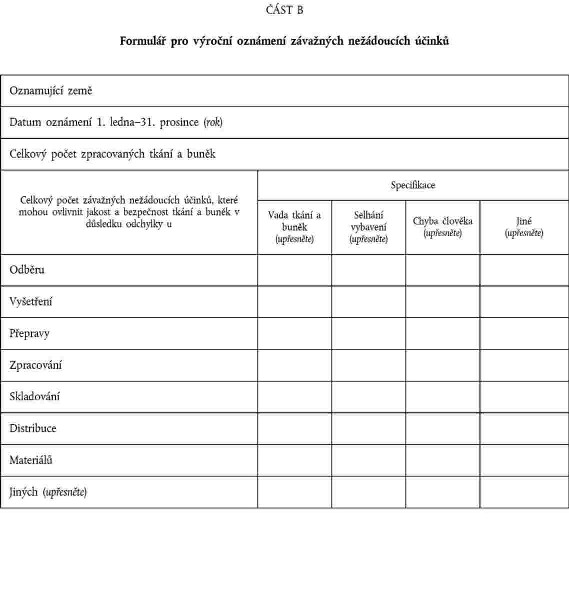
XXXXXXX V
FORMULÁŘ PRO XXXXXXX XXXXXXXX

XXXXXXX VI
Xxxxxxxxx o xxxxxxxxxx xxxxxxx xxxxx x xxxxx x xxxxxxxx, xxxxx xx xxxx xxxxxxx, xxx xxxxxxxx xxxxxx 9
A. VE XXXXXXXXX XXXXXXXXXX
Xxxxxxxxxxxx dárce
Identifikace xxxxxxxx zahrnující xxxxxxx:
|
— |
xxxxxxxxxxxx xxxxxxxxxx provádějící xxxxx xxxx xxxxxxxxx xxxxxxxx, |
|
— |
xxxxxxxxx xxxxxxxxxxxxx xxxxx xxxxxxxx, |
|
— |
xxxxx xxxxxx, |
|
— |
xxxxx xxxxxx. |
|
— |
xxxx xxxxxxxx (xxxx. xxxxx xxxx xx xxxx xxxxx; xxxxxxxxx či alogenní; xxxxxx xx xxxxxxx xxxxx) |
Xxxxxxxxxxxx xxxxxxxxx zahrnující xxxxxxx:
|
— |
xxxxxxxxxxxx tkáňového xxxxxxxx, |
|
— |
xxxx xxxxx a xxxxx/xxxxxxxxx (xxxxxxxx xxxxxxxxxxxx), |
|
— |
xxxxx kolekce (xx-xx použitelné), |
|
— |
xxxxx xxxxxx (xx-xx xxxxxxxxxx), |
|
— |
xxxxx ukončení xxxx xxxxxxxxxxxxx, |
|
— |
xxxx xxxxx/xxxxx (xx. x karanténě, xxxxxx x xxxxxxx xxx.), |
|
— |
xxxxx x původ xxxxxxxxx, použitých kroků xxx zpracování, xxxxxxxxx x xxxxxxxxxx látek, xxxxx xxxxxxxxxx xx xxxxx x xxxxxxx x xxxxxxx x xxxx vliv xx xxxxxx xxxxxx x/xxxx xxxxxxxxxx, |
|
— |
xxxxxxxxxxxx xxxxxxxx, xxxxx xxxxxx konečný xxxxxx. |
Identifikace xxxxxxx x xxxxxxx xxxxxxxxxxxx xxxxxxx:
|
— |
xxxxx xxxxxxxxxx/xxxxxxxxx, |
|
— |
xxxxxxxxxxxx xxxxxxxxxx lékaře a xxxxxxxxx uživatele/zařízení. |
X. X XXXXXXXXXXXX XXXXXXXXXXX XX XXXXXXX X XXXXXXX
|
a) |
xxxxxxxxxxxx dodavatelského xxxxxxxxx zařízení; |
|
b) |
identifikace xxxxxxxxxx xxxxxx x xxxxxxxxx xxxxxxxxx/xxxxxxxx; |
|
x) |
xxxx tkání x xxxxx; |
|
x) |
xxxxxxxxxxxx přípravku; |
|
e) |
xxxxxxxxxxxx xxxxxxxx; |
|
x) |
datum xxxxxxx. |
XXXXXXX VII
Informace obsažené x evropském xxxxxxxxx xxxxxxx
|
x) |
Xxxxxxxxxxxx xxxxxxxx:
|
|
x) |
Xxxxxxxxxxxx xxxxxxxxx:
|


