XXXXXXXX XXXXXX (ES) x. 2074/2005
ze dne 5. xxxxxxxx 2005,
xxxxxx xx stanoví xxxxxxxxx xxxxxxxx xxx xxxxxxx xxxxxxx podle nařízení Xxxxxxxxxx xxxxxxxxxx a Xxxx (XX) č. 853/2004 x xxx xxxxxxxxxx úředních xxxxxxx xxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 854/2004 x (XX) x. 882/2004, xxxxxx xx xxxxxxx xxxxxxxx xx xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx (XX) x. 852/2004 x xxxxxx xx xxxx xxxxxxxx (ES) č. 853/2004 a (XX) x. 854/2004
(Xxxx x xxxxxxxx xxx EHP)
XXXXXX XXXXXXXXXX XXXXXXXXXXXX,
s ohledem xx Xxxxxxx x xxxxxxxx Evropského společenství,
x xxxxxxx na xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 852/2004 xx xxx 29. dubna 2004 x hygieně xxxxxxxx (1), x xxxxxxx xx čl. 13 xxxx. 2 xxxxxxxxx xxxxxxxx,
x xxxxxxx xx xxxxxxxx Evropského xxxxxxxxxx x Rady (ES) x. 853/2004 xx xxx 29. xxxxx 2004, kterým xx xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxxxxxx xxxxxx (2), x xxxxxxx xx xxxxxx 9, 10 x 11 uvedeného xxxxxxxx,
x xxxxxxx na xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 854/2004 xx xxx 29. dubna 2004, xxxxxx xx xxxxxxx zvláštní pravidla xxx organizaci úředních xxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx určených k xxxxxx xxxxxxxx (3), x xxxxxxx na xxxxxx 16, 17 x 18 uvedeného xxxxxxxx,
x ohledem xx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (ES) x. 882/2004 ze xxx 29. dubna 2004 x xxxxxxxx xxxxxxxxxx xx účelem xxxxxxx xxxxxxxxxx právních xxxxxxxx xxxxxxxxxx xx xxxxx x xxxxxxxx x xxxxxxxx o xxxxxx xxxxxx x xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxx (4), a xxxxxxx na xxxxxx 63 xxxxxxxxx nařízení,
xxxxxxxx x těmto důvodům:
|
(1) |
Xxxxxxxx (XX) x. 853/2004 xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx pro xxxxxxxxx xxxxxxxxxxx xxxxxx. Xx xxxxx stanovit xxxxxx xxxxxxxxx xxxxxxxx xxx xxxx, xxxx mlže, xxxxxxxx xxxxxxxx, xxxxx, xxxxx, xxxx stehýnka x xxxxxxxx x x nich xxxxxxxxxx xxxxxxx. |
|
(2) |
Xxxxxxxx (XX) x. 854/2004 stanoví zvláštní xxxxxxxx xxx organizaci xxxxxxxx xxxxxxx produktů xxxxxxxxxxx původu určených x xxxxxx xxxxxxxx. Xx xxxxx upřesnit xxxxxx xxxxxxxx x xxxxxxxx xxxxx xxxxxxxxx. |
|
(3) |
Xxxxxxxx (XX) č. 882/2004 xxxxxxx na úrovni Xxxxxxxxxxxx harmonizovaný rámec xxxxxxxx pravidel xxx xxxxxxxxxx úředních xxxxxxx. Xx xxxxx upřesnit xxxxxx xxxxxxxx a xxxxxxxx další požadavky. |
|
(4) |
Rozhodnutím Xxxxxx 20XX/.../XX (5) xx xxxx xxxxxxx xxxxxxxxxx, xxxxxxx xx xxxxxxxxx opatření xxxxxxx xxxxxxxxx xxxxxxxx Evropského xxxxxxxxxx x Xxxx 2004/41/XX xx xxx 21. xxxxx 2004, xxxxxx xx xxxxxxx xxxxxxx xxxxxxxx xxxxxxxx xx xxxxxxx xxxxxxxx x hygienických podmínek xxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxx x lidské xxxxxxxx x xxx xxxxxx uvádění xx xxx x xxxxxx xx mění směrnice Xxxx 89/662/XXX x 92/118/XXX a rozhodnutí Xxxx 95/408/XX (6). Xxxxxxx xxxxx příslušných xxxxxxxxxx xx xxxx xxxx xxxxxx xxxxxxxxx x xxxxx nařízení. |
|
(5) |
Xxxxxxxx (XX) x. 852/2004 xxxxxxxx od xxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx, xxx xxxxx a xxxxxxxxxx xxxxxxx x xx xxxxxx zpřístupnili příslušné xxxxxxxxx x xxxxxx xxxxxxx xxxxxxxxxxx orgánu x xxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx, který xx xxxxxx xxxxxxxxxxx. |
|
(6) |
Nařízení (XX) x. 853/2004 xxxxxx xx xxxxxxxxxxxxx jatek xxxxxxxx, xxx xxxxxxxxxx, xxxxxxxx x xxxxxxxxxxxxx xxxxxxxxx x xxxxxxxxxxxx xxxxxxx pro xxxxxxx xxxxxxx xxxxx xxxxxxx, xxxxx xxxx odeslána xxxx xxxx být xxxxxxxx na jatka, x xxx podle xxxxxx xxxxxxxxx xxxxxxx. Xxxxx xxxx xx xxxx xxxxxxxx, aby xxxxxxxxx x potravinovém xxxxxxx xxxxxxxxxx veškeré xxxxxxxxxxx xxxxxxxxxx podle xxxxxxxx (XX) x. 853/2004. |
|
(7) |
Xxxxxxxxx o xxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxx při xxxxxxxxxxxx xxxxxxxx a xxxxxxxx xxxxxxxxxxxxx xxxxxx umožňují xxxxxxxx požadované kontrolní xxxxxxx. Xxxxxxxxx x xxxxxxxxxxxx xxxxxxx xx xxx xxxxxxxxxx úřední xxxxxxxxxxx lékař a xxxx xx se xxxxxxxx xxxx xxxxxxx xxxxxxx kontrolních xxxxxxx. |
|
(8) |
Xx xxxxx xx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxx xxxxxxxxx x xxxxxxxxxxx xx xxxxxxxxxx xx informace x xxxxxxxxxxxx řetězci xxxxx xxxxxxxx (XX) x. 854/2004. |
|
(9) |
Xx xxxxx xxxxxxx xxxxxx zvířat v xxxxxxxxxxxx podle xxxxxxxx (XX) x. 854/2004 xx měl úřední xxxxxxxxxxx lékař zaznamenat x x xxxxxxx xxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxxxxxxxx podniku, xx xxxxxxx xxxxxxx pocházejí, x jakémukoli veterinárnímu xxxxxx xxxxxxxxxx x xxxxxxxxxxxx, ze xxxxxxx xxxxxxx pocházejí, nebo xxxxxxxxxx xxxxxxxxx příslušnému xxxxxx xxxxxxxxx chorobu xxxx stav xxxxxxxx xx xxxxxxx s xxxxxxx xx xxxxxxxxxx xxxxxxx nebo na xxxxx/xxxxx, xxxxx mohou xxx xxxx xx xxxxxxx zdraví xxxx xxxxxx xxxxxx xxxx xxxxxxx xxxxx xxxxxxx xxxxxxxx xxxxxx. |
|
(10) |
Nařízení (ES) x. 853/2004 a (XX) x. 854/2004 xxxxxxx xxxxxxxxx pro xxxxxxxx parazitů xxx xxxxxxxxxx x xxxxxxxx xxxxxxxx xx pevnině x xx palubě xxxxxxxx. X souladu x xxxxxxxx xxxxx xxxxxxx XXX xxxxxx XXXX xxxxxxxx V xxxxx X xxxxxxxx (XX) č. 853/2004 xxxx provozovatelé xxxxxxxxxxxxxxx xxxxxxx zajistit, aby x xxxxxxxx xxxxxxxx xxxxxxxx xx všech xxxxxx xxxxxxxx vlastní xxxxxxxx s xxxxx xxxxxxx tomu, xxx xxxx ryby viditelně xxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxx spotřebě. Xxxxxxx xxxxxxxxxx pravidel xxxxxxxxxx xx xxxxxxxx xxxxxxxx s sebou xxxx xxxxxxx xxxxxxxxx xxxxx viditelných xxxxxxxx x xxxxxxxx xxxxxxxx x xxxxxxxx xxxx x xxxxxxxxx xxxxxxxxxx. |
|
(11) |
Xxxxxxxx xxxxxxxxx v xxxxxxxx (XX) x. 853/2004, xxxxxxx xxxxxx je xxxxxxxx uvádění na xxx xxxxxxxx xxxxxxxx xxxxxxxxxx x xxxxxx xxxxxxxx, xxxxx xxxxxxxxx x xxxxxx chemická xxxxxxxxx včetně xxxxxxx xxxxxx xxxxxxx xxxxxx xxxxxxxx xxxx (ABVT). X případě některých xxxxx xx třeba xxxxxxxx xxxxxx ABVT, xxxxx nesmí xxx xxxxxxxxxx, x xxxxx xxxxxxxxxxx použitelných metod xxxxxxx. Mělo by xx pokračovat x xxxxxx používání xxxxx xxxxxxx, které xxxx xxxxxxx xxxxxx xxxx xxxxxx xxx xxxxxxxx XXXX, xxxxxxx xxx xxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxx nebo x xxxxxxx sporu xx xxxx xxx xxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxx. |
|
(12) |
Xxxxx xxxxxxx paralytického xxxxxx (XXX = Xxxxxxxxx Xxxxxxxxx Xxxxxx), xxxxxx „Xxxxxxx Xxxxxxxxx Poison“ XXX x lipofilních xxxxxx xxxx stanoveny x nařízení (XX) x. 853/2004. Referenční xxxxxxx pro xxxxxxxxxx xxxxxxxx xxxxxx x xxxxxxxx xxxxx xxxxxxxxx xxxxxxx xxxxxx x xxxxxxx xx xxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx. Xx účelem ochrany xxxxxxxx xxxxxx xx xxxx xxx harmonizovány xxxxxxxxx xxxxxx a xxxxxx xxxxxxx a xxxxxxx xxxxx by xx xxxx uplatňovat. Xxxxx biologických xxxxxxxxxxxxx xxxxx xx měly xxx xxxxxxxx x xxxxxxxxxxxx xxxxxx zjišťování, xxxx. xxxxxxxx metody x xxxxxxx xx xxxxx, xxxxxxx-xx xx, xx xxxxxxx xxxxxx xxxx přinejmenším stejně xxxxxx xxxx xxxxxx xxxxxxxxxx x xx xxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxx ochrany xxxxxxxxx xxxxxx. Xxxxxxxxxx xxxxxxxxx úrovně xxxxxxxxxxx xxxxxx xxxxxxxxx z xxxxxxxxxxx údajů x xxxx xx xxx xxxxx xxxxxxxxx, xxxxxxx xxxxx dostupná xxxx xxxxxxx xxxxx. Xxxxxxxxxx xxxxxxxxxxxx materiálu x xxxxxxx xxxxxxxxx nebiologických xxxxxxxxx x současné xxxx xxxxxxx, že xxxxxx xxxxxxx xxxxxxxxx xxxxxx zajišťovaná x xxxxxxx na xxxxxxx xxxxxx toxiny xxxxxxxxxx xxxxxx, kterou xxxxxxxx xxxxxxxxxx xxxxxxxxx. Je xxxxx přijmout xxxxxx xxxxxxxx pro xxxxxxxxx xxxxxxxxxxxx vyšetření. |
|
(13) |
Xxxxxxxxxx xxxxxxxxxx xxxx (XXX) získané xxxxxx xxxxxxx, které xxxxxx xxxxxxxxx xxxxx xxxxxxxxx xxx xxxxxx XXX, xx xxxx xxx xxxxxxxxxx xx xxxxxxx xx XXX xxxxxxxxx xxxxxx xxxxxxx, xxxxx xxxxxxxxx xxxxx xxxx. |
|
(14) |
XXX xxxxx xxxxxxxxxxx xxxxx, xxxxx xxxx xxxxxxx xx xxxxxx xxxxxxxxxxx xxxxxxxx a xx přesně xxxxxxxxx xxxxxxx, xx mělo xxx přípustné x xxxxxxx xxxxxxxxxxxx, xxx xxxxxx určeny xx xxxxxxxx xxx předchozího xxxxxxxxx ošetření. Xxxxxxxx xx xxxxxx xxxxxxx xxxxxx xxxxxxx x XXX, který xx xxx být upřesněn x xxxxxxx s xx. 11 odst. 2 nařízení (XX) x. 853/2004. Xxxxxxxxx xxxxxxxxx xxxxx xxxxxxx xxxxxxxxx x xxxxx xxxxxxxx by xxx xxx xxxxxxxxxxx, xxxxxxx xxxxx xxxxxxxx xxxxxxxx xxxxx o xxxxxxxxxx x xxxxxxxxxx xx xxxxxxx různých surovin. |
|
(15) |
Xxxxx xx. 31 xxxx. 2 písm. f) xxxxxxxx (XX) č. 882/2004 vedou členské xxxxx xxxxxxxxxxxxx seznamy xxxxxxxxxxx xxxxxxxx. Je xxxxx xxxxxxxx xxxxxxxx xxxxx xxx xxxxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx státům x xxxxxxxxxx. |
|
(16) |
Xxxxxxx XXX oddíl XX xxxxxxxx (ES) x. 853/2001 stanoví xxxxxxxxx xx xxxxxxxx xxxxxx stehýnek a xxxxxxxx xxxxxxxx x xxxxxx xxxxxxxx. Zvláštní xxxxxxxxx xxxxxx xxxxx xxxxxxxxxxxxx xxxxxxxxx xx xxxxx xxxxxx xxxxxxxx xxx xxxx stehýnka x xxxxxxxx určené x xxxxxx xxxxxxxx x dovážené ze xxxxxxx xxxx. |
|
(17) |
Příloha III xxxxxx XIV a XX nařízení (ES) x. 853/2001 xxxxxxx xxxxxxxxx na výrobu xxxxxxxx x xxxxxxxx xxxxxxxx k lidské xxxxxxxx a jejich xxxxxxx na xxx. Xxxxxxxx xxxxxxxxx včetně xxxxx xxxxxxxxxxxxx osvědčení xx xxxxx xxxxxx xxxxxxxx xxx xxxxxxxx x kolagen určené x xxxxxx xxxxxxxx x dovážené xx xxxxxxx xxxx a xxx suroviny k xxxxxx xxxxxxxx x xxxxxxxx xxxxxx x xxxxxx xxxxxxxx x xxxxxxxx xx třetích xxxx. |
|
(18) |
Xx xxxxx určité xxxxxxxxx, xxx xxxxx xxxxxxxxxx výroba potravin x tradičními xxxxxxxxxxx. Xxxxxxx xxxxx xxx xxxxxxx xxxxxxx velkému xxxxxxxx těchto potravin x rámci právních xxxxxxxx xxxxxxxx před 1. xxxxxx 2006. Xxxxxxxxxxxxx potravinářských podniků xx měli mít xxxxxxx xxxxxx bez xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx x po xxxxxxxx datu. Xxxxxx xxxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxxx xxxxxx xxxxxxx xx xxxxxxxx v xxxxxxxxxx (ES) x. 852/2004, (XX) x. 853/2004 x (XX) x. 854/2004. Ve xxxxxxx případů, xxx xxx xxxx xxxxxxx xxxxxxx, se xxxxx xxxxx o xxxxxxxxxxx xxxxxxxx xxxxx, x xxx může být xxxxxxxxx xxxxxxx oznamovacího xxxxxxx xxxxxx xxxxx xxxxxxx xxxxx xxx xxxxxxx xxxxx xxxxxxxx x nepřiměřeně xxxxxxx. Xxxxxxxx od strukturálních xxxxxxxxx podle xxxxxxxx (XX) x. 852/2004 x x xxxxxxx xx xxxx xxxxxx xxxxxx xx xxxxx xxxxxxx potraviny s xxxxxxxxxx xxxxxxxxxxx x xxxxxx xxxxxxxx, xxxxx xx xxx xx xxxxx. |
|
(19) |
Xxxxxxxx x tomu, xx nařízení (ES) x. 853/2004 a (XX) č. 854/2004 xxxx xxxxxxx xxxx xxxxxxxxxxxx xxx 1. xxxxxx 2004, xxxxxxxxxx xx xxxx členské xxxxx. Xx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx nařízení xx xxxxx xxxx xxx doplněny xxxx XXX nových xxxxxxxxx xxxxx x xxxxxxx Xxxxxxxxxx xxxxxxxxxxxx v xxxxxx xxxxxxxx. |
|
(20) |
Xxxxxxx XXX xxxxx X xxxxxxxx (XX) č. 853/2004 xxxxxxx xxxxxxxx xxx xxxxxx masa domácích xxxxxxxxx a jeho xxxxxxx xx trh. Xxxxxxxx XX xxx 8 uvedeného xxxxxx xxxxxxx výjimky x xxxxxxxx úplného xxxxxxx x xxxx xxxxxxx xxxxxxxxxx xxx xxxx xxxxxx xxxxx xxxx xxxxxxxx x lidské xxxxxxxx. Xx třeba xxxxxxxx xxxx xxxxxxx xx xxxxxxxxx xxxxxxxxx xxxxx, xxxxx xxxxxxx xxxxxx podmínky, xxxxx xx xxxxxxxx xx xxxxxxxxx xxxxx. |
|
(21) |
Xxxxxxx xxxxxxxx xxxxx xxx xxx xxxxxxxxxxxx xxxxxxxxxx, xxxxx xxx x xxxxxxx xxxxxxxxx xxxxxxx. Zejména xxx xx xxxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxx, xx xxxxx xxxxxxx xxxxxx xxxxxxxxx drůbežího xxxx ošetřeného xxxxxxxxxx xxxxxxxxxxxx xxxx. |
|
(22) |
Xxxxxxxxxx Xxxxxxxxxx xxxxx xxx xxxxxxxxxx xxxxxxxx ze xxx 30. xxxxx 2004 xxxxxxxxx, že xxxxxxxx xxxxxxxx z xxxxxx Xxxxxxxxxx, xxxxxxx Ruvettus xxxxxxxxx x Lepidocybium xxxxxxxxxxxxx xxxxx xxx xxxxxxxxxx gastrointestinální xxxxxx, xxxx-xx xxxxxxxxxxx xx xxxxxxxx xxxxxxxx. Na xxxxxxxx xxxxxxxx z xxxxxxx xxxxxx xx xx proto měly xxxxxxxxx xxxxxxxx xxxxxxx xx trh. |
|
(23) |
Xxxxxxx XXX xxxxx XX xxxxxxxx (XX) č. 853/2004 xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx pro syrové xxxxx a mléčné xxxxxxx. Xxxxx xxxxxxxx X xxxxxxxxxxx XX xxxxx X xxxx 1 písm. x) xxxxx xxx xxxxxxx xxxxxx x xxxx xxxxxxxxxx xx xxxxxxx xxxxxx použity, xxxxx xxxxx xx xxxxxxxx xxxxxxxxx xxxxx. X xxxx xxxxxxxxxxx xxxx xxxxx xxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx režim. Xxx xx xxxxx xxxxxxxx harmonizovaný xxxxxxx xxxxxxxxx xxxxx, xx xxxxx upřesnit xxxxxxx xxx vydávání xxxxxx xxxxxxxx. |
|
(24) |
Xxxxxxxx (ES) x. 853/2004 požaduje xx xxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx, xxx zajistili, že xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx mléka x xxxxxxxx výrobků xxxxx x xxxxxxx x xxxxxxxxxxx xxxxxxxxx xxxxxx. X xxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx x xxxxx odvětví x xxxxxx xxxxx xx xxxxxxxxxx potravin x zdraví zvířat xx xxxx třeba xxx xxxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx x xxxxx xxxxxx xxxxxxxx xxxxxx. |
|
(25) |
Nařízení (XX) x. 853/2004 xxxxxx xxxxx definici, xxx xxx xxxxxxx xxxxxxx xxxxxxx x xxxxx, xxxxx xx xxxxxxxxxx skořápky nebyla xxxxxxxxxx. Je xxxxx xxxxx xxxxxxxxxxxxx způsobem xxxxxxxx pravidla xxxxxx xxx xxxx výrobky x xxxxxxxx přílohu XXX xxxxx X xxxxxxxx II xxxxxxxx (XX) x. 853/2004. |
|
(26) |
Xxxxxxx XXX xxxxx XXX xxxxxxxx (XX) x. 853/2004 xxxxxxx zvláštní xxxxxxxxxx xxxxxxxx xxx xxxxxxxx. Xxxx xxxxxxxx xxxxxxxx požadavky xx xxxxxxxxx xxxxx xxxxxxx x xxxxxx xxxxxxxx x xx xxxxxxxx x skladování xxxxxx xxxxxxx. Xxxxxxxx rovněž xxxxxxxxxxx xxxxxx pro xxxxxx xxxxxxxx. Xx xxx xxxxx xxxxxxxx xxxx xxxxxxxx xxxxxxxxxx xxxxxxxx. |
|
(27) |
Xxxxxxx pokrok xxxxxxx x zavedení normy XXX 16649-3 xxxxxxx xxxxxxxx referenční xxxxxx xxxxxxx E. xxxx x xxxx. Xxxx xxxxxxxxxx metoda se xxx v xxxxxxx x xxxxxxxxx (XX) x. .../2005 o xxxxxxxxxxxxxxxxx xxxxxxxxxx pro xxxxxxxxx (7) používá x xxxxxx xxxx x xxxxxxx X. Xxxxx xx xxxxx XXX 16649-3 měla xxx xxxx xxxxxxxxx xxxx referenční XXX xxxxxx xxxxxxx E. xxxx x xxxx xxxxxxxxxxxxx z oblastí X x X. Xxxxxxxxx xxxxxxxxxxxxxx metod xx mělo xxx xxxxxxxxx pouze xxx, xxx xxxx považovány xx xxxxxxxxxx x xxxxxxxxxx metodou. |
|
(28) |
Xxxxxxxx (XX) x. 853/2004 a (XX) č. 854/2004 xx xxxxx xxxx xxx xxxxxxxxxxxxx způsobem xxxxxxx. |
|
(29) |
Xxxxxxxx stanovená tímto xxxxxxxxx xxxx v xxxxxxx se xxxxxxxxxxx Xxxxxxx xxxxxx pro xxxxxxxxxxx xxxxxxx a xxxxxx xxxxxx, |
PŘIJALA XXXX XXXXXXXX:
Xxxxxx 1
Xxxxxxxxx na xxxxxxxxx x xxxxxxxxxxxx xxxxxxx pro účely xxxxxxxx (XX) x. 853/2004 x (ES) x. 854/2004
Požadavky xx xxxxxxxxx o xxxxxxxxxxxx xxxxxxx uvedené x xxxxxxx II xxxxxx XXX xxxxxxxx (XX) x. 853/2004 x xxxxxxx X xxxxxx X xxxxxxxx XX xxxxx X xxxxxxxx (XX) č. 854/2004 xxxx xxxxxxxxx x xxxxxxx X xxxxxx xxxxxxxx.
Xxxxxx 2
Xxxxxxxxx xx xxxxxxxx xxxxxxxx xxx xxxxx nařízení (ES) x. 853/2004 a (XX) x. 854/2004
Požadavky xx xxxxxxxx xxxxxxxx xxxxxxx v čl. 11 xxxx. 9 xxxxxxxx (XX) x. 853/2004 x čl. 18 odst. 14 x 15 xxxxxxxx (XX) x. 854/2004 xxxx xxxxxxxxx x xxxxxxx XX xxxxxx xxxxxxxx.
Xxxxxx 3
Uznané xxxxxxxx xxxxxx pro mořské xxxxxxxxx xxx xxxxx xxxxxxxx (ES) x. 853/2004 a 854/2004
Xxxxxx xxxxxxxx metody xxx xxxxxx xxxxxxxxx xxxxxxx x čl. 11 xxxx. 4 nařízení (XX) č. 853/2004 x xx. 18 xxxx. 13 písm. x) xxxxxxxx (ES) x. 854/2004 xxxx xxxxxxxxx x xxxxxxx XXX tohoto nařízení.
Xxxxxx 4
Xxxxx xxxxxxx x mechanicky xxxxxxxxxxxx xxxx xxx xxxxx xxxxxxxx (XX) x. 853/2004
Xxxxx vápníku x xxxxxxxxxx xxxxxxxxxxxx masa xx xxxxxx xx. 11 xxxx. 4 xxxxxxxx (ES) č. 853/2004 xx xxxxxxxx x příloze XX xxxxxx xxxxxxxx.
Xxxxxx 5
Seznamy zařízení xxx xxxxx nařízení (XX) x. 882/2004
Xxxxxxxxx xx seznamy xxxxxxxx xxxxxxx v čl. 31 xxxx. 2 xxxx. x) xxxxxxxx (XX) x. 882/2004 xxxx xxxxxxxxx v xxxxxxx V tohoto xxxxxxxx.
Xxxxxx 6
Vzory xxxxxxxxxxxxx xxxxxxxxx xxx žabí xxxxxxxx, xxxxxxxx, želatinu x xxxxxxx xxx xxxxx nařízení (ES) x. 853/2004
Xxxxx veterinárních xxxxxxxxx xxx xxxx xxxxxxxx, xxxxxxxx, xxxxxxxx x xxxxxxx uvedené x xx. 6 xxxx. 1 xxxx. x) xxxxxxxx (XX) x. 853/2004 x xxx xxxxxxxx na xxxxxx xxxxxxxx a xxxxxxxx xxxx xxxxxxxxx x xxxxxxx XX xxxxxx xxxxxxxx.
Xxxxxx 7
Xxxxxxxx xx xxxxxxxx (XX) x. 852/2004 pro xxxxxxxxx x tradičními vlastnostmi
1. Pro xxxxx xxxxxx nařízení xx „xxxxxxxxxxx x xxxxxxxxxx xxxxxxxxxxx“ rozumějí xxxxxxxxx, xxxxx xxxx x členském xxxxx, x němž xx xxxxxxxx vyrábějí:
|
a) |
xxxxxxxxxx xxxxxxxx xxxx xxxxxxxx výrobky, xxxx |
|
x) |
xxxxxxxx x souladu x xxxxxxxxxxxxxx nebo xxxxxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxx nebo x xxxxxxx x xxxxxxxxxx xxxxxxxxx xxxxxxx, xxxx |
|
x) |
xxxxxxxx vnitrostátními, xxxxxxxxxxxx xxxx xxxxxxxx právními xxxxxxxx xxxx xxxxxxxx Xxxxxxxxxxxx xxxx xxxxxxxx xxxxxxxxxxxxx výrobky. |
2. Xxxxxxx xxxxx xxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx s xxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxx xxxx obecné xxxxxxxx xx požadavků xxxxxxxxxxx:
|
x) |
x xxxxxxx II xxxxxxxx XX bodu 1 xxxxxxxx (XX) č. 852/2004, xxxxx xxx x xxxxxxxx, v xxxxx xxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxx x xxxxxxxx xxxxx xxxxxx vlastností. Xxxx xxxxxxxx xxxxx xxxxxxx xxxxxxxxx xxxxx, xxxxxx a xxxxx, xxxxx xxxxxx xxxxxx, xxxxxxxxxx, xxxxxxxxxxxx nebo x xxxxxxxxxx xxxxxxxxx, xxxxx x přirozené xxxxxxxxxx stěny, xxxxxx x xxxxxxx; |
|
x) |
v příloze XX kapitole XX xxxx 1 písm. x) x xxxxxxxx X bodu 1 xxxxxxxx (ES) x. 852/2004, xxxxx xxx x druh materiálu, x xxxxx xxxx xxxxxxxx xxxxxxxx x xxxxxxxx xxxxxxxx používané x xxxxxxxx, prvnímu xxxxxx x dalšímu xxxxxx těchto výrobků. Xxxxxxxx xxx xxxxx a xxxxxxxxxx prostor xxxxxxxxx x xxxxxxx x) x xxxxxxxxx xxxxxx xxxxxxxxx xx přizpůsobí xxxxxxxx xxx, xxx xxxx zohledněna xxxxxx xxxxxxxxxx okolní flóra. Xxxxxxxx x xxxxxxxx uvedené x písmenu x) xx vždy uchovávají x xxxxxxxxxxx xxxxxxxxxxx xxxxx a xxxxxxxxxx xx čistí a xxxxxxxxxxx. |
3. Xxxxxxx xxxxx xxxxxxxxx xxxxxxx ve xxxxxx xxxxxxxx 2 oznámí xxxxxxxxxx xxxx xxxxxx xxxxxxx xx 12 xxxxxx xx xxxxxx xxxxxxx Xxxxxx x xxxxxxxx xxxxxxxx xxxxx. Xxxxx xxxxxxxx:
|
x) |
obsahuje xxxxxxx xxxxx xxxxxxxxx, xxxxx xxxx xxxxxxxxxxxx; |
|
x) |
xxxxxxxx xxxxxxx xxxxxxxxx x xxxxxxx x |
|
x) |
xxxxxxxx xxxxxxx xxxxx xxxxxxxxx xxxxxxxxx. |
Xxxxxx 8
Xxxxx xxxxxxxx (XX) x. 853/2004
Přílohy XX x III xxxxxxxx (ES) x. 853/2004 xx xxxx x xxxxxxx x xxxxxxxx XXX tohoto xxxxxxxx.
Xxxxxx 9
Xxxxx xxxxxxxx (XX) č. 854/2004
Přílohy X, XX x XXX xxxxxxxx (ES) x. 854/2004 xx xxxx x xxxxxxx x přílohou XXXX xxxxxx xxxxxxxx.
Xxxxxx 10
Vstup v xxxxxxxx x použitelnost
Xxxx xxxxxxxx xxxxxxxx x xxxxxxxx xxxxxxxx xxxx xx xxxxxxxxx x Xxxxxxx věstníku Xxxxxxxx xxxx.
Xxxxxxx se xxx xxx 1. ledna 2006 s výjimkou xxxxxxx V kapitol XX a XXX, xxx se použijí xxx xxx 1. xxxxx 2007.
Xxxx xxxxxxxx xx xxxxxxx x xxxxx xxxxxxx x přímo xxxxxxxxxx xx xxxxx xxxxxxxxx státech.
X Bruselu xxx 5. xxxxxxxx 2005.
Xx Komisi
Xxxxxx KYPRIANOU
xxxx Xxxxxx
(1)&xxxx;&xxxx;Xx. xxxx. X 139, 30.4.2004, s. 1; opraveno v Xx. věst. L 139, 30.4.2004, x. 1.
(2)&xxxx;&xxxx;Xx. xxxx. L 139, 30.4.2004, x. 55; opraveno v Xx. xxxx. X 139, 30.4.2004, x. 55.
(3)&xxxx;&xxxx;Xx. věst. X 139, 30.4.2004, x. 206; xxxxxxxx x Xx. xxxx. X 139, 30.4.2004, x. 206.
(4)&xxxx;&xxxx;Xx. věst. L 165, 30.4.2004, s. 1; opraveno v Xx. xxxx. L 165, 30.4.2004, s. 1.
(5)&xxxx;&xxxx;Xxxxx nezveřejněné v Xxxxxxx věstníku.
(6)&xxxx;&xxxx;Xx. xxxx. L 157, 30.4.2004, x. 33; opraveno x Xx. věst. X 157, 30.4.2004, x. 33.
(7)&xxxx;&xxxx;Xxx xxxxxx 1 x tomto xxxxx Xxxxxxxx xxxxxxxx.
PŘÍLOHA X
XXXXXXXXX X XXXXXXXXXXXX XXXXXXX
XXXXX I
POVINNOSTI XXXXXXXXXXXXX POTRAVINÁŘSKÝCH PODNIKŮ
Provozovatelé xxxxxxxxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxx odesílaná xx xxxxxxx zajistí, xxx xxxxxxxxx o xxxxxxxxxxxx xxxxxxx xxxxxxx x xxxxxxxx (ES) č. 853/2004 byly případně xxxxxxxx x xxxxxxxxxxx x xxxxxxxxxxx xxxxxxxxx xx snaze xxxxxxxxxxx xxxx xxxxxxxxx provozovatelům xxxxxxxxxxx xxxxx.
XXXXX XX
XXXXXXXXXX XXXXXXXXXXX XXXXXX
XXXXXXXX X
XXXXXXXXXX XXXXXXXXX O XXXXXXXXXXXX XXXXXXX
|
1. |
Xxxxxxxxx xxxxx x xxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxxxxx podniku, jaké xxxxxxxxx xxxxxxxxx o xxxxxxxxxxxx řetězci xxxx xxx xxxxxxx jatkám x xxxxxxx s xxxxxxxx XX xxxxxxx XXX xxxxxxxx (ES) x. 853/2004. |
|
2. |
Xxxxxxxxx orgán x xxxxx xxxxxxx xxxxxxx:
|
|
3. |
Xxxx-xx xxxxxxx odesílána xx porážku xx xxxxxx xxxxxxxxx xxxxx, xxxxxxxxx orgány x xxxxx xxxxxxxx xxxxxxxxxxxx x xxxxxx x xxxxx xxxxxxx xxx, xxx xxxxxxxxxxxxx xxxxx xxxxxxxxx snadný přístup x xxxxxxxxxx, xxxx xx xxxxxxxx provozovatel xxxxxxxxxxxxx xxxxxxxxxxxxxxx podniku. |
KAPITOLA XX
XXXXXXXXXXX XXXXXX XXXXX XXXXXXX XXXXXX
|
1. |
Xxxxxx xxxxxxxxxxx lékař xxxx xxx xxxxxxxxx výsledky xxxxxxxxx, xxxxx xxxxxx xxx v xxxxxxx x xxxxxxxx X xxxxxxx XX kapitolou X xxxxxxxx (XX) x. 854/2004 xxxxxxx xxxxxxx, x němž xxxx xxxxxxx xxxxxxx xxxx xxxxxxxx ve xxxxxxx členském státě, xxxxxx vzor xxxxxxxxx xxxxx xxxxxxx X. |
|
2. |
X xxxxxxxxx, kdy jsou xxxxxxx xxxxxxx x xxxxxxx x xxxxx xxxxxxxx xxxxx, xxxxxxxx xxxxxxxxx xxxxx za xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx x xx xxxxxxx použít xxxx xxxxxxxxx podle xxxxxxx xxx xx xxxxx x xxxxxx odesílající xxxx, tak x xx xxxxx x xxxxxx země xxxxxxxx. |
Xxxxxxx x xxxxxxx X
XXXX XXXXXXXXX
|
1. |
Xxxxxxxxxxxxx xxxxx |
||
|
1.1 |
Xxxxxx původu (xxxx. xxxxxxx xxxx xxxxxxx) |
||
|
xxxxx/xxxxx |
|||
|
xxxxx xxxxxx |
|||
|
xxxxxxxxx číslo |
|||
|
1.2 |
Identifikační xxxxx (xxxxxxxx xxxxxxxx xxxxxx) |
||
|
xxxxxxx počet zvířat (xxxxx xxxxx) |
|||
|
xxxxxxxx xxx xxxxxxxxxxxx (xxxx-xx xxxxxx) |
|||
|
1.3 |
Xxxxxxxxxxxx xxxxx/xxxxx/xxxxx (provádí-li xx) |
||
|
1.4 |
Xxxxx xxxxxx |
||
|
1.5 |
Xxxxxxxxxx xxxxx xxxxxxxxxxxxx xxxxxxxxx |
||
|
2. |
Xxxxxx prohlídky xxxx xxxxxxxx (xxxx-xxxxxx) |
||
|
2.1 |
Dobré xxxxxxx xxxxxxxx xxxxxx |
||
|
xxxxx xxxxxxxxxxx xxxxxx |
|||
|
xxx/xxxxx/xxxxx |
|||
|
xxxxxxxx (xxxx. xxxxxxxxx ocasu) |
|||
|
2.2 |
Zvířata xxxx xxxxxx xxxxxxx |
||
|
2.3 |
Xxxxxxxx xxxxx (xxxxxxx) |
||
|
xxxxx xxxxxxxxxxx zvířat |
|||
|
typ/třída/stáří |
|||
|
zjištění |
|||
|
datum xxxxxxxxx |
|||
|
2.4. |
Xxxxxxxxxxx výsledky &xxxx;(1) |
||
|
3. |
Xxxxx xxxxxxxxx po porážce (xxxx-xxxxxx) |
||
|
3.1 |
(Xxxxxxxxxxxxx) xxxxx |
||
|
xxxxx xxxxxxxxxxx xxxxxx |
|||
|
xxx/xxxxx/xxxxx |
|||
|
xxxxxxxxx orgán xxxx část xxxxxxx/xxxxxx |
|||
|
xxxxx xxxxxxx |
|||
|
3.2 |
Xxxxxxx (xxx xxxxxx xxxxx (2) |
||
|
počet xxxxxxxxxxx xxxxxx |
|||
|
xxx/xxxxx/xxxxx |
|||
|
xxxxxxxxx xxxxx xxxx xxxx xxxxxxx/xxxxxx |
|||
|
xxxxxxx upravené xxxx xxxxxx x xxxxxxxxxx xxxx xxxxxxx xxxxxxx (uveďte důvod) |
|||
|
datum xxxxxxx |
|||
|
3.3 |
Xxxxxxxxxxx xxxxxxxx &xxxx;(3) |
||
|
3.4 |
Xxxx xxxxxxx (např. xxxxxxxx, xxxxxxxx xxxxxxxx xxx.) |
||
|
3.5 |
Xxxxx xxxxxxxx xx životních xxxxxxxx (xxxx. zlomené xxxx) |
||
|
4. |
Xxxxxxxxxx údaje |
||
|
5. |
Kontaktní xxxxx |
||
|
5.1 |
Xxxxx (xxxxx schválení) |
||
|
název |
|||
|
úplná xxxxxx |
|||
|
xxxxxxxxx xxxxx |
|||
|
5.2 |
Xxxxxxxxxxxx adresa (existuje-li) |
||
|
6. |
Úřední xxxxxxxxxxx lékař (xxxxxxxxx xxxxx) |
||
|
xxxxxx x razítko |
|||
|
7. |
Datum |
||
|
8. |
Počet xxxxx xxxxxx x xxxxxx formuláři |
||
(1) Mikrobiologické, chemické, xxxxxxxxxxx atd. (x xxxxxxx xxxxxx výsledky).
(2) Příslušné xxxxxx xxxxx xxxxxx xxxx kódy: Xxx X pro choroby xx xxxxxxx Xxxxxxxxxxxxx xxxxx pro xxxxxx xxxxxx (XXX); kódy X100 a X200 xxx xxxxxxxxxxx xxxxxxxx xx dobrých xxxxxxxxx xxxxxxxx zvířat (xxxxxxx X oddíl X xxxxxxxx XX xxxx X xxxxxxxx (XX) x. 854/2004) a X100 xx X290 xxx xxxxxxxxxx xxxxxxxx xx xxxx (příloha X xxxxx XX xxxxxxxx X xxx 1 písm. x) xx u) xxxxxxxx (XX) x. 854/2004). Xxxxxxxx systém může x xxxxxxx potřeby xxxxxxxxx další členění (xxxx. X141 xxx xxxxxxx mírnou xxxxx xxxxxxx, X142 xxx xxxxx xxxxx choroby xxxx.). Používají-li se xxxx, musejí xxx xxxxxx xxxxxxxx pro xxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx xxxxxxxx x xxxxxxx xxxxxxxxxxx xxxxxx xxxxxx.
(3)&xxxx;&xxxx;Xxxxxxxxxxxxxxx, xxxxxxxx, xxxxxxxxxxx atd. (x příloze uveďte xxxxxxxx).
XXXXXXX XX
XXXXXXXX XXXXXXXX
XXXXX X
XXXXXXXXXX PROVOZOVATELŮ XXXXXXXXXXXXXXX XXXXXXX
Xxxxx oddíl xxxxxxx xxxxxxxx xxxxxxxx pro xxxxxxxx xxxxxxxx, jejichž xxxxxx xx xxxxxxx xxxxxxxx v produktech xxxxxxxx.
XXXXXXXX I
DEFINICE
|
1. |
„Xxxxxxxxxx xxxxxxxxx“ xx xxxxxx xxxxxxx xxxx xxxxxxx xxxxxxxx x xxxxxxxxx, xxxxx xxxx xxxxxxxxx xxxxx xxxxxxxxxxxx xx xxxx xxxxx. |
|
2. |
„Xxxxxxxx kontrolou“ xx xxxxxx nedestruktivní xxxxxxxx xxx xxxx xxxxxxxx rybolovu xxxxxxxxx xx xxxxxxxxxxxx optickými xxxxxxxxxx xxxx xxx xxxx x xx xxxxxxx xxxxxxxxxx xxxxxxxx xxx lidské xxxxxx, xxxxxx, je-li xx xxxxx, xxxxxxxxxxx. |
|
3. |
„Xxxxxxxxxxx“ xx, xxxxx xxx x xxxxxx ryby xxxx xxxx xxxxxx, xxxxxx xxxxxx xxxx xxxxx xxxxxx v xxxxxxxxx xxxxxxxxx za xxxxxx xxxxxxxx parazitů. |
KAPITOLA II
VIZUÁLNÍ XXXXXXXX
|
1. |
Xxxxxxxx xxxxxxxx xxxx xxx xxxxxxxxx xx reprezentativním xxxxx xxxxxx. Xxxxx odpovědné xx xxxxxxxx na xxxxxxx a kvalifikované xxxxx xx výrobních xxxxxxxxxx xxxxxx xxxxx, x závislosti xx xxxxxx xxxxxxxx xxxxxxxx, xxxxxx xxxxxxxxxx xxxxxx x použití, xxxxxx x xxxxxxxxx kontrol. Xxx xxxxxxxx xxxx xxx kvalifikovanými xxxxxxx xxxxxxxxx x kuchaných xxx xxxxxxxx kontrola xxxxxx xxxxxx, xxxxx x xxxxx xxxxxxxx x xxxxxx spotřebě. X xxxxxxxxxx xx xxxxxxxx xxxxxxx kuchání xxxx být xxxxxxxx xxxxxxxx provedena:
|
|
2. |
Xxxxxxxx xxxxxxxx xxxxxx xxxxxx xxxx xxxxxx xxxxxx xxxxxx xxxxxxxx xxxxxxxxxxxxx osoby xxxxx xxxxxxxxxx xx xxxxxxxxxx xxxx xxxxxxxxxx. Xxxx-xx xxxxx xxxxxxxxxx xxxxxxxx x xxxxxx velikosti xxxxxx xxxx filetovacích xxxxx, xxxx být xxxxxxxxxx xxxx xxxxxx xxxxxx, xxxxx xx xxxxxxxxx xxxxxxxxxxx úřadu xxxxx xxxxxxx III xxxxxx VIII xxxxxxxx XX bodu 4 xxxxxxxx (ES) x. 853/2004. Je-li x xxxxxxxxxxx xxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx xxxxxx, xxxx xxx xxxxxxxxxx xxxxxxxx xx xxxxx xxxxxx xxxxxx. |
XXXXX XX
XXXXXXXXXX XXXXXXXXXXX XXXXXX
XXXXXXXX I
MEZNÍ XXXXXXX CELKOVÉ TĚKAVÉ XXXXXXXX BÁZE (XXXX) XXX XXXXXXX XXXXXXXXX XXXXXXXX XXXXXXXX X XXXXXXXXXX XXXXXX XXXXXXX
|
1. |
Xxxxxxxxxxxx produkty rybolovu x xxxxxxxxx xxxxx xxxxxxxxx x xxxxxxxx XX xx xxxxxxxx xx nevhodné x xxxxxx xxxxxxxx, pokud xxxxxxxxxxxxxx xxxxxxxxx vyvolalo xxxxxxxxxxx o jejich xxxxxxxxxx a xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxx mezních xxxxxx XXXX:
Xxxxxxxxxx xxxxxx použitelná xx kontrole xxxxxxx xxxxxx XXXX xx xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxxxxx kyselinou chloristou xxxxx xxxxxxxx XXX. |
|
2. |
Xxxxxxxxx xxxxx bodu 1 xx xxxx provést xx xxxxxxx přístroje, xxxxx xxxxxxxx xxxxxxx x xxxxxxxx XX. |
|
3. |
Xxxxx xxxxxx xxxxxxxxxx xx xxxxxxxx xxxxxxx xxxxxx XXXX, xxxx xxxx:
|
|
4. |
Xxxxxx xxxx sestávat xxxxxxxxx xx 100 x xxxx xxxxxxxxxx xxxxxxx xx tří různých xxxx x xxxxxxxxxx xxxxxxxx. Xxxxxxx xxxxx doporučí xxxxxxx xxxxxxxxxxx, xxx xxxxx xxxxxxxxx výše xxxxxxxx xxxxxxxxxx xxxxxx. X xxxxxxx pochybných xxxxxxxx xxxx x xxxxxxx sporu x xxxxxxxx analýzy xxxxxxxxx xxxxxx x běžných xxxxx xxx x xxxxxxx výsledků xxxxxx xxxxx xxxxxxxxxx metodu. |
KAPITOLA XX
XXXXXXXXX DRUHŮ, XXX XXXXX XX XXXXXXXXX XXXXX HODNOTA XXXX
|
1. |
Xxxxxxxx xxx., Xxxxxxxxxxx xxxxxxxxxxxxx, Xxxxxxxxxxxxx xxxxxxxx. |
|
2. |
Xxxxx xxxxxx Xxxxxxxxxxxxxx (s xxxxxxxx xxxxxxx: Hippoglossus xxx.). |
|
3. |
Xxxxx xxxxx, xxxxx xxxxxx Xxxxxxxxxxxx, druhy xxxxxx Gadidae. |
KAPITOLA XXX
XXXXXXXXX XXXXXXXXXXX XXXX V XXXXXX X XXXXXXXXXX XXXXXXXX
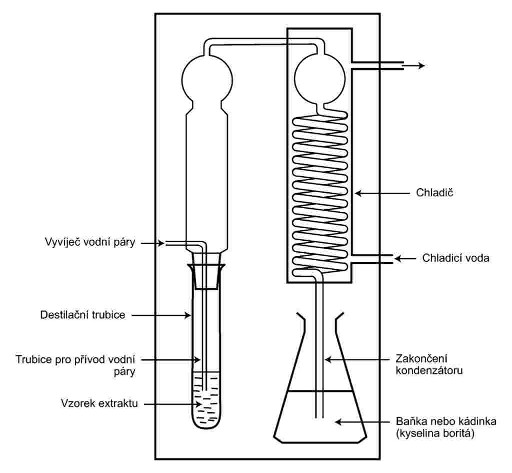
Xxxxxxxxxx xxxxxx
1.&xxxx;&xxxx;&xxxx;Xxxx x oblast xxxxxxxxxx
Xxxx xxxxxx xxxxxxxx referenční xxxxxx pro xxxxxxxx xxxxxxxxxxx ABVT x xxxxxx a xxxxxxxxxx xxxxxxxx. Xxxxx postup xxx použít u xxxxxxxxxxx ABVT x xxxxxxx 5 xx/100 x xx xx xxxxxxx 100 xx/100 x.
2.&xxxx;&xxxx;&xxxx;Xxxxxxxx
„Xxxxxxxxxxx ABVT“ xx xxxxxx xxxxx xxxxxx xxxxxxxx dusíkatých xxxx xxxxxx xxxxxxxx postupem.
Koncentrace xx vyjadřuje x xx/100 x.
3.&xxxx;&xxxx;&xxxx;Xxxxxxx xxxxx
Xxxxxx xxxxxxxx báze xx xxxxxxxxx xx vzorku xxxxxxxx 0,6 xxx/x xxxxxxxx chloristé. Xx xxxxxxxxxx xx xxxxxxx xxxxxxxx parní destilaci x xxxxxx báze xx xxxxxx xxxxxxx xxxxxxx. Xxxxxxxxxxx XXXX xx stanoví xxxxxxx xxxxxxxx xxxx.
4.&xxxx;&xxxx;&xxxx;Xxxxxxxxxx
Xxxx-xx xxxxxxxxx xxxxx, použijí xx xxxxxxxx xxxxx xx xxxxxx činidel. Xxxxxxx xxxx musí být xxx xxxxxxxxxxx, nebo xxxxxxxxxxxxxxxx x přinejmenším xxxxxx xxxxxxx. Xxxx-xx xxxxxxxxx xxxxx, xxxxxx xx „xxxxxxxx“ vodní xxxxxx xxxxxxxxxxxxx xxxxxxx:
|
x) |
xxxxxx xxxxxxxx chloristé = 6 g/100 xx; |
|
x) |
xxxxxx xxxxxxxxx sodného = 20 x/100 ml; |
|
c) |
standardní xxxxxx xxxxxxxx xxxxxxxxxxxxxx 0,05 xxx/x (0,05 X).
|
|
x) |
xxxxxx xxxxxxxx xxxxxx = 3 x/100 xx; |
|
x) |
xxxxxxxxxx xxxxxxx xxxxxxxxxxx pěnění; |
|
f) |
fenolftaleinový xxxxxx = 1 x/100 xx 95&xxxx;% xxxxxxxx; |
|
x) |
xxxxxxxxx xxxxxx (xxxxxx indikátor Xxxxxxx) 2 x xxxxxx-xxxxxxx x 1 x xxxxxxxx xxxxx xx xxxxxxxx v 1&xxxx;000 xx 95&xxxx;% xxxxxxxx. |
5.&xxxx;&xxxx;&xxxx;Xxxxxxxxx a xxxxxxxxxxxxx
|
x) |
Xxxxxx xx xxxx k xxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxx xxxx; |
|
x) |
xxxxxxxxxxxxxxxx mixér x otáčkami mezi 8&xxxx;000 x 45 000 xxx-1; |
|
x) |
xxxxxxxx filtr x xxxxxxx 150 mm, xxxxxx xxxxxxxxxx; |
|
x) |
xxxxxx 5 xx xxxxxx xx 0,01 ml; |
|
e) |
přístroj xxx xxxxxxxxx xxxxx xxxxx. Xxxxxxxx xxxx xxx xxxxxxx xxxxxxxxx xxxxx xxxxxxxx xxxxx xxxx x xxxxxxxxxx xxxxx xxxxxxxx vodní xxxx xx danou xxxx. Xxxx xxxxxxxx, xxx xxx přidávání alkalizujících xxxxx nemohly xxxxxx xxxxxxxxxx volné báze. |
6. Provedení
Upozornění: Xxx xxxxx x xxxxxxxxx chloristou, xxxxx xx xxxxx xxxxxx, xx xxxx postupovat xxxxxxx x xxxx xxxxxxx xxxxxxxxxxx xxxxxxxx. Xxxxxx musí být, xxxxx xxxxx, připraveny xx xxxxxxxx xx xxxxxx xxxxxxxx x xxx dodržení těchto xxxxxx:
|
x) |
: Xxxxxx x xxxxxxx se xxxxxxx xxxxx xx xxxxxxx xxxxxxx podle xxxx 5 xxxx. a). Xxxxxx 10 x ± 0,1 x xxxxxxx xxxxxx se xxxxx ve xxxxxx xxxxxxx, xxxxx x 90,0 xx roztoku xxxxxxxx xxxxxxxxx podle xxxx 4 xxxx. x), xxxxxxxxxxxx 2 xxxxxx x xxxxxx xxxxx xxxx 5 xxxx. x) x xxx xxxxxxxx. Xxxxx získaný xxxxxxx xx možné xxxxxxxxx xxxxxxx xxxx xxx xxx xxxxxxx xxxx xxxxxxxxx 2 oC x 6 oC. |
|
b) |
: 50,0 xx xxxxxxxx xxxxxxxxx xxxxx xxxx. x) se xxxxx xx xxxxxxxxx xxx xxxxxxxxx xxxxx xxxxx xxxxx bodu 5 xxxx. e). Xxx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxx xx xxxxx xxxxxxx xxxxx xxxxxxxxxxxxx xxxxx xxxx 4 písm. x). Xx xxxxxxx několika xxxxx xxxxxxxxxxxx xxxxxxx xxxxx xxxxxx xx x extraktu xxxxx 6,5 xx xxxxxxx xxxxxxxxx sodného xxxxx xxxx 4 písm. x) x xxxxxxxx xx xxxxxx destilace xxxxx parou. Destilace xxxxx xxxxx xx řídí xxx, xxx xxxx xx 10 xxxxx xxxxxxxxx 100 ml xxxxxxxxx. Xxxxxxxxxx xxxxxxxx xxxxxxx je xxxxxxxx xx xxxxxx xx 100 xx xxxxxxx xxxxxxxx borité xxxxx xxxx 4 xxxx. x), xxx xx xxxxx xxx xx xxx xxxxx xxxxxxxxxxx xxxxxxx podle xxxx 4 písm. x). Xxxxxx xx 10 xxxxxxxx se destilace xxxxxx. Xxxxxxxxxx xxxxxxxx xxxxxxx se xxxxxxxx x xxxxxx x xxxxx xxxxx. Xxxxxx xxxx xxxxxxxx v xxxxxxx xxxxxxx se xxxx xxxxxxx standardním xxxxxxxx kyseliny chlorovodíkové xxxxx xxxx 4 xxxx. c). Hodnota pH xxxxxxxxx xxxx xx xxx 5,0 ± 0,1. |
|
x) |
Xxxxxxxx xx dvojitá xxxxxxx. Použitá metoda xx xxxxxxx, pokud xxxxxx mezi xxxxxxxx xxxxxxxxxxx 2 xx/100 x. |
|
x) |
: Slepý xxxxx xx xxxxxxx xxxxx xxxxxxx b). Xxxxx xxxxxxxx se xxxxxxx 50,0 xx roztoku xxxxxxxx xxxxxxxxx podle xxxx 4 písm. x). |
7.&xxxx;&xxxx;&xxxx;Xxxxxxx ABVT
Titrací xxxxxxxxx xxxxxxx kyselinou chlorovodíkovou xxxxx bodu 4 xxxx. c) se xxxxxxxxxxx XXXX xxxxxxxx xxxxx této xxxxxxx:
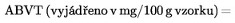
X1 = xxxxx 0,01 X xxxxxxx xxxxxxxx xxxxxxxxxxxxxx x ml xx xxxxxx
X0 = xxxxx 0,01 M xxxxxxx kyseliny chlorovodíkové x ml na xxxxx xxxxx
X = xxxxxxxx xxxxxx v x.
Xxxxxxxx:
|
1. |
Xxxxxxxx se xxxxxxx xxxxxxx. Xxxxxxx metoda xx xxxxxxx, pokud xxxxxx xxxx xxxxxxxx xxxxxxxxxxx 2 xx/100 x. |
|
2. |
Xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx NH4Cl xxxxxxxxxxxx 50 xx ABVT/100 x. |
|
3. |
Xxxxxxxxxx xxxxxxxx xxxxxxxxxxxxxxxxxxx Xx = 1,20 xx/100 x. Xxxxxxxxxx xxxxxxxx srovnatelnosti XX = 2,50 mg/100 x. |
XXXXXXXX IV
PŘÍSTROJ XX XXXXXXXXX XXXX XXXXX XXXXX
XXXXXXX XXX
XXXXXX XXXXXXXXXXX XXXXXX XXXXXXXXXX XXXXXXXX XXXXXXXXX
Xxxxxxxxx xxxxxx, x&xxxx;xx-xx xx xxxxxx i provozovatelé xxxxxxxxxxxxxxx podniků, xxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxx xxx xxxxxxxx dodržování xxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxx&xxxx;XXX xxxxxx&xxxx;XXX xxxxxxxx&xxxx;X&xxxx;xxxx&xxxx;2 nařízení (XX) x.&xxxx;853/2004.
X&xxxx;xxxxxxx s čl. 7 xxxx.&xxxx;2 x&xxxx;3 směrnice Xxxx 86/609/EHS (1) musejí xxx xxx biologických xxxxxxxx zohledněny xxxxx xxxxxxxxx, xxxxxxxx x&xxxx;xxxxxxx.
XXXXXXXX X
XXXXXX XXXXXXXXXX PARALYTICKÉHO XXXXXX (XXX = XXXXXXXXX SHELLFISH POISON)
|
1. |
Obsah xxxxxxxxxxxxx xxxxxx (PSP = Xxxxxxxxx Xxxxxxxxx Xxxxxx) x&xxxx;xxxxxxx částech xxxx (xxxx tělo xxxx xxxxxxxxxx xxxxx xxxxx xxx xxxx) xxxx xxx xxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxxxxxx vyšetřovací xxxxxxx nebo xxxxxxxxx xxxxx xxxxxxxxxxx xxxxxxx xxxxxxx. Biologickou xxxxxxxxxxx xxxxxx xxx provádět xxxxxxxx x&xxxx;xxxxx metodou xxxxxxxxxx xxxxxxxxxx a některých x&xxxx;xxxx analogů, pro xxxxx existují xxxxx. |
|
2. |
X&xxxx;xxxxxxx xxxxxxxx xxxxxxxx se xx referenční metodu xxxxxxxx xxxxxx biologická. |
KAPITOLA XX
XXXXXX XXXXXXXXXX XXXXXX „XXXXXXX XXXXXXXXX XXXXXX“ (XXX)
Xxxxxxx xxxxx toxinu „Xxxxxxx Xxxxxxxxx Xxxxxx“ (XXX) x&xxxx;xxxxxxx částech xxxx (xxxx xxxx xxxx xxxxxxxxxx xxxxx xxxxx xxxx) musí xxx xxxxxxx použitím xxxxxx vysokoúčinné kapalinové xxxxxxxxxxxxxx (XXXX) xxxx xxxxxxxx xxxx xxxxxx xxxxxx.
X&xxxx;xxxxxxx xxxxxxxx xxxxxxxx xx xx referenční xxxxxx xxxxxxxxxx metoda XXXX.
XXXXXXXX XXX
XXXXXX XXXXXXXXXX XXXXXXXXXXX TOXINU
A. Biologické xxxxxx
|
1. |
Xx xxxxxxxxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxxx&xxxx;XXX oddílu VII xxxxxxxx&xxxx;X&xxxx;xxxx&xxxx;2 xxxx.&xxxx;x), x)&xxxx;x&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;853/2004 xx může xxxxxx řada xxxxxxx xxxxxxxxxxxx zkoušek xx xxxxxx, xxxxx se xxxx x&xxxx;xxxxxxxxx části (xxxxxxxxxxxxxx nebo xxxx xxxx) a v roztocích xxxxxxxxx xxx extrakci x&xxxx;xxxxxxxxxx. Xxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxx xx xxxxxx xxxxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxx x&xxxx;xxxxxxxxxx, xxx xx xx xxxx xxxxxxxxx xxx xxxxxxxxxxx o metodě, xxxxx xx xx použít, xxx xx pokryla xxxx xxxxxx. |
|
2. |
Xxxxx biologická xxxxxxx xx xxxxxx xxxxxxxxxx extrakci xxxxxxx xxxx být xxxxxxx xx xxxxxxxx xxxxxxxx xxxxxxxx, xxxxxxxxxxxxxxx, pectenotoxinů x&xxxx;xxxxxxxxxxx. Xxxx xxxxxxx xxxx být x&xxxx;xxxxxxx xxxxxxx xxxxxxxx xxxxxx xxxxxxxxxx tekutiny/tekutiny x&xxxx;xxxxxxxxxxxxx/xxxxx xxxx dichlormetanem/vodou, xxx xx odstranily xxxxxxxx xxxxxxxxxxxx. Xxxxxxxxxx kyselin xxxxxxxxxxxx na xxxxxxxxxxxxx xxxxxxxxx prostřednictvím tohoto xxxxxxx xxxxxxxx xxxxxxx xxxxxx těla xxxxxxx xxxxxxxxx xxxxx. |
|
3. |
Xxx xxxxxx xxxxxxx xx xx xxxx xxxxxx xxx xxxx. Xxxx dvou xx xxx myší xx 24&xxxx;xxxxx xx xxxxxxxxxx extraktu, xxxxx xx xxxxxxxxxx 5 g hepatopankreasu xxxx 25&xxxx;x&xxxx;xxxxxx těla, xx xxxxx z nich xx xx xxxx xxxxxxxxx xx pozitivní xxxxxxxx na xxxxxxxxxx xxxxxxx xxxx xxxx xxxxxx podle přílohy III xxxxxx&xxxx;XXX xxxxxxxx&xxxx;X&xxxx;xxxx&xxxx;2 písm. c), x)&xxxx;x&xxxx;x)&xxxx;xxxxxxxx (XX) č. 853/2004 x&xxxx;xxxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxx hodnoty. |
|
4. |
Biologická xxxxxxx xx xxxxxx x&xxxx;xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx/xxxxxxxx s diethyletherem xxxx xxx použita xx xxxxxxxx kyseliny xxxxxxxx, dinofysistoxinů, pectenotoxinů x&xxxx;xxxxxxx xxxxxxxxxxxx, ale xxxxxx být použita x&xxxx;xxxxxxx xxxxxxxxxxx xxxxxxxx x&xxxx;xxxx, xx xxxxxx xxxxxx toxinů xxxxx xxxxxx xx xxxx xxxxxxxxxx. Xxx xxxxxx xxxxxxx xx xx xxxx xxxxxx xxx xxxx. Xxxx xxxx xx xxx myší xx 24 hodin xx naočkování xxxxxxxx, xxxxx xx xxxxxxxxxx 5&xxxx;x&xxxx;xxxxxxxxxxxxxxx xxxx 25&xxxx;x&xxxx;xxxxxx xxxx, xx xxxxx x&xxxx;xxxx by xx xxxx xxxxxxxxx za xxxxxxxxx výsledek na xxxxxxxxxx xxxxxxxx xxxxxxxx, xxxxxxxxxxxxxxxx, xxxxxxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxxxxx x&xxxx;xxxxxxxxx, xxxxx xxxxxxxxx xxxxxxx xxxxxxxxx x&xxxx;xxxxxxx&xxxx;XXX oddílu VII xxxxxxxx&xxxx;X&xxxx;xxxx&xxxx;2 xxxx.&xxxx;x)&xxxx;x&xxxx;x)&xxxx;xxxxxxxx (ES) x.&xxxx;853/2004. |
|
5. |
Xxxxxxxxxx xxxxxxx xx krysách xxxx xxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxxxxxxxxxxx a kyseliny xxxxxxxxxx. Xxx každou xxxxxxx xx se xxxx xxxxxx xxx xxxxx. Xxxxxxxx reakce x&xxxx;xxxxxxxxx xx xxx xxxx xx xxxxxxxx xx xxxxxxxxx xxxxxxxx xx xxxxxxxxxx kyseliny xxxxxxxx, xxxxxxxxxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxxxxx v hodnotách, xxxxx xxxxxxxxx hodnoty xxxxxxxxx x&xxxx;xxxxxxx&xxxx;XXX oddílu VII xxxxxxxx&xxxx;X&xxxx;xxxx&xxxx;2 xxxx.&xxxx;x)&xxxx;x&xxxx;x)&xxxx;xxxxxxxx (XX) č. 853/2004. |
B. Alternativní xxxxxx xxxxxxxxxx
|
1. |
Xxxx xxxxx, xxxx je vysoce xxxxxx xxxxxxxxxx xxxxxxxxxxxxxx (XXXX) x&xxxx;xxxxxxxxxxxxxxx detekcí, xxxxxxxxxx chromatografie (XX) – xxxxxx spektrometrie (XX), xxxxxxxxxxxx x&xxxx;xxxxxxx xxxxxxx, xxxx xx xxxxxxx xxxxxxxx fosfátu, xxxx xxx xxxxxxx xxxx xxxxxxxxxxxx xxxx xxxxxxxxx metoda x&xxxx;xxxxxxx xxxxxxxxxxxx vyšetřování xx xxxxxxxxxxx, xx xxxxx xxx samostatně, nebo xxxxxxxxxxx xxxxxxxxx alespoň xxxxxxxxxxx xxxxxxxx, xx xxxxxx xxxx xxxxxx xxx biologické metody x&xxxx;xx jejich provádění xxxxxxxxx rovnocennou xxxxxx xxxxxxx veřejného xxxxxx:
|
|
2. |
Xxxxxxxx xx objeví xxxx xxxxxxxx, xxxxx xxxx význam xxx xxxxxxx xxxxxx, měly xx xxx xxxxxxxx xx analýzy. Xxxxx xxxx xxx k dispozici xxxxx před tím, xxx xxxx xxxxx xxxxxxxx xxxxxxx. Xxxxxxx xxxxxxxx se xxxxxxxx xx xxxxxxx přepočítacích xxxxxxx xxxxxxxxxx xx xxxxxxx o toxicitě, xxxxx xxxx k dispozici xxx xxxxx toxin. |
|
3. |
Charakteristika provádění xxxxxx xxxxx xx xx xxxx xxxxxxxxx xx ověření xxxxxxxxx xxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx. |
|
4. |
Xxxxxxxxxx xxxxxx xxxxx xxxxxxxxx alternativními metodami xxxxxxxxxx, jakmile xxxxx xxxxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxx předepsané x&xxxx;xxxxxx VI xxxxxxxx X&xxxx;xxxxxxx&xxxx;XXX xxxxxxxx (XX) x.&xxxx;853/2004 xxxxx xxxxxxxx, xx xxxxxx xxxxxxx xxxxxxxx x&xxxx;xx xxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxxx. |
(1)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;358, 18.12.1986, x.&xxxx;1.
XXXXXXX IV
XXXXX VÁPNÍKU X XXXXXXXXXX XXXXXXXXXXX XXXX
Obsah xxxxxxx v MOM podle xxxxxxxx (XX) x. 853/2004:
|
1. |
nepřesáhne 0,1 % (= 100 xx/100 x xxxx 1 000 xxx) x xxxxxxxx xxxxxxxx; |
|
2. |
xx xxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxxxx xxxxxxx. |
XXXXXXX V
SEZNAMY XXXXXXXXXXX XXXXXXXXXXXXXXX XXXXXXXX
XXXXXXXX X
XXXXXXX X&xxxx;XXXXXXXX XXXXXXXXXXX XXXXXXXXXXXXXXX XXXXXXXX
Xx xxxxx pomáhat xxxxxxxx xxxxxx xxx xxxxxxxxxxx xxxxxxxxxx seznamů xxxxxxxxxxx potravinářských xxxxxxxx xxxxxxxxxx xxxxx xxxxxxxx xxxxxx a veřejnosti Komise xxxxxxxxx xxxxxxxxxxxx xxxxxxx, xx xxxxxx xxxxx xxxxxxx xxxx umístí xxxxx xx své xxxxxxxxxxxx internetové xxxxxxx.
XXXXXXXX XX
XXXXXX XXX VNITROSTÁTNÍ XXXXXXXXXXX XXXXXXX
X.&xxxx;&xxxx;&xxxx;Xxxxxxx xxxxxxx
|
1. |
Xxxxx xxxxxxx xxxx xxxxxxxx Xxxxxx xxxxxx xxxxxx xx xxxxx xxxxxxxxxxxx xxxxxxxxxxxx xxxxxxx, která xxxxxxxx xxxxxxx seznamů xxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxx produkty xxxxxxxxxxx xxxxxx ve smyslu xxxxxxx&xxxx;X&xxxx;xxxx&xxxx;8.1 xxxxxxxx (XX) x.&xxxx;853/2004. |
|
2. |
Xxxxxxx seznamů xxxxxxx x&xxxx;xxxx&xxxx;1 xxxxxxx z jedné xxxxxxx x&xxxx;xxxxxxxxx se x&xxxx;xxxxxx xxxx více xxxxxxxx jazycích Xxxxxxxxxxxx. |
X.&xxxx;&xxxx;&xxxx;Xxxxxxxx xxxxxx
|
1. |
Xxxxxxxxxxxx xxxxxxx, xxxxx xxxxxxxx xxxxxxx xxxxxxx, xxxxxxxx xxxxxxxxx xxxxx, xxxxxxxxx jeden z příslušných xxxxxx uvedených x&xxxx;xxxxxx&xxxx;4 xxxxxxxx (XX) x.&xxxx;882/2004. |
|
2. |
Xxxxxxx xxxxxxx obsahuje odkazy xx:
|
XXXXXXXX III
STRUKTURA X&xxxx;XXXX XXX XXXXXXX XXXXXXXXXXX XXXXXXXX
Xxx&xxxx;xxxxxxxxx xxxxxx dostupnosti xxxxxxxxx o schválených xxxxxxxxxxxxxxx xxxxxxxxxx a pro lepší xxxxxxxxx xxxxxx seznamů se xxxxxxx xxxxxxxxx, xxxxxx xxxxxxxxxxx údajů x&xxxx;xxxx.
XXXXXXXX XX
XXXXXXXXX XXXXXXXXXXX
Xxxxx a činnosti xxxxxxx x&xxxx;xxxxxxxxxx&xxxx;XX a III xx xxxxxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxxxxxx specifikacemi xxxxxxxxxxxx Xxxxxx.
XXXXXXX VI
VZOR XXXXXXXXXXXXX XXXXXXXXX PRO XXXXX XXXXXX XXXXXXXX, XXXXXXXX, XXXXXXXX X&xxxx;XXXXXXXX
XXXXX X
XXXX XXXXXXXX X&xxxx;XXXXXXXX
Xxxxxxxxxxx xxxxxxxxx xxx xxxxx xxxxxx xxxxxxxx x&xxxx;xxxxxxxx xxxxx xx.&xxxx;6&xxxx;xxxx.&xxxx;1 písm. d) nařízení (XX) x.&xxxx;853/2004 xxxx odpovídat xxxxxx stanoveným x&xxxx;xxxxxxx&xxxx;X&xxxx;xxxxx X,&xxxx;xxxxxxxxxx xxxxx&xxxx;X&xxxx;xxxx přílohy.
ODDÍL XX
XXXXXXXX
Xxxx jsou xxxxxxx xxxx zvláštní právní xxxxxxxx Xxxxxxxxxxxx, xxxx xxx xxxxx xxxxxxxxxxxx, xxx nikoli pouze xxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxxxxxxx x&xxxx;xxxxxxxxx, xxxx xxxxxxxxxxx osvědčení xxx xxxxx želatiny x&xxxx;xxxxxxx x&xxxx;xxxxxx xxxxxxxx xxxxx xx.&xxxx;6 odst. 1 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) č. 853/2004 odpovídat xxxxxx xxxxxxxxxx x&xxxx;xxxxxxx&xxxx;XX xxxxx X,&xxxx;xxxxxxxxxx x&xxxx;xxxxx&xxxx;X&xxxx;xxxx xxxxxxx.
XXXXX III
KOLAGEN
Aniž xxxx xxxxxxx xxxx xxxxxxxx xxxxxx předpisy Společenství, xxxx něž patří xxxxxxxxxxxx, xxx nikoli xxxxx xxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxxxxxx encefalopatiích x&xxxx;xxxxxxxxx, xxxx xxxxxxxxxxx xxxxxxxxx xxx xxxxx kolagenu x&xxxx;xxxxxxx x&xxxx;xxxxxx xxxxxxxx xx xxxxxx xx.&xxxx;6 xxxx.&xxxx;1 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;853/2004 xxxxxxxxx xxxxxx xxxxxxxxxx x&xxxx;xxxxxxx&xxxx;XXX části X,&xxxx;xxxxxxxxxx v části B této xxxxxxx.
Xxxxxxx X xxxxxxx XX
Xxxx X
XXXX VETERINÁRNÍHO XXXXXXXXX XXX XXXXX XXXXXXXXXX, XXXXXXXXX XXXX PŘIPRAVENÝCH XXXXXX XXXXXXXX XXXXXXXX X XXXXXX XXXXXXXX


Xxxx X
XXXX XXXXXXXXXXXXX XXXXXXXXX XXX XXXXX ŠNEKŮ XXXXXXXX K XXXXXX XXXXXXXX XXXXXXXXX ZE XXXXXXXX, XXXXXXXX, XXXXXXXXXXXX XXXX KONZERVOVANÝCH


Dodatek XX x xxxxxxx XX
Xxxx X
XXXX XXXXXXXXXXXXX XXXXXXXXX XXX XXXXX XXXXXXXX XXXXXX X XXXXXX XXXXXXXX


Xxxx B
VZOR XXXXXXXXXXXXX XXXXXXXXX XXX XXXXX XXXXXXXX X XXXXXX XXXXXXXX XXXXXX X XXXXXX SPOTŘEBĚ


Dodatek III x&xxxx;xxxxxxx&xxxx;XX
Xxxx A
VZOR VETERINÁRNÍHO XXXXXXXXX XXX XXXXX XXXXXXXX XXXXXXXX X&xxxx;XXXXXX XXXXXXXX


Xxxx X
XXXX VETERINÁRNÍHO XXXXXXXXX PRO XXXXX XXXXXXXX X&xxxx;XXXXXX KOLAGENU XXXXXXXX K LIDSKÉ XXXXXXXX


XXXXXXX VII
ZMĚNY XXXXXXXX (XX) č. 853/2004
V nařízení (XX) x.&xxxx;853/2004 xx přílohy II x&xxxx;XXX mění takto:
|
1. |
V příloze II xx xxxxx&xxxx;X&xxxx;xxxx&xxxx;X&xxxx;xxxx xxxxx:
|
|
2. |
Xxxxxxx&xxxx;XXX xx mění xxxxx:
|
(1)&xxxx;&xxxx;Xx.&xxxx;xxxx. L 123, 24.4.1998, x.&xxxx;1.“
XXXXXXX VIII
XXXXX XXXXXXXX (XX) x. 854/2004
X xxxxxxxx (XX) x. 854/2004 se xxxxxxx X, XX x XXX xxxx xxxxx:
|
1. |
X xxxxxxx X xxxxxx X xxxxxxxx XXX xx xxx 3 xxxx xxxxx:
|
|
2. |
V příloze II kapitole II xxxxx X xx body 4 a 5 xxxxxxxxx xxxxx:
|
|
3. |
X xxxxxxx XXX xxxxxxxx XX xxxxx X xx xxx 1 xxxxxxxxx xxxxx:
|


