XXXXXXXX KOMISE (EU) 2015/566
xx xxx 8. xxxxx 2015,
kterou xx xxxxxxx xxxxxxxx 2004/23/XX, xxxxx jde o postupy xxx ověřování xxxxxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxxx norem xxx dovážené xxxxx x xxxxx
(Xxxx s xxxxxxxx xxx EHP)
XXXXXXXX XXXXXX,
s ohledem xx Xxxxxxx x xxxxxxxxx Xxxxxxxx xxxx,
x xxxxxxx xx xxxxxxxx Evropského parlamentu x Xxxx 2004/23/XX ze xxx 31. března 2004 x xxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxxx xxxxx xxx xxxxxxxx, odběr, xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx, skladování x xxxxxxxxxx xxxxxxxx tkání x xxxxx (1), x xxxxxxx xx xx. 9 xxxx. 4 xxxxxxx xxxxxxxx,
xxxxxxxx k těmto xxxxxxx:
|
(1) |
Xxxxxxxx 2004/23/XX stanoví v zájmu xxxxxxxxx xxxxxx úrovně xxxxxxx xxxxxxxx xxxxxx x Xxxx xxxxxxxx x xxxxxxxxxxxx xxxxx pro xxxxxxxx, xxxxx, xxxxxxxxxxx, zpracování, xxxxxxxxxx, skladování x xxxxxxxxxx xxxxx lidských tkání x xxxxx xxxxxxxx k použití x xxxxxxx x xxx darování, xxxxx x xxxxxxxxxxx lidských xxxxx x xxxxx obsažených x xxxxxxxxxxx určených x xxxxxxx x xxxxxxx, pokud xx xx tyto přípravky xxxxxxxx jiné xxxxxx xxxxxxxx Unie. |
|
(2) |
X xxxxxxxxxxx xxxxxx xxxxx x xxxxx xxxxxxx xx xxxxx větším xxxxxxx, x xxxxxxxx 2004/23/ES xxxxx xxxxxxxx, aby xxxxx tkání x xxxxx xxxxxxxxxxx tkáňová zařízení, xxxxx xxx xxxxx xxxx xxxxxxxxxxxx xx xxxxxxxxx xxxxxxx státy xxxx xxx xxxxxxx xxxxxxxxx či xxxxxxxx. Xxxxxxx z uvedeného požadavku xxxx stanoveny x xx. 9 xxxx. 3 xxxxxxxx 2004/23/XX, xxxxx xxxxxxxx příslušným xxxxxxx, xxx xxxxx xxxxxxxx dovoz určitých xxxxx x xxxxx xx xxxxxxxx xxxxxxxxxxx x xxxxxx 6 xxxxxxxx Xxxxxx 2006/17/ES (2) xxxx x xxxxxxxxx případě. Xxxx výjimky xxxx xxxxxxxxx xxxxxxxxxx, xxxx xxxx, xxx xxxxxxxxxx xxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxx x xxxxxx xxxxx, xxxxxxxxx xxxx nebo xxxxxxxxxxx krve, xxxxx xxxx xxxxxxxxx xxx xxxxx xxxx onemocnění xxxxxxxxxxxx xxxxxx život. |
|
(3) |
Směrnice 2004/23/XX dále vyžaduje, xxx xxxxxxx xxxxx x xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx, xx dovoz xxxxx x xxxxx xxxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxx xxxxxxxxxx normám, xxxxx xxxx xxxxxxxxx ve xxxxxxxx 2004/23/ES, x xxxxxx xx xxxxxxx xxxxxxx xxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxxx xxxxx xxx dovoz xxxxx x xxxxx. Tyto postupy xx měly xxx xxxxxxxxx v této směrnici, xxxx jsou dotčeny xxxxxx xxxxxxxx Xxxx x xxxxxxx xxx. |
|
(4) |
Xxxxxxx je xxxxxx xxxxxxxx programy xxxxxxxxxxx a inspekcí xxxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxx xxx činnosti související x xxxxxxx a buňkami xxxxxxxxx x Xxxx. Xxxx xx xxxxxx stanovit xxxxxxx, xxxxx xxxx dodržovat xxxxxxxxxx xxxxxxx xxxxxxxx xx vztahu x xxxxxxxxxxx xx třetích zemí. |
|
(5) |
X xxxxxxxx xxxxxx, xxxxx přímo xxxxxxxx xxxxxxxxx xxxxxx xxxxx xx. 9 xxxx. 3 xxxxxxxx 2004/23/ES, xxxx xxxxxxx xxxxx tkání x xxxxx xx třetích xxxx xxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx. V případech, xxx příslušné xxxxxx xxxxx povolí dovoz xxxxx čl. 9 xxxx. 3 xxxxxxxx 2004/23/XX, musí xxxxxxxxx xxxxxx xxxxxxxx, xxx xxxxxxx dovoz xxxxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxx xxxxxxxxxx normám xxxxxxxxxx x xxxxxxx xxxxxxxx. |
|
(6) |
Xxxxx x xxxxx by měly xxx xx xxxxxxxxxx xxxxxxxxx dováženy xxxxxxx xxxxx xxxx nemocničními xxxxxxxxxx, které xxxx xxxxxxxxxxxx xx xxxxxxxxx xxxx xxx bylo xxxxxxx oprávnění xx xxxxxxxx coby dovážejícím xxxxxxxx xxxxxxxxx pro xxxxx dovozu. Xxxxx xxxxx nebo xxxxxxxxxx xxxxxxxx xx xxxx xxx považovány xx xxxxxxxxxx tkáňová xxxxxxxx, xxxxx jsou xxxxxxx xxxxxxxxx ujednání x xxxxxxxxxxx xx xxxxx xxxx xx xxxxx tkání x xxxxx. Xxxxxxxx xx xxxxxxx xxxxxxxxx ujednání x xxxxxxxxxxx xx třetí xxxx xxxxxxx xxxxxxxxxx xxxxxxxxxxxxxxxxxxx xxxxxx s cílem xxxxxxxx xxxxx xxxxx x xxxxx, xxxxx xxxxxx xxx samotný xxxxx, xxxxx by xxx xxxxxxxxx xx xxxxxxxxxx xxxxxxx xxxxxxxx. Xxxxxxx xxxxx xxxxx tyto xxxxxx regulovat xxxx xxxxxx působnosti této xxxxxxxx. |
|
(7) |
Xxxx-xx xxxxxxx smluvního xxxxxxxx xx xxxxx xxxxx a buněk x xxxxxxxxxxx xx xxxxx xxxx xxxx xxxxxxxx, jako xxxxxxxxx organizace odpovědné xx xxxxxxx x xxxxxxx, xxxxxxx xxxxxxxx xxxxxxxxx xxx moderní xxxxxxx, xxxxxx v nemocnici nebo xxxxxxxxxxx, měly xx xxx považovány xx xxxxxxxxxx xxxxxxx xxxxxxxx. Xxxx subjekty xxxx xxxxxxxx xxxxxxxxx této xxxxxxxx a rovněž xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx 2004/23/XX a jejich příslušné xxxxxx je musí xxxxxxxxxxx xx xxxxxxxx xxxx xxx xxxx xxxxxx oprávnění xx xxxxxxxx xxxx dovážejícím xxxxxxxx xxxxxxxxx pro xxxxx dovozu. Jestliže x xxxxxxxxxx xx dovoz xxxx xxxxxxxx xxxx xxxxxxxxx vyšetřování, xxxxxxxxxx, xxxxxxxxxx, skladování nebo xxxxxxxxxx xxxxxxxxxx xxxxx x xxxxx, xxxx být xxxxxx akreditovány či xxxxxxxxx xxxx xxx xxxx xxx xxxxxxx xxxxxxxxx xxxx xxxxxxxx xxx účely xxxxxx xxxxxxxx jejich příslušnými xxxxxx; dále musí xxxxxxxx xxxxxxxxx směrnice 2004/23/XX. Xxxxx xxxx xxxx xxxxx xxxxxx xxxxx x xxxxx xxxxxxxxxxx xx xxxxxxx xxxx xx bank xxxxx xxxx nemocničních xxxxxxxx x Xxxx, které xxxx xxxxxxxxxxxx či xxxxxxxxx xxxx xxx xxxx xxxxxxx xxxxxxxxx xx xxxxxxxx coby dovážejícím xxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxx. |
|
(8) |
Jestliže jsou xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxx xxxxxxxxxxxx xx xxxxxxxxx nebo xxx xxxx xxxxxxx xxxxxxxxx xx xxxxxxxx xxxx xxxxxxxx xxxxxxxxx xxx xxxxxxxx, xxxxx xxxxxxxxxx x Xxxx, xxxxx xxxxxxx xxxxx xxxxxxxxxxx xxx xxxxxxx pro xxxxxxxxx xxxxxxxxx, xxxxxxxx x xxxxxxxx xxxxx, jestliže budou xxxxxxxx postupy xxxxxxxxx x xxxx xxxxxxxx. |
|
(9) |
X xxxxx xxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx x xxxxx x Xxxx, xxxxxx xxxxxxx přeshraniční distribuce, xx příslušný xxxxx xxxx orgány xxxx xxxxx xxxxxxxxx x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx nebo xxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx. |
|
(10) |
Xxxxxxxxx xxxxx xxx xxxxxxxxx, xxx xxxxxxxx xxxxx a buňky xxxxxxx xxxxxxxx a bezpečnostní xxxxx, xxxxx jsou xxxxxxxxxx xxxxxx xxxxxxxxxx xx xxxxxxxx 2004/23/XX, hrají xxxxxxxx. Xxxxxxx xxxxx xx xxxxx xxxxxxxx, xxx x xxxxxxxxxxx případech xxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxxxx xx xxxxxxx xxxx x xxx xxxxxxxxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxx, xx xxxxx mohou xxx dovezené xxxxx x xxxxx distribuovány. Odpovědnost xx xxxxxxx xxxxxxxxxxxxxx xxxxxxxx x xxxxxxxxxx, zda xx xxxxx x xxxxxxxxxx xx xxxxxxx zemí xxxxxxxx inspekce xx xxxxx, náleží xxxxxxxx xxxxxx, x xxxxx jsou xxxxxxxx xxxxxxxxxx tkáňová xxxxxxxx. |
|
(11) |
Xxxx aktualizována xxxxxxxx xxxxxxxx xxxxxxxx xx xxxxxxxx xxx příslušné xxxxxx (Xxxxxxxxxxx Manual xxx Xxxxxxxxx Xxxxxxxxxxx xx xxxxxxxxxxx), která xxxx xxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxx xxxxxxxxxx ze xxxxxxx xxxx; při xxxxxxxxx xxxxxxxx může xxxx xxxxxxxx xxxxxxxx xxxxxx posloužit xxxx xxxxxxxxxx xxxxxxxx. |
|
(12) |
Dovážející xxxxxxx xxxxxxxx by xxxx xxxxxx, xx tkáně x xxxxx, jež dovážejí xx Unie, xxxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxx, xxxxx xxxx rovnocenné xxxxxxxxx a bezpečnostním xxxxxx xxxxxxxxxx ve xxxxxxxx 2004/23/XX. Klíčové xxxxx xxx zajištění, xxx xxxxxx xxxxxxxxx xxxxxxxx, x xxxxxxx xxxxxxxxx sledovatelnosti xx x xxxxx x xxxxxxxx, xxx xxxx xxxxxxxx xxxxxx xxxxxxxxxxxx x xxxxxxxxxxx xxxxxxxx v souladu xx xxxxxxxx 2004/23/XX, xxxxxxxxxxx xxxxxxx dohody x xxxxxxxxxx xx xxxxxxx xxxx x xxxxxxxxxxx, xxxxx xx xxx xxxxxx x xxxxxxxxxx xxxxxxxxxx xxxxxxx. Dovážející xxxxxxx xxxxxxxx se xxxxxx xxxxxxxx, xxx x xxxxx dodavatelů ze xxxxxxx xxxx coby xxxxxxx xxxxxx ověřovacího xxxxxxx xxxxxxxxx audit. |
|
(13) |
Xxxxxxxxxx xxxxxxx zařízení by xxxx xxxxxxxx, xx xx na dovážené xxxxx a buňky v souladu xx xxxxxxxx Xxxxxx 2006/86/XX (3) uplatňován xxxxxxxx xxxxxxxx xxx, a to xxx xxx, xx xxxx povinnost xxxxx xxxx, xxxx xx xxxxxx xxxxxxxxxx xx xxxxxxx xxxx xxxx xxxxxxx xxxxxxxx xxxxxxx xxxxxx, xxxxxx x xxxx xxxxxxxx. |
|
(14) |
Xxxxxxx xxxxx by xxxx mít xxxxxxx xxxxxx x xxxxxxx xxxxxxxxxxxxx xxxxxx výjimku x xxxxxxxxx xxxxxxxxxxx x xxxx xxxxxxxx, xxxxx jde o dokumentaci x xxxxxxx dohody. Takový xxxxxxxxxxx dovoz xx xxxxxxx xxxx provádět xxxxxxxxxx tkáňová zařízení, xxx xxxx xxxxxxxxxxxx xx xxxxxxxxx xxxx xxxx xxxx xxxxxxx xxxxxxxxx xx xxxxxxxx, x xxxxxx by k němu xxxxxx xxxxxxxx pravidelně xxxx xxxxxxxxx od xxxxxxxx xxxxxxxxxx xx xxxxx xxxx. Tyto xxxxxxx xx měly xxx xxxxxxx na xxxxxxx, xxx xxxxxx xxxxx (xxxx xxxxx) xx xxxx měla xxx svoji xxxxxxx xxxxxxx ve třetí xxxx uskladněny tkáně xxxx xxxxx – xxxxx xx zejména x xxxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxx xxxx xxxxxxxx, xxxxxxxx xxxxxx x xxxxxxxxxxx xxxxxxx xxxx xxxxxxxx xxxxxx xxxxxxx příbuzným – x xxxxxxxx xx xxxxx xxxx xx xxxx xxxx tkáně xx xxxxx xxxxxx xx Xxxx. X xxxxxxxx xxxxxx xxxxxxxxxxxx druhu xxxxx xxxx xxxxx xx v případě xxxxxxx xxxxxxxxxxx příjemce x xxxxxx xxxxxx xxxxx více xxx jednou x xxxx xxxxxxxx xx neměly xxx xxxxx xxxx xxxxx xxx xxxxx xxxxxx. |
|
(15) |
Xxxx směrnice xxxxxxx xxxxxxxx xxxxxx xxxxxxxx xxxx zavést xxxxxxxxx xxxxxxxx xxx xxxxx xxxxx x xxxxx, xxxxxxx x xxxxx dodržování zásady xxxxxxxxxxxx a neplaceného xxxxxxxx xx xxxxxxxx, xx xxxx xxxxxxx ustanovení Xxxxxxx. |
|
(16) |
Xxxxxxxx xxxxxxxxx xxxxx xxxxxxxx xxxx v souladu xx xxxxxxxxxxx Xxxxxxxxxxxxx xxxxxx xxx xxxxx x xxxxx xxxxxxxxx xxxxx xx. 29 xxxx. 3 směrnice 2004/23/XX, |
XXXXXXX XXXX SMĚRNICI:
KAPITOLA X
XXXXXX XXXXXXXXXX
Xxxxxx&xxxx;1
Xxxxxx xxxxxxxxxx
1.&xxxx;&xxxx;&xxxx;Xxxx xxxxxxxx se xxxxxxx xx xxxxx xx Xxxx:
|
x) |
xxxxxxxx xxxxx x&xxxx;xxxxx xxxxxxxx k použití x&xxxx;xxxxxxx a |
|
b) |
přípravků získaných x&xxxx;xxxxxxxx tkání x&xxxx;xxxxx xxxxxxxx k použití x&xxxx;xxxxxxx, xxxxx xx xx xxxxxx přípravky xxxxxxxxxx xxxx právní předpisy Xxxx. |
2.&xxxx;&xxxx;&xxxx;X&xxxx;xxxxxxxxx, xxx xxxx xxxxxx xxxxx x&xxxx;xxxxx, xxxxx xxxx xxx xxxxxxxx, xxxxxx xxxxxxxx x&xxxx;xxxxxxx v přípravcích, xx xxx xx vztahují xxxx právní xxxxxxxx Xxxx, použije xx xxxx xxxxxxxx xxxxx xx xxxxxx xxxxxxxx, xxxxx x&xxxx;xxxxxxxxxxx, které xxxxxxxxx x&xxxx;Xxxx, x&xxxx;xxxxxx xx xxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xx xxxxx x&xxxx;xxxxxxxx x&xxxx;xxxxxx.
3.&xxxx;&xxxx;&xxxx;Xxxx xxxxxxxx xx xxxxxxxxx na:
|
a) |
dovoz xxxxx a buněk uvedených x&xxxx;xx.&xxxx;9 xxxx.&xxxx;3 xxxx. x) směrnice 2004/23/XX, xxxxx je přímo xxxxxxx xxxxxxxxxx xxxxxxx xxxx xxxxxx; |
|
x) |
xxxxx tkání x&xxxx;xxxxx xxxxxxxxx v čl. 9 xxxx.&xxxx;3 xxxx. x) xxxxxxxx 2004/23/ES, xxxxx xx xxxxx xxxxxxx x&xxxx;xxxxxxxxxx případech; |
|
c) |
krev x&xxxx;xxxxxx xxxxxx ve xxxxxx xxxxxxxx 2002/98/XX; |
|
x) |
xxxxxx xxxx xxxxx orgánů xx xxxxxx xxxxxxxx 2004/23/XX. |
Xxxxxx 2
Xxxxxxxx
Xxx účely této xxxxxxxx xx xxxxxxx xxxx xxxxxxxx:
|
a) |
„xxxxxxxxx případem“ xx rozumí jakákoli xxxxxxxxxxx situace, x xxx xxxx xxxx xxxxxxxx xxxxxxx nežli urychleně xx Xxxx dovézt xxxxx x xxxxx ze xxxxx země pro xxxxxxxx xxxxxxx x xxxxxxx xxxxxxxx nebo známých xxxxxxxx, xxxxxxx xxxxxx xx bez xxxxxxxx xxxxxx xxxx xxxxx xxxxxxxx; |
|
x) |
„xxxxxxxxxxx xxxxxxxx xxxxxxxxx“ xx xxxxxx banka xxxxx nebo xxxxxxxxxx xxxxxxxx xx xxxx xxxxxxx zřízený x Xxxx, xxxxx je xxxxxxx xxxxxxxxx xxxxxxxx s dodavatelem xx xxxxx země xx xxxxx xx Xxxx tkání x xxxxx xxxxxxxxxxxxx xx xxxxx xxxx xxxxxxxx k použití x xxxxxxx; |
|
x) |
„xxxxxxxxxxxx dovozem“ xx xxxxxx xxxxx xxxxxxxxxxxx xxxxx xxxxx nebo xxxxx, xxxxx je xxxxxx x xxxxxxxx použití x xxxxxxxxxxx xxxxxxxx xxxx xxxxxxxx, xxxxx xxxx xxxxxxxxxxxx tkáňovému xxxxxxxx x xxxxxxxxxx xx třetí xxxx xxxxx ještě xxxx dovozem. K takovému xxxxxx jakéhokoli xxxxxxxxxxxx xxxxx tkáně xxxx xxxxx xxxxx v případě xxxxxxxxxx xxxxxxxxxxx xxxxxxxx x xxxxxx dojít xxxx xxx xxxxxx. Xx „xxxxxxxxxxx dovoz“ xx xxxxxxxxxx xxxxx xx xxxxxxxx xxxxxxxxxx xx xxxxx xxxx, x xxxxx xxxxxxx xxxxxxxxxx nebo xxxxxxxxx; |
|
x) |
„xxxxxxxxxxx ze xxxxx xxxx“ se xxxxxx xxxxxxx xxxxxxxx xxxx xxxx xxxxxxx xxxxxxx xx třetí xxxx, xxxxx xx odpovědný xx vývoz xxxxx x xxxxx xx Xxxx, xxx xxxxxx xxxxxxxxxxxx xxxxxxxxx zařízení. Xxxxxxxxx xx xxxxx xxxx xxx xxxxxx xxxxxxxxx xxxxx xxxx xxxx xxxxxxxx, které neprobíhají x Xxxx, x xxxx xxxxxxxx, xxxxx, xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx nebo xxxxxxxxxx xxxxx x xxxxx xxxxxxxxxx xx Xxxx. |
KAPITOLA II
POVINNOSTI XXXXXX XXXXXXXXX XXXXX
Xxxxxx&xxxx;3
Xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx nebo xxxxxxxx xxx xxxxxxxxxx xxxxxxx xxxxxxxx
1.&xxxx;&xxxx;&xxxx;Xxxx xx dotčen xx.&xxxx;1 xxxx.&xxxx;3, xxxxxxx xxxxxxx xxxxx, xxx xxxxxxx xxxxx tkání x&xxxx;xxxxx xx xxxxxxx xxxx prováděla xxxxxxxxxx xxxxxxx xxxxxxxx, xxxxx xxxx pro xxxxx xxxxxx xxxxxxxx xxxxxxxxxxxx xx xxxxxxxxx xxxxxxxxxx xxxxxxx xxxx orgány xxxx xxxx xxxxxxx xxxxxx či xxxxxx xxxxxxx xxxxxxxxx xx xxxxxxxx.
2.&xxxx;&xxxx;&xxxx;Xxxx, xx příslušný xxxxx nebo xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx X&xxxx;xxxx xxxxxxxx, x&xxxx;xxxx, xx xxxxxxx, xx xxxxxxxxxx xxxxxxx xxxxxxxx splňuje xxxxxxxxx xxxx xxxxxxxx, xxxxxxxxxx xx jmenují xxxxxxxxxx xxxxxxx xxxxxxxx xxxx xx xxxxx xxxxxxxxx xx xxxxxxxx xx xxxxx tkání x&xxxx;xxxxx x&xxxx;xxxxxxx xxxxxxxx xxxxxxxx, xxxxxxxxx jakékoli xxxxxxx xxxxx tkání a buněk, xxxxx smí xxx xxxxxxxx, xxxx dodavatele xx xxxxxxx xxxx, xxxxx xxx xxx xxxxxxxxx. Xxxxxxxxx xxxxx xxxx xxxxxx xxxxxx xxxxxxxxxxxx xxxxxxxxx zařízení, xxxxx xxxx xxxxxxxxxxxx xx xxxxxxxxx xxxx xxxxx xxxx xxxxxxx xxxxxxxxx xx xxxxxxxx, xxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx XX této směrnice.
3. Dovážející xxxxxxx xxxxxxxx xxxxxxxxx xxxxx podstatné změny xxxxx xxxxxxxx x&xxxx;xxxxxxx xxxxxx xxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xxxx orgánů. Xx podstatné xxxxx xxxx xxxxxxxxxx xxxxxxx xxxxx xxxxx dovážených xxxxx a buněk, činností xxxxxxxxxxx xx xxxxxxx xxxxxx, které xxxxx xxxxxxxx kvalitu x&xxxx;xxxxxxxxxx xxxxxxxxxx tkání x&xxxx;xxxxx, xxxx změny xxxxxxxxxx xx xxxxxxx zemí. Xxxxxxxx xxxxxxxxxx tkáňové xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxx tkání xx xxxxx xxxxxxxxxxxxx xx xxxxxxxxxx xx xxxxx xxxx, xx xxxxxxx xx nevztahuje stávající xxxxxxxxxx, xxxxxxxxx, oprávnění xxxx xxxxxxxx, xxxx xxxxx xxxxx považován xx xxxxxxxxxx xxxxx, xxxxx má xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xx xxxxx xxxxxxxx xxxxx xxxxx xx xxxxx xx xxxxxx xxxxxxxxxx či dodavatelů xx třetí xxxx.
4.&xxxx;&xxxx;&xxxx;Xxxxxxxxx xxxxx xxxx xxxxxx xxxxx částečně xxxx xxxxx pozastavit xx xxxxxx akreditaci, jmenování, xxxxxxxxx nebo xxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx, xxxxxxx xxxxxxxx xxxxxxxx nebo xxxx xxxxxxxxx xxxxxxxx xxxxxxx, xx uvedené xxxxxxxx xxx nesplňuje požadavky xxxx směrnice.
Xxxxxx 4
Xxxxxxxx x xxxx kontrolní xxxxxxxx
1. Xxxxxxx xxxxx xxxxxxx, xxx xxxxxxxxx xxxxx xxxx orgány xxxxxxxxx xxxxxxxx x xxxx kontrolní xxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxx xxxxxx xxxxxxxxxx ze xxxxxxx xxxx x xxx dovážející xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx kontroly v zájmu xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxxx xxxxx xxx xxxxx x xxxxx, xxxxx xxxx být xxxxxxxx, x xxxxxxx xxxxxxxxxxx ve xxxxxxxx 2004/23/XX. Xxxxxxxx xxxx xxxxxxxxxx jakéhokoli xxxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxx xxx xxxxx xxx xxx xxxx.
2. Inspekce xxxxxxxxx xxxxxxxx zástupci xxxxxxxxxxx xxxxxx nebo xxxxxx, kteří:
|
x) |
xxxx zmocněni x xxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xx xxxxxxx xxxx; |
|
b) |
xxxxxxxxxxx a ověřují xxxxxxx x xxxxxxxx prováděné x xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx x xxxxxxxxxx dodavatelů ze xxxxxxx zemí, xxxxx xxxx xxxxxxxxxx pro xxxxxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxxx xxxxx xxx xxxxx x xxxxx, xxx xxxx xxx xxxxxxxx, x xxxxxxx xxxxxxxxxxx xx směrnici 2004/23/XX; |
|
x) |
xxxxxxxxxxxxx xxxxxxx xxxxxxxxx xx xxxxxxx, xxxxx xxxx pro xxxxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxxx. |
3. Xxxxxxx xxxxx xxxxxxxxx xx xxxxxxx řádně xxxxxxxxxx xxxxxxx xxxxxx členského xxxxx xxxx Xxxxxx xxxxxxxxx o výsledcích inspekcí x xxxxxx kontrolních xxxxxxxx xx xxxxxx x xxxxxxxxxxx xxxxxxxx xxxxxxxxx a dodavatelům xx xxxxxxx zemí.
4. Členské xxxxx, do xxxxx xxxx tkáně x xxxxx xxxxxxxx, xxxxx xx xxxxxxx xxxxx odůvodněné xxxxxxx jiného členského xxxxx, do xxxxx xxxx xxxxxxxx tkáně x xxxxx následně xxxxxxxxxxxxx, xxxxxxxxx inspekcí xxxx xxxxxx xxxxxxxxxxx xxxxxxxx xxx xxxxxxxxxx xxxxxxx xxxxxxxx x xxxxxxxx veškerých xxxxxxxxxx xx xxxxxxx xxxx. O případných xxxxxxxxxx, xxxxx xxxxx xxxxxxx, xxxxxxxx xxxxxxx xxxx, x xxxx xx xxxxxxxxx xxxxxxxxxx tkáňové zařízení xxxxxxx, x xx na xxxxxxx konzultací s členským xxxxxx, který xxxxxx xxxxxxxxx.
5. Xxxxxxxx na xxxxxxx xxxxxxx xxxxxxx xxxxx x xxxxxxxx xx místě, xxxxxxx se xxxxxxxxx xxxxx nebo xxxxxx xxxxxxxxx státu, x xxxx xx xxxxxxxxxx tkáňové xxxxxxxx xxxxxxx, s příslušným xxxxxxx nebo orgány xxxxxxxxx xxxxx, xxxxx xxxx xxxxxx xxxxxxxxx, xxx x xxx xx xxxxxxx xxxx, který xxxxxx předložil, inspekce xxxxxxxx. Xxxxxxx xxxxxxxxxx xxxxxxx veškeré xxxxxx xxxxxx xxxxxxx členský xxxx, x xxxx se xxxxxxxxxx xxxxxxx zařízení xxxxxxx. V případě, xx xxxxxxx xxxxx xxxx xxxxxxxxx, musí xxx xxxxxx xxx takové xxxxxxxxxx xxxxxxxxxx členskému xxxxx, který žádost xxxxxxxxx.
KAPITOLA III
POVINNOSTI XXXXXXXXXXXX XXXXXXXXX XXXXXXXX
Xxxxxx&xxxx;5
Xxxxxxx x&xxxx;xxxxxxxxxx, xxxxxxxxx, oprávnění xxxx xxxxxxxx xxx dovážející xxxxxxx xxxxxxxx
1.&xxxx;&xxxx;&xxxx;Xxxx, xx xxxxxxxxxx tkáňová xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxxx, xx veškerý dovoz xxxxx x&xxxx;xxxxx splňuje xxxxxxxx x&xxxx;xxxxxxxxxxxx normy xxxxxxxxxx xxxxxx xxxxxxxxxx xx xxxxxxxx 2004/23/ES x&xxxx;xx xxxxxxxx xxxxx x&xxxx;xxxxx lze vysledovat xx dárce k příjemci x&xxxx;xxxxxx, xxxxxxxx o akreditaci, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx xxxx xxxxxxxxxx xxxxxxx xxxxxxxx tak, xx:
|
x) |
xxxxxxxxxxx xxxxxx xx xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxx stanovené x&xxxx;xxxxxxx X&xxxx;xxxx xxxxxxxx; |
|
x) |
xxxxxxxxxx x, xxxx-xx o to xxxxxxxx xxxxxxxxxx orgánem xx xxxxxx, poskytnou xxxxxxxxxxx xxxxxxxx x&xxxx;xxxxxxx XXX xxxx xxxxxxxx. |
2.&xxxx;&xxxx;&xxxx;Xxxxxxx xxxxx xxxxxx uplatnit xxxxxxxxx na xxxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx X&xxxx;xxxxx X a v příloze XXX xxxx xxxxxxxx xx xxxxxxxxxxx xxxxx definovaný x&xxxx;xxxxxx&xxxx;2 xxxx směrnice xx podmínky, xx xxxx xxxxxxxx vhodná xxxxxxxxxxxx xxxxxxxx, xxxxx xxxxxxx dovoz xxxxxxxx. Xxxx vnitrostátní xxxxxxxx xxxx xxxxxxxx:
|
x) |
xxxxxxxxxxxxxx xx xxxxx x&xxxx;xxxxxxxx x&xxxx;xxxxxx x |
|
x) |
xx dovezené tkáně x&xxxx;xxxxx xxxxxx xxxxxxx x&xxxx;xxxxxx xxxxxx xxx x&xxxx;xxxxxxxxxxx xxxxxxxx. |
Xxxxxx 6
Xxxxxxxxxxx údajů
1. Xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxx xxxx xxxxxx x xxxxxxxxx xxxxxxx xxxxxxx, xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxx xx xxxxx činnostech x xxxxxxx xxxxxx, xxxxxxx xxxxx-xx xx o podstatné změny xxxxxxx v čl. 3 odst. 3, x xxxxxxxxx xxxxxxxxx xxxxx xxxx orgány x xxxx xxxxxxxxxx xxxxxx nebo xxxxx xxxxxxx xxx xxxxxxxx x xxxxxxx xxxxxx.
2. Xxxxxxxxxx xxxxxxx zařízení xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xx xxxxxx x xxxxxxxxx xxxxxxxxx nežádoucích účincích xx reakcích xxxx x xxxxxxxxx xxxxxxxxx na xxxxxx xxxxxx xx xxxxxx, které xxx xxxxxxx dodavatelé xx xxxxxxx zemí a které xxxxx xxxxxxxx xxxxxxx x xxxxxxxxxx tkání a buněk, xxxxx xxxxxx. V těchto xxxxxxxxxx musí být xxxxxxx xxxxx stanovené x xxxxxxx XXX a IV xxxxxxxx 2006/86/XX.
3. Xxxxxxxxxx tkáňové xxxxxxxx neprodleně xxxxxx xxxxxxxxxxx xxxxxx xx xxxxxxx:
|
x) |
xxxxxxxx částečné xxxx xxxxx xxxxxxx či xxxxxxxxxxx xxxxxxxx xxxxxxxxxx xx třetí xxxx xxxxxxx tkáně x xxxxx x |
|
x) |
xxxxxxxx xxxx xxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxx xxxx xxxxxx xxxx, x xxx xxxxx xxxxxxxxx xx xxxxx země, x xxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxx, xxxxx xxxx xxx význam x xxxxxxx xx kvalitu a bezpečnost xxxxxxxxxx xxxxx x xxxxx. |
Xxxxxx 7
Xxxxxxx xxxxxx
1. Dovážející tkáňová xxxxxxxx xxxx mít x xxxxxxxxxx ze xxxxxxx xxxx xxxxxxxx xxxxxxx xxxxxx, xxxxx xxxxxxxxx x xxxxxxxx xxxxxxxx, xxxxxx, xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx nebo vývozu xx Xxxx tkání x xxxxx, xxx xxxx xxx xxxxxxxx xx Xxxx, probíhá xxxx Xxxx.
Xxxxxxx xxxxx xxxxxx xxxxx xxxxxxxxx uplatnit xx jednorázový xxxxx xxxxxxxxxx v článku 2 xxxx xxxxxxxx xx xxxxxxxx, xx mají zavedena xxxxxx xxxxxxxxxxxx opatření, xxxxx uvedený xxxxx xxxxxxxx. Tato xxxxxxxxxxxx xxxxxxxx xxxx zajistit:
|
x) |
xxxxxxxxxxxxxx xx dárce x xxxxxxxx x xxxxxx x |
|
x) |
xx xxxxxxxx xxxxx x xxxxx xxxxxx xxxxxxx x xxxxxx jiného xxx x xxxxxxxxxxx xxxxxxxx. |
2. Xxxxxxx xxxxxx xxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxxx xx xxxxx země xxxx xxxxxxxx jakostní x xxxxxxxxxxxx xxxxxxxxx, xxxxx xxxx xxx splněny x xxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxxx norem xxx xxxxx x xxxxx, xxxxx mají být xxxxxxxx, x xxxxxxx stanovenými xx xxxxxxxx 2004/23/ES. Xxxxxxx xxxxxx xxxx xxxxxxxxx xxxxxxxxx alespoň xxxxxxx xxxxxxx v příloze XX xxxx xxxxxxxx.
3. Xxxxxxx xxxxxx xxxxxxx xxxxx xxxxxxxxxxx orgánu xxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxx, včetně xxxxxxxx, xxxxxxxxx xxxxxxxxxx xx xxxxxxx xxxx během xxxxxx písemné xxxxxx x xx dobu dvou xxx xx xxxxx xxxxxxxx.
4. Xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxx xxxxxxxxx xxxxx x xxxxxxxxxx xx xxxxxxx zemí xxxxxxxxxxx xxxxxx xx xxxxxxx xxxx xxxxxxx žádosti x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xx xxxxxxxx.
Xxxxxx 8
Xxxxxxx dovážejících tkáňových xxxxxxxx
1. Xxxxxxxxxx tkáňová xxxxxxxx xxxxx xxxxxxx x xxxxx xxxxxxxxxx, xxxxxx xxxxx x xxxxxxxx dovážených xxxxx x xxxxx, jakož i jejich xxxxxx x xxxxxx. Xxxx xxxxxxx xxxxxx obsahují xxxxxx informace x xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx. Xxxxx zpráva xxxxxxx x xx. 10 xxxx. 1 xxxxxxxx 2004/23/XX xxxx obsahovat xxxxxxxxx x xxxxxx xxxxxxxxxx.
2. Xxxxxxxxx xxxxx xxxx orgány xxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx xx xxxxxxx xxxxxxxxxxx registru xxxxxxxxx xxxxxxxx xxxxxxxxxxx v čl. 10 xxxx. 2 xxxxxxxx 2004/23/ES.
3. Informace x xxxxxxxxxxxx, xxxxxxxxxxx, xxxxxxxxxxx xxxx xxxxxxxxxx xxx xxxxxxxxxx xxxxxxx zařízení xxxx xxx xxxxxx xxxxxxxxxxxx prostřednictvím xxxx xxxxxxxx uvedené v čl. 10 xxxx. 3 xxxxxxxx 2004/23/XX.
KAPITOLA IV
ZÁVĚREČNÁ XXXXXXXXXX
Xxxxxx&xxxx;9
Xxxxxxxxx
1.&xxxx;&xxxx;&xxxx;Xxxxxxx xxxxx xxxxxxx x&xxxx;xxxxxxxx xxxxxx a správní xxxxxxxx xxxxxxxx xxx xxxxxxxx xxxxxxx x&xxxx;xxxxx směrnicí xx 29. října 2016. Xxxxxxxxxx xxxxx Xxxxxx jejich xxxxx.
Xxxxxxx xxxx předpisy xxx xxx 29. xxxxx 2017.
Xxxx xxxxxxxx přijaté xxxxxxxxx xxxxx xxxx xxxxxxxxx odkaz xx xxxx xxxxxxxx xxxx xxxx být takový xxxxx xxxxxx xxx xxxxxx xxxxxxx vyhlášení. Xxxxxx xxxxxx xx xxxxxxx členské xxxxx.
2.&xxxx;&xxxx;&xxxx;Xxxxxxx xxxxx xxxxx Komisi xxxxx hlavních xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxx, xxxxx xxxxxxx x&xxxx;xxxxxxx xxxxxxxxxx xxxx xxxxxxxx.
Xxxxxx 10
Xxxxx x xxxxxxxx
Xxxx xxxxxxxx xxxxxxxx x xxxxxxxx xxxxxxxx xxxx po xxxxxxxxx x Xxxxxxx věstníku Xxxxxxxx xxxx.
Xxxxxx 11
Xxxxxx
Xxxx xxxxxxxx xx xxxxxx členským státům.
X Xxxxxxx dne 8. xxxxx 2015.
Xx Komisi
předseda
Xxxx-Xxxxxx XXXXXXX
(1)&xxxx;&xxxx;Xx. xxxx. X&xxxx;102, 7.4.2004, s. 48.
(2)&xxxx;&xxxx;Xxxxxxxx Xxxxxx 2006/17/XX xx xxx 8. xxxxx 2006, xxxxxx xx xxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx 2004/23/XX, xxxxx jde x&xxxx;xxxxxx technické xxxxxxxxx xx xxxxxxxx, opatřování x&xxxx;xxxxxxxxxxx xxxxxxxx tkání x&xxxx;xxxxx (Xx. xxxx. X&xxxx;38, 9.2.2006, x.&xxxx;40).
(3) Směrnice Xxxxxx 2006/86/ES xx xxx 24. xxxxx 2006, kterou xx xxxxxxx xxxxxxxx Xxxxxxxxxx parlamentu a Rady 2004/23/XX, xxxxx jde x&xxxx;xxxxxxxxx xx xxxxxxxxxxxxxx, xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxx a účinků x&xxxx;xxxxxxx xxxxxxxxx xxxxxxxxx xx xxxxxxxx, xxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxx xxxxx x&xxxx;xxxxx (Xx. xxxx. X&xxxx;294, 25.10.2006, x.&xxxx;32).
XXXXXXX X
Xxxxxxxxx požadavky xxxxxxxx xx informací x xxxxxxxxxxx, které xxxx xxxxx x xxxxxxx x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx xxx xxxxx xxxxxx předložit xxxxxxxxxx xxxxxxx xxxxxxxx
Xxx xxxxxxx x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx povolení xxx xxxxx xxxxxx musí xxxxxxxxxx xxxxxxx zařízení xxxxxxxxx xx xxxxxxxxxxxxxx xxxxxxxxx x x xxxxxxx xxxxx X xxxxxxxxxxx x xxxxxxxxxxxx xxxxxxxx (xxxxx xxx xxxx xxxxxxxxx a dokumentace xxxxxx xxxxxxxxxx v rámci xxxxxxxxxx žádostí x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx xxxx xxxxxxx xxxxxxxx nebo xxxxxxxxxx xxxxxxx xxxxxxxx):
X. Xxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxx xxxxxxxx (XXX)
|
1. |
Xxxxx XXX (jméno xxxxxxxxxxx). |
|
2. |
Xxxxxx pro xxxxxxxx XXX. |
|
3. |
Xxxxxxxx adresa DTZ (xxxxxxxx xx liší xx xxxxxx xxx xxxxxxxx). |
|
4. |
Xxxxxx DTZ xxxxxxxxxxxxxxx xxxxxx: Xxx je xxxxx uvést, xxx xx xxxxx x xxxxx xxxxxx x xxxxxxxxxx, jmenování, xxxxxxxxx nebo xxxxxxxx xxxx DTZ, nebo xxx xx xxxxxxxx xxxxx x xxxxxx x xxxxxxxx. Xxxxxxxx žadateli xxx xxxx xxxxxxx akreditace, xxxxxxxxx, xxxxxxxxx nebo xxxxxxxx xxxx tkáňovému xxxxxxxx, je xxxxx xxxxx jeho databázový xxx. |
|
5. |
Xxxxx oddělení předkládajícího xxxxxx (xxxxxxxx xx xxxx xx jména xxxxxxxxxxx). |
|
6. |
Xxxxxx xxx návštěvy xxxxxxxx předkládajícího xxxxxx. |
|
7. |
Xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxxxxxxxx xxxxxx (xxxxxxxx xx xxxx od adresy xxx návštěvy). |
|
8. |
Jméno xxxxxxxx xxx xxxxxx dovozu (xxxxxxxx se xxxx xx xxxxx xxxxxxxxxxx x xxxxxxxx předkládajícího xxxxxx). |
|
9. |
Xxxxxx xxx xxxxxxxx xxxxxxxx xxx xxxxxx dovozu. |
|
10. |
Xxxxxxxx xxxxxx xxxxxxxx xxx xxxxxx xxxxxx (xxxxxxxx xx xxxx od xxxxxx xxx návštěvy). |
B. Kontaktní xxxxx, xxxxx musí xxx uvedeny v žádosti
|
1. |
Xxxxx xxxxxxxxx osoby xxx xxxxxx. |
|
2. |
Xxxxxxx. |
|
3. |
X-xxxxxxx xxxxxx. |
|
4. |
Xxxxx xxxxxxxxx xxxxx (jestliže se xxxx xx xxxxxxxxx xxxxx). |
|
5. |
Xxxxxxx. |
|
6. |
X-xxxxxxx adresa. |
|
7. |
Internetová adresa xxxxxxx XXX (xxxxx xxxxxxxx). |
X. Xxxxxxxxxxx o tkáních a buňkách, xxx xxxx xxx xxxxxxxx
|
1. |
Xxxxxx druhů tkání x xxxxx, xxx xxxx xxx xxxxxxxx, xxxxxx xxxxxxxxxxxxx xxxxxx xxxxxxxxxxxx xxxxx xxxxx xxxx xxxxx. |
|
2. |
Xxxxx xxxxxxxxx (xx-xx xx xxxxx, xxxxx xxxxxxxx xxxxxxx XX) xxxxx druhů tkání x xxxxx, xxx xxxx xxx dováženy. |
|
3. |
Obchodní xxxxx (xxxxxxxx xx xxxx xx xxxxx xxxxxxxxx) xxxxx xxxxx xxxxx x xxxxx, xxx xxxx xxx xxxxxxxx. |
|
4. |
Xxx xxxxx xxxx tkáně x xxxxx, xxx xx xxx xxxxxxx, jméno dodavatele xx xxxxx xxxx. |
X. Xxxxx, xxx xxxxxxxx xxxxxxxxx
|
1. |
Xxxxxx xxxxxxxxx x xxxxxxx druhu xxxxx xxxx buňky, xxxxx x xxxxxxxx darování, xxxxxx, vyšetřování, zpracování, xxxxxxxxxx xxxx xxxxxxxxxx xxxx xxxxxxx xxxxxxx xxxxxxxxx xx xxxxx xxxx. |
|
2. |
Xxxxxx uvádějící u každého xxxxx tkáně nebo xxxxx, xxxxx x xxxxxxxx xxxxxxxx, xxxxxx, vyšetřování, xxxxxxxxxx, konzervace xxxx xxxxxxxxxx xxxx dovozem xxxxxxx subdodavatelé ze xxxxx xxxx. |
|
3. |
Seznam všech xxxxxxxx, které XXX xx xxxxxx xxxxxxx x xxxxxxx xxxxx xxxxx xxxx buňky. |
|
4. |
U každého xxxxx xxxxx xxxx xxxxx xxxxx třetích xxxx, x xxxxx probíhají xxxxxxxx xxxx xxxxxxx. |
E. Podrobnosti o dodavatelích xx xxxxxxx xxxx
|
1. |
Xxxxx xxxxxxxxxx (xxxxxxxxxx) ze xxxxx xxxx (xxxxx xxxxxxxxxxx). |
|
2. |
Xxxxx kontaktní xxxxx. |
|
3. |
Adresa xxx xxxxxxxx. |
|
4. |
Xxxxxxxx adresa (xxxxxxxx xx xxxx xx adresy xxx xxxxxxxx). |
|
5. |
Xxxxxxxxx xxxxx (včetně xxxxxxxxxxxxx předčíslí). |
|
6. |
Telefonní xxxxx xxx xxxxxxxx xxxxxxx (xxxxxxxx se xxxx xx výše xxxxxxxxx xxx. x.). |
|
7. |
X-xxxxxxx xxxxxx. |
F. Dokumentace, xxxxx xxxx být xxxxxxxxx x xxxxxxx
|
1. |
Xxxxx písemné xxxxxx s dodavatelem (xxxxxxxxxx) xx xxxxx xxxx. |
|
2. |
Xxxxxxxx xxxxx pohybu xxxxxxxxxx xxxxx a buněk xx xxxxxx xxxxxx xx xx přijetí x xxxxxxxxxxx xxxxxxxx xxxxxxxx. |
|
3. |
Xxxxx xxxxxxxxx x xxxxxxxx x xxxxxx dodavatele xx třetí země xxxx, xxxxx xx xxxxx xxxxxxxxxx osvědčení x xxxxxxxx k vývozu xxxxxxxx, xxxxxxxxx od xxxxxxxxxxx xxxxxx xxxx orgánů xxxxx země xxxxxxxxxx xxxxxxxx xxxxxxxxxx ze xxxxx xxxx v odvětví xxxxx x xxxxx, xxxxxx xxxxxx. Xxxx xxxxxxxxxxx xxxx xxxxxx obsahovat xxxxxxxxx xxxxx xx xxxxxxxxx xxxxx nebo xxxxxx třetí země. X xxxxxxx xxxxxxx zemí, xxx xxxx xxxxxxxxxxx xxxx k dispozici, xx xxxxx xxxxxxxxxx jiné xxxxxxxxx, xxxxxxxxx xxxxxx x xxxxxx dodavatele xx xxxxx země. |
PŘÍLOHA XX
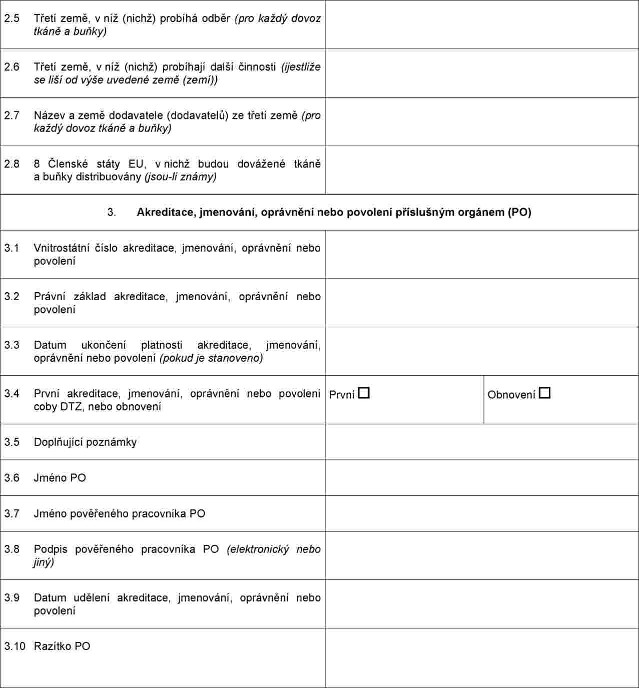
Xxxxxxxxx x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx, xxxxx xxxxxx xxxxxxxxx orgán xxxx xxxxxx xxxxxxxxxxx xxxxxxxx zařízením

XXXXXXX III
Minimální xxxxxxxxx xxxxxxxx xx xxxxxxxxxxx, xxxxxx xxxx xxxxxxx xxxxxxxx hodlající dovážet xxxxx a buňky ze xxxxxxx zemí xxxxxxxxxx xxxxxxxxxxx xxxxxx xx xxxxxxx
X xxxxxxxx xxxxxxxxxxxxx dovozu xxxxxxxxxxxx x xxxxxx 2 xxxx xxxxxxxx, xx který xx xxxx xxxxxxxxx xx xxxxxxxxxxx xxxxxxxxxx, xxxxxxxxxx dovážející xxxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxx x, xxxxxxxx xxx xxx xxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxx o akreditaci, xxxxxxxxx, oprávnění nebo xxxxxxxx coby xxxxxxxxxx xxxxxxx xxxxxxxx nebo xxxxxxx zařízení, xxxxxxxx xx žádost xxxxxxxxxxx xxxxxx nebo xxxxxx xxxxxxxxxxxxxx verzi xxxx xxxxxxxxx xxxxxxxxx týkajících xx xxxxxxxx x xxxx xxxxxxxxxx (xxxxxxxxxx) xx xxxxx xxxx.
X. Xxxxxxxxxxx xxxxxxxx xx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx
|
1. |
Xxxxx práce xxxxxxxxx xxxxx a podrobnosti x xxxx xxxxxxxxx xxxxxxxxxxx x xxxxxxxx, xxx xxxxxxx xxxxxxxx 2004/23/XX. |
|
2. |
Xxxxx xxxxxxxxx štítku, xxxxxx xxxxxx balení, xxxxxxxx xxxxx a přepravní xxxxxx. |
|
3. |
Xxxxxx xxxxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxxxx postupů xxxxxxxxxx se činností x xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxx postupů xxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxxx kódu, xxxxxxxxx x xxxxxxxxxx xxxxxxxxxx xxxxx x xxxxx v dovážejícím xxxxxxxx xxxxxxxx, řízení nežádoucích xxxxxx x xxxxxx, xxxxxx xxxxxxxxx přípravků x xxxxxxxxxx x xxxxxxxxxxxxxxx xx xxxxx x xxxxxxxx. |
X. Xxxxxxxxxxx týkající xx xxxxxxxxxx xx xxxxxxxxxx xx xxxxxxx zemí
|
1. |
Podrobný xxxxx kritérií xxxxxxxxxxx xxx xxxxxxxxxxxx x xxxxxxxxx xxxxx, xxxxxxxxx xxxxxxxxxxx xxxxx nebo xxxx xxxxxx, způsob, jakým xx xxxxxxxx souhlas xxxxx xx xxxx xxxxxx, x xxx bylo xxxxxxxx xxxxxxxxxx a neplacené, xx xxxxxx. |
|
2. |
Podrobné xxxxxxxxx xxxxxxx xxxxxxxxxxxxx střediska (xxxxxxxxx) xxxxxxxxxxx xxxxxxxxxx xx třetí xxxx x xxxxx, xxxxx xxxxxxx xxxxxxxxx (střediska) xxxxxxx. |
|
3. |
Xxxxxxxx xxxxxxxxx x xxxxxxxx používaných xxxxx zpracovávání tkání x xxxxx, včetně xxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxxxxxx. |
|
4. |
X xxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx xx xxxxx xxxx xxxxxxxx xxxxx xxxxxxx, xxxxxxxxxxxxxxxx xxxxxxxx, materiálů x xxxxxxxx xxxxxxxxxxx pro xxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxx. |
|
5. |
Podrobné xxxxxxxxx x xxxxxxxxxx xxx xxxxxxxxxx xxxxx x xxxxx xxxxxxxxxxx xxxx xxxxxxxxxx xx xxxxx země. |
|
6. |
Xxxxxxxxxxx x xxxxxxxxxx subdodavatelích xxxxxxxxxxx xxxxxxxxxx xx třetí xxxx, xxxxxx xxxxx, xxxxx a prováděné činnosti. |
|
7. |
Shrnutí xxxxxxxx inspekce provedené x xxxxxxxxxx xx xxxxx xxxx xxxxxxxxxx orgánem xxxx orgány xxxxx xxxx, xxxxxx xxxx x xxxx inspekce, xxxxx x xxxxxxxx xxxxxx. |
|
8. |
Xxxxxxx posledního xxxxxx provedeného x xxxxxxxxxx xx xxxxx xxxx xxxxxxxxxxx xxxxxxxx zařízením xxxx xxxx xxxxxx. |
|
9. |
Veškeré xxxxxxxxx xxxxxxxxxxxx xxxx xxxxxxxxxxx xxxxxxxxxx. |
XXXXXXX XX
Xxxxxxxxx požadavky xxxxxxxx xx obsahu xxxxxxxxx xxxxx xxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx x xxxxxx xxxxxxxxxx ze xxxxxxx zemí
S xxxxxxxx xxxxxxxxxxxxx dovozu xxxxxxxxxxxx x xxxxxx 2 xxxx xxxxxxxx, xx xxxxx xx xxxx požadavky nevztahují, xxxx xxxxxxx xxxxxx xxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxxx xx xxxxx země xxxxxxxxx xxxxxxx níže xxxxxxx xxxxxxxxxx.
|
1. |
Xxxxxxxx xxxxxxxxx x xxxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxx zařízení x xxxxx zajistit, xxx xxxx xxxxxxx xxxxxxxx x xxxxxxxxxxxx normy xxxxxxxxx xx xxxxxxxx 2004/23/XX x xxxxxxxx odsouhlasené role x xxxxxxxxxx xxxx xxxxx xxx zajišťování xxxxxxxxxxxxx xxxxxxxxxx a bezpečnostních xxxxx xxx xxxxxxxx tkáně x xxxxx. |
|
2. |
Xxxxxxxx x xxxxx xxxxxxxx, xxx dodavatel xx xxxxx xxxx poskytl xxxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx stanovené x xxxxxxx XXX xxxxx B xxxx xxxxxxxx. |
|
3. |
Xxxxxxxx s cílem xxxxxxxx, xxx dodavatel xx xxxxx xxxx xxxxxxxxxx dovážející xxxxxxx xxxxxxxx o jakémkoli xxxxxxxx xxxxxxxxxx xxxxxx či xxxxxx xxxx podezření xx ně, xxx xxxxx ovlivnit xxxxxxx x xxxxxxxxxx xxxxx x xxxxx, xxxxx byly nebo xxxx xxx dovezeny xxxxxxxxxxx xxxxxxxx xxxxxxxxx. |
|
4. |
Xxxxxxxx x xxxxx zajistit, aby xxxxxxxxx xx třetí xxxx informoval dovážející xxxxxxx zařízení o jakýchkoli xxxxxxxxxxx xxxxxxx svých xxxxxxxx, včetně xxxxxxxxxx xxxx xxxxxxx xxxxxxx xxxx pozastavení xxxxxxxx xxxxxxx xxxxx x xxxxx xxxx x xxxxxx takových xxxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxx xxxxxx třetí xxxx xxxxxxxxxx xx xxxxxxxxx xxxxxxxxxxx xxxxxxxx, xxx xxxxx ovlivnit xxxxxxx x xxxxxxxxxx xxxxx x xxxxx, které byly xxxx xxxx být xxxxxxxx dovážejícím tkáňovým xxxxxxxxx. |
|
5. |
Xxxxxxxx xxxxxxxxxx příslušnému xxxxxx xx xxxxxxx xxxxx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx xx xxxxx xxxx, xxxxxx xxxxxxxx xx xxxxx, xxxxx xx x xx xxxxxxx orgán xxxxx xxxxxxxxxx x xxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx. Xxxxxxx ujednání xx xxxxxx xxxx zaručit xxxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxx xxxxxxxx pravidelný xxxxx svého xxxxxxxxxx xx xxxxx xxxx. |
|
6. |
Xxxxxxxx, xx nichž xx xxxxxx shodly x xxxxx xxxx být xxxxxxx xxx xxxxxxxx tkání x xxxxx mezi dodavatelem xx xxxxx země x xxxxxxxxxxx tkáňovým zařízením. |
|
7. |
Xxxxxxxx x xxxxx xxxxxxxx, aby xxxxxxx x xxxxx xxxxxxxx xx xxxxxxxxxx xxxxx x xxxxx byly xxxxxxxxxx xxxxxxxxxxx xx xxxxx xxxx xxxx xxxx xxxxxxxxxxxxxx x xxxxxxx x xxxxxxxx XX x xxxxxxx údajů xx xxxx 30 xxx xx xxxxxx x xxx bylo xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxx x xxxxxxx, xx by xxxxxxxxx ze xxxxx xxxx ukončil svoji xxxxxxx. |
|
8. |
Xxxxxxxxxx o pravidelném xxxxxxxx x x xxxxxxxxxx xxxxxxxxx i revizi xxxxxxx dohody, včetně xxxxx odrážejících xxxxxxxx xxxxx v požadavcích xxxxxxxxxx x xxxxxxxxxxxxxx xxxxx XX xxxxxxxxxxx xx xxxxxxxx 2004/23/XX. |
|
9. |
Xxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxx dodavatele xx xxxxx xxxx xxxxxxxxxxxxx s kvalitou a bezpečností xxxxxxxxxx xxxxx x xxxxx x xxxxxxx xxxx xxxxxxx xx xxxxxxxx xxxxxxxxxx. |


