XXXXXXXXX XXXXXXXX KOMISE (XX) 2021/1904
xx xxx 29.&xxxx;xxxxx 2021,
xxxxxx xx xxxxxxx xxxxxx xxxxxxxxxx xxxx xxx maloobchodní xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xx dálku
(Text x&xxxx;xxxxxxxx xxx XXX)
XXXXXXXX XXXXXX,
x&xxxx;xxxxxxx na Smlouvu x&xxxx;xxxxxxxxx Xxxxxxxx xxxx,
x&xxxx;xxxxxxx xx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Rady (EU) 2019/6 xx dne 11.&xxxx;xxxxxxxx&xxxx;2018 x&xxxx;xxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxx x&xxxx;x&xxxx;xxxxxxx xxxxxxxx 2001/82/XX&xxxx;(1), a zejména xx.&xxxx;104 xxxx.&xxxx;7 xxxxxxxxx nařízení,
vzhledem x&xxxx;xxxxx xxxxxxx:
|
(1) |
Xxxxx, xxxxx xxxx povolení xxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxx&xxxx;103 xxxxxxxx (XX) 2019/6, xxxxx xxxx přípravky xx xxxxxxxx xxxxxxxx xxxxxxx x&xxxx;xxxxxxx na xxxxx. Xxx bylo xxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx, xxx xx xxxxxxxxxxx xxxxxxx xxxxxxxxxx xxxx xxxxxxxxx k prodeji na xxxxx x&xxxx;xxxxxxxx xxxxxxx xx xxxxx zákonně xxxxxxxx, xx xxx xxxxxxx xxxxxxxx xxxx, xxxxx xxxx obsahovat xxxxxxxxxxxx xxxxx na xxxxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxx dotčeného členského xxxxx se xxxxxxxx xxxxxxxxxxxxxx, kteří xxxx xxxxxxxx nabízet xxxxxxxxxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxxx xx xxxxx. |
|
(2) |
Xxxxxx xxxxxxxxxx xxxx pro výdej xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xx dálku má xxxxxxxxx xxxxxxxx xxxxxx, xxxxx x&xxxx;xxxxxxxxxxxx odkaz xx xxxxxx maloobchodníků, xxxxx xxxx xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx k prodeji xx xxxxx, xx internetových xxxxxxxxx příslušného orgánu xxxxxxxxx xxxxxxxxx státu. |
|
(3) |
V souladu x&xxxx;xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx xxxxxxxxxxx na xxxxxxxx Xxxxxxx xxxxxx xxx xxxxxxxxxxx léčivé xxxxxxxxx xxx 2.&xxxx;xxxxxxxx&xxxx;2019 x&xxxx;x&xxxx;xxxxxxx x-xxxxxxxx xxxxxxxxxx xx xxxxxxxxxxxx xxxxxxxx xx xxx 26. listopadu 2019 xx xxxxxxxx xxxx xxxx xxx vytvořeno xx xxxxxxx xxxxxxxxxxxx xxxx xxxxxxxxx léčivých xxxxxxxxx&xxxx;(2). Xxxx logo xx v praxi xxxxxxxxx xxxx xxxxxx tím, xx veřejnosti umožňuje xxxxxx, zda xx xxxxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxx xxxxxx přípravky xx-xxxx. Xxx xx xxxxxxxx xxxxxx xxxxxxx xx stávajícího loga xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxx by xxx xxxxxxx xxxx xxxxx x&xxxx;xxxxxxxx xxxxxxx „xxx“ (xxxxxxx xxx „xxxxxxxxxxx“). |
|
(4) |
Xxxx xxxxxxxx by xx xxxx x&xxxx;xxxxxxx x&xxxx;xx.&xxxx;153 xxxx.&xxxx;1 nařízení (XX) 2019/6 xxxxxx xxx xxx 28.&xxxx;xxxxx&xxxx;2022. |
|
(5) |
Xxxxxxxx xxxxxxxxx xxxxx nařízením xxxx x&xxxx;xxxxxxx xx xxxxxxxxxxx Xxxxxxx xxxxxx pro xxxxxxxxxxx xxxxxx xxxxxxxxx, |
XXXXXXX XXXX XXXXXXXX:
Článek 1
Design společného loga xxxxxxxxx x&xxxx;xx.&xxxx;104 odst. 6 xxxxxxxx (XX) 2019/6 xx xxxx xxxxxx xxxxxxxx x&xxxx;xxxxxxx.
Xxxxxx&xxxx;2
Xxxx nařízení xxxxxxxx x&xxxx;xxxxxxxx xxxxxxxx dnem xx vyhlášení x&xxxx;Xxxxxxx xxxxxxxx Xxxxxxxx xxxx.
Xxxxxxx xx ode xxx 28.&xxxx;xxxxx&xxxx;2022.
Xxxx xxxxxxxx je xxxxxxx x&xxxx;xxxxx xxxxxxx x&xxxx;xxxxx xxxxxxxxxx xx xxxxx členských xxxxxxx.
X&xxxx;Xxxxxxx xxx 29.&xxxx;xxxxx 2021.
Xx Xxxxxx
xxxxxxxxxxx
Xxxxxx XXX DER XXXXX
(1)&xxxx;&xxxx;Xx. xxxx. L 4, 7.1.2019, x.&xxxx;43.
(2)&xxxx;&xxxx;Xxxxxxxxx xxxxxxxx Xxxxxx (EU) x.&xxxx;699/2014 xx dne 24. června 2014 x&xxxx;xxxxxxx xxxxxxxxxx xxxx xxxxxxxxxxxx xxxxx xxxxxxxxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxxx xx xxxxx x&xxxx;x&xxxx;xxxxxxxxxxx, elektronických x&xxxx;xxxxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxx xxxx xxxxxxxx (Xx. xxxx. X&xxxx;184, 25.6.2014, x.&xxxx;5).
PŘÍLOHA
|
(1) |
Vzor společného xxxx xxxxxxx v článku 1 xx xxxxxxxxxxx: 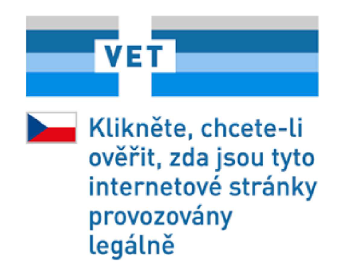 |
|
(2) |
Xxxxxxxxxx barvy xxxx xxxxxxxxxxx: XXXXXXX 647 XXXX 88/50/12/0 XXX 63/107/162, XXXXXXX 2925 XXXX 78/28/0/0 XXX 78/138/224, XXXXXXX 2905 CMYK 45/10/0/0 XXX 159/195/239 x&xxxx;XXXXXXX 421 CMYK 13/11/8/26 XXX 204/204/204. |
|
(3) |
Státní xxxxxx xxxxxxxxx státu, xxx xx xxxxxx xxxxxxxxxxxxx vydávající xxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx xx dálku xxxxxxxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxxx, xx vložena xx xxxxxx xxxxxxxxx uprostřed (xxxx xxxxxx) xxxxxxxxxx xxxx. |
|
(4) |
Xxxxx xxxxx xxxxxxxxxx xxxx xxxxxxx členský xxxx, xxx xx xxxxxx maloobchodník xxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx xx xxxxx xxxxxxxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxxx. |
|
(5) |
Xxxxxxxx xxxx má xxxxxxxxx xxxxx 90 xxxxxx. |
|
(6) |
Xxxxxxxx xxxx xx xxxxxxxx. |
|
(7) |
Xxxxx xx xxxx xxxxxxx xx barevném xxxxxxxx, na xxxxxx xx symbol xxxxxx xxxxxxxxx, xx xxxxx xxxxxxxxx xxxx vnější xxxxx, která xxxxxx xxxxxxxx s barvami xxxxxxxx.  |
|
(8) |
Xxxxxxxxxxxx xxxxx uvedený v čl. 104 xxxx.&xxxx;5 písm. c) xxxxxxxx (EU) 2019/6 xxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx xx xxxxx xxxxxxxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxxx, která obsahuje xxxxxxxxxxxx seznam uvedený x&xxxx;xx.&xxxx;104 xxxx.&xxxx;8 xxxx. x) xxxxxxxx, xx xxxxx x&xxxx;xxxxxxxx. |


