XXXX&Xxxxxx;XĚX&Xxxxxx; XXŘ&Xxxxxx;XXX&Xxxxxx; KOMISE (XX) 2016/561
xx xxx 11. dubna 2016,
kterým xx xěx&xxxxxx; příloha XX prováděcího xxř&xxxxxx;xxx&xxxxxx; (XX) č. 577/2013, xxxxx xxx x&xxxx;xxxxxx&xxxxxx; veterinární xxxěxčxx&xxxxxx; pro xxxxxxxxx&xxxxxx; xřxxxxx xxů, koček xxxx xxxxxx x&xxxx;&xxxxxx;xxx&xxxxxx; xxxx xřxx&xxxxxx; země xx čxxxxx&xxxxxx;xx xx&xxxxxx;xx
(Text x významem xxx XXX)
XXXXXXX&Xxxxxx; KOMISE,
s ohledem xx Xxxxxxx x&xxxx;xxxxxx&xxxxxx;x&xxxxxx; Evropské xxxx,
x&xxxx;xxxxxxx xx xxř&xxxxxx;xxx&xxxxxx; Xxxxxxx&xxxxxx;xx parlamentu x&xxxx;Xxxx (XX) č.&xxxx;576/2013 xx xxx 12.&xxxx;čxxxxx&xxxx;2013 x&xxxx;xxxxxxxxx&xxxxxx;xx xřxxxxxxx zvířat x&xxxx;x&xxxxxx;xxxx&xxxxxx;x xxxxx x&xxxx;x&xxxx;xxx&xxxxxx;xx&xxxxxx; nařízení (XX) č.&xxxx;998/2003 (1), x&xxxx;xxxx&xxxxxx;xx xx čx.&xxxx;25 xxxx.&xxxx;2 xxxxxx&xxxxxx;xx nařízení,
xxxxxxxx x&xxxx;xěxxx xůxxxůx:
|
(1) |
Xxř&xxxxxx;xxx&xxxxxx; (EU) č. 576/2013 xxxxxx&xxxxxx;, že xxx, xxčxx a fretky, xxxř&xxxxxx; xxxx přemísťováni do čxxxxx&xxxxxx;xx xx&xxxxxx;xx z určitého &xxxxxx;xxx&xxxxxx; xxxx xřxx&xxxxxx; xxxě x&xxxx;x&xxxxxx;xxx xxxxxxxxx&xxxxxx;xx xřxxxxx, xxx&xxxxxx; x&xxxxxx;x xxxx&xxxxxx;xxxx identifikačním xxxxxxxx xx formátu xxxxxxx&xxxxxx;xx&xxxxxx;xx xxxěxčxx&xxxxxx;. Část 1 xř&xxxxxx;xxxx IV xxxx&xxxxxx;xěx&xxxxxx;xx xxř&xxxxxx;xxx&xxxxxx; Xxxxxx (XX) č.&xxxx;577/2013 (2) stanoví vzorové xxxxxxx&xxxxxx;xx&xxxxxx; xxxěxčxx&xxxxxx;. |
|
(2) |
Xx xxxxxx&xxxxxx;x xxxxxxx&xxxxxx;xx&xxxxxx;x xxxěxčxx&xxxxxx; xx xxxňxxx xxžxxxxxx &xxxxxx;xxě&xxxxxx;x&xxxxxx;xx xxxxx xxxxxxx&xxxxxx; xxxxxěxx xx xčxxx&xxxxxx;x&xxxxxx; xxxxx xxxxxxxxě, který xx xěx x&xxxxxx;x xxxxxxxx x&xxxx;xxxxxxx s přílohou XX xxř&xxxxxx;xxx&xxxxxx; (XX) č.&xxxx;576/2013 xx xxxxx&xxxxxx;xx xxxx xxxxxxx&xxxxxx;xx xxůx, kočkám x&xxxx;xxxxx&xxxxxx;x xxxx&xxxxxx;xxx&xxxxxx;x&xxxxxx;x x&xxxx;&xxxxxx;xxx&xxxxxx; xxxx xřxx&xxxxxx; země xxx&xxxxxx;xx xxž xxxxxx&xxxxxx;xx xx xxxxxxx x&xxxx;xř&xxxxxx;xxxx XX xxxx&xxxxxx;xěx&xxxxxx;xx xxř&xxxxxx;xxx&xxxxxx; Xxxxxx (XX) č. 577/2013 xxxx jejichž xxxxxxx xx xřxx xxxx &xxxxxx;xxx&xxxxxx; xxxx xřxx&xxxxxx; xxxx xx&xxxxxx;xxx&xxxxxx;x. |
|
(3) |
Xx xxxxxxxx&xxxxxx;xx xř&xxxxxx;xxxxxx xxxěx&xxxxxx;x&xxxxxx; xxxxxxxxxx&xxxxxx;xx xxxxxxxxů x&xxxx;x&xxxxxx;xxxxx&xxxxxx;xx sérologického xxxxx xxxxxxxx&xxxxxx;x&xxxxxx;xx xxxx xxxxxx&xxxxxx;xxx xxxxx xxxxxxxxě xx xxxxx&xxxxxx; xřxxxxxxxxx &xxxxxx;řxxx&xxxxxx;xůx xxx&xxxxxx;xxx&xxxxxx;x&xxxxxx;x xxxěxčxx&xxxxxx; xx &xxxxxx;xxx&xxxxxx;xx xxxx xx třetích xxx&xxxxxx;xx, žx uspokojivé výsledky xxxxxx xxxxx xx xxxěxx x&xxxxxx;x xxxxxxxxx, xxxxx xxxxxx xxěřxxx xxxxxxx xxxxxxxxxx&xxxxxx;xx xxxxxxxxx. Xx x&xxxxxx;xxx &xxxxxx;čxxxx xx xěxx být xx xxxxxxx&xxxxxx;xx&xxxxxx;xx xxxěxčxx&xxxxxx; xxxxxxxx xxx&xxxxxx;&xxxxxx;xx&xxxxxx; pokyny. |
|
(4) |
&Xxxxxx;řxxx&xxxxxx;xx xxx&xxxxxx;xxx&xxxxxx;x&xxxxxx; xxxěxčxx&xxxxxx; xx xřxx&xxxxxx;xx xxx&xxxxxx;xx xxxxě xxxx xxxxxě vykládají xxxxžxx xxx xxxxx xxxxčxx&xxxxxx;x&xxxxxx; xxů, xxčxx xxxx xxxxxx x&xxxx;č&xxxxxx;xxx X&xxxx;xxxxxxx&xxxxxx;xx&xxxxxx;xx xxxěxčxx&xxxxxx;, xxž xůxxx&xxxxxx; xxxxx&xxxxxx;xx xřx xxxxxxx&xxxxxx;xx xx xxěx&xxxxxx;&xxxxxx;xx xxxxxx&xxxxxx;xx Unie. Xxx xx zabránilo xxx&xxxxxx;xxxxxx xxxxxxxxxěx&xxxxxx;, xěxx by x&xxxxxx;x tato xxxxžxx xxxxxxxěxx x&xxxx;č&xxxxxx;xxx X&xxxx;xxxxxxx&xxxxxx;xx&xxxxxx;xx xxxěxčxx&xxxxxx;, xxxx&xxxxxx; popisuje xx&xxxxxx;řxxx, x&xxxx;xxxžxxx xx č&xxxxxx;xxx II xxxxxx xxxěxčxx&xxxxxx;, xxž se x&xxxxxx;x&xxxxxx; xxxěxčxx&xxxxxx;x&xxxxxx;. Xx č&xxxxxx;xxx XX by xxxxěž xěxx být xxxxxxxx xxx&xxxxxx;&xxxxxx;xx&xxxxxx; xxxx&xxxxxx;xxx x&xxxx;xxxxxx týkající xx xxěřxx&xxxxxx;x&xxxxxx; xxxxčxx&xxxxxx;. |
|
(5) |
Xř&xxxxxx;xxxx XX xxxx&xxxxxx;xěx&xxxxxx;xx nařízení (XX) č.&xxxx;577/2013 xx xxxxx xěxx x&xxxxxx;x odpovídajícím xxůxxxxx xxěxěxx. |
|
(6) |
Aby se xxxxxxxx xxx&xxxxxx;xxxxxx xxxx&xxxxxx;xx&xxxxxx; xřxxxxů, xěxx xx x&xxxxxx;x xx xřxxxxxx&xxxxxx; xxxxx&xxxxxx; xxxxxxxx xxxž&xxxxxx;x&xxxxxx;x&xxxxxx; xxxxxxx&xxxxxx;xx&xxxxxx;xx xxxěxčxx&xxxxxx; xxxxx&xxxxxx;xx x&xxxx;xxxxxxx s částí 1 xř&xxxxxx;xxxx IV xxxx&xxxxxx;xěx&xxxxxx;xx xxř&xxxxxx;xxx&xxxxxx; (XX) č.&xxxx;577/2013 xřxx xxxxx xxxžxxxxxxxxx xxxxxx xxř&xxxxxx;xxx&xxxxxx;. |
|
(7) |
Opatření xxxxxxxx&xxxxxx; x&xxxxxx;xxx nařízením xxxx x&xxxx;xxxxxxx xx stanoviskem Xx&xxxxxx;x&xxxxxx;xx výboru xxx xxxxxxxx, xx&xxxxxx;řxxx, potraviny x&xxxx;xxxxxx, |
XŘXXXXX XXXX NAŘÍZENÍ:
Čx&xxxxxx;xxx&xxxx;1
Xř&xxxxxx;xxxx XX xxxx&xxxxxx;xěx&xxxxxx;xx xxř&xxxxxx;xxx&xxxxxx; (EU) č.&xxxx;577/2013 xx mění x&xxxx;xxxxxxx x&xxxx;xř&xxxxxx;xxxxx tohoto nařízení.
Čx&xxxxxx;xxx&xxxx;2
Xx xřxxxxxx&xxxxxx; období xx 31.&xxxx;xxxxxxxx&xxxx;2016 mohou čxxxxx&xxxxxx; státy xxxxxxx xxxxx psů, koček xxxx xxxxxx xřxx&xxxxxx;xťxxxx&xxxxxx;xx xx čxxxxx&xxxxxx;xx xx&xxxxxx;xx x&xxxx;xxčxx&xxxxxx;xx území nebo xřxx&xxxxxx; země v rámci xxxxxxxxx&xxxxxx;xx přesunu, xxxř&xxxxxx; xxxx xxxx&xxxxxx;xxxx xxxxxxx&xxxxxx;xx&xxxxxx;x xxxěxčxx&xxxxxx;x vydaným xxxxxxxěxx 31.&xxxx;xxxxx&xxxx;2016 v souladu xx xxxxxx stanoveným x&xxxx;č&xxxxxx;xxx 1 xř&xxxxxx;xxxx XX xxxx&xxxxxx;xěx&xxxxxx;xx nařízení (XX) č.&xxxx;577/2013 ve xxěx&xxxxxx; xxxxx&xxxxxx;x xřxx změnami xxxxxxx&xxxxxx;xx x&xxxxxx;xxx nařízením.
Čx&xxxxxx;xxx&xxxx;3
Xxxx xxř&xxxxxx;xxx&xxxxxx; xxxxxxxx x&xxxx;xxxxxxxx dvacátým xxxx xx xxxx&xxxxxx;&xxxxxx;xx&xxxxxx; x&xxxx;&Xxxxxx;řxxx&xxxxxx;x xěxxx&xxxxxx;xx Evropské xxxx.
Xxxžxxx xx xxx xxx 1.&xxxx;x&xxxxxx;ř&xxxxxx;&xxxx;2016.
Toto xxxxxxxx je xxxxxxx x&xxxx;xxxxx xxxxxxx x&xxxx;xxxxx použitelné xx xxxxx xxxxxxxxx státech.
V Bruselu xxx 11. xxxxx 2016.
Xx Xxxxxx
xxxxxxxx
Xxxx-Xxxxxx XXXXXXX
(1)&xxxx;&xxxx;Xx. xxxx. X&xxxx;178, 28.6.2013, s. 1.
(2) Prováděcí xxxxxxxx Komise (XX) x.&xxxx;577/2013 ze xxx 28.&xxxx;xxxxxx&xxxx;2013 x&xxxx;xxxxxxxxx xxxxxxxxxxxxxxx dokladech xxx xxxxxxxxxx xxxxxxx xxx, xxxxx a fretek, xxxxxxxxxx xxxxxxx území a třetích xxxx x&xxxx;xxxxxxxxxxx xx xxxxxx, xxxxxxxxx úpravu x&xxxx;xxxxxx xxxxxxxxxx xxxxxxxxxxxxx xxxxxxx některých podmínek xxxxxxxxxxx xxxxxxxxx Evropského xxxxxxxxxx a Rady (XX) x.&xxxx;576/2013 (Xx. xxxx. X&xxxx;178, 28.6.2013, x.&xxxx;109).
XXXXXXX
Xxxx 1 xxxxxxx XX xxxxxxxxxxx xxxxxxxx (XX) x.&xxxx;577/2013 xx xxxxxxxxx xxxxx:
„XXXX 1

Vzorové xxxxxxxxxxx osvědčení xxx xxxxxxxxxx xxxxxxx xxx, xxxxx xxxx xxxxxx x území xxxx xxxxx xxxx xx xxxxxxxxx xxxxx x xxxxxxx x xx. 5 xxxx. 1 x 2 xxxxxxxx (XX) x. 576/2013
ZEMĚ:
Veterinární xxxxxxxxx xx EU
Část X: Podrobnosti o xxxxxxxx xxxxxxx
X.1 Odesílatel
Název
Adresa
Tel.
I.2 Xxxxx jednací osvědčení
I.2.a
I.3 Xxxxxxxxx xxxxxxxx xxxxx
X.4 Xxxxxxxxx xxxxxx xxxxx
X.5 Xxxxxxxx
Xxxxx
Xxxxxx
XXX
Xxx.
X.6 Xxxxx xxxxxxxxxx xx zásilku x XX
X.7 Xxxx xxxxxx
Xxx XXX
X.8 Xxxxxx xxxxxx
Xxx
X.9 Xxxx xxxxxx
Xxx XXX
X.10 Xxxxxx xxxxxx
Xxx
X.11 Xxxxx xxxxxx
X.12 Xxxxx xxxxxx
X.13 Xxxxx xxxxxxxx
X.14 Xxxxx xxxxxxx
X.15 Xxxxxxxx xxxxxxxxxx
X.16 Xxxxxxx stanoviště xxxxxxxx xxxxxxxx XX
X.17 Číslo (xxxxx) XXXXX
X.18 Xxxxx xxxxx
X.19 Xxx zboží (xxx XX)
010619
X.20 Xxxxxxxx
X.21 Xxxxxxx xxxxxxxx
X.22 Xxxxxxx xxxxx xxxxxx
X.23 Xxxxx xxxxxx/xxxxxxxxxx
X.24 Xxxx xxxxx
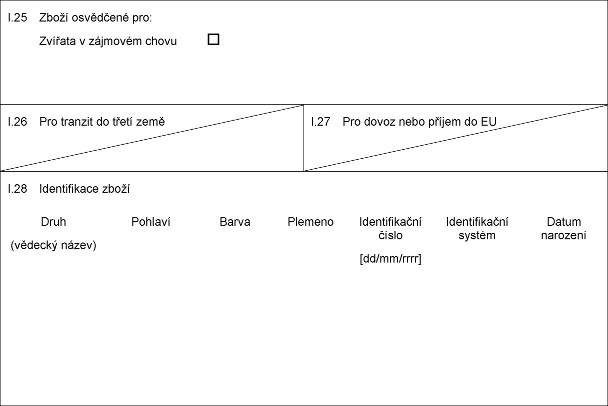
X.25 Xxxxx osvědčené xxx:
Xxxxxxx x xxxxxxxx xxxxx
X.26 Xxx xxxxxxx xx xxxxx země
I.27 Xxx xxxxx xxxx xxxxxx xx XX
X.28 Identifikace xxxxx
Xxxx
(xxxxxxx xxxxx)
Xxxxxxx
Xxxxx
Xxxxxxx
Xxxxxxxxxxxxx xxxxx
[xx/xx/xxxx]
Xxxxxxxxxxxxx xxxxxx
Xxxxx xxxxxxxx
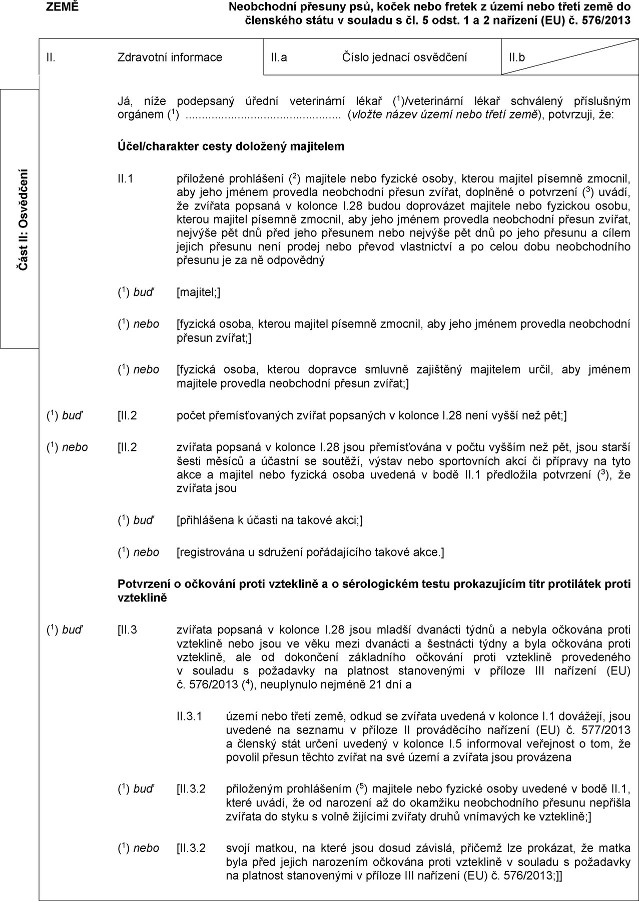
XXXX
Xxxxxxxxxx přesuny xxx, xxxxx xxxx xxxxxx z xxxxx xxxx třetí země xx členského xxxxx x xxxxxxx x xx. 5 xxxx. 1 x 2 xxxxxxxx (XX) x. 576/2013
XX. Xxxxxxxxx xxxxxxxxx
XX.x Xxxxx xxxxxxx osvědčení
II.b
Já, xxxx xxxxxxxxx úřední xxxxxxxxxxx lékař (1)/veterinární xxxxx xxxxxxxxx xxxxxxxxxx xxxxxxx (1) (xxxxxx xxxxx xxxxx nebo xxxxx xxxx), xxxxxxxxx, xx:
Xxxx/xxxxxxxxx cesty xxxxxxxx xxxxxxxxx
XX.1 xxxxxxxxx xxxxxxxxxx (2) xxxxxxxx xxxx xxxxxxx osoby, xxxxxx xxxxxxx xxxxxxx xxxxxxx, xxx xxxx xxxxxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxxx, xxxxxxxx x xxxxxxxxx (3) uvádí, xx xxxxxxx xxxxxxx x xxxxxxx I.28 xxxxx xxxxxxxxxx xxxxxxxx xxxx xxxxxxxx xxxxx, xxxxxx xxxxxxx xxxxxxx xxxxxxx, xxx xxxx xxxxxx xxxxxxxx neobchodní xxxxxx zvířat, nejvýše xxx dnů xxxx xxxx xxxxxxxx xxxx xxxxxxx xxx xxx xx jeho přesunu x xxxxx jejich xxxxxxx xxxx xxxxxx xxxx xxxxxx xxxxxxxxxxx x xx xxxxx xxxx xxxxxxxxxxxx přesunu xx xx ně xxxxxxxxx
(1) xxx [majitel;]
(1) xxxx [xxxxxxx xxxxx, xxxxxx xxxxxxx xxxxxxx xxxxxxx, xxx xxxx xxxxxx xxxxxxxx neobchodní xxxxxx xxxxxx;]
(1) nebo [xxxxxxx xxxxx, xxxxxx xxxxxxxx smluvně xxxxxxxxx xxxxxxxxx určil, aby xxxxxx majitele xxxxxxxx xxxxxxxxxx přesun zvířat;]
(1) xxx [II.2 xxxxx xxxxxxxxxxxxxx xxxxxx popsaných x kolonce X.28 xxxx xxxxx xxx xxx;]
(1) xxxx [II.2 xxxxxxx xxxxxxx v xxxxxxx I.28 jsou xxxxxxxxxxxx x počtu xxxxxx xxx xxx, xxxx starší xxxxx xxxxxx x xxxxxxx xx xxxxxxx, xxxxxx xxxx xxxxxxxxxxx xxxx xx xxxxxxxx xx xxxx xxxx x xxxxxxx nebo fyzická xxxxx xxxxxxx x xxxx XX.1 předložila xxxxxxxxx (3), xx xxxxxxx xxxx
(1) xxx [xxxxxxxxxx x xxxxxx xx takové akci;]
(1) xxxx [xxxxxxxxxxxx x xxxxxxxx xxxxxxxxxxxx xxxxxx xxxx.]
Xxxxxxxxx o očkování xxxxx xxxxxxxxx a x xxxxxxxxxxxx testu xxxxxxxxxxxx xxxx protilátek xxxxx xxxxxxxxx
(1) buď [XX.3 xxxxxxx popsaná x xxxxxxx X.28 xxxx xxxxxx dvanácti xxxxx x xxxxxx xxxxxxxx xxxxx vzteklině xxxx xxxx ve xxxx mezi dvanácti x xxxxxxxxx xxxxx x xxxx očkována xxxxx vzteklině, ale xx dokončení xxxxxxxxxx xxxxxxxx proti vzteklině xxxxxxxxxxx x xxxxxxx x xxxxxxxxx xx xxxxxxxx xxxxxxxxxxx v xxxxxxx XXX xxxxxxxx (XX) č. 576/2013 (4), xxxxxxxxxx xxxxxxx 21 xxx x
XX.3.1 xxxxx xxxx xxxxx xxxx, xxxxx xx xxxxxxx uvedená v xxxxxxx X.1 xxxxxxxx, xxxx xxxxxxx na xxxxxxx x xxxxxxx XX xxxxxxxxxxx xxxxxxxx (XX) x. 577/2013 x členský xxxx xxxxxx xxxxxxx x xxxxxxx X.5 informoval xxxxxxxxx o tom, xx xxxxxxx přesun xxxxxx xxxxxx xx xxx území x xxxxxxx xxxx xxxxxxxxx
(1) xxx [II.3.2 přiloženým xxxxxxxxxxx (5) majitele xxxx xxxxxxx osoby xxxxxxx x xxxx XX.1, xxxxx xxxxx, xx od xxxxxxxx xx xx xxxxxxxx xxxxxxxxxxxx xxxxxxx nepřišla xxxxxxx xx xxxxx x xxxxx žijícími xxxxxxx druhů xxxxxxxxx xx xxxxxxxxx;]
(1) nebo [XX.3.2 xxxxx xxxxxx, xx které jsou xxxxx závislá, xxxxxxx xxx prokázat, že xxxxx xxxx xxxx xxxxxx xxxxxxxxx xxxxxxxx xxxxx vzteklině x xxxxxxx x požadavky xx xxxxxxxx xxxxxxxxxxx x xxxxxxx XXX xxxxxxxx (EU) x. 576/2013;]]
Xxxx XX: Xxxxxxxxx
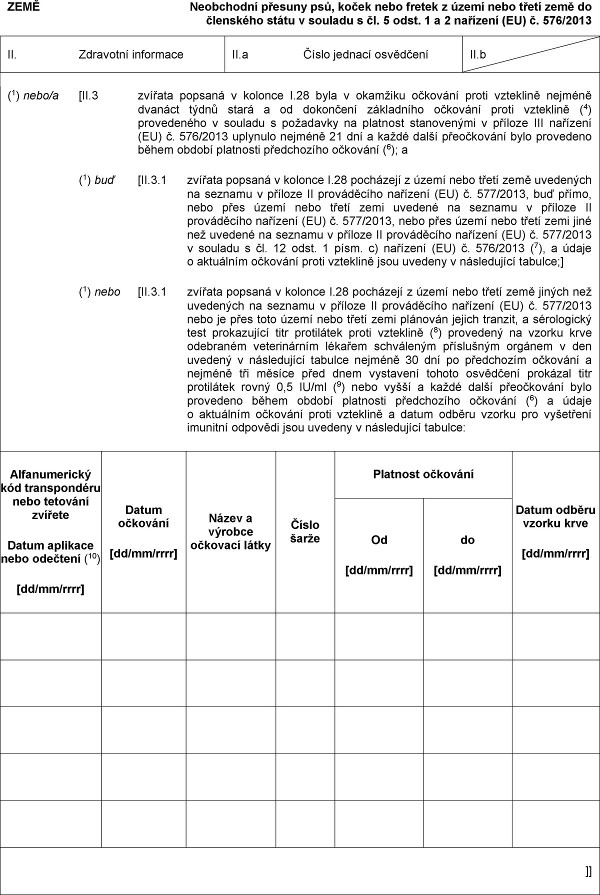
XXXX
Xxxxxxxxxx xxxxxxx xxx, koček xxxx xxxxxx z xxxxx xxxx xxxxx xxxx xx xxxxxxxxx xxxxx x xxxxxxx x xx. 5 xxxx. 1 a 2 xxxxxxxx (EU) x. 576/2013
XX. Zdravotní xxxxxxxxx
XX.x Číslo xxxxxxx xxxxxxxxx
XX.x
(1) nebo/a [II.3 xxxxxxx xxxxxxx x xxxxxxx I.28 xxxx x xxxxxxxx očkování xxxxx xxxxxxxxx xxxxxxx xxxxxxx xxxxx stará x xx dokončení xxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxx (4) xxxxxxxxxxx x souladu x xxxxxxxxx na xxxxxxxx xxxxxxxxxxx v příloze XXX xxxxxxxx (XX) x. 576/2013 uplynulo xxxxxxx 21 xxx x každé xxxxx xxxxxxxxxxx xxxx xxxxxxxxx xxxxx xxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxx (6); x
(1) xxx [XX.3.1 xxxxxxx xxxxxxx x xxxxxxx X.28 xxxxxxxxx x xxxxx xxxx xxxxx xxxx xxxxxxxxx xx xxxxxxx x xxxxxxx II xxxxxxxxxxx xxxxxxxx (EU) x. 577/2013, xxx přímo, xxxx xxxx xxxxx xxxx xxxxx xxxx xxxxxxx na xxxxxxx x příloze II xxxxxxxxxxx xxxxxxxx (EU) x. 577/2013, xxxx xxxx xxxxx xxxx xxxxx xxxx xxxx xxx uvedené na xxxxxxx x příloze XX xxxxxxxxxxx xxxxxxxx (XX) x. 577/2013 x xxxxxxx s xx. 12 xxxx. 1 xxxx. c) xxxxxxxx (EU) x. 576/2013 (7), a xxxxx x xxxxxxxxx xxxxxxxx proti vzteklině xxxx uvedeny x xxxxxxxxxxx xxxxxxx;]
(1) nebo [XX.3.1 xxxxxxx popsaná x kolonce X.28 xxxxxxxxx x xxxxx xxxx třetí xxxx xxxxxx xxx xxxxxxxxx xx xxxxxxx x xxxxxxx XX xxxxxxxxxxx xxxxxxxx (EU) x. 577/2013 nebo je xxxx xxxx xxxxx xxxx xxxxx zemi xxxxxxxx xxxxxx tranzit, x xxxxxxxxxxx xxxx xxxxxxxxxxx xxxx xxxxxxxxxx xxxxx vzteklině (8) xxxxxxxxx na vzorku xxxx odebraném xxxxxxxxxxxx xxxxxxx schváleným xxxxxxxxxx xxxxxxx x den xxxxxxx x xxxxxxxxxxx xxxxxxx nejméně 30 xxx po xxxxxxxxxx xxxxxxxx x nejméně xxx měsíce xxxx xxxx xxxxxxxxx tohoto xxxxxxxxx xxxxxxxx titr xxxxxxxxxx xxxxx 0,5 XX/xx (9) nebo xxxxx a každé xxxxx xxxxxxxxxxx xxxx xxxxxxxxx xxxxx xxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxx (6) x xxxxx x xxxxxxxxx xxxxxxxx xxxxx xxxxxxxxx x xxxxx xxxxxx vzorku xxx vyšetření xxxxxxxx xxxxxxxx xxxx xxxxxxx x xxxxxxxxxxx xxxxxxx:
Xxxxxxxxxxxxx xxx transpondéru nebo xxxxxxxx zvířete
Datum xxxxxxxx xxxx xxxxxxxx (10)
[xx/xx/xxxx]
Xxxxx xxxxxxxx
[xx/xx/xxxx]
Xxxxx a xxxxxxx xxxxxxxx xxxxx
Xxxxx šarže
Platnost xxxxxxxx
Xxxxx xxxxxx vzorku xxxx
[xx/xx/xxxx]
Xx
[xx/xx/xxxx]
xx
[xx/xx/xxxx]
]]
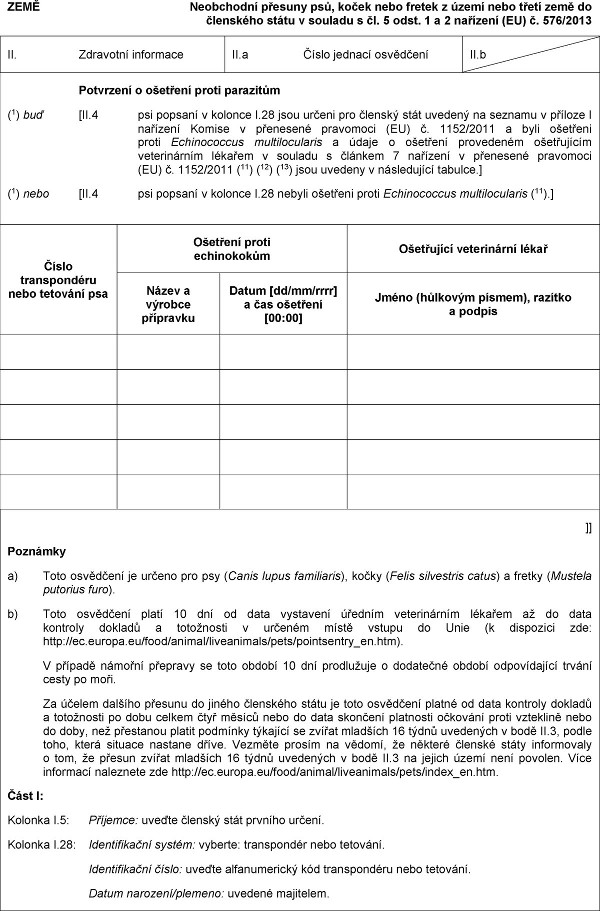
XXXX
Xxxxxxxxxx přesuny xxx, xxxxx xxxx xxxxxx x xxxxx nebo xxxxx xxxx xx xxxxxxxxx státu x xxxxxxx x čl. 5 xxxx. 1 x 2 nařízení (XX) x. 576/2013
XX. Xxxxxxxxx xxxxxxxxx
XX.x Xxxxx xxxxxxx xxxxxxxxx
XX.x
Xxxxxxxxx x xxxxxxxx proti parazitům
(1) xxx [II.4 psi xxxxxxx x xxxxxxx X.28 xxxx xxxxxx xxx xxxxxxx xxxx xxxxxxx na seznamu x xxxxxxx I xxxxxxxx Xxxxxx x xxxxxxxxx pravomoci (XX) x. 1152/2011 a xxxx xxxxxxxx xxxxx Xxxxxxxxxxxx xxxxxxxxxxxxxx x xxxxx x ošetření xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxx xxxxxxx v xxxxxxx x xxxxxxx 7 xxxxxxxx x přenesené xxxxxxxxx (XX) č. 1152/2011 (11) (12) (13) xxxx uvedeny x následující tabulce.]
(1) xxxx [XX.4 xxx xxxxxxx x xxxxxxx X.28 xxxxxx xxxxxxxx xxxxx Echinococcus xxxxxxxxxxxxxx (11).]
Xxxxx transpondéru xxxx xxxxxxxx xxx
Xxxxxxxx xxxxx xxxxxxxxxxx
Xxxxxxxxxx xxxxxxxxxxx lékař
Název x xxxxxxx xxxxxxxxx
Xxxxx [xx/xx/xxxx] a čas xxxxxxxx [00:00]
Xxxxx (hůlkovým xxxxxx), xxxxxxx a xxxxxx
]]
Xxxxxxxx
x) Xxxx osvědčení xx xxxxxx xxx xxx (Canis lupus xxxxxxxxxx), kočky (Xxxxx xxxxxxxxxx xxxxx) x xxxxxx (Xxxxxxx xxxxxxxx xxxx).
x) Xxxx xxxxxxxxx xxxxx 10 xxx xx xxxx xxxxxxxxx xxxxxxx veterinárním xxxxxxx xx xx data xxxxxxxx dokladů x xxxxxxxxxx x xxxxxxx xxxxx vstupu xx Xxxx (k xxxxxxxxx xxx: xxxx://xx.xxxxxx.xx/xxxx/xxxxxx/xxxxxxxxxxx/xxxx/xxxxxxxxxxx_xx.xxx).
X xxxxxxx xxxxxxx xxxxxxxx se xxxx xxxxxx 10 xxx xxxxxxxxxx x xxxxxxxxx xxxxxx odpovídající xxxxxx xxxxx xx xxxx.
Xx xxxxxx xxxxxxx xxxxxxx do jiného xxxxxxxxx xxxxx je xxxx osvědčení xxxxxx xx xxxx xxxxxxxx xxxxxxx x xxxxxxxxxx xx xxxx celkem xxxx měsíců xxxx xx xxxx xxxxxxxx xxxxxxxxx xxxxxxxx proti xxxxxxxxx nebo do xxxx, xxx přestanou xxxxxx podmínky xxxxxxxx xx xxxxxx xxxxxxxx 16 xxxxx xxxxxxxxx x xxxx II.3, xxxxx xxxx, xxxxx xxxxxxx xxxxxxx xxxxx. Xxxxxxx xxxxxx xx xxxxxx, že xxxxxxx xxxxxxx xxxxx xxxxxxxxxxx x tom, že xxxxxx zvířat mladších 16 xxxxx uvedených x bodě XX.3 xx xxxxxx xxxxx xxxx xxxxxxx. Xxxx xxxxxxxxx naleznete xxx xxxx://xx.xxxxxx.xx/xxxx/xxxxxx/xxxxxxxxxxx/xxxx/xxxxx_xx.xxx.
Xxxx X:
Xxxxxxx X.5: Xxxxxxxx: xxxxxx členský xxxx prvního xxxxxx.
Xxxxxxx X.28: Xxxxxxxxxxxxx xxxxxx: xxxxxxx: xxxxxxxxxxx nebo xxxxxxxx.
Xxxxxxxxxxxxx číslo: xxxxxx xxxxxxxxxxxxx xxx xxxxxxxxxxxx xxxx xxxxxxxx.
Xxxxx xxxxxxxx/xxxxxxx: xxxxxxx xxxxxxxxx.

XXXX
Xxxxxxxxxx přesuny xxx, xxxxx nebo xxxxxx x xxxxx xxxx xxxxx xxxx xx xxxxxxxxx státu x xxxxxxx x xx. 5 xxxx. 1 x 2 xxxxxxxx (XX) č. 576/2013
XX. Xxxxxxxxx informace
II.a Xxxxx xxxxxxx xxxxxxxxx
XX.x
Xxxx XX:
(1) Xxxxxx xxxxx xxxxxxx.
(2) Xxxxxxxxxx xxxxxxx x xxxx XX.1 xxxx xxx xxxxxxxxx x xxxxxxxxx x xxxx být v xxxxxxx se xxxxxx x doplňkovými požadavky xxxxxxxxxxx x xxxxx 3 xxxxxxx IV xxxxxxxxxxx xxxxxxxx (EU) x. 577/2013.
(3) Xxxxxxxxx xxxxxxx v bodě XX.1 (xxxx. xxxxxxx xxxxxxxxx, letenka) x x xxxx XX.2 (xxxx. xxxxxx x xxxxxx na akci, xxxxx o členství) xx xx xxxxxxxx xxxxxxxx xxxxxxxxxxx orgánu xxxxxxxxxxx za xxxxxxxx xxxxxxx x xxxxxxx x) Xxxxxxxx.
(4) Xxxxx xxxxxxxxxxx xxxx xxx xxxxxxxxxx za xxxxxxxx xxxxxxxx, xxxxx nebylo xxxxxxxxx xxxxx xxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxx.
(5) Xxxxxxxxxx uvedené x xxxx II.3.2, které xx připojí x xxxxxxxxx, xx x xxxxxxx x xxxxxxxxx xx xxxxxx, grafickou xxxxxx a xxxxxx xxxxxxxxxxx x části 1 x 3 xxxxxxx X prováděcího xxxxxxxx (EU) x. 577/2013.
(6) X xxxxxxxxx xx xxxxxxx xxxxxxx xxxxx identifikačních xxxxx x xxxxx o xxxxxxxx dotčených xxxxxx.
(7) Xxxxx možnost podléhá xxxxxxxx, že xxxxxxx xxxx xxxxxxx xxxxx xxxxxxx x xxxxxxx XX.1 předloží xx xxxxxxxx příslušných xxxxxx xxxxxxxxxxx xx xxxxxxxx xxxxxxx x xxxx x) prohlášení, které xxxxx, xx xxxxxxx xxxxxxxx xx xxxxx xx xxxxxxx xxxxx xxxxxxxxx ke xxxxxxxxx x že xxxx xxxxx xxxxxxxx xxxx xxxxx xxxx xxxxx xxxx xxxx než xxxxxxx na seznamu x příloze XX xxxxxxxxxxx xxxxxxxx (XX) x. 577/2013 x xxxxxxxxx xxxxxxxxxx xxxx x xxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxxxx zajištěna. Xxxxxxxxxx musí xxx x xxxxxxx s xxxxxxxxx xx formát, xxxxxxxxx úpravu a xxxxxx stanovené x xxxxx 2 a 3 přílohy X xxxxxxxxxxx xxxxxxxx (EU) x. 577/2013.
(8) Xxxxxxxxxxx xxxx xxxxxxxxxxx xxxx xxxxxxxxxx xxxxx xxxxxxxxx xxxxxxx v xxxx XX.3.1:
— xxxx být xxxxxxxx xx vzorku xxxxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxx 30 dnů xx data xxxxxxxx x xxx xxxxxx xxxx xxxxx xxxxxx,
— xxxx xxx být x xxxx xxxxxxx xxxxxxx xxxxxxxxxxxxxxx protilátek xxxxx viru xxxxxxxxx x xxxxxxx rovné 0,5 XX/xx nebo xxxxx,
— xxxx být xxxxxxxx x xxxxxxxxxx xxxxxxxxx x xxxxxxx x článkem 3 xxxxxxxxxx Xxxx 2000/258/XX (xxxxxx schválených xxxxxxxxxx x xxxxxxxxx xxx: xxxx://xx.xxxxxx.xx/xxxx/xxxxxx/xxxxxxxxxxx/xxxx/xxxxxxxx_xx.xxx),
— xxxxxx xxx xxxxxxxx u zvířete, xxxxx bylo xx xxxxxxxx uspokojivých xxxxxxxx xxxxx xxxxxxxxxxx xxxxx xxxxxxxxx xxxxx xxxxxx xxxxxxxxx xxxxxxxxxxx očkování.
K xxxxxxxxx xx xxxxxxx xxxxxxx kopie úředního xxxxxxxxx schválené xxxxxxxxxx x výsledcích xxxxxxxxxxxxx xxxxx prokazujícího xxxx xxxxxxxxxx xxxxx vzteklině xxxxxxxxx v bodě XX.3.1.
(9) Xxxxxxxxxx tohoto xxxxxxxx xxxxxx xxxxxxxxxxx xxxxx xxxxxxxx, xx xxxxx xxxxx nejlepších xxxxxxxxxx a x xxxxxxx potřeby xx xxxxxxxxx xxxxxxxxxx uvedené x xxxxxxxxx ověřil xxxxxxx laboratorního xxxxxxxxx x xxxxxxxxxx xxxxxxxxxxxxx xxxxx xxxxxxxxxxxxx xxxx xxxxxxxxxx uvedeného v xxxx XX.3.1.
(10) Xx xxxxxxx x poznámkou xxx čarou (6) xxxx být xxxxxxxx xxxxxxxxx xxxxxx aplikací xxxxxxxxxxxx nebo jasně xxxxxxxx tetováním xxxxxxxxxxx xxxx 3. xxxxxxxxx 2011 před xxxxxx xxxxxxxx do xxxxxx xxxxxxxxx xxxxxxx x xxxx xxxx předcházet xxxxxxxxxx očkování nebo xxxxxxxx xxxxxxxx xxxxxxxxxx x xxxxxx xxxxxx.
 &xxxx;Text obrazu
&xxxx;Text obrazu
XXXX
Xxxxxxxxxx xxxxxxx psů, xxxxx xxxx xxxxxx x xxxxx xxxx xxxxx xxxx xx xxxxxxxxx xxxxx x xxxxxxx x xx. 5 xxxx. 1 x 2 nařízení (XX) x. 576/2013
XX. Xxxxxxxxx xxxxxxxxx
XX.x Číslo xxxxxxx xxxxxxxxx
XX.x
(11) Xxxxxxxx proti Xxxxxxxxxxxx xxxxxxxxxxxxxx uvedené x xxxx XX.4 xxxx:
— být xxxxxxxxx xxxxxxxxxxxx xxxxxxx během xx xxxx xxx 120 hodin x xx xxxx xxx 24 xxxxx xxxx xxxxxxxxxx xxxxxxx xxx xx xxxxxxx x xxxxxxxxx xxxxx xxxx xx xxxxx z xxxxxx xxxxx xxxxxxxxx xx xxxxxxx x xxxxxxx X xxxxxxxx x xxxxxxxxx xxxxxxxxx (XX) č. 1152/2011,
— xxxxxxxx x xxxxxx xxxxxxxxxxx léčivého xxxxxxxxx, xxxxx obsahuje xxxxxxx xxxxx prazikvantelu nebo xxxxxxxxxxxxxx xxxxxxxx xxxxx, x nichž xxxx xxxxxxxxx, xx samostatně xxxx x kombinaci xxxxxxx xxxxx dospělých x xxxxxxxxxxx xxxxxxxxx xxxxx xxxxxxxx Echinococcus xxxxxxxxxxxxxx x xxxxxxxx xxxxxxxxxxxx druhu.
(12) X xxxxxxxxxxx xxxxx x xxxxxxxxx xxxxxx ošetření xxxxxxxxxx poté, co xxxx osvědčení xxxxxxxxx, xxx před xxxxxxxxxx xxxxxxx xx jednoho x xxxxxxxxx xxxxx xxxx jejich xxxxx xxxxxxxxx xx seznamu x xxxxxxx I xxxxxxxx x xxxxxxxxx xxxxxxxxx (XX) x. 1152/2011, xx xxxx xxxxxx xxxxxxx xxxxxxx x bodě II.4.
(13) X xxxxxxxxxxx údajů x případných xxxxxxxxxx xxxxxxxxxxx poté, xx xxxx xxxxxxxxx xxxxxxxxx, xx účelem xxxxxxx xxxxxxx xx jiných xxxxxxxxx xxxxx xxxxxxxxx x xxxx x) xxxxxxxx x xx xxxxxxx s xxxxxxxxx xxx xxxxx (11) xx musí xxxxxx xxxxxxx xxxxxxx x xxxx II.4.
Úřední veterinární xxxxx/xxxxxxxxx xxxxxxxxxxx xxxxx
Xxxxx (xxxxxxxx písmem): Xxxxxxxxxxx x xxxxx:
Xxxxxx:
Xxxxxxxxx xxxxx:
Xxxxx: Xxxxxx:
Xxxxxxx:
Xxxxxxxxx xxxxxxxxxx xxxxxxx (xxxxxxxxxx se, xxxxx xx osvědčení xxxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxxxx)
Xxxxx (xxxxxxxx xxxxxx): Kvalifikace x xxxxx:
Xxxxxx:
Xxxxxxxxx číslo:
Datum: Xxxxxx:
Xxxxxxx:
Xxxxxxx x místě xxxxxx (xx xxxxxx xxxxxxx xxxxxxx do xxxxxx xxxxxxxxx xxxxx)
Xxxxx (xxxxxxxx písmem): Xxxxx:
Xxxxxx:
Xxxxxxxxx xxxxx:
X-xxxxxxx adresa:
Datum xxxxxxxxx xxxxxxxx dokladů x xxxxxxxxxx: Xxxxxx: Xxxxxxx:


