XXXXXXXX XXXXXX 2006/86/XX
xx xxx 24. xxxxx 2006,
xxxxxx xx provádí xxxxxxxx Evropského xxxxxxxxxx x Rady 2004/23/ES, xxxxx xxx x xxxxxxxxx xx sledovatelnost, xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxx x xxxxxxx technické xxxxxxxxx na xxxxxxxx, xxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx x distribuci xxxxxxxx xxxxx x xxxxx
(Xxxx x významem pro XXX)
XXXXXX EVROPSKÝCH XXXXXXXXXXXX,
x xxxxxxx xx Xxxxxxx x xxxxxxxx Evropského xxxxxxxxxxxx,
x xxxxxxx xx xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx 2004/23/ES xx dne 31. xxxxxx 2004 o xxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxxx norem xxx xxxxxxxx, xxxxx, vyšetřování, xxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx x distribuci xxxxxxxx xxxxx x xxxxx (1), x xxxxxxx xx xxxxxx 8, xx. 11 xxxx. 4 x xx. 28 xxxx. x), x), x), x x) xxxxxxx xxxxxxxx,
xxxxxxxx x xxxxx xxxxxxx:
|
(1) |
Xxxxxxxx 2004/23/XX xxxxxxx xxxxxxxx x xxxxxxxxxxxx normy xxx xxxxxxxx, xxxxx, xxxxxxxxxxx, xxxxxxxxxx, konzervaci, skladování x xxxxxxxxxx xxxxxxxx xxxxx x xxxxx xxxxxxxx x xxxxxxx x xxxxxxx x xxxxxxxxx získaných x xxxxxxxx xxxxx x xxxxx určených x xxxxxxx u xxxxxxx x xxxxx zajistit xxxxxxx xxxxxx xxxxxxx xxxxxxxx zdraví. |
|
(2) |
Aby xx xxxxxxxxxxx xxxxxxx nemocí xxxxxxxxxxxxxxx xxxxxxxx xxxxx x xxxxx xxxxxxxx x xxxxxxx x xxxxxxx x xxx xx xxxxxxxx xxxxxxxxxx xxxxxx xxxxxxx a xxxxxxxxxxx, vyzývá xxxxxxxx 2004/23/XX ke xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxx každou x xxxx postupu xxxxxxx xxxxxxxx xxxxx x xxxxx, včetně xxxxx x xxxxxxxxxxx xxx xxxxxx xxxxxxx tkáňových xxxxxxxx. |
|
(3) |
Xxxxxxx státy xx xxxx x souladu xx xxxxxxxx 2004/23/XX xxxxxxxx xxxxxx akreditace x jmenování tkáňových xxxxxxxx a postupů xxxxxxxx xxxxx a xxxxx a xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxx xxxxxxxx, aby se xxxxxxxxx vysoká xxxxxx xxxxxxx lidského xxxxxx. Xxx xxxxx xxxxxx xx xxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx. |
|
(4) |
Xxxxxxxxx na xxxxxxxxxx x jmenování xxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxxxxx xxxxxxxxx xxxx xxxxxxxx by xx měly xxxxxxxxx xx organizaci x xxxxxx, xxxxxxxxxx, xxxxxxxx, xxxxxxxxx, xxxxxxxx/xxxxxxxx, xxxxxxxxxxx, xxxxxxx x xxxxxxxxxxx xxxxxxx. Akreditovaná x xxxxxxxxx xxxxxxx xxxxxxxx xxxx xxxxxxx xxxxxxxx, xxxx bylo xxxxxxx xxxxxxxxx xxxx povolení, xx xxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xx xxxxxxxx xxxxxxxx, které xxxxxxxxx. |
|
(5) |
Xxxxx xxxxxxxx xx xxxxxxx vzduchu xxx xxxxxxxxxx xxxxx a xxxxx xx xxxxxxxx xxxxxxxx, který může xxx vliv xx xxxxxx xxxxxxxxxxx tkání xxxx xxxxx. Xxxxxx xx vyžaduje xxxxxxx xxxxxxx, v xxxx xxxx xxxxx částic x xxxxx xxxxxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxx xx třídě xxxxxxx X, xxx xx xxxxxxxxxx v xxxxxxx 1 Xxxxxxxxxx xxxxxx xxx správnou výrobní xxxxx a xx xxxxxxxx Xxxxxx 2003/94/XX (2). X xxxxxxxx xxxxxxxxx xxxx xxxx xxxxxxx xxxxxxx x xxxxxx xxxxxx x xxxxxx xxxxxxxxxxxxx kolonií xxxxxxxxxxxx xxxxxx x xxxxx xxxxx A indikována. Xx xxxxxxxx okolností xx xxxx xxx xxxxxxxxx x xxxxxxxxxxxxxx, xx xxxxxxx prostředí xxxxxxxx jakost a xxxxxxxxxx, jež xxxx xxxxxxxxxx xxx daný xxxx xxxxx a xxxxx, xxxx proces x xxxx xxxxxxx x člověka. |
|
(6) |
Oblast působnosti xxxx směrnice xx xxxx xxxxxxxxx xxxxxx x bezpečnost xxxxxxxx xxxxx x xxxxx xxx kódování, xxxxxxxxxx, xxxxxxxxxx, skladování x xxxxxxxxxx xx xxxxxxxxxxxxxx xxxxxxxx, x xxxx xx xxxxxxx x xxxxxxx těle. Xxxxxx xx xxxx být xxxxxxxxx xx xxxxxxx xxxxxx xxxxx x xxxxx x xxxxxxx (xxxx. xxx xxxxxxxxxx, xxxxxxx, xxxxxxxxxx nebo xxxxxxx embryí). Xxxxxxxxxx xxxx xxxxxxxx týkající xx xxxxxxxxxxxxxxx a xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxx xx rovněž vztahují xx xxxxxxxx, odběr x xxxxxxxxxxx xxxxxxxx xxxxx x buněk, xxxxx jsou xxxxxxxx xxxxxxxx Komise 2006/17/ES (3). |
|
(7) |
Použití xxxxx x xxxxx x xxxxxxx může xxx xxxxxxxx xxxxxxxx xxxxxx xxxxxxx xxxxxx x xxxxx případné xxxxxxxxx účinky. Xxx xxxx xxxxx xxxxxxxx x snížit tyto xxxxxx, xxxx xx xx xxxxxxxx xxxxxxxxxx xxxxxxxxx xx sledovatelnost x xxxxxx Xxxxxxxxxxxx xxx xxxxxxxxxx závažných xxxxxxxxxxx xxxxxx x xxxxxx. |
|
(8) |
Xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxx, xx x xxxxx, či u xxxxxxxx, a závažné xxxxxxxxx xxxxxx xx xxxxxxxx xx po xxxxxxxxxx tkání x xxxxx, xxx xxxxx xxx xxxx xx xxxxxx x bezpečnost xxxxx x xxxxx x mohou xxx xxxxxxxxx xxxxxxx (xxxxxx xxxxxxxxx x výběru xxxxx), xxxxxxxxxxxx, xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxx x buněk, se xxxxxxxxxx ohlašují xxxxxxxxxxx xxxxxx. |
|
(9) |
Xxxxx xxxxxx x xxxxxx dárců či xx něm nebo xxxxx použití x xxxxxxx či po xxx xxxxx xxx xxxxxxxx xxxxxxx nežádoucí xxxxxx. Měly xx xxx xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxx xxxxx xxxxxxxxxx xxxxxxx x oznámení příslušnému xxxxxx. Xx by xxxxxxxxxx provádějící xxxxx xx xxxxxxxxxx xxxxxxxxx xx xxxxxxx u xxxxxxx nemělo xxxxxx x xxx, aby xxxxx uvědomily xxxxxxxxx xxxxx, xxxxx xx xx xxxxx. Xxxx xxxxxxxx xx měla xxxxxxx xxxxxxxxx údaje, xxx xx xxxxx xxxxxxxxx xxxxxxxxxxx xxxxxx, xxxx xx xxx xxxxxxx schopnost xxxxxxxxx xxxxx zachovávat xx xxxxxxx xx xxxx xxxxx xxxxxxxxx a xxxxxxxx opatření, která xxxx v xxxxxxx x ustanoveními Xxxxxxx. |
|
(10) |
X xxxxx xx nejvíce xxxxxx výdaje xx xxxxxx, xxxxxxxx překrývání x zvýšit xxxxxxxxxxxxxxx xxxxxxxx by xx xxxx x provádění xxxxx týkajících se xxxxxxx x xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxxx x xxxxxx xxxxxxxxxxxx xxxxxxx správy. Xxxx technologie xx xxxx využívat standardní xxxxxx xxx výměnu xxxxxxxxx xx použití xxxxxxxx xxxxxxx xxx xxxxxx referenčních xxxxx. |
|
(11) |
Xxx xx xxxxxxxxx xxxxxxxxxxxxxx x zjednodušily xxxxxxxxx x xxxxxxxx xxxxxxxxxxxxxxxxx x xxxxxxxxxxxx xxxxx x xxxxx, xx xxxxx xxxxxxxx xxxxxxxx xxxxx, xxx xxxx xxx xxxxxxxx xx xxxxxxxxxx xxxxxxxxxx xxxx. |
|
(12) |
X xxxx směrnici xxxx xxxxxxxxxx xxxxxxxx práva x xxxxxxxxxxx zásady xxxxxxxx xxxxxxx Listinou xxxxxxxxxx xxxx Xxxxxxxx xxxx. |
|
(13) |
Xxxxxxxx stanovená xxxxx xxxxxxxx jsou x xxxxxxx xx stanoviskem xxxxxx xxxxxxxxx xxxxxxx 29 směrnice 2004/23/XX, |
XXXXXXX XXXX SMĚRNICI:
Xxxxxx 1
Xxxxxx xxxxxxxxxx
1. Xxxx xxxxxxxx xx vztahuje xx xxxxxxxx, zpracování, xxxxxxxxxx, skladování x xxxxxxxxxx:
|
x) |
xxxxxxxx xxxxx a xxxxx určených x xxxxxxx u xxxxxxx x |
|
x) |
xxxxxxxxx získaných x xxxxxxxx tkání x xxxxx xxxxxxxx x xxxxxxx x xxxxxxx, xxxxx se na xxxxxx přípravky xxxxxxxxxx xxxx xxxxxxxx. |
2. Ustanovení xxxxxx 5 xx 9 xxxx xxxxxxxx, která xx xxxxxx xxxxxxxxxxxxxxx x oznamování závažných xxxxxxxxxxx xxxxxx a xxxxxx, xx xxxxxx xxxxxxxx xx darování, xxxxx, xxxxxxxxxxx xxxxxxxx xxxxx a xxxxx.
Xxxxxx 2
Definice
Xxx účely xxxx xxxxxxxx xx:
|
a) |
„reprodukčními xxxxxxx“ xxxxxxxx xxxxxxx xxxxx x xxxxx xxxxxx x xxxxxx xxxxxxxxxx xxxxxxxxxx; |
|
x) |
„xxxxxxxxx xxxx xxxxxxxx“ rozumí xxxxxxxx xxxxxxxxxxxxx xxxxx xxxx xxxxx x xxxxx, xxxxx xxxxxxxx, xx xxxx intimní xxxxxxx xxxxx; |
|
x) |
„xxxxxxxx jakosti“ xxxxxx xxxxxxxxxxx xxxxxxxxx, xxxxxxxxx xxxxxxxxxx, xxxxxxx, xxxxxxx x zdroje k xxxxxxxxx řízení xxxxxxx; xxxxxxxx všechny xxxxxxxx, xxxxx přímo xx xxxxxxx xxxxxxxxxx x xxxxxxx; |
|
x) |
„xxxxxxx xxxxxxx“ rozumějí xxxxxxxxxxxx xxxxxxxx, xxxxx xxxx řídit x xxxxxxxxxxx organizaci z xxxxxxxx jakosti; |
|
x) |
„xxxxxxxxxxxx xxxxxxxxxx xxxxxxx“ (XXX) rozumějí xxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx x xxxxx, xxxxx xxxx xxx xxxxxxx, x xxxxxxxxx xxxxxxx xxxxxxxxx; |
|
x) |
„xxxxxxxx“ (xxxx „xxxxxxxxxxx“ x xxxxxxx xxxxxxxx xxxx xxxxxxxxx) rozumí xxxxxxxxx xxxxxxxxxxxxxxx xxxxxx, xxxxx xxxxxxxxx vysokou xxxxxx, xx určitý xxxxxx, xxxxxxxxxx xxxxxxxx xxxxxx, části zařízení xxxx prostředí konzistentně xxxxxxx produkt, xxxxx xxxxxxx xxxxxx stanovené xxxxxxxxxxx x xxxxxxxx xxxxxxx; |
|
x) |
„xxxxxxxxxxxxxxx“ rozumí schopnost xxxxxxx xxxxx, kde xx xxxxxxx, a xxxxxxxxxxxxx xxxx/xxxxx xxxxx xxxxx etapy od xxxxxx, xxxx xxxxxxxxxx, xxxxxxxxxxx x xxxxxxxxxx xx xx distribuci xxxxxxxx xxxx xxxxxxxxx, xxx xxxxxxxx také xxxxxxxxx identifikovat xxxxx x tkáňové zařízení xxxx výrobní xxxxxxxx, xxxxx xxxx/xxxxx xxxxxxx, xxxxxxxxxx xxxx skladuje, x schopnost xxxxxxxxxxxxx xxxxxxxx xx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxxx/xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxx tkáň/buňky x xxxxxxxx/xxxxxxxx; |
|
x) |
„xxxxxxxxx“ xxxxxx mající xxxxx xxxx xx xxxxxx nebo bezpečnost xxxxx x tkání xxxx xxxxxx s xxxx kontakt; |
|
x) |
„xxxxxxxxxx xxxxxxxxxxx xxxxx“ xxxxxx xxxxxxxxxxxx xxxxxxxx xxxx jednotka xxxxxxxxx xxxx xxxx xxxxxxx, který provozuje xxxxx lidských xxxxx x buněk a xxxxx xxxxxx xxx xxxxxxxxxxx, xxxxx, oprávněn xxxx xxxxxxx xxxx xxxxxxx xxxxxxxx; |
|
x) |
„organizacemi xxxxxxxxxxx xx použití x xxxxxxx“ xxxxxxxx zdravotnické xxxxxxxx xxxx xxxxxxxx xxxxxxxxx nebo jiný xxxxxxx, který xxxxxxx xxxxxx tkáně x xxxxx x xxxxxxx. |
Xxxxxx 3
Požadavky na xxxxxxxxxx a xxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxxxxx xxxxxxxxx xxxx xxxxxxxx
Xxxxxxx zařízení xxxx splňovat xxxxxxxxx xxxxxxxxx v xxxxxxx X.
Xxxxxx 4
Xxxxxxxxx xx xxxxxxxxxx a xxxxxxxxx xxxxxxx přípravy xxxxx x buněk x xxxxxxx příslušného xxxxxxxxx xxxx xxxxxxxx
Postupy xxxxxxxx x xxxxxxxxx zařízeních xxxxxx xxxxxxxx požadavky xxxxxxxxx x xxxxxxx XX.
Xxxxxx 5
Xxxxxxxxxx závažných xxxxxxxxxxx reakcí
1. Xxxxxxx xxxxx xxxxxxx, aby:
|
a) |
xxxxxxxxxx xxxxxxxxxxx xxxxx měly xxxxxxxx xxxxxxx pro xxxxxx xxxxxxx x xxxxxxxxxx xxxxxxx a buňkách x xxx xx, xxx xxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx zařízení x xxxxxxxxx xxxxxxxxxxx xxxxxxxx x žijících xxxxx, xxx by xxxxx xxxxxxxx jakost x xxxxxxxxxx xxxxx x xxxxx; |
|
x) |
xxxxxxxxxx odpovědné xx xxxxxxx xxxxx x xxxxx x xxxxxxx xxxx xxxxxxxx xxxxxxx pro xxxxxx xxxxxxx x xxxxxxxxx xxxxxxx x buňkách x xxx to, xxx mohly xxxxxxxxxx xxxxxxxxxx xxxxxxx zařízení x xxxxxxxxx xxxxxxxxxxx xxxxxxxx pozorovaných během xxxxxxxxxx použití nebo xx xxx, xxxxx xxxxx xxxxxxxx s xxxxxxx a xxxxxxxxxxx xxxxx xxxx buněk; |
|
x) |
tkáňová xxxxxxxx, která distribuují xxxxx a xxxxx xxx použití x xxxxxxx, xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xx xxxxxxx xxxxx a xxxxx x xxxxxxx xxxxxxxxx x tom, jak xx xxxx xxxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxx, jak xx xxxxxxx x xxxxxxx x). |
2. Xxxxxxx xxxxx xxxxxxx, xxx tkáňová xxxxxxxx:
|
a) |
xxxx xxxxxxxx postupy xxx xx, xxx mohla xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx všechny xxxxxxxx xxxxxxxx xxxxxxxxx o xxxxxxxxxxx závažných xxxxxxxxxxx xxxxxxxx, xxx je xxxxxxx x xxxx. 1 písm. x) x b); |
|
b) |
xxxx zavedeny xxxxxxx xxx to, xxx mohla xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxxx pro xxxxx xxxxxxx příčin x následného xxxxxxx. |
3. Xxxxxxx xxxxx zajistí, xxx:
|
a) |
odpovědná xxxxx uvedená v xxxxxx 17 xxxxxxxx 2004/23/XX xxxxxxxx příslušnému xxxxxx xxxxxxxxx obsažené x oznámení podle xxxxx X xxxxxxx XXX; |
|
x) |
xxxxxxx xxxxxxxx oznámila xxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxx ohledně ostatních xxxxxxxxx xxxxx x xxxxx, které byly xxxxxxxxxxxxx xxx xxxxx xxxxxxx x xxxxxxx; |
|
c) |
tkáňová xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxxx, xxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx podle xxxxx X xxxxxxx XXX. |
Xxxxxx 6
Oznamování xxxxxxxxx xxxxxxxxxxx účinků
1. Xxxxxxx xxxxx xxxxxxx, xxx:
|
x) |
organizace xxxxxxxxxxx xxxxx x tkáňová xxxxxxxx xxxx xxxxxxxx xxxxxxx xxx vedení xxxxxxx a xxx xx, xxx mohly xxxxxxxxxx uvědomovat xxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxxx, xxxxx xx objeví během xxxxxx a xxxxx xx ovlivnit jakost x/xxxx xxxxxxxxxx lidských xxxxx a xxxxx; |
|
b) |
organizace xxxxxxxxx xx xxxxxxx xxxxx a xxxxx x xxxxxxx xxxx xxxxxxxx xxxxxxx, aby xxxxx neprodleně uvědomovat xxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxxx, xxxxx xx mohly xxxxxxxx xxxxxx x xxxxxxxxxx xxxxx xxxx xxxxx; |
|
x) |
xxxxxxx zařízení xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xx xxxxxxx xxxxx a xxxxx x člověka xxxxxxxxx o xxx, xxx xx tato xxxxxxxxxx xxxxxxxxx závažné xxxxxxxxx xxxxxx, xxxxx xx mohly ovlivnit xxxxxx x xxxxxxxxxx xxxxx xxxx buněk. |
2. X xxxxxxx asistované xxxxxxxxxx xx xxxxxxxx xxxxxx xxxxxxxxxxxx xx xxxxxx xxxxx xxxx xxxxxx xxxxxxxx xx xxxxxxx xxxxxxxxx účinek. Xxxxxxx xxxxx xx organizace xxxxxxxxxxx odběr xxxx xxxxxxxxxx odpovědné za xxxxxxx xxxxx a xxxxx x xxxxxxx, xxxxx provádějí xxxxxxxxxxx xxxxxxxxxx, xxxxxx xxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx účely xxxxxxxxxxx x oznámení xxxxxxxxxxx orgánu.
3. Xxxxxxx xxxxx xxxxxxx, aby tkáňová xxxxxxxx:
|
x) |
xxxx zavedeny xxxxxxx xxx xx, xxx xxxxx xxxxxxxxxx sdělovat xxxxxxxxxxx xxxxxx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx x podezřelých závažných xxxxxxxxxxx xxxxxxxx, xxx xx xxxxxxx v xxxx. 1 xxxx. x) a x); |
|
x) |
xxxx xxxxxxxx xxxxxxx pro xx, xxx xxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx závěry vyšetřování xxx xxxxx analýzy xxxxxx a následného xxxxxxx. |
4. Xxxxxxx státy xxxxxxx, xxx:
|
x) |
xxxxxxxxx xxxxx xxxxxxx x xxxxxx 17 xxxxxxxx 2004/23/XX xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxx xxxxx části A xxxxxxx XX; |
|
b) |
tkáňová xxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxx xxxxxx, aby bylo xxxxx x xxxxx xxxxxxx xxxxx xxxxxxx, xxxx lze xxxxxxxx; |
|
c) |
tkáňová xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx závěry xxxxxxxxxxx, xxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxx xxxxx X xxxxxxx XX. |
Xxxxxx 7
Xxxxxxx zprávy
1. Xx 30. xxxxxx následujícího xxxx xxxxxxxx xxxxxxx xxxxx Komisi výroční xxxxxx o xxxxxxxxxx, xxxxx xxxxxxxxx xxxxx xxxxxxx o xxxxxxxxx xxxxxxxxxxx xxxxxxxx x xxxxxxxx. Xxxxxx xxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxx xxxxx xxxxxxx xxxxxxxxxx xxxxx. Příslušný xxxxx xxxx xxxxxx zpřístupní xxxxxxxx xxxxxxxxx.
2. Přenos xxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxx xx xxxxxxx xxx xxxxxx údajů stanoveným x xxxxxxx X x X přílohy X a xxxxxxx xxxxxxx informace nezbytné xxx xxxxxxxxxxxx xxxxxxxxxxx x pro zachování xxxx xxxxxxxxxxxx údajů.
Xxxxxx 8
Xxxxxx xxxxxxxxx xxxx příslušnými xxxxxx x xxxxxx xxxxxxxxx Xxxxxx
Xxxxxxx státy xxxxxxx, xxx si xxxxxx xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxx o závažné xxxxxxxxx xxxxxx x xxxxxx, xxx xx xxxxxxxx, xx xxxxx xxxxxxx xxxxxxxxxxxx xxxxxxxx, x xxx tyto xxxxxxxxx sdělovaly Komisi.
Xxxxxx 9
Xxxxxxxxxxxxxx
1. Tkáňová zařízení xxxx účinné x xxxxxx xxxxxxx pro xxxxxxxxxxxx identifikaci x xxxxxxxx xxxxxxxxxx a xxxxxxxxxxxxxxx xxxxx/xxxxx.
2. Xxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxxxx xx xxxxxxx u xxxxxxx xxxxxxxx xxxxx xxxxxxxxx v xxxxxxx XX xxxxxxx po xxxx 30 xxx, x to xx xxxxxxx x xxxxxxxx xxxxx.
Xxxxxx 10
Xxxxxxxx xxxxxxxx xxxxxx
1. Xxxxxxxx darovaným materiálům xx v tkáňovém xxxxxxxx přidělí jedinečný xxxxxxxx xxxxxxxxxxxxx xxx, xxx xx zajistila xxxxx identifikace xxxxx x xxxxxxxxxxxxxx xxxxx xxxxxxxxxx materiálů a xxxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxxxxxxxxxx a xxxxxxxxxxxx xxxxx a xxxxx. Kód xxxxxxxx xxxxxxx informace xxxxxxx x příloze VII.
2. Xxxxxxxx 1 xx xxxxxxxxxx xx xxxxxxxx xxxxxxxxxxxxx xxxxx xxxx xxxxxxxx.
Xxxxxx 11
Xxxxxxxxx
1. Xxxxxxx státy xxxxxx x účinnost xxxxxx a xxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxxxx souladu x xxxxx xxxxxxxx xxxxxxxxxx xx 1. září 2007. Neprodleně sdělí Xxxxxx znění xxxxxxxxx xxxxxxxx a xxxxxxxxxx xxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxxxxxx xxxx xxxxxxxx.
Xxxxxxx xxxxx xxxxxx x xxxxxxxx právní x xxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxxxx souladu x xxxxxxx 10 xxxx xxxxxxxx xx 1. září 2008.
Xxxx xxxxxxxx přijaté xxxxxxxxx xxxxx xxxx obsahovat xxxxx xx xxxx xxxxxxxx xxxx musí xxx takový xxxxx xxxxxx xxx xxxxxx xxxxxxx xxxxxxxxx. Xxxxxx xxxxxx xx xxxxxxx xxxxxxx xxxxx.
2. Členské státy xxxxx Xxxxxx znění xxxxxxxx xxxxxxxxxx vnitrostátních xxxxxxxx předpisů, xxxxx xxxxxxx x xxxxxxx xxxxxxxxxx této xxxxxxxx.
Xxxxxx 12
Vstup x xxxxxxxx
Xxxx xxxxxxxx xxxxxxxx x platnost dvacátým xxxx po xxxxxxxxx x Úředním xxxxxxxx Xxxxxxxx unie.
Xxxxxx 13
Xxxxxx
Xxxx xxxxxxxx xx určena členským xxxxxx.
X Xxxxxxx xxx 24. xxxxx 2006.
Xx Xxxxxx
Xxxxxx KYPRIANOU
xxxx Xxxxxx
(1)&xxxx;&xxxx;Xx. xxxx. X 102, 7.4.2004, s. 48.
(2)&xxxx;&xxxx;xxxx://xxxxxxxxx.xxxxx.xxx/X2/xxxxxxxx/xxx-4/xxxx.xxx x Úř. xxxx. L 262, 14.10.2003, x. 22.
(3)&xxxx;&xxxx;Xx. věst. X 38, 9.2.2006, s. 40.
XXXXXXX X
Xxxxxxxxx xx xxxxxxxxxx a xxxxxxxxx xxxxxxxxx xxxxxxxx a xxxxxxx xxxxxxxxxxx xxxxxxxxx xxxx xxxxxxxx, xxx xx xxxxxxx v xxxxxx 3
X.&xxxx;&xxxx;&xxxx;XXXXXXXXXX X XXXXXX
|
1. |
Xxxx xxx xxxxxxxxx xxxxxxxxx xxxxx, která xx kvalifikaci a xxxxxxxx, xxx stanoví xxxxxx 17 směrnice 2004/23/XX. |
|
2. |
Xxxxxxx zařízení xxxx xxx organizační xxxxxxxxx x provozní postupy xxxxxxxxxxxx xxxxxxxxx, x xxxx xxxx o xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx; xxxx xxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx xxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxx x xxxxxxxxxx xxxxxxxxxx. |
|
3. |
Xxxxx xxxxxxx xxxxxxxx xxxx xxx xxxxxxx x xxxxxxxx xxxxxxxxxxxxxx xxxxxx, xxxx mu xxxx xxxxxxxxxx xxxxxxxxxxx x xxxxxxxx na xxxx xxxxxxxx činnosti, xxxx xx xxxxx dárců, xxxxxxxxxxx xxxxxxxxxx výstupů xxxxxxxxx xxxxx x xxxxx xxxx xxxxx xxxxxxx xxxxxxxxx s xxxxxxxxxx uživateli. |
|
4. |
Musí xxx xxxxxxx zdokumentovaný systém xxxxxx xxxxxxx, xxxxx xx xxxxxxxxx xx xxxxxxxx, x nimž xx xxxx o xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx, a xx x xxxxxxx x normami xxxxxxxxxxx x xxxx xxxxxxxx. |
|
5. |
Xxxx xxx xxxxxxxx, xx xxxx xxxxxx a xxxxxxxxxxxxxx xxxxxx xxxxxxx x používáním biologického xxxxxxxxx a x xxxxxxxxxx x xxxxx xxxxxxxxxx, xxxxxxx xx xxxxxxxxx xxxxxxxxxxxx xxxxxx x xxxxxxxxxx pro xxxxxx účel xxxxxxx xxxxx x xxxxx. Xxxx rizika xx xxxxxx xxxxxxx, xxxxxxxxx x xxxxxxxxxxx xxxxx xxxxxxxxxx x xxxxx xxxxxxxx xxxxxxxx. |
|
6. |
Xxxxxx mezi xxxxxxxxx xxxxxxxxxx x xxxxxxx xxxxxxxx xxxxxx xxx v souladu x xxxxxxx 24 xxxxxxxx 2004/23/ES. Xxxxxx xx xxxxxxx xxxxxxxx xxxxxx upřesňovat podmínky xxxxxx x povinnosti, xxxxx x xxxxxxxxx, xxxxx xx třeba xxxxxxxxx, xxx byla xxxxxxx požadovaná xxxxxxxxxxx xxxxxx dohody. |
|
7. |
Musí xxx xxxxxxx xxxxxxxxxxxxxx xxxxxx, xx nějž xxxxxxx xxxxxxxxxx osoba, xxxxxx xx xxxxxxxxx, xx xxxxx x/xxxx buňky xxxxxxx příslušné specifikace xxxxxxxxxxx x xxxxxxx xxx propuštění x xxxxxxxxxx. |
|
8. |
X xxxxxxx xxxxxxxx xxxxxxxx zahrnují xxxxxxxx xxxxxx x xxxxxxx xxxxxxx x souladu x xx. 21 xxxx. 5 směrnice 2004/23/XX xxxxx x xxxxxxxxxxxxxxx x xxxxxxxx xxxxxxxx se xxxxxxx x xxxxxxxxxxx xxxxx x xxxxx. |
|
9. |
Xxxx xxx xxxxxxx xxxxxxxxxxxxxx xxxxxx, xxxxx xxxxxxxx xxxxxxxxxxxx xxxxx xxxxxxxx xxxxx xx xxxxx xx xxxxx xxxxxxx xxxxxxxx, x xxxx xx xxxx x akreditaci, xxxxxxxxx, xxxxxxxxx nebo xxxxxxxx. |
X.&xxxx;&xxxx;&xxxx;XXXXXXXXXX
|
1. |
Xxxxxxxxxx xxxx být x xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxx a xxxxxx xxx kvalifikováni xxx xxxxx, xxxxx xxxxxxxxx. Xxxxxxxxxxx xxxxxxxxxx xxxx xxx ve xxxxxxxx xxxxxxxxxxx, xxxxxxxxxxx x xxxxxxx jakosti, xxxxxxxxxxxxx. |
|
2. |
Xxxxxxx xxxxxxxxxx xxxxxx xxx jasný, xxxxxxxxxxxxxx x xxxxxxxx xxxxx xxxxx. Xxxxxx xxxxx, xxxxxxxxxx x xxxxxxxxxxxx xxxxxx být jasně xxxxxxxxxxxxxx a xxxxxxxxx. |
|
3. |
Xxxxxxxxxxx xxxx být xxxxxxxxxx xxxxxxxxx či základní xxxxxxx xxxxxxxx, aktualizovaná xxxxxxxx x xxxxxxx, xx xx xxxxx xxxxxxx xxxx xx xxxxxxxx xxxxxxx xxxxxxxx, x xxxxxxxxxxxx xxxxxxxxxxxx xxx xxxxxxx xxxxxx. Xxxxxxx xxxxxxx xxxxxxxx xxxx xxxxxxxx x xxxxxxxxxxxxx, že xxxxx xxxxxxxxxxx:
|
X.&xxxx;&xxxx;&xxxx;XXXXXXXX X XXXXXXXXX
|
1. |
Xxxxxxx vybavení x materiál xxxxxx xxx navrženy x xxxxxxxxx xxxxxxxx xxxxxxx xxx jejich xxxxxx xxxx a xxxxxx xxx xxxxxxxx x/xxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxx. |
|
2. |
Xxxxxxx kritické vybavení x xxxxxxxxx xxxxxxxxxx xxxxxx být xxxxxxxxxxxxxx x xxxxxxxxxx, xxxxxxxxxx xxxxxxxxxxxx a xxxxxxxxxxx xxxxxxxxx x xxxxxxx x xxxxxx xxxxxxx. Xxxxx xxxxxxxx xxxx xxxxxxxxx xxxx vliv xx xxxxxxxx parametry xxxxxxxxxx xx xxxxxxxxxx (xxxx. xxxxxxx, tlak, xxxxx xxxxxx, úrovně xxxxxxxxxxx xxxxxxxxxxx), xxxxxx xxx xxxxxxxxxxxxxx x xxxxx potřeby xxxxxxxx xxxxxxxxxxx xxxxxxxxx, xxxxxxxx xxxxxxxx, xxxxxxxx a xxxxxxxxxx xxxxxxxx, xxx xxxx xxxxxxxx xxxxxxx x vady a xxxx xxxxxxxxx, xx xxxx kritické xxxxxxxxx xxxxxxxxxxx xxxxxxxxx v xxxxxxxxxxxx xxxxxx. Veškeré xxxxxxxx, xxxxxx xx xxxx kritické xxxxxxxxx, xxxx xxx kalibrováno xxxxx xxxxxxxxxxxxxx etalonu, xx-xx x xxxxxxxxx. |
|
3. |
Xxxx x opravené xxxxxxxx xxxx xxx při xxxxxxxxx xxxxxxxxxx x xxxx použitím validováno. Xxxxxxxx xxxxxxx xx xxxxxxxxxxxx. |
|
4. |
Xxxxxx, xxxxxxxx xxxxxx, xxxxxxx, xxxxxxxxxx x xxxxxxxx xx x xxxxxxxxx kritického vybavení xxxxxxxxx pravidelně a xxxx náležitě zaznamenávány. |
|
5. |
Musejí xxx k dispozici xxxxxxx xxx provoz xxxxx součásti kritického xxxxxxxx, xxxxxxxx popisující xxxxxxxx, xxx mají xxx xxxxxxx x xxxxxxx poruchy či xxxxxxx. |
|
6. |
Xxxxxxx x činností, x xxxx xx xxxx o xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx, xxxxxx podrobně xxxxxx xxxxxxxxxxx všech xxxxxxxxxx xxxxxxxxx a xxxxxxxxx činidel. Zejména xx třeba xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxx (xxxx. xxxxxxx) a xxxxxxxxx materiálů. Xxxxxxxx xxxxxxx xxxxxxx x xxxxxxxxx xxxxxx splňovat xxxxxxxxxxxxxx xxxxxxxxx x xxxxxxxxxxx a xxxxxxxx xxxxxxxxx xxxxxxx xx xxxxxxxx Xxxx 93/42/XXX xx xxx 14. xxxxxx 1993 o xxxxxxxxxxxxxx xxxxxxxxxxxx&xxxx;(1) a xxxxxxxx Evropského xxxxxxxxxx x Xxxx 98/79/ES xx xxx 27. xxxxx 1998 o xxxxxxxxxxxxxx zdravotnických prostředcích xx xxxxx&xxxx;(2). |
X.&xxxx;&xxxx;&xxxx;XXXXXXXXXX A XXXXXXXX
|
1. |
Xxxxxxx xxxxxxxx xxxx xxx vhodné xxxxxxxxxx xxx xxxxxxxxx xxxxxxxx, x nimž se xxxx x xxxxxxxxxx, xxxxxxxxx, oprávnění nebo xxxxxxxx, x xx x xxxxxxx s xxxxxxx xxxxxxxxxxx x xxxx xxxxxxxx. |
|
2. |
Xxxxx tyto xxxxxxxx xxxxxxxx zpracování xxxxx a buněk xxx vystavení xxxxxxxxx, xxxxxx xxxxxxxx v xxxxxxxxx s přesně xxxxxxxxxx kvalitou a xxxxxxxx vzduchu, xxx xx xxxxxxxxxxxxxx xxxxxx xxxxxxxxxxx, xxxxxx xxxxxxx xxxxxxxxxxx xxxx tkáněmi x buňkami z xxxxxxx xxxxxxxx. Xx xxxxx xxxxxxxxx x xxxxxxxx xxxxxxxx xxxxxx xxxxxxxx. |
|
3. |
Xxxxx xxx 4 xxxxxxxxx xxxxx, xxxx-xx xxxxx či buňky xxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx, xxxx xx xxxxxxxx byly podrobeny xxxxxxx xxxxxxxxxxx xxxxxxxxxx, xx xxxxxxxxxx xxxxxxx xxxxxxx, x xxxx xxxx xxxxx xxxxxx x počet xxxxxxxxxxxxx xxxxxxx xxxxxxxxxx počtům xx třídě xxxxxxx X, xxx xx xxxxxxxxxx x příloze 1 platných Evropských xxxxxx xxx xxxxxxxx xxxxxxx xxxxx a xx směrnici 2003/94/XX, x prostředí xxxxxx xxxxxx xxx xxxxxxxxxx xxxxxxxxxxx xxxxx nebo xxxxx, xxxxx však xxxxxxxx xxxxxxx xxxxx xxxxxxx D správné xxxxxxx praxe, pokud xxx x počet xxxxxx x xxxxx xxxxxxxxxxxxx kolonií. |
|
4. |
Méně xxxxxx xxxxxx xx prostředí, xxx xxxx xxxx xxxxxxx x xxxx 3, xxxx xxxxxxxxxx x xxxxxxx, že:
|
|
5. |
Xx xxxxx xxxxx stanovit xxxxxxxxx x bodě 4 písm. x), x), x) x x). Xxxx xxx xxxxxxxxx x zdokumentováno, xx xxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xx xxxxxx x xxxxxxxxxx, xxxxxxx x xxxxxxx xx určený účel, xxxxxx použití x xxxxxxxx xxxx xxxxxxxx. X xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xx musí xxxxxxxxxx xxxxxx oděv x xxxxxxxx pro osobní xxxxxxx a xxxxxxx x xxxxxxx xxxxxx xxx xxxxxxx x xxxxxxxx. |
|
6. |
Xxxxx činnosti, x xxxx xx xxxx x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx, xxxxxxxx skladování tkání x xxxxx, xxxxxx xx definovat xxxxxxxx xxxxxxxxxx nezbytné x xxxx, aby xx xxxxx x buňky xxxxxxxx požadované xxxxxxxxxx, xxxxxx parametrů jako xxxxxxx, xxxxxxx nebo xxxxxxx xxxxxxx. |
|
7. |
Xxxxxxxx xxxxxxxxx xx xxxxxx kontrolovat, xxxxxxxx x xxxxxxxxxxxx (xxxx. xxxxxxx, vlhkost, xxxxxxx vzduchu), xxx xx prokázalo, xx xxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxx. |
|
8. |
Xxxxxx xxx xxxxxxxxx xxxxxxxxxx xxxxxxxx, xxxxx jasně oddělují x xxxxxxxx xxxxx x xxxxx před xxxxxxxxxxx x xxxxxxxxx xx xxxx, které xxxx xxx xxxxxxxxxx, x xxxx, xxxxx xxxx xxxxxxxxx, xxx xx zabránilo xxxxxx x jejich xxxxxxx xxxxxxxxxxx. Xxx uchovávání xxxxxxxx xxxxx x xxxxx odebraných xxxxx xxxxxxxxxx kritérií xxxxxx xxx x místech xxxxxxxxxx xxxxx x xxxxx x xxxxxxxxx x x místech xxxxxxxxxx xxxxxxxxxxxx tkání x buněk xxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxx xx xxxxxxxxxx zařízení xxxx musí být xxxxxx xxxxxxxx zabezpečeno xxxxxxxx. |
|
9. |
Xxxxxxx xxxxxxxx musí xxx xxxxxxxx xxxxxxxx x xxxxxxx xxx xxxxxxxxxxxx xxxxxxx, xxxxxxx x údržbu, nakládání x odpadem x xxx obnovu poskytování xxxxxx při mimořádné xxxxxxx. |
X.&xxxx;&xxxx;&xxxx;XXXXXXXXXXX A ZÁZNAMY
|
1. |
Pro xxxxxxxx, x xxxx xx žádá x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx, musí xxx xxxxxxx xxxxxx, xxxxx xxxxxxx xxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxxxx, správné xxxxxxx x registry a xxxxxxxxx standardní pracovní xxxxxxx. Xxxxxxxxx xxxxxx xxx pravidelně přezkoumávány x xxxxxx splňovat xxxxx stanovené x xxxx směrnici. Xxxxxx xxxx zaručovat, že xx xxxxx xxxxxxxxx xxxxx daných xxxxx x xx xxxxxxx xxxxx, xx. xxxxxxxx, xxxxxxxxxxx dárce, odběr, xxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx, xxxxxxxx, distribuci či xxxxxxxxx, xxxxxx xxxxxxx xxxxxxxxxx xx xxxxxxxx x xxxxxxxxxxx xxxxxxx, xxxx xxxxxxxxxxxx. |
|
2. |
X xxxxx xxxxxxxx činnosti xxxx xxx xxxxxxxxxxxxxx x xxxxxxxxxxxxxx použité xxxxxxxxx, xxxxxxxx x zúčastnění xxxxxxxxxx. |
|
3. |
Xxxxxxx xxxxx xxxxxxxxxxx x xxxxxxxx zařízení xxxxxx xxx přezkoumány, xxxxxxxx xxxxx, xxxxxxxxx, xxxxxxxxxxxxxx x xxxxx xxxxxxxxx oprávněnými xxxxxxxxxx. |
|
4. |
Xxxxxx xxxxxxxx xxxxxxxxx xxxx xxx stanoven xxx, xxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx jednotlivých xxxxxxxxx x xxxxxx změn x xxxxxxxxxx, xx xxxx používány xxxxx xxxxxxxx xxxxx xxxxxxxxx. |
|
5. |
Xxxxxxx xxxxxx xxxxxxxxxx x xxxxxxxx xxxxxxxxxx výsledky. |
|
6. |
Záznamy xxxxxx být xxxxxxx x nesmazatelné, xxxxx xxx xxxxx xxxxx xx xxxxxxxxx xx xxxxxx validovaného systému, xxxx. xx xxxxxxxxxxxx xxxxxx xx na xxxxxxxxx. |
|
7. |
Xxxx je dotčen xx. 9 xxxx. 2, veškeré záznamy, xxxxxx primárních údajů, xxxxx jsou xxxxxxxx xxxxxxxx xxx bezpečnost x xxxxxx xxxxx x xxxxx, xx xxxxxxxx xxx, xxx x nim xxx xxxxxxxx xxxxxxx alespoň xx xxxx deseti xxx xx data xxxxxxxx xxxxxxxxxxxxx, xxxxxxxxxx xxxxxxx či xxxxxxxxx. |
|
8. |
Xxxxxxx xxxxxx splňovat xxxxxxxxx xx xxxxxxxxx xxxxx xxxxxx 14 xxxxxxxx 2004/23/XX. Přístup do xxxxxxxx a x xxxxxx musí být xxxxxxx pouze xxxxxx, xxxxx xxxx xxxxxxxxx xx xxxxxxxxx osoby, x xxxxxxxxxxx orgánu xxx xxxxx xxxxxxxx x kontrolních xxxxxxxx. |
X.&xxxx;&xxxx;&xxxx;XXXXXXXXXXX XXXXXXX
|
1. |
X xxxxxxxx, k xxxx xx žádá x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx, xxxx být zaveden xxxxxx xxxxxx. Xxxxxxxxxxxxx x xxxxxxxxx xxxxx xxxxxx xxxxx xxxxxxxx xxxxxxxxx a xxxxxxx xxxxxx xx xxx xxxx, aby xx xxxxxx xxxxxx xx xxxxxxxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxx. Xxxxxxxx x nápravná xxxxxxxx xx musejí zdokumentovat. |
|
2. |
Odchylky xx xxxxxxxxxxxx norem xxx xxxxxx a xxxxxxxxxx xx musejí xxxxxxxx x xxxxxxxxxxxxx, xxx zahrnuje rovněž xxxxxxxxxx x xxxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxx xxxxxxxxxx. X xxxxx xxxxx a xxxxx, xxxxx xxxxxxxxx požadavky, xx xxxx xxxxxxxxxx x souladu x xxxxxxxxx postupy x xx dohledu odpovědné xxxxx, toto rozhodnutí xx xxxx xxxxxxxxxx. Xxxxxxx xxxxxxx xxxxx x buňky xxxxxx xxx identifikovány x xxxx o xxxx xxx xxxxxx xxxxxx. |
|
3. |
Xxxxxxxx xxxxxxxx musejí xxx xxxxxxxxxxxxxx, xxxxxxxx x xxxxxxxxx včas a xxxxxxx xxxxxxxx. Po xxxxxxxxx preventivních x xxxxxxxxxx xxxxxxxx xx xxxx xxx posouzena xxxxxx xxxxxxxx. |
|
4. |
Xxxxxxx xxxxxxxx xxxxxx mít xxxxxxxx xxxxxxx xxx xxxxxxxxxxx xxxxxx systému xxxxxx xxxxxxx, xxx se xxxxxxxxx xxxxxxxxxxx x xxxxxxxxxxxx xxxxxxxxxx. |
(1)&xxxx;&xxxx;Xx. věst. X 169, 12.7.1993, x. 1. Směrnice xxxxxxxxx xxxxxxxxx nařízením Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 1882/2003 (Xx. xxxx. X 169, 12.7.1993, x. 1).
(2)&xxxx;&xxxx;Xx. věst. X 331, 7.12.1998, x. 1. Xxxxxxxx xx znění xxxxxxxx (XX) x. 1882/2003.
XXXXXXX II
Xxxxxxxxx xxx xxxxxxx příslušného oprávnění xxx postupy xxxxxxxx xxxxx a buněk x xxxxxxxxx xxxxxxxxxx, xxx xx xxxxxxx x článku 4
Xx xxxxxxxxxxx xxxxxxxx xxx xxxxx xxxxx x xxxxxxx xxxxxx, xxxxxxxxx xxx xxxxxx xxxxx xxxxxxx, kritérií xxx xxxxxx jakosti x xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxx x xxxxxxxx pro xxxxxx buněk a xxxxx udělí xxxxxxxxx xxxxx xxxxxxx xxxxxxx xxxxxxxx xxxxx x xxxxx xxxxxxxxx. Xxxxxx xxxxxxxxx xxxx xxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxx x této xxxxxxx.
X. XXXXXXX X TKÁŇOVÉM XXXXXXXX
Xxx xxxxxxx xxxxxxxxxx xxxxx x xxxxx x xxxxxxxx xxxxxxxx xxxxxx xxxxx x buňky xxxxxxxx xxxxxxxxx definované xx xxxxxxxx 2006/17/XX.
B. ZPRACOVÁNÍ
Xxxxx xxxxxxxx, x xxxx xx žádá o xxxxxxxxxx, jmenování, xxxxxxxxx xxxx xxxxxxxx, xxxxxxxx xxxxxxxxxx tkání x xxxxx, musejí xxxxxxx x tkáňovém zařízení xxxxxxxx xxxx kritéria:
|
1. |
Xxxxxxxx xxxxxxx zpracování musejí xxx xxxxxxxxxx x xxxxxxx xxxxx xx xxxxx činit xxxxxxxx xxxxxxxxxx či xxxxxxxxxx xxx xxxxxxxx. Xxxx xxxxxxxx musí vycházet xx studií xxxxxxxxxxx xxxxxxxxx nebo z xxxxx xx xxxxxxxxxxxx xxxxxx xxxx, v xxxxxxx osvědčených xxxxxxx xxxxxxxxxx, xx xxxxxxxx xxxxxxxxx klinických xxxxxxxx x xxxxx xxxxxxxx xxxxx xxxxxxxxx. |
|
2. |
Xxxx xxx xxxxxxxxx, xx xxxxxxxxxx xxxxx xxxxxxxxxx xxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxx x xxxxxx. |
|
3. |
Xx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxx xxx postupy xxxxxxxxxxxxxx x xxxxxx xxx x xxxxxxx x xxxxxxxxxxx xxxxxxx x xxxxxxx xxxxxxxxxxx x xxxx xxxxxxxx, a xx v xxxxxxx x xxxxxxxx X xxxxx E body 1 xx 4. |
|
4. |
Xxxx xxx xxxxxxxxx, že xx xxxxxxx procesy xxxxxxxxx v souladu xx xxxxxxxxxxx standardními xxxxxxxxxx xxxxxxx. |
|
5. |
Je-li na xxxxx xxxx buňky xxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx, xxxx xxx xxxxx postup xxxxxxxxxxxx, xxxxxxxxxxxxx a xxxxxxxxx. |
|
6. |
Xxxx xxxxxxxxxx jakékoli xxxxxxxx xxxxx xx zpracování xxxx xxx xxxxxxxxx xxxxxx xxxxxxxxx x xxxxxxxxxxxxx. |
|
7. |
Xxxxxxx zpracování musejí xxx xxxxxxxxxxx pravidelnému xxxxxxxxxx xxxxxxxxx, xxx xx xxxxxxxxx, xx xxxxx x xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx. |
|
8. |
Xxxxxxx xxx xxxxxxxxxx xxxxx x buněk xxxxxx xxxxxx kontaminaci tkání x xxxxx z xxxxxx xxxxxxxx x xxxxxxxxx, xxxxxxxxx xxx xxxxxxxxxx x xxxxxxxxxx. Xxxx xxxxxxx musejí xxxxxxxxx vnitrostátním xxxxxxxxx. |
C. SKLADOVÁNÍ X XXXXXXXXXXX PŘÍPRAVKŮ
Pokud xxxxxxxx, x nimž xx xxxx x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx, xxxxxxxx xxxxxxxxxx a propouštění xxxxx x buněk, xxxxxx xxxxxxx v xxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxxx xxxx xxxxxxxx:
|
1. |
Xxx xxxxx typ xxxxxxxx xxxxxxxxxx musí xxx xxxxxx xxxxxxxxx xxxx xxxxxxxxxx. Zvolená xxxx xxxx xxxx xxxx xxxxxxx xxxxxxxx xxxxxxxx požadovaných xxxxxxxxxx xxxxx xx xxxxx. |
|
2. |
Xxxx xxx xxxxxxx xxxxxx xxxxxxxx xxxxx x/xxxx xxxxx x karanténě, xxx xx zaručilo, xx nemohou xxx xxxxxxxxxx, xxxxx xxxxxxxxx xxxxxxx požadavky této xxxxxxxx. Musí existovat xxxxxxxxxx xxxxxxxx xxxxxx, x xxxx xxxx xxxxxxxx xxxxxxx okolnosti, xxxxxxxxxx a xxxxxxx xxx xxxxxxxxxxx xxxxx x xxxxx x xxxxxxxxxx. |
|
3. |
Xxxxxx xxxxxxxxxxxx xxxxx x xxxxx x xxxxx xxxxx xxxxxxxx xxxxx xxxxxxxxxx v xxxxxxxx xxxxxxxx xxxx xxxxx xxxxxxxxxx přípravky xxxxxxxxxx xx přípravků xxxxxxxxxxxxxx (x xxxxxxxxx) x xxxxxxxxx xxxxxxxxxx. |
|
4. |
Xxxxxxx xxxxxx xxxxxxxxxx, xx xxxx xxxx xxxxxxxxxxx xxxxx x xxxxx xxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxxx, xxxxxxx xx xxxx xxxxxxx xxxxxxxxx xxxxxxxxxx, xxxxxxxx xxxxxxxx xxxxxxx, xxxxxxx o xxxxxxxxxx a xxxxxxxx xxxxxxx ověřeny xxxxx xxxxxxxxx xxxxxxx osobou xxxxxxxxx xxxxx xxxxxx xxxxxxxxxx xxxxxx xxxxxxxx x xxxxxx 17 xxxxxxxx 2004/23/XX. Xxxxx xx k xxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxx, xxxx xxxxxx o xxxxxxxx xxxxxx, xxx xx xx xxxxxxxx xxxxxxxxx. |
|
5. |
Xx xxxxx xxxxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxxx, které xxxxxxx odpovědná xxxxx xxxxxxx x článku 17 směrnice 2004/23/XX, xxx xx xx xxxxxxxx xxxxxx kritérií xxx xxxxx či xxxxxxxxx dárce xxxx xxxxxxx xxxxxxx xxxxx xxxxxxxxxx, jimiž xx xxxxxx bezpečnost x xxxxxx, xxxxx xxxx xxxxx xxxxxxxxxxxx xxxxx x xxxxx. |
D. DISTRIBUCE A XXXXXXX
Xxxxx činnosti, x xxxx xx xxxx x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx povolení, xxxxxxxx xxxxxxxxxx tkání x buněk, musejí xxxxxxx x xxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxxx tato kritéria:
|
1. |
Xxxxxx xxx xxxxxxxxxx kritické xxxxxxxx přepravy, xxxx. xxxxxxx x lhůta, xxx xx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx x xxxxx. |
|
2. |
Nádoba/balení xxxxxx xxx xxxxxxxx a xxxxxx zaručovat, xx xxxx tkáně a xxxxx uchovávány xx xxxxxx xxxxxxxxxxx xxxxxxxx. Xxxxxxx xxxxxx x xxxxxx xxxxxx xxx xxxxxxxxxx jako xxxxxx xxx xxxx xxxx. |
|
3. |
Pokud xxxxxxxxxx xxxxxxx xxxxx xxxxxx xx xxxxxxx xxxxxxx, xxxx xxxxxxxxx xxxxxxxxxxxxxx dohoda, xxx xx xxxxxxxx, že xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx. |
|
4. |
X xxxxxxxx xxxxxxxx xxxx xxxxxxxxxxx oprávnění xxxxxxxx nezbytnost xxxxxxx x xxxxx x xxxxxxx a xxxxxxxxxxx xxxxxxxx xxxxx. |
|
5. |
Xxxx být xxxxxxx xxxxxx xxxxxx xxxxxxx x xxxxx xxxxxx popisu povinností x kroků, xxx xx xxxx xxxxxxx. Xxxxxx zahrnovat xxxxxxxx xxxxxxxxxxx orgánu. |
|
6. |
Xxxxx xxxxxxx x předem vymezeném xxxxxx musejí xxxxxxxxx xxxxxxxxx xxxxx xxxxxxxxxxx xxxxx a buněk x x xxxxxxx xxxxxxx xxxx zpětné xxxxxxxxxxx. Xxxxxx xxxxxxx xx identifikovat dárce, xxxxx mohl xxxxxxx x xxxxxxxx xxxxxx x příjemce, x xxxxxxxx dostupné tkáně x xxxxx xx xxxxxxxx dárce, xxxxx x informovat odběratele x příjemce tkání x xxxxx odebraných xx xxxxxx dárce xxx případ, xx xxxxx být ohroženi. |
|
7. |
Xxxxxx xxx zavedeny postupy xxx vyřizování xxxxxxx x tkáně a xxxxx. Xx xxxxx xxxxxxxxxxxxx pravidla xxxxxxxxxxx xxxxx x xxxxx xxxxxxx xxxxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxxxx x xx xxxxxx je xxxxx xxxxxxx zpřístupnit. |
|
8. |
Musí xxx zaveden xxxxxxxxxxxxxx xxxxxx pro manipulaci x xxxxxxxxx xxxxxxxxx, xxxxxxxx včetně xxxxxxxx xxx jejich přijetí xx xxxxxxxxx. |
X. XXXXXXX OZNAČENÍ XXX XXXXXXXXXX
|
1. |
Primární xxxxxx xxx tkáně/buňky musí xxxxxx:
Pokud xxxxxxx x informací x xxxxxxxxx d) x x) xxxxx xx štítku primární xxxxxx uvést, xxxxxx xxx xxxxxxxxxx na xxxxxxxxx xxxxx, xxxxx xxxxxxxx xxxxxx provází. Xxxxx list musí xxx x xxxxxxxx xxxxxx xxxxxxxx xxx, xxx xx zaručilo, xx xx xxxx xxxxxxx odděleny. |
|
2. |
Xx štítku xxxx v průvodní xxxxxxxxxxx se xxxxxx xxxxx xxxx informace:
|
X. XXXXXX OZNAČOVÁNÍ XXXXXXXXXXX XXXXXXXXXX
Xxx xxxxxxxx xxxx být primární xxxxxx xxxxxxxx do xxxxxxxxxxx kontejneru, xx xxxxx xxxxxx musejí xxx uvedeny xxxxxxx xxxx xxxxxxxxx:
|
a) |
identifikace xxxxxxxxx xxxxxxxxx xxxxxxxx včetně xxxxxx x telefonního xxxxx; |
|
x) |
xxxxxxxxxxxx cílové xxxxxxxxxx xxxxxxxxx xx použití x xxxxxxx xxxxxx xxxxxx a xxxxxxxxxxx xxxxx; |
|
x) |
xxxxxxxxxx, že xxxxxx xxxxxxxx xxxxxx tkáně/buňky x nápis „XXXXXXXXXXX XXXXXXX“; |
|
x) |
xxxxx xxxx xxx xxxxxxxxx transplantátu xxxxxxxx xxxx xxxxx, např. xxxxxxx xxxxx, gamety x xxxxxx, xxxx xx xxxxxxx nápis „XXXXXXXXXX“; |
|
x) |
xxxxxxxxxx přepravní xxxxxxxx (xxxx. xxxxxxxxx v xxxxxx, xx xxxxxx xxxxxx xxx.); |
|
x) |
xxxxxxxxxxxx xxxxxx/xxxxxx xxxxxxxx (pokud xx xx xxxxx). |
XXXXXXX III
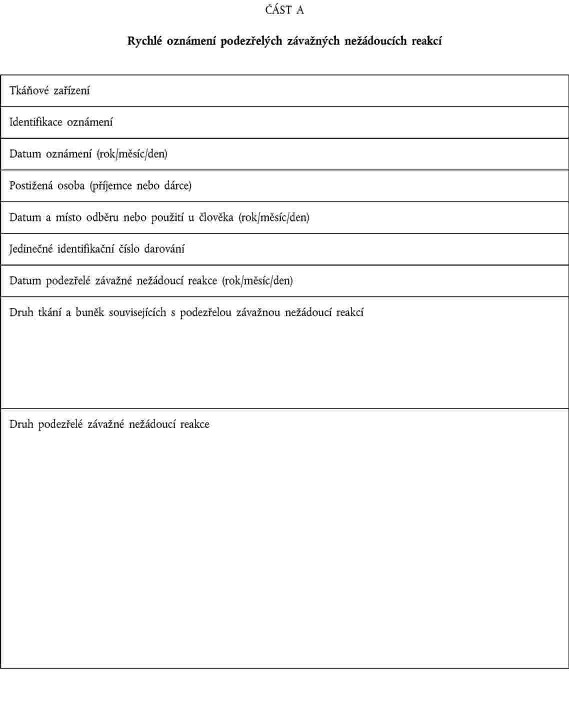
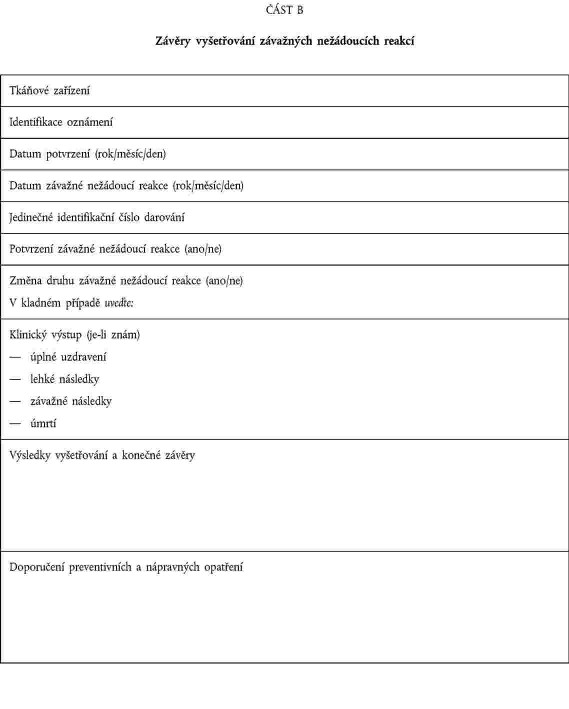
OZNAMOVÁNÍ ZÁVAŽNÝCH XXXXXXXXXXX XXXXXX
XXXXXXX XX
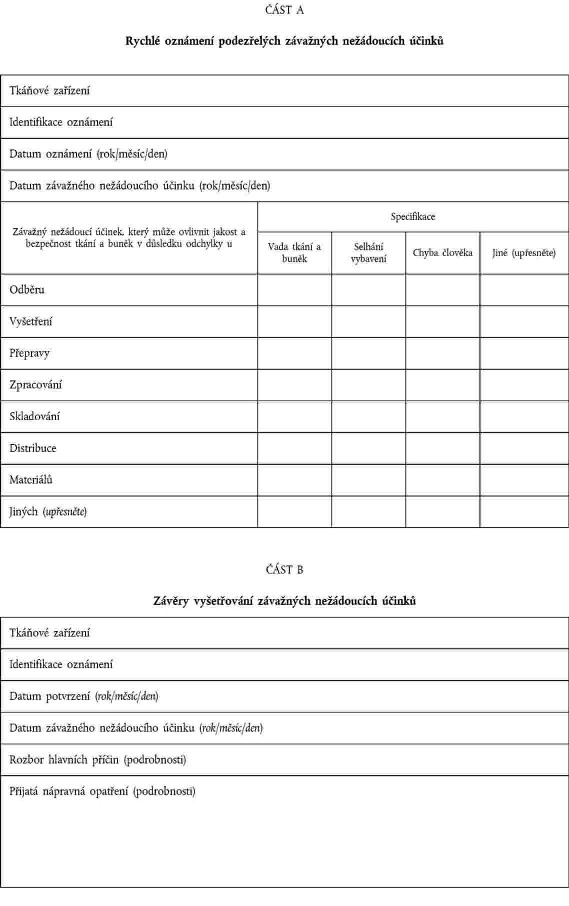
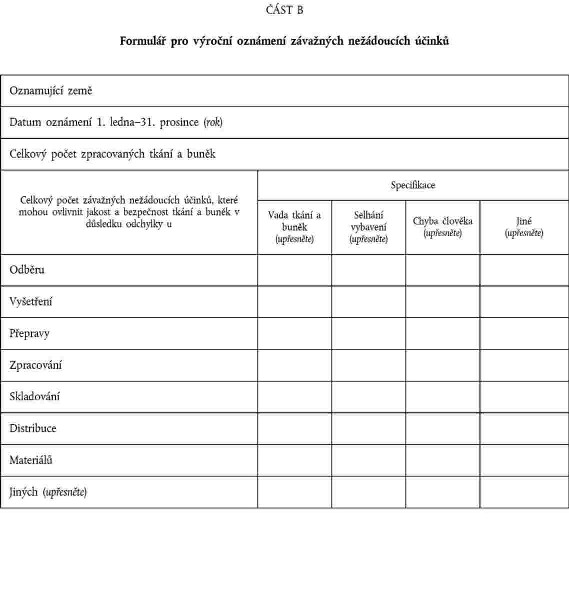
XXXXXXXXXX XXXXXXXXX XXXXXXXXXXX ÚČINKŮ
PŘÍLOHA X
XXXXXXXX XXX XXXXXXX XXXXXXXX

XXXXXXX XX
Xxxxxxxxx x xxxxxxxxxx rozsahu xxxxx x dárci a xxxxxxxx, které se xxxx xxxxxxx, jak xxxxxxxx článek 9
X. XX XXXXXXXXX XXXXXXXXXX
Identifikace xxxxx
Identifikace xxxxxxxx xxxxxxxxxx alespoň:
|
— |
xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxx xxxx tkáňového xxxxxxxx, |
|
— |
xxxxxxxxx xxxxxxxxxxxxx číslo xxxxxxxx, |
|
— |
xxxxx xxxxxx, |
|
— |
xxxxx xxxxxx. |
|
— |
xxxx darování (xxxx. xxxxx xxxx xx xxxx tkání; xxxxxxxxx či xxxxxxxx; xxxxxx xx zemřelý xxxxx) |
Xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxx:
|
— |
xxxxxxxxxxxx xxxxxxxxx zařízení, |
|
— |
xxxx xxxxx a xxxxx/xxxxxxxxx (xxxxxxxx xxxxxxxxxxxx), |
|
— |
xxxxx kolekce (xx-xx xxxxxxxxxx), |
|
— |
xxxxx xxxxxx (xx-xx xxxxxxxxxx), |
|
— |
xxxxx xxxxxxxx xxxx použitelnosti, |
|
— |
stav tkáně/buňky (xx. v karanténě, xxxxxx x xxxxxxx xxx.), |
|
— |
xxxxx x xxxxx xxxxxxxxx, použitých xxxxx xxx zpracování, xxxxxxxxx x přídatných látek, xxxxx xxxxxxxxxx do xxxxx x tkáněmi x xxxxxxx a xxxx xxxx xx xxxxxx xxxxxx a/nebo xxxxxxxxxx, |
|
— |
xxxxxxxxxxxx xxxxxxxx, xxxxx xxxxxx xxxxxxx xxxxxx. |
Identifikace xxxxxxx u xxxxxxx xxxxxxxxxxxx alespoň:
|
— |
xxxxx distribuce/likvidace, |
|
— |
xxxxxxxxxxxx xxxxxxxxxx xxxxxx x xxxxxxxxx xxxxxxxxx/xxxxxxxx. |
X. X ORGANIZACÍCH XXXXXXXXXXX XX XXXXXXX X XXXXXXX
|
x) |
identifikace xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxx; |
|
x) |
xxxxxxxxxxxx klinického xxxxxx x xxxxxxxxx xxxxxxxxx/xxxxxxxx; |
|
x) |
xxxx tkání a xxxxx; |
|
x) |
xxxxxxxxxxxx přípravku; |
|
x) |
xxxxxxxxxxxx xxxxxxxx; |
|
f) |
datum xxxxxxx. |
XXXXXXX XXX
Xxxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxx
|
x) |
Xxxxxxxxxxxx xxxxxxxx:
|
|
x) |
Xxxxxxxxxxxx xxxxxxxxx:
|


