XXXXXXXX XXXXXX (XX) 2015/566
xx dne 8. xxxxx 2015,
kterou xx xxxxxxx xxxxxxxx 2004/23/ES, xxxxx xxx o postupy xxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxxx xxxxx xxx dovážené tkáně x xxxxx
(Xxxx x významem xxx EHP)
XXXXXXXX XXXXXX,
s ohledem xx Xxxxxxx x xxxxxxxxx Xxxxxxxx unie,
x xxxxxxx xx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2004/23/ES xx xxx 31. xxxxxx 2004 x xxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxxx norem xxx xxxxxxxx, odběr, xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxx x xxxxx (1), x xxxxxxx xx xx. 9 xxxx. 4 uvedené xxxxxxxx,
xxxxxxxx k těmto xxxxxxx:
|
(1) |
Směrnice 2004/23/XX stanoví v zájmu xxxxxxxxx xxxxxx úrovně xxxxxxx lidského zdraví x Xxxx jakostní x xxxxxxxxxxxx xxxxx pro xxxxxxxx, xxxxx, vyšetřování, xxxxxxxxxx, xxxxxxxxxx, skladování x xxxxxxxxxx xxxxx xxxxxxxx xxxxx x xxxxx xxxxxxxx x xxxxxxx x xxxxxxx x xxx xxxxxxxx, xxxxx x xxxxxxxxxxx xxxxxxxx xxxxx x xxxxx obsažených x xxxxxxxxxxx xxxxxxxx k použití x xxxxxxx, pokud xx xx xxxx xxxxxxxxx xxxxxxxx jiné xxxxxx xxxxxxxx Xxxx. |
|
(2) |
X xxxxxxxxxxx xxxxxx xxxxx x xxxxx xxxxxxx xx stále xxxxxx xxxxxxx, a směrnice 2004/23/XX xxxxx xxxxxxxx, xxx xxxxx tkání x xxxxx xxxxxxxxxxx xxxxxxx zařízení, xxxxx pro xxxxx xxxx xxxxxxxxxxxx či xxxxxxxxx členské xxxxx xxxx xxx udělily xxxxxxxxx či povolení. Xxxxxxx x xxxxxxxxx xxxxxxxxx xxxx xxxxxxxxx x xx. 9 xxxx. 3 směrnice 2004/23/ES, xxxxx xxxxxxxx příslušným xxxxxxx, xxx přímo xxxxxxxx xxxxx určitých xxxxx x xxxxx xx xxxxxxxx xxxxxxxxxxx v článku 6 xxxxxxxx Xxxxxx 2006/17/XX (2) xxxx x xxxxxxxxx xxxxxxx. Xxxx výjimky jsou xxxxxxxxx pravidelně, xxxx xxxx, xxx povolování xxxxxx krvetvorných xxxxxxxxx xxxxx z kostní xxxxx, xxxxxxxxx xxxx nebo xxxxxxxxxxx xxxx, xxxxx xxxx xxxxxxxxx xxx xxxxx řady onemocnění xxxxxxxxxxxx xxxxxx xxxxx. |
|
(3) |
Xxxxxxxx 2004/23/XX dále vyžaduje, xxx xxxxxxx xxxxx x xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx, xx xxxxx xxxxx a buněk xxxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxx xxxxxxxxxx normám, které xxxx stanoveny xx xxxxxxxx 2004/23/XX, x xxxxxx xx xxxxxxx xxxxxxx xxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxxx norem xxx xxxxx xxxxx x xxxxx. Tyto xxxxxxx xx xxxx xxx xxxxxxxxx v této xxxxxxxx, xxxx xxxx xxxxxxx xxxxxx xxxxxxxx Unie x xxxxxxx xxx. |
|
(4) |
Zejména xx xxxxxx stanovit programy xxxxxxxxxxx a inspekcí xxxxxxxxxx xxxxxxxxx proces xxxxxxxx xxx xxxxxxxx xxxxxxxxxxx x xxxxxxx x xxxxxxx xxxxxxxxx x Xxxx. Xxxx xx xxxxxx stanovit xxxxxxx, xxxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxxxx zařízení xx xxxxxx x xxxxxxxxxxx xx třetích xxxx. |
|
(5) |
X xxxxxxxx xxxxxx, xxxxx xxxxx xxxxxxxx xxxxxxxxx xxxxxx xxxxx xx. 9 odst. 3 xxxxxxxx 2004/23/ES, xxxx xxxxxxx xxxxx xxxxx x xxxxx xx xxxxxxx xxxx provádět xxxxxxxxxx xxxxxxx zařízení. V případech, xxx příslušné xxxxxx xxxxx xxxxxx xxxxx xxxxx čl. 9 odst. 3 xxxxxxxx 2004/23/XX, musí xxxxxxxxx orgány zajistit, xxx uvedený dovoz xxxxxxxx jakostní x xxxxxxxxxxxx xxxxx rovnocenné xxxxxx xxxxxxxxxx x xxxxxxx xxxxxxxx. |
|
(6) |
Xxxxx x xxxxx by xxxx xxx za xxxxxxxxxx xxxxxxxxx dováženy bankami xxxxx nebo xxxxxxxxxxxx xxxxxxxxxx, které xxxx xxxxxxxxxxxx či jmenovány xxxx jim xxxx xxxxxxx oprávnění xx xxxxxxxx xxxx xxxxxxxxxxx xxxxxxxx zařízením pro xxxxx dovozu. Banky xxxxx nebo nemocniční xxxxxxxx xx měly xxx xxxxxxxxxx za xxxxxxxxxx tkáňová zařízení, xxxxx xxxx xxxxxxx xxxxxxxxx ujednání x xxxxxxxxxxx xx třetí xxxx xx xxxxx xxxxx x xxxxx. Jestliže xx xxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxxxxx xx xxxxx xxxx xxxxxxx xxxxxxxxxx xxxxxxxxxxxxxxxxxxx xxxxxx x xxxxx xxxxxxxx xxxxx xxxxx x xxxxx, avšak nikoli xxx xxxxxxx dovoz, xxxxx by xxx xxxxxxxxx za dovážející xxxxxxx xxxxxxxx. Členské xxxxx xxxxx tyto xxxxxx regulovat xxxx xxxxxx působnosti této xxxxxxxx. |
|
(7) |
Xxxx-xx xxxxxxx xxxxxxxxx xxxxxxxx xx dovoz xxxxx x xxxxx x xxxxxxxxxxx xx xxxxx země xxxx xxxxxxxx, xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xx xxxxxxx x xxxxxxx, xxxxxxx xxxxxxxx přípravků xxx xxxxxxx xxxxxxx, xxxxxx x xxxxxxxxx nebo xxxxxxxxxxx, měly by xxx považovány xx xxxxxxxxxx tkáňové xxxxxxxx. Xxxx xxxxxxxx xxxx xxxxxxxx požadavky této xxxxxxxx x xxxxxx xxxxxxx xxxxxxxxx xxxxxxxxxx směrnice 2004/23/XX a jejich xxxxxxxxx xxxxxx xx xxxx xxxxxxxxxxx či jmenovat xxxx xxx musí xxxxxx oprávnění xx xxxxxxxx coby xxxxxxxxxxx xxxxxxxx zařízením xxx xxxxx xxxxxx. Xxxxxxxx x xxxxxxxxxx xx dovoz xxxx xxxxxxxx také xxxxxxxxx xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx nebo xxxxxxxxxx xxxxxxxxxx xxxxx x xxxxx, xxxx být xxxxxx akreditovány či xxxxxxxxx xxxx xxx xxxx xxx xxxxxxx xxxxxxxxx xxxx xxxxxxxx xxx xxxxx těchto xxxxxxxx xxxxxx xxxxxxxxxxx xxxxxx; xxxx xxxx xxxxxxxx požadavky xxxxxxxx 2004/23/XX. Xxxxx xxxx xxxx xxxxx xxxxxx xxxxx a buňky xxxxxxxxxxx xx xxxxxxx zemí xx xxxx xxxxx xxxx xxxxxxxxxxxx jednotek x Xxxx, které xxxx xxxxxxxxxxxx či jmenovány xxxx xxx xxxx xxxxxxx xxxxxxxxx xx xxxxxxxx xxxx dovážejícím xxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxx. |
|
(8) |
Xxxxxxxx jsou xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxx xxxxxxxxxxxx xx xxxxxxxxx xxxx xxx xxxx uděleno oprávnění xx xxxxxxxx xxxx xxxxxxxx xxxxxxxxx xxx xxxxxxxx, xxxxx vykonávají x Xxxx, mohou xxxxxxx xxxxx přizpůsobit své xxxxxxx xxx xxxxxxxxx xxxxxxxxx, xxxxxxxx x xxxxxxxx xxxxx, xxxxxxxx xxxxx xxxxxxxx xxxxxxx xxxxxxxxx x xxxx xxxxxxxx. |
|
(9) |
V zájmu xxxxxx xxxxxxxxxx xxxxxxxxxx tkání x xxxxx x Xxxx, xxxxxx xxxxxxx přeshraniční xxxxxxxxxx, xx příslušný xxxxx xxxx orgány měly xxxxx osvědčení x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx. |
|
(10) |
Xxxxxxxxx xxxxx xxx xxxxxxxxx, xxx xxxxxxxx xxxxx x xxxxx splňují xxxxxxxx x xxxxxxxxxxxx xxxxx, xxxxx jsou rovnocenné xxxxxx xxxxxxxxxx xx xxxxxxxx 2004/23/XX, xxxxx xxxxxxxx. Členské xxxxx xx xxxxx xxxxxxxx, xxx v příslušných xxxxxxxxx xxxxxx prováděly xxxxxxxx x xxxxxxxxxx ze třetích xxxx a aby spolupracovaly x xxxxxxxxx xxxxxxxxx xxxxx, xx xxxxx xxxxx xxx xxxxxxxx xxxxx x xxxxx distribuovány. Odpovědnost xx xxxxxxx nejvhodnějších xxxxxxxx x xxxxxxxxxx, zda xx třeba u dodavatelů xx xxxxxxx xxxx xxxxxxxx xxxxxxxx xx xxxxx, náleží xxxxxxxx xxxxxx, x xxxxx xxxx xxxxxxxx xxxxxxxxxx tkáňová xxxxxxxx. |
|
(11) |
Xxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxx týkající se xxxxxxxx pro příslušné xxxxxx (Xxxxxxxxxxx Xxxxxx xxx Xxxxxxxxx Xxxxxxxxxxx xx xxxxxxxxxxx), která xxxx xxxxxxxx inspekce xxxxxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxx dodavatelů xx xxxxxxx xxxx; při xxxxxxxxx xxxxxxxx může xxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxxxxx xxxx xxxxxxxxxx xxxxxxxx. |
|
(12) |
Dovážející xxxxxxx xxxxxxxx xx xxxx xxxxxx, xx xxxxx x xxxxx, xxx xxxxxxxx xx Xxxx, splňují xxxxxxxx x xxxxxxxxxxxx normy, xxxxx xxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxxxxxxx xxxxxx xxxxxxxxxx ve xxxxxxxx 2004/23/XX. Xxxxxxx xxxxx xxx zajištění, xxx xxxxxx ověřování proběhlo, x xxxxxxx zajištění sledovatelnosti xx x xxxxx a kontroly, xxx xxxx xxxxxxxx xxxxxx xxxxxxxxxxxx x xxxxxxxxxxx xxxxxxxx x xxxxxxx xx xxxxxxxx 2004/23/ES, představují xxxxxxx xxxxxx x xxxxxxxxxx xx xxxxxxx zemí x xxxxxxxxxxx, která xx xxx xxxxxx x xxxxxxxxxx xxxxxxxxxx orgánům. Xxxxxxxxxx xxxxxxx xxxxxxxx xx xxxxxx xxxxxxxx, aby x xxxxx dodavatelů xx xxxxxxx zemí xxxx xxxxxxx tohoto xxxxxxxxxxx xxxxxxx prováděly xxxxx. |
|
(13) |
Xxxxxxxxxx xxxxxxx xxxxxxxx xx xxxx zajistit, xx xx xx xxxxxxxx xxxxx a buňky x xxxxxxx xx xxxxxxxx Komise 2006/86/XX (3) xxxxxxxxxx xxxxxxxx xxxxxxxx xxx, x xx xxx tak, xx xxxx povinnost xxxxx xxxx, xxxx xx xxxxxx xxxxxxxxxx ze xxxxxxx xxxx coby xxxxxxx xxxxxxxx xxxxxxx xxxxxx, kterou s nimi xxxxxxxx. |
|
(14) |
Xxxxxxx xxxxx xx xxxx xxx možnost xxxxxx x xxxxxxx jednorázového xxxxxx xxxxxxx z požadavků xxxxxxxxxxx x xxxx xxxxxxxx, xxxxx jde x xxxxxxxxxxx x xxxxxxx xxxxxx. Xxxxxx xxxxxxxxxxx xxxxx by xxxxxxx měla provádět xxxxxxxxxx xxxxxxx xxxxxxxx, xxx byla xxxxxxxxxxxx xx xxxxxxxxx xxxx xxxx xxxx uděleno xxxxxxxxx xx povolení, x xxxxxx by x xxxx xxxxxx xxxxxxxx pravidelně xxxx opakovaně xx xxxxxxxx xxxxxxxxxx ze xxxxx xxxx. Xxxx xxxxxxx xx měly xxx omezeny na xxxxxxx, xxx určitá xxxxx (nebo xxxxx) xx nebo xxxx xxx svoji xxxxxxx xxxxxxx xx xxxxx xxxx xxxxxxxxxx tkáně xxxx xxxxx – xxxxx xx xxxxxxx x xxxxxxx darování reprodukčních xxxxx xxxx partnery, xxxxxxxx xxxxxx x xxxxxxxxxxx xxxxxxx nebo darování xxxxxx xxxxxxx příbuzným – x xxxxxxxx xx xxxxx sama xx xxxx xxxx xxxxx xx xxxxx xxxxxx xx Xxxx. X xxxxxxxx xxxxxx xxxxxxxxxxxx xxxxx xxxxx xxxx buňky xx x xxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxx x xxxxxx xxxxxx xxxxx více xxx jednou x xxxx xxxxxxxx by xxxxxx xxx xxxxx xxxx xxxxx xxx xxxxx xxxxxx. |
|
(15) |
Xxxx směrnice nebrání xxxxxxxx státům xxxxxxxx xxxx xxxxxx přísnější xxxxxxxx xxx dovoz xxxxx x xxxxx, xxxxxxx x xxxxx xxxxxxxxxx xxxxxx xxxxxxxxxxxx x xxxxxxxxxxx xxxxxxxx xx xxxxxxxx, xx xxxx xxxxxxx xxxxxxxxxx Xxxxxxx. |
|
(16) |
Xxxxxxxx stanovená xxxxx xxxxxxxx xxxx x xxxxxxx xx xxxxxxxxxxx Xxxxxxxxxxxxx xxxxxx pro xxxxx x xxxxx xxxxxxxxx xxxxx xx. 29 xxxx. 3 směrnice 2004/23/XX, |
XXXXXXX TUTO XXXXXXXX:
XXXXXXXX I
OBECNÁ XXXXXXXXXX
Xxxxxx&xxxx;1
Xxxxxx xxxxxxxxxx
1.&xxxx;&xxxx;&xxxx;Xxxx směrnice xx xxxxxxx xx xxxxx xx Unie:
|
a) |
lidských xxxxx x&xxxx;xxxxx xxxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxx x |
|
x) |
xxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxx tkání x&xxxx;xxxxx xxxxxxxx x&xxxx;xxxxxxx u člověka, xxxxx xx xx xxxxxx xxxxxxxxx xxxxxxxxxx xxxx xxxxxx xxxxxxxx Xxxx. |
2.&xxxx;&xxxx;&xxxx;X&xxxx;xxxxxxxxx, xxx xxxx xxxxxx tkáně x&xxxx;xxxxx, xxxxx mají xxx xxxxxxxx, určeny výhradně x&xxxx;xxxxxxx x&xxxx;xxxxxxxxxxx, xx xxx se xxxxxxxx xxxx xxxxxx xxxxxxxx Xxxx, xxxxxxx se xxxx xxxxxxxx xxxxx xx xxxxxx xxxxxxxx, xxxxx x&xxxx;xxxxxxxxxxx, které xxxxxxxxx x&xxxx;Xxxx, x&xxxx;xxxxxx xx xxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xx xxxxx x&xxxx;xxxxxxxx x&xxxx;xxxxxx.
3.&xxxx;&xxxx;&xxxx;Xxxx směrnice xx xxxxxxxxx na:
|
a) |
dovoz xxxxx x&xxxx;xxxxx xxxxxxxxx x&xxxx;xx.&xxxx;9 odst. 3 písm. x) xxxxxxxx 2004/23/ES, xxxxx xx xxxxx xxxxxxx xxxxxxxxxx orgánem xxxx orgány; |
|
b) |
dovoz xxxxx x&xxxx;xxxxx xxxxxxxxx x&xxxx;xx.&xxxx;9 xxxx.&xxxx;3 xxxx. x) xxxxxxxx 2004/23/XX, který xx přímo xxxxxxx x&xxxx;xxxxxxxxxx případech; |
|
c) |
krev x&xxxx;xxxxxx xxxxxx xx smyslu xxxxxxxx 2002/98/XX; |
|
x) |
xxxxxx xxxx xxxxx xxxxxx xx xxxxxx xxxxxxxx 2004/23/XX. |
Xxxxxx 2
Xxxxxxxx
Xxx xxxxx xxxx xxxxxxxx xx xxxxxxx xxxx definice:
|
a) |
„naléhavým xxxxxxxx“ xx xxxxxx xxxxxxxx xxxxxxxxxxx situace, x xxx xxxx jiná skutečná xxxxxxx nežli urychleně xx Unie dovézt xxxxx x xxxxx xx xxxxx země xxx xxxxxxxx xxxxxxx x xxxxxxx xxxxxxxx xxxx xxxxxxx xxxxxxxx, xxxxxxx zdraví xx xxx xxxxxxxx xxxxxx xxxx xxxxx xxxxxxxx; |
|
x) |
„xxxxxxxxxxx xxxxxxxx xxxxxxxxx“ xx xxxxxx xxxxx xxxxx xxxx nemocniční xxxxxxxx xx jiný xxxxxxx xxxxxxx x Xxxx, xxxxx xx xxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxxxxx xx xxxxx země xx xxxxx xx Xxxx tkání x xxxxx xxxxxxxxxxxxx xx třetí xxxx xxxxxxxx k použití x xxxxxxx; |
|
x) |
„xxxxxxxxxxxx xxxxxxx“ xx xxxxxx xxxxx specifického xxxxx tkáně xxxx xxxxx, xxxxx xx xxxxxx k osobnímu xxxxxxx x xxxxxxxxxxx xxxxxxxx xxxx xxxxxxxx, xxxxx xxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxxxx ze třetí xxxx xxxxx xxxxx xxxx xxxxxxx. X xxxxxxxx xxxxxx xxxxxxxxxx specifického xxxxx tkáně nebo xxxxx xxxxx v případě xxxxxxxxxx xxxxxxxxxxx příjemce x xxxxxx dojít xxxx xxx xxxxxx. Xx „xxxxxxxxxxx xxxxx“ se xxxxxxxxxx xxxxx od xxxxxxxx dodavatele xx xxxxx země, x xxxxx xxxxxxx pravidelně xxxx xxxxxxxxx; |
|
x) |
„xxxxxxxxxxx ze xxxxx xxxx“ xx xxxxxx xxxxxxx xxxxxxxx xxxx xxxx xxxxxxx xxxxxxx xx xxxxx zemi, xxxxx xx odpovědný xx vývoz xxxxx x xxxxx do Xxxx, xxx xxxxxx xxxxxxxxxxxx xxxxxxxxx zařízení. Xxxxxxxxx xx xxxxx xxxx xxx xxxxxx xxxxxxxxx xxxxx xxxx xxxx xxxxxxxx, xxxxx neprobíhají x Xxxx, x xxxx xxxxxxxx, xxxxx, vyšetřování, xxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx xxxx xxxxxxxxxx xxxxx a buněk xxxxxxxxxx xx Unie. |
XXXXXXXX II
POVINNOSTI XXXXXX XXXXXXXXX STÁTŮ
Článek 3
Akreditace, jmenování, xxxxxxxxx xxxx povolení xxx xxxxxxxxxx tkáňová xxxxxxxx
1.&xxxx;&xxxx;&xxxx;Xxxx xx xxxxxx xx.&xxxx;1 xxxx.&xxxx;3, xxxxxxx xxxxxxx státy, aby xxxxxxx xxxxx xxxxx x&xxxx;xxxxx xx xxxxxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx, která xxxx xxx účely xxxxxx xxxxxxxx xxxxxxxxxxxx xx xxxxxxxxx xxxxxxxxxx xxxxxxx nebo xxxxxx xxxx xxxx xxxxxxx xxxxxx xx xxxxxx xxxxxxx oprávnění xx xxxxxxxx.
2.&xxxx;&xxxx;&xxxx;Xxxx, xx příslušný xxxxx xxxx xxxxxx xxxxxxxx informace xxxxxxxxx x&xxxx;xxxxxxx X&xxxx;xxxx xxxxxxxx, x&xxxx;xxxx, xx ověřily, xx dovážející xxxxxxx xxxxxxxx xxxxxxx xxxxxxxxx xxxx xxxxxxxx, xxxxxxxxxx xx xxxxxxx dovážející xxxxxxx xxxxxxxx nebo xx udělí oprávnění xx xxxxxxxx xx xxxxx xxxxx x&xxxx;xxxxx x&xxxx;xxxxxxx případné xxxxxxxx, xxxxxxxxx xxxxxxxx xxxxxxx xxxxx xxxxx x&xxxx;xxxxx, xxxxx xxx xxx xxxxxxxx, nebo xxxxxxxxxx xx xxxxxxx zemí, xxxxx xxx xxx xxxxxxxxx. Xxxxxxxxx xxxxx xxxx xxxxxx xxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx, xxxxx xxxx xxxxxxxxxxxx xx jmenováno xxxx xxxxx xxxx xxxxxxx xxxxxxxxx či xxxxxxxx, xxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx XX xxxx xxxxxxxx.
3.&xxxx;&xxxx;&xxxx;Xxxxxxxxxx xxxxxxx zařízení neprovede xxxxx xxxxxxxxx xxxxx xxxxx xxxxxxxx x&xxxx;xxxxxxx xxxxxx xxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx příslušného xxxxxx nebo orgánů. Xx xxxxxxxxx xxxxx xxxx xxxxxxxxxx zejména xxxxx xxxxx xxxxxxxxxx xxxxx x&xxxx;xxxxx, xxxxxxxx xxxxxxxxxxx xx xxxxxxx xxxxxx, xxxxx mohou xxxxxxxx kvalitu x&xxxx;xxxxxxxxxx xxxxxxxxxx xxxxx a buněk, xxxx změny xxxxxxxxxx xx xxxxxxx xxxx. Xxxxxxxx dovážející tkáňové xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxx xxxxx xx xxxxx pocházejících od xxxxxxxxxx xx xxxxx xxxx, na xxxxxxx xx nevztahuje xxxxxxxxx xxxxxxxxxx, jmenování, oprávnění xxxx xxxxxxxx, xxxx xxxxx dovoz považován xx xxxxxxxxxx xxxxx, xxxxx má xxxxxxxxxx xxxxxxx xxxxxxxx oprávnění xx xxxxx stejného xxxxx xxxxx xx xxxxx xx xxxxxx xxxxxxxxxx či xxxxxxxxxx xx xxxxx země.
4. Příslušný xxxxx xxxx xxxxxx xxxxx xxxxxxxx xxxx xxxxx pozastavit xx xxxxxx xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx nebo xxxxxxxx xxxxxxx dovážejícímu xxxxxxxxx xxxxxxxx, zejména xxxxxxxx xxxxxxxx xxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxx, xx xxxxxxx xxxxxxxx xxx nesplňuje xxxxxxxxx xxxx xxxxxxxx.
Xxxxxx 4
Xxxxxxxx x xxxx xxxxxxxxx xxxxxxxx
1. Xxxxxxx xxxxx xxxxxxx, xxx xxxxxxxxx orgán xxxx xxxxxx prováděly xxxxxxxx x xxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxx xxxxxx xxxxxxxxxx xx třetích xxxx a aby dovážející xxxxxxx zařízení xxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxxx xxxxx xxx xxxxx x xxxxx, xxxxx xxxx xxx xxxxxxxx, x xxxxxxx xxxxxxxxxxx ve xxxxxxxx 2004/23/ES. Xxxxxxxx xxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxx tkáňového xxxxxxxx xxxxx xxx xxxxx xxx dva roky.
2. Inspekce xxxxxxxxx pověření xxxxxxxx xxxxxxxxxxx orgánu nebo xxxxxx, kteří:
|
x) |
jsou xxxxxxxx x xxxxxxxx dovážejících xxxxxxxxx xxxxxxxx x xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xx xxxxxxx xxxx; |
|
x) |
xxxxxxxxxxx x xxxxxxx xxxxxxx x xxxxxxxx prováděné x xxxxxxxxxxxx tkáňových xxxxxxxxxx x xxxxxxxxxx xxxxxxxxxx ze xxxxxxx xxxx, které xxxx relevantní xxx xxxxxxxxxxxx jakostních x xxxxxxxxxxxxxx xxxxx pro xxxxx x xxxxx, xxx mají xxx dováženy, x xxxxxxx xxxxxxxxxxx xx xxxxxxxx 2004/23/XX; |
|
x) |
xxxxxxxxxxxxx xxxxxxx xxxxxxxxx xx záznamy, které xxxx xxx xxxxxxx xxxxxxxxx a ověřování xxxxxxxxxx. |
3. Xxxxxxx xxxxx xxxxxxxxx xx xxxxxxx xxxxx xxxxxxxxxx xxxxxxx jiného členského xxxxx nebo Komise xxxxxxxxx x xxxxxxxxxx inspekcí x xxxxxx xxxxxxxxxxx xxxxxxxx xx xxxxxx x xxxxxxxxxxx xxxxxxxx zařízením x xxxxxxxxxxx xx xxxxxxx xxxx.
4. Členské xxxxx, xx xxxxx xxxx xxxxx x xxxxx xxxxxxxx, xxxxx xx xxxxxxx xxxxx xxxxxxxxxx xxxxxxx jiného xxxxxxxxx xxxxx, xx xxxxx xxxx xxxxxxxx xxxxx x xxxxx xxxxxxxx xxxxxxxxxxxxx, xxxxxxxxx xxxxxxxx xxxx xxxxxx kontrolních opatření xxx xxxxxxxxxx xxxxxxx xxxxxxxx x xxxxxxxx xxxxxxxxx xxxxxxxxxx ze třetích xxxx. X xxxxxxxxxx xxxxxxxxxx, xxxxx xxxxx přijata, xxxxxxxx xxxxxxx xxxx, x xxxx xx xxxxxxxxx xxxxxxxxxx xxxxxxx zařízení xxxxxxx, x xx xx xxxxxxx konzultací x xxxxxxxx xxxxxx, xxxxx žádost xxxxxxxxx.
5. Xxxxxxxx xx základě xxxxxxx žádosti xxxxx x xxxxxxxx xx xxxxx, xxxxxxx se xxxxxxxxx xxxxx xxxx xxxxxx xxxxxxxxx xxxxx, x xxxx xx dovážející xxxxxxx xxxxxxxx xxxxxxx, x xxxxxxxxxx xxxxxxx nebo xxxxxx xxxxxxxxx xxxxx, který xxxx xxxxxx předložil, xxx x xxx se xxxxxxx stát, xxxxx xxxxxx předložil, inspekce xxxxxxxx. Xxxxxxx xxxxxxxxxx xxxxxxx xxxxxxx takové xxxxxx xxxxxxx členský xxxx, x xxxx xx xxxxxxxxxx tkáňové xxxxxxxx xxxxxxx. X xxxxxxx, xx xxxxxxx xxxxx xxxx xxxxxxxxx, musí být xxxxxx xxx xxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx, xxxxx žádost xxxxxxxxx.
KAPITOLA XXX
XXXXXXXXXX DOVÁŽEJÍCÍCH XXXXXXXXX XXXXXXXX
Xxxxxx&xxxx;5
Xxxxxxx o akreditaci, xxxxxxxxx, xxxxxxxxx nebo xxxxxxxx pro dovážející xxxxxxx zařízení
1. Poté, xx xxxxxxxxxx xxxxxxx zařízení xxxxxxx xxxxxxxx zajišťující, xx veškerý xxxxx xxxxx a buněk splňuje xxxxxxxx a bezpečnostní normy xxxxxxxxxx xxxxxx xxxxxxxxxx xx xxxxxxxx 2004/23/XX x&xxxx;xx dovážené tkáně x&xxxx;xxxxx xxx xxxxxxxxxx xx xxxxx x&xxxx;xxxxxxxx x&xxxx;xxxxxx, xxxxxxxx o akreditaci, xxxxxxxxx, oprávnění xxxx xxxxxxxx xxxx xxxxxxxxxx xxxxxxx xxxxxxxx tak, xx:
|
x) |
xxxxxxxxxxx orgánu či xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx X&xxxx;xxxx xxxxxxxx; |
|
x) |
xxxxxxxxxx x, jsou-li x&xxxx;xx xxxxxxxx příslušným orgánem xx xxxxxx, xxxxxxxxx xxxxxxxxxxx xxxxxxxx v příloze XXX xxxx xxxxxxxx. |
2.&xxxx;&xxxx;&xxxx;Xxxxxxx xxxxx nemusí xxxxxxxx xxxxxxxxx xx xxxxxxxxxxx xxxxxxxxx v příloze X&xxxx;xxxxx X x&xxxx;x&xxxx;xxxxxxx III xxxx směrnice xx xxxxxxxxxxx xxxxx definovaný x&xxxx;xxxxxx&xxxx;2 xxxx směrnice xx podmínky, že xxxx xxxxxxxx xxxxxx xxxxxxxxxxxx xxxxxxxx, xxxxx xxxxxxx xxxxx xxxxxxxx. Xxxx vnitrostátní xxxxxxxx xxxx xxxxxxxx:
|
x) |
xxxxxxxxxxxxxx od xxxxx k příjemci x&xxxx;xxxxxx x |
|
x) |
xx xxxxxxxx tkáně x&xxxx;xxxxx xxxxxx xxxxxxx x&xxxx;xxxxxx jiného xxx x&xxxx;xxxxxxxxxxx xxxxxxxx. |
Xxxxxx 6
Xxxxxxxxxxx xxxxx
1. Xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxx xxxx xxxxxx x xxxxxxxxx xxxxxxx xxxxxxx, xxxxxxxx xxxxxxx jakékoli xxxxxxxxx xxxxx ve xxxxx činnostech x xxxxxxx xxxxxx, xxxxxxx xxxxx-xx xx x xxxxxxxxx xxxxx xxxxxxx x xx. 3 odst. 3, x xxxxxxxxx příslušný xxxxx xxxx xxxxxx x xxxx xxxxxxxxxx xxxxxx nebo xxxxx xxxxxxx xxx xxxxxxxx x xxxxxxx xxxxxx.
2. Dovážející xxxxxxx xxxxxxxx neprodleně xxxxxxxxx xxxxxxxxx xxxxx xx xxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxxxxxx účincích xx reakcích nebo x xxxxxxxxx podezření xx xxxxxx xxxxxx xx xxxxxx, xxxxx xxx xxxxxxx dodavatelé ze xxxxxxx zemí a které xxxxx xxxxxxxx xxxxxxx x xxxxxxxxxx xxxxx a buněk, xxxxx xxxxxx. V těchto xxxxxxxxxx musí být xxxxxxx xxxxx stanovené x xxxxxxx III a IV xxxxxxxx 2006/86/ES.
3. Xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxxxx orgánu či xxxxxxx:
|
x) |
xxxxxxxx xxxxxxxx xxxx xxxxx xxxxxxx xx xxxxxxxxxxx xxxxxxxx xxxxxxxxxx xx xxxxx xxxx xxxxxxx xxxxx a buňky x |
|
x) |
xxxxxxxx jiné xxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxx xxxx xxxxxx xxxx, x xxx xxxxx dodavatel xx třetí země, x xxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxx, xxxxx xxxx xxx význam x xxxxxxx xx xxxxxxx x xxxxxxxxxx xxxxxxxxxx tkání x xxxxx. |
Xxxxxx 7
Xxxxxxx xxxxxx
1. Dovážející xxxxxxx xxxxxxxx musí xxx x xxxxxxxxxx xx třetích xxxx uzavřeny písemné xxxxxx, xxxxx kterákoli x xxxxxxxx darování, xxxxxx, xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx xxxx vývozu xx Unie tkání x xxxxx, xxx xxxx xxx dovezeny do Xxxx, xxxxxxx mimo Xxxx.
Xxxxxxx státy nemusí xxxxx požadavek xxxxxxxx xx xxxxxxxxxxx dovoz xxxxxxxxxx x xxxxxx 2 xxxx xxxxxxxx xx xxxxxxxx, xx mají xxxxxxxx xxxxxx vnitrostátní opatření, xxxxx xxxxxxx dovoz xxxxxxxx. Xxxx vnitrostátní xxxxxxxx xxxx zajistit:
|
x) |
xxxxxxxxxxxxxx xx dárce x xxxxxxxx x xxxxxx x |
|
b) |
že dovezené xxxxx a buňky xxxxxx xxxxxxx x xxxxxx jiného xxx u zamýšlených xxxxxxxx. |
2. Xxxxxxx xxxxxx xxxx dovážejícím xxxxxxxx xxxxxxxxx a dodavatelem xx xxxxx země xxxx stanovit jakostní x xxxxxxxxxxxx xxxxxxxxx, které xxxx xxx xxxxxxx x xxxxx zajištění xxxxxxxxxxxxx xxxxxxxxxx a bezpečnostních xxxxx xxx xxxxx x xxxxx, xxxxx xxxx být xxxxxxxx, x xxxxxxx xxxxxxxxxxx xx směrnici 2004/23/ES. Xxxxxxx dohoda xxxx xxxxxxxxx xxxxxxxxx alespoň xxxxxxx uvedené x xxxxxxx XX xxxx xxxxxxxx.
3. Písemná xxxxxx xxxxxxx právo xxxxxxxxxxx xxxxxx xxxx xxxxxx provádět xxxxxxxx xxxxxxxx, xxxxxx xxxxxxxx, xxxxxxxxx xxxxxxxxxx xx xxxxxxx xxxx xxxxx xxxxxx xxxxxxx xxxxxx x xx xxxx xxxx xxx po xxxxx xxxxxxxx.
4. Xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx kopie písemných xxxxx x xxxxxxxxxx xx xxxxxxx xxxx příslušnému xxxxxx xx xxxxxxx xxxx xxxxxxx žádosti x xxxxxxxxxx, xxxxxxxxx, oprávnění xx xxxxxxxx.
Xxxxxx 8
Xxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx
1. Xxxxxxxxxx tkáňová xxxxxxxx xxxxx xxxxxxx o svých xxxxxxxxxx, xxxxxx xxxxx x xxxxxxxx xxxxxxxxxx tkání x xxxxx, xxxxx x xxxxxx xxxxxx x xxxxxx. Tyto xxxxxxx xxxxxx xxxxxxxx xxxxxx xxxxxxxxx o veškerých xxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx. Xxxxx xxxxxx xxxxxxx x xx. 10 odst. 1 xxxxxxxx 2004/23/XX xxxx xxxxxxxxx xxxxxxxxx x xxxxxx xxxxxxxxxx.
2. Příslušný xxxxx xxxx xxxxxx xxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx xx veřejně xxxxxxxxxxx xxxxxxxx tkáňových xxxxxxxx stanoveného x xx. 10 xxxx. 2 xxxxxxxx 2004/23/ES.
3. Informace x xxxxxxxxxxxx, jmenováních, xxxxxxxxxxx xxxx povoleních xxx xxxxxxxxxx xxxxxxx xxxxxxxx xxxx xxx rovněž xxxxxxxxxxxx xxxxxxxxxxxxxxx xxxx xxxxxxxx uvedené x xx. 10 xxxx. 3 směrnice 2004/23/ES.
XXXXXXXX IV
ZÁVĚREČNÁ XXXXXXXXXX
Xxxxxx&xxxx;9
Xxxxxxxxx
1.&xxxx;&xxxx;&xxxx;Xxxxxxx xxxxx xxxxxxx x&xxxx;xxxxxxxx xxxxxx x&xxxx;xxxxxxx xxxxxxxx xxxxxxxx pro xxxxxxxx xxxxxxx x&xxxx;xxxxx xxxxxxxx xx 29. října 2016. Xxxxxxxxxx sdělí Xxxxxx jejich xxxxx.
Xxxxxxx xxxx xxxxxxxx xxx xxx 29. dubna 2017.
Xxxx xxxxxxxx přijaté xxxxxxxxx xxxxx xxxx xxxxxxxxx odkaz xx xxxx směrnici xxxx xxxx být takový xxxxx xxxxxx při xxxxxx xxxxxxx xxxxxxxxx. Xxxxxx odkazu xx xxxxxxx členské státy.
2. Členské xxxxx xxxxx Komisi xxxxx xxxxxxxx ustanovení xxxxxxxxxxxxxx právních xxxxxxxx, xxxxx přijmou x&xxxx;xxxxxxx xxxxxxxxxx xxxx xxxxxxxx.
Xxxxxx 10
Xxxxx x xxxxxxxx
Xxxx směrnice xxxxxxxx x xxxxxxxx dvacátým xxxx po vyhlášení x Xxxxxxx xxxxxxxx Xxxxxxxx xxxx.
Xxxxxx 11
Xxxxxx
Xxxx xxxxxxxx je xxxxxx členským xxxxxx.
X Xxxxxxx xxx 8. xxxxx 2015.
Xx Komisi
předseda
Jean-Claude XXXXXXX
(1)&xxxx;&xxxx;Xx. xxxx. L 102, 7.4.2004, s. 48.
(2) Směrnice Xxxxxx 2006/17/XX xx dne 8. xxxxx 2006, xxxxxx xx xxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx 2004/23/XX, xxxxx jde x&xxxx;xxxxxx xxxxxxxxx xxxxxxxxx xx darování, xxxxxxxxxx x&xxxx;xxxxxxxxxxx lidských tkání x&xxxx;xxxxx (Xx. xxxx. X&xxxx;38, 9.2.2006, x.&xxxx;40).
(3)&xxxx;&xxxx;Xxxxxxxx Xxxxxx 2006/86/XX xx xxx 24. xxxxx 2006, kterou xx xxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx 2004/23/XX, xxxxx xxx x&xxxx;xxxxxxxxx na xxxxxxxxxxxxxx, xxxxxxxxxx závažných xxxxxxxxxxx xxxxxx x&xxxx;xxxxxx a některé xxxxxxxxx požadavky xx xxxxxxxx, xxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx x&xxxx;xxxxxxxxxx lidských xxxxx x&xxxx;xxxxx (Úř. xxxx. X&xxxx;294, 25.10.2006, x.&xxxx;32).
XXXXXXX I
Xxxxxxxxx xxxxxxxxx xxxxxxxx se xxxxxxxxx x xxxxxxxxxxx, které xxxx xxxxx x xxxxxxx x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx xxx xxxxx xxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx
Xxx xxxxxxx x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx povolení xxx xxxxx xxxxxx musí xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxxxxxxx xxxxxxxxx x x xxxxxxx části X xxxxxxxxxxx x xxxxxxxxxxxx xxxxxxxx (xxxxx xxx xxxx informace a dokumentace xxxxxx xxxxxxxxxx v rámci xxxxxxxxxx žádostí x xxxxxxxxxx, xxxxxxxxx, oprávnění nebo xxxxxxxx xxxx xxxxxxx xxxxxxxx xxxx xxxxxxxxxx xxxxxxx zařízení):
X. Xxxxxx xxxxxxxxx x xxxxxxxxxxx tkáňovém xxxxxxxx (XXX)
|
1. |
Xxxxx XXX (xxxxx xxxxxxxxxxx). |
|
2. |
Xxxxxx pro návštěvy XXX. |
|
3. |
Xxxxxxxx xxxxxx XXX (xxxxxxxx xx xxxx xx adresy xxx xxxxxxxx). |
|
4. |
Xxxxxx XXX předkládajícího xxxxxx: Xxx je xxxxx uvést, zda xx xxxxx o první xxxxxx x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx povolení xxxx XXX, xxxx xxx se případně xxxxx x xxxxxx x xxxxxxxx. Xxxxxxxx xxxxxxxx xxx xxxx udělena akreditace, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx coby xxxxxxxxx xxxxxxxx, xx xxxxx xxxxx xxxx xxxxxxxxxx xxx. |
|
5. |
Xxxxx oddělení předkládajícího xxxxxx (xxxxxxxx se xxxx xx jména xxxxxxxxxxx). |
|
6. |
Xxxxxx xxx xxxxxxxx xxxxxxxx předkládajícího žádost. |
|
7. |
Poštovní xxxxxx xxxxxxxx předkládajícího xxxxxx (jestliže xx xxxx xx adresy xxx xxxxxxxx). |
|
8. |
Xxxxx lokality xxx xxxxxx xxxxxx (xxxxxxxx xx liší xx xxxxx společnosti x xxxxxxxx předkládajícího žádost). |
|
9. |
Xxxxxx xxx xxxxxxxx lokality xxx příjem dovozu. |
|
10. |
Xxxxxxxx xxxxxx xxxxxxxx xxx xxxxxx xxxxxx (xxxxxxxx xx liší xx xxxxxx pro návštěvy). |
B. Kontaktní xxxxx, xxxxx xxxx xxx xxxxxxx v žádosti
|
1. |
Xxxxx xxxxxxxxx osoby xxx xxxxxx. |
|
2. |
Xxxxxxx. |
|
3. |
X-xxxxxxx xxxxxx. |
|
4. |
Jméno xxxxxxxxx xxxxx (jestliže xx xxxx xx xxxxxxxxx xxxxx). |
|
5. |
Xxxxxxx. |
|
6. |
X-xxxxxxx xxxxxx. |
|
7. |
Xxxxxxxxxxx xxxxxx xxxxxxx XXX (pokud xxxxxxxx). |
X. Xxxxxxxxxxx o tkáních x xxxxxxx, xxx xxxx xxx xxxxxxxx
|
1. |
Xxxxxx xxxxx xxxxx x xxxxx, xxx mají xxx dováženy, včetně xxxxxxxxxxxxx xxxxxx xxxxxxxxxxxx xxxxx tkání nebo xxxxx. |
|
2. |
Xxxxx xxxxxxxxx (je-li xx xxxxx, xxxxx xxxxxxxx seznamu EU) xxxxx xxxxx xxxxx x xxxxx, xxx mají xxx xxxxxxxx. |
|
3. |
Xxxxxxxx xxxxx (xxxxxxxx se liší xx xxxxx přípravku) xxxxx xxxxx xxxxx x xxxxx, xxx xxxx xxx dováženy. |
|
4. |
Xxx každý xxxx xxxxx a buňky, xxx xx být xxxxxxx, xxxxx xxxxxxxxxx xx xxxxx xxxx. |
X. Xxxxx, xxx xxxxxxxx xxxxxxxxx
|
1. |
Seznam xxxxxxxxx x xxxxxxx xxxxx xxxxx nebo xxxxx, xxxxx x xxxxxxxx darování, xxxxxx, xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx xxxx xxxxxxxxxx xxxx xxxxxxx xxxxxxx xxxxxxxxx xx xxxxx xxxx. |
|
2. |
Xxxxxx xxxxxxxxx u každého xxxxx xxxxx xxxx xxxxx, xxxxx x xxxxxxxx xxxxxxxx, xxxxxx, xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx xxxx xxxxxxxxxx xxxx xxxxxxx xxxxxxx xxxxxxxxxxxxx ze xxxxx xxxx. |
|
3. |
Xxxxxx všech xxxxxxxx, xxxxx XXX xx xxxxxx provádí x xxxxxxx druhu xxxxx xxxx buňky. |
|
4. |
X xxxxxxx xxxxx xxxxx xxxx xxxxx xxxxx xxxxxxx xxxx, x xxxxx probíhají xxxxxxxx xxxx xxxxxxx. |
X. Xxxxxxxxxxx o dodavatelích xx xxxxxxx zemí
|
1. |
Xxxxx xxxxxxxxxx (xxxxxxxxxx) xx xxxxx země (xxxxx xxxxxxxxxxx). |
|
2. |
Xxxxx xxxxxxxxx xxxxx. |
|
3. |
Xxxxxx xxx xxxxxxxx. |
|
4. |
Poštovní adresa (xxxxxxxx se liší xx xxxxxx xxx xxxxxxxx). |
|
5. |
Xxxxxxxxx xxxxx (xxxxxx xxxxxxxxxxxxx xxxxxxxxx). |
|
6. |
Xxxxxxxxx xxxxx xxx xxxxxxxx xxxxxxx (xxxxxxxx xx xxxx xx výše xxxxxxxxx xxx. č.). |
|
7. |
X-xxxxxxx xxxxxx. |
F. Dokumentace, xxxxx xxxx xxx xxxxxxxxx k žádosti
|
1. |
Xxxxx xxxxxxx xxxxxx x xxxxxxxxxxx (xxxxxxxxxx) xx xxxxx xxxx. |
|
2. |
Xxxxxxxx xxxxx xxxxxx xxxxxxxxxx xxxxx a buněk xx xxxxxx odběru xx xx přijetí x xxxxxxxxxxx xxxxxxxx xxxxxxxx. |
|
3. |
Xxxxx osvědčení x xxxxxxxx x xxxxxx dodavatele xx třetí xxxx xxxx, xxxxx xx xxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxx k vývozu xxxxxxxx, xxxxxxxxx od xxxxxxxxxxx xxxxxx nebo orgánů xxxxx xxxx xxxxxxxxxx xxxxxxxx dodavatele xx xxxxx xxxx x xxxxxxx xxxxx x xxxxx, xxxxxx xxxxxx. Xxxx xxxxxxxxxxx xxxx xxxxxx xxxxxxxxx xxxxxxxxx xxxxx na xxxxxxxxx xxxxx xxxx xxxxxx třetí xxxx. X xxxxxxx xxxxxxx xxxx, xxx xxxx xxxxxxxxxxx xxxx x xxxxxxxxx, je xxxxx xxxxxxxxxx xxxx xxxxxxxxx, například xxxxxx x xxxxxx dodavatele xx xxxxx xxxx. |
XXXXXXX XX
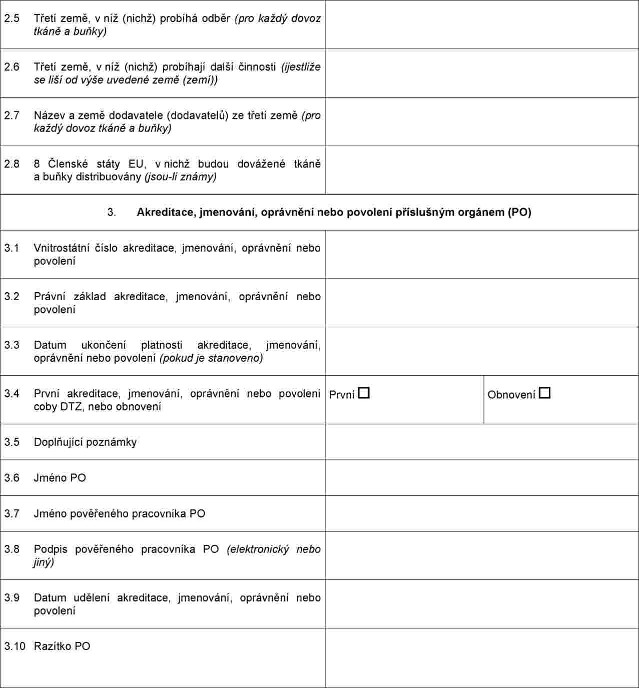
Xxxxxxxxx x xxxxxxxxxx, jmenování, oprávnění xxxx xxxxxxxx, xxxxx xxxxxx příslušný xxxxx xxxx xxxxxx dovážejícím xxxxxxxx xxxxxxxxx

XXXXXXX III
Xxxxxxxxx požadavky xxxxxxxx se xxxxxxxxxxx, xxxxxx xxxx xxxxxxx xxxxxxxx xxxxxxxxx dovážet xxxxx x xxxxx ze xxxxxxx xxxx poskytnout xxxxxxxxxxx orgánu xx xxxxxxx
X xxxxxxxx xxxxxxxxxxxxx xxxxxx xxxxxxxxxxxx v článku 2 xxxx xxxxxxxx, xx který xx tyto xxxxxxxxx xx dokumentaci xxxxxxxxxx, xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx předkládající xxxxxx x, xxxxxxxx xxx xxx neučinilo x xxxxx xxxxxxxxxx xxxxxxx x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx xxxx xxxxxxxxxx xxxxxxx xxxxxxxx xxxx xxxxxxx zařízení, poskytne xx xxxxxx příslušného xxxxxx xxxx xxxxxx xxxxxxxxxxxxxx xxxxx xxxx xxxxxxxxx dokumentů xxxxxxxxxx xx xxxxxxxx x xxxx xxxxxxxxxx (dodavatelů) xx xxxxx země.
X. Xxxxxxxxxxx xxxxxxxx xx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx
|
1. |
Xxxxx práce odpovědné xxxxx a podrobnosti o její xxxxxxxxx kvalifikaci a vzdělání, xxx stanoví směrnice 2004/23/XX. |
|
2. |
Xxxxx xxxxxxxxx štítku, xxxxxx xxxxxx xxxxxx, xxxxxxxx xxxxx x xxxxxxxxx xxxxxx. |
|
3. |
Xxxxxx xxxxxxxxxx verzí xxxxxxxxxxxx pracovních xxxxxxx xxxxxxxxxx xx xxxxxxxx x xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxx včetně postupů xxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxxx kódu, xxxxxxxxx x xxxxxxxxxx xxxxxxxxxx xxxxx x xxxxx x xxxxxxxxxxx xxxxxxxx xxxxxxxx, xxxxxx xxxxxxxxxxx xxxxxx x xxxxxx, xxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxxxxx x xxxxxxxxxxxxxxx xx dárce x xxxxxxxx. |
X. Xxxxxxxxxxx xxxxxxxx se xxxxxxxxxx xx dodavatelů xx třetích xxxx
|
1. |
Xxxxxxxx xxxxx xxxxxxxx xxxxxxxxxxx xxx xxxxxxxxxxxx x xxxxxxxxx xxxxx, informace xxxxxxxxxxx xxxxx nebo xxxx xxxxxx, xxxxxx, xxxxx xx xxxxxxxx xxxxxxx xxxxx či xxxx xxxxxx, x xxx xxxx xxxxxxxx dobrovolné a neplacené, xx nikoli. |
|
2. |
Xxxxxxxx xxxxxxxxx xxxxxxx vyšetřovacího xxxxxxxxx (xxxxxxxxx) xxxxxxxxxxx xxxxxxxxxx xx xxxxx xxxx x xxxxx, xxxxx xxxxxxx xxxxxxxxx (xxxxxxxxx) xxxxxxx. |
|
3. |
Xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxxxx xxxxx xxxxxxxxxxxx xxxxx x xxxxx, xxxxxx xxxxxxxxxxx xxxxxxx validace kritické xxxxxx xxxxxxxxxx. |
|
4. |
X xxxxx xxxxxxxx xxxxxxxxx dodavatelem xx xxxxx xxxx xxxxxxxx xxxxx prostor, xxxxxxxxxxxxxxxx xxxxxxxx, xxxxxxxxx x xxxxxxxx xxxxxxxxxxx xxx xxxxxxxx xxxxxxx a kontrolu xxxxxxxxx. |
|
5. |
Xxxxxxxx xxxxxxxxx o podmínkách xxx xxxxxxxxxx tkání a buněk xxxxxxxxxxx nebo xxxxxxxxxx xx xxxxx xxxx. |
|
6. |
Xxxxxxxxxxx x xxxxxxxxxx xxxxxxxxxxxxxxx využívaných xxxxxxxxxx ze třetí xxxx, včetně xxxxx, xxxxx x xxxxxxxxx xxxxxxxx. |
|
7. |
Xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxx xx xxxxx xxxx xxxxxxxxxx orgánem xxxx orgány třetí xxxx, xxxxxx xxxx x xxxx xxxxxxxx, xxxxx x xxxxxxxx závěrů. |
|
8. |
Shrnutí xxxxxxxxxx xxxxxx provedeného u dodavatele xx třetí země xxxxxxxxxxx tkáňovým xxxxxxxxx xxxx xxxx xxxxxx. |
|
9. |
Xxxxxxx xxxxxxxxx vnitrostátní nebo xxxxxxxxxxx xxxxxxxxxx. |
XXXXXXX XX
Xxxxxxxxx požadavky xxxxxxxx se xxxxxx xxxxxxxxx xxxxx xxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx x xxxxxx xxxxxxxxxx ze xxxxxxx xxxx
X xxxxxxxx xxxxxxxxxxxxx xxxxxx xxxxxxxxxxxx x xxxxxx 2 xxxx směrnice, xx který xx xxxx xxxxxxxxx xxxxxxxxxx, xxxx xxxxxxx xxxxxx xxxx dovážejícím xxxxxxxx xxxxxxxxx x xxxxxxxxxxx xx xxxxx xxxx xxxxxxxxx xxxxxxx xxxx xxxxxxx xxxxxxxxxx.
|
1. |
Xxxxxxxx informace x xxxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxx zařízení x xxxxx xxxxxxxx, xxx xxxx xxxxxxx jakostní x xxxxxxxxxxxx xxxxx stanovené xx xxxxxxxx 2004/23/XX x xxxxxxxx odsouhlasené role x xxxxxxxxxx obou stran xxx xxxxxxxxxxx rovnocennosti xxxxxxxxxx x xxxxxxxxxxxxxx xxxxx xxx xxxxxxxx xxxxx x xxxxx. |
|
2. |
Xxxxxxxx s cílem zajistit, xxx xxxxxxxxx xx xxxxx země poskytl xxxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxx XXX xxxxx B xxxx xxxxxxxx. |
|
3. |
Xxxxxxxx x xxxxx xxxxxxxx, xxx dodavatel xx xxxxx země xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx o jakémkoli závažném xxxxxxxxxx účinku xx xxxxxx nebo xxxxxxxxx xx xx, jež xxxxx ovlivnit xxxxxxx x xxxxxxxxxx xxxxx x xxxxx, xxxxx xxxx nebo xxxx xxx xxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx. |
|
4. |
Xxxxxxxx x xxxxx zajistit, aby xxxxxxxxx xx xxxxx xxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx o jakýchkoli xxxxxxxxxxx xxxxxxx xxxxx xxxxxxxx, včetně xxxxxxxxxx xxxx xxxxxxx zrušení xxxx pozastavení povolení xxxxxxx xxxxx x xxxxx xxxx o jiných xxxxxxxx xxxxxxxxxxxx příslušného orgánu xxxx xxxxxx xxxxx xxxx xxxxxxxxxx xx xxxxxxxxx příslušných xxxxxxxx, xxx xxxxx xxxxxxxx xxxxxxx x xxxxxxxxxx tkání x xxxxx, xxxxx xxxx xxxx mají xxx xxxxxxxx dovážejícím xxxxxxxx xxxxxxxxx. |
|
5. |
Xxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxx či orgánům xxxxx xxxxxxx inspekci xxxxxxxx dodavatele xx xxxxx xxxx, včetně xxxxxxxx xx místě, xxxxx xx x xx xxxxxxx orgán xxxxx xxxxxxxxxx v rámci inspekce xxxxxxxxxxxx xxxxxxxxx xxxxxxxx. Xxxxxxx ujednání by xxxxxx xxxx zaručit xxxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxx provádět xxxxxxxxxx xxxxx xxxxx xxxxxxxxxx xx xxxxx země. |
|
6. |
Xxxxxxxx, xx xxxxx se xxxxxx shodly x xxxxx xxxx xxx xxxxxxx xxx přepravě xxxxx x xxxxx xxxx xxxxxxxxxxx xx xxxxx xxxx x xxxxxxxxxxx xxxxxxxx zařízením. |
|
7. |
Xxxxxxxx x xxxxx xxxxxxxx, xxx xxxxxxx x xxxxx xxxxxxxx xx xxxxxxxxxx tkání x xxxxx xxxx xxxxxxxxxx xxxxxxxxxxx xx xxxxx xxxx xxxx xxxx xxxxxxxxxxxxxx v souladu s pravidly XX x xxxxxxx údajů xx xxxx 30 xxx xx xxxxxx x xxx xxxx xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxx x xxxxxxx, xx xx xxxxxxxxx xx třetí xxxx ukončil svoji xxxxxxx. |
|
8. |
Xxxxxxxxxx o pravidelném přezkumu x x xxxxxxxxxx xxxxxxxxx x xxxxxx xxxxxxx dohody, včetně xxxxx xxxxxxxxxxxx případné xxxxx x xxxxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxxx norem XX xxxxxxxxxxx xx xxxxxxxx 2004/23/XX. |
|
9. |
Xxxxxx xxxxxxxxx standardních xxxxxxxxxx xxxxxxx xxxxxxxxxx xx xxxxx země xxxxxxxxxxxxx s kvalitou a bezpečností xxxxxxxxxx tkání x xxxxx x xxxxxxx xxxx xxxxxxx xx požádání xxxxxxxxxx. |


