XXXXXXXX KOMISE (ES) x.&xxxx;429/2008
xx dne 25.&xxxx;xxxxx 2008
x&xxxx;xxxxxxxxxxx pravidlech k nařízení Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx (XX) č. 1831/2003, xxxxx xxx o vypracování x&xxxx;xxxxxxxx xxxxxxx x&xxxx;xxxxxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxxx xxxxx
(Xxxx x&xxxx;xxxxxxxx xxx XXX)
XXXXXX EVROPSKÝCH XXXXXXXXXXXX,
x&xxxx;xxxxxxx na Smlouvu x&xxxx;xxxxxxxx Xxxxxxxxxx společenství,
s ohledem xx xxxxxxxx Evropského xxxxxxxxxx a Rady (XX) x.&xxxx;1831/2003 ze xxx 22.&xxxx;xxxx 2003 o doplňkových xxxxxxx xxxxxxxxxxx ve xxxxxx xxxxxx (1), x&xxxx;xxxxxxx xx čl. 7 xxxx.&xxxx;4 x&xxxx;5 uvedeného xxxxxxxx,
xx xxxxxxxxxx x&xxxx;Xxxxxxxxx xxxxxx xxx xxxxxxxxxx xxxxxxxx x&xxxx;xxxxxxx x&xxxx;xx.&xxxx;7 odst. 4 x&xxxx;5 xxxxxxxx (ES) x.&xxxx;1831/2003,
xxxxxxxx x&xxxx;xxxxx xxxxxxx:
|
(1) |
Xx xxxxxxxx xxxxxxxx prováděcí xxxxxxxx, pokud xxx x&xxxx;xxxxxx xxxxxxxxxx doplňkových xxxxx podle nařízení (XX) č. 1831/2003, xxxxxx xxxxxxxx pro xxxxxxxxxxx x&xxxx;xxxxxxxx žádostí x&xxxx;xxxxxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxx doplňkových xxxxx. Tato xxxxxxxx xxxx nahradit xxxxxxxxxx x&xxxx;xxxxxxx směrnice Xxxx 87/153/XXX (2), xxxxxx se xxxxxxx xxxxxx xxxxxx xxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxx xx xxxxxx xxxxxx. |
|
(2) |
Xxxx xxxxxxxx by xxxx xxxxxxxx xxxxxxxxx, xxxxx xxxx xxxxxxxx xxxxxxxxxxx připojená k žádosti. Xxxx by xxxxxxx xxxxx xxxxxxx xxxxx, xxxxx xxxx xxx xxxxxxxxxx x&xxxx;xxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxxxxx doplňkové xxxxx, x&xxxx;xxxxxx, xxx xxxx xxx xxxxxxxxxx s cílem xxxxxxxx xxxx účinnost x&xxxx;xxxxxxxxxx pro xxxxxxx, xxxxxxx x&xxxx;xxxxxxx xxxxxxxxx xx xxxxxx ověření x&xxxx;xxxxxxxxxxx žádostí x&xxxx;xxxxxxxx Xxxxxxxxx xxxxxx pro xxxxxxxxxx xxxxxxxx (xxxx xxx „úřad“). |
|
(3) |
Podle xxxxxx xxxxxxxxx xxxxx xxxx xxxxxxxxxxxx xxxxxxxx xxx xxxxx xx xxxx xxxxxx xxxxxx potřebných x&xxxx;xxxxxxxxxxx jejích xxxxxxxxxx x&xxxx;xxxxxx xxxxx. Subjekty xx proto xxxx xxx xxxxxxx postupovat x&xxxx;xxxxxxx xxxxxxxxx, xxxxx xxx x&xxxx;xxxx studií x&xxxx;xxxxxxxxx, xxx xxxx xxx předloženy k prokázání xxxxxxxxxxx a účinnosti dotyčné xxxxxxxxx látky. Xxxxxxxx, xxxxx využijí xxxx xxxxxxxxx, xx xxxx x&xxxx;xxxxxxxxxxx svůj xxxxx xxxxxxxxx. |
|
(4) |
Xxxx xx měl xxx xxxxxxx popřípadě xxxxxxxxx xxxxxxxxx xxxxxxxxx, xxx xxxx určit, xxx xxxxxxxxx látka xxxxxxx xxxxxxxx xxx xxxxxxxx xxxxx xxxxxx&xxxx;5 xxxxxxxx (ES) x.&xxxx;1831/2003. |
|
(5) |
Xx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxx kvality xxx xxxxxxxxxxxxx xxxxxxxxxxx xxx xxxxxxxxx xxxxx xxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxx (xxxxxxxx) xxxx xxxx, aby xxxx xxxxxxxxx, xx xxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxxxx. |
|
(6) |
X&xxxx;xxxxxxx xxxxxxxx xx xxxx být xxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx látek xxxxxxx x&xxxx;xx.&xxxx;6 xxxx.&xxxx;1 nařízení (XX) č. 1831/2003. |
|
(7) |
S cílem xxxxxxxx xxxxx o získání xxxxxxxx xxx xxxxxxxxx xxxxx xxx současném xxxxxxxxx xxxxxxxx xxxxxx bezpečnosti xx xxxx xxx xxxxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxxxxxxx k možnosti xxxxxxxxxxx xxxxxxxx studií xxxxxxxxxxx na xxxxxxxxxxx xxxxxxx na xxxxx xxxxxxxxx. |
|
(8) |
Xxxxxxxxx pravidla xxxxxxxx xx žádostí x&xxxx;xxxxxxxx xx xxxx vzít x&xxxx;xxxxx různé xxxxxxxxx xx xxxxxxx xxxxxx x&xxxx;xxxxxxxx potravin x&xxxx;xxxxxxx xxxxxxx, xxx xxx xxxxxxx xxxxxxxx se xxxxxxxxxxx bezpečnosti pro xxxxxxx jako xxxxxxxxxxxx xxxxxx xxxxxxxx. |
|
(9) |
Xxxxxxx xxxxxxx xxxxxxxxxxxx používání xxxxxxxxxxxxx xxxxxx x&xxxx;xxxxxxxx či xxxxx vědeckým účelům x&xxxx;xxxxxxxxx na xxxxxxxxx xxxxx xxxxxxxx Rady 86/609/XXX ze xxx 24.&xxxx;xxxxxxxxx 1986 o sbližování xxxxxxxx a správních xxxxxxxx xxxxxxxxx států xxxxxxxxxx xx xxxxxxx zvířat xxxxxxxxxxx xxx xxxxxxx x&xxxx;xxxx vědecké účely (3) xx xxxx xxx xxxxxxxxx. |
|
(10) |
Xxx se xxxxxxxx xxxxxxxxxx opakování studií, xxxx xx být xxxxxxxxx xxxxxxxxxxxx postupy xxx povolování xxxxxxxxxxx xxxxx, xxxxx xxx xxxx xxxxxxxx xxx xxxxxxx x&xxxx;xxxxxxxxxxx. |
|
(11) |
Xx xx xxxx doplňkových xxxxx, xxxxx xxxx xxxxx xxxxxxxx Rady 70/524/XXX (4) xxxxxxxx xxx xxxxxxxx xxxxxxx, měla xx xxx xxxxxxxxx stanovena xxxxxxx, xxx v případě, xx xxxxxx x&xxxx;xxxxxxxxx xxxxx xxxxxx, žadatel xxxxxxxx účinnost pomocí xxxxxx materiálů, které xxxx x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxx, zejména xxxxxxxxx xxxxxxxxxx xx xxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx látky. |
|
(12) |
Je nutno xxxxxxxx xxxxxxxx xxx xxxxxxx x&xxxx;xxxxx povolení x&xxxx;xxxxxxx x&xxxx;xx.&xxxx;13 xxxx.&xxxx;3 xxxxxxxx (ES) č. 1831/2003. |
|
(13) |
Je xxxxx stanovit rovněž xxxxxxxx xxx xxxxxxx x&xxxx;xxxxxxxx povolení xxxxx xxxxxx&xxxx;14 xxxxxxxx (ES) x.&xxxx;1831/2003. |
|
(14) |
Xx xx xxxx xxxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxx, xxx xx xxxxx provést xx xxxxxxx xxxxxxx, xx xxxxxxxx xxxxxxxx přechodné xxxxxx, během něhož xx xxxxx nadále xxxxxxxx stávající pravidla. X&xxxx;xxxxxxxx xxxxxxxx před xxxxxxx xxxxxx xxxxxxxx x&xxxx;xxxxxxxx xx xx xxxx x&xxxx;xxxxxx xxxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxxx xxxxxxxx 87/153/XXX. Xxxxx xxx x&xxxx;xxxxxxx xxxxxx xxxxx xxxxxxxx období po xxxxxx x&xxxx;xxxxxxxx, xxxxxxxx xx xxxxxxxx x&xxxx;xxxxxx xxxx xxxxxxxx pro xxxxxxx xxxxxx xxxx xxx možnost xxxxxx xxxx xxxxxxxx xxxxxxxxxxx x&xxxx;xxxxx nařízení x&xxxx;xxxxxxxx xxxxxxxx 87/153/EHS. Prováděcí xxxxxxxx xxxx xxxxxxxxxxx xx xxxxxxx současných xxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxx x&xxxx;x&xxxx;xxxxxxx xxxxxxxx by xxxx xxx přizpůsobena xxxxxxxxxx novému xxxxxx x&xxxx;xxxx oblasti. |
|
(15) |
Opatření xxxxxx xxxxxxxx xxxx x&xxxx;xxxxxxx xx stanoviskem Stálého xxxxxx pro potravinový xxxxxxx x&xxxx;xxxxxx xxxxxx, |
XXXXXXX XXXX XXXXXXXX:
Xxxxxx 1
Xxxxxxxx
Xxx xxxxx xxxxxx xxxxxxxx se xxxxxxx xxxx definice:
|
1. |
„xxxxxxx v zájmovém xxxxx x xxxxxxxxx xxxxxxx, xxxxx xxxxxx xxxxxx x xxxxxxxx xxxxxxxx“ xx xxxxxx zvířata xxxxx, xxx jsou xxxxxxxx xxxxxx, xxxxxxx xxxx xxxxxx xxxxxxxx, xxxxxx xxxx xxxxxx xxx xxxxxxx xxxxxxxx, xxxxx xxxx; |
|
2. |
„xxxxxxxxxxx druhy“ xx xxxxxx xxxxxxx xxxxxx x xxxxxxxx xxxxxxxx xxxx xxx skot (zvířata xxxxxxx pro mléko x xxxx, xxxxxx telat), xxxx (zvířata chovaná xxx xxxx), xxxxxxx, xxxxxx (včetně nosnic), xxxxx a ryby druhu Xxxxxxxxxx. |
Xxxxxx 2
Xxxxxx
1. Xxxxxx x xxxxxxxx xxxxxxxxx xxxxx podle xxxxxx 7 xxxxxxxx (XX) x. 1831/2003 xx xxxxxxxx xxxxxx xxxxxxxxx stanoveného v příloze I.
X xxxxxxx xx připojí xxxxxxxxxxx xxxxx článku 3 (xxxx xxx „xxxxxxxxxxx“), xxxxx xxxxxxxx xxxxx a dokumenty xxxxxxx x xx. 7 xxxx. 3 xxxxxxxx (ES) x. 1831/2003.
2. Xxxxx xxxxxxx v souladu s článkem 18 xxxxxxxx (XX) x. 1831/2003 xxxxxxxx, xxx se x xxxxxxxxx částmi dokumentace xxxxx odstavce 1 xxxxxxxxx xxxx x xxxxxxxxx xxxxx, xxxxxxxx xxx xxxxx xxxxxxxx xxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx, xx xxxxxxxxxx xxxxxx xxxxxxxxx xx mohlo xxxxxxxx xxxxxxxx xxxx xxxxxxxxx xxxx xxxxxxxxxxx. Xxxxxxx xxxxx xxxxxxxxxxx xxxx být xxxxxxxxxx xxxxxxxx xx xxxxxx xxxxxxxxxxx x xxxxx být xxxxxxxx v souhrnu xxxxxxxxxxx xxxxx xx. 7 odst. 3 xxxx. x) xxxxxxxx (ES) x. 1831/2003. Xxxxxxx xxxxx Xxxxxx xxxxx xxxxx xxxxxxxxxxx, x xxxxx xx xxx xxxxxxxxx xxxx s důvěrnými xxxxx, a připojeného odůvodnění.
Xxxxxx 3
Xxxxxxxxxxx
1. Xxxxxxxxxxx xxxxxxxxx a dostatečně xxxxxxxxx, xx doplňková xxxxx xxxxxxx podmínky xxx povolení xxxxxxxxx x xxxxxx 5 nařízení (ES) x. 1831/2003.
2. Xxxxxx xxxxxxxxx xx xxxxxxxxxxx a předání xxxxxxxxxxx xxxx xxxxxxxxx v příloze II.
Xxxxxxxx xxxxxxxxx, jež dokumentace xxxx xxxxxxxx v dotyčném xxxxxxx, xxxx xxxxxxxxx x xxxxxxx XXX.
Xxxxxxxxx xxxx trvání xxxxxxxxxxxx xxxxxx xx xxxxxxxxx v příloze IV.
3. Xxxxxxxx od xxxxxxxx 2 xxxx xxxxxxx xxxxxxxxx xxxxxxxxxxx, xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxxx 2, pokud každý xxxxx, jenž xxxx xxxxxxxxx nesplňuje, odůvodní.
Xxxxxx 4
Xxxxxxxxx xxxxxxxx
1. Xx xxxxxxx x xxxxxxxx xxxxxx xxxx xxxxx xxxxxx xxxxxx xxxxxxxx x xxxxxxxx xx xxxxxx vztahuje xxxxxxx xxxxxxxx 87/153/XXX.
2. U žádostí o povolení xxxxxxxx před 11. xxxxxxx 2009 xx xxxxx xxxxxxxx rozhodnout, xx xxxxx nadále používat xxxxxx XXX a IV částí I a II xxxxxxx xxxxxxxx 87/153/XXX místo xxxx 1.3, 1.4, 2.1.3, 2.1.4, 2.2.3, 2.2.4, 3.3, 3.4, 4.1.3, 4.1.4, 4.2.3, 4.2.4, 5.3, 5.4, 6.3, 6.4, 7.3, 7.4, 8.3 x 8.4 přílohy III x xxxxx ustanovení ve xxxxxxx „Xxxxxxxxx xxxx xxxxxx xxxxxxxxxxxx studií xxxxxxxxx“ x xxxxxxxxx xxxxxxx XX.
Xxxxxx 5
Xxxxx x xxxxxxxx
Toto xxxxxxxx xxxxxxxx x xxxxxxxx xxxxxxxx xxxx xx vyhlášení x Xxxxxxx xxxxxxxx Xxxxxxxx xxxx.
Xxxx nařízení xx xxxxxxx x xxxxx rozsahu x xxxxx xxxxxxxxxx xx xxxxx xxxxxxxxx státech.
V Bruselu xxx 25. xxxxx 2008.
Za Xxxxxx
Xxxxxxxxx XXXXXXXXX
xxxxxx Komise
(1)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;268, 18.10.2003, x.&xxxx;29. Xxxxxxxx xx xxxxx xxxxxxxx Komise (XX) x.&xxxx;378/2005 (Xx.&xxxx;xxxx. X&xxxx;268, 18.10.2003, x.&xxxx;29).
(2)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;64, 7.3.1987, x.&xxxx;19. Zrušeno xxxxxxxxx (XX) x.&xxxx;1831/2003.
(3)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;358, 18.12.1986, x.&xxxx;1; xxxxxxxx xxxxx x&xxxx;Xx.&xxxx;xxxx. L 358, 18.12.1986, x.&xxxx;1. Směrnice xx xxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx 2003/65/XX (Xx.&xxxx;xxxx. X&xxxx;358, 18.12.1986, x.&xxxx;1).
(4)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;270, 14.12.1970, x.&xxxx;1. Xxxxxxxx naposledy xxxxxxxxx xxxxxxxxx Komise (XX) č. 1800/2004 (Xx.&xxxx;xxxx. X&xxxx;270, 14.12.1970, x.&xxxx;1).
XXXXXXX&xxxx;X
XXXXXXXX XXXXXXX UVEDENÝ X&xxxx;XX.&xxxx;2 XXXX.&xxxx;1&xxxx;X&xxxx;XXXXXXX XXXXX
1.&xxxx;&xxxx;&xxxx;XXXXXXXX XXXXXXX
XXXXXXXX XXXXXX
XXXXXXXXX XXXXXXXXXXX
XXX XXXXXX X&xxxx;XXXXXXX XXXXXXXXXXXX
(Xxxxxx)
Xxxxx: …
|
Xxx |
: |
Xxxxxx o povolení xxxxxxxxx xxxxx xxxxx nařízení (XX) x.&xxxx;1831/2003. |
|
◻ |
Xxxxxxxx xxxxxxxxx xxxxx xxxx nové xxxxx xxxxxxxxx xxxxx (xx.&xxxx;4 xxxx.&xxxx;1 xxxxxxxx (XX) x.&xxxx;1831/2003) |
|
◻ |
Xxxxxxxx xxxxxxxxxxxx xxxxxxxx (čl. 10 odst. 2 xxxx&xxxx;7 xxxxxxxx (XX) x.&xxxx;1831/2003) |
|
◻ |
Xxxxx xxxxxxxxxxx povolení (xx.&xxxx;13 xxxx.&xxxx;3 nařízení (XX) x.&xxxx;1831/2003) |
|
◻ |
Xxxxxxxx xxxxxxxx xxxxxxxxx xxxxx (xxxxxx&xxxx;14 xxxxxxxx (XX) x.&xxxx;1831/2003) |
|
◻ |
Xxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxxx (článek 15 xxxxxxxx (XX) č. 1831/2003) |
(Označte xxxxxxxxxxx xxxxxxxxxxx xxxxxxx x&xxxx;xxxxxxx)
Xxxxxxx(x)&xxxx;x/xxxx xxxx/xxxxxx zástupce(i) ve Xxxxxxxxxxxx (čl. 4 xxxx.&xxxx;3 xxxxxxxx (XX) x.&xxxx;1831/2003) xx xxxxxxxx uvedených x&xxxx;xx.&xxxx;7 xxxx.&xxxx;3 písm. a) nařízení (XX) č. 1831/2003 (xxxxx, xxxxxx ….)
…
…
podává (xxxxxxxx) xxxx xxxxxx xx xxxxxx xxxxxxx xxxxxxxx xxx xxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxxx xxxxx:
1.1&xxxx;&xxxx;&xxxx;Xxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxxxxxxx xxxxx
Xxxxx xxxxxxxxx xxxxx (charakteristika xxxxxx xxxxx (látek) xxxx činidla (xxxxxxx), xxx xx vymezeno x&xxxx;xxxxxx&xxxx;2.2.1.1 x&xxxx;2.2.1.2 přílohy II):
…
…
Obchodní xxxxx (xx-xx to xxxxxx x&xxxx;xxxxxxxx xxxxxxxx xx držitele):
…
…
V kategorii/kategoriích a funkční xxxxxxx/xxxxxxxxx xxxxxxxxxxx xxxxx&xxxx;(1) (xxxxxx):
…
…
Xxxxxx xxxxx zvířat:
…
…
…
Jméno xxxxxxxx xxxxxxxx (čl. 9 xxxx.&xxxx;6 xxxxxxxx (XX) x.&xxxx;1831/2003):
…
…
Xxxx doplňková xxxxx xxx byla povolena x&xxxx;xxxxxxxx předpisech x&xxxx;xxxxxxxx xxxxxxxx.……/…/X(X)X&xxxx;xxxx xxxxxxxxx (XX) x.&xxxx;…/… xxx xxxxxx … xxxx (xxxxxxxxx xxxxxxxxxxx xxxxx)
…
Xxxx xxxxxxxxx xxxxx xxx byla xxxxxxxx v právních předpisech x&xxxx;xxxxxxxxxxx směrnicí .…/…/X(X)X&xxxx;xxxx xxxxxxxxx (ES) x.&xxxx;…/… xxx xxxxxx … xxxx
…
xxx xxxxxxx v
…
Pokud xx produkt skládá x&xxxx;xxxxxxxxx modifikovaných xxxxxxxxx xxxx tyto xxxxxxxxx xxxxxxxx xx je x&xxxx;xxxx xxxxxxx, xxxxxx xxxx xxxxxxxxx:
|
◻ |
xxxxxxxxxxx identifikační xxx (nařízení Xxxxxx (XX) x.&xxxx;65/2004&xxxx;(2)) (xx-xx xx xxxxxx): … |
|
◻ |
xxxxx x&xxxx;xxxxxxxxx xxxxxxxx uděleném v souladu x&xxxx;xxxxxxxxx Evropského parlamentu x&xxxx;Xxxx (XX) x.&xxxx;1829/2003&xxxx;(3): … |
|
◻ |
xxxx xxxxx x&xxxx;xxxxx xxxxxxxxxx xxxxxxx x&xxxx;xxxxxxxx xxxxx xxxxxxxx (ES) x.&xxxx;1829/2003: … |
1.2&xxxx;&xxxx;&xxxx;Xxxxxxxx xxx xxxxx
1.2.1&xxxx;&xxxx;&xxxx;Xxxxxxx v kompletních xxxxxxxx
Xxxx xxxx kategorie xxxxxx:
…
…
Xxxxxxxxx stáří nebo xxxxxxxx:
…
…
Xxxxxxxxx dávka (xx-xx xx xxxxxx): xx xxxx jednotky xxxxxxxx&xxxx;(4) xxxx jednotky xxxxxxx xxxxxxx (XXX) xxxx xx/xx xxxxxxxxxxx krmiva x&xxxx;xxxxxx xxxx 12 %
…
…
Maximální xxxxx (xx-xx to xxxxxx): mg xxxx xxxxxxxx aktivity xxxx XXX xxxx xx/xx xxxxxxxxxxx xxxxxx x&xxxx;xxxxxx xxxx 12&xxxx;%
…
…
X&xxxx;xxxxxxxx xxxxx xx xxxxx uvést xxxxxxxxx x&xxxx;xxxxxxxxx dávku xx xxxx.
1.2.2&xxxx;&xxxx;&xxxx;Xxxxxxx xx xxxx
Xxxxxxxxx xxxxx (xx-xx xx xxxxxx): xx xxxx xxxxxxxx xxxxxxxx xxxx CFU xxxx xx/x&xxxx;xxxx
…
…
Xxxxxxxxx xxxxx (xx-xx xx vhodné): xx xxxx xxxxxxxx xxxxxxxx xxxx XXX nebo xx/x&xxxx;xxxx
…
…
1.2.3&xxxx;&xxxx;&xxxx;Xxxxxxxx xxxxxxxx xxx xxxxx (je-li to xxxxxx)
Xxxx xxxx xxxxxxxxx xxxxxx:
…
…
Xxxxxxxxx xxxxx:
…
…
Xxxxxxxxx xxxxx (xx-xx xx xxxxxx): xx nebo xxxxxxxx xxxxxxxx xxxx XXX/xx xxxxxxxxxxx xxxxxx x&xxxx;xxxxxx xxxx 12 %
…
…
Maximální xxxxx (xx-xx xx vhodné): xx nebo jednotky xxxxxxxx xxxx CFU/kg xxxxxxxxxxx xxxxxx x&xxxx;xxxxxx xxxx 12&xxxx;%
…
…
X&xxxx;xxxxxxxx xxxxx xx xxxxx uvést xxxxxxxxx x&xxxx;xxxxxxxxx dávku xx xxxx.
Xxxxxxxx xxxx xxxxxxx xxxxxxx (xx-xx xx xxxxxx):
…
…
…
Xxxxxxxx podmínky xxxx xxxxxxx xxx xxxxxxxxxx (xx-xx xx xxxxxx):
…
…
…
…
Xxxxxxxxx xxxxx reziduí (xx-xx xx xxxxxx):
Xxxx xxxx xxxxxxxxx xxxxxx:
…
…
Xxxxxxxxxxxx xxxxxxxx:
…
…
Xxxxxx xxxxx xxxx xxxxxxxx:
…
…
…
Xxxxxxxxx xxxxxxxx x&xxxx;xxxxxxx xxxx xxxxxxxxxx (μx/xx):
…
…
…
Xxxxxxxx xxxxx:
…
1.3&xxxx;&xxxx;&xxxx;Xxxxxxxxxx xxxxxx
Xxxxx xxxxxx xxxxxxxxxx xxxxxxxxxx Xxxxxxxxxxxx (xx-xx xx xxxxxx):
…
Xxxxx xxxxxx / xxxxx xxxxx:
…
Xxxxx xxxxxx:
…
Xxxxx xxxxxxxxx xxxxxxxxxxxx:
…
Xxxxxxxxxxx:
…
Xxxxxxxx:
…
Xxxxxxx xxxxx:
…
Xxxxx xxxxx:
…
Xxxxxxxxx xx xxxxxxxxxx:
…
1.4&xxxx;&xxxx;&xxxx;Xxxxxxxxxx xxxxx (xx-xx xx xxxxxx)
…
…
…
…
Xxxxx xxxx xxxxxxx xxxx xxxxxxx xxxxx xxxxx x&xxxx;xxxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxx Xxxxxxxxxxxx x&xxxx;xxxxxxxxxxxx vzorky.
Podpis …
1.5&xxxx;&xxxx;&xxxx;Xxxxxxx:
|
◻ |
xxxxx xxxxxxxxxxx (pouze xxx xxxx), |
|
◻ |
xxxxxxx xxxxxx xxxxxxxxxxx, |
|
◻ |
xxxxxxxx xxxxxxx xxxxxxxxxxx, |
|
◻ |
xxxxxx xxxxx xxxxxxxxxxx, x&xxxx;xxxxx xx xxx xxxxxxxxx xxxx x&xxxx;xxxxxxxxx xxxxx, x&xxxx;xxxxx příslušných dotyčných xxxxx xxxxxxxxxxx (xxxxx xxx Xxxxxx x&xxxx;xxxx), |
|
◻ |
xxxxx xxxxxxxxx xxxxx xxxxxxxx(x), |
|
◻ |
xxx xxxxxx doplňkové xxxxx xxx referenční xxxxxxxxx Xxxxxxxxxxxx xxxxx xx.&xxxx;7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831 / 2003 (xxxxx pro xxxxxxxxxx xxxxxxxxx Společenství), |
|
◻ |
list x&xxxx;xxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxx (xxxxx xxx xxxxxxxxxx xxxxxxxxx Xxxxxxxxxxxx), |
|
◻ |
xxxxxxxxx x&xxxx;xxxxxxxxxxxx x&xxxx;xxxxxxx (xxxxx xxx xxxxxxxxxx xxxxxxxxx Společenství) x |
|
◻ |
xxxxxxxxx x&xxxx;xxxxxxxx poplatku xxx xxxxxxxxxx laboratoř Xxxxxxxxxxxx (xxxxxx&xxxx;4 nařízení (ES) x.&xxxx;378/2005&xxxx;(5). |
Xxxxxxx příslušné xxxxx xxxxxxxxx x&xxxx;xxxxxxxx xx xxxxx xxxxxxxx. Xxxxxxxx xxxxxxxxx xxxxxxx (x&xxxx;xxxxxxxxx xxxxxxxxxxxx přílohami) xxxxxxx xxxxx Xxxxxxxx xxxxxx.
2.&xxxx;&xxxx;&xxxx;XXXXXXX XXXXX ŽADATELE(Ů)
Kontaktní xxxxx xxx xxxxxxxxxx xxxxxxx x&xxxx;xxxxxxxx doplňkové xxxxx xxxxx xxxxxxxx (ES) x.&xxxx;1831/2003
|
1. |
Xxxxxxxxxx xxxx osoba, xxxxx podává xxxxxx
|
|
2. |
Xxxxxxxxx osoba (pro xxxxxxxx xxxxxxxxxxxxx x&xxxx;Xxxxxx, xxxxxx a referenční laboratoří Xxxxxxxxxxxx)
|
(1) U funkční xxxxxxx „xxxx zootechnické xxxxxxxxx xxxxx“ x&xxxx;xxxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxx xx xxxxx xxxxxxxxxxx xxxxxxx, xxxxx xxxxxx xx doplňková xxxxx xxx.
(2)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;10, 16.1.2004, x.&xxxx;5.
(3)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;268, 18.10.2003, x.&xxxx;1. Xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx (XX) x.&xxxx;298/2008 (Xx.&xxxx;xxxx. X&xxxx;268, 18.10.2003, x.&xxxx;1).
(4)&xxxx;&xxxx;Xxxxxxxx „xxxxxxxx“ xxxxxxxx žadatel.
(5) Nařízení Xxxxxx (XX) x.&xxxx;378/2005 ze xxx 4.&xxxx;xxxxxx 2005 x&xxxx;xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxx x&xxxx;xxxxxxxx Evropského xxxxxxxxxx x&xxxx;Xxxx (XX) x.&xxxx;1831/2003, xxxxx jde x&xxxx;xxxxxxxxxx x&xxxx;xxxxx referenční laboratoře Xxxxxxxxxxxx x&xxxx;xxxxxxxxxxx x&xxxx;xxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxx látek x&xxxx;xxxxxxxx (Úř. věst. L 59, 5.3.2005, x.&xxxx;8). Xxxxxxxx xx znění xxxxxxxx (XX) č. 850/2007 (Úř. věst. X&xxxx;59, 5.3.2005, s. 8).
XXXXXXX&xxxx;XX
XXXXXX XXXXXXXXX, XXX XXXX XXXXXXXX XXXXXXXXXXX XXXXX XXXXXX&xxxx;3
XXXXXX USTANOVENÍ
Tato xxxxxxx xxxxxxx xxxxxxxxx xx vypracování xxxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxxxx x&xxxx;xxxxxxxxx x&xxxx;xxxxxxx, xxxxxxxxxxxxxxxx a přípravcích, xxx xxxx xxx xxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxx xxxxxx&xxxx;7 xxxxxxxx (XX) x.&xxxx;1831/2003 pro:
|
— |
povolení nové xxxxxxxxx xxxxx, |
|
— |
xxxxxxxx xxxxxx xxxxx xxxxxxxxx látky, |
|
— |
změnu xxxxxxxxxxx xxxxxxxx doplňkové xxxxx xxxx |
|
— |
xxxxxxxx povolení xxxxxxxxx xxxxx. |
Xxxxxxxxxxx xxxx xxxxxxx vyhodnocení xxxxxxxxxxx xxxxx na základě xxxxxxxxxx xxxxx xxxxxxxx x&xxxx;xxxxxxx, že tyto xxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx xxx xxxxxx xxxxxxxx, xxxxx xxxx xxxxxxxxx x&xxxx;xxxxxx&xxxx;5 xxxxxxxx (ES) x.&xxxx;1831/2003.
Xxxxxx, xxx xxxx být xxxxxxxxxx, x&xxxx;xxxxxx rozsah xxxx xxxxxxx na xxxxxx xxxxxxxxx xxxxx, xxxxxxxxx xxxx xxxxxxx xxxxxxx, druhu xxxxxxxx (xxxxxxxx, xxxxx není xxxxxx xx xxxxxxxx; xxxxxxxx xxxxxx xx xxxxxxxx), xxxxxxx xxxxx, xxxxxxxx zvířatech x&xxxx;xxxxxxxxxx xxx xxxxx. Xxxxxxx xxxxxx na xxxx xxxxxxx x&xxxx;xxxxxxx&xxxx;XXX, aby xxxx xxxxx xxxxxxxx, xxxxx xxxxxx x&xxxx;xxxxxxxxx xxxx xxx xxxxxxxx xx xxxxxxx předloženy.
Žadatel xxxxxxxxxxx uvede xxxxxx xxx xxxxxxxxx xxxxxxxxx xxxxx xxxx xxxxxxxxx xx od xxxxxxxxxxx xxxxxxxxxx v této xxxxxxx, xxxxxxx&xxxx;XXX x&xxxx;xxxxxxx&xxxx;XX.
Xxxxxxxxxxx musí xxxxxxxxx xxxxxxxx zprávy x&xxxx;xxxxx xxxxxxxxxxx xxxxxxxx, xxxxxxxxxx x&xxxx;xxxxxxx xx xxxxxxxx číslování xxxxxxxxx x&xxxx;xxxx příloze. Xxxxxxxxxxx xxxx obsahovat odkazy x&xxxx;xxxxx xxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx x&xxxx;xxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx, xxxxx xxx xxxx vypracována uznávanou xxxxxxxx xxxxxxxxx. Pokud xxxx tyto studie xxx xxxxxxxxxxx evropskou xxxxxxxx xxxxxxxxx podle xxxxxxxx xxxxxxxx xxxxxxxx xx Společenství, postačuje xxxxx xx výsledek xxxxxxxxx. Xxxxx xx xxxxxx, které xxxx xxxxxxxxx x&xxxx;xxxxxxxxxx xxx xxxxx, xxxx údaje xxxxxxxxxxx z rovnocenných xxxxxxx xx xxxx xxxxxxxxxxx xxxxxxxxx xx xxxxxxx xxxxxxxxxx látku jako xxxxx, xxxxx xx xxxxxxxxx xxxxxxx o povolení.
Studie, xxxxxx studií, xxxxx xxxx xxxxxxxxx x&xxxx;xxxxxxxxxx xxx dříve xxxx xxxxx xxxxxxxxx z rovnocenných xxxxxxx, xxxx xxx xxxxxxxxx x&xxxx;xxxxxxxxxxxxxx podle xxxxxxxxxxx xxxxx kvality (xxxx. xxxxxxx laboratorní xxxxx v souladu xx xxxxxxxx Xxxxxxxxxx parlamentu x&xxxx;Xxxx 2004/10/XX xx xxx 11.&xxxx;xxxxx 2004 x&xxxx;xxxxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxx týkajících xx xxxxxxxxx xxxxx xxxxxxx xxxxxxxxxxx praxe x&xxxx;xxxxxxxxx xxxxxx xxxxxxxxx xxx xxxxxxxxx xxxxxxxxxx látek (1) xxxx Mezinárodní xxxxxxxxxx xxx xxxxxxxxxxx (XXX).
Xxxxx xx xxxxxx in xxxx xxxx xx xxxxx xxxxxxxxx xxxx Xxxxxxxxxxxx, xxxxxxx xxxx xxxxxxxx, xx dotyčná xxxxxxxx xxxxxxxx xxxxxx xxxxxxx laboratorní praxe Xxxxxxxxxx xxx xxxxxxxxxxxx xxxxxxxxxx x&xxxx;xxxxxx (XXXX) xxxx normy ISO.
Fyzikálně-chemické, xxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxxx xxxxxxxxxx xx xxxx xxxxx xxxxx xxxxxxxxxxx směrnicí Xxxx 67/548/XXX ze xxx 27.&xxxx;xxxxxx 1967 x&xxxx;xxxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxx xxxxxxxxxx xx xxxxxxxxxxx, balení a označování xxxxxxxxxxxx xxxxx&xxxx;(2), naposledy xxxxxxxxxx xxxxxxxx Komise 2004/73/XX&xxxx;(3), xxxx xxxxxx xxxxxxxxxxxxxxx metod uznaných xxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx. Xxxxxxx xxxxxx xxxxx xxxx xxx xxxxxxxxxx.
Xx xxxxx podporovat xxxxxxxxx xxxxx in xxxxx xxxx xxxxx xxxxxxxxxxxxx xxxx nahrazujících xxxxxxx xxxxx xxxxxxxxx x&xxxx;xxxxxx xxxxxxxxxxxxx zvířat nebo xxxxxxxxxxx xxxxx xxxxxx xxxxxxxxx xxx xxxxxx xxxxxxx. Xxxx xxxxxx xxxx stejnou xxxxxxx x&xxxx;xxxxxxxxx xxxxxxx xxxxxx xxxxxxx jako metoda, xxxxxx xxxx xxxxxxxx.
Xxxxx xxxxx xxxxxxx x&xxxx;xxxxxxxx xxxx xx vodě xxxx být v souladu x&xxxx;xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxx xxxxxxxxxxx ve xxxxxxxx 2004/10/XX a/nebo xxxxx EN XXX/XXX 17025. Tyto xxxxxx xxxxxxxx požadavkům stanoveným x&xxxx;xxxxxx&xxxx;11 xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx (XX) x.&xxxx;882/2004 xx xxx 29.&xxxx;xxxxx 2004 o úředních xxxxxxxxxx xx účelem xxxxxxx dodržování xxxxxxxx xxxxxxxx xxxxxxxxxx se xxxxx x&xxxx;xxxxxxxx x&xxxx;xxxxxxxx x&xxxx;xxxxxx xxxxxx x&xxxx;xxxxxxx xxxxxxxxx podmínkách xxxxxx&xxxx;(4).
Xxxxx xxxxxxxxxxx xxxx xxxxxxxxx xxxxxxx xxxxxx x&xxxx;xxxxxxxx xxxxxxx xxxxxxx, xxx xxxx xxxxx xxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx.
Xxxxx xxxxxxxxxxx xxxxxxxx xxxxx xxxxx monitorování x&xxxx;xxxxxx xx uvedení xxxxx xx xxx, xxxxx se požaduje xxxxx xx.&xxxx;7 odst. 3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) č. 1831/2003, x&xxxx;xxxxx xx xxxxxxxxxx xxxxx čl. 7 odst. 3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (ES) x.&xxxx;1831/2003.
Xxxxxxxxx xxxxxxxxxxx
Xxxx xxxxxxxxx je xxxxxxxx xx xxxxxxxx, xxxxx mají xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx ve xxxxxx x:
|
x) |
xxxxxxx xxxxxx xxx xxxxxxxxxx navrhovaných xxxxxxxx xxx zapracování xx xxxxx xxxx xxxx x&xxxx;xxx násobku xxxxxx xxxxxx xxx xxxxxxxxx xxxxxxx xxx xxxxxxxxxx; |
|
x) |
xxxxxxxxxxxxx, xxxxx požívají potravinářské xxxxxxx xxxxxxx xx xxxxxx xxxxxxxxxxxxx doplňkovou xxxxx, xxxx xxxxxxx xxxx xxxxxxxxxx. V tomto xxxxxxx xxxx bezpečnost xxxxxxxxx stanovením maximálních xxxxxx xxxxxxx (MLR) x&xxxx;xxxxxxxxxx xxxx xx xxxxxxx xxxxxxxxxx xxxxx xxxxx (ADI) xxxx xxxxxxxx povolené dávky (XX); |
|
x) |
xxxxxx, xxxxx budou xxxxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx vdechnutím xxxx xxxxxxxxx xxxxxxxx, očí xx xxxx xxx xxxxxxxxxx x&xxxx;xxxxxxxxxx látkou xxxx takovou xxxx xxx xxxxx xxxxxxxxxxxxx xx premixů xxxx xxxxxxxxxxx krmiv nebo xxxx xx xxx xxxxxxxxx xxxxxx nebo xxxx, xxxxx obsahují xxxxxxxx xxxxxxxxxx xxxxx; |
|
x) |
xxxxxxxx x&xxxx;xxxxxxx xxxxxxxx xxxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxxxx genů xxxxxxxxxxxxx xxxx antimikrobiálním xxxxxx x |
|
x) |
xxxxxxxxx xxxxxxxxx, x&xxxx;xxxxxxx xx nebezpečí xxxxxxxxxxx z doplňkové xxxxx xxxxxxx xxxx produktů x&xxxx;xx xxxxxxxxxx, xx xx xxxxx x/xxxx xxxxxxxxxxx xxxxxxx. |
Xxxxx xx xxxxxxxxx látka více xxxxxx, každá xxxxxx xxxx být xxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxx xxx xxxxxxxxxxxx xxxxxxxxxx a posléze xxxxxxxxxxx s ohledem na xxxxxxxxxxx xxxxxx (xxx-xx xxxxxxxx, xx xxxx xxxxxxxx xxxxxxxxx k vzájemnému xxxxxxxx). Xxxxxxxxxxxx xx xxxxx xxxxxxxx xxxxxxxxx xxxxx.
Xxxxxxxxx xxxxxxxxx
Xxxx xxxxxxxxx xx založeno na xxxxxxxx, xxxxx xxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxx, xxxxx xxx x&xxxx;xxxxxx xxxxx, jak xx xxxxxxxxx x&xxxx;xx.&xxxx;6 xxxx.&xxxx;1 x&xxxx;xxxxxxx&xxxx;X&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003.
1.&xxxx;&xxxx;&xxxx;XXXXX&xxxx;X:&xxxx;XXXXXX XXXXXXXXXXX
1.1&xxxx;&xxxx;&xxxx;Xxxxxxx souhrn xxxxxxxxxxx podle xx.&xxxx;7 xxxx.&xxxx;3 písm. h) nařízení (XX) x.&xxxx;1831/2003
Xxxxxxx xxxxxxxx xxxxxx x&xxxx;xxxxxxxx xxxxxxxx vlastností xxxxxxx xxxxxxxxx xxxxx. Xxxxxx nesmí xxxxxxxxx xxxxx xxxxxxx údaje x&xxxx;xxxx xxx xxxx xxxxxxxxx:
1.1.1&xxxx;&xxxx;&xxxx;Xxxxx
|
x) |
xxxxx xxxxxxxx(x); |
|
x) |
xxxxxxxxxxxx xxxxxxxxx xxxxx; |
|
x) |
xxxxxx výroby a metoda xxxxxxx; |
|
x) |
xxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxx xxxxx; |
|
x) |
xxxxxxxxxx xxxxxxxx xxx xxxxx x |
|
x) |
xxxxx xxxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx uvedení látky xx trh. |
1.1.2. Popis
|
a) |
Jméno a adresa xxxxxxxx(x) Xxxx xxxxx musí xxx xxxxxxxxxx xx xxxxx xxxxxxxxx xxxxxxxxx xx xxxxx povolení xxxxxxxxx xxxxx (xxxxxxxx xxxxxx xx xxxxxxxx xxxx xxxxxxxx, které xxxx xxxxxx xx xxxxxxxx). Předkládá-li xxxxxxxxxxx xxxxxxx xxxxxxxx, xxxx xxx xxxxxxx xxxxx xxxxxxx xxxxxxxx. |
|
x) |
Xxxxxxxxxxxx doplňkové xxxxx Xxxxxxxxxxxx doplňkové xxxxx xxxxxxxx xxxxxxx požadovaných xxxxxxxxx xxxxx přílohy II xxxx&xxxx;XXX podle xxxxx xxxxxxxx xxxxxxxxx xxxxx. Xxxxxxxxx: xxxxx xxxxxxxxx xxxxx, xxxxxxxxxx xxxxxxxx xx xxxxxxxxx x&xxxx;xxxxxxx xxxxxxx, xxxxxx druhy/kategorie xxxxxx x&xxxx;xxxxx. |
|
x) |
Xxxxxx xxxxxx x&xxxx;xxxxxx analýzy Je xxxxx xxxxxx xxxxxxx xxxxxx. Xx xxxxx xxxxxx xxxxxx xxxxxxx xxxxxxxxxxxx metod, xxx mají xxx xxxxxxx pro xxxxxxx xxx xxxxxx xxxxxxxx xxxxxxxxx xxxxx jako xxxxxx, v premixech a krmivech xxxxx xxxxxxxxx xxxx xxxxxxx x&xxxx;xxxxxxx&xxxx;XXX. Xxxxxxxxx xx na xxxxxxx xxxxxxxxx předložených x&xxxx;xxxxxxx x&xxxx;xxxxx přílohou x&xxxx;xxxxxxxx&xxxx;XXX xxxxx postup xxxxxx (xxxxx) xxxxxxxxx x&xxxx;xxxxxxx xxx xxxxxx kontroly xxxxxxxxxxx látek xxxx xxxxxx xxxxxxxxxx v potravinách xxxxxxxxxxx původu. |
|
d) |
Studie xxxxxxxxxxx x&xxxx;xxxxxxxxx doplňkové látky Je xxxxx uvést závěr x&xxxx;xxxxxxxxxxx x&xxxx;xxxxxxxxx doplňkové xxxxx xx základě xxxxxxx provedených xxxxxx. Xxxxxxxx xxxxxx xxxxx xxx xxxxxxx v podobě xxxxxxx xx xxxxxxx xxxxxx xxxxxxxx(x). Xx xxxxxxx xx xxxx xxx xxxxxxx pouze xxxxxx xxxxxxxxxx podle xxxxxxx&xxxx;XXX. |
|
x) |
Xxxxxxxxxx xxxxxxxx xxx xxxxx Xxxxxxx(x)&xxxx;xxxxxxxx xxxxx xxxxxxxx xxx xxxxx. Xxxxxxx xxxxxxx xxxxxx obsah xxxxxxx ve vodě xxxx xxxxxx xxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxx xxx xxxxx v doplňkových xxxxxxxx. Xxxxxxxx se rovněž xxxxxxxxx, zda xx xxxxxxxxx xxxx způsoby xxxxxxxx nebo xxxxxxxxxxx xx xxxxxx nebo xxxx. Je xxxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxx xxx xxxxx (xxxx. xxxxxxxxxxxxxxx), zvláštní xxxxxxxxx xx označování x&xxxx;xxxxx xxxxxx, pro xxx xx xxxxxxxxx xxxxx určena. |
|
f) |
Návrh plánu xxxxxxxxxxxx x&xxxx;xxxxxx po xxxxxxx látky na xxx Xxxx xxxx xx xxxxxxxx pouze xx xxxxxxxxx xxxxx, které xxxxx xx.&xxxx;7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003 xxxxxxx xx kategorií a) nebo b) v čl. 6 xxxx.&xxxx;1 xxxxx xxxxxxxx, x&xxxx;xx doplňkové xxxxx, xxxxx spadají do xxxxxxx xxxxxxxxxx xxxxx Xxxxxxxxxxxx x&xxxx;xxxxxxx xx xxx produktů, xxxxx xx xxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxxxxxx organismů nebo xxxxxxxxx modifikované xxxxxxxxx xxxxxxxx nebo xxxx x&xxxx;xxxx xxxxxxxx. |
1.2&xxxx;&xxxx;&xxxx;Xxxxxxx shrnutí xxxxxxxxxxx
Xx nutno xxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxxx xxxxx x&xxxx;xxxxx xxxxx xxxxxxxxx xxxxxxxxxxxx na xxxxxxx xxxxxxx podle xxxx přílohy x&xxxx;xxxxxxx&xxxx;XXX. Xxxx xxxxxxx xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx (xxxxxxxx).
Xxxxxxx xxxx xxxxxxx xxxxxx xxxx přílohy x&xxxx;xxxxxxx se xxxxx xxxxxxxxxxxx xxxxxx s odkazem xx xxxxxxxxx xxxxxx xxxxxxxxxxx.
1.3&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxxx a ostatních xxxxx
Xxxxxxx xxxx xxxxx xxxxx x&xxxx;xxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx na xxxxxxx žádosti. Je xxxxx xxxxxxxx xxxxxxxx xxxxx x&xxxx;xxxxxxx xx xxxxxx x&xxxx;xxxxxx.
1.4&xxxx;&xxxx;&xxxx;Xxxxxx xxxxx xxxxxxxxxxx, x&xxxx;xxxxx xx xxx xxxxxxxxx jako x&xxxx;xxxxxxxxx xxxxx
Xxxxxx xxxxxxxx xxxxx xx xxxxxxxxx xxxxxx a strany xxxxxxxxxxx.
2.&xxxx;&xxxx;&xxxx;XXXXX&xxxx;XX: XXXXXXXX, XXXXXXXXXXXXXXX A PODMÍNKY XXX XXXXX DOPLŇKOVÉ XXXXX; XXXXXX XXXXXXX
Xxxxxxxxx xxxxx musí xxx xxxx xxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxxx.
2.1&xxxx;&xxxx;&xxxx;Xxxxxxxx xxxxxxxxx látky
2.1.1 Název doplňkové xxxxx
Xxxxxxxx xx xxxxx xxxxxxxxxx xxxxxxxx název xxxxxxxxxxx látek xxxxxxxx xx xxxxxxxx povolení.
2.1.2 Návrh xx xxxxxxxx
Xx xxxxx xxxxxxxxx xxxxx na xxxxxxxx xxxxxxxxx xxxxx xx xxxxx xx xxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxx xxxxxx podle xxxxxx xxxxxxxx funkcí x&xxxx;xxxxxxx x&xxxx;xxxxxxx&xxxx;6 a přílohou I nařízení (XX) x.&xxxx;1831/2003.
Xxxx být xxxxxxxxxx xxxxx x&xxxx;xxxxxx známých xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxx nebo xxxxxxx (xxxx. xxxxx x&xxxx;xxxxxxxxxxx, xxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxx, xxxxxxxxxxx x&xxxx;xxxxxxxx). Xx nutno xxxxx xxxxxxxx jiná xxxxxxxx xxxx xxxxxxxxx látka xxxx potravinářská přídatná xxxxx, xxxxxxxxxxx xxxxxx xxxxxxxxx nebo xxxx xxxx xxxxxxxx účinné xxxxx.
2.1.3&xxxx;&xxxx;&xxxx;Xxxxxxxxxxxx a kvantitativní xxxxxxx (xxxxxx látka/činidlo, jiné xxxxxx, xxxxxxxxx, xxxxxxxxxxx xxxxxxxxxxxx xxxxx)
Xx xxxxx xxxxx xxxxxxx xxxxx(x)/xxxxxxx(x)&xxxx;x&xxxx;xxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxxx x&xxxx;xxxxxxxx xxxxxxxxxxxx xxxxxx x&xxxx;xxxxxxx xxxxxxxx. Xx xxxxx xxxxxxxx xxxxxxxxxxxx a kvantitativní xxxxxxxxxxx xxxxxxxxxxxx xxxxx xxxxxx xxxxx (látek) / xxxxxxx (činidel).
Pro mikroorganismy: xx xxxxx stanovit xxxxx životaschopných buněk xxxx xxxx xxxxxxxxx xxxx CFU xx xxxx.
Xxx xxxxxx: je xxxxx xxxxxx xxxxxxx xxxxxxx (xxxxxx) xxxxxxxx x&xxxx;xxxxx xxxxxxxx xxxxxxxx x&xxxx;xxxxx xxxxxxx xxxxxxxx. Xx xxxxx xxxxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxx. Vymezí xx xxxxxxxx xxxxxxxx, pokud xxxxx jako μmoly xxxxxxxx xxxxxxxx za xxxxxx xx xxxxxxxxx, xxxxxx x&xxxx;xxxxxxxx xX x&xxxx;xxxxxxx.
Xx-xx účinná xxxxxx xxxxxxxxx xxxxx xxxxx xxxxxxxx xxxxx nebo xxxxxxx, přičemž všechny xxx jednoznačně xxxxxxxxx (xxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxx), xxxx xxx složky účinné xxxxx (xxxxx) / xxxxxxx (xxxxxxx) xxxxxxx xxxxxxxxxx x&xxxx;xxxxxxxx podílů x&xxxx;xxxx směsi.
Ostatní xxxxx, xxxxxxx xxxxxx xxxxx xxxxxx jedním xxxxxxxxx xxxxxxx x/xxxx není xxxxx všechny složky xxxxxxxxxxxxx, xxxx být xxxxxxxxxxxxxxxx xxxxx xxxxxx (xxxxxx) xxxxxxxxxxxxxx x&xxxx;xxxx xxxxxxxx a/nebo xxxxx xxxxxxx hlavní xxxxxx (xxxxxx).
Xxxx xx xxxxxxx xxxxxxxx žádost x&xxxx;xxxxxxxxx xxxxxxxxx předložená xxxxxx xxxxx xx.&xxxx;8 odst. 2 xxxxxxxx (XX) x.&xxxx;1831/2003, xxxxxxx xxxx xxxxxxxx xxxxx xxxxxxxxx složek, xxxxx xxxxxxxxxxxxx bezpečnostní xxxxxx, xxxxxx xxx xxxxxx xxxxx xxxx xxxxxxx x&xxxx;xxxxxxx doplňkových xxxxx, xxxxx nejsou xxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxxx xxxxx, kokcidiostatik x&xxxx;xxxxxxxxxxxxxxx x&xxxx;xx xxx xx nevztahuje xxxxxx xxxxxxxxxx nařízení (ES) x.&xxxx;1829/2003. Xxxxxxx studie xxxxxxx x&xxxx;xxxxxxxxxxx xxxx xxx xxxxxxxxxx xxxxxxxx xx xxxxxxxxx doplňkové xxxxx, pro xxx xx požaduje xxxxxxxx, x&xxxx;xxxxx xxxxxxxxxx informace x&xxxx;xxxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxx. Xx xxxxx xxxxxxx xxxxxxx xxxxxxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxxxxx třetích xxxxx a je xxxxx xxxxxxx xx účelem xxxxxxxxxxx identifikátorů a potvrzení, xx se identifikátor(y) vztahuje(í) na xxxxxxx, xxx xxx xx xxxxxx žádost.
2.1.4 Čistota
Žadatel xxxxxxxxxxxx x&xxxx;xxxxxxx xxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxx, xxxxx x&xxxx;xxxxxxxxx xxxx xxxxxx xxxxxxxxxxx vlastnostmi, xxxxx xxxxxx xxxxxxx xxxxxxx x&xxxx;xxxxxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxx xxxxx. X&xxxx;xxxxxxxx xxxxxxxxxxxxx xxxxxxx žadatel xxxxxxx xxxxxxxxxxxx produkčních xxxxxxxxx x&xxxx;xxxxxxxxx xxxxx. Je xxxxx xxxxxx protokol xxxxxxxxx k rutinní xxxxxxxx xxxxxxxxx šarží x&xxxx;xxxxxxx xx znečišťující xxxxx x&xxxx;xxxxxxxxx.
Xxxxxxx poskytnuté xxxxx xxxx podpořit návrh xx xxxxxxxxxxx xxxxxxxxx xxxxx.
Xxxx xxxx xxxxxxx xxxxxxxx xxxxxxxxx v závislosti xx xxxxxxxx xxxxxxx, xxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxx Xxxxxxxxxxxx.
2.1.4.1&xxxx;&xxxx;&xxxx;Xxxxxxxxx xxxxx, xxxxxxx xxxxxxxx xx xxxxxx na xxxxxxxx xxxxxxxx
X&xxxx;xxxxxxxxxxx xxxxx, xxxxxxx xxxxxxxx xx xxxxxx xx xxxxxxxx xxxxxxxx, xx nutno xxxxx příslušné informace xxxxxxxx xx xxxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxx xx xxxxxxx xxxxxxxxxxx xxxxx používaných x&xxxx;xxxxx xxxxxxxxxxxx xxxxxx. Je xxxxx použít specifikace Xxxxxxxxxx xxxxxx xxxxxxxxx XXX/XXX xxx xxxxxxxxxxxxx xxxxxxxx xxxxx (JECFA) xxxx xxxxxxxxxxx z povolení Xxxxxxxxxx xxxxxxxxxxxx xxx xxxxxxxxxxxxx xxxxxxxx xxxxx.
2.1.4.2&xxxx;&xxxx;&xxxx;Xxxxxxxxx xxxxx, xxxxxxx xxxxxxxx xxxx vázané na xxxxxxxx povolení
U doplňkových xxxxx, xxxxxxx povolení xxxx xxxxxx xx držitele xxxxxxxx, je xxxxx xxxxxx stávající xxxxx xxxxxxxxx x&xxxx;xxxxx xxxxxxxxxxxx xxxxxx xxxx normy xx xxxxxxxxxxxxx xxx xxxxxxxxxxxxx přídatné xxxxx xxxxxxxx x&xxxx;Xxxxxxxxx xxxxxxxxxxxx xxxx XXXXX. Xxxxxx-xx xxxxxx xxxxx xxxxxxxx xxxx xx-xx to xxxxxxxx xxx výrobní xxxxxx, je xxxxx xxxxxx xxxxxxxxxxxx níže xxxxxxx xxxxx x&xxxx;xxxxxxxx xxxxxxxxxxx:
|
— |
xxx xxxxxxxxxxxxxx: xxxxxxxxxxxxxxx xxxxxxxxxxx, xxxxxxxxxx, těžké xxxx; |
|
— |
xxx xxxxxxxx xxxxxxxxxxxxx xxxxxxx (xxxxx neobsahují xxxxxxxxxxxxxx xxxx xxxxxx xxxxxxx): xx nutno xxxxxxx xxxxxx xxxxxxxxx xxxx xxx xxxxxxxx xxxxxxxxxxxxxx (xxx xxxx). Xx xxxxx xxxxx xxxxxx xxxxxx, x&xxxx;xxxx xx xx xxxxxxxx xxxxxxxx zapracováno xxxxxxx xxxxxxxxxx medium; |
|
— |
pro látky xxxxxxxxxxx xxxxxx: mikrobiologická x&xxxx;xxxxxxxxx kontaminace (xxxxxxx xxxx. xxxxxx xxxxxx, xxxxxx plevele, xxxxx xxxxx), mykotoxiny, kontaminace xxxxxxxxx, xxxxxxxxx xxxxxxx xxx xxxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxxxxx xxxxxxxx látky, x&xxxx;xxxxx xx známo, xx xx xxxxxxxxx x&xxxx;xxxxxxx rostlině; |
|
— |
pro látky xxxxxxxxxxx xxxxxx: mikrobiologická xxxxxxxxxxx, xxxxx xxxx x&xxxx;xxxxxxxxx xxxxxxxxx xxxxxxx xxx rozpouštědla; |
|
— |
pro xxxxxxxxx xxxxx: těžké kovy, xxxxxxx x&xxxx;XXX; |
|
— |
xxx produkty xxxxxxxx xxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxx: xxxx xx xxxxxxx chemické xxxxx xxxxxxx v syntetických xxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxx xxxxxxxx x&xxxx;xxxxx se xxxxxx xxxxxxxxxxx. |
Xxxxxxxxx xx xxxxxxx xxxxxxx mykotoxinů pro xxxxxxx xxxxx různých xxxxxx.
2.1.5&xxxx;&xxxx;&xxxx;Xxxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxx produktu
U přípravků x&xxxx;xxxxx xxxxx xx xxxxxxxxx xxxxx o rozdělení xxxxx xxxxxxxxx xxxxxx, xxxxx xxxxxx, xxxxxxx, objemové xxxxxxx, protiprašných xxxxxxxxxxxx x&xxxx;xxxxxxx xxxxxxx, xxxxx xxxx xxxx xx xxxxxxxxx vlastnosti. X&xxxx;xxxxxxxxx x&xxxx;xxxxxxxx xxxxx se xxxxxxxxx xxxxx x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxx. Pokud xx doplňková xxxxx xxxxxx k použití xx xxxx, je xxxxx xxxxxxxx xxxxxxxxxxx xxxx xxxxxx disperze.
2.2 Charakteristika xxxxxx xxxxx (látek) / xxxxxxx (xxxxxxx)
2.2.1&xxxx;&xxxx;&xxxx;Xxxxx
Xx xxxxx xxxxx kvalitativní xxxxx xxxxxx xxxxx nebo xxxxxxx. Xx xxxxxxxx xxxxxxx x&xxxx;xxxxx xxxxx xxxx xxxxxxx x&xxxx;xxxx xxxxxxxx xxxxxxxxxxxxxxx.
2.2.1.1&xxxx;&xxxx;&xxxx;Xxxxxxxx látky
Chemicky xxxxxx definované xxxxx xx nutno xxxxxx xxxxxxxx xxxxxx, chemickým xxxxxxxxx xxxxx xxxxxxxxxx XXXXX (International Union xx Xxxx xxx Xxxxxxx Xxxxxxxxx), xxxxxxx xxxxxxxxxxxxx xxxxxxxxx názvy x&xxxx;xxxxxxxxx x/xxxx xxxxxx XXX (Xxxxxxxx Xxxxxxxx Xxxxxxx). Xx xxxxx xxxxx xxxxxxxxxxxx a empirický xxxxxx x&xxxx;xxxxxxxxxxx hmotnost.
U chemicky xxxxxxxxxx sloučeniny xxxxxxx xxxx zchutňující xxxxx xx xxxxx xxxxx xxxxx FLAVIS spolu x&xxxx;xxxxxxxxxx chemickou xxxxxxxx. X&xxxx;xxxxxxxxxxx xxxxxxx je xxxxx xxxxx fytochemické xxxxxxx.
Xxxxx, x&xxxx;xxxxx xxxxx xxxxxx popsat jedním xxxxxxxxx xxxxxxx x/xxxx x&xxxx;xxxxx xxxxx xxxxxxx xxxxxx identifikovat, je xxxxx xxxxxxxxxxxxxxx xxxxx xxxxxx (složek) xxxxxxxxxxxxxx x&xxxx;xxxx aktivitě a/nebo xxxxx xxxxxxxxx hlavních xxxxxx. Je xxxxx xxxxxxxxxxxxx markerovou xxxxxxxxxx, xxx xxxx xxxxx xxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxxxxx.
Xxx xxxxxx a přípravky xxxxxx xx nutno xxx xxxxxx udávanou xxxxxxxx xxxxx číslo x&xxxx;xxxxxxxxxxxx název xxxxxxxxxx Xxxxxxxxxxx xxxx biochemie (XXX) v posledním xxxxxx „Xxxxxxxxxx enzymů“. X&xxxx;xxxxxxx xxxxx xxxxxxxxxxxx se xxxxxxx xxxxxxxxxxxx xxxxx xxxxxxxxxxxx pravidlům xxxxxxxxxx XXX. Xxxxxx xxxxx xxxx přípustné xx xxxxxxxxxxx, xx jsou xxxxxxxxxxx a jsou používány xxxxxxxxxxxx v celé xxxxxxxxxxx x&xxxx;xxx xxxxxx první xxxxxx xx lze xxxxxxxxxxx xxxxxxxxx xx xxxxxxxxxxxx xxxxx a číslo XXX. Xx nutno xxxxx biologický xxxxx xxxxx xxxxxxxx xxxxxxxx.
Xx xxxxx xxxxxx xxxxxx xxxxxxxxxxx xxxxx xxxxxxxxxx xxxxx vzniklých xxxxxxxxxx (xxx xxx&xxxx;2.2.1.2 Xxxxxxxxxxxxxx).
2.2.1.2&xxxx;&xxxx;&xxxx;Xxxxxxxxxxxxxx
Xx xxxxx xxxxx xxxxx xxxxx xxxxxxxxxxxxxx xxxxxxxxxxx xxxx produkt xxxx xxxxxxx xxxx.
X&xxxx;xxxxxxxxxxxxxx xxxxxxxxxxx xxxx xxxxxxx xxxx xxxx výrobní xxxx xx nutno uvést xxxxxxxx xxxx. Xxxxx xx xxxxx a taxonomická xxxxxxxxxxx xxxxxxx xxxxxxxxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxxxxxx xxxxx v mezinárodních xxxxxxxxxxxxxxx xxxxxx (ICN). Xxxxxxxxxxx xxxxx musí být xxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxx xxxxxx xxxxxx (pokud xxxxx x&xxxx;Xxxxxxxx xxxx) x&xxxx;xxxxxxxxxx xxxxxxx xxxxxx xx povolenou xxxx xxxxxxxxx xxxxxxxxx xxxxx. Xx xxxxx předložit xxxxxxxxx o uložení xx xxxxxx, které xxxxxxxxx xxxxxxxxx xxxxx, xxx xxxxxx xx kmen xxxxxx. Xxxx xx xxxxx popsat všechny xxxxxxxxxx morfologické, xxxxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxxxxxxxx nezbytné xxx xxxxxxxxxx xxxxxxxxxxxx xxxxx x&xxxx;xxxxxxxxxx potvrzení xxxx xxxxxxxxx xxxxxxxxx. X&xxxx;xxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx xx xxxxx popis xxxxxxxxxxx xxxx. Xxx xxxxx geneticky xxxxxxxxxxxx xxxxxxxxxx se xxxxx xxxxxxxxxxx identifikační kód xxxxx xxxxxxxx Xxxxxx (XX) č. 65/2004 ze xxx 14. ledna 2004, xxxxxx xx xxxxxxx xxxxxx tvorby x&xxxx;xxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxxxxx kódů xxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxx.
2.2.2&xxxx;&xxxx;&xxxx;Xxxxxxxx xxxxxxxxxx
2.2.2.1&xxxx;&xxxx;&xxxx;Xxxxxxxx xxxxx
Xx xxxxx xxxxx xxxxx xxxxxxxxxxx a chemických vlastností. Xxxxxxxxx rozkladu, xXx, xxxxxxxxxxxxxxx vlastnosti, xxx xxxx, xxx xxxx, xxxxxxx, xxxx xxx, xxxxxxxxxxx ve vodě x&xxxx;x&xxxx;xxxxxxxxxxx rozpouštědlech, Xxx x&xxxx;Xx/Xxx, hmotnostní spektrometrie x&xxxx;xxxxxxxxx spektra, xxxxx XXX, případné izomery x&xxxx;xxxxxxxxx xxxx důležité xxxxxxxxx xxxxxxxxxx xxxx xxx uvedeny, xxx xx to xxxxxx.
Xxxxx xxxxxxx xxxxxxxxxxxxxxx fermentačního xxxxxxx xxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxxxxx x&xxxx;xxxxxxx nebo xxxxxx.
2.2.2.2&xxxx;&xxxx;&xxxx;Xxxxxxxxxxxxxx
|
— |
Xxxxxx x&xxxx;xxxxxxx xxxxxxxxx Xx xxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xxxx faktorů xxxxxxxxx xxxx jejich xxxxxxxxxxxx. Xxxxx bakterií xxxxxxxxxx xx xxxxxxxxxxx xxxxxxx, xxxxx xxxxxxxx xxxxxxxxxxx, x&xxxx;xxxxx je xxxxx, xx mohou xxxxxxxxxx xxxxxx nebo xxxx xxxxxxx xxxxxxxxx, xx xxxxx xxxxxxxx odpovídajícím xxxxxx x&xxxx;xxxxx xxxxxxxx xx molekulové x&xxxx;xxxxxxxxx xxxxxxx úrovni, xx xxxxxxxxxx xxxxx k obavám. U kmenů xxxxxxxxxxxxxx, xxx xxx xxxxxx x&xxxx;xxxxxxxxx xxxxx x&xxxx;xxxxxxx bezpečném používání x&xxxx;xxxxxxx biologie není xxxxx dostatečně známa, xx xxxxxxxx xxxx xxxxxxx toxikologických xxxxxx. |
|
— |
Xxxxxxxx xxxxxxxxxx a rezistence xxxx xxxxxxxxxxxx Xxxxxxxxxxxxxx xxxxxxxxx jako xxxxxxxxx xxxxx xxxx xxxx xxxxxxx kmen xxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxx nebo xxxxx xxx xxxxxxx produkovat xxxxxxxxxxxx xxxxx, které xxxx důležité jako xxxxxxxxxxx u člověka x&xxxx;xxxxxx. Xxxxx xxxxxxxxxxxxxx určené x&xxxx;xxxxxxx xxxx doplňkové látky xxxxx dále přispívat x&xxxx;xxxxxx xxxx xxxxxxxxxx xxxx xxxxxxxxxxxx, xxxxx xx xxx xxxxxxxxx x&xxxx;xxxxxxx xxxxx xxxxxx x&xxxx;x&xxxx;xxxxxxxx xxxxxxxxx. Xxxxxxx xxxxx bakterií xx xxxxx xxxxx xxxxxxxxx xx xxxxxxxxxx vůči xxxxxxxxxxxx xxxxxxxxxx v humánním x&xxxx;xxxxxxxxxxxx xxxxxxxxx. Xx-xx xxxxxxxx rezistence, je xxxxx zjistit genetický xxxxxx xxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxxxxx xxxxxxxxxx na xxxxxxx xxxxxxxxx xx xxxxxxxx. Xxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxx antimikrobiální rezistenci xx nesmí xxxxxxxx xxxx xxxxxxxxx xxxxx, xxxxx-xx prokázat, xx xxxxxxxxxx je xxxxxxxxx xxxxxxxxxxxx xxxxxx(x)&xxxx;x&xxxx;xxxx xxxxxxxx. |
2.3&xxxx;&xxxx;&xxxx;Xxxxxxx xxxxxx, xxxxxx zvláštních xxxxxxxxx xxxxxxx
Xx xxxxxxxxx xxxxxxxxxx míst procesu, xxxxx xxxxx xxx xxxx na xxxxxxx xxxxxx látky / xxxxxxx (činidel) xxxx xxxxxxxxx xxxxx, xx xxxxx popis xxxxxxxxx xxxxxxx. Je xxxxx xxxxxxxxx listy s údaji x&xxxx;xxxxxxxxxxx xxxxxxxxx u chemických xxxxx xxxxxxxxxxx ve xxxxxxxx xxxxxxx.
2.3.1&xxxx;&xxxx;&xxxx;Xxxxxx xxxxx(x) / xxxxxxx(x)
Xx xxxxx xxxxxxxxxx xxxxx výrobního xxxxxxx (xxxx. chemická xxxxxxx, xxxxxxxxxx, xxxxxxxxx, xxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxx xxxx destilace) xxxxxxxxx xxx xxxxxxxx xxxxxx xxxxx (xxxxx) / xxxxxxx (xxxxxxx) doplňkové xxxxx, případně xxxxxxxxxxxxxxx xxxxxxxxxxx xxxxxxxx. Xxxxx xx xxxxxxx fermentačního/kultivačního xxxxx. Xx xxxxx xxxxxx xxxxxxxx xxxxxx xxxxxxx.
X&xxxx;xxxxxxxxx modifikovaných mikroorganismů (XXX) xxxxxxxxxxx xxxx xxxxx xxxxxxxxxxx xxxxx x&xxxx;xxxxxxxxxxxxx xx podmínek xxxxxxxxxx xxxxxxxxx xx xxxxxxx xxxxxxxx Xxxx 90/219/XX&xxxx;(5). Xx nutno xxxxx xxxxx fermentačních xxxxxxx (xxxxxx xxx xxxxxxx, fermentační xxxxxxxx x&xxxx;xxxxxxxx zpracování xxxxxxxx xxxxxxxxxxxxx xxxxxxx).
2.3.2&xxxx;&xxxx;&xxxx;Xxxxxxxxx xxxxx
Xxxxxxxx xx xxxxxxxx xxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxx. Xx xxxxx xxxxx xxxxxx xxxxxx xxxxxx xxxxxxxxx látky, xxxxxx xxxx (místa) xxxxxxxxxxx účinné xxxxx (xxxxx) / xxxxxxx (xxxxxxx) x&xxxx;xxxxxx xxxxxx x&xxxx;xxxxxxx xxxxxxxx xxxxxx xxxxxxxxxx, xxxxx mají xxxx xx xxxxxxxx xxxxxxxxx látky, případně xxxxxxxxxxxxxxx xxxxxxxxxxx xxxxxxxx.
2.4&xxxx;&xxxx;&xxxx;Xxxxxxxxx-xxxxxxxx x&xxxx;xxxxxxxxxxxxx vlastnosti xxxxxxxxx xxxxx
2.4.1&xxxx;&xxxx;&xxxx;Xxxxxxxxx
Xxxxxxxxx xx xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxx xxxxx (xxxxx) / xxxxxxx (činidel) xxxx xxxx (xxxx) xxxxxxxx/xxxxxxxxxxxxxxxx. U enzymů xxx xxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx xx ztrátu xxxxxxxxxxx xxxxxxxx; u mikroorganismů s ohledem xx xxxxxx životaschopnosti; x&xxxx;xxxxxxxxxxxxx xxxxx x&xxxx;xxxxxxx xx xxxxxx xxxxx. X&xxxx;xxxxxxxxx chemických xxxxx/xxxxxxxx xxx stabilitu posuzovat xxxxxxxxxx koncentrace jedné xxxx xxxxxxxx xxxxxxxx xxxxxxxxxxxxxx xxxxx.
Xxxxxxxxx doplňkové xxxxx
Xx xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxx xxxxx při xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx (světlo, teplota, xX, vlhkost, kyslík x&xxxx;xxxxxxx xxxxxxxxx). Xxxxxxxxxxxxx xxxxxxxxxxx doplňkové xxxxx x&xxxx;xxxxxxxxxxxxxx xxxxx xx xxxx xxx založena xx nejméně dvou xxxxxxxxxx situacích xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxx xxx xxxxx (xxxx. 25&xxxx;xX, 60&xxxx;% xxxxxxxxx xxxxxxx vzduchu x&xxxx;40&xxxx;xX, 75&xxxx;% xxxxxxxxx xxxxxxx xxxxxxx).
Xxxxxxxxx xxxxxxxxx xxxxx xxxxx v premixech x&xxxx;xxxxxxxx
X&xxxx;xxxxxxxxxxx xxxxx xxxxxxx x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxxxx xxxxxx xx xxxxxxxxx xxxxxxx xxxxxxx doplňkové xxxxx xxxxx za xxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxxx xxxxxxx x&xxxx;xxxxx. Xxxxxx xxxxxxxxx xxxxxxx xxxx xxxxx xxxxxxx xxxx xxxxxx. Stabilita xx xxxxxxx xxxxx xxxxx x&xxxx;xxxxxxx xxxxxxxxxxxx xxxxxxx prvky; v opačném xxxxxxx xx xxxxxxxxx xxxxx xxxx xxx xxxxxxxx xxxxxxx „xxxxxxxx xx stopovými prvky“.
Studie xxxxxxxxx x&xxxx;xxxxx trvají xxxxxxxx xxxxxxx tři xxxxxx. Obvykle xx xxxxxxxxx xxxxxxxxxx u krmiv xx xxxxx xxxx x&xxxx;xxxxxxxxxxxx krmiv (xxxxxx xxxxx peletování xxxx xxxxxx xxxxx úpravy) xxx hlavní xxxxxxx xxxxx zvířat.
U doplňkových xxxxx xxxxxxxx k použití ve xxxx xx xxxxx xxxxxxxxx xxxxxxx složení xxxxxxxxx xxxxx xxxxxx xx xxxx za xxxxxxxx simulujících použití x&xxxx;xxxxx.
Xxxxx-xx xx xxxxxx xxxxxxxxx x&xxxx;xx vhodných xxxxxxxxx xx xxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxx.
Xx xxxxx xxxxxxxxxx xxxxx x&xxxx;xxxxxx, xxxxx xxxxxxxx xxxxxxx xxxxx xxxxxxxxxx xx xxxxxxx x&xxxx;xxxxx xx xxxxx xxxx xxxxxxxxxx.
X&xxxx;xxxxxxx xxxxxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxx složení premixů xxxx xxxxx xxxxxxxxx xxx zkoušky.
2.4.2 Homogenita
Je nutno xxxxxxxx schopnost xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx (xxxxx xxxxxxxxxxxxx složek) x&xxxx;xxxxxxxxx, xxxxxxxx nebo xx xxxx.
2.4.3&xxxx;&xxxx;&xxxx;Xxxxxxx xxxxxxxxxx
Xx xxxxx xxxxxx ostatní xxxxxxxxxx, xxxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxxxxxxxx nebo xxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxxxx.
2.4.4&xxxx;&xxxx;&xxxx;Xxxxxxxxx-xxxxxxxx xxxxxxxxxxxxxxx xxxx xxxxxxxxx
Xx xxxxx uvést fyzikálně-chemické xxxxxxxxxxxxxxx nebo xxxxxxxxx, x&xxxx;xxxx xx mohlo xxxxx ve xxxxx x&xxxx;xxxxxx, xxxxxx, xxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxx xxxx léčivými xxxxxxxxx.
2.5&xxxx;&xxxx;&xxxx;Xxxxxxxx xxx užití xxxxxxxxx xxxxx
2.5.1&xxxx;&xxxx;&xxxx;Xxxxxxxxxx způsob použití xx výživě xxxxxx
Xx xxxxx uvést xxxx xxxx xxxxxxxxx xxxxxx, xxxxxxx xxxxxxx nebo xxxxxxxxx xxxxxxx xxxxxx x&xxxx;xxxxxxx s kategoriemi v příloze IV xxxxxx xxxxxxxx. Xx xxxxx xxxxxx xxxxx xxxxxxxxxxxxxx. Xxxxx xx xxxxxxxxxx xxxxxxx v krmivu xxxx ve vodě.
Je xxxxx xxxxx navrhovaný xxxxxx xxxxxxxx x&xxxx;xxxxxxxxxxx xxx xxxxxxx, xxxxxx xxxx xxxxxx vodu. Xxxxx xx navrhovaná xxxxx x&xxxx;xxxxxxxxxx xxxxxx x&xxxx;xxxxxxxxxx xxxx xxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxx. Xxxxx xx xxxxxxxx konkrétní xxxxxxx xxxxxxxxx xxxxx x&xxxx;xxxxxxxxxx xxxxxx, je xxxxx xxxxxxxxxx.
2.5.2&xxxx;&xxxx;&xxxx;Xxxxxxxxx xxxxxxxxxxx s bezpečností xxx xxxxxxxxx/xxxxxxxxxx
2.5.2.1&xxxx;&xxxx;&xxxx;Xxxxxxxx xxxxx
Xx xxxxx xxxxxxxxxx listy x&xxxx;xxxxx x&xxxx;xxxxxxxxxxx materiálu xx xxxxxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxxxxx Komise 91/155/XXX ze xxx 5.&xxxx;xxxxxx 1991, xxxxxx xx x&xxxx;xxxxxxxxx xxxxxx&xxxx;10 xxxxxxxx 88/379/EHS vymezují x&xxxx;xxxxxxx podrobná xxxxxxxx x&xxxx;xxxxxxx xxxxxxxxxxxx xxxxxxxxx xxx xxxxxxxxxx xxxxxxxxx&xxxx;(6). X&xxxx;xxxxxxx xxxxxxx xx xxxxx navrhnout opatření xxx xxxxxxxxxxx xxxxxxxxx xxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxx xxx výrobě, xxxxxxxxxx, xxxxx a likvidaci.
2.5.2.2 Mikroorganismy
Je xxxxx xxxxx xxxxxxxxxxx xxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx 2000/54/XX xx xxx 18.&xxxx;xxxx 2000 x&xxxx;xxxxxxx xxxxxxxxxxx xxxx xxxxxx spojenými x&xxxx;xxxxxxxx xxxxxxxxxxx xxxxxxxxx xxx xxxxx (xxxxx xxxxxxxxxx xxxxxxxx xx&xxxx;xxxxxx čl. 16 xxxx.&xxxx;1 xxxxxxxx 89/391/EHS) (7). X&xxxx;xxxxxxx xxxxxxxxxxxxxx nezařazených xx xxxxxxx&xxxx;1 xxxx xxxxxxxx je xxxxx xxxxxxxxxx spotřebitelům informace, xxxxx xxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xx xxxxxxx xxxxxxxxxx, xxx xx xxxxxxxxx x&xxxx;xx.&xxxx;3 xxxx.&xxxx;2 xxxxxxx xxxxxxxx.
2.5.2.3&xxxx;&xxxx;&xxxx;Xxxxxxxxx xx označování
Aniž xxxx dotčena xxxxxxxxxx x&xxxx;xxxxxxxxxx x&xxxx;xxxxxx xxxxxxxx x&xxxx;xxxxxx&xxxx;16 xxxxxxxx (XX) x.&xxxx;1831/2003, xx nutno xxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxxx a popřípadě xxxxxxxx xxxxxxxx pro xxxxx a manipulaci (xxxxxx xxxxxxx xxxxxxxxxxxxxxx a kontraindikací) x&xxxx;xxxxxx xxx správné xxxxxxx.
2.6&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxx x&xxxx;xxxxxxxxxx xxxxxx
Xxxxxx xxxxxxx xx xxxxxx ve standardní xxxxxx xxxxx doporučení xxxxx XXX (xx. XXX 78-2).
Xxxxx xxxxxxxx (XX) x.&xxxx;1831/2003 a nařízení (XX) x.&xxxx;378/2005 xxxxxx xxxxxxx xxxxxxx x&xxxx;xxxxx xxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx Společenství. Xxxxxxxxxx xxxxxxxxx Xxxxxxxxxxxx xxxxxxxx xxxxx hodnotící zprávu, x&xxxx;xxx xx xxxxx, xxx xxxx tyto xxxxxx xxxxxx xxx xxxxxxx za xxxxxx xxxxxxxx xxxxxxx xxxxxxxxx xxxxx, xx xxx xx xxxxxx xxxxxxxx. Xxxxxxxxx referenční laboratoře Xxxxxxxxxxxx se xxxxxx xx xxxxxx xxxxxxxxx x&xxxx;xxxxxx&xxxx;2.6.1 x&xxxx;2.6.2.
Xxxxx byl xxxxxxxx XXX xxx xxxxx, xx niž xx xxxxxxxx xxxxxxxx Xxxx (EHS) č. 2377/90 xx xxx 26. června 1990, kterým xx xxxxxxx postup Xxxxxxxxxxxx xxx xxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxx xxxxxxxxxxxxx xxxxxxxx přípravků v potravinách xxxxxxxxxxx xxxxxx&xxxx;(8), xxxxxx xxx&xxxx;2.6.2 xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx Xxxxxxxxxxxx. Xxxxxxx xxxxxxx xxx&xxxx;2.6.2 xxxxxxxxxx xxxxxxx xxxxxx, xxxxxxxxx x&xxxx;xxxxx (xxxxxx xxxxxxxxxxx xxxxxxxxxxx), xxx xxxx xxx xxxxxxxxxx Xxxxxxxx xxxxxxxx xxx xxxxxx xxxxxxxxx (EMEA) x&xxxx;xxxxxxx x&xxxx;xxxxxxxx&xxxx;X&xxxx;xxxxxxxx (XXX) x.&xxxx;2377/90 a podle xxxxxxxxx „Xxxxxx xx Applicants xxx Xxxxxxxxxx“, xxxxxx&xxxx;8 „Xxxxx governing xxxxxxxxx xxxxxxxx xx the Xxxxxxxx Union“.
V hodnocení xxxxx xxx xxxxxxxx xxxxxx xxxxxxxxxx xxxxxx xxxxxxx x&xxxx;xxxx&xxxx;2.6.3, xxxxx to xxxxxxxxxx xxxxxxxxx Xxxxxxxxxxxx, xxxx xxxx Komise xxxxxxxx za xxxxxxxx.
X&xxxx;xxxxxxx x&xxxx;xxxxxxxxx (ES) x.&xxxx;378/2005 xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxx přímo referenční xxxxxxxxxx Xxxxxxxxxxxx xxxx xxxxxxxxxxxx technické dokumentace x&xxxx;xxxxxxxx vzorky před xxxxxxxxx doby xxxxxxxxxxxxx.
Xxxxxxxx xxxxxx na xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx Xxxxxxxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxx&xxxx;12 xxxxxxxx (XX) x.&xxxx;378/2005.
2.6.1&xxxx;&xxxx;&xxxx;Xxxxxx analýzy xxx xxxxxxx xxxxx
Xx xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxxx (xxxxx) xxx zjištění, zda xxxx xxxxxxxx maximální xxxx xxxxxxxxx navrhované xxxxxx xxxxxx xxxxx (xxxxx) / xxxxxxx (xxxxxxx) x&xxxx;xxxxxxxxx xxxxx, xxxxxxxxx, xxxxxxxx x&xxxx;xxxxxxxxx xxxx.
|
2.6.1.1 |
Xxxx metody xxxxxxx xxxxxx xxxxxxxxx jako x&xxxx;xxxxxxx xxxxx xxxxxxx xxxxxxxxxxx xxx xxxxxx xxxxxxxx xxxxx xxxxxx&xxxx;11 xxxxxxxx (ES) x.&xxxx;882/2004. Xxxxxxx xxxxxxx xxxxxxx xxxxx x&xxxx;xxxxxx xxxxxxxxx:
|
|
2.6.1.2 |
Podrobná charakteristika xxxxxx (xxxxx) xxxxxxxx xxxxxxxxxxxx charakteristiky xxxxxxxxx x&xxxx;xxxxxxx&xxxx;XXX xxxxxxxx (XX) x.&xxxx;882/2004. |
|
2.6.1.3 |
Xxxxxxxx xxxxxxxxxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxx se xxxxx otestováním xxxxxx x&xxxx;xxxxx akreditované a nezávislé xxxxxxxxxx. Poskytnou xx xxxxxxxx xxxxxx xxxxx xxxxx x&xxxx;xxxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxx xx úřední xxxxxxxxx xxxxxxxxx. X&xxxx;xxxxxx xxxxxxxxxxxx x&xxxx;xxxxxx na xxxxxxxxx dokumentace xxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx, že xxxxx xxxxxxxxx je xxxxxxxxxx xxxxxxxxx národních xxxxxxxxxxxx xxxxxxxxxx napomáhajících xxxxxxxxxx xxxxxxxxxx Společenství, xxx xx xxxxxxxxx x&xxxx;xxxxxxxx (XX) x.&xxxx;378/2005, xxxxxxx laboratoř zašle xxxxxxxxxx xxxxxxxxxx Společenství xxxxxxxxxx o zájmech (jakmile xxxxxxxxxx laboratoř Xxxxxxxxxxxx xxxxxx žádost) xxxxxxxxxx xxxxx laboratoře v souvislosti x&xxxx;xxxxx xxxxxxx x&xxxx;xxxxx xx účastnit xxxxxxxxxxx xxxxxxx. |
|
2.6.1.4 |
Xx xxx hodnotící xxxxxx xxx xxxx xxxx xxxxxxxxxx laboratoř Xxxxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxxxxxxx xxxxx xxxxxxx&xxxx;XXX xxxxxxxx (XX) č. 882/2004. |
|
2.6.1.5 |
Pracovní xxxxxxxxxxxxxxx xxx metody xxxxxxxxxx xxxxxx xxxxx (xxxxxxxxx xxxxxx) xxxxx xxx xxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxx poskytnutých referenční xxxxxxxxxx Xxxxxxxxxxxx xxxxx xxxxxx&xxxx;12 xxxxxxxx (XX) x.&xxxx;378/2005. |
2.6.2&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxx pro xxxxxxxxx reziduí xxxxxxxxx xxxxx xxxx jejích xxxxxxxxxx x&xxxx;xxxxxxxxxxx
Xx xxxxx xxxxxxxxxx xxxxxxxxx charakteristiku xxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx analytických xxxxx xxx xxxxxxxxx xxxxxxxxxxxxxx reziduí x/xxxx xxxxxxxxxx xxxxxxxxx látky x&xxxx;xxxxxxxx tkáních x&xxxx;xxxxxxxxxxx xxxxxxxxxx.
|
2.6.2.1 |
Xxxx xxxxxx xxxxxxx xxxxxx požadavky xxxx x&xxxx;xxxxxxx metod xxxxxxx xxxxxxxxxxx xxx xxxxxx xxxxxxxx xxxxx xxxxxx&xxxx;11 xxxxxxxx (XX) č. 882/2004. Xxxx xxxxxx splňují xxxxxxx xxxxxxx jeden x&xxxx;xxxxxxxxx xxxxxxxxx x&xxxx;xxxx 2.6.1.1. |
|
2.6.2.2 |
Xxxxxxxx xxxxxxxxxxxxxxx metody (xxxxx) xxxxxxxx odpovídající xxxxxxxxxxxxxxx stanovené v příloze III xxxxxxxx (XX) x.&xxxx;882/2004 x&xxxx;xxxx v úvahu xxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxx Xxxxxx 2002/657/XX&xxxx;(10). Xxxxxxxxx xx xxxxx xxxxxx pracovní xxxxxxxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxxx Xxxxxx, xxxxx stanoví xxxxxxxxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxx určitých xxxxx x&xxxx;xxxxxx xxxxxxx x&xxxx;xxxxxx xxxxxxxxx xxxxx xxxxxxxx Xxxx 96/23/ES. Limit xxxxxxxxxxxx x&xxxx;xxxxx metody xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxxxxx XXX a musí xxx xxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxxxxx xx xxxxx poloviny xx dvojnásobek MLR. |
|
2.6.2.3 |
Pracovní xxxxxxxxxxxxxxx xxxxxxx validovaných xxxxx xx ověří xxxxxxxxxxx metody x&xxxx;xxxxx xxxxxxxxxxxx x&xxxx;xxxxxxxxx laboratoři. Xx xxxxx uvést xxxxxxxx těchto xxxxx. X&xxxx;xxxxxx xxxxxxxxxxxx a účasti xx hodnocení xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx, xx xxxxx xxxxxxxxx xx účastníkem xxxxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxxx referenční laboratoři Xxxxxxxxxxxx, xxx xx xxxxxxxxx v nařízení (XX) x.&xxxx;378/2005, dotyčná xxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxxx Xxxxxxxxxxxx prohlášení x&xxxx;xxxxxxx (xxxxxxx xxxxxxxxxx laboratoř Xxxxxxxxxxxx xxxxxx žádost) xxxxxxxxxx xxxxx xxxxxxxxxx x&xxxx;xxxxxxxxxxx s danou xxxxxxx x&xxxx;xxxxx xx xxxxxxxx xxxxxxxxxxx žádosti. |
|
2.6.2.4 |
Ve xxx xxxxxxxxx xxxxxx xxx xxxx xxxx xxxxxxxxxx xxxxxxxxx Xxxxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxx xxxxxxxxx v bodě 2.6.2.2. |
|
2.6.2.5 |
Pracovní xxxxxxxxxxxxxxx xxx xxxxxx pro xxxxxxxx xxxxxxx xxxxx (xxxxxxxxx xxxxxx) mohou xxx stanoveny x&xxxx;xxxxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxx Společenství xxxxx xxxxxx&xxxx;12 xxxxxxxx (XX) x.&xxxx;378/2005. |
2.6.3&xxxx;&xxxx;&xxxx;Xxxxxx analýzy týkající xx xxxxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxxxxxxx látky
Žadatel poskytne xxxxx metod xxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxxxx xxxxx bodů 2.1.3, 2.1.4, 2.1.5, 2.2.2, 2.4.1, 2.4.2, 2.4.3 x&xxxx;2.4.4.
X&xxxx;xxxxxxx x&xxxx;xxxxxxxx&xxxx;XX xxxxxxxx (XX) x.&xxxx;1831/2003 xx znění xxxxxxxx (XX) x.&xxxx;378/2005 xxxxx být xxxxxxxxxxx xxxxxx xxxxxx poskytnuté xxxxx tohoto xxxx, xxxxx to xxxx xxxx Komise xxxxxxxx xx xxxxxxxx pro xxxxxxxxx xxxxxxx.
Xxxxxxxxxx xx, xxx xxxxxx xxxxxxx x&xxxx;xxxxx xxxx xxxx xxxxxxxxxxx xxxxxx. Metody, xxxxx nejsou xxxxxxxxxxx xxxxxx, xx xxxxx xxxx popsat. X&xxxx;xxxxxx xxxxxxxxx xxxx být xxxxxx xxxxxxxxx akreditovanými x&xxxx;xxxxxxxxxxx xxxxxxxxxxxx a musí xxx xxxxxxxxxxxxxx xxxxx xxxxxxxxxxx norem xxxxxxx (xxxx. xxxxxxx xxxxxxxxxxx xxxxx xxxxx xxxxxxxx 2004/10/XX xxxx xxxxx XXX).
Xxxxxx xxx xxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxxxxxxx xxxxx xxxxxxx stejné požadavky xxxx xxxxxx xxxxxxx xxxxxxxxx pro xxxxxx xxxxxxxx podle xxxxxx&xxxx;11 xxxxxxxx (XX) x.&xxxx;882/2004, xxxxxxx pokud xxxx xxxxxxxxx právní xxxxxxxxx (xxxx. xxxxxxxxx, xxxxxxxxx xxxxx).
3.&xxxx;&xxxx;&xxxx;XXXXX&xxxx;XXX: XXXXXX XXXXXXXX XX BEZPEČNOSTI DOPLŇKOVÉ XXXXX
Xxxxxx xxxxxxx x&xxxx;xxxxx xxxxxx x&xxxx;xx xxxxxxxxxx xxxxxxxxx mají xxxxxxx xxxxxxxxxxx:
|
— |
xxxxxxxxxxx xxxxxxx xxxxxxxxx xxxxx xxx xxxxxx xxxxx zvířat, |
|
— |
případného xxxxxx xxxxxxxxxxxxx se xxxxxxx x/xxxx přenosem rezistence xxxx xxxxxxxxxxxxxxxx látkám x&xxxx;xxxxx perzistencí x&xxxx;xxxxxxxxxxx xxxxxxxxxxxxxx, |
|
— |
xxxxx xxx spotřebitele x&xxxx;xxxxxxxx xxxxxxxxx xx xxxxxx, jimž byla xxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxx látku xxxx xxxxxx ošetřená doplňkovou xxxxxx, nebo xxxxx, xxxxx xxxxx xxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxx obsahujících xxxxxxx xxxxxxxxx xxxxx xxxx xxxxxx xxxxxxxxxx, |
|
— |
xxxxx xxx osoby xxxxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxx xxxx xxxxxxx xxxx xxxxxxxxxxxx xx xxxxxxx či xxxxx, vznikajících při xxxxx xxxxxxxxxx xx xxxxxxxx sliznice, očí xxxx kůže x |
|
— |
xxxxx xxxxxxxxxxx xxxxxx vlastní xxxxxxxxx xxxxx xxxx xxxxxxxx x&xxxx;xx odvozených, xxxxxxxxxx přímo x/xxxx xxxxxxxxxxxx xxxxxxx, xx xxxxxxx xxxxxxxxx. |
3.1&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx bezpečnosti používání xxxxxxxxx xxxxx xxx xxxxxx xxxxx zvířat
Studie xxxxxxx x&xxxx;xxxxx oddíle xxxx určeny k vyhodnocení:
|
— |
bezpečnosti xxxxxxxxx doplňkové xxxxx xxx xxxxxx xxxxx xxxxxx x |
|
— |
xxxxxxxxxx xxxxxx xxxxxxxxxxxxx xx xxxxxxx x/xxxx xxxxxxxx xxxxxxxxxx xxxx antimikrobiálním xxxxxx x&xxxx;xxxxx xxxxxxxxxxx a uvolňováním xxxxxxxxxxxxxx. |
3.1.1&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxxx x&xxxx;xxxxxxxx xxxxx xxxxxx
Xxxxxx testu xxxxxxxxx je xxxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxx doplňkové xxxxx x&xxxx;xxxxxxxx xxxxxx. Používá xx xxxxxx xx xxxxxxxxx xxxxxxx pro xxxxxxxxxx, xxxxx se xxxxxxxxx látka xxxxxx x&xxxx;xxxxxxx xxxxxxx, xxx xx xxxxxxxxxx. Tyto xxxxx xxxxxxxxx je xxxxx xxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxx xxx všechny xxxxxx xxxxx/xxxxxxxxx xxxxxx, xx xxx xx xxxxxx xxxxxxxx. X&xxxx;xxxxxxxxx xxxxxxxxx xx přípustné xxxxxxxx xxxxxxx prvky xxxxx tolerance xx xxxxx xx xxxxxxx xxxxxxxxx, pokud xxxx xxxxxxx xxxx xxxxxxx xxxxxxxxx na xxxx xxxxx. Všechny studie xxxxxxx v tomto xxxxxx xxxx být xxxxxxxx xx doplňkové xxxxx xxxxxxx v oddíle II.
3.1.1.1 Návrh testu xxxxxxxxx xxxxxxxx xxxxxxx xxx xxxxxxx:
|
— |
xxxxxxx, xxx xx doplňková xxxxx xxxxxxxx, |
|
— |
xxxxxxx s nejvyšší doporučenou xxxxxx x |
|
— |
xxxxxxxx skupinu x&xxxx;xxxxxxxxxxxxx xxxxxxx nejvyšší xxxxxxxxxx xxxxx. |
X&xxxx;xxxxxxx xxxxxxx xx doplňková xxxxx xxxxxxx xxxxxx xx xxxx desetinásobku xxxxxxxx xxxxxxxxxx xxxxx. Xxxxxxx xxxxxxx jsou xxxxxxx xxxxxxxxx x&xxxx;xxxxxxx xx xxxxxxxx xxxxxx klinických xxxxxx, xxxxxxxx xxxxxxxxxxxxxxx, xxxxxxxxx jakost produktu, xxxxxxxxxxx a rutinní vyšetření xxxxxxxxxx xxxxxxx krve x&xxxx;xxxx parametry, xxxxx xxxxxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxxxxxx doplňkové xxxxx. Xxxxxx xx xx xxxxx xxxxxxxx xxxxxxxxx xxxxx z toxikologických xxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxx. V tomto xxxxxx se xxxxxx xxxxxx případné xxxxxxxxx xxxxxx xxxxxxxx během xxxxxxx účinnosti. V případě xxxxxxxxxxxxxx úmrtí při xxxxx tolerance se xxxxxxx nekropsie x&xxxx;xxxxxxxxx xxxxxxxxxx.
Xxxxx xxx xxxxxxxx, xx je xxxxxx 100xxxxxxx xxxxxxxxx doporučené xxxxx, xxxxxxxxxx xx xxxxxxxxxxx ani xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxx xxxx. Je-li xxxxxxx xxxxxx pouze xxx xxxxxx nižším, xxx xx 10xxxxxxx xxxxxxxx xxxxxxxxxx xxxxx, xx xxxxxx navržena xxx, xxx xxxx xxxxx xxxxxxxxx xxxxxxx pro xxxxxxxxxx xxxxxxxxx xxxxx, x&xxxx;xxxxxx se doplňkové xxxxxxxxx (xxxxxx xxxxxxxxx, xxxxxxxxx xxxxxxxxxx x&xxxx;xxxxxx xxxxxxxx kritérií).
U některých xxxxxxxxxxx xxxxx nemusí xxx x&xxxx;xxxxxxxxxx xx xxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxxxx nebo xxxxx xxxxx xxxxxxx xxxxx xxxxxxxxx.
Xxxxxxx xxxxxxxxxxxxxx xxxxxx xxxx zahrnovat xxxxx x&xxxx;xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx.
3.1.1.2&xxxx;&xxxx;&xxxx;Xxxx trvání zkoušek xxxxxxxxx
Xxxxxxx&xxxx;1
Xxxx xxxxxx xxxxxxx xxxxxxxxx: xxxxxxx
|
Xxxxxx zvířata |
Doba xxxxxx xxxxxx |
Xxxxxxxxxxxxxxx cílových xxxxxx |
|
Xxxxxx xxxxxx |
14&xxxx;xxx |
Xxxxx možno xx 14&xxxx;xxx do xxxxxxx |
|
Xxxxxxxxx xxxxxx |
42&xxxx;xxx |
42&xxxx;xxx xx xxxxxxx |
|
Xxxxx xxxxxx |
42&xxxx;xxx |
Xxxxxxx xxxxxxxx xx xxxxxxx xxxxxx ≤&xxxx;35&xxxx;xx |
|
Xxxxxxxx určené x&xxxx;xxxxxxxxxx |
1&xxxx;xxxxxx |
Xx xxxxxxxxxx do konce xxxxxxx |
X&xxxx;xxxxxxx xxxxxxx xxxxxxxx xx xxxxxxxx x&xxxx;xxxxxxxxxxx xxxxx xx xxxxxxxx xx dostatečnou xxxxxxxxxxx xxxxxx (14xxxxx pro xxxxxx xxxxxx a 28denní xxx xxxxxxxxx xxxxxx). Xxxxx byla prokázána xxxxxxxxx u odstavených xxxxx, xxxxxxxxxx se xxxxxxxx xxxxxx xxx výkrm xxxxxx.
Xxxxxxx&xxxx;2
Xxxx xxxxxx zkoušek xxxxxxxxx: xxxxxx
|
Xxxxxx xxxxxxx |
Xxxx xxxxxx studií |
Charakteristika cílových xxxxxx |
|
Xxxxx xxxxx/xxxxxx |
35&xxxx;xxx |
Xx xxxxxxxxx |
|
Xxxxxxx |
56&xxxx;xxx |
Xxxxx xxxxx během xxxxx xxxxxxx doby snášky |
|
Výkrm xxxx |
42&xxxx;xxx |
Xx xxxxxxxxx |
Xxxxx x&xxxx;xxxxxxxxx x&xxxx;xxxxxx xxxxx xxxx xxxx lze xxxxxx x&xxxx;xxxxxxxxx tolerance x&xxxx;xxxxxxx xxxxx x&xxxx;xxxxx nebo x&xxxx;xxxxxxx krůt.
Tabulka 3
Doba trvání xxxxxxx tolerance: skot
|
Cílová xxxxxxx |
Xxxx xxxxxx studií |
Charakteristika xxxxxxxx xxxxxx |
|
Xxxxx telat |
28 dní |
Výchozí xxxxxxx xxxxxxxx ≤&xxxx;70&xxxx;xx |
|
Xxxxxx xxxxx; xxxxx skotu xxxx skot x&xxxx;xxxxxxxxxx |
42&xxxx;xxx |
|
|
Xxxxxxx |
56&xxxx;xxx |
X&xxxx;xxxxxxx xxxxxxx xxxxxxxxxx se xx xxxxxx telat x&xxxx;xxxxx xxxxx xx xxxxxxxx za xxxxxxxxxxx xxxxxxxxxxx xxxxxx (28 dnů xxx xxxxx období).
Tabulka 4
Doba xxxxxx xxxxxxx tolerance: xxxx
|
Xxxxxx xxxxxxx |
Xxxx xxxxxx xxxxxx |
Xxxxxxxxxxxxxxx xxxxxxxx xxxxxx |
|
Xxxxxx xxxxxx x&xxxx;xxxxx xxxxxx |
28&xxxx;xxx |
Xxxxxxx&xxxx;5
Xxxx xxxxxx xxxxxxx tolerance: xxxxxxxxxx x&xxxx;xxxx xxxx
|
Xxxxxx xxxxxxx |
Xxxx xxxxxx xxxxxx |
Xxxxxxxxxxxxxxx xxxxxxxx zvířat |
|
Losos x&xxxx;xxxxxx |
90&xxxx;xxx |
Xxxx xxxxxxxxxxx 90xxxxx studie xx bylo možno xxxxxxx xxxxxx, xxx xxxx xxxxx xxxx xxxxxxxx hmotnost oproti xxxxxxx xxxxxxx hmotnosti xx začátku xxxxxxx xxxxxxx xxxxxxxxxxx.
Xx-xx xxx xxxxxxxxx xxxxx používána xxxxx xxx xxxxx xxxxxxxxx xxx, xxxxx xxxxxxxxx se provedou xxxxx xxxxx xx xxxxxxxx xxxx xxxxx. Xxxxx tolerance xxxxxx 90&xxxx;xxx x&xxxx;xx xxxxx xxxxxxx pozornost xxxxxxx x&xxxx;xxxxxxx xxxxx.
Xxxxxxx&xxxx;6
Xxxx xxxxxx xxxxxxx xxxxxxxxx: xxxxxxx x&xxxx;xxxxxxxx xxxxx x&xxxx;xxxx xxxxxxx, xxxxx nejsou xxxxxx x&xxxx;xxxxxxxx potravin
|
Cílová xxxxxxx |
Xxxx xxxxxx studií |
Charakteristika xxxxxxxx xxxxxx |
|
Xxx x&xxxx;xxxxx |
28&xxxx;xxx |
Xxxxxxx 7
Xxxx trvání xxxxxxx xxxxxxxxx: xxxxxxx
|
Xxxxxx&xxxx;xxxxxxx |
Xxxx xxxxxx xxxxxx |
Xxxxxxxxxxxxxxx cílových xxxxxx |
|
Xxxxx xxxxxxx |
28&xxxx;xxx |
|
|
Xxxxxx xxxxxxx |
1&xxxx;xxxxxx |
Xx xxxxxxxxxx xx xxxxx xxxx xxxxxxx |
Xxxxxxxx-xx se xxxxxx xx xxxxxx x&xxxx;xxxxxxxxx xxxxxxx, xxxxxxxx xx xx xxxxxxxxxx xxxxxx 49&xxxx;xxx (xxxxxxxx xxxxx xx xxxxxxxx) a musí xxxxxxxxx xxxxxxx xx xx xxxxxxx.
Xxxxx xx xxxxxxxxx látka xxxxxxx xx specifickou x&xxxx;xxxxxx xxxx, xxx je xxxxxxx v definici xxxxxxxxx xxxxxx, xxxxxx xx xxxxx navrhovaných podmínek xxx xxxxx. Xxxxxx xxxxxxxxxx však xxxxx xxx xxxxxx než 28&xxxx;xxx x&xxxx;xxxx xxxxxxxxx xxxxxxxxx xxxxxxxx (xxxx. x&xxxx;xxxxxxx xxxxxxxx k reprodukci xxxxx živě xxxxxxxxxx xxxxx se xxxxxxxx xx xxxxxx březosti xxxx počet a hmotnost xxxxxxxxxxx xxxxx se xxxxxxxx xx xxxxxx xxxxxxx).
3.1.1.3&xxxx;&xxxx;&xxxx;Xxxxxxx xxxxxxxx
Xxxxxx xxxx xxx xxxxxxx xxxxxxxxxx x&xxxx;xxxxx o všech pokusných xxxxxxxxx. Xxxxxxxx xxxxxxxx xxxx xxx xxxxxxx xxxxxxxxxx x&xxxx;xxxxxxx xx xxxxxx xxxxxxx xxxxx. Xxxxxxxxxxxxx se xxxxxxx xxxx xxxxxxx:
|
1. |
xxxxx xxxx xxxxx: xxxxx x&xxxx;xxxxx; xxxxxxxx krmení x&xxxx;xxxxx, xxxxxx xxxxxx; x&xxxx;xxxxxxx xxxxx velikost a počet xxxxxx xxxx xxxxx x&xxxx;xxxxxxxxxxxx, xxxxxxxx poměry x&xxxx;xxxxxxx vody, xxxxxx xxxxxxx xxxx x&xxxx;xxxxxx xxxx xx vodě; |
|
2. |
zvířata: xxxx (x&xxxx;xxxxxxx druhů xxxxxxxx pro xxxxxxx xxxxxxxx xx xxxxxxx xxxxxxxxxxxx xxxxx jejich xxxxxxxx jména x&xxxx;xx xxx x&xxxx;xxxxxxxxx následuje xxxxxxxx binomické jméno), xxxxxxx, stáří (velikost x&xxxx;xxxxxxx xxxxx), xxxxxxx, xxxxxx označení, xxxxxxxxxxxx xxxxxxx a celkový xxxxxxxxx xxxx; |
|
3. |
xxxxx x&xxxx;xxxxxx doba xxxxxx xxxxx: xxxxx x&xxxx;xxxx xxxxxxxxxxx zkoušek; |
|
4. |
krmné xxxxx: xxxxx výroby x&xxxx;xxxxxxxxxxxxxxx xxxxxxx krmné xxxxx (dávek) x&xxxx;xxxxxxxx xxxxxxxxx xxxxxx, xxxxxxxxxxx xxxxx (xxxxxxxxxxx xxxxxxx) x&xxxx;xxxxxxxxxxx xxxxxxx. Xxxxx x&xxxx;xxxxxx xxxxxx; |
|
5. |
xxxxxxxxxxx xxxxxx xxxxx (látek) xxxx xxxxxxx (xxxxxxx) (a případných xxxxx xxxxxxxxx pro xxxxxxxxxx xxxxx) x&xxxx;xxxxxxxx xxxx být xxxxxxxxx xxxxxxxxx analýzou x&xxxx;xxxxxxxx xxxxxxxxxxx uznávaných xxxxx. Xxxxxxxxxx xxxxx xxxxxxxxx xxxxx; |
|
6. |
xxxxx pokusných x&xxxx;xxxxxxxxxxx xxxxxx, počet zvířat x&xxxx;xxxxx skupině: xxxxx xxxxxx použitých xxx xxxxxx xxxx umožnit xxxxxxxxx statistické xxxxxxx. Xxxx xx být xxxxxxx xxxxxxx metody xxxxxxxxxxxxx hodnocení. Xx xxxxxx xxxx xxx xxxxxxxx všechna zvířata x/xxxx xxxxxxxxxxxxxx celky, x&xxxx;xxxxx se xxxxxx xxxxxxxxx. Případy, xxxxx xxxx xxxxx vyhodnotit xxx xxxxxxxxxx xxxx xxxxxx xxxxx, xxxx xxx xx zprávě xxxxxxx x&xxxx;xxxxxx rozložení x&xxxx;xxxxxxxxxxxx skupinách zvířat xxxx xxx xxxxxxxxxxxxx; |
|
7. |
xxxxxxx x&xxxx;xxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxx x&xxxx;xxxxxxx xxxx skupin musí xxx xxxxxxxxxx (xxxxxxxxxx xxxxx x&xxxx;xxxxxxxx xxxxxxxxxx xxxxxxxxx ve xxxxxx) x |
|
8. |
xxxxxxx/xxxxxxxxxxx xxxxxxxx, je-li xxxxx, xxxxx ovlivňovat xxxxxxxxxx xxxxxxxxxxx působení xxxxxxxxx xxxxx a musí xxx xxxxxxxxxxx xxxxxxxxxxxx. |
3.1.2&xxxx;&xxxx;&xxxx;Xxxxxxxxxxx xxxxxx
Xx nutno poskytnout xxxxxx ke stanovení xxxxxxxxxx xxxxxxxxx xxxxx xxxxxxxx křížovou xxxxxxxxxx xxxx xxxxxxxxxxxx používaným x&xxxx;xxxxxxxx nebo xxxxxxxxxxxx xxxxxxxxx, selektovat rezistentní xxxxxxxxxxx xxxxx xx xxxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxx xxxxx, xxxxxxx xxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxx xxxxxxxxxx x&xxxx;xxxxxxxxx traktu, xxxxxxx xxxxxxxxxx xxxx vylučování xxxxxxxxxxxx mikroorganismů.
V případě, že xxxxxx xxxxx (xxxxx) xxxxxxxx(x)&xxxx;xxxxxxxxxxxxxxx xxxxxxxx xxx xxxxxxxxxxx, ve které xx obsažena x&xxxx;xxxxxx, xxxx být v souladu xx standardizovanými xxxxxxx xxxxxx xxxxxxxxx inhibiční xxxxxxxxxxx (XXX) pro xxxxxxxxx xxxxx xxxxxxxx. Xx-xx xxxxxxxxx příslušná xxxxxxxxxxxxxxx xxxxxxxx, je xxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxxxx bakteriální kmeny xx xxxxx a u cílových xxxxx x&xxxx;xxxxxxxx křížovou xxxxxxxxxx xxxx odpovídajícím xxxxxxxxxxxx&xxxx;(11).
Xxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxx xxxxx xx xxxxxxxx xxx xxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxx x&xxxx;xxx xxxx xxxxxxxxx xxxxx, x&xxxx;xxxxx xxx očekávat xxxxxx na xxxxxxx xxxxxxxxxx. Xxxx xxxxxx xxxx xxxxxxxx, xx xxxxx xxxxxxxxx látky xxxxxxxxx podmínky, xxxxx xxxxxxxxxx nadměrnému xxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxxx patogenních xxxxxxxxxxxxxx.
Xxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxx xxxxxxx xx xxxxxxxx xxxxxxx, xxxxxxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxx xxx xxxxxx xx to, xxx x&xxxx;xxxxxxxx zvířat vyvolávají xx nevyvolávají xxxxxxxx.
3.2&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx doplňkové xxxxx xxx spotřebitele
Cílem xx xxxxxxxxxx xxxxxxxxxx doplňkové xxxxx pro xxxxxxxxxxxx x&xxxx;xxxxxxxx xxxxx xxxxxxx xxxxxxxxx xxxxx nebo xxxxxx metabolitů x&xxxx;xxxxxxxxxxx xxxxxxxxx xx xxxxxx, xxxx xxxx xxxxxxxx xxxxxx xxxx xxxx xxxxxxxxxx xxxxxxxxxx xxxxx xxxx xxxxxxxx xxxxx xxxxxxxxxx látkou.
3.2.1 Studie xxxxxxxxxxx x&xxxx;xxxxxxx
Xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxx x&xxxx;xxxxxxxx druhů xx xxxxxxxxxxxx xxxxxx xxx xxxxxxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxx x&xxxx;xxxxxxxxxxxxx tkáních xxxx produktech xxxxxxxxx xx xxxxxx, jimž xxxx podáváno krmivo xxxx voda xxxxxxxxxx xxxxxxxxxx xxxxx. Xx xxxxx předložit xxxxxx xxxxxxxx xx absorpce, xxxxxxxxxx, xxxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxx (x&xxxx;xxxxxx metabolitů).
Studie xxxx být xxxxxxxxx xxxxxx xxxxxxxxxxx validovaných xxxxxxxxxx xxxxx x&xxxx;x&xxxx;xxxxxxx x&xxxx;xxxxxxxx evropskými xxxxxxxx xxxxxxxx xxxx xxxxxxxx xxxxxxxx xxx xxxxxxxxxxxxx xxxxxxxxx OECD x&xxxx;xxxxx xxxxx správné xxxxxxxxxxx xxxxx. Xxxxxx musí xxxxxxxxxxx xxxxxxxx xxxxxxxx xx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx předpisy Evropského xxxxxxxxxxxx x&xxxx;xxxxxxxxx xx, xxxx-xx xx nezbytné.
Studie xxxxxxxxxxx a reziduí x&xxxx;xxxxxxxx xxxxxxx (xxxxxx) se xxxxxxxx s účinnou látkou xxxxxxxxxxxx do xxxxxx (xxxxxxxxxxx xxxxxx xxxxxx xxxxxxxxx xxxxxx, xxxx-xx xx řádně xxxxxxxxxx).
Xxxxxxx xx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxxxx xxxx xxx 10&xxxx;% xxxxx xxxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxxx x&xxxx;xxxxxxxxxx x&xxxx;xxxx xxx 20&xxxx;% xxxxx xxxxxxx x&xxxx;xxxxxxxxxxxx. Pokud xx xxxxxxxxxxx xxxxx xxxxxx xxxxx xxxxxxxxxxxxx významná, xx xxxxx xxxxxxxxxxxxx xxxxxxxxxx pod výše xxxxxxxxx xxxxxx.
Xxxxxxxxx studie xxxxxxx xxxxx xxxxxx xxx xxxxxxx xxxxxxxx xxxxxxxxxxxx a případně stanovení xxxxxxxx lhůty x&xxxx;XXX. Xxxxxxxx xx xxxxx xx indikátorové xxxxxxxx.
X&xxxx;xxxxxxxxx xxxxxxxxxxx xxxxx nemusí xxx x&xxxx;xxxxxxxxxx na xxxxxx xxxxxx nebo xxxxx xxxx xxxxx xxxxxxx studie metabolismu x&xxxx;xxxxxxx.
3.2.1.1&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxxxxx
Xxxxxx xxxxxx xxxxxxxxxxx xx xxxxxxxxxx xxxxxxxx, distribuci, biotransformaci x&xxxx;xxxxxxxxxx xxxxxxxxx xxxxx x&xxxx;xxxxxxxx druhů xxxxxx.
Xxxxxxxxxx xxxxxx:
|
1. |
xxxxxxxxxxx xxxxxxx xx xxxxxx jediné xxxxx xxxxxx látky x&xxxx;xxxxxxxxxxxx xxxxxxx pro xxxxx (xxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxx) x&xxxx;xxxxxxxx xxxxxxxxxxx dávky (xx-xx xx xxxxxxxxxx), xxx xxxxx být xxxxxxxxx xxxxxxxx x&xxxx;xxxxxx absorpce, xxxxxxxxxx (xxxxxx/xxxx) x&xxxx;xxxxxxxxxx (xxx, žluč, xxxxxx, xxxxx xxxx vejce, xxxxxxxxxxx xxxxxx, xxxxxxxxxx xxxx xxxxx) u samců x&xxxx;xxxxx, je-li xx xxxxxx, x |
|
2. |
xxxxxxxxx xx xxxxxxxxxxx, identifikace xxxxxxxxxx(x)&xxxx;x&xxxx;xxxxxxxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxxxxx se stanoví xx xxxxxxxxxx podávání xxxxx označené látky xxxxxxxx xx vyrovnaném xxxxx (xxxxxxxxxxx xxxxxxxxx) xxxxx obsahu v plazmě. Xxxxxxxxxx dávka xxxxxxxx xxxxxxxx navrhované dávce xxx užití x&xxxx;xxxx xxx zapracována xx xxxxxx. |
3.2.1.2&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxx
Xxxxx xx xxxxxxxx x&xxxx;xxxxxx xxxxxxxxxxxxxxxxxx xxxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxxx xxxx xxxxxxxxxx.
Xxxxxx xxxxxxx xx požadují xxx xxxxxxx xxxxx, x&xxxx;xxxxx xxxx xxxxx studie xxxxxxxxxxx.
Xx-xx xxxxx přirozenou xxxxxxx xxxxxxx xxxxxxx xxxx xxxxx xxxx xxxxxxxxx-xx xx x&xxxx;xxxxxxxxxxx xxxx xxxxxxxx přirozeně xx značném množství, xx xxxxxxxxx xx xxxxxx xxxxxxx xxxxxx xx porovnání obsahu x&xxxx;xxxxxxx/xxxxxxxx x&xxxx;xxxxxxxxxx skupiny x&xxxx;x&xxxx;xxxxxxx, xxx xxxx xxxxxxxx nejvyšší udávaná xxxxx.
X&xxxx;xxxxxxxxxxx xxxxx xxxxxx xxxxxxxx xxxxxxxxx všechna xxxxxxx, která jsou xxxxxxxxxxxxx významná, a určí xxxxxxxxxxxx reziduum účinné xxxxx x&xxxx;xxxxxxxxxxx xxxxx (xxxxx, xxxxxxx, xxxxx, xxxx, xxxx + xxx) a produktech (xxxxx, xxxxx x&xxxx;xxx). Xxxxxxxxxxxx xxxxxxxx je reziduum xxxxxxx xxx zkoušku, xxxxx xxxxxxxxxxx xx xx xxxxxx xxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxxxxx x&xxxx;xxxxxxx. Studie xxxx xxxxxxxx xxxxxx xxxxxxx xxxxxxx v tkáních xxxx xxxxxxxxxx, xxx xxxx xxxxx stanovit xxxxxxxxxxxx xxxxxxxxx xxxxx.
Xx xxxxxxxxx xxxxxxxx lhůty xx xxxxxxxxxx minimální xxxxx zvířat xx xxxxxx x/xxxx xxxxxxxx x&xxxx;xxxxxx bodu xxxxxx xxxxx:
|
— |
xxxxxxxxxxx xxxxx:
|
|
— |
produkty:
|
Uváží se xxxxxx xxxxxxxxx xxxxx xxxxxxx.
Xxxxxxx xx xxxx xxx xxxxxx xxxxxxxx xxxxx (xxxxxxxxx xxxx) x&xxxx;xxxxxxx xx třech xxxxxx xxxxxx měření.
Předloží xx xxxxx xx xxxxxxxxxxxx xxxxxxxx.
Xx xxxxx xxxxxxx studie xxxxxxxx, xxxxxxxxxx a vylučování, xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxxx, x&xxxx;xxxxxxxxxxxxx xxxxx xxxxxx, x&xxxx;xxxxx xxxx získána xxxxxxxx xxxxxxx XXXXX xxxx standardně x&xxxx;xxxx (xxxx xxxxxxx). Doplňkové xxxxxx týkající xx xxxxxxxx metabolitů xxxxx xxx xxxxxxxx x&xxxx;xxxxxxx, xxxx-xx xxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxx x&xxxx;x&xxxx;xxxxxxxxxxxxx xxxxx xx xx významném xxxxxxx xxxxxxx.
3.2.1.3&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxxxxx a ukládání
Musí xxx provedena xxxxxx xxxxxxxxxxx xxxxxxxxxx metabolickou xxxxxxx, xxxxxxxxxxx xxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxxx xxxxxxxxxx x&xxxx;xxxx x&xxxx;xxxxxxxx. Xxxxxxxx xxxx laboratorní druhy xxxxxxxx oproti xxxxx xxxxxxx xxxxxx v citlivosti, xxxxx požadovány xxxxxxxxx xxxxxxxxx.
3.2.1.4&xxxx;&xxxx;&xxxx;Xxxxxxxxxx xxxxxxxxxx reziduí
Při xxxxxxxxxx xxxxxx pro xxxxxxxxxxxx xxxxxxxxx s určitými xxxxxxxx rezidui obsaženými x&xxxx;xxxxxxxxxxx xxxxxxxxxx xx xxxxx vzít x&xxxx;xxxxx xxxxxxxxx xxxxxxxxxxxx faktor xxxxxxxx xx určení xxxxxx biologické dostupnosti xx xxxxxxx xxxxxxxx xxxxxxxxxxxxx zvířat a uznaných xxxxx.
3.2.2&xxxx;&xxxx;&xxxx;Xxxxxxxxxxxxx xxxxxx
Xxxxxxxxxx xxxxxxxxx xxxxx xx posuzuje xx základě xxxxxxxxxxxxxxx xxxxxx xxxxxxxxxxx xx xxxxx x&xxxx;xx vivo xx xxxxxxxxxxxxx zvířatech. Xxxx xxxxxxx xxxxxxx xxxxxxxx xxxxxx:
|
1. |
xxxxxx xxxxxxxx; |
|
2. |
xxxxxxxxxxxx (xxxxxxxxxx, klastogenicity); |
|
3. |
subchronické xxxxxx xxxxxxxx; |
|
4. |
xxxxxxxxx xxxxxx xxxxxxxx/xxxxxxxxxxxxx; |
|
5. |
xxxxxxxx xxx xxxxxxxxxx xxxxxx xxxxxxxxxxxx x |
|
6. |
xxxxxxx studie. |
Existuje-li xxxxx x&xxxx;xxxxxx, musí xxx xxxxxxxxx další xxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx, xxxxx jsou xxxxxxxx pro xxxxxxxxx xxxxxxxxxxx xxxxxx xxxxx x&xxxx;xxxxxx xxxxxxx.
Xx xxxxxxx xxxxxxxx xxxxxx studií xx xxxxxxx toxikologická XXXXX.
Xxxxxxxxx xxxxxx xxxxxxxx xx xxxxxxxx metabolitů xxxxx být nezbytné, xxxxx xxxx xxxx xxxxxxxxxx produkovány xxxxxxxx xxxxx x&xxxx;x&xxxx;xxxxxxxxxxx xxxxxxxxxxxxx xxxxx se ve xxxxxxxxx rozsahu xxxxxxx. Xxxx-xx x&xxxx;xxxxxxxxx studie xxxxxxxxxxx u člověka, vezmou xx xxxx xxxxx x&xxxx;xxxxx xxx xxxxxxxxxxx x&xxxx;xxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxx.
Xxxxxxxxxxxxx studie xxxx xxx xxxxxxxxx x&xxxx;xxxxxxx xxxxxx. Xxxxx je xxxxxx xxxxx přítomna x&xxxx;xxxxxxxx xxxxxxxxxxxxx xxxxxxx, xxxxxxx se produkt xxxxxxxxxxxxx procesu. Testovaný xxxxxxx fermentačního xxxxxxx xxxx xxx xxxxxxx x&xxxx;xxxxxxxxx, xxxxx xx xxx použit x&xxxx;xxxxxxxxx xxxxxxxx.
Xxxxxx xxxx xxx xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxxxx zkušebních metod x&xxxx;xxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxx xxxxxxxx předpisy xxxx xxxxxxxx xxxxxxxx pro xxxxxxxxxxxxx xxxxxxxxx XXXX x&xxxx;xxxxx zásad xxxxxxx xxxxxxxxxxx xxxxx. Xxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxx xxxx xxxxxxxxxxx xxxxxxxx xxxxxxxx xx dobrých xxxxxxxxx xxxxxxxx zvířat xxxxxxxxx evropskými xxxxxxxx xxxxxxxx x&xxxx;xxxxxxxxx xx, xxxx-xx xx xxxxxxxx.
3.2.2.1&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx
Xxxxxx akutní xxxxxxxx xx xxxxxxxx xx xxxxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxxxxxxxx xxxxxxxx látky.
Studie akutní xxxxxxxx xxxx xxx xxxxxxxxx xxxxxxx xx xxxx xxxxxxx xxxxx. Xxxxx xxxxxxxxxxx druh xxxx xxx xxxxxxxx xxxxxxxx cílovým xxxxxx.
Xxxxxx xxxxx xxxxxxx xxxxxxx xxxxxxx LD50; xxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxx xxxxx. Xxxxxxxxx xxxxxxxxx nesmí překročit 2&xxxx;000&xxxx;xx/xx xxxxxxx xxxxxxxxx.
Xx xxxxxxx xxxxx xxxxxxxxxxx xxxxxx x&xxxx;xxxxxxxx xxxxxx xxxxxxx xx xxxxxxxx xxxxxxxx xxxx xxxxxxxxx xxx xxxxxxxxx dávky xxxxxxxxxxxx xxxxxx xxxxxxxx. Xxxxxx xxxxxxxxx pomocí xxxxxx xxxxxx xxxxxxx xxxxx xxxxxx, xxxx-xx xxxxx xxxxxxxxxx.
Xx nutno xxxxxxx xxxxxx XXXX 402 (xxxxxx xxxxxxxx xxxxxxxx), 420 (xxxxxx xxxxx xxxxx), 423 (xxxxxx xxxxxxxxx xxxxx xxxxxx xxxxxxxx) a 425 (xxxxxx xxxxxx x&xxxx;xxxx).
3.2.2.2&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxxxxxx, xxxxxx xxxxxxxxxx
Xx xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxx x&xxxx;xxxxxxxx xxxxxx xxxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxx, xxxxx mají xxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxxx, xxxx xxx xxxxxxxxx výběrová xxxxxxxxx xxxxxxx xxxxx xx xxxxxxxxxxxx. V případě xxxxxxx se xxxxx xxxx provádět xxx x&xxxx;x&xxxx;xxxxxxxxxxxx xxxxxxxx x&xxxx;xxxxx x&xxxx;xxxxx xx v úvahu xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xx xxxxxxxxx systémem.
Základní xxxxxx xxxxxxxx xxxx xxxxxxx:
|
1. |
xxxxxxx xxxxxxxx xxxxxx x&xxxx;xxxxxxxxxx a/nebo v buňkách xxxxx (pokud xxxxx xxxx na xxxxxxxxxxxxx x&xxxx;xxxxxxx myší); |
|
2. |
indukce xxxxxxxxxxxxxx xxxxxxx x&xxxx;xxxxxxx xxxxx x |
|
3. |
xxxxxxx xx xxxx x&xxxx;xxxxx. |
X&xxxx;xxxxxxxxxx xx xxxxxxxx xxxx xxxxxxxxx xxxxxxx x&xxxx;x&xxxx;xxxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx látky a jejímu xxxxxxxx xxxxx xxxxx xxx xxxxxxxx xxxxxxxxx xxxxxxx.
Xxxxxxxxx xx xxxx xxx v souladu s pokynem XXXX 471&xxxx;(xxxx xxxxxxxxxx xxxxxx u Salmonella xxxxxxxxxxx), 472&xxxx;(xxxx reverzních mutací x&xxxx;Xxxxxxxxxxx xxxx), 473&xxxx;(xxxx xxxxxxxxxxxxxx xxxxxxx x&xxxx;xxxxx xx xxxxx), 474&xxxx;(xxxx xx xxxxxxxxxx v savčích erytrocytech), 475&xxxx;(xxxx xxxxxxxxxxxxxx xxxxxxx x&xxxx;xxxxxx xxxxx savců), 476&xxxx;(xxxx genových xxxxxx x&xxxx;xxxxxxx xxxxxxx xx xxxxx) xxxx 482 (neplánovaná xxxxxxx DNA v buňkách xxxxx xx vitro), xxxxx x&xxxx;xxxxxx příslušnými xxxxxx OECD xxx xxxxxxx xx vitro x&xxxx;xx xxxx.
3.2.2.3&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxx xxx xxxxxxxxx dávce
K ověření potenciálu xxxxxxxxxxxx xxxxxxxx xxxxxx xxxxx xx předloží xxxxxxx xxxxx xxxxxx xx xxxxxxxxxx s dobou xxxxxx xxxxxxx 90 dnů. Xxxxxxxx-xx xx to xx nutné, xxxx xxx xxxxxxxxx xxxxx xxxxxx na jiném xxxxx xxx xxxxxxxxxx. Xxxxxxxxx položka musí xxx xxxxxxxx xxxxxx xxxxxxx x&xxxx;xxxxx xxxxxxx xxxxxxxx xxxxx ke xxxxxxxxx xxxxxxx, aby xx získala xxxxxx xx dávku. Maximální xxxxx xxxx za xxxxxxxxxx xxxxxxxxx odhalit xxxxxxxxxx xxxxxxxxxxx xxxxxx. Xxxxxxxx xxxxxx dávkování xxxxx xxxxxxxxx žádnou xxxxxx xxxxxxxx.
Xxxxxxxxx xxx xxxx xxxxxxx xxxx xxx v souladu x&xxxx;xxxxxx XXXX 408 (xxxxxxxx) xxxx 409 (xxxx xxxxx než xxxxxxxx).
3.2.2.4&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxxx orální toxicity (xxxxxx xxxxxxxxxxxxx)
X&xxxx;xxxxxxx potenciálu xxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxxxxxxx xx xxxxx provést xxxxxx xxxxxxxxx orální xxxxxxxx nejméně xx xxxxxx xxxxx s dobou xxxxxx xxxxxxx 12&xxxx;xxxxxx. Xxxxxxx xxxx musí xxx xxxxxxxxxxxxx druhem xxxxx všech xxxxxxxxxx xxxxxxxxx údajů, včetně xxxxxxxx 90xxxxxxx xxxxxx. Xxxxxxxxxxx xxxxxx je xxxxx. Požaduje-li xx xxxxx xxxxxx, xxxxxxx xx xxxx xxxxxxxx xxxx jiný xxxx xxxxx xxx xxxxxxxx. Xxxxxxxxx xxxxxxx musí xxx xxxxxxxx xxxxxx xxxxxxx x&xxxx;xxxxx xxxxxxx xxxxxxxx navíc ke xxxxxxxxx xxxxxxx, xxx xx xxxxxxx xxxxxx xx xxxxx.
Xx-xx xxxxxx xxxxxxxxx toxicity kombinována xx xxxxxxxx karcinogenity, xxxx xxxxxx je xxxxxxxxxxx na 18&xxxx;xxxxxx x&xxxx;xxxx x&xxxx;xxxxxx x&xxxx;xx 24&xxxx;xxxxxx x&xxxx;xxxx.
Xxxxxx karcinogenity xxxxxx xxx nutné, xxxxx xxxxxx xxxxx x&xxxx;xxxx xxxxxxxxxx:
|
1. |
xxxxxxxx xxxxx xxxxxxxxx xxxxxxxx x&xxxx;xxxxxxx xx genotoxicitu; |
|
2. |
nejsou xxxxxxxxxxxx xxxxxxxxx xx xxxxxxx xxxxxxxxxxx a |
|
3. |
nevyvolávají xxx xxxxxxxxx chronické xxxxxxxx xxxxx xxxxxx (xxx)xxxxxxxxx. |
Xxxxxxxxx xxxx xxx v souladu x&xxxx;xxxxxxx XXXX 452 (xxxxxx chronické xxxxxxxx) xxxx 453 (kombinovaná xxxxxx xxxxxxxxx xxxxxxxx/xxxxxxxxxxxxx).
3.2.2.5&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xxx xxxxxxxxxx (xxxxxx xxxxxxxx xxx xxxxxxxxxx xxxxx)
X&xxxx;xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx x&xxxx;xxxxx nebo samic xxxx xxxxxxxxxx xxxxxx xx xxxxxxxxx vyplývajících x&xxxx;xxxxxxxx xxxxxx látky xx xxxxx xxxxxxx xxxxxx reprodukční xxxxxx xxxxxx:
|
1. |
xxxxxxxxxxxxx xxxxxx xxxxxxxx xxx reprodukci x |
|
2. |
xxxxxx xxxxxxxx xxx xxxxxxxxxx xxxxx (xxxxxxx teratogenity). |
U nových xxxxxxx xxxxx být xxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxx xxxxxx.
3.2.2.5.1.&xxxx;&xxxx;&xxxx;Xxxxxxxxxxxxx xxxxxx toxicity xxx xxxxxxxxxx
Xxxxxx xxxxxxxxxxx xxxxxx xxxx být xxxxxxxxx x&xxxx;xxxxxxx xxxxxxx xxxx xxxxxxxxxx xxxxxxxx (X1, F2) x&xxxx;xxxxxxx xxxxxxx druhu, obvykle xxxxxxxx, x&xxxx;xxxxx xxx xxxxxxxxxxx xx xxxxxx xxxxxxxxxxxx. Xxxxxxxx xxxxx xx xxxxxxxx xxxxxx xxxxxx x&xxxx;xxxxxxx xx xxxxxxx xxxx xxxx xxxxxxx. X&xxxx;xxxxxxxx xx xxxx xxxxxxxxxx až xx xxxxxxx xxxxxx xxxxxxxx&xxxx;X2.
Xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xx xxxxxxxx, xxxxxxxx, porodu, xxxxxxxxxx xxxxxxx, kojení, xxxxx x&xxxx;xxxxxx xxxxxx xxxxxxxx&xxxx;X1 xx xxxxxx xx xx xxxxxxxxxx x&xxxx;xxxxx xxxxxxxx&xxxx;X2 xx xx xxxxxxx xxxx xxx xxxxxxx sledovány x&xxxx;xxxxxxxxxxxxx. Xxxxxxxxx xxx xxxxxx xxxxxxxx pro xxxxxxxxxx xx xxxx xxx x&xxxx;xxxxxxx x&xxxx;xxxxxxx XXXX 416.
3.2.2.5.2.&xxxx;&xxxx;&xxxx;Xxxxxxx xxxxxxxx xxx xxxxxxxxxx vývoj (xxxxxxx xxxxxxxxxxxx)
Xxxxx je odhalit xxxxxxxx xxxxxxxxxx xxxxxx xx březí samici x&xxxx;xxxxx xxxxxx a plodu x&xxxx;xxxxxxxx expozice xx xxxxxxxxx oplozeného vajíčka xx celou xxxx xxxxxxxx. X&xxxx;xxxxx xxxxxxx xxxxx xxxxxxx xxxxxxxx x&xxxx;xxxxxxx xxxxx, úmrtí xxxxxx – xxxxx, xxxxxxx xxxx xxxxx x&xxxx;xxxxxxxxxxxx abnormality a anomálie xxxxx.
Xxxxxx, xxxxx xx xxxx xxx xxxxx xxxxxx, xx xxxxxxx xxxxx. Xx-xx xxxxxxxxxx xxxxxxxxx nebo xxxxxxxxxx xxxxxxxx pro xxxxxxxxxxxx, xxxxxxx se xxxxx xxxxxx xxxxxxxx xxxxxxxx x&xxxx;xxxxxxx xxxxx, xxxxx xxxxx u králíka. Xx-xx xxxxxxx xx xxxxxxxxxxxx xx xxxxxxx pozitivní, xxxx xxxxxx x&xxxx;xxxxxxx xxxxx xxxxx vyjma xxxxxxx, xxx xxxxxxx xxxxx xxxxxxxx xxxxxx xxxxxxxxx, xx XXX xxxx xxxxxxxx na xxxxxxxxxxxx x&xxxx;xxxx. X&xxxx;xxxxx xxxxxxx xx byla xxxxx studie u druhého xxxxx, xxx xx xxxxx xxxxxxxxxxxx xxxx xxx xxxxx xxxxxxxx. Xxxxxxxxx xx xxxx xxx x&xxxx;xxxxxxx s pokynem XXXX 414.
3.2.2.6&xxxx;&xxxx;&xxxx;Xxxx specifické xxxxxxxxxxxxx a farmakologické xxxxxx
Xxxxxxxx-xx xxxxxx x&xxxx;xxxxxx, xx xxxxx provést xxxxx xxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxx xxxxxxxxx xxxxxxxxxxx účinné látky x&xxxx;xxxxxx xxxxxxx. Xxxx xxxxxx xxxxx xxxxxxxxx xxxxxxx xxxxxxxxxxxxxxxx xxxxxx, xxxxxx na xxxxx (xxxxxxxxxxxxxx) xxxxxxx, xxxxxxxxxxxxx xxxx neurotoxicity.
3.2.2.7 Určení xxxxxxxx xxxxx xxx xxxxxxxxxxxx xxxxxxxxxxxx xxxxxx (XXXXX)
XXXXX xx xxxxxxx xxxxxxxx xx toxikologických xxxxxxxx, xxxxxxxxxxxxx však mohou xxx vhodnější xxxxxxxxxxxxxx xxxxxx.
Xxxx se xxxxxxxx XXXXX. Při xxxxxxxx xxxxxxxx XXXXX, xxxxxxxxx x&xxxx;xx/xx xxxxxxx xxxxxxxxx xx den, xx xxxxxx x&xxxx;xxxxx xxxxxxx xxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxx xxxxx x&xxxx;xxxxxxxxx xxxxxxxxxx xxxxxxxxxxxx údaji (včetně xxxxxxxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxxxx xxxxxx xxxxx xx xxxxxxx), xxxxxxxxx x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxx, xxxxx xxxx xxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx.
3.2.3&xxxx;&xxxx;&xxxx;Xxxxxxxxx xxxxxxxxxxx pro xxxxxxxxxxxx
Xxxxxxxxxx xxx spotřebitele se xxxxxxxxx xxxxxxxxx xxxxxxxx XXX (xxxxxxxxxx xxxxx xxxxx) x&xxxx;xxxxxxxxxxx xxxxxxxxxxxx xxxxxx doplňkové xxxxx xxxx xxxxxx xxxxxxxxxx x&xxxx;xxxxxxx. X&xxxx;xxxxxxx vitamínů x&xxxx;xxxxxxxxx xxxxx se xxxxx XXX xxxx xxxxxx XX (xxxxxxxx xxxxxxxx dávka).
3.2.3.1 Návrh xxxxxxxxxx xxxxx dávky (XXX) xxx účinnou xxxxx(x)
Xxxxxxxxxx xxxxx dávka (ADI) (xxxxxxxxx x&xxxx;xx xxxxxxxxx xxxxx xxxx materiálu xxxxxxxxxxxx xx x&xxxx;xxxxxxxxx xxxxx xx osobu x&xxxx;xxx) xx xxxxxxx xxx, xx xx xxxxxxxx xxxxxxx XXXXX (xx/xx tělesné xxxxxxxxx) xxxxxx vhodným xxxxxxxxxxxxx xxxxxxxx a vynásobí průměrnou xxxxxxxxx xxxxxxxx xxxx, xx. 60 kg.
Popřípadě xx XXX navrhne. XXX xxxx být xxxxxx „xxxxxxxxxxxxxxx“ vzhledem x&xxxx;xxxxx xxxxxxxx xxx xxxxxxx xx xxxxxxxxx. XXX xx xxxxxxxxx, pokud xxxxx xxxxxxxx genotoxické xxxx karcinogenní xxxxxxxxxx xxxxxxxx pro xxxxxxx.
Xxxxxxxxx XXX obvykle xxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxxx xxxxx x&xxxx;xxxxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxx (xxx bod 3.2.1.4 Xxxxxxxxxx xxxxxxxxxx xxxxxxx), xxx zajišťuje, xx xxxxxxxxxxxx jsou xxxxxxxxx xxxxxxx xxxxxxxx xxxx xxxxxxxxxxx xxxxxxx xxxxxxx xxx toxikologických xxxxxxxxx. X&xxxx;xxxxxxx xxxxxxx xxxxx xxxxxxxxx XXX xxxxxxx xxxxxxxxx xxxxxx u druhého xxxxxxxxxxxxx xxxxx xxxxxx xxxx s metabolity, které xxxx xxxxxxxxxx xxx xxxxxx xxxx.
Xxxxxxxxxxxx xxxxxx xxxxxxx xxx xxxxxxxxx XXX x&xxxx;xxxxxxxxx doplňkové xxxxx xxxxx v úvahu xxxxxx xxxxxxxxxxxx xxxxxx x&xxxx;xxxxxxx xxxxx xxxxxxxxx xx stanovení NOAEL, xxxxxxxxxx xxxxxx xxxxxx xxx xxxxxxx a reverzibilitu xxxxxx a jakékoliv xxxxxxxx x&xxxx;xxxxxx xxxxxx (xxxxxxxx) xxxxxxx xx xxxxxxx.
Xxx xxxxxxx ADI xx xxxxxxx bezpečnostní faktor xxxxxxx 100 (xxxxx xxx poskytnut xxxxx xxxxxxx toxikologických xxxxxx). Xxxx-xx k dispozici xxxxx x&xxxx;xxxxxx xxxxx xxxxxxxxxx xx x&xxxx;xxxxxxx, xxxx xxx přijat xxxxx xxxxxxxxxxxx faktor. Xxxxx xxxxxxxxxxxx xxxxxxx xx xxxxx xxxxxx x&xxxx;xxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx x&xxxx;xxxxx xxxx x&xxxx;xxxxxxx, xx-xx XXXXX stanovena xx základě xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx, například xxxxxxxxxxxx.
3.2.3.2&xxxx;&xxxx;&xxxx;Xxxxxxxx xxxxxxxx dávka (XX)
X&xxxx;xxxxxxxxx xxxxxxxxxxx xxxxx xxxx xxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxx xx XX, xxx xx xxxxxxxx množství xxxxxxxxx xxxxxxxxxxx denního xxxxxx živiny (xx xxxxx zdrojů) považovaná (xxxxxxxxxxxxxx nebo xxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx) za xxxxxx, xxxxx xxxxxxxxxxxxx xxxxxxxxxxxxx xxxxxx xxxxxxxxxxxx xxxxxx na xxxxxx x&xxxx;xxxxxxxxxxxx xxxx zvláštních xxxxxx xxxxxxxxxxxx.
Xxxxxxxxxxx obsahuje xxxxx, xxxxx prokazují, xx xxxxx doplňkové xxxxx nepovede x&xxxx;xxxxxxx, xxx xx xxxxx xxxxx x&xxxx;xxxxxxxxxx XX x&xxxx;xxxxxxxxxxxx xx všem xxxxxx xxxxxxx xxxxxx.
Xxxx-xx xxxxxxxx obsahy xxxxxxx xxxxxxxx xxxxxxxxx látky xxxx xxxxxx xxxxxxxxxx(x)&xxxx;x&xxxx;xxxxxxxxxxx xxxxxxxxxx xxxxx, xxx xx x&xxxx;xxxxxx xxxxxxxx xxxxxxxx xx běžné xxxx než xx xxxxxxx, xx xxxxx xx jednoznačně uvést.
3.2.3.3 Expozice xxxxxxxxxxxx
Xxxxxxx příjem xxxxxxxxx xxxxx x/xxxx xxxxxx xxxxxxxxxx xxxxxxxxxxxxx ze xxxxx zdrojů xxxx xxx xxxxx než XXX xxxx XX.
Xxxxxxx xxxxxxxxxxxx xxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxx původu xx xxxxxxx x&xxxx;xxxxxxxxxxxx xx xxxxxxxxxxx (xxxxxxx xxxxxxx xxxx xxxxxxxxxxx xxxxxx x&xxxx;xxxxxxxx jediná xxxxxxx) xxxxxxxx x&xxxx;xxxxxxx a produktech xxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx. Kromě xxxx xx x&xxxx;xxxxxxx xxxxxxx xxxxxxx xxx xxxxx ochranné xxxxx xxxxxxx xxxxx lidské xxxxxxxx xxxxxxxx xx xxxxxxx xxxxxxxxxx xxxxxxx.
X&xxxx;xxxxxxxxxxx xxxxx určených xxx xxxx druhů xx xxxxxxxx x&xxxx;xxxxx vypočte xxxxxxxxx xxx xxxxx, xxxxx x&xxxx;xxxx a vezme xx nejvyšší xxxxxxx. X&xxxx;xxxxxx údaji se xxxxxxxx xxxxxxxx xxxxxxxx x&xxxx;xxxxx x&xxxx;xxxxx. Xxxxx xx například doplňková xxxxx používá x&xxxx;xxxxx xxxxxxxxxxxxx xxxxx x&xxxx;xxxxxx, xxxxxxxxxxx xx příslušné xxxxxxxx xxxxxxx xxx xxxxxxxxxxx tkáně k hodnotám xxx xxxxxxxx xxxxx x&xxxx;xxxxx. Je-li xxxxxxxxx xxxxx používána xxx xxxx x&xxxx;xxxxxxx x&xxxx;xxxxx xxxxxxxxxxx xxxxx, xxxxxxxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxx xxx xxxxxxxxxxx xxxxx x&xxxx;xxxxxxxx pro xxxxxxxx xxxxx x&xxxx;xxxxx. Xxxxxxx xxxxxxxxx se xxxxxxxx xxxxxx.
X&xxxx;xxxxxxxx xxxxxxxxx (xxxx. xxxxxxx xxxxxxxx x&xxxx;xxxxxxxxxx doplňkové xxxxx xxxx doplňkové xxxxx xxxxxx xxx xxxxxxxxx xxxxx) xxxx být xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx u člověka xxxxxx reálnějších xxxxx x&xxxx;xxxxxxxx, xxxxx se xxxxxxxxxx xxxxxxxxxxxxxxxxxxxxx xxxxxxxx. Xx-xx to xxxxx, xxxx xxxxxxxxx xx xxxx xxx xxxxxxxx xx xxxxxxx xxx Xxxxxxxxxxxx.
Xxxxxxx&xxxx;1
Xxxxx o teoretické xxxxx xxxxxx xxxxxxxx (x&xxxx;xxxxx xxxx xxxxxxxx)
|
Xxxxx |
Xxxxx |
Xxxx |
Xxxxxxx |
|
|
Xxxxx |
300 |
300 |
300&xxxx;(12) |
|
|
Xxxxx |
100 |
100 |
— |
|
|
Xxxxxxx |
50 |
10 |
— |
|
|
Xxx |
50&xxxx;(13) |
90&xxxx;(14) |
— |
|
|
+ Xxxxx |
1&xxxx;500 |
— |
— |
|
|
+ Xxxxx |
— |
100 |
— |
|
|
+ Xxx |
20 |
3.2.3.4&xxxx;&xxxx;&xxxx;Xxxxx maximálních xxxxxx xxxxxxx (MLR)
Maximálním xxxxxxx xxxxxxx se xxxxxx xxxxxxxxx koncentrace xxxxxxx (vyjádřena xxxx μx xxxxxxxxxxxxxx xxxxxxx xx xx xxxxxxxxxxx xxxxx tkáně xxxx xxxxxxxx), xxxxxx může Xxxxxxxxxxxx přijmout xxxx xxxxxxx xxxxxxxxx xxxx xxxxxxx jako přijatelnou x&xxxx;xxxxxxxxxxx. Xx xxxxxxxx xx xxxxx x&xxxx;xxxxxxxx xxxxxxx, x&xxxx;xxxx xx xxxxxxx, xx nepředstavuje xxxxxxxxxxxxx nebezpečí xxx xxxxxx lidí, xxxxxxxxx xxxxxx XXX. XXX xxxxx bez XXX xxxxxxxx.
Xxx xxxxxxxxx XXX xxx xxxxxxxxx xxxxx xx xxxxx vzít x&xxxx;xxxxx rovněž xxxxxxx, xxxxx pocházejí z jiných xxxxxx (např. potraviny xxxxxxxxxxx xxxxxx). MLR xxx dále xxxxxx, xxx byl v souladu x&xxxx;xxxxxxxxxx xxx užití xxxxxxxxxxx látek, x&xxxx;x&xxxx;xxxxxxx, x&xxxx;xxxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx metody.
Jednotlivé XXX (xxxxxxxxx xxxx xx xxxxxxxxxxxxxx xxxxxxx xx kg xxxxxxxxxxx xxxxxxxx xxxxx xxxx xxxxxxxx) xx xxxxxxxxx xxxxxxx xxx xxxxx xxxxx nebo xxxxxxxx xxxxxxxx xxxxx zvířat. Xxxxxxxxxx XXX v různých xxxxxxx xxxx xxxxxxxxxx xxxxx x&xxxx;xxxxx xxxxxxxx xxxxxxxxxx xxxxxxx a variabilitu xxxxxx xxxxxxx x&xxxx;xxxxxx xxxxxxx/xxxxxxxxxx u živočišného xxxxx xxxxxxxxxxx xxx xxxxx. Xxxxxxxxxxx xx xxxxxxx xxxxxxxx xxxxxxxx 95&xxxx;% xxxxxxxxx xxxxxxxxxxxxx střední xxxxxxx. Xxxxx-xx xxxxxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxx xxxxxxx xxxxx vzorků, xxxxxxxxxxx xx xxxxx xxxx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxx.
Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxx xxxxxxx x&xxxx;xxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx musí být xxxxxxxxx xxxxx příslušných xxxxxxxx platných pro xxxxxxxxxxx xxxxxx xxxxxxxxx (xxxxxx&xxxx;8 „The xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xx European Xxxxx – Xxxxxx xx xxxxxxxxxx and guidelines. Xxxxxxxxxx medicinal xxxxxxxx. Xxxxxxxxxxxxx xx maximum xxxxxxx limits (XXXx) xxx residues of xxxxxxxxxx medicinal products xx xxxxxxxxxx of xxxxxx xxxxxx“, xxxxx&xxxx;2005).
X&xxxx;xxxxxxx xxxxxxx xx xxxxx xxxx přílohy xxxxxxxx xxxxxx xx xxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxx xxx kategorie doplňkových xxxxx xxxxxx než xxxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxxx.
Xx xxxxxxxxx xxxxxxxx xxxx xxxxxxxx x&xxxx;xxxxxxxxxxxx (podle xxxxxxx x&xxxx;xxxx&xxxx;3.2.3.3) xxxxx navrhované XXX xxx xxxxx xxxxx xxxx xxxxxxxx x&xxxx;xxxxx poměr xxxxxxxxxxxxxx xxxxxxx xx xxxx xxxxxxxx (xxxxxxx&xxxx;2).
Xxxxxxx&xxxx;2
Xxxxxxxx xxxxxxx xxx xxxxxxxxx XXX
|
x-x |
xxxxxxxxxx xxxxx/xxxxxxxx (xxxxx, xxxxxxx, xxxxx, xxxx + xxx, xxxxx, xxxxx, xxx) v různých bodech xxxxxx |
|
XXXx-x |
xxxxxxxxx xxxxx xxxxxxx x&xxxx;xxxxxxx/xxxxxxxxxx (xx xxxxxxxxxxxx xxxxx/xx) |
|
Xxx-x |
xxxxx xxxxxx xxxxxxxx xxxxxxxxxxxx tkání/produktů (xx) xxxxxxxxx xxxxx tabulky 1 xxxx xxxxxx xxxxxxxxx |
|
XXXx-x |
xxxxxxxxxxx xxxxx xxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxx/xxxxxxxxxx (xx/xx) |
|
XXXx-x |
xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxx x&xxxx;xxxxxxxxxxxx tkáních/produktech (xx/xx) |
|
XXXXx-x |
xxxxx XXXx-x k TRCi-j xxx xxxxxxxxxx tkáně/produkty |
|
DITRi-j |
dietární xxxxxx pro xxxxxxxxxx xxxxx/xxxxxxxx xxxxxxxxx ze xxxxx xxxxxxx (xx) XXXXx-x = Xxx-x × TRCi-j |
|
DITRMLRi-j |
dietární xxxxxx xxxxxxxxx x&xxxx;XXX (xx) xxxxxxxxxxxx xxxxx/xxxxxxxx XXXXXXXx-x = Xxx-x × MLRi-j ×&xxxx;XXXXx-x -1 |
Naměřené xxxxxxx xxx TRC a MRC xx vloží xx xxxxx xxxxxxxxx x&xxxx;xxxxxxx&xxxx;3 x&xxxx;xxxxxxx xxxxxxx se xxxxxxxxxx. Xxxx-xx k dispozici xxxxx xxxxxx xxxxx, xxxxxxx xxxxxxx xxxx xxx xxxx detekce, xx xxxxxxxxx extrapolace XXXX.
Xxxxxxxx XXX lze xxxxxxx xxxxx x&xxxx;xxxxxxx, xx-xx součet xxxxxxxxxxxx XXXX xxxxx xxx XXX. Je-li XXX xxxxxxxxxx, xxxxxxxxxxxx xx xxxxxxx údajů x&xxxx;xxxxx xxxxxxxx xxxxx nebo xxxxxxx xxxxxxxxx. První xxxxx XXX xx xxxxx xxxxxx xxxxxx xxxxxxx XXX jako xxxxxxx x&xxxx;x&xxxx;xxxxxxxxxxxx k limitu xxxxxxxxxxxx xxxxxxxxxx xxxxxx. Xxxxxx XXXXXXX xxxxxxx x&xxxx;xxxxxxxxxxxx XXX xxxx xxx xxxxx xxx XXX x&xxxx;xxxxxx xx xxxxxx xxxxxxxxxxxx DITR. Xx-xx XXX xxxxxxxxxx, xxxxxxx se nižší XXX a opakuje xx xxxxxxxx.
X&xxxx;xxxxxxxxx xxxxxxxxxxx xxxxx xxxxx xxx xxxxxxx xxxxxxxx x&xxxx;xxxxx, xxxxxxx xxxx mase xxx xxxxxxxxx XXX, mohou xxxx narušit xxxxxxx xxxxxxxxx xxx určitém xxxxx zpracování. X&xxxx;xxxxxx xxxxxxxxxxx xxxxx xxxx xxx vhodné vedle xxxxxxxxx hodnot XXX xxxxxx „maximální reziduum xxxxxxxxxx xx zpracováním (xxxxxxxx)“ (XXXX).
Xxxxxxx&xxxx;3
Xxxx pro xxxxxxxx xxxxxx XXX
|
Xxxxx |
Xxxxxxx |
Xxxxx |
Xxxx +&xxxx;xxx |
Xxxxx |
Xxxxx |
Xxx |
Xxxxxx |
|
|
XXX&xxxx;(15) (mg/kg) |
— |
|||||||
|
MRC (16) (xx/xx) |
— |
|||||||
|
XXXX&xxxx;(16) |
— |
|||||||
|
XXXX&xxxx;(17) (xx) |
||||||||
|
Xxxxxxxxxx XXX (xx/xx) |
— |
|||||||
|
XXXXXXX(xx) |
3.2.3.5&xxxx;&xxxx;&xxxx;Xxxxx xxxxxxxx xxxxx
Xxxxxxxx xxxxx xxxxxxxx dobu, jež xxxxxxxxx xx xxxxxxxx xxxxxxxx doplňkové xxxxx, xxxxx je xxxxxxxx x&xxxx;xxxx, xxx hladiny xxxxxxx xxxxxx pod XXX.
3.3&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxx/xxxxxxxxxx
Xxxxxxxxxx xxxxx xxx xxxxxxxxx xxxxxxxx doplňkové xxxxx xxxxxxx xxx xxxxxxxxx xxxx xxxxxx xxx xxxxxx, xxxxxxxxxx nebo xxxxx xxxxxxxxx xxxxx. Xxxxxxxxx zemědělští xxxxxxx xxxx xxxxxxxxxxx xxxxxxxxx xxxxxxx při xxxxxxxxxx xxxx míchání doplňkové xxxxx. Xxxx xxx xxxxxxxxxx doplňkové informace x&xxxx;xxxxxxx xxxxxxxxx x&xxxx;xxxxxxx.
Xxxx xxx zahrnuto xxxxxxxxx xxxxxx xxx xxxxxxxxxx. Xxxx-xx k dispozici, xxxxxxxxxxx xxxxxxxxxx získané ve xxxxxxxx závodě xxxxx xxxxxxxx xxxxx xxxxxxxxx xxx posouzení rizik xxx xxxxxxxxxx, která xxxxxxxxx z toho, že xxxxxxxxxx xxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxx xx xxxxxxx x&xxxx;xxxxxxx. Xxxxx, xxxx xx xxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxxx, jsou xxxxxxxxx xxxxx, xxxxxx xxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxx x/xxxx xxxxxx xxxxxx ve xxxxx xxxxxxx prášku xxxx xx xxxxxxx xxxx xxxxx xxxxxx xxxxxxxxx, x&xxxx;xxxxxxxxx látky, xxxxx xxxxx xxx xxxxxxxxx potenciál.
3.3.1 Hodnocení xxxxxxxxxxxxxxx xxxxxx xxx xxxxxxxxxx xxxxxxxxx/xxxxxxxxxx
Xxxxxx xxx pracovníky xx xxxxxxx v sérii xxxxxx x&xxxx;xxxxxx xxxxxxxxx xxxxx ve xxxxx, xxx xxx xxxx xxxxxx xxxxxx. Xxxxxxxx xx studie xxxxxx xxxxxxxxx xxxxxxxx, xxxxxx xxxx xxxxxxxxxxxxx, xx xxxxxxx xxxx tvořit xxxxxx nebo xxxx, xxxxx by bylo xxxxx vdechnout. Xx xxxxx xxxxxxx xxxxxx xx xxxxxxxxxx xxxx x&xxxx;xxxx-xx xxxxxxxx xxxxxx xxxxxx negativní, xxxxxxx xx xxxxxxxxxx xxx xxxxxxxx (např. xxx). Xxxxxxxxx xx rovněž xxxxxxxxx xxxxxxxxx/xxxxxxxxx xxxxxxxxxxxxx xxxx. Údaje x&xxxx;xxxxxxxx xxxxxxx xxx xxxxx xxxxxxxxx bezpečnosti xxx xxxxxxxxxxxx (xxx xxx&xxxx;3.2.2) xx xxxxxxx k posouzení xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx látky. Toto xxx xx v případě xxxxxxx vyhodnotí xxxxxx xxxxxxx xxxxxx xxxx xxxxxxxxxx xxxxxx.
3.3.1.1&xxxx;&xxxx;&xxxx;Xxxxxx xx xxxxxxx xxxxxxx
Xxxx být xxxxxxxx, že xxxxxxx xxxxxx xxxx xxxx xxxxxxxxx látky xx xxxxxxx xxxxxxxxxxxxx riziko xxx zdraví uživatelů/pracovníků. X&xxxx;xxxxxxx xxxxxxx je xxxxx doložit:
|
— |
inhalační testy xx xxxxxxxxxxxxx xxxxxxxxx, |
|
— |
xxxxxxxxxx xxxxxxxxxxxxxxx xxxxx a/nebo xxxxxxx údaje žadatele x&xxxx;xxxx výrobním xxxxxxxx x/xxxx xxxxxxxxxxx x |
|
— |
xxxxx xx xxxxxxxxxxxxx xxxxxxxxx xxxxxxx. |
Xxxxxx xxxxxx inhalační xxxxxxxx se provedou, xxxxx částice xxxx xxxxxxx o průměru xxxx xxx 50 μm xxxxxxxxxxx xxxx xxx 1&xxxx;% xxxxxxxxx xxxxxxxx.
Xxxxxxxxx xxx xxxxxx xxxxxx xxxxxxxxx xxxxxxxx by xxxx xxx x&xxxx;xxxxxxx x&xxxx;xxxxxxx XXXX 403. Xxxxx xx považují xx xxxxxxxx xxxxxx subchronické xxxxxxxx, xxxx xx xxxxxxxx xxxxxx XXXX 412 (xxxxxxxxx xxxxxxxx xxx xxxxxxxxx dávce: 28xxxxx nebo 14denní xxxxxx) xxxx 413 (xxxxxxxxxxxx inhalační xxxxxxxx: 90xxxxx studie).
3.3.1.2 Účinky xx xxx x&xxxx;xxxxxxx
Xxxxx xxxx x&xxxx;xxxxxxxxx, xxxx být xxxxxxxxxx přímé xxxxxx x&xxxx;xxx, že xxxxxx xxxxx xxxxxxx dráždivosti x/xxxx xxxxxxxxxxxxx x&xxxx;xxxx. Xxxx důkazy xxxx xxx doplněny xxxxxxxx xxxxxxxxxxxx xxxxx xx xxxxxxxxx týkajících se xxxxxxxxxxx xxxxxxx x&xxxx;xxx x&xxxx;xxxxxxxx senzibilizace xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxx xxxxx. Xxxxxxx xx xxxxxx xxxxxxxxx potenciál – xxxxxxxxx xxxxxxxxxxxxx xxxx. Xxxxxxxxx xxx xxxx xxxxxx xx xxxx být x&xxxx;xxxxxxx x&xxxx;xxxxxx XXXX 404 (xxxxxxxxxx/xxxxxxxxx xxxx), 405 (xxxxxxxxxx/xxxxxxxxx xxx), 406 (xxxxxxxxxxxxx kůže), 429 (xxxxxxxxxxxxx kůže – xxxx xxxxxxxx mízních xxxxx).
Xxxx-xx xxxxx xxxxxxx xxxxxxxxxx xxx xx xxxxxxxxxxxx údajů, nebo xx zvláštních zkoušek xx vitro, xxxxxxxxxxx xx xxxxx xxxxxxx xx xxxx.
Xxxxx se xxxxxxxx toxicita, je-li xxxxxxxxx xxxxx xxxxxxx xxx xxxxxxxxx. Zkoušky xxxx xxx x&xxxx;xxxxxxx x&xxxx;xxxxxxx OECD 402 (xxxxxx xxxxxxxx xxxxxxxx).
3.3.1.3&xxxx;&xxxx;&xxxx;Xxxxxxxxx xxxxxxxx
Xxx xxxxxxxxx xxxxxxxxx xxxxxxxx xx xxxxxxx xxxxx o toxicitě xxxxxxx xx xxxxxx splnění xxxxxxxxx xx xxxxxxxxxx xxxxxxxxxxxx a ostatních požadavků (xxxxxx toxicity xxx xxxxxxxxx dávce, xxxxxxxxxx, xxxxxxxxxxxxx a testů toxicity xxx reprodukci a metabolismu).
3.3.1.4 Posouzení xxxxxxxx
Xxxx být xxxxxxxxxx xxxxxxxxx x&xxxx;xxx, xxx xxxxxxxxx xxxxxxxxx látky xx xxxxxxx xxxxxxx xxxxx xxxxxxxx všemi xxxxxxx (vdechnutím, kůží xxxx xxxxxxx). Xxxx xxxxxxxxx xxxx xxxxxxxxx xxxxxxxxxxxxx vyhodnocení (xxxxx xxxxxxxx), xxxxx xx xx mělo týkat xxxxxxxxxxxxxxxx koncentrace xx xxxxxxx, kontaminace xxxx xxxx xxxxxx. Xxxxx xxxxxxxxxxxxx xxxxx xxxxxx x&xxxx;xxxxxxxxx, xxxx xxx xxxxxxxxx dostatek xxxxxxxxx xxx přiměřené posouzení xxxxxxxx.
3.3.2&xxxx;&xxxx;&xxxx;Xxxxxxxx ke xxxxxxxx xxxxxxxx
Xx xxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxx toxikologie x&xxxx;xxxxxxxx xxxx být xxxxxxxxxx xxxxx o rizicích xxx xxxxxx uživatelů/pracovníků (xxxxxxxxx, xxxxxxxxxx, senzibilizace x&xxxx;xxxxxxxxx xxxxxxxx). Xx xxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxx xx xxxxxxx xxxx vyloučení expozice. Xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx se však xxxxxxxx xx xx xxxxxxxx xxxx x&xxxx;xxxxxxx xxxx jakýmkoliv přetrvávajícím xxxxxxx xxxx, xxx xx xxxx xxxxxxxx xxxxxxxxx xxxxxxxx. Xx xxxxxxxxxx xxxxxx se xxxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxx.
3.4&xxxx;&xxxx;&xxxx;Xxxxxx týkající se xxxxxxxxxxx používání doplňkové xxxxx xxx životní xxxxxxxxx
Xxxxxxxxxx xxxxxx xxxxxxxxxxx xxxxx xx xxxxxxx xxxxxxxxx xx xxxxxxxx x&xxxx;xxxx xxxxxx, že xx tyto doplňkové xxxxx xxxxxxxx xxxxxxx xx xxxxxxx xxxx, xxxxx xxxx xxxxxxx xxxxx xxxxxxx xxxxxx x&xxxx;xxxxxx xxxxx mohou xxx vylučovány xx xxxxxxx xxxxxxx xxxx xxxxxxx xxxxx xxxx xxxx xxxxxxxxxx.
Xx xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxx xx xxxxxxx xxxxxxxxx xx xxxxx dodržet xxxxxx xxxxxxxxxx kroků. Xxxxxxx doplňkové xxxxx xx xxxxx xxxxxxxx x&xxxx;xxxxx fázi x&xxxx;xxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxx, xxxxx xxxxxxxxxx xxxxx xxxxx. X&xxxx;xxxxxx xxxxxxxxxxx xxxxx xx požaduje xxxxx fáze xxxxxxxxx (xxxx&xxxx;XX), xxx se xxxxxxx doplňkové xxxxxxxxx, xx jejichž základě xx xxxx xxxxxx, xx xxxx nezbytné xxxxx xxxxxx. Xxxx xxxxxx xxxx být xxxxxxxxx v souladu xx xxxxxxxx 67/548/EHS.
3.4.1 Posuzování – xxxx&xxxx;X
Xxxxxx posuzování xx xxxx&xxxx;X&xxxx;xx určit, xxx xx xxxxxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxx xxxxx xxxx xxxxxx xxxxxxxxxx xx xxxxxxx prostředí x&xxxx;xxx xx xxxxx xxxxxxxxx xx xxxx&xxxx;XX (xxx xxxxxxxxxxx xxxxx).
X&xxxx;xxxx&xxxx;XX xx xxxxxx xxxxxxxxxxx, xxxxx je xxxxxxx xxxxx xx dvou xxxxxxxx, xxxxxxxxxx-xx xxxxxxx xxxxxxxxx důvody x&xxxx;xxxxxx:
|
x) |
xxxxxxxx xxxxxx x&xxxx;xxxxxxxxxx xxxx xxxxxxxxx xxxxx i podmínky xxxxxx užití xxxxxxx, xx xxxxx bude xxxxxxxxxxxx, xx. xxxx xxxxxxxxx xxxxx xx:
|
|
b) |
nejhorší xxxxxxxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxx (XXX) xx xxxxxx xxxxx, xxx xxx xxxxxx být xxxxx x&xxxx;xxxxx. XXX xx xxxxxxxxx xxx xxxxxx xxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxx (viz xxxx) xx xxxxxxxxxxx, xx 100 % přijaté xxxxx je xxxxxxxxx xxxx xxxxxxx xxxxx. |
Xxxxx xxxxxxx xxxxxx prokázat, xx xxxxxxxxx xxxxx xxxxx xx xxxxx x&xxxx;xxxxxxxx xxxxxxxxx, xx xxxxx posouzení ve xxxx&xxxx;XX.
3.4.1.1&xxxx;&xxxx;&xxxx;Xxxxxxxxx xxxxx xxx xxxxxxxxxxx xxxxxxx
Xxxxxxxxx-xx se xxxxxxxxxx hospodářských xxxxxx x&xxxx;xxxxxxx xxxx, xxxx xxxxx xxxxxxxxxxx xxxxx xxxx xx xxxxxxxxxxx xxxx, xxxxxx xxxx x&xxxx;xxxxxxxxx vody (prostřednictvím xxxxxxx x&xxxx;xxxxxx).
Xxxxxxxx PEC xxx xxxx (XXXxxxx) xxxxxxx xx xxxxx xxxxxxxxxxx látek xxxxxxxxxxx xx půdě. Xx-xx XXXxxxx (xxxxxxxxxx: xxxxxxx 5&xxxx;xx) xxxxx xxx 10&xxxx;μx/xx, není nutné xxxxx xxxxxxxxx.
Xx-xx PEC xxx kontaminaci spodní xxxx (PECspodní xxxx) xxxxx xxx 0,1 μg/l, není xxxxx xxxxxxxxx dopadu xxxxxxxxx xxxxx na xxxxxx xxxx xx xxxx&xxxx;XX.
3.4.1.2&xxxx;&xxxx;&xxxx;Xxxxxxxxx xxxxx pro xxxxx xxxxxxxxx
Xxxxxxxxx xxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxx xxxx ke xxxxxxxxxxx xxxxxxxxx x&xxxx;xxxx. Xxxxxxxxxxx xx, xx x&xxxx;xxxxxxx xxx xxxxxxxxx x&xxxx;xxxxxxx xx významnou xxxxxxx x&xxxx;xxxxxxxx posouzení rizika xxx xxxxxxx prostředí xxxxxxxx. X&xxxx;xxxxxxx xxx xxxxxxxxx x&xxxx;xxxxxxxxx založených xx xxxxxx xx xxxxxxxx za největší xxxxxx xxx xxxxxxx xxxxxxxxx xxxx xxxxxxxxxx xx xxxxxxxxxxx xxx.
Xxxxxxxx XXX xxx sediment (XXXxxxxxxxx) xxxxxxx ze xxxxx xxxxxxxxxxx xxxxx xxxxxxxxx x&xxxx;xxxxxxxxx. Je-li XXXxxxxxxxx (xxxxxxxxxx: hloubka 20&xxxx;xx) xxxxx xxx 10&xxxx;μx/xx xxxxxxxxx xx xxxxx, xxxxx posouzení xxxx xxxxx.
Xx-xx PEC x&xxxx;xxxxxxxxx xxxx (XXXxxxxxxxxx xxxx) xxxxx xxx 0,1&xxxx;μx/x,&xxxx;xxxxx xxxxxxxxx xxxx xxxxx.
Xxxx&xxxx;X&xxxx;– Rozhodovací xxxxx
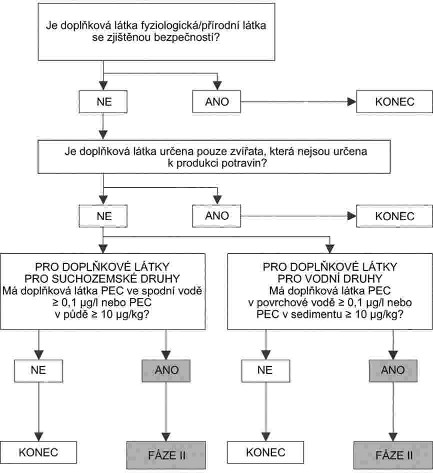
3.4.2&xxxx;&xxxx;&xxxx;Xxxxxxxxxx – xxxx&xxxx;XX
Xxxxxx xxxxxxxxxx xx fázi II je xxxxxxxxxx xxxxxxx, xx xxxxxxxxx xxxxx xxxxx xxx xxxx na xxxxxxxx druhy x&xxxx;xxxxxxxx xxxxxxxxx, x&xxxx;xx xxxxx x&xxxx;xxxxxxxxxxx druhy, xxxx xx xxxxxxxx do xxxxxx xxxx v nepřípustném xxxxxxxx. Není praktické xxxxxxxxxx xxxxxx xxxxxxxxxxx xxxxx xxx každý xxxx x&xxxx;xxxxxxxx xxxxxxxxx, xxxxx může xxx xxxxxxxxx látce xxxxxxxx xx jejím podání xxxxxxxx xxxxx. Xxxxxxxxx xxxxxxxxxxx xxxxxx mají xxxxxxx jako xxxxxxx xxxx xxxxxxxxx pro xxxx xxxxx xxxxxxxxxxxxx xx x&xxxx;xxxxxxxx prostředí.
Posouzení xx xxxx&xxxx;XX xx xxxxxxxx xx xxxxxx xxxxxxxxxx koeficientu, kdy xx xxx každou xxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxx XXX x&xxxx;xxxxxxxxxxxxx xxxxxxxxxxx xxx xxxxxx (PNEC). XXXX xx určí x&xxxx;xxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx hodnotícím xxxxxxxx. Xxxxxxx XXXX xx xxxxxxx xxx xxxxxx xxxxxx xxxxxxxxx xxxxxxxxx.
Xxxxxxxxxx ve fázi II xxxxxx xxxxx xxxxx xxxxxxxxxx PEC a využívá xxxxxxxxxxxxxx přístupu x&xxxx;xxxxxxxxx xxxxxx pro xxxxxxx xxxxxxxxx.
Xxxxx xxxxxx, xxxx&xxxx;XXX, xxxxxxx xxxxxxxxx počtu xxxxxx xxxxx xxxxx x&xxxx;xxxxxxxxx a účinku x&xxxx;xxxxxxxxxxx xxxxxxxxxxxxxxx posouzení xxxxxx xx xxxxxxx xxxxxxxx x&xxxx;xxxxxx xx xxxxxxxxx xxxxxx životního xxxxxxxxx. Xx-xx poměr XXX x&xxxx;XXXX xxxxx xxx xxxxx (1), xxxx xxxxx xxxxx posouzení, xxxxx xx xxxxxxxxx xxxxxxxxxxxx.
Xxxxx xxxxx PEC/PNEC xxxxxxxxxx xxxxxxxxxxxx riziko (xxxxx &xx; 1), xxxxxxx xxxxxxxx x&xxxx;xxxx&xxxx;XXX, xxx xxxxxxxx xxxxxxxxx xxxxxx xxx životní xxxxxxxxx.
3.4.2.1&xxxx;&xxxx;&xxxx;Xxxx&xxxx;XXX
Xxxxx složek xxxxxxxxx xxxxxxxxx xxxxxxxxxxxx ve xxxx&xxxx;X&xxxx;xx xxxxx vypočítat XXX xxx povrchovou xxxx s přihlédnutím x&xxxx;xxxxxx x&xxxx;xxxxxxx.
Xx základě xxxxx xxxxxxxxxxxxxx xx fázi I lze xxxxxxxxx přesnější PEC xxx xxxxxx xxxxxxxxxx xxxxxx životního xxxxxxxxx. Xxx určování xxxxxxxxx XXX xx nutno xxxx x&xxxx;xxxxx:
|
x) |
xxxxxxxxxxx sledované xxxxxx látky (xxxxx) / xxxxxxxxxx x&xxxx;xxxxx/xxxxxxxx xxx xxxxxxxx po xxxxxx xxxxxxxxx dávky xxxxxxxx v navrhované dávce. Xxxxx xxxxxxx musí xxxx x&xxxx;xxxxx xxxx xxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxx; |
|
x) |
xxxxxxxxxxx xxxxxxxxxxxxxx vyloučené xxxxxxxxx xxxxxx xxxxx (xxxxx) / xxxxxxxxxx xxxxx xxxxxxxxx xxxxxxxx a uložení xxxxx xxxx xxxx xxxxxxxxxx xx xxxx; |
|
x) |
xxxxxxxx xxxxxxxxx xxxxxx xxxxx (xxxxx) / metabolitů xx xxxx xxxx xxxxxxxx x&xxxx;xxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxx, xxxxx xxxxx xx xxxxxxx studií xxxx/xxxxxxxxx (XXXX 106); |
|
x) |
xxxxxxxxxxxxxx x&xxxx;xxxx x&xxxx;xxxxxxx xxxxxxxxx/xxxxxxxxx xxxxxxxxx (OECD 307 xxxx. 308) x |
|
x) |
xxxx xxxxxxx, xxxx xxxxxxxxx xxxxxxxxx, xxxxxxxx, xxxxxxxxxx, xxxxxxxxx xxx xxxx. |
Xxx xxxxx posuzování xxxxxx xx xxxx&xxxx;XX xx xxxxxxx xxxxxxxx xxxxxxx XXX získaná z těchto xxxxxxx xxx každou xxxxxxxxxx xxxxxx životního xxxxxxxxx.
Xxxxx xx xxxxxxxxxxx xxxxxxx přetrvávání x&xxxx;xxxx/xxxxxxxxx (xxxx xx xxxxxxxxx 90&xxxx;% původní koncentrace xxxxx: XX90 &xx; 1&xxxx;xxx), xxxxxxx se xxxxxxxxx x&xxxx;xxxxxxxxx.
Xxxxxxx xx xxxxxxxxxxx xxxxxxxxxxx xxxxx (xxxx xxxxxxxxxx) vyvolávajících xxxxxxx nežádoucí xxxxxx xxx různé xxxxxxxx xxxxxxx x&xxxx;xxxx xxxxxx xxxxxxxxx xxxxxxxxx. Xxxx xxxxx xxxx xxxxxxxx xxxxxx xxxxx a měly xx xxxxxxxxx xxxxxx XXXX xxxx obdobné xxxxx xxxxxxxx xxxxxx. Xxxxxx pro xxxxxxxxxxx xxxxxxxxx xxxxxxxx: xxxxxxxx xxx xxxxxxxx; xxx xxxxxxxxxxx rostliny a půdní xxxxxxxxxxxxxx (xxxx. účinky xx xxxxx xxxxxx). Xxxxxx xxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx: toxicitu xxx xxxx; Xxxxxxx xxxxx; xxxx x&xxxx;xxxxxxxxxxxx xxxxxxxxx. X&xxxx;xxxxxxx xxxxx x&xxxx;xxxx se xxxxxxx xxx xxxxx xxxxxxx xxxxxx xxxxxxxxxxxxxx xxxxxxxxx.
Xxxxxxx xx xxxxxxx xxxxxxx XXXX pro xxxxxx xxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxx. PNEC je xxxxxxx odvozena z nejnižší xxxxxxx xxxxxxxx xxxxxxxxxxx xx xxxx uvedených xxxxxxx a vydělí xx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx 100, x&xxxx;xxxxxxxxxx xx xxxxxxxxx x&xxxx;xxxxx užitých xxxxxxxxxxx druhů.
Potenciál x&xxxx;xxxxxxxxxxxx xxx xxxxxxxxx z hodnoty xxxxxxxxxxxxx xxxxxxxxxxx n-oktanol/voda, Xxx Xxx. Xxxxxxx ≥ 3 udávají, xx x&xxxx;xxxxx xxxx xxxxxxxx x&xxxx;xxxxxxxxxxxx. X&xxxx;xxxxxxxxx xxxxxx xxxxxxxxxx otravy xx xxxxxxxx, xxx xx xx fázi IIB xxxxxxx studie biokoncentračního xxxxxxx (XXX).
3.4.2.2&xxxx;&xxxx;&xxxx;Xxxx&xxxx;XXX (xxxxxxxxxxx xxxxxxxxxxxxxxxx xxxxxx)
X&xxxx;xxxxxxxxxxx látek, x&xxxx;xxxxx po posouzení xx xxxx&xxxx;XXX nelze xxxxxxxx xxxxxx xxx xxxxxxx prostředí, jsou xxxxx podrobnější xxxxxxxxx x&xxxx;xxxxxxxx xx biologické xxxxx x&xxxx;xxxx xxxxxx (xxxxxxxx) xxxxxxxxx xxxxxxxxx, x&xxxx;xxxxxxx xxxxxx xx xxxx&xxxx;XXX xxxxxxxxx možné xxxxxxxx. V tomto xxxxxxx xx požadují xxxxx xxxxx, kterými xx xx xxxxxxxx xxxxxxxxxxxxx, xxxxxxxxxxx x&xxxx;xxxxxxxxxxx druzích xxxx xxxxxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxx. Xxxx xxxxxxxxx xxxxxxxxx xxxxxx xxxxxxx xxxxxxx bezpečnostního xxxxxxx.
Xxxxxx xxxxxxxxx testy xx xxxxxxxxxxx xxxx xxxxxxx x&xxxx;xxxx xxxxxxxxx, xxxx. x&xxxx;xxxxxxxx XXXX. Xxxxxxxx xx xxxxxxx xxxxx xxxxxx xxxxx, xxx xxxx xxxxxxxxx, xx xxxx vhodné xxx xxxxxxx, x&xxxx;xxx může xxx xxxxxxxxx látka x/xxxx xxxx xxxxxxxxxx xxxxxxxx a rozptýlena do xxxxxxxxx. Zpřesnění xxxxxxxxx xxxxxx xx půdu (XXXXxxxx) xx xxxxx xxx založeno xx xxxxxxxx xxxxxxxxxxx účinků xx xxxxxxxx, xxxxxxxxxxx xxxxxxxx xxxxx xx xxxxx xxxxxxxxxx x&xxxx;xxxx xxxxxxxxxx xxxxxxxxxxx druhů, xxxxxxxx xxxxxxxxxx na xxxxxxxxxx živočichy xx xxxxxxxxxx (xxxxxx xxxxx) x&xxxx;xxxxx xxxxxx xxxxx.
Xxxxxxxxx xxxxxxxxx xxxxxx pro xxxx/xxxxxxxx xxxx xxx xxxxxxxx xx xxxxxxx xxxxxxxxx xxxxxxxx u nejcitlivějších xxxxxxx/xxxxxxxxxx xxxxxxxxx xxxxxxxx xxx posuzování xx xxxx&xxxx;XXX.
X&xxxx;xxxxxxx potřeby xx xxxxxxxx studie xxxxxxxxxxxx xxxxx pokynu OECD 305.
4.&xxxx;&xxxx;&xxxx;XXXXX&xxxx;XX: XXXXXX XXXXXXXX XX XXXXXXXXX XXXXXXXXX XXXXX
Xxxxxx musí prokázat xxxxxxxx x&xxxx;xxxxxxx xxxxxxxxxxxx xxxxx x&xxxx;xxxxxxxx přinejmenším xxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxxx x&xxxx;xx.&xxxx;5 odst. 3 xxxxxxxx (XX) x.&xxxx;1831/2003, xxxxx xxxxxxxxx x&xxxx;xxxxxxxxx skupin xxxxxxxxxxx xxxxx xxxxxxxxxxx x&xxxx;xxxxxx&xxxx;6 x&xxxx;xxxxxxx&xxxx;X&xxxx;xxxxxxxxx nařízení. Xxxx studie xxxx xxxxxx xxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxxxx běžné zemědělské xxxxx x&xxxx;XX.
Xxxxxxx experimentální xxxxxx xxxx být xxxxxxxxxx xxxxx xxxxx xxxxxxxxx xxxxx, druhu x&xxxx;xxxxxxxxx xxxxxx. Xxxxx xx xxxxxxxxx xxxxxxx, xxxxxx musí xxx xxxxxxxxx xxx, xxx xxxxxx zdraví a podmínky xxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxx. X&xxxx;xxxxxxx xxxxxx xx xxxxx xxxxxx xxxxxxxx x&xxxx;xxxxxxxxxx xxxxxx, x&xxxx;xx xxx x&xxxx;xxxxxx xxxxxxxxxxxxx, tak x&xxxx;xxxxxxxxxx. Xx xxxxx xxxxxxxx xxxxxx neexistenci xxxxxx, xxxxx xxxxxxx xxxxxxxxxx vlastnosti xxxxxxxxxxx xxxxxxxx. X&xxxx;xxxxxxxx případě xxxxxxx xxxxxxxx kritériím xxxxxxxxxx xxxxxxx, xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxx. Pokud xxxxxxxx xxxxxx xxxxxxxxxx, xx xxxxx xxxxxxxxx důkazy, xxxxx xxxxxxxxx, xx xxxxx xxxx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxx, xxxxx xx xxxxxxxxx jmenovanému xxxxxxxxx xxxxxx, xx xxxxxxx xxxxxxxx xxxxxxxx x&xxxx;xxxxxxxx.
Xxxxxxxx protokol xxxx xxxxxxx xxxxxxxxxx xxxxxxx xxxxxx x&xxxx;xxxxxxx na xxxxxx xxxxxxx xxxxx, xxxx. xxxxxx, xxxxxxx xxxxxxxxx x&xxxx;xxxxxxxx, xxxxx x&xxxx;xxxxx, xxxxxxx xxxx xxxxx xxxxxx, xxxxxx xxxxx x&xxxx;xxxxxxxxxx, xx xxxxx xxxx ustájena x&xxxx;xxxxxx. X&xxxx;xxxxx studií xxxxxxxxxxxx xxxxxxx xx xxxxx popsat xxxxxxxx xxxxxxxx podle xxxx&xxxx;3.1.1.3. Xxxxxxxxx zprávy, prvotní xxxx, xxxxx studie x&xxxx;xxxxxx charakterizované x&xxxx;xxxxxxxxxxxxxx xxxxxxxxx látky xxxx xxxxxxxxxxx pro xxxxxxx xxxxxxx.
Xxxxxx xxxx být xxxxxxxx tak, aby xxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx dávky doplňkové xxxxx xxxxxxxxx se xx xxxxxxx parametry x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxxx a volitelně x&xxxx;xxxxxxxxx kontrolní skupinou. Xxxx xxxxxx xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxxxx xxxxx, xxxxxxx se xxxxxxxx. Xxxxxxxxxxxx se xxxxx xxxxxxxx xxxxxx, xxxxxx míra xxxxxxx xx xxxxxxxxx xxx xxxxxxx xxxxx xx xxxxxx x&xxxx;xxxxxxxxx xxxxxx.
Xxxxxxxxx xx xxxxx věnovat xxxxxx xxxxxx xxxx xxxxxxxxxxxx xxxxxxxxxxx xxxx xxxxxxxxx interakcím xxxx xxxxxxxxxx látkou, xxxxxx xxxxxxxxxxx xxxxxxx x/xxxx xxxxxxxxxxxxx xxxxxx a/nebo xxxxxxxx xxxxx xxxxx, xxxxx xx xx xxxxxxxx xxx účinnost xxxxxxx doplňkové xxxxx (xxxxxxxxx snášenlivost xxxxxxxxxxx xxxxxxxxx xxxxx s kokcidiostatiky x&xxxx;xxxxxxxxxxxxxxxx xxxx organickou xxxxxxxxx).
4.1&xxxx;&xxxx;&xxxx;Xxxxxx xx xxxxx
X&xxxx;xxxxx xxxxxxxxxxxxxxx a některých senzorických xxxxxxxxxxx látek, xxxxx xxxxxxxxx vlastnosti krmiva, xx xxxxx účinnost xxxxxxxx xxxxxx xxxxxxxxxxx xxxxxx. Xxxxxx musí xxx xxxxxxxx xxx, xxx xxxxxxxxxx reprezentativní xxxxxx xxxxxxxxx, x&xxxx;xxxxx xx xxxxxxxxx xxxxx xxxx aplikovat. Xxxxxxxx xx xxxxxxxxx pokud xxxxx xxxxx bez xxxxxxxxx x&xxxx;xxxx xxxxxxxx xxxxxxxxx xxxxx s pravděpodobností X&xxxx;≤ 0,05.
X&xxxx;xxxxxxxxx xxxxx xxxxxxxxxxx látek je xxxxx xxxxxx x&xxxx;xxxxxxxx xxxxxxxxx xxxxxx xx xxxxx, zejména studie, xxxxx simulují xxxxxxx xxxxxxxxxxxxxxxxxxxx xxxxxx. Xxxx xxxxxx by xxxx xxxxxxx statistické xxxxxxxxxxx.
4.2&xxxx;&xxxx;&xxxx;Xxxxxxxxxx xxxxxx xxxxxxxxx se xxxxxxx
Xx xxxxx xxxxxx xxxxxx xxxxxxxxxx dostupnosti x&xxxx;xxxxxxxxx, xxxxxxx xxxx xxxxx xxxx zdroj xxxxxx xxxx xxxxxxx xxxx xxx xxxxxxxx xx xxxxxxxxxxx doplňkovou xxxxx, xxxxx již xxxx schválena xxxx xxxxxxxx.
Xxxxxx xxxxxxxx xxxxxxxxxxxxxx xxx xxxxxx xx xxxxxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxx x&xxxx;xxxxxxxx mechanismu xxxxxxxx. X&xxxx;xxxxxxxxx xxxxxxxxx, xxxxxxx xx xxxxxx x&xxxx;xxxxxxxx xxx životní xxxxxxxxx, xx xxxxx xxxxxxxx xxxxxxxx lépe xxxxxxxxxx xxxxxxxx x&xxxx;xx xxxxx xxx použity xxxxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxx účinnosti. Při xxxxxx xxxxxxxx xx xxxxxxx xxxxx x&xxxx;xxxxx/xxxxxxxxx xxxxxx odpovídající navrhovaným xxxxxxxxx pro užití.
Popřípadě xx možno xxxxxxxxx xxxx xxxxxxxxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxx a ty xxxxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxx, xx-xx xx xxxx xxxxxxxxxx.
4.3&xxxx;&xxxx;&xxxx;Xxxxxxxxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxx
Xxxxxxx by xxxx xxx xxxxxxxxx xxxxxxx xx dvou různých xxxxxxx.
Xxxxxxx xxxxxxxxxxxxxx xxxxxx xxxx xxxxxxxxx xxxxx x&xxxx;xxxxxxxxxxxx statistické xxxxxxxxxxx x&xxxx;xxxxxx xxxx&xxxx;1 x&xxxx;2. Xxxxxxxx xxxx xxx xxxxxxxxxx xxxxxxx, xxx xxxxxxx xxxxxx doplňkové xxxxx xxx xxxxxxxx xxxxxxxxxx xxxxx (riziko xxxx 1-α, P ≤ 0,05 xxxxxx x&xxxx;X&xxxx;≤ 0,1 xxx xxxxxxxxxxx, xxxxxxxxx xxxxx, zvířata x&xxxx;xxxxxxxx xxxxx a zvířata, xxxxx xxxxxx xxxxxx k produkci xxxxxxxx) x&xxxx;xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxx, xxx xxxx xxxxxxxx, xx experimentální xxxxxxxx xxxxxxx xxx xxxxxx. Riziko xxxx 2-β&xxxx;xxxx xxx nižší xxxx rovno 20&xxxx;% xxxxxx a 25 % u pokusů x&xxxx;xxxxxxxxxxx, xxxxxxxxxxx druhy, xxxxxxx v zájmovém chovu x&xxxx;xxxxxxx, xxxxx nejsou xxxxxx x&xxxx;xxxxxxxx xxxxxxxx; xxxxxxxxxx (1-β)&xxxx;xx tedy xxxxx xxxx xxxxx 80&xxxx;% (75 % x&xxxx;xxxxxxxxxxx, xxxxxxxxxxx xxxxx, xxxxxx x&xxxx;xxxxxxxx xxxxx x&xxxx;xxxxxx, xxxxx xxxxxx určena x&xxxx;xxxxxxxx potravin).
Uznává se, xx xxxxxxxx k povaze xxxxxxxxx xxxxxxxxxxx xxxxx xx xxxxxxx stanovit xxxxxxxx xxxxxxxx, xx xxxxx lze dosáhnout xxxxxxxxxxx xxxxxxxx. Xx xxxxx xxxxx zvážit xxxxxxx použití xxxxxxxxxxx, xx-xx xxxxx dostupných xxxxxxx vyšší než xxx. X&xxxx;xxxxxx xxxxxx xx xxx všechny xxxxxxx xxxx být xxxxxxx xxxxxxx xxxxx xxxxxxxxx, aby xxx xxxxx mohly xxx xxxxxxx z hlediska jejich xxxxxxxxxxxxx x&xxxx;xxxxxxxxxx (xxxxx xx xxxxx xxxxxxxx) xx xxxxxx statistického xxxxxxxxx x&xxxx;xxxxxxxx P ≤ 0,05.
4.4&xxxx;&xxxx;&xxxx;Xxxx trvání xxxxxxxxxxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxxxx xxxxxxx
Xxxx xxxxxx xxxxxxx xxxxxxxxx obvykle xxxxxxxx xxxxxxx xxxx xxxxxxxxx.
Xxxxxx xxxxxxxxx se xxxxxxxxx xxxxx xxxxxxxxxx praxe x&xxxx;Xxxxxxxx xxxx x&xxxx;xxxxxxxxx xxxx xxxxxx xx xxxxxxx v příloze IV.
Pokud xx xxxxxxxxx látka xxxxxxx xx specifickou x&xxxx;xxxxxx xxxx, xxx je xxxx xxxxxxxx xxxxxxxxx xxxxxx, xxxx xxx xxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxx xxx xxxxx. Xxxx xxxxxxxxxx však xxxxx xxx xxxxxx xxx 28&xxxx;xxx x&xxxx;xxxx xxxxxxxxx všechny xxxxxxxx xxxxxxxxx (xxxx. u prasnic x&xxxx;xxxxxxxxxx xxxxx xxxxx xxxxxxxxxx živě xx xxxxxxxx na xxxx xxxxxxxx, xxxx xxxxx x&xxxx;xxxxxxxx odstavených xxxxx xx xxxxxxxx xx xxxx laktace).
U ostatních xxxxx xxxx xxxxxxxxx xxxxxx, xxx xxx xxxxxx x&xxxx;xxxxxxx&xxxx;XX xxxxxxxxx minimální xxxx xxxxxx xxxxxx, xx vezme x&xxxx;xxxxx xxxxxx podávání xxxxx xxxxxxxxxxxx xxxxxxxx xxx xxxxx.
4.5&xxxx;&xxxx;&xxxx;Xxxxxxxxx na xxxxxxxx xxx xxxxxxxxx x&xxxx;xxxxxxx xxxxxxx xxxxxxxxxxx xxxxx
Xxx xxxxxxx doplňkové xxxxx, xxxxx xxxx mít xxxxxx xx xxxxxxx, xx požadují xxxxxx xx xxxx.
Xxx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxxx xxxxx x&xxxx;xxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxx xxx xxxxxxxx xxxxxxxxx xxxxxxx třemi dlouhodobými xxxxxxxx xxxxxxxxx. X&xxxx;xxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxxx látek x&xxxx;xxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxx, xxxxx xxxx xxxxxx xx zvířata, xx xxxxx xxxxx xxxxxxxxxx xxxxxx xxxxxxxxx, xxxxx xxx xxxxxxxx xxxxxxxxxxx xxxxxxxx.
Xxx ostatní xxxxxxxxx doplňkových látek xxx přímého xxxxxx xx xxxxxxx se xxxxxxxx xxxxxxx xxxxx xxxxxx xxxxxxxxx in xxxxx.
4.6&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxx živočišných xxxxxxxx, xxxxxxxx xx není xxxxxxx účinek
S cílem xxxxxxxx, xx xxxxxxxxx látka xxxx xxxxxxxxxx či xxxx xxxxxxxxx účinek xx xxxxxxxxxxxxxx a nutriční (xxxxxxxxx xxxxxxxxxx a technologické) xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxx, jež xxxx xxxxxx xxxxxxxxxx xxxxxx (xxxxx xx xxxx xxxxxxx účinek), xx xxxxx xxxxx xx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxxx vzorky. Xxxx pozorovány xxx xxxxxxx: xxxxxxx, xxx xxxxx není xxxxxxxx, x&xxxx;xxxxxxx x&xxxx;xxxxxxxxx navrhovaným xxxxxxxxxx doplňkové xxxxx. Xxxxx xxxx umožnit xxxxxxxxxxx xxxxxxxxxxx. Xxxxxxxxx xxxxxx studií xxxx xxx xxxxxxxxx xxxxxxxxxx.
5.&xxxx;&xxxx;&xxxx;XXXXX&xxxx;X:&xxxx;XXXX XXXXXXXXXXXX X&xxxx;XXXXXX XX XXXXXXX XXXXX NA XXX
Xxxxx xx.&xxxx;7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) č. 1831/2003 xx xxxxx pro xxxxxxx xxxxxxxxx doplňkových xxxxx xxxxxxxxx návrh xxxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx uvedení látky xx trh x&xxxx;xxxxx xxxxxxxx x&xxxx;xxxxxxxxxxxxx případné xxxxx xxxx xxxxxxx, xxxxxxxx, opožděné nebo xxxxxxxxxxxx xxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxx doplňkové xxxxx xx xxxxxx lidí xxxx zvířat nebo xx xxxxxxx xxxxxxxxx x&xxxx;xxxxxxx s vlastnostmi dotyčných xxxxxxxx.
Xxxxx plánu xxxxxxxxxxxx xxxx xxx xxxxxxxx xxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxx a musí xxxxxxx, xxx (xxxx. xxxxxxx, xxxxxxxxx) vykonává jednotlivé xxxxx x&xxxx;xxxxx stanovené x&xxxx;xxx odpovídá za xxxxxxxx a řádné xxxxxxxxx xxxxx, x&xxxx;xxxx xxxxxxxx xxxxxx xxxxxxxxxxx příslušných xxxxxx x&xxxx;xxxxxxxxx xxxxxx xxxxxxxxxxxxx, které xxxxxxxxx x&xxxx;xxxxxxxxxxx užívání xxxx xxxxxxxxx xxxxx. Xxxxxx x&xxxx;xxxx je xxxxx xxxxxxxxxx x&xxxx;xxxxxxxxxx zaznamenaných xxxxxxxxxxxx xxxxxxxx, xxxx xxxx xxxxxxx xxxxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxxx x&xxxx;xxxxxx&xxxx;12 xxxxxxxx (XX) x.&xxxx;1831/2003.
Xx-xx xxxxxx látka rovněž xxxxxxx xxxxxxxxxxxx x&xxxx;xxxx-xx xxxxxxxxx, že xxx xxxxx xxxxxxxxx x&xxxx;xxxxxxxx, xx xxxxxx je xxxxx v krmivu, dochází x&xxxx;xxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxxx xxxxx, provedou xx xxxx xxxxxxx monitorování x&xxxx;xxxxxx xx xxxxxxx xxxxx xx xxx xxxxxxx xxxxxx xx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxx xxxxxxxxx látce.
U kokcidiostatik x&xxxx;xxxxxxxxxxxxxxx xx provede xxxxxxx xxxxxxxxxxxx rezistence Xxxxxxx spp. x&xxxx;Xxxxxxxxxx xxxxxxxxxxx, pokud možno xxxxx xxxxx xxxxx xxxx xxxxxxxx.
(1)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;50, 20.2.2004, s. 44.
(2) Úř. věst. X&xxxx;196, 16.8.1967, x.&xxxx;1. Směrnice xxxxxxxxx xxxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx 2006/121/XX (Úř. věst. L 196, 16.8.1967, s. 1; xxxxxxxx x&xxxx;Xx.&xxxx;xxxx. X&xxxx;196, 16.8.1967, x.&xxxx;1).
(3)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;152, 30.4.2004, x.&xxxx;1.
(4)&xxxx;&xxxx;Xx.&xxxx;xxxx. L 165, 30.4.2004, x.&xxxx;1.
(5)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;117, 8.5.1990, x.&xxxx;1. Xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxx Xxxxxx 2005/174/XX (Xx.&xxxx;xxxx. X&xxxx;117, 8.5.1990, x.&xxxx;1)
(6)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;76, 22.3.1991, x.&xxxx;35. Směrnice xxxxxxxxx xxxxxxxxx směrnicí 2001/58/XX (Úř. věst. L 76, 22.3.1991, x.&xxxx;35).
(7)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;262, 17.10.2000, s. 21.
(8) Úř. věst. L 224, 18.8.1990, x.&xxxx;1. Xxxxxxxx xxxxxxxxx pozměněné nařízením Xxxxxx (ES) x.&xxxx;203/2008 (Xx.&xxxx;xxxx. X&xxxx;224, 18.8.1990, x.&xxxx;1).
(9)&xxxx;&xxxx;X.&xxxx;Xxxxxxxx et xx.: Xxxxxxxxxx Xxxxxxxxxx For Xxxxxx Xxxxxxxxxx Xxxxxxxxxx Xx Xxxxxxx Of Xxxxxxxx (XXXXX Xxxxxxxxx Xxxxxx) Xxxx Xxxx. Xxxx., sv. 74, x.&xxxx;5, x.&xxxx;835–855, 2002.
(10) Úř. věst. X&xxxx;221, 17.8.2002, x.&xxxx;8. Xxxxxxxxxx xxxxxxxxx pozměněné xxxxxxxxxxx 2004/25/XX (Xx.&xxxx;xxxx. X&xxxx;221, 17.8.2002, s. 8).
(11) Nevyčerpávající xxxxxx xx x&xxxx;xxxxxxxxx xxxxxx: xxx.xxxx.xxxxxx.xx/xx/xxxxxxx/xxxxxx/xxxxxx_xxxxxxx/993.xxxx.
(12)&xxxx;&xxxx;Xxxxx x&xxxx;xxxx x&xxxx;xxxxxxxxxxx xxxxxxxx.
(13)&xxxx;&xxxx;X&xxxx;xxxxxx 50&xxxx;x&xxxx;xxxx x&xxxx;xxxx x&xxxx;xxxxxxxxxxx xxxxxxxx.
(14)&xxxx;&xxxx;Xxx a kůže x&xxxx;xxxxxxxxxxx xxxxxxxx.
(15)&xxxx;&xxxx;X&xxxx;xxxxxxxxxxxx k navrhované xxxxxxxx xxxxx.
(16)&xxxx;&xxxx;X&xxxx;xxxxxxxx xxxxxxx xxxxxxxxx xx xxxxxxx xxxxxxxx xxxx XXX.
(17)&xxxx;&xxxx;Xxxxxxxxx x&xxxx;xxxxxx XXX.
XXXXXXX&xxxx;XXX
XXXXXXXX XXXXXXXXX, XXX XXXX SPLŇOVAT XXXXXXXXXXX XXXXXXXXX X&xxxx;XXXXXX&xxxx;3, XXXXX XXX O NĚKTERÉ XXXXXXXXX XXXXXXXXXXX LÁTEK XXXX XXXXXXX XXXXXXXX SITUACE, XXX XX STANOVENO X&xxxx;XX.&xxxx;7 ODST. 5 XXXXXXXX (XX) X.&xxxx;1831/2003
Xxxxxxxx (ES) x.&xxxx;1831/2003 xxxxxxxxxxx xxxxxxxxxx xxxxx při vypracování xxxxxxxxxxx (je-li xx xxxxx) xxx xxxxxx xxxxxxxxx xxxxxxxxxxx xxxxx xxxx xx xxxxx xxxxxxxxx účelem xxxxx xx.&xxxx;7 odst. 5 nařízení (XX) č. 1831/2003.
Seznam xxxxxxxxxx xxxxxxxxx xx vypracování xxxxxxxxxxx pro:
|
1. |
technologické xxxxxxxxx xxxxx |
|
2. |
xxxxxxxxxx xxxxxxxxx xxxxx |
|
3. |
xxxxxxxx xxxxxxxxx xxxxx |
|
4. |
xxxxxxxxxxxx xxxxxxxxx xxxxx |
|
5. |
xxxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxxx |
|
6. |
xxxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxx na xxxxx xxxxxxxxx |
|
7. |
xxxxxxx x&xxxx;xxxxxxxx chovu x&xxxx;xxxx zvířata, která xxxxxx xxxxxx x&xxxx;xxxxxxxx xxxxxxxx |
|
8. |
xxxxxxxxx xxxxx, xxxxx xxx xxxx xxxxxxxx xxx použití x&xxxx;xxxxxxxxxxx |
|
9. |
xxxxx xxxxxxxx |
|
10. |
xxxxxxxx xxxxxxxx |
|
11. |
xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx látek, které xxx xxxx povoleny xxxxx směrnice 70/524/EHS. |
Žádosti xx xxxxx předložit xx základě více xxx xxxxxxx x&xxxx;xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx.
Xxxxxx xxxxxxxx
Xxxxx-xx v dokumentaci xxxxxxx x&xxxx;xxxxx xxxxxxxxxxxx x&xxxx;xxxxxx xxxxxxxx, je xxxxx xxxxx xxxxxx.
1.&xxxx;&xxxx;&xxxx;XXXXXXXXXXXXX XXXXXXXXX XXXXX
1.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx se xxxx xxxxx&xxxx;X&xxxx;xxxxxxx&xxxx;XX.
1.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxxxx, xxxxxxxxxxxxxxx a podmínky pro xxxxx xxxxxxxxx látky; xxxxxx xxxxxxx
Xxxxx&xxxx;XX xxxxxxx&xxxx;XX xx použije xxxxx:
|
— |
xxx xxxxxxxxx látky, xxxxx xxxxxx xxxxxx na xxxxxxxx xxxxxxxx, se xxxxxxx xxxx&xxxx;2.1.2, 2.1.3, 2.1.4, 2.1.4.2, 2.2, 2.3.1, 2.3.2, 2.4.1, 2.4.2, 2.4.4, 2.5, 2.6, |
|
— |
xxx jiné xxxxxxxxx xxxxx, xxxxx jsou xxxxxx na držitele xxxxxxxx, xx použije xxxx xxxxx&xxxx;XX. |
1.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Studie xxxxxxxx se xxxxxxxxxxx xxxxxxxxxxx xxxxx
Xxxx&xxxx;3.1, 3.2 x&xxxx;3.4 xxxxxxx&xxxx;XX xx xxxxxxxxxx xx xxxxxxxxx xxxxx x&xxxx;xxxxxxxxxx, xxxxx xxx xxxxxxxx, xx:
|
— |
x&xxxx;xxxxxxx xxxxxx nepřetrvávají zjistitelná xxxxxxxx xxxxxx xxxxx (xxxxx) xxxx důležitých xxxxxxxxxx xxxx xxxxxxxx xxxxxxx (xxxxxxx) xxxx |
|
— |
xxxxxx xxxxx(x)&xxxx;x&xxxx;xxxxxxx(x)&xxxx;xx vyskytují xxxx xxxxx složky xxxxxx x&xxxx;xxxxx xxxxxxxxxxx xxxxx xxxxxxxxx významně xxxxxx xxxxxxxxxxx v porovnání xx xxxxxx připravenou xxx xxxxx xxxxxxxxx xxxxx (xxxx. xxxxx xxxxxxxxxx xxxxx podstatná změna xxxxxxxx). |
X&xxxx;xxxxxxxxx případech se xxxxxxx xxxx xxxxx&xxxx;3 xxxxxxx&xxxx;XX.
1.3.1&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx doplňkové xxxxx xxx xxxxxx xxxxxxx
X&xxxx;xxxxxxxxxx&xxxx;(1) látek: xxxxxxx xx xxxx xxx&xxxx;3.1 xxxxxxx&xxxx;XX.
1.3.1.1&xxxx;&xxxx;&xxxx;Xxxxxx tolerance u cílových xxxxx
Xxx xxxxxxxxx xxxxx x&xxxx;xxxxxxxxxx:
|
— |
xxxxxxx xx přidá xx xxxxxxxx xxxxx xxxxx x&xxxx;xxxxxxxx xx xxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxx xxxxxxxx xx xxxxxxx xxxxxx xxxxxx. Základní xxxxx dávka xxxx xxxxxxxxx xxxxxx zdroj xxxxxx xxxxxxxxxx bez xxxxxxx xxxxxxxxx xxxxx; |
|
— |
xxxxx xxxxxxx xxx studie xxxxxxxxx xx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxx se x&xxxx;xxxxxx x&xxxx;xxxx xxxxxxxxxx xxxxxxxxx, xxxxx xx xxx xxxxxxxxxxx xxxxxxx. Xxxxxxxx pozornost se xxxxxx produktu, který xxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxxxx, x&xxxx;xxxxxxxxxx xxxxxx xxxxxxxxx xxxxxx x&xxxx;xxxxxx xx xxxxx silážování. |
Studie tolerance xxx xxxxxxx xxxxxx xx xxxxx přežvýkavců, xxxxxxxxx dojnice. Studie xxxxxxxxxx xxxx xxxxx xxxx nutné pouze x&xxxx;xxxxxxx, je-li siláž xxxxxxxx xx své xxxxxx xxxxxxxxx k použití xxx xxxx druhy xxx xxxxxxxxxxx.
Xxxxxxx látky:
U ostatních xxxxx, xxx něž xx xxxxxxxx xxxxxxxx xxxx technologické doplňkové xxxxx x&xxxx;xxxxx xxxxxx xxxxxxxx xxx xxxxxxx xxxx xxxxxx, xx xxxxx xxxxxxxx, že xxx zvířata nejsou xxxxxxxx xxx nejvyšším xxxxxxxxxxx xxxxxx. Xxxx xxxxxxxxx xxxx xxx xxxxxxx xx xxxxx xxxxx x&xxxx;xxxxxxx z nejcitlivějších xxxxxxxx druhů nebo x&xxxx;xxxxxxx xxxxx xxxxxxxxxxxxx xxxxxx.
1.3.1.2&xxxx;&xxxx;&xxxx;Xxxxxxxxxxx xxxxx
Xxxxxxx xx xxxx xxx&xxxx;3.1.2 xxxxxxx&xxxx;XX.
1.3.2&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx doplňkové látky xxx spotřebitele
|
1.3.2.1 |
Studie xxxxxxxxxxx x&xxxx;xxxxxxx Xxxxxx metabolismu x&xxxx;xxxxxxx xx nepožadují, xxxxx:
Xxxxxx xxxxxxxxxxx xx xxxxxxxxxx rovněž x&xxxx;xxxxxxx, xxxxx xx xxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxx xxxx xxxxxxxx přirozeně xx xxxxxxx xxxxxxxx xxxx xx běžnou xxxxxxx tělních xxxxxxx xxxx tkání. X&xxxx;xxxxxx xxxxxxxxx se však xxxxxxxx xxxxxx xxxxxxx, xxxxx xxxxx xxx xxxxxxx xx xxxxxxxx xxxxxx x&xxxx;xxxxxxx/xxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxx x&xxxx;xx xxxxxxx, xxx xxxx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxx. |
|
1.3.2.2 |
Xxxxxxxxxxxxx xxxxxx Xxxxxxxxxxxxx xxxxxx xx xxxxxxxxxx, pokud:
Xxx xxxxxxxxxxxxxx a enzymy, xxxxx xxxxxx xxxxxx xxxx, xx xxxxxxxx xxxxxx xxxxxxxxxxxx (xxxxxx xxxxxxxxxx) x&xxxx;xxxxxx xxxxxxxxxxxx orální xxxxxxxx. Xxxxxx genotoxicity xx xxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxx xxxxx. Xxx cizorodé látky, xxx nejsou xxxxxx xxxx, xx použije xxxx xxx&xxxx;3.2.2 xxxxxxx&xxxx;XX. Xxx xxxxxxx xxxxx xx xxxxxxxxx xxxxxxxxxxxx podle xxxxxxxxxxxx xxxxxxx s přihlédnutím x&xxxx;xxxxxx a způsobu expozice. |
|
1.3.2.3 |
Posouzení xxxxxxxxxxx pro xxxxxxxxxxxx Xxx xxxxxxxxx xxxxx xxxxxxxxxx xxx xxxxxxx, xxxxx xxxx určena k produkci xxxxxxxx, se xxxxxxx xxxx bod 3.2.3 xxxxxxx&xxxx;XX. |
1.3.3&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxx/xxxxxxxxxx
Xxxxxxx xx xxxx bod 3.3 xxxxxxx&xxxx;XX. Xxxxxxxxx xxxxx xxxxxxxxxx xxxxxx a mikroorganismy se xxxxxxxx za xxxxxxxxxxxxxxx xxxxxxxxx xxxxxxx, xxxxx xxxxxx xxxxxxxxxx přesvědčivé xxxxxx xxxxxxxxxxx opak.
1.3.4 Studie xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx doplňkové látky xxx životní prostředí
Použije xx celý bod 3.4 xxxxxxx&xxxx;XX. U doplňkových xxxxx x&xxxx;xxxxxxxxxx xx posoudí xxxxxx xxxxxxxxx látky xx xxxxxx xxxxxxxxx xxxx ze xxxxxxxxx xxx nebo xxx xxxxx xxxxxxxxxx.
1.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxx xxxxxxxx xx účinnosti xxxxxxxxx látky
Technologické doplňkové xxxxx xxxx zlepšit xxxx xxxxxxxxxxxx xxxxxxxxxx xxxxx, xxxxxxx xxxx xxxxxx žádný xxxxx xxxxxxxxxx účinek xx xxxxxxxxxx výrobu. Xxxxxx x&xxxx;xxxxxxxxx doplňkové xxxxx xxxx xxx poskytnuty xxxxxx xxxxxxxx kritérií xxxxxxxxxxxx x&xxxx;xxxxxxxx přípustných xxxxxxxx xx xxxxxxxx xxxxxxxxxxx xxxxxxxx xxx xxxxx v porovnání x&xxxx;xxxxxxxxxxxxx xxxxxxxxxx xxxxxxx.
Xxxxxxxx xx xxxxxxx xxxxxxxx xx xxxxx x&xxxx;xxxxxxxx xxxxx xxx kontrolu xxxxxxxxxxx xxxxxxxxxxxx. V následující xxxxxxx xxxx xxxxxxx xxxxxx xxxxxxxxx xxx xxxxx xxxxxxx xxxxxxx.
Xxxxxxxxx xxx xxxxxxxxxx technologické doplňkové xxxxx
|
Xxxxxxx xxxxxxx |
Xxxxxxxxx xxx xxxxxxxxx xxxxxxxxx |
||||||||||
|
Xxxxxxxx xxxxxxxxxxxxx xxxxx, xxxxxxx biotických xxxxxxxxx a organismů přispívajících xx xxxxxxxxxxxx. Je xxxxx prokázat udávanou xxxx xxxxxx xxxxxxxxxxxxx xxxxxx. |
||||||||||
|
Xxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxxxx oxidací xxxxxxxx xxxxx/xxxxxx během zpracování x/xxxx xxxxxxxxxx xxxxxx. Xx nutno xxxxxxxx xxxxxxxx dobu xxxxxx xxxxxxxxxx xxxxxx. |
||||||||||
|
Xxxxx/xxxxxxxx xxxxxxxxxx xxxxxx jinak nesmísitelných xxxx špatně smísitelných xxxxxx xxxxxx. |
||||||||||
|
Xxxxxxxxx xxxxxxxxx-xxxxxxxxxx xxxxx xxxxx. |
||||||||||
|
Viskozita xxxxxxx xxxxxxxxx xxxx xxxxx. |
||||||||||
|
Xxxxxxx xxxx xxxxxxx ke xxxxx xxxxxxxxx xxxxxx. |
||||||||||
|
Xxxxxxxxxxx xxxxx xxxx xxxxxxxxx xxx xxxxxxxxx pelet. |
||||||||||
|
Xxxxx x&xxxx;xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx. |
||||||||||
|
Xxxxxxxxx xxxxxxxx xxxxxxx. Xx xxxxx xxxxxxxx xxxxxxxx xxxx xxxxxx xxxxxxxxxxxxxx xxxxxx. |
||||||||||
|
xX x/xxxx xxxxxxxxx xxxxxxxx xxxxx. |
||||||||||
|
|
||||||||||
|
Xxxxxxxxxxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxxxxx. |
Xxxxxxxxx xxxxx x&xxxx;xxxxxxxxxx
Xxxxxxxx xx xxxxxxxx xxxxxxx x&xxxx;xxxxx prokázat požadovaný xxxxxx na xxxxxxx xxxxxx&xxxx;(2). Xxxxxxx se xxxxxxxx x&xxxx;xxxxxx příkladem x&xxxx;xxxxx x&xxxx;xxxx xxxxxxxxx xxxxxxxxx (pokud xxxx xxxxxxxx všechna xxxx xxxxxxxxxxxxxxx krmiva):
|
— |
krmiva, xxxxx xxx snadno xxxxxxxxx: &xx;3&xxxx;% rozpustných xxxxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxx (např. xxxx rostlina kukuřice, xxxxx, sveřep nebo xxxxx xxxxx), |
|
— |
xxxxxx, která xxx silážovat x&xxxx;xxxxxxx xxxxxxxx: 1,5–3,0&xxxx;% rozpustných xxxxxxxxxxx v čerstvém xxxxxxxxx (xxxx. lipnice, xxxxxxxx xxxx zavadlá xxxxxxxx), |
|
— |
xxxxxx, xxxxx xxx xxxxxxxxx xxxxxxx: &xx;&xxxx;1,5&xxxx;% xxxxxxxxxxx xxxxxxxxxxx v čerstvém xxxxxxxxx (xxxx. srha xxxx xxxxxxxxx). |
Xxxx-xx xxxxxxx xxxxxxx xx xxxxx xxxxxxxxx xxxxx xxxxxxx xx xxxxxxx xxxxxx, xxxxx xx výslovně xxxxxxx xxxxxx. Xxxx se xxxxxxxx xxx zkoušky x&xxxx;xxxxxxxxxx xxxxxxxxxxxxxxxx pro xxxx xxxxxxx, pokud xxxxx za xxxxxxx xxxxxxxx různého botanického xxxxxx.
Xxx zvláštní xxxxxx xx xxxxxxxx specifické xxxxxxx.
Xxxx trvání studie xx xxxxxxx 90 dnů xxxx xxxx při xxxxx xxxxxxx (xxxxxxxxxx xxxxxx 15 – 25&xxxx;xX). Použití xxxxxx xxxx xxxxxx musí xxx xxxxxxxxxx.
Xxxxxxx se xxxxxx xxxxxxxx xxxxxx xxxx xxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxx xxxxxxxx:
|
— |
xxxxxx x&xxxx;xxxxxxxxx xxxxxx xxxxxx (upraveno x&xxxx;xxxxxxx xx těkavé xxxxx), |
|
— |
xxxxxx xX, |
|
— |
xxxxxxxxxxx těkavých xxxxxxxx xxxxxxx (xxxx. xxxxxxxx xxxxxx, xxxxxxxx xxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxx) x&xxxx;xxxxxxxx xxxxxx, |
|
— |
xxxxxxxxxxx xxxxxxxx (ethanol), |
|
— |
koncentrace xxxxxx (x/xx xxxxxxxxx xxxxxx) x |
|
— |
xxxxx xxxxxxxxxxx xxxxxxxxxxx xx xxxx. |
Xxxxxxxxx xx uvedou jiné xxxxxxxxxxxxxxx x&xxxx;xxxxxxxx parametry x&xxxx;xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx (xxxx. xxxxx xxxxxxxx schopných xxxxxxxxxx xxxxxx, xxxxxxxx xxxxxxxxxx, xxxxxxxx xxxxxxxx x&xxxx;xxxxxxxxxx xxxxx).
Xxxxxxx xxxxxx v souvislosti xx xxxxxxxx xxxxxxxx xxxxxxxxxxxx silážních xxxx xx posoudí xx xxxxxxx xxxxxxxxx xxxxxx xxxxxxxxx xxxx xxxxxxxxxxx xx celé pokusné xxxxxx x&xxxx;xxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxxxx xx životní xxxxxxxxx (např. xxxxxxxxxxx xxxxxxxxx šťáv xxxx xxxxxxxxxx xxxxxxx kyslíku). Xxxxxxx xxxxxx xxxxxxxxx xxxx je xxxxx xxxxxxxx xxxxx. Kapacita xxxxxxx xxxx xxxx xxx dostatečná, xxx xxxxx xxxxxxx šťávy xxxxxxx xx pomoci xxxxx. Doba xxxxxx xxxxxx xx xxxxxxx 50&xxxx;xxx. Xxxxx se xxxxxxx jiná xxxx, xx xxxxx xx xxxxxxxxx.
Xxxxx xxxxxxx xxxxxxxxx xxxx xxx xxxxxxxxx x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxx xxxxxxxx. Xxxxxx stability xxxx xxxxx xxxxxxx xxxx xxx xx xxxxxxxx vzduchu a doplňková xxxxx dokládá stabilitu xx xxxx nejméně x&xxxx;xxx xxx delší, xxx xx xxxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxxxxxx vzorku. Xxxxxxxxxx xx, xxx xx xxxxx prováděl xxx xxxxxxx xxxxx 20&xxxx;xX x&xxxx;xxx xx xxxxxxx xxxxxxx x&xxxx;3&xxxx;xX xxxx xxxx xxxxxx xxxxxxx xxxxx xxxxxxxxxx xx xxxxxx xxxxxxxxxxx. Xxxxxx teploty xx xxxxx nahradit xxxxxxx xxxxxxxx CO2.
1.5 Oddíl X:&xxxx;Xxxx xxxxxxxxxxxx v období po xxxxxxx látky xx xxx
Xxxxx xxxxx se xxxxxxx podle ustanovení xx.&xxxx;7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003. Xx xxxxxxx, xx xx xxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxx xxxxx xx trh xxxxxxxx xxxxx xxx doplňkové xxxxx, xxxxx jsou xxxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxx xxxx z geneticky xxxxxxxxxxxxxx organismů vyrobeny.
2. SENZORICKÉ XXXXXXXXX XXXXX
2.1&xxxx;&xxxx;&xxxx;Xxxxxxx
2.1.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx xx xxxx xxxxx&xxxx;X&xxxx;xxxxxxx&xxxx;XX.
2.1.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxxxx, xxxxxxxxxxxxxxx x&xxxx;xxxxxxxx xxx xxxxx doplňkové xxxxx; xxxxxx xxxxxxx
Xxxxx&xxxx;XX xxxxxxx&xxxx;XX se použije xxxxx:
|
— |
xxx xxxxxxxxx xxxxx, xxxxx nejsou xxxxxx xx xxxxxxxx povolení, xx xxxxxxx xxxx&xxxx;2.1.2, 2.1.3, 2.1.4, 2.1.4.2, 2.2, 2.3.1, 2.3.2, 2.4.1, 2.4.2, 2.4.4, 2.5, 2.6, |
|
— |
xxx jiné xxxxxxxxx látky, xxxxx xxxx xxxxxx na xxxxxxxx povolení, xx xxxxxxx xxxx oddíl II. |
2.1.3 Oddíl III: Xxxxxx týkající se xxxxxxxxxxx používání xxxxxxxxx xxxxx
Xxx&xxxx;3.3 xxxxxxx&xxxx;XX se xxxxxxxx xxxx na xxxxxxx doplňkové xxxxx.
|
1. |
Xx xxxxx, které při xxxxxxx v krmivu, xxxxxx xxxxx xxxxxxxxxx živočišného xxxxxx, xx vztahuje xxxx oddíl III xxxx&xxxx;3.1, 3.2 a 3.4 přílohy II. |
|
2. |
U látek, xxxxx xxxxxx nebo xxxxxxxxx krmivům barvu, xx xxxxxx xxxxxxxx xx xxxxxx&xxxx;XXX xxxx&xxxx;3.1 xxxxxxxx na zvířatech, xxxxxx byla doplňková xxxxx xxxxxxxx v doporučované xxxxx. Xx xxxxx xxxxxxxxxx xxxxx xxxxxx xxxxxxx na xxxxxxxxxx xxxxxxxx literaturu. Použije xx xxxxx&xxxx;XXX xxxx&xxxx;3.2 x&xxxx;3.4 xxxxxxx&xxxx;XX. |
|
3. |
X&xxxx;xxxxx, xxxxx xxxx pozitivní xxxx xx xxxxxxxx xxxxxxxxx xxx xxxx xxxxx, xx xxxxxxxx xxxxxx xxxxxxxx se xxxxxx&xxxx;XXX xxxx&xxxx;3.1 přílohy II a tyto xxxxxx musí xxx xxxxxxxxx xx xxxxxxxxx, xxxx xxxx xxxxxxxxx xxxxx xxxxxxxx x&xxxx;xxxxxxxxxx xxxxx. Je xxxxx xxxxxxxxxx xxxxx xxxxxx xxxxxxx xx xxxxxxxxxx xxxxxxxx xxxxxxxxxx. Xxxxxxxxxx xx xxxx body 3.2 x&xxxx;3.4. |
2.1.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxx týkající xx xxxxxxxxx xxxxxxxxx xxxxx
Xxxxxxx xx celý xxxxx&xxxx;XX xxxxxxx&xxxx;XX.
|
x) |
Xxx xxxxx, xxxxx xxx xxxxxxx x&xxxx;xxxxxx dávají xxxxx xxxxxxxxxx živočišného původu: změny xxxxx produktů získaných xx xxxxxx, xxxxxx xxxx xxxxxxxxx xxxxx xxxxxxxx za xxxxxxxxxxxx xxxxxxxx xxx užití, xx xxxx xxxxxx xxxxxx xxxxxxxx. Je xxxxx xxxxxxxx, že xxxxxxxxx xxxxxxxxx látky xxxx xxxxxxxxxx xxxx xx stabilitu xxxxxxxx xxxx xxxxxxxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxx xxxxxxxx. Jsou-li xxxxxx konkrétní xxxxx xx xxxxxxx/xxxxxxxxxx živočišných xxxxxxxx dobře zdokumentovány, xxx xxxxx xxxxxxxxxxxx xxxxx x&xxxx;xxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxx (xxxx. xxxxxx xxxxxxxxxx xxxxxxxxxxx). |
|
x) |
Xxx xxxxx, xxxxx xxxxxx xxxx navracejí xxxxxxx xxxxx: xxxxx x&xxxx;xxxxxxxxx je xxxxx xxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxxxxx studií xxxxxxxxxxxxxx x&xxxx;xxxxxxx podmínkám xxx xxxxx x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxxxxx krmivy. |
|
c) |
Pro látky, xxxxx xxxx xxxxxxxxx xxxx na xxxxxxxx xxxxxxxxx xxx nebo xxxxx: xxxxxx xxxxxxxxxxx účinek (xxxxxx) xx xxxxxxxx xx xxxxxxxxx, xxxxxx xxxx xxxxxxxxx xxxxx xxxxxxxx x&xxxx;xxxxxxxxxx xxxx. Xxxxx xxxxx xx xxxx xxxxxx xxxxxx xxxxxxxx. Důkaz o účinnosti xx možno xxxxxxxxxx xxxxxx xxxxxx experimentálními xxxxxxxx (xxxx. xxxxxxxxxx xxxxxxxxxx) nebo xxxxxxx xx xxxxxxxx literaturu. |
2.1.5 Oddíl V: Plán xxxxxxxxxxxx v období xx xxxxxxx látky na xxx
Xxxxx xxxxx xx xxxxxxx xxxxx xxxxxxxxxx xx.&xxxx;7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003. Xx xxxxxxx, xx xx xxxx xxxxxxxxxxxx v období xx xxxxxxx látky xx trh požaduje xxxxx xxx doplňkové xxxxx, xxxxx xxxx xxxxxxxxx xxxxxxxxxxxx organismy xxxx xxxx z geneticky xxxxxxxxxxxxxx organismů xxxxxxxx.
2.2&xxxx;&xxxx;&xxxx;Xxxxxxxxxxx xxxxx
2.2.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx se xxxx xxxxx&xxxx;X&xxxx;xxxxxxx&xxxx;XX.
2.2.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxxxx, xxxxxxxxxxxxxxx x&xxxx;xxxxxxxx pro xxxxx xxxxxxxxx látky; xxxxxx analýzy
V případě skupiny „xxxxxxxx xxxxxxxx“ xx xxxxxxx celé xxxxxxxx, xxxxxxx x&xxxx;xxxx xxxxxxxxx x&xxxx;xxxxxx xxxxx xxxx xxxxxx xxxxxxxx, které xxxx xxxxx xxxx xxxxxxxxxx, jako např. xxxxxxx, mletím nebo xxxxxxx (xxxx. xxxxx xxxxx x&xxxx;xxxxxx), nepovažují xx xxxxxxxx xxxxxxxxx xx funkční skupiny xxxxxxxxxxxxx látek x&xxxx;xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxx látek.
Pro xxxxx xxxxxxxxxxx žádostí xxxxxxxxxx se xxxxxx xxxxxxxx xxxx xxxxxxxxxxx xxxxx klasifikovány xxxxx:
|
1. |
Xxxxxxxx xxxxxxxx:
|
|
2. |
Xxxxxxxx xxxx xxxxxxxxxxxx syntetické chemicky xxxxxxxxxx xxxxxxxxxxx xxxxx |
|
3. |
Xxxxx xxxxx Xx xxxxx xxxxx xxxxxxxxxx xxxxxxx, xx xxx xxxxx xxxxxxx, xxxxx se xxxxxx xxxx. X&xxxx;xxxxxxx xxxxxxxx, xxxxx nespadá xx xxxxx x&xxxx;xxxx xxxxxxxxx xxxxxx, xx toto xxxxx xxxxx x&xxxx;xxxxxxxxx. |
|
2.2.2.1 |
Xxxxxxxxxxxxxxx xxxxxx látky (xxxxx) / xxxxxxx (činidel) Použije xx celý xxx&xxxx;2.2 xxxxxxx&xxxx;XX. Xxxxxx: Xxx xxxxxxx skupiny xxxxxxxxxxxxx xxxxx xx xxxxx uvést vždy xxxxxxxxx identifikační číslo (xxxxx) (např. XXXXXX&xxxx;(3), Xxxx Evropy (4), XXXXX, XXX&xxxx;(5) nebo jiný xxxxxxxxxxx schválený xxxxxx xxxxxxxxx) používané specificky x&xxxx;xxxxxxxxxxxx xxxxxxxxxxxxx produktů x&xxxx;xxxxxxxx x&xxxx;xxxxxxxxxxx, pokud xx x&xxxx;xxxxxxxxx.
|
|
2.2.2.2 |
Xxxxxx xxxxxx Xxxxxxx xx xxxx xxx&xxxx;2.3 přílohy II. V případě xxxxxxxxxx xxxxxxxx, které xxxxxx xxxxxxxx xxxxxx xxxxxxxxxx, xxxxxxx xxxxxxxxx xxxxx xxxxx látek xxxxxxx x&xxxx;xxxxxxx xxxxxxxx, xx nutno uvést xxxxxxxx xxxxx procesu xxxxxxxx. Xxxxxxxxxx se x&xxxx;xxxxxx použít odpovídající xxxxxxxxxxxx, xxxx. xxxxxx, xxxxx, xxxxx, extrakt x&xxxx;xxxxxxxxxxx pojmy (7) xxxxx xxxxxxxxx xxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx produkty x&xxxx;xxxxxx xxxxxxx xxxxxxxx. Xxxxxxx xx xxxxxxx xxxxxxxxx rozpouštědla, přijatá xxxxxxxxxxxx xxxxxxxx, xxx xx zamezilo xxxxxxxx x&xxxx;xxxxxxxxxxxx, x&xxxx;xxxxxx xxxxxxx, xxxxx jsou toxikologicky xxxxxxxx, xxxxxxxx xxxxxx xxxxxxx xxxxx zabránit. Xxxxx xxxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxxxxxx mohou xxxxxxxxx xxxxx na xxxxxx xxxxxxxx. |
|
2.2.2.3 |
Xxxxxx xxxxxxx
Xxxx xxx&xxxx;2.6 přílohy II xx xxxxxxxx na xxxxxxx xxxxxxx zchutňující xxxxx, xxxxxxxxx xxxxxxxx xxxxxxxx, xxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxx, přírodní xxxx odpovídající xxxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxx, xxx jsou xxxxxxxxxxxxx xxxxxxxxxx xxxxxxx, x&xxxx;xxxxx zchutňující xxxxx. |
2.2.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Xxxxxx xxxxxxxx xx xxxxxxxxxxx doplňkové xxxxx
Xxx xxxxxxx xxxxxxxxxxx xxxxx xx nutno xxxxx xxxxxxxx xxxxxx a výpočty xxxxxx xxx z přirozené xxxxxxxx, xxx xx xxxxxxx xxxxxxxxxxx látky xx krmiv.
Na zchutňující xxxxx patřící do xxxxxxx xxxxxxx látek xx xxxxxxxx celý xxxxx&xxxx;XXX xxxxxxx&xxxx;XX.
|
2.2.3.1 |
Xxxxxx xxxxxxxx xx xxxxxxxxxxx používání xxxxxxxxx xxxxx pro xxxxxx xxxxxxx
|
|
2.2.3.2 |
Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxxxxx Xx xxxxx xxxxxxx, že metabolity xxxxxxxxxxx látky xxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxxxxx významných xxxxxxxx pro xxxxxxx xx xxxxxxx. X&xxxx;xxxxxxx, xx xxxxx xxxxxxxxxxxx xxxxxxxxxxxxx produktu v důsledku xxxx přidání xx xxxxx vede k reziduím x&xxxx;xxxxxxxxxxx živočišného xxxxxx, xx xxxxx xxxxxxxxxx xxxxxxxx xxxxxxx expozice xxxxxxxxxxxx.
|
|
2.2.3.3 |
Studie xxxxxxxx se xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxx/xxxxxxxxxx Xxxxxxx xx xxxx xxx&xxxx;3.3 xxxxxxx&xxxx;XX. |
|
2.2.3.4 |
Xxxxxx xxxxxxxx xx bezpečnosti xxxxxxxxx doplňkové látky xxx xxxxxxx prostředí Použije xx celý xxx&xxxx;3.4 xxxxxxx&xxxx;XX. |
2.2.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Studie xxxxxxxx xx xxxxxxxxx doplňkové xxxxx
Xx nutno předložit xxxxxx o vlastnostech xxxxxxxxxxxxx xxxxx, xxxxxxx na xxxxxxx xxxxxxxxxx xxxxxxxxxx. Xx xxxx být xxxxxxxxx rovněž xxxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxx, xxxx-xx x&xxxx;xxxxxxxxx, x&xxxx;xxxxxxx xxxxxxx xxxxx xxx xxxxxxxxxx xxxxxx xx zvířatech.
Je xxxxx plně xxxxxxxx x&xxxx;xxxxx, xxx xxxxxxx, xxxxxxx xx xxxxxx xxxx, xxxx x&xxxx;xxxxxx, xxxxxxx xxxx xxxxxxxxxxx xxxxxxxxxxx původu xxxx xxxxxx kromě xxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxxxx xxxxx x&xxxx;xxxxxxx&xxxx;X&xxxx;xxxxxxxx (XX) č. 1831/2003.
2.2.5 Oddíl V: Plán xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxx látky xx xxx
Xxxxx xxxxx se xxxxxxx xxxxx xxxxxxxxxx xx.&xxxx;7 odst. 3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003. Xx xxxxxxx, že xx xxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxx xxxxx xx trh xxxxxxxx xxxxx xxx xxxxxxxxx xxxxx, xxxxx xxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxx xxxx x&xxxx;xxxxxxxxx xxxxxxxxxxxxxx organismů xxxxxxxx.
3.&xxxx;&xxxx;&xxxx;XXXXXXXX XXXXXXXXX LÁTKY
3.1 Oddíl I: Shrnutí xxxxxxxxxxx
Xxxxxxx xx xxxx xxxxx X&xxxx;xxxxxxx&xxxx;XX.
3.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Identita, xxxxxxxxxxxxxxx x&xxxx;xxxxxxxx xxx užití xxxxxxxxx xxxxx; metody xxxxxxx
Xxxxx&xxxx;XX přílohy II xx xxxxxxx takto:
|
— |
pro doplňkové xxxxx, xxxxx xxxxxx xxxxxx xx držitele xxxxxxxx, xx xxxxxxx xxxx&xxxx;2.1.2, 2.1.3, 2.1.4, 2.1.4.2, 2.2, 2.3.1, 2.3.2, 2.4.1, 2.4.2, 2.4.4, 2.5, 2.6, |
|
— |
xxx xxxx xxxxxxxxx xxxxx, xxxxx xxxx xxxxxx xx xxxxxxxx xxxxxxxx, xx použije xxxx xxxxx&xxxx;XX. |
3.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Xxxxxx týkající xx xxxxxxxxxxx xxxxxxxxxxx xxxxx
3.3.1&xxxx;&xxxx;&xxxx;Xxxxxx týkající se xxxxxxxxxxx používání xxxxxxxxx xxxxx xxx cílové xxxxx
|
3.3.1.1 |
Xxxxxxxxx x&xxxx;xxxxxxxx xxxxx
|
|
3.3.1.2 |
Xxxxxxxxxxx xxxxxx Xxxxxxx xx xxxx xxx&xxxx;3.1.2 xxxxxxx&xxxx;XX. |
3.3.2&xxxx;&xxxx;&xxxx;Xxxxxx týkající xx xxxxxxxxxxx xxxxxxx xxxxxxxxx xxxxx pro xxxxxxxxxxxx
|
3.3.2.1 |
Xxxxxx metabolismu x&xxxx;xxxxxxx Xxxxxx xxxxxxxxxxx xx obvykle xxxxxxxxxx. Pro deriváty xxxxxxxx xx xxxxxxxxx xxxxxxxxxxxx v bachoru. Studie reziduí xxxx ukládání xx xxxxxxxx xxxxx x&xxxx;xxxx xxxxxxxxxxx xxxxx, xxxxx xxxxxxx xx funkční xxxxxxx „xxxxxxxx, xxxxxxxxxxx x&xxxx;xxxxxxxx xxxxxx definované xxxxx se xxxxxxxxxxxx xxxxxxx“, xxxxx xxxx xxxxxxxxx x&xxxx;xxxxxxxxx x&xxxx;xxxx, x&xxxx;xxx xxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxx prvků, xxxxx se xxxxxxx xxxxxxxxxx dostupnost. X&xxxx;xxxxx xxxxxxx se xxxxxxxxx xxxxxx popsaný v oddíle 3.2.1 xxxxxxx&xxxx;XX. Požadavek xx xxxxxx na srovnání xxxxxx v tkáních xxxx xxxxxxxxxx xxxx xxxxxxxx, xxx xxxx podávána xxxxxxxx xxxxx dotyčné xxxxx, a pozitivní xxxxxxxxx xxxxxxxx (xxxxxxxxxx xxxxx). |
|
3.3.2.2 |
Xxxxxxxxxxxxx xxxxxx Xx xx xxxxxxxx xxx xxxxxxxx xxxxxxxxxxxxx xxxxxxx a pro doplňkové xxxxx, které nebyly xxxxx xxxxxxxx. Xxx xxxxxxxx xxxxxxxxxxxxx xxxxxxx xx xxxxx předložit xxxxxx xxxxxxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxxx, xxxxxx:
Xxxxx xxxxxxxxx xxxxxxxxxx xxxxx xx xxxxxxx, x&xxxx;xxx xx známo, xx xxxxxxx kmeny produkují xxxxxx, je xxxxx xxxxxxxx vyloučit jejich xxxxxxxxxx. |
|
3.3.2.3 |
Xxxxxxxxx xxxxxxxxxxx xxx xxxxxxxxxxxx Xxxxxxx xx celý xxx&xxxx;3.2.3 xxxxxxx&xxxx;XX. |
3.3.3&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx používání xxxxxxxxx látky xxx xxxxxxxxx/xxxxxxxxxx
Xxxxxxx xx celý xxx&xxxx;3.3 xxxxxxx&xxxx;XX.
3.3.4&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxx xxxxxxxxx
Xxxx xxx&xxxx;3.4 xxxxxxx&xxxx;XX xx xxxxxxx xxx xxxx xxxxxx xxxxx, xxxxx xxxxx xx skupině xxxxxxxxx xxxxxxxxx xxxxx.
3.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxx xxxxxxxx se účinnosti xxxxxxxxx xxxxx
Xxxxxx xxxxxxxxx xx nepožadují pro xxxxxxxx, xxxxxxxxxxxxx, xxxx x&xxxx;xxxxxxx xxxxxxxxxxxx, xxxxx xxx xxxx povoleny xxxx xxxxxxxxx xxxxx, xxxxxxxxxx xxxxxxxxx prvků, xxxxx již xxxx xxxxxxxx xxxx xxxxxxxxx xxxxx, x&xxxx;xxxxxxxx, provitamíny x&xxxx;xxxxxxxx přesně xxxxxxxxxx xxxxx se xxxxxxxxxxxx xxxxxxx, xxxxx xxx xxxx xxxxxxxx jako xxxxxxxxx xxxxx.
Xxxxxxxxxx xxxxxx xx xxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxx pro deriváty xxxxxxxx, xxxx a analogy xxxxxxxxxxxx, které xxxxx xxxxxx xxxxxxxx xxxx xxxxxxxxx xxxxx, sloučeniny xxxxxxxxx xxxxx, xxxxx xxxxx nebyly povoleny xxxx xxxxxxxxx látky, x&xxxx;xxx vitamíny, xxxxxxxxxxx x&xxxx;xxxxxxxx xxxxxx xxxxxxxxxx xxxxx se xxxxxxxxxxxx xxxxxxx, které xxxxx xxxxxx xxxxxxxx xxxx xxxxxxxxx xxxxx.
Xxx ostatní xxxxx, x&xxxx;xxxxx xx xxxxx nutriční xxxxxx, xx xxxxxxxx xxxxxxx xxxxx dlouhodobá studie xxxxxxxxx xxxxx ustanovení xxxxxx&xxxx;4 xxxxxxx&xxxx;XX.
Xxxxxx xxxx xxxxxxxx prokázat, xx xxxxxxxxx látka xxxx xxxxxxx xxxxxxxxx požadavkům xxxxxx. Xxxxx zahrnují xxxxxxxx skupinu x&xxxx;xxxxxx xxxxxx, xxxxx xxxxxxxx xxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxxx xxx xxxxxxxx xxxxxxxxx xxxxxx. Xx však xxxxx xxxxxxx xxxxxxxx x&xxxx;xxxxxxxx kontrolní xxxxxxx xxxxxx xxxxxx deficitem. Xxxxxxx postačuje xxxxxxxx xxxxxxxx u jednoho xxxxx xxxx xxxxxxxxx xxxxxx, xxxxxx xxxxxxxxxxxxx xxxxxx.
3.5&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxx xxxxxxxxxxxx x&xxxx;xxxxxx po xxxxxxx xxxxx xx xxx
Xxxxx xxxxx xx xxxxxxx podle xxxxxxxxxx xx.&xxxx;7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) č. 1831/2003.
4. ZOOTECHNICKÉ DOPLŇKOVÉ XXXXX
4.1&xxxx;&xxxx;&xxxx;Xxxxxxxxxxxx doplňkové látky xxxx než enzymy x&xxxx;xxxxxxxxxxxxxx
4.1.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx xx xxxx xxxxx&xxxx;X&xxxx;xxxxxxx&xxxx;XX.
4.1.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxxxx, xxxxxxxxxxxxxxx a podmínky pro xxxxx xxxxxxxxx xxxxx; xxxxxx xxxxxxx
Xxxxxxx xx xxxx xxxxx&xxxx;XX xxxxxxx&xxxx;XX.
4.1.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Xxxxxx týkající se xxxxxxxxxxx doplňkových látek
|
4.1.3.1 |
Studie xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxx zvířata Použije xx celý xxx&xxxx;3.1 xxxxxxx&xxxx;XX. |
|
4.1.3.2 |
Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx spotřebitele
|
|
4.1.3.3 |
Studie xxxxxxxx xx bezpečnosti xxxxxxxxx xxxxx xxx uživatele/pracovníky Použije xx celý bod 3.3 xxxxxxx&xxxx;XX. |
|
4.1.3.4 |
Xxxxxx xxxxxxxx se xxxxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxx xxxxxxxxx Xxxxxxx xx xxxx bod 3.4 xxxxxxx&xxxx;XX. |
4.1.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Studie xxxxxxxx xx xxxxxxxxx xxxxxxxxx xxxxx
Xxxxxxx se xxxx xxxxx&xxxx;XX xxxxxxx&xxxx;XX.
|
1. |
Xxxxxxxxx xxxxx, xxxxx xxxx xxxxxxxxx xxxx xx xxxxxxxxxx xxxxxx, xxxxxxxxxx nebo xxxxx životní xxxxxxxx, x&xxxx;xxxxxxx xxxxxxx „xxxx xxxxxxxxxxxx xxxxxxxxx xxxxx“ Xxxxxx xxx xxxxxxxx xxxxx xx xxxxxx xx xxxxxxx xxxxxxxx xxxxx xxxx xxxxxxxxx xxxxxx. X&xxxx;xxxxxxxxxx xx vlastnostech xxxxxxxxx látky xxxxx xxx xxxxxx xxxxxxxx xx xxxxxxxxxx xxxxxxxxxxxxxxxxx (xxxx. xxxxxxxxx xxxxxxxx, xxxxxxxx xxxxx xxxxxxxxx, xxxxxx xxxxxxxxxxx xxxxxxxx), xxxxxxx jatečně xxxxxxxxxx xxxx, xxxxxxxxxxx xxxxx, xxxxxxxxxxxxx xxxxxxxxxxx xxxx xxxxxxx xxxxxxxxx podmínkách xxxxxx. Xxxxx o mechanismu xxxxxxxx lze poskytnout xxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx laboratorními xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx. |
|
2. |
Xxxxxxxxx xxxxx, které xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx xxx xxxxxxx xxxxxxxxx X&xxxx;xxxxxxxxxxx xxxxx, které xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx (xxxx. omezená xxxxxxx xxxxxx x&xxxx;xxxxxxx xxxx xxxxxxx xxxxxxxx xxxxxx, eliminace xxxxxxxx), xx xxxxx účinnost x&xxxx;xxxxxxxx xxxxx doložit xxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx se xxxxxxx xxxxxxxxxxxxx xxxxxxxx prospěšné xxxxxx. Studie xxxxxx x&xxxx;xxxxx možnost přizpůsobení xx xxxxxxxxx xxxxx. |
4.1.5&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxx xxxxxxxxxxxx v období xx xxxxxxx xxxxx xx xxx
Xxxxx xxxxx xx xxxxxxx xxxxx xxxxxxxxxx xx.&xxxx;7 xxxx.&xxxx;3 písm. g) nařízení (XX) č. 1831/2003.
4.2 Zootechnické xxxxxxxxx xxxxx: enzymy x&xxxx;xxxxxxxxxxxxxx
4.2.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx se xxxx xxxxx&xxxx;X&xxxx;xxxxxxx&xxxx;XX.
4.2.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxxxx, xxxxxxxxxxxxxxx x&xxxx;xxxxxxxx xxx užití xxxxxxxxx xxxxx; xxxxxx xxxxxxx
Xxxxxxx xx xxxx xxxxx&xxxx;XX přílohy II.
4.2.3 Oddíl III: Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxxxx látek
|
4.2.3.1 |
Studie týkající xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx látky xxx xxxxxx xxxxxxx Xxxxxxx xx xxxx xxx&xxxx;3.1.1 xxxxxxx&xxxx;XX. Xxxxxxxx xx xxxxxxxx, xxx xxxxx xxxxx používali x&xxxx;xxxxxxx skupiny přinejmenším 100xxxxxxx xxxxxxxx dávky x&xxxx;xxxxxxx počet xxxxxxxxxxxx xxxxxxxxx. X&xxxx;xxxxxx xxxxx xxx použít koncentrovanou xxxxx doplňkové látky. Xxxxxxxxxxx se xxxxxx xxxxxxxx xxxxxxxx přítomného xxxxxx, poměr xxxxxxxx xxxxxxx (xxxxxxx) / xxxxx (látek) x&xxxx;xxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxx xxxx xxx xxxxxx xxxx x&xxxx;xxxxxxx xxxxxxxx. X&xxxx;xxxxxx xxxxxx xxxxxxxxx xxxxxx xxxxxxxx(x). Xxxx xxx&xxxx;3.1.2 přílohy II xx xxxxxxxx na xxxxxxx xxxxxxxxxxxxxx x&xxxx;xxxxxx, xxxxx xxxx přímý xxxxxxxxxxx xxxxxx xx xxxxxx xxxxxxxxxxx xxxxx nebo x&xxxx;xxxxxxx xx xxx xx xxxxx, xx xxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxx. X&xxxx;xxxxxxx xxxx xxxxxxxx xxxx značného xxxxxxx xxxxxxxx mikroorganismům mohou xxx xxxxxxxx xxxxxxxxx xxxxxx, xxx byla xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxx xxxxxx xx xxxxxxxxxx xxxxxxxxxxx xxxxx trávícího xxxxxx. U přežvýkavců bude xxxxx xxxxx xxxxxxxx xxxxxxxxxxx xxxxx xxxxx x&xxxx;xxxxxxx, xx xxxxxx xxxxxxxxx nepříznivé změny xxxxxx xxxxxxx (xxxxxx xx xxxxx xxxx xxxxx koncentrací těkavých xxxxxxxx xxxxxxx, xxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxx xxxxxxx celulolýza). |
|
4.2.3.2 |
Studie xxxxxxxx xx xxxxxxxxxxx používání xxxxxxxxx látky xxx xxxxxxxxxxxx
Xxxxxx x&xxxx;xxxxxxxxxxxxxx xxxxx pouze xxxx celé xxxxxxxxx xxxxx, xxxxx xx xxxxxxx případů xxxx xxxxxxxxx jiné xxxxxx xxxxxxxxxxx z fermentačního xxxxxxx. Xxxxx je xxxxxxxx xxxxxxxxxx xxxxx otestovat, xxx bylo xxxxxxxxx, xx xxxxxxxxxx xxxxxxxxx xxxx xxxx xxxxxxxxx, xxxxx xxxxx xxxxxxxx xxxxxxx požívajícího xxxxxxxxx xxxxxxx xx xxxxxx, xxx xxxx xxxxxx xxxxxx xxxx vodou xxxxxxxxxx xxxxxx doplňkovými xxxxxxx. Xxxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxx xxx xxxxx xxxx xxxxxxx xxxxxxxxx xxxxx (včetně xxxxxxx) xx xxxx xxxxxxxx xx xxxxxx organismů, xxx něž xxxx x&xxxx;xxxxxxxxx xxxxx x&xxxx;xxxxxxx xxxxxxxxx používání, nebo xx skupin, xxx xxx jsou xxxxxxx xxxxxx přesně xxxxxxxx. Xxxxxxx nebezpečí xxxxxxx x&xxxx;xxxxxxxxxxxxxx, xxxxx xx x&xxxx;xxxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxx xxxxxx, je xxxxxxx xxxxxx xxxxxxxxxx a významně xxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxx. Proto se xxx xxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxx x&xxxx;xxx xxxxxxxxxxxxxx, xxx xxx xxxx x&xxxx;xxxxxxxxx xxxxx x&xxxx;xxxxxxx xxxxxxxxx xxxxxxxxx, x&xxxx;xxxx-xx xxxxxx xxxxxxxxxxxxx procesu xxxxxx xxxxxxxxxx a známé, xxxxxxxxxx zkoušky toxicity (xxxx. xxxxxxxxx xxxxxx xxxxxxxx nebo xxxxxxxxxxxx) xx nutné. Xxxxx x&xxxx;xxxxxx xxxxxxxxx a organismů xxxxxxxxxxx x&xxxx;xxxxxxxx xxxxxx xx vždy xxxxx xx zabývat xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxx v bodě 2.2.2.2 xxxxxxx&xxxx;XX. Xx-xx xxxxxxxxxx xxxx jeho xxxxx xxxx a neexistují dostatečné xxxxxxxx o biologii (xxxxxxxxxxx) xxxxxxxxx, xxx xxx xxxxxxxx potenciál xxxxxxxx xxxxxxxxx xxxxxxxxxx, je xxxxx předložit studie xxxxxxxxxxxx x&xxxx;xxxxxx toxicity xxxxxxxxx x&xxxx;xxxxxxxxxxx látkami, xxxxx xxxxxxxx životaschopné xxxxxxxxxxxxxx xxxx enzymy. X&xxxx;xxxxx xxxxxxx mají xxxxxx xxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxxx x&xxxx;xxxxxx xxxxxxxxxxxx xxxxxx toxicity. Xxxxxxxxxx se, xxx xx xxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxxxx xxxxx nebo v případě xxxxxxxxxx xxxxxx materiálů x&xxxx;xxxxxxx extraktem. |
|
4.2.3.3 |
Studie xxxxxxxx xx bezpečnosti xxxxxxxxx xxxxx xxx uživatele/pracovníky Použije xx xxxx xxx&xxxx;3.3 xxxxxxx&xxxx;XX s výjimkou xxxxxx xxxxxxx:
|
|
4.2.3.4 |
Xxxxxx xxxxxxxx xx xxxxxxxxxxx doplňkové látky xxx xxxxxxx prostředí Celý xxx&xxxx;3.4 přílohy II xx xxxxxxxx xxxx xx xxxxxxxxxxxxxx, xxxxx xxxxxx xxxxxxxxx xxxxxx xxxx xxxxxx všudypřítomné v životním xxxxxxxxx. |
4.2.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxx týkající xx xxxxxxxxx xxxxxxxxxxx xxxxx
Xxxxxxx se celý xxxxx&xxxx;XX xxxxxxx&xxxx;XX.
|
1. |
Xxxxxxxxx xxxxx, xxxxx mají xxxxxxxxx xxxx xx xxxxxxxxxx xxxxxx, užitkovost xxxx xxxxx xxxxxxx podmínky x&xxxx;xxx funkční xxxxxxx „xxxx xxxxxxxxxxxx doplňkové xxxxx“. Xxxxxx lze xxxxxxxx xxxxx xx xxxxxx xx každému xxxxxxxx xxxxx xxxx xxxxxxxxx xxxxxx. X&xxxx;xxxxxxxxxx xx xxxxxxxxxxxx doplňkové xxxxx xxxxx být xxxxxx xxxxxxxx xx xxxxxxxxxx xxxxxxxxxxxxxxxxx (xxxx. xxxxxxxxx xxxxxxxx, xxxxxxxx denní xxxxxxxxx, xxxxxx xxxxxxxxxxx xxxxxxxx), skladbě jatečně xxxxxxxxxx xxxx, užitkovosti xxxxx, xxxxxxxxxxxxx xxxxxxxxxxx xxxx xxxxxxx životních xxxxxxxxxx xxxxxx. Xxxxx x&xxxx;xxxxxxxxxx xxxxxxxx xxx xxxxxxxxxx krátkodobými xxxxxxxx xxxxxxxxx nebo xxxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx. |
|
2. |
Xxxxxxxxx xxxxx, které xxxxxxxxx ovlivňují důsledky xxxxxxxxx xxxxxx pro xxxxxxx prostředí. U doplňkových látek, xxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx (např. xxxxxxx exkrece xxxxxx xxxx xxxxxxx xxxx xxxxxxx xxxxxxxx metanu, xxxxxxxxx příchutí), xx xxxxx účinnost x&xxxx;xxxxxxxx xxxxx xxxxxxx xxxxx xxxxxxxxxxxx studiemi účinnosti xx xxxxxxx xxxxxxxxxxxxx xxxxxxxx prospěšné xxxxxx. Xxxxxx xxxxxx x&xxxx;xxxxx xxxxxxx xxxxxxxxxxxx se xxxxxxxxx xxxxx. |
4.2.5&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx uvedení xxxxx na trh
Tento xxxxx xx použije xxxxx ustanovení xx.&xxxx;7 xxxx.&xxxx;3 písm. g) nařízení (XX) x.&xxxx;1831/2003.
5.&xxxx;&xxxx;&xxxx;XXXXXXXXXXXXXXX X&xxxx;XXXXXXXXXXXXXXXX
5.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx xx xxxx xxxxx&xxxx;X&xxxx;xxxxxxx&xxxx;XX.
5.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxxxx, xxxxxxxxxxxxxxx x&xxxx;xxxxxxxx xxx xxxxx xxxxxxxxx xxxxx; xxxxxx analýzy
Použije xx xxxx xxxxx&xxxx;XX xxxxxxx&xxxx;XX.
5.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxxxx xxxxx
5.3.1&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxx xxxxxxx
Xxxxxxx xx celý xxx&xxxx;3.1 xxxxxxx&xxxx;XX.
5.3.2&xxxx;&xxxx;&xxxx;Xxxxxx týkající xx xxxxxxxxxxx používání xxxxxxxxx látky xxx xxxxxxxxxxxx
Xxxxxxx xx xxxx xxx&xxxx;3.2 přílohy II.
5.3.3 Studie týkající xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxx/xxxxxxxxxx
Xxxxxxx xx celý xxx&xxxx;3.3 přílohy II.
5.3.4 Studie xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx látky pro xxxxxxx xxxxxxxxx
Xxxxxxx xx xxxx xxx&xxxx;3.4 xxxxxxx&xxxx;XX.
5.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxx týkající se xxxxxxxxx xxxxxxxxx látky
Tyto xxxxxxxxx xxxxx chrání xxxxxxx xxxx xxxxxxxx xxxxxx Eimeria xxx. xxxx Xxxxxxxxxx xxxxxxxxxxx. Xxxxxx se přikládá xxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx (např. xxxxxxxxxxxx druh) x&xxxx;xxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxx (xxxx. xxxxxxx xxxxxxxxx, xxxxxxxxx, xxxxx oocyst a výskytu xxxxxxxxxx změn). Xxxxxxxxx xx xxxxxxxx xxxxxxxxx x&xxxx;xxxxxx na xxxx x&xxxx;xxxxxxxx krmiva (xxxxx xxxxxxx, xxxxxxx xxxxxx x&xxxx;xxxxxxx), účincích xx xxxxxxx vajec (xxxxxxxx xxxxxx).
Xxxxxxxxxx údaje o účinnosti xxxx odvozeny xx xxx xxxx xxxxxx x&xxxx;xxxxxxxx xxxxxxx:
|
— |
xxxxx jednotlivé x&xxxx;xxxxxxx xxxxxxx, |
|
— |
xxxxxxxxx/xxxxx xxxxxxx x&xxxx;xxxxx xxxxxxxxx xxxxxxxx xxx xxxxx, |
|
— |
xxxxxxxx xxxxxxxx xxx xxxxx xxx xxxxxxxxx v terénu. |
Pokusy x&xxxx;xxxxxxx xxxxxxxxxxxx x&xxxx;xxxxxxxxx infekcemi (xxxx. xxxxxxx chov xxxxxxx) xxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxx xxxxxxxxx a nevyžadují xxxxxxxxx. Xxx průkazné xxxxxxxx xx xxxxxxxx pro xxxxxx xxxxxxxxxx xxxxxxxx xxx xxxxx (xxxx. xxxxxx xxx xxxxxx xxxxxxxx s drůbeží, xxxxxx xxx klecovém xxxxx x&xxxx;xxxxxxx). Požadují se xxxxxx tři xxxxxx x&xxxx;xxxxxx s určitou mírou xxxxxxxxx xxxxxxx.
5.5&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxx monitorování x&xxxx;xxxxxx xx xxxxxxx xxxxx xx xxx
Xxxxx xxxxxxx&xxxx;XX xx použije xxxxx xxxxxxxxxx čl. 7 xxxx.&xxxx;3 písm. g) nařízení (ES) x.&xxxx;1831/2003.
6.&xxxx;&xxxx;&xxxx;XXXXXXXXXXX Z VĚTŠINOVÝCH DRUHŮ XX DRUHY XXXXXXXXX
Xxxxxxxxx xxxxx xxxx xxxxxxxx x&xxxx;xx.&xxxx;1 xxxx.&xxxx;2 xxxxxx xxxxxxxx.
X&xxxx;xxxxxx xx xxxxxxxxx xxxxxxxxxx xxxxx pro xxxx, xxxxx xx x&xxxx;xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxx, pro xxxx xxx xxxx xxxxx xxxxxxxxx látky xxxxxxxx, xx obvykle xxxxxxxxxx xxxxxxxxxx údajů x&xxxx;xxxxx xxxxxxx.
Xxxx uvedené xxxxxxxxx xx xxxxxxxx xxxxx xx xxxxxxxxxx povolení xxx xxxxxxxxx xxxxx x&xxxx;xxxxxxx xx xxxxxxxxx xxxxx, xxxxx xxx xxxx xxxxxxxx xxx xxxxx xxxxxxxxx. Xxx xxxxxxxx nových xxxxxxxxxxx xxxxx xxxxxxxxxx pouze xxx xxxxxxxxx druhy xx použijí xxxx xxxxxxx xxxxxx x&xxxx;xxxxxxxxxx xx xxxxxxxxx/xxxxxxx xxxxxxx xxxxxxxxx xxxxx (viz xxxxxxxxxxxx zvláštní xxxxxxxxx x&xxxx;xxxxxxx&xxxx;XXX).
6.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx xx xxxx oddíl I přílohy II.
6.2 Oddíl II: Xxxxxxxx, xxxxxxxxxxxxxxx a podmínky xxx xxxxx xxxxxxxxx xxxxx; xxxxxx xxxxxxx
Xxxxx&xxxx;XX xxxxxxx&xxxx;XX xx použije xxxxx:
|
— |
xxx xxxxxxxxx látky, xxxxx xxxx vázané na xxxxxxxx xxxxxxxx, xx xxxxxxx xxxx xxxxx&xxxx;XX, |
|
— |
xxx xxxx xxxxxxxxx xxxxx xx xxxxxxx xxxx&xxxx;2.1.2, 2.1.3, 2.1.4, 2.1.4.2, 2.2, 2.3.1, 2.3.2, 2.4.1, 2.4.2, 2.4.4, 2.5, 2.6. |
6.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx doplňkové xxxxx
6.3.1&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx cílová xxxxxxx
|
6.3.1.1 |
Xxxxxxxxx x&xxxx;xxxxxxxx xxxxx Xxxxx xxxxxxxxx xxx xxxxxxxxxx xxxxxxxxx / xxxxxxx xxxxxxx xxxxxxxxxxx látek. V zásadě xx xxxxxx tolerance u menšinových xxxxx xxxxxxxxxx, xxxxx xxxxxxxxx xxxxx vykazuje xxxxxx rozpětí xxx xxxxxxxxxx (xxxxxxx koeficient 10) x&xxxx;xxxxxxxxxxx většinového xxxxx, který je x&xxxx;xxxxxxxxxxxxxx hlediska xxxxxxx. Xxxxx xxx většinové xxxxxx xxxxx (xxxxxx xxxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxx savců x&xxxx;xxxxxxx) xxxxxxxx xxxxxxx x&xxxx;xxxxxx xxxxxxx xxx xxxxxxxxxx, xxxxxxxxxx xx další xxxxxx xxxxxxxxx xxx xxxxxxxxx xxxxx, které xxxxxx x&xxxx;xxxxxxxxxxxxxx hlediska xxxxxxx (např. koně xxxx xxxxxxx). Xxxxx xx požaduje xxxxxx xxxxxxxxx, doba trvání xxxxxx xxx xxxxxxxxx xxxxx (xxxxx xxxxxxx) xxxx xxxxxxx 28&xxxx;xxx xxx xxxxxxx v růstu x&xxxx;42&xxxx;xxx pro dospělá xxxxxxx. X&xxxx;xxxxxxx xxxxx xxxx xxxx xxxxxx: xxxxx králíků: 28&xxxx;xxx; xxxxxx xxxxxxx: xxxxx xxxxxx (xx xxxxxxxxxx xx xxxxx doby xxxxxxx). Pokud xx xxxxxx xxxxxxxx xx xxxxxx x&xxxx;xxxxxxxxx xxxxxxx, xxxxxxxx se za xxxxxxxxxx období 49&xxxx;xxx (xxxxxxxx xxxxx xxxxx xx narození) x&xxxx;xxxx xxxxxxxxx xxxxxxx až xx odstavu. Xxx xxxx (jiné xxx xxxxxxxxxx) xx xxxxxxxx 90xxxxx xxxxxx. |
6.3.2&xxxx;&xxxx;&xxxx;Xxxxxx týkající xx xxxxxxxxxxx používání xxxxxxxxx xxxxx pro xxxxxxx jako xxxxxxxxxxxx
|
6.3.2.1 |
Xxxxxx xxxxxxxxxxx Xxxxx xxxxxxxxx pro xxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx xxxxxxx xxxxxxxxxxx xxxxx. Xxxxxx xxxxxxxxxxx xx nepožadují, xx-xx doplňková látka xxx xxxxxxxx xxx xxxxx u druhu, xxxxx xx x&xxxx;xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxx, xx xxx se xxxxxxxx žádost o povolení. Xxxxxxxx podobnost x&xxxx;xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxxx, považuje xx pro posouzení xxxxxxxxxx xxxxxxxxxxx za xxxxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxx na xxxxxxx xxxxxx xx xxxxx (xxxx. x&xxxx;xxxxxxxxxx xxxxxx xxxxxxx xxxxx). Xxxx-xx menšinový xxxx x&xxxx;xxxxxxxxxxxxxx hlediska xxxxxxx xxxxxxxxxxx xxxxx, xx xxxxx xxxxxx xxxxx x&xxxx;xxxxxxxxxxx doplňkové xxxxx u menšinového xxxxx. |
|
6.3.2.2 |
Xxxxxx xxxxxxx Xx-xx xxxxxxx xxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxx, xxxxxxxx se xxxxx xxxxxxxxxxxx xxxxxxxxxxxxxx rezidua x&xxxx;xxxxxxxxxxxxx xxxxxxx a produktech. Xx xxxxx xxxxxxxxx xxxxxxxxx xx použije xxxx xxx&xxxx;3.2.1.2 přílohy II. |
|
6.3.2.3 |
Posouzení xxxxxxxxxxx xxx spotřebitele Návrh xxxxxxxxxxx xxxxxx reziduí (XXX) Xxxxxxxxx XXX xxx xxxxxxx xx xxxxxxxxxxx, xx xx x&xxxx;xxxxxxxxxxxxx xxxxxxx menšinového druhu x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxx většinovým xxxxxx xxxxxxxxxxx xxxxx xxxxxxxx rozdíly v obsahu xxxxxxx. XXX xxx extrapolovat x&xxxx;xxxxx xxxx xxxxxx xxxxx:
XXX xxx xxxx xxx xxxxxxxxxxxx, pokud xxxxxxxx MLR xxx xxxxxxxxxxx xxxxxxxxxxx a většinového xxxxxxxxxxxxxxx xxxxx. Xxxxx byly xxxxxxxx identické XXX x&xxxx;xxxxx (xxxx xxxx), xxxxxx x&xxxx;xxxxx (xxxx xxxxxxx), xxxxx xxxxxxxxxxx xxxxxxxxx druhy x&xxxx;xxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxx xxxxx, je xxxxx xxxxxxxx xxxxxx XXX xxxxxx pro xxxx, xxxxxxxx x&xxxx;xxxxxxx, což xxxxxxx, xx se xxxxxxxx xx možnou xxxxxxxxxxx na všechna xxxxxxx, která xxxx xxxxxx x&xxxx;xxxxxxxx potravin, x&xxxx;xxxxxxxx xxx. X&xxxx;xxxxxxx xx pokyn Výboru xxx xxxxxxxxxxx xxxxxx xxxxxxxxx (XXXX)&xxxx;(10) xxx xxxxxxxxx MLR xxx Xxxxxxxxxx a ostatní ryby, xxxxx xxx xxxxxxxx xxxxxxxxxxx x&xxxx;XXX xx xxxxx většinového xxxxx xx Salmonidae a ostatní xxxx xx xxxxxxxxxxx, xx xxxxxxx xxxxx xxxx xxxxxxxxxx xxxx xxxxxxxxxxxx reziduum pro XXX xx svalu x&xxxx;xxxx, xxx MLR xxxxxxxxxxxx na xxxxxxx xxxxxxx určená x&xxxx;xxxxxxxx xxxxxxxx. Xxxx k dispozici xxxxxxxxxx xxxxxx pro monitorování xxxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxxx x&xxxx;xxxxxxxxxx xxxxx xxxxxx xxxxxxxx x&xxxx;xxxxxxxx potravin. |
6.3.3 Studie xxxxxxxx se xxxxxxxxxxx xxxxxxxxx doplňkové látky xxx xxxxxxxxx/xxxxxxxxxx
Xxxxxxx xx xxxx xxx&xxxx;3.3 xxxxxxx&xxxx;XX.
6.3.4&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx látky xxx xxxxxxx prostředí
Posouzení xxxxx xxx životní xxxxxxxxx lze xxxxxxxxxxxx x&xxxx;xxxxxxxxx provedeného pro xxxxxxxxx xxxx, xxxxx xx x&xxxx;xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxx. Pro xxxxxxxxx xxxxx, xxxxx xxxx xxx xxxxxxxxx x&xxxx;xxxxxxx, xx xxxxxxx xxxx xxxxx s přihlédnutím k požadavkům xxx xxxxxx xxxxxxxxx / xxxxxxx xxxxxxx xxxxxxxxxxx xxxxx.
6.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxx xxxxxxxx xx xxxxxxxxx xxxxxxxxx xxxxx
Xxxxx xxxxxxxxx xxxxx byla pro xxxxxxx xxxxxx xxxxxxxx xxx většinový druh, xxxxx je x&xxxx;xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxx, x&xxxx;xxxxx xx znám xxxx xxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx, je xxxxx považovat xx xxxxxxxx účinnosti xxxxxx x&xxxx;xxxxxxx xxxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxxxxx xxxxx. Pokud xxxxxxxx xxxxxxxxx neexistuje, xx xxxxx xxxxxxxx xxxxxxxx xxxxx obecných xxxxxxxx pro xxxxx&xxxx;XX x&xxxx;xxxxxxx&xxxx;XX. V některých xxxxxxxxx xxxx být xxxxxx xxxxxxxxxx xxxxx xxxxxx xx xxxxxx xxxxxxxxxxx xxxx (např. kozy x&xxxx;xxxx používané k produkci xxxxx). V každé xxxxxx (X&xxxx;≤ 0,1) xxxx xxxxxx metaanalýzy (X&xxxx;≤ 0,05), xx-xx xx xxxxx, xx xxxx xxx prokázána xxxxxxxxxx.
Xxxxxxxx-xx xx xxxxxxxxx xxxxxxxxx, xxxx xxxxxx xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxxx xxxxx, xxxxx xx x&xxxx;xxxxxxxxxxxxxx xxxxxxxx srovnatelný. X&xxxx;xxxxxxxxx xxxxxxxxx minimální xxxx xxxxxx xxxxxx xxxxxxx xxxxxxxxx xxxxxxxxxx x&xxxx;xxxx&xxxx;4.4 xxxxxxx&xxxx;XX x&xxxx;xxxxxxx&xxxx;XX.
6.5&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxx xxxxxxxxxxxx v období xx xxxxxxx xxxxx na xxx
Xxxxx xxxxx xxxxxxx&xxxx;XX xx xxxxxxx xxxxx xxxxxxxxxx čl. 7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003.
7.&xxxx;&xxxx;&xxxx;XXXXXXX X&xxxx;XXXXXXXX CHOVU A OSTATNÍ XXXXXXX, XXXXX XXXXXX XXXXXX X&xxxx;XXXXXXXX POTRAVIN
Zvířata x&xxxx;xxxxxxxx xxxxx x&xxxx;xxxxxxx xxxxxxx, xxxxx xxxxxx xxxxxx x&xxxx;xxxxxxxx xxxxxxxx, xxxx vymezena x&xxxx;xx.&xxxx;1 xxxx.&xxxx;1 xxxxxx nařízení.
7.1 Oddíl I: Shrnutí xxxxxxxxxxx
Xxxxxxx xx xxxx xxxxx&xxxx;X&xxxx;xxxxxxx&xxxx;XX.
7.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxxxx, xxxxxxxxxxxxxxx x&xxxx;xxxxxxxx pro xxxxx xxxxxxxxx látky; metody xxxxxxx
Xxxxx&xxxx;XX xxxxxxx&xxxx;XX se xxxxxxx takto:
|
— |
pro doplňkové xxxxx, xxxxx xxxx xxxxxx xx xxxxxxxx xxxxxxxx, se xxxxxxx xxxx xxxxx&xxxx;XX, |
|
— |
xxx xxxx xxxxxxxxx xxxxx xx xxxxxxx xxxx&xxxx;2.1.2, 2.1.3, 2.1.4, 2.1.4.2, 2.2, 2.3.1, 2.3.2., 2.4.1, 2.4.2, 2.4.4, 2.5, 2.6. |
7.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Studie xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxx
7.3.1&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx používání xxxxxxxxx xxxxx pro cílová xxxxxxx
Xxxxx požadavky xxx xxxxxxxxxx xxxxxxxxx / xxxxxxx skupiny xxxxxxxxxxx xxxxx. Xxxxxxxx-xx xx xxxxxx tolerance, její xxxx xxxxxx xxxx xxxxxxx 28&xxxx;xxx.
Xxxxxx tolerance xx nepožaduje, pokud xxxxxxxxx xxxxx vykazuje xxxxxxxxxxx x&xxxx;xxxxxx rozpětí xxx xxxxxxxxxx u třech xxxxxxxxxxx xxxxx (xxxxxx xxxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxx savců x&xxxx;xxxxxxx).
7.3.2&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxxxxx
Xxxxx xxx xx obvykle xxxxxxxxxx. Pozornost se xxxxxx xxxxxxxxxxx majitele.
7.3.3 Studie xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx uživatele/pracovníky
Použije se xxxx bod 3.3 xxxxxxx&xxxx;XX.
7.3.4&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx doplňkové xxxxx xxx životní xxxxxxxxx
Xxx&xxxx;3.4 xxxxxxx&xxxx;XX xx xxxxxxxxxx.
7.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxx xxxxxxxx xx xxxxxxxxx doplňkové látky
Platí xxxxxxxxx xxx xxxxxxxxxx xxxxxxxxx / xxxxxxx xxxxxxx xxxxxxxxxxx xxxxx.
Xxxxxxxx xxxxxxxxx xxxxx, xxx xxx xx požadují xxxxxx xx xxxxxxxxx, xxx xxxx xxxxxx xxxxxxxx xxx xxxx, xxxxx xx x&xxxx;xxxxxxxxxxxxxx xxxxxxxx podobný, xxxxxxxxxx xx xxxxx xxxxxxxxx xxxxxxxxx, xxxx-xx xxxxxxxxxx xxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxx xxxxxx. Pokud doplňková xxxxx xxxxxx xxxxx xxxxxxxx nebo xxxxxxxxxx xxxxxx xx mechanismus xxxxxxxx xxxx xxxx xxx v případě xxxxxxxxxxx xxxxxxxx, je nutno xxxxxxxx xxxxxxxx xxxxx xxxxxxxx xxxxxxxx xxx xxxxx&xxxx;XX x&xxxx;xxxxxxx&xxxx;XX.
Xxxx xxxxxx xxxxxxxxxxxx zkoušek xxxxxxxxx xxxx nejméně 28 dní.
7.5 Oddíl V: Plán xxxxxxxxxxxx x&xxxx;xxxxxx po xxxxxxx látky xx xxx
Xxxxx xxxxx xxxxxxx&xxxx;XX xx xxxxxxx xxxxx xxxxxxxxxx xx.&xxxx;7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) č. 1831/2003.
8. DOPLŇKOVÉ XXXXX, XXXXX JIŽ XXXX XXXXXXXX XXX XXXXX X&xxxx;XXXXXXXXXXX
8.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx xx xxxx xxxxx&xxxx;X&xxxx;xxxxxxx&xxxx;XX.
8.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxxxx, xxxxxxxxxxxxxxx a podmínky xxx xxxxx xxxxxxxxx xxxxx; xxxxxx xxxxxxx
Xxxxx&xxxx;XX xxxxxxx&xxxx;XX xx xxxxxxx xxxxx:
|
— |
xxx xxxxxxxxx látky, xxxxx xxxx xxxxxx xx xxxxxxxx xxxxxxxx, xx použije xxxx xxxxx&xxxx;XX, |
|
— |
xxx xxxx xxxxxxxxx xxxxx se xxxxxxx xxxx&xxxx;2.1.2, 2.1.3, 2.1.4, 2.1.4.2, 2.2, 2.3.1, 2.3.2., 2.4.1, 2.4.2, 2.4.4, 2.5, 2.6. |
8.3 Oddíl III: Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxxxx xxxxx
Xxxx xxx xxxxxxx xxxxxxxxxx xxxxxxxx posouzení xxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxx látek x&xxxx;xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx.
Xxx xxxxxxxxx xxxxx, které xxxx xxxxxxxx xxxx potravinářské xxxxxxxx xxxxx xxxx xxxxxxxxx x&xxxx;Xxxxxxxx xxxx xxxx složky xxxxxxxx xxx jakéhokoliv omezení, xxxxxx xxxxxx týkající xx xxxxxxxxxxx xxx xxxxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxx xxxxx.
Xxxxxx se xxxx&xxxx;3.1, 3.2 x&xxxx;3.3 xxxxxxx&xxxx;XX xx xxxxxxxx xx xxxxxxxxx xxxxxxxx o bezpečnosti xxxxxx xxxxx, pokud xxxx xxxxxxxxx x&xxxx;xxxxxxxxxxx. Xxxxxxxx xxxxx, xxxxx xxxx používány rovněž x&xxxx;xxxxxxxxxxx, lze xxxxxxxxxxxx xxxx:
|
— |
x&xxxx;xxxxxxxxxxxxxxxx XXX (xxx xxxxxxxxxx xxxxxxx xxxxxxx xxxxxx xxxxxx xxx xxxxx x&xxxx;xxxxx nízkou xxxxxxxxx), |
|
— |
xx stanovenou XXX xxxx XX xxxx |
|
— |
x&xxxx;xxxxxxxxxxxx XXX (pro xxxxx, x&xxxx;xxxxx xxxxxxxx xxxxx xxxxxxxxxxx xx xxxxxxxx xxxxxx bezpečnosti). |
8.3.1 Studie xxxxxxxx xx xxxxxxxxxxx používání xxxxxxxxx látky pro xxxxxx xxxxxxx
Xx-xx obsah xxxxx xxxxxxxxx látky xxxxxxx xxxx v případě xxxxxxxx, xxx xxxxxxxxxx xxx xxxxxx xxxxx xxxxxxxx xx základě xxxxxxxxxx xxxxxxxxxxxxxxx xxxxx xx zkoušek in xxxx x&xxxx;xxxxxxxxxxxx k chemické xxxxxxxxx x&xxxx;xxxxxxxxxxx schopnosti xxxxxxxx xxxxx. Je-li xxxxx xxxxx x&xxxx;xxxxxxxx xxxxxxxx vyšší xxx xxxxxxxxxxxx xxxxx v potravinách, xxxx xxx xxxxx xxxxxx xxxxx nutná xxxxxx xxxxxxxxx x&xxxx;xxxxxxxx xxxxxxx.
8.3.2&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx se xxxxxxxxxxx používání xxxxxxxxx xxxxx pro spotřebitele
Pokud xxxxx jako xxxxxxxxx xxxxx vede x&xxxx;xxxxx xxxxxxxx xxxxxxxxxxxx xxxx x&xxxx;xxxxxx xxxxx xxxxxxxxxx xxx x&xxxx;xxxxxxx užití x&xxxx;xxxxxxxxxxx, xxxxx xxxxxxxxxx xxxxx xxxxxxxxxxxxx xxxxx x&xxxx;xxxxx o reziduích.
|
8.3.2.1 |
Pro xxxxxxxxx xxxxx, xxx xxx xxxx specifikována XXX Xxxxxxxxx xxxxxxxxxxx xxx xxxxxxxxxxxx xx xxxxxxxxxx vyjma xxxxxxx, xxx xxxxx xxxxxxxxx xxxxx x&xxxx;xxxxxxxx xxxx x&xxxx;xxxxxxxxx xxxxx xxxxxxxxxx xxx při xxxxx x&xxxx;xxxxxxxxxxx. |
|
8.3.2.2 |
Xxxxxxxxx látky xx xxxxxxxxxx ADI xxxx XX Xxxxxxxxxx xxx xxxxxxxxxxxx xx xxxxx xxxxxxxx x&xxxx;xxxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxx xxxxxxxxxxx z užití x&xxxx;xxxxxxxx xxxx xxxxxxxx xxxxxxxx x&xxxx;xxxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxxxx x&xxxx;xxxxxxxx xxxxx. Xx lze xxxxxxx xxxxxxxxxxx xxxxx o reziduích x&xxxx;xxxxxxxxxx. Xxxx-xx xxxxxxxx studie xxxxxxx, požadavek xx xxxxxx xx xxxxxxxx xxxxxx x&xxxx;xxxxxxx nebo xxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxx x&xxxx;xxxxxxx, xxx xxxx xxxxxxxx xxxxxxxx udávaná xxxxx. |
|
8.3.2.3 |
Xxxxxxxxxxxxx xxxxxxxx xxxxx, xxx xxx xxxxxx XXX xxxxxxxxx Xx nutno xxxxxxxxxxx xxxxx xxxxxx, xxxx nebyla XXX xxxxxxxxx. Xxxxx xx xxxxxxxx xxxxx x&xxxx;xxxxx xxxxxxxxx xxxxx x&xxxx;xxxxxxxx xx přispělo k významnému xxxxxxx expozice x&xxxx;xxxxxxxxxxxx, xxxxxxxx se xxxxx xxxxxxxxxxxxx xxxxxxxxx. Xxxxxxxxxx xxxxxxxx xxxxxxxxxxx z užití x&xxxx;xxxxxxxx xxx xxxxxxxxxxxx z údajů x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxxxx. Xxxx-xx nezbytné xxxxxx xxxxxxx, požadavek xx xxxxxx xx xxxxxxxx xxxxxx x&xxxx;xxxxxxx xxxx xxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxx a skupiny, xxx xxxx xxxxxxxx xxxxxxxx xxxxxxx xxxxx. |
8.3.3&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx látky xxx xxxxxxxxx/xxxxxxxxxx
Xxxxxxx xx celý xxx&xxxx;3.3 xxxxxxx&xxxx;XX.
Xxx xxxxxxxxxx xxxxxxxxxxx doplňkové xxxxx xxx xxxxxxxxx xx xxxxxx x&xxxx;xxxxx bezpečnostní xxxxxxxx xxxxxxxxx pro xxxxxxxxxx s těmito látkami xxxxxxxxxxx v potravinách.
8.3.4 Studie xxxxxxxx xx xxxxxxxxxxx používání xxxxxxxxx xxxxx xxx xxxxxxx prostředí
Požaduje xx xxx&xxxx;3.4 xxxxxxx&xxxx;XX.
8.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxx xxxxxxxx se xxxxxxxxx xxxxxxxxx xxxxx
Xxxxxxxx je xxxxxx požadovaná xxx xxxxxx xxxxxx xxxx xxx xxxxx x&xxxx;xxxxxxxxxxx, xxxxxx xxx nutné xxxxx xxxxxxxxx účinnosti. X&xxxx;xxxxxxx xxxxxxx xxxxx xxxxxxxxx na účinnost xxxxxxx x&xxxx;xxxxxx&xxxx;XX xxxxxxx&xxxx;XX.
8.5&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxx xxxxx na xxx
Xxxxx oddíl xxxxxxx&xxxx;XX xx xxxxxxx podle xxxxxxxxxx čl. 7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) č. 1831/2003.
9. ZMĚNA XXXXXXXX
Xxxxxxx xx možno xxxxxx hodnocení xxxxx xxxxxxxxxxxx xxx xxxxxxxxx xxxxxxxx, xxxx xxxxxxxxxxx xxxxxxxxxx pro žádost xxxxx čl. 13 xxxx.&xxxx;3 xxxxxxxx (ES) x.&xxxx;1831/2003 xxxxxxxx pouze níže xxxxxxx xxxxxxxxx.
Xxxxxx x&xxxx;xxxxx xxxxxxxx xxxxxxxxxx ve xxxxxxxxxx xxxxxxxx, xxxx. xxxxxxxxxxxx, charakteristika xxxx xxxxxxxx pro užití xxxxxxxxx xxxxx, xxxx xxxxxxxx, xx xxxxx xxxx xxxxx xxxxxxxx xxxxxx xxx cílový xxxx, xxxxxxxxxxxx, uživatele xxxx xxxxxxx prostředí. Xx tímto xxxxxx xx xxxxx doplňkovou xxxxx považovat xx xxxxxxxx, xxxxx xxxxxx xxxxx(x)&xxxx;xxxx xxxxxxx(x)&xxxx;x&xxxx;xxxxxxxx xxx xxxxx jsou xxxxxx, xxxx xxxxxxx xx x&xxxx;xxxxxx xxxxxxx a nebyly xxxxxxx žádné xxxx xxxxxx, xxxxx by xxxxxxxxxx obavy. Xxx xxxxxxxx xxxxxxxx je xxxxx xxxxx zkrácenou xxxxxx, jelikož obvykle xxxxxx nutné opakovat xxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxxx xxx xxxxxx xxxx, xxxxxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxx.
Xxxxxx musí xxxxxxxx xxxx xxxxxxxxx:
|
1. |
xxxxxxx xx xxxx příloha I – xx xxxxxxxx xxxxx x&xxxx;xxxxxxxxxx xxxxx; |
|
2. |
xxxxxxx xx celý xxxxx&xxxx;XX xxxxxxx&xxxx;XX; |
|
3. |
xx nutno xxxxxxxxxx xxxxx, xxxxx xxxxxxxxx, xx xxxxxxxx xxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx xxxx x&xxxx;xxxxxx stejné xxxx x&xxxx;xxxxxxx xxxxxxxx; |
|
4. |
xxxxxxxxx xx xxxxx xxxxxxxxx xxxxxx x&xxxx;xxxxxxxxxxxxxx, x&xxxx;xx xx xxxxxxx xxxxxxxxxxx, zveřejněné xxxxxxxxxx xxxx xxxxxxxxxx xxxxxx. Není-li xxxxxxxxxxxxxx xxxx prokázána, je xxxxx prokázat xxxxx xxxxxxxx xxxxx x&xxxx;XXX; |
|
5. |
xx xxxxx xxxxxxxxx důkaz, xx xx xxxxxxxxxx xxxxxxxxx poznatků xxxxxxx xxxxxxxxx xxxxx xx xxxxxxxxxxx xxxxxxxx xxxxxxxx xxx cílové xxxxx, xxxxxxxxxxxx, xxxxxxxxxx a životní xxxxxxxxx; |
|
6. |
xx nutno předložit xxxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx uvedení xxxxx xx xxx, xxxx-xx xxxxxxxx xxxxxxxxx xx xxxxxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxx; a |
|
7. |
je xxxxx xxxxxxxxx xxxxxxxx xxxxx x&xxxx;xxxxxxxx žádosti o změnu x&xxxx;xxxxxxx x&xxxx;xxxxxxxxxxx xxxxxx xxxxxx&xxxx;XXX, IV a V přílohy II. |
10. OBNOVENÍ XXXXXXXX
Xxxxxxx o obnovení xxxxxxxx xxxxx článku 14 xxxxxxxx (XX) x.&xxxx;1831/2003 xxxxxxx xxxx xxxxxxxxx:
10.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx xx xxxx xxxxx&xxxx;X&xxxx;xxxxxxx&xxxx;XX. Xxxxxxxx xx xxxxx xxxxxxxxx xxxxxxxx Xxxxxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxx látky xx trh xxxx xxxxxxxx obnovení xxxxxxx. Xxxxxxxx xx aktualizovaná xxxxxxxxxxx podle nejnovějších xxxxxxxxx x&xxxx;xxxxxxxx xx xxxxxx s uvedením xxxxx xxxx oproti xxxxxxxxx xxxxxxxx nebo poslednímu xxxxxxxx xxxxxxxx. Xxxxxxx xxxx předložit xxxxxxx xxxxxxxxxxx, xxxxx xxxxxxxx xxxxxx žádosti, x&xxxx;xxxxxxxx xxxx xxxxxxxxx, xxxxx xx xxxxx xxxxxxxxxx xx xxxx xxxxxxx xxxxxxxxxxx xxxxxxxx/xxxxxxxx povolení x&xxxx;xxxxxxx xx identitu x&xxxx;xxxxxxxxxx.
10.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxxxx, xxxxxxxxxxxxxxx x&xxxx;xxxxxxxx xxx užití xxxxxxxxx xxxxx; metody xxxxxxx
Xxxxx&xxxx;XX přílohy II se xxxxxxx xxxxx:
|
— |
xxx doplňkové xxxxx, xxxxx xxxx xxxxxx xx xxxxxxxx xxxxxxxx, xx použije xxxx oddíl II, |
|
— |
pro xxxx xxxxxxxxx látky xx xxxxxxx xxxx&xxxx;2.1.2, 2.1.3, 2.1.4, 2.1.4.2, 2.2, 2.3.1, 2.3.2, 2.4.1, 2.4.2, 2.4.4, 2.5, 2.6. |
Xx xxxxx předložit xxxxxx, xxxxx xxxxxxxxx, xx se xxxxxxxxx xxxxx xxxxxxxx xxxxxxxxx, xxxxx xxx x&xxxx;xxxxxxx, xxxxxxx xxxx xxxxxxxx, xxxxxx povolené xxxxxxxxx xxxxx. Je nutno xxxxxxx xxxxxxxxxx xxxxx xxxxxxxxx xxxxxxx.
10.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Studie xxxxxxxx se bezpečnosti xxxxxxxxxxx xxxxx
Xxxx být xxxxxxxxx xxxxx, že xx xxxxxxxxxx xxxxx xxxxxxxx xxxxxxx xxxxxxxxx xxxxx za xxxxxxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxx xxxx, xxxxxxxxxxxx, xxxxxxxxxx a životní prostředí. Xxxx xxx předložena xxxxxxxxxxxxx xxxxxxxxxxx o bezpečnosti xx xxxxxx od xxxxxxx původního xxxxxxxx xxxx xx posledního xxxxxxxx xxxxxxxx, xxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxx:
|
— |
xxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxx, xxxxxx xxxxxxxxxx xxxx (xxxxx xxxxxxx účinky, závažné xxxxxx xxxxx xxxxx, xxxxxxx xxxxxx xxxxxxx xxxxxx) u cílových xxxxxx, xxxxxxxxxxxx, uživatelů a v životním xxxxxxxxx. Xxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxx xxxx xxxxxx xxxxxx xxxxxx, xxxxx xxxxxxxxxxx xxxx/xxxxxx, výsledek, xxxxxxxx xxx užití x&xxxx;xxxxxxxxx xxxxxxxx souvislosti, |
|
— |
zprávy x&xxxx;xxxxx neznámých xxxxxxxxxxx x&xxxx;xxxxxxxxx kontaminacích, |
|
— |
údaje x&xxxx;xxxxxxxxxxxx xxxxxxx, je-li xx xxxxx, |
|
— |
xxxxx x&xxxx;xxxxxxxxxxxxxxxxx/xxxxxxxxxxxxxxxxx x/xxxx xxxxxxxxxxxxxxx xxxxxx, |
|
— |
xxxxxxxxx xxxxx xxxxxxxxx xxxxxxxx xx xxxxxxxxxxx doplňkové látky x&xxxx;xxxxx xxxxxxxxx xxxxx xxx xxxxxxx, xxxxxxx x&xxxx;xxxxxxx xxxxxxxxx. |
Xxxxx xxxxxx xxxxxxxxxx xxxxx další xxxxxxxxx x&xxxx;xxxxxxxx z těchto xxxxxxx, xxxx xx xxx xxxxxx odůvodněno.
Zpráva x&xxxx;xxxxxxxxxx xxxxxxxx xxxxxxxxxxxx x&xxxx;xxxxxx po uvedení xxxxx xx xxx xx xxxxxxxx, xx-xx xxxxxxxx xxxxxxxxx na xxxxxxxxxxxx xxxxxxx v předchozím xxxxxxxx.
Xxxxx xxxxx ustanovení xx.&xxxx;14 odst. 2 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003 žádost x&xxxx;xxxxxxxx povolení zahrnuje xxxxx xx xxxxx xxxx doplnění xxxxxxxx xxxxxxxxx povolení, xxxx xxxx podmínek xxxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxx, xx xxxxx xxxxxxxxx xxxxxxxx xxxxx xx xxxxxxx xxxxxx xx xxxxx x&xxxx;xxxxxxx s příslušnými xxxxxx xxxxxx&xxxx;XXX, IV x&xxxx;X&xxxx;xxxxxxx&xxxx;XX.
11.&xxxx;&xxxx;&xxxx;XXXXXXXXXXXX XXXXXXXXX XXXXXXXXXXX XXXXX, XXXXX JIŽ XXXX XXXXXXXX PODLE XXXXXXXX 70/524/EHS
Doplňkovými látkami, xxxxx xx xxxx xxxxx bod 11, jsou xxxxxxxxx xxxxx, xxxxx xxx xxxx povoleny xxxxx xxxxxxxx 70/524/EHS x&xxxx;xxxx xxx xxxxxxxxxxxx x&xxxx;xxxxxxx s čl. 10 odst. 2 xxxxxxxx (XX) x.&xxxx;1831/2003 x&xxxx;xxxxx xxxxx xx xxxxxx xxxxxx:
|
— |
xxxxxxxxxxxx xxxxx, |
|
— |
xxxxxxxxxxx x&xxxx;xxxxxxxxxxx látky, |
|
— |
emulgátory x&xxxx;xxxxxxxxxxxxx, xxxxxxxxxxx xxxxx x&xxxx;xxxxxxxxxx xxxxx, |
|
— |
xxxxxxx, včetně pigmentů, |
|
— |
konzervanty, |
|
— |
vitamíny, xxxxxxxxxxx x&xxxx;xxxxxxxx xxxxxx xxxxxxxxxx xxxxx xx xxxxxxxxxxxx xxxxxxx, |
|
— |
xxxxxxx prvky, |
|
— |
pojiva, xxxxxxxxxxxx xxxxx a koagulanty; |
|
— |
regulátory xxxxxxxxx a |
|
— |
radionuklidní xxxxxx. |
Xxxxxx x&xxxx;xxxxxxx xxxxxxxxxxx rizik x&xxxx;xxxxxx doplňkových xxxxx xxxx být xxxxxxx xxxx x&xxxx;xxxxxx xxxxxxxxxxx xxxxx. Xxxxx xxxxxxxx x&xxxx;xxxxxx historii jejich xxxxxxxxxx xxxxxxxxx xx xxxxx xxxxxx údaje x&xxxx;xxx zveřejněných studií xxxxx ustanovení xxxxxx xxxxxxxx, aby bylo xxxxxxxxx, xx xx xxxxxxxxxxx podmínek xxxxxxxxx xxxxx zůstává xxxxxxxx xxx xxxxxx xxxxx, xxxxxxxxxxxx, xxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxx.
11.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx se xxxx xxxxx&xxxx;X&xxxx;xxxxxxx&xxxx;XX.
11.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Identita, xxxxxxxxxxxxxxx x&xxxx;xxxxxxxx xxx xxxxx xxxxxxxxx xxxxx; xxxxxx xxxxxxx
Xxxxx&xxxx;XX xxxxxxx&xxxx;XX xx použije xxxxx:
|
— |
xxx xxxxxxxxx xxxxx, které xxxxxx xxxxxx na xxxxxxxx povolení, xx xxxxxxx xxxx&xxxx;2.1.2, 2.1.3, 2.1.4, 2.1.4.2, 2.2, 2.3.1, 2.3.2, 2.4.1, 2.4.2, 2.4.4, 2.5, 2.6, |
|
— |
xxx xxxx xxxxxxxxx xxxxx, xxxxx xxxx xxxxxx xx xxxxxxxx xxxxxxxx, xx použije xxxx xxxxx&xxxx;XX. |
11.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Xxxxxx xxxxxxxx xx bezpečnosti xxxxxxxxxxx látek
Pokud byla xxxxxxxxx xxxxx posouzena x&xxxx;xxxxxxx xx xxxxxxxxxx xxx xxxxxx xxxxx, xxxxxxxxxxxx, xxxxxxxxx/xxxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxx, xxxxxxxx xx xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxxxx xxx předchozí xxxxxxxx x&xxxx;xxxxxxxx xxxx xxxxxxxxx, xxxxx byly xxxxxxx xx xxxx xxxxxxx xxxxxxxxxxx povolení. Xxxxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxx xxxxx xxxxx xxxx doplňkové xxxxx, xxx xxxxxx studie x&xxxx;xxxxx z vědecké xxxxxxxxxx, xxxxxxxx jsou xxxxxxxxxx xxxxxx, xxxxx xx xx xxxxxxxxxx x&xxxx;xxxx xxxxxxx. V opačném případě xx předloží xxxxx xxxxxx xxxxxx bezpečnosti.
11.4 Oddíl IV: Xxxxxx xxxxxxxx se xxxxxxxxx xxxxxxxxx látky
Shodu x&xxxx;xxxxxxxxx xx xxxxxxxx xxxxx xx.&xxxx;5 odst. 3 xxxxxxxx (ES) x.&xxxx;1831/2003 xx xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx jiných xxxxxxxxx než studie, xxxxxxx xxxxxxxxxx xx xxxxxx historie používání.
11.5 Oddíl V: Plán xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxx xxxxx na xxx
Xxxxx xxxxx xxxxxxx&xxxx;XX xx xxxxxxx xxxxx xxxxxxxxxx xx.&xxxx;7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003.
(1)&xxxx;&xxxx;Xxxxxxxx xxxxx xx xxxxxxxx xxxxx, xxxxx xxxx xxxxxxxxxx součástí organismu, xxxx je xxxx xxxxx xxxxxxxx. Může xxxxxxxxx rovněž xxxxx, xxxxx xxxx xxxxxxxx x&xxxx;xxxxxx vyšších xxxxxxxxxxxxx, xxx xx xxxxxxx.
(2)&xxxx;&xxxx;Xxx xxxxx xxxxxx xxxxxxxx xx „silážním procesem“ xxxxxx xxxxxx, xxx xxxx xx xxxxxxxxx xxxxxxxxxxxxxx organické xxxxx xxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxxx xx xxxxxxx xxxxxxxxx xxxxxxxxxx a/nebo xxxxxxx xxxxxxxxxxx xxxxx x&xxxx;xxxxxxxxxx.
(3)&xxxx;&xxxx;Xxxxxxxxxxxxx xxxxx pro xxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxx používané ve XXXXXX, xxxxxxxxxxx systému XX xxx xxxxxxxxxxx xxxxx, xxxxxxxx v nařízení Xxxxxx (XX) x.&xxxx;1565/2000 xx dne 18.&xxxx;xxxxxxxx 2000 (Xx.&xxxx;xxxx. X&xxxx;180, 19.7.2000 s. 8), xxxxxx xx xxxxxxx opatření xxxxxxxx xxx xxxxxxx xxxxxxxx xxxxxxxxx podle xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx (XX) č. 2232/96 (Xx.&xxxx;xxxx. X&xxxx;180, 19.7.2000 x.&xxxx;8).
(4)&xxxx;&xxxx;X.&xxxx;Xxxx Evropy: xxxxx Xxxx Evropy xxxxxxxxx xxx xxxxxxxxx definované xxxxxxxx xxxxxx k aromatizaci xx xxxxxx Xxxx Xxxxxx x.&xxxx;1 „Xxxxxxx xxxxxxx xx xxxxxxxxxxx“, xx.&xxxx;X,&xxxx;Xxxxxxxxx&xxxx;2000 a následujících xxxxxxxx.
(5)&xxxx;&xxxx;Xxxxx XXX (x.&xxxx;XXX) Registrační xxxxx xxxxx Xxxxxxxx Xxxxxxxxx Xxxxxxx, jednoznačný xxxxxxxxxxxxx xxxxxxxxxx látek xxxxx xxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxx xxxxx.
(6)&xxxx;&xxxx;Xxx účely xxxxxx xxxxxx xxxxxxxx xx „toxikologicky xxxxxxxxx xxxxxx“ xxxxxx xxxxx x&xxxx;xxxxxxxxxx denním xxxx xxxxxxxx xxxxxxx (TDI xxxx TWI), ADI, xxxx x&xxxx;xxxxxxxx, xxxxx xxx o její používání, xxxx účinná složka, xxx je xxxxxxxxx xx xxxxxxxx Xxxx 88/388/XXX xxxxxxxx xx xxxxx xxxxxxxx x&xxxx;xxxxxxxxxxx xxx xxxxxxx x&xxxx;xxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxx pro xxxxxx xxxxxx, nebo xxxxxxxxx xxxxx.
(7)&xxxx;&xxxx;Xxxxxxxxx x&xxxx;xxxxxxx&xxxx;4 xxxxxx Xxxx Xxxxxx x.&xxxx;1 „Natural sources xx flavourings“, xx.&xxxx;X,&xxxx;Xxxxxxxxx, 2000.
(8)&xxxx;&xxxx;XXXXX (XXX/XXX, 1996, Xxxx additive xxxxxx 35, IPCS, WHO Xxxxxx) xxxxxxxxxxxx xxxxxxx xxxxxxx xxx xxxxxx xxxxx xx xxxx xxx xxxxxxxx s přihlédnutím x&xxxx;xxxxxxxxx zvířete x&xxxx;xxxxxx xxxxxx.
(9)&xxxx;&xxxx;Xx.&xxxx;xxxx. L 180, 19.7.2000, x.&xxxx;8.
(10)&xxxx;&xxxx;Xxxxx xxx xxxxxxxxx xxxxxxxxxxx xxxxxx reziduí xxx Xxxxxxxxxx x&xxxx;xxxxxxx xxxx. Evropská xxxxxxxx xxx xxxxxx přípravky. Xxxxxxxxxx Xxxxxxxxx Xxxxxxxxxx Xxxx. XXXX/XXXX/153x/97-XXXXX.
XXXXXXX XX
Xxxxxxxxx a definice xxxxxxxx xxxxxx x xxxx o minimální xxxx trvání xxxxxx xxxxxxxxx
1. Xxxxxxx. Xxxxxxxxx xxxxxx: xxxxxxx
|
Xxxxxxxxx |
Xxxxxxxx xxxxxxxxx xxxxxx |
Xxxxxxxxx xxxx xxxxxx (hmotnost/stáří) |
Minimální xxxx xxxxxx dlouhodobých xxxxxx xxxxxxxxx |
||
|
Xxxxxx/xxxxx |
Xxxxx |
Xxxxxxxx |
|||
|
Xxxxxx (xxxxxx) |
Mladá xxxxxxx xxxxxx xxxxx xx xxxxxxx |
Od narození |
Až xx 21–42 xxx |
Xx do 6–11 xx |
14 xxx |
|
Xxxxxx (odstavená) |
Xxxxx xxxxxxx xx xxxxxxxx xxxxxx xxxx xxxxxxx x xxxxxxxxxx xxxx xxx xxxxxx xxxxxxxx |
Xx 21–42 xxx |
Xx xx 120 xxx |
Xx do 35 xx |
42 xxx |
|
Xxxxxx (xxxxxx a odstavená xxxxxx) |
Xxxxx xxxxxxx xx narození xxxxxxx k reprodukci nebo xxx masnou xxxxxxxx |
Xx xxxxxxxx |
Xx xx 120 xxx |
Xx xx 35 xx |
58 dní |
|
Xxxxx prasat |
Prasata xx xxxxxxx určená x xxxxx xxxxxxxx xx xx xxx odvozu xx jatky |
Xx 60–120 xxx |
Xx xx 120–250 dní (xxxx xxxxx xxxxxxxx xxxxxxxxx) |
80–150 kg (xxxx xxxxx místních xxxxxxxxx) |
Xx do xxxxxxx xxxxxxxxx, xxxxxxx však 70 xxx |
|
Xxxxxxxx xxxxxx k reprodukci |
Xxxxxx xxxxxxx, xxxxx xxxx xxxxxxx jednou xxxxxxxxxxxx/xxxxxxxxxx |
Xx xxxxx xxxxxxxxxx |
|
|
Xx xxxxxxxxxx xx xxxxx odstavu xxxxxxx xxxx (xxx xxxxx) |
|
Xxxxxxxx xxxxxx k reprodukci xxxxx |
Xxxxxx xxxxxxx, které xxxx xxxxxxx xxxxxx xxxxxxxxxxxx/xxxxxxxxxx |
|
|
|
Xxxxxxx xxx xxxxx xxxx porodem xx xxxxx xxxx odstavu |
2. Tabulka. Xxxxxxxxx xxxxxx: xxxxxx
|
Xxxxxxxxx |
Xxxxxxxx xxxxxxxxx xxxxxx |
Přibližná doba xxxxxx (hmotnost/stáří) |
Xxxxxxxxx xxxx xxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx |
||
|
Xxxxxx |
Xxxxx |
Xxxxxxxx |
|||
|
Xxxxx xxxxx |
Xxxxxx xxxxxx xxx výkrm |
Od xxxxxxxxx |
Až xx 35 xxx |
Až xx ~1 600 g (až do 2 xx) |
35 xxx |
|
Odchov xxxxx x xxxxxx |
Xxxxxxxx chované xxx xxxxxxxx xxxxxxxx xxxxx xxxx xxx xxxxxx xxxxx |
Xx vylíhnutí |
Až do ~16 xxxxx (xx do 20 xxxxx) |
— |
112 xxx (xxxxxx-xx xxxxx o účinnosti x xxxxxxxxx xxx xxxxx xxxxx) |
|
Xxxxxxx |
Xxxxxxx ve xxxxxx xxxxxxx xxx xxxxxxxx xxxxx |
Xx 16–21 xxxxx |
Xx do ~13 xxxxx (xx do 18 měsíců) |
Od 1 200 x (xxxx), 1 400 x (xxxxx) |
168 dní |
|
Výkrm krůt |
Xxxxx x xxxxxxx xxxxxxx xx xxxxx |
Xx xxxxxxxxx |
Xx do ~14 xxxxx (xx xx 20 xxxxx) Xx xx ~16 týdnů (xx do 24 xxxxx) |
Xxxxxx: xx xx ~7 000 x (xx xx 10 000 g) Samci: až xx ~12 000 x (xx xx 20 000 x) |
84 xxx |
|
Xxxxx xxx xxxxx plemenitby |
Xxxxx a krocani xxxxxxx pro účely xxxxxxxxxx |
Xxxx xxxxxx |
Od 30 týdnů xx xx ~ 60 xxxxx |
Xxxxxx: xx ~15 000 x Xxxxx: xx ~30 000 x |
Xxxxxxx xxxx xxxxxx |
|
Xxxxxx krůt |
Mladé xxxxx x xxxxxxx xxxxxx x xxxxxxx xxxxxx |
Xx xxxxxxxxx |
Až xx 30 xxxxx |
Xxxxxx: xx xx ~15 000 x Xxxxx: xx xx ~30 000 x |
Celé xxxxxx (xxxxxx-xx údaje x xxxxxxxxx k dispozici xxx xxxxx xxxx) |
3. Tabulka. Xxxxxxxxx xxxxxx: xxxx (xxxxxx xxxx, xxxxxx xxxxx xxxxxxx x xxxxx)
|
Kategorie |
Xxxxxxxx kategorie xxxxxx |
Xxxxxxxxx doba trvání (xxxxxxxx/xxxxx) |
Xxxxxxxxx xxxx xxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx |
||
|
Xxxxxx |
Stáří |
Xxxxxxxx |
|||
|
Xxxxxx xxxxx |
Xxxxxx xxxxxxx xxx xxxxxxxxxx xxxx xxxxxxxx xxxxxxxx xxxx |
Xx xxxxxxxx |
Xx xx 4 xxxxxx |
Xx xx 60–80 xx (až xx 145 xx) |
56 xxx |
|
Xxxxx xxxxx |
Xxxxxx pro xxxxxxxx xxxxxxxx xxxx |
Xx xxxxxxxx |
Xx xx 6 xxxxxx |
Xx xx 180 kg (až do 250 xx) |
Xx porážky, xxxxxxx xxxx 84 dní |
|
Výkrm skotu |
Xxxx xx odstavu xxxxxx x xxxxx produkci xx xxx odvozu xx xxxxx |
Xx xxxxxxx xxxxxxx xxxxxxxxxxxx |
Xx xx 10–36 xxxxxx |
Až xx 350–700 kg |
168 dní |
|
Dojnice xxx xxxxxxxx xxxxx |
Xxxxxx xxxxx, xxxxx porodily nejméně xxxxx xxxx |
|
|
|
84 xxx (je xxxxx uvést xxxx xxxxxx laktace) |
|
Xxxxx k reprodukci |
Samice xxxxx, xxxxx xxxx xxxxxxx xxxxxx xxxxxxxxxxxx/xxxxxxxxxx |
Xx xxxxx inseminace xx xxxxx xxxxxxx xxxxxxx |
|
|
Xxx xxxxx (xxxxx xx xxxxxxxx reprodukční xxxxxxxxx) |
4. Xxxxxxx. Xxxxxxxxx xxxxxx: xxxx
|
Xxxxxxxxx |
Xxxxxxxx xxxxxxxxx xxxxxx |
Přibližná xxxx xxxxxx (hmotnost/stáří) |
Minimální doba xxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx |
||
|
Xxxxxx |
Xxxxx |
Xxxxxxxx |
|||
|
Xxxxxx xxxxxx |
Xxxxxxx chovaná xxx xxxxxxx reprodukci |
Xx xxxxxxxx |
Xx xx 3 měsíců |
15–20 kg |
56 xxx |
|
Xxxxx xxxxxx |
Xxxxxxx xxxxxxx xxx xxxxxxxx jehněčího xxxx |
Xx xxxxxxxx |
Xx do 6 xxxxxx (xxxx xxxxxx) |
Xx do 55 xx |
Xx xxxxxxx hmotnosti, xxxxxxx však 56 xxx |
|
Xxxx xxxxxx k produkci xxxxx |
Xxxx, xxxxx xxxxxxxx xxxxxxx xxxxx xxxxx |
|
|
|
84 xxx (xx xxxxx xxxxx xxxx xxxxxx laktace) |
|
Xxxxxxx k reprodukci |
Xxxxxx xxxx, které xxxx xxxxxxx xxxxxx xxxxxxxxxxxx/xxxxxxxxxx |
Xx xxxxx xxxxxxxxxx xx xxxxx xxxxxxx odstavu |
|
|
Dva xxxxx (xxxxx xx xxxxxxxx xxxxxxxxxxx xxxxxxxxx) |
5. Tabulka. Xxxxxxxxx xxxxxx: xxxx
|
Xxxxxxxxx |
Xxxxxxxx xxxxxxxxx zvířat |
Xxxxxxxxx doba xxxxxx (xxxxxxxx/xxxxx) |
Minimální xxxx xxxxxx dlouhodobých xxxxxx xxxxxxxxx |
||
|
Xxxxxx |
Xxxxx |
Xxxxxxxx |
|||
|
Xxxxxx xxxxxx |
Xxxxx xxxx xxxxxxx xxx xxxxxxx xxxxxxxxxx |
Xx xxxxxxxx |
Až do 3 xxxxxx |
15–20 xx |
Xxxxxxx 56 xxx |
|
Xxxxx kůzlat |
Mladé xxxx xxxxxxx xxx xxxxxxxx xxxxxx xxxx |
Xx xxxxxxxx |
Xx do 6 měsíců |
|
Xxxxxxx 56 xxx |
|
Xxxx xxxxxx x xxxxxxxx xxxxx |
Xxxx xxxxxxx x xxxxxx xxxxxxxx |
|
|
|
84 xxx (je xxxxx xxxxx xxxx xxxxxx xxxxxxx) |
|
Xxxx x xxxxxxxxxx |
Xxxxxx xxxx, xxxxx byly xxxxxxx xxxxxx xxxxxxxxxxxx/xxxxxxxxxx |
Od xxxxx xxxxxxxxxx xx konce xxxxxxx odstavu |
|
|
Xxx cykly (xxxxx xx xxxxxxxx xxxxxxxxxxx xxxxxxxxx) |
6. Xxxxxxx. Kategorie xxxxxx: ryby
|
Xxxxxxxxx |
Definice kategorie xxxxxx |
Xxxxxxxxx doba xxxxxx (xxxxxxxx/xxxxx) |
Xxxxxxxxx doba xxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx |
||
|
Xxxxxx |
Xxxxx |
Xxxxxxxx |
|||
|
Losos x xxxxxx |
|
|
|
200–300 x |
90 xxx xxxx do xxxx, xxx se xxxxxxx tělesná xxxxxxxx xxxxxxxxxxx |
|
Xxxxx a pstruh |
Xxxxx xxxxxxxxx xxx |
Xxxxx možno co xxxxxxxx xxxx xxxxx |
|
|
90 dní |
7. Xxxxxxx. Xxxxxxxxx xxxxxx: xxxxxxx
|
Kategorie |
Definice xxxxxxxxx xxxxxx |
Xxxxxxxxx doba xxxxxx (xxxxxxxx/xxxxx) |
Xxxxxxxxx xxxx xxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx |
||
|
Xxxxxx |
Xxxxx |
Xxxxxxxx |
|||
|
Xxxxxx a odstavení xxxxxxx |
|
Xxxxxxxx xx xxxxxxx týdne xx xxxxxxxx |
|
|
56 xxx |
|
Výkrm xxxxxxx |
Xxxxxxx xxxxxxx xxx xxxxxx xxxxxxxx |
Xx xxxxxxx |
Až xx 8–11 xxxxx |
|
42 xxx |
|
Xxxxxx králice (xxx xxxxxxxxxx) |
Xxxxxxx, xxxxx xxxx xxxxxxx xxxxxx inseminovány/připuštěny |
Od xxxxxxxxxx do xxxxx xxxxxxx xxxxxxx |
|
|
Xxx cykly (xxxxx se požadují xxxxxxxxxxx xxxxxxxxx) |
|
Xxxxxx xxxxxxx xxxxxx x xxxxxxxx xxxxxxx xxxxxxx |
Xxxxxxx, xxxxx xxxx xxxxxxx xxxxxx xxxxxxxxxxxx |
Xx xxxxx xxxxxxxxxx |
|
|
Xxxxxxx 2 xxxxx xxxx porodem do xxxxx xxxx odstavu (xxxx. xxx produkt mikroorganismů) |
8. Xxxxxxx. Xxxxxxxxx xxxxxx: xxxx
|
Xxxxxxxxx |
Definice xxxxxxxxx zvířat |
Xxxxxxxxx xxxx xxxxxx (hmotnost/stáří) |
Xxxxxxxxx xxxx xxxxxx dlouhodobých xxxxxx xxxxxxxxx |
||
|
Xxxxxx |
Xxxxx |
Xxxxxxxx |
|||
|
Xxxx |
Xxxxxxx xxxxxxxxx |
|
|
|
56 dní |


