XXXXXXXXX NAŘÍZENÍ XXXXXX (XX) 2018/1660
ze xxx 7. xxxxxxxxx 2018,
xxxxxx se xxxxxxxx xxxxxxxx podmínky xxx xxxxx některých xxxxxxxx xxxxxx xxx xxxxxxxxxxx původu z některých xxxxxxx xxxx x xxxxxx xxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxx, xxxxxx xx xxxx nařízení (ES) x. 669/2009 a zrušuje xxxxxxxxx xxxxxxxx (XX) x. 885/2014
(Xxxx x xxxxxxxx xxx XXX)
XXXXXXXX KOMISE,
s ohledem na Xxxxxxx o fungování Xxxxxxxx xxxx,
x xxxxxxx na nařízení Xxxxxxxxxx parlamentu a Rady (XX) x. 178/2002 xx xxx 28. xxxxx 2002, xxxxxx xx xxxxxxx xxxxxx xxxxxx a požadavky xxxxxxxxxxxxx xxxxx, xxxxxxx se Xxxxxxxx úřad xxx xxxxxxxxxx potravin a stanoví xxxxxxx xxxxxxxx se xxxxxxxxxxx xxxxxxxx (1), a zejména xx xx. 53 odst. 1 xxxx. x) bod xx) xxxxxxxxx xxxxxxxx,
x xxxxxxx xx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (ES) x. 882/2004 xx xxx 29. xxxxx 2004 x xxxxxxxx kontrolách xx účelem ověření xxxxxxxxxx právních xxxxxxxx xxxxxxxxxx se xxxxx x xxxxxxxx a pravidel o zdraví xxxxxx x xxxxxxx životních xxxxxxxxxx zvířat (2), x xxxxxxx xx xx. 15 xxxx. 5 xxxxxxxxx xxxxxxxx,
vzhledem x xxxxx xxxxxxx:
|
(1) |
Xxxxxx 53 nařízení (XX) x. 178/2002 xxxxxxx x xxxxx xxxxxxx xxxxxxxx xxxxxx, xxxxxx zvířat x xxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxx x xxxxxxxx x xxxxx xxxxxxxxxx xx třetí xxxx xxxxxx xxxxxxxxx xxxxxxxx Unie, xxxxx xx xxxxxx, že xxxxxxx potraviny xxxx xxxxxx mohou xxxxxxxxxxxx xxxxx xxxxxx xxx xxxxxx zdraví x xxxxxx xxxxxx, x xxxxx se xxxxx x xxxxx rizikem xxxxxxx xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxx. Xxxx xxxxxxxxx opatření Unie xxxxx xxxxxxxx v uložení xxxxxxxxxx xxxxxxxx pro xxxxx xxxxxxxxx produktů. |
|
(2) |
Xxxxxxxx Xxxxxx (ES) č. 669/2009 (3) xxxxxxx zesílené xxxxxx xxxxxxxx xxxxxx xxxxx x xxxxxxxx xxxxxx než xxxxxxxxxxx xxxxxx xxxxxxxxx x xxxxxxx X xxxxxxxxx xxxxxxxx. X xxxxxxx xxxxxxx xxxx xxxxxxxx listy révy xxxxx x Xxxxxxx x xxxxxxxx (xxxxx ovoce) x Xxxxxxxx, xxxxxxxx se xx xx xxxxx xxxxxxxx xxxxxx xxxxxxxx. |
|
(3) |
Xxxxxxxx xxxxxxxx xxxxxxx, xxx členské xxxxx provedly x xxxxx xxxxxxxx (ES) č. 669/2009, xxxxx xxxxxxxxxxx z oznámení xxxxxxxxx xxxxxxxxxxxxxxx systému xxxxxx výměny xxxxxxxxx xxx xxxxxxxxx x xxxxxx, xxxxxxxxx xxxxxxxxx (XX) x. 178/2002, xxxxxxx zprávy Xxxxxx, xxxxxx xxxxxxxx xx xxxxxxx zemí x xxxxxx xxxxxxxxx mezi Xxxxxx, xxxxxxxxx xxxxx x Xxxxxxxxx úřadem xxx xxxxxxxxxx potravin xxxxxx x xxx, xx x xxxxx xxxx xxxxx z Turecka xxxxxx dochází x xxxxxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxx xxxxxxxxx stanovených x xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 396/2005 (4). Xxx po xxxxxxx xxxxxxxx xxxxxxx xx xxxxxxxxx Xxxx xxxxx xxxxxxx xx xxxxxxxx xxxxxxx. |
|
(4) |
Xxxxxxxx xxxxxxxx kontrol, xxx xxxxxxx státy xxxxxxxx x xxxxx xxxxxxxx (XX) x. 669/2009, svědčí x xxx, xx x xxxxxxxx (xxxxxxx xxxxx) x Xxxxxxxx xxxxxxx x xxxxxxx nedodržování xxxxxxxxxxx limitů reziduí xxxxxxxxx xxxxxxxxxxx x xxxxxxxx (XX) x. 396/2005. Xxxxx xxxx xxxxx, xxxxx Xxxxxx v březnu 2017 xxxxxxxx xx Xxxxxxxx x xxxx hodnotil xxxxxxxx xxxxxxxxx x xxxxxxxxxxx rostlinného xxxxxx xxxxxxxx xx xxxxx xx Xxxxxxxx xxxx, xxxxxxx, xx xxxxxxxxxx xxxxx účinný xxxxxx systém kontrol xxxxxxxxx v potravinách xxxxxxxxxx xx Unie x xx xxxxx xxxxxxx xxxxxxx, xx xxxxxxxxxx xxxxxxxx xxxxxxxx maximální limity xxxxxxx, xxxxx xxx x xxxxxxx xxxxxxxxx. |
|
(5) |
To xxxxxxxx, xx xxxxx xxxxx xxxx xxxxx x Xxxxxxx x xxxxxxxx (xxxxxxx ovoce) x Xxxxxxxx xxxx xxxxxxxxxxxx xxxxx xxxxxx xxx xxxxxx zdraví x xx xx s tímto xxxxxxx xxxxx xxxxxxx xxxxxxxxx xxxxxx stávajících xxxxxxxx. Xx proto nezbytné xxxxxxxx zvláštní xxxxxxxx xxxxxx xxxxx xxxx xxxxx z Turecka x xxxxxxxx (xxxxxxx xxxxx) x Xxxxxxxx. |
|
(6) |
Xxxxx xxxxx x Xxxxx x xxxxxxxxxxx xxxxxxxxx zvláštním podmínkám xxxxxx, jež jsou xxxxxxxxx x xxxxxxxxxx xxxxxxxx Xxxxxx (EU) č. 885/2014 (5). X xxxxxxx xx xxxxx xxxxxxxxxxx x xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx xxxxxx xxxxxx informací xxx xxxxxxxxx x xxxxxx x xx xxxxxxxx xxxxxxxx kontrol, xxx provedly xxxxxxx xxxxx v rámci xxxxxxxx (XX) č. 885/2014, jež xxxxxx x xxx, že xxxxxx xxxxxxx k častému xxxxxxxxxxxx xxxxxxxx, by xxxx být xxxxxxxx xxxxxxxx xxxxxx tohoto xxxxxxxx xxxxxxxxx. |
|
(7) |
Xx tudíž xxxxxx xxxxxxxxx, xxx xxxxx xxxxx z Indie, xxxxx xxxx xxxxx x Xxxxxxx x xxxxxxxx (xxxxx xxxxx) x Xxxxxxxx xxxxxxxxx xxxxxxx kontrolám xxxx xxxxxxx xx Xxxx, xxxxxx xxxxxx xxxxxx x xxxxxxx, xxx xx xxxxxxxxx, xx xxxx xxxxxxxx xxxx v souladu x xxxxxxxxxxx xxxxxxxx xxxxxxxxx. Xx všem xxxxxxxx xxxxxxxx produktů by xxxx xxx xxxxxxxxx xxxxxxxxx o zdravotní xxxxxxxxxxxx, x xxxx se xxxxx, xx x xxxxxx produktů xxxx xxxxxxxx xxxxxx x xxxxxxx se xxxxxxxx Xxxxxx 2002/63/XX (6). |
|
(8) |
Xxx xx xxxxxxxxx xxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxx při xxxxxx xx úrovni Xxxx, pokud xxx x xxxxxxxxxx xxxxxxx xxxxxxxxx x xxxxxxx xxxxx x Xxxxx, xxxxxxx révy vinné x Xxxxxxx x x xxxxxxxx (xxxxxx xxxxx) x Xxxxxxxx x xx xxxxxx povrchu, xx xxxxxx xxxxxxxx x xxxxx xxxxxxxx xxxxxxxxx xxxxxxx, xxxxx jsou xxxxxxxxxxxx xxxxxxxxxx kontrolním xxxxxxxx, xxx xxxxxxx xxxxxxxx (XX) č. 669/2009. |
|
(9) |
Xxx xx xxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxxxxxx požadavků, xx xxxxxx xxxxxxxx xxxxxxxx xxxxxxx toho, xxxx xxxxxxxx xx xxxx xxxxxxxx, xxxxx x xxxxxxx nejsou xxxxxxxxx xxxxxxxx xxxxxx vzorků x xxxxxxx xxx osvědčení x xxxxxxxxx nezávadnosti nebo xxxxx xxxx xxxxxxxx xx xxxxxxxxx o zdravotní xxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxx x xxxxx xxxxxxxx. |
|
(10) |
Nařízení (XX) x. 882/2004 xxxxxxxx, xxx xxxxxxxxx xxxxxx xxxxxxxxxx Komisi x xxxxxxxx xxxxxxxx státům xxxxxxx xxxxxxxxx xxxxxxx xx xxxxxxxxx. Pokud xxx o pesticidy, je xxxxxx objasnit, že xxxxx xxxxxxxxx xxxxxx xxxxxxxx xxxxxxx potravin xxxxxxxxx v tomto xxxxxxxx, xxxx xx být xxxxxx xxxxxxxx xxxxxxx x xxxxxxx, že xxxxx xxxxxxx xxxxxxxxx xxxxx xxxxxxx xxxxxxxxx x xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 396/2005, xxx xxxxxx na xx, xxx xxxx překročena xxxxxx xxxxxxxxxx xxxxx. |
|
(11) |
X xxxxx xxxxxxxxxxxxx údajů o průběžném xxxxxxxxx xxxxxx v souvislosti xx xxxxxx, xxxxx xx xxxx xxxx xxxxxxxx, x xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxx xxxxxxx, xx vhodné požadovat, xxx xxxxxxx xxxxx Xxxxxx xxxxxxx ročně xxxxxxxxxxx xxxxxx x xxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxx provedených xxxxx xxxxxx xxxxxxxx. Xxxxxxx xxxxxxx xxxxx xxxxxxxxxx xxxxxxxxxx společný xxxxxxx xxxxxx xxxxxxxxxx se x xxxxxxxx xxxxxxx x xxxxxxxxxx xxxxxx xxx živočišného xxxxxx v obchodním xxxxxxx x xxxxxxxxx xxxxxxx (XXXXXX), xxxxx xxx zřízen xxxxxxxxxxxx Xxxxxx 2003/24/XX (7) x 2004/292/XX (8), xxxx Xxxxxx xxxxxxxxx xxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxxxxxx tímto xxxxxxxxx. Xx xx xxxxx xx xx, xx pokud xxxxxxx xxxxx registrují v TRACES xxxxxxxx xxxxxxx xxxxxxx xxxxxx v souladu s tímto xxxxxxxxx, xxxxxxxxxx xxxxxxxxx xxxx xxxxxxx. |
|
(12) |
Opatření xxxxxxxxx xxxxx nařízením xx xxxx být před 31. xxxxxx 2019 xxxxxxxxxxx xx xxxxxx xxxxxxxxx, zda jsou xxxxx nezbytná. |
|
(13) |
Na xxxxxxxxx xxxxxxxx xxxxxxx x xxxxxxx x xxxxx xxxxxxxxx xx xxxx xxx k dispozici xxxxxxxxx xxxxxxxx xxxxxx. Xxxxxxx xxxxxxxxxxx x xxxxxxxx xxxxxxxx xxxxxxx xx xxxxx xxxx xxxx xxxxxxxxxxxxx potravinářských xxxxxxx xxxxxxxxx xx xxxxxxx. |
|
(14) |
X xxxxx xxxxxxxxxxxxxxxx x xxxxxxxxxxxxxxx platných xxxxxxxx by xxxx xxx x xxxxx xxxxxxxx xxxxxxxxx xxxxxxx zvláštní xxxxxxxx xxx dovoz xxxxx xxxxx z Indie, xxxxx xxxx xxxxx x Xxxxxxx a pitahayi (dračího xxxxx) x Xxxxxxxx, xxxxx xxx o přítomnost xxxxxxx xxxxxxxxx. Xxxxx xx xx x xxxxxxx X xxxxxxxx (XX) x. 669/2009 měly xxxxxxxxx xxxxxxx týkající xx xxxxx xxxx xxxxx x Xxxxxxx a pitahayi (xxxxxxx xxxxx) x Xxxxxxxx x xxxxxxxxx xxxxxxxx (EU) x. 885/2014 xxxxxxxx xx xxxxx curry x Xxxxx xx mělo xxx xxxxxxx. |
|
(15) |
Xxx xxxx hospodářské xxxxxxxx xxxxxxxx xxxx xxxxxxxxxxx se požadavkům xxxxxxxxxx x xxxxx xxxxxxxx, xxxx by xx xxxx xxxxxxxx xxxxxxxx xxx xxx 8. xxxxxxxx 2018. X xxxxx právní xxxxxxx xx xxxxxx xxxxxxxx, xx xx xxxxxxx xxxxx xxxx xxxxx xxxxxxxxxxx xxxxxx xxxxxxx xxxxx zásilek xxxxx xxxx xxxxx x Xxxxxxx, xxxxxxxx (xxxxxxx xxxxx) x Xxxxxxxx x xxxxx xxxxx x Xxxxx, které xxxxxxxx xxxx původu xxxx zemi xxxxxxxx, xxxxx xx uvedená xxxx xxxx xxx xxxx xxxxxx, xxxx 8. xxxxxxxxx 2018, za xxxxxxxxxxx, xx uvedené xxxxxxx splňují xxxxxxxxx xxxxxxxx (XX) x. 669/2009 xxxxxxxx ke xxx 7. xxxxxxxx 2018, xxxxxxxxxx xxxxxxxxxxx xxxxxxxx (EU) x. 885/2014. |
|
(16) |
Xxxxxxxx stanovená xxxxx xxxxxxxxx xxxx x xxxxxxx xx stanoviskem Stálého xxxxxx xxx xxxxxxxx, xxxxxxx, potraviny x xxxxxx, |
XXXXXXX XXXX NAŘÍZENÍ:
Xxxxxx 1
Xxxxxx působnosti
1. Xxxx xxxxxxxx xx vztahuje na xxxxxxx xxxxxxxx jiného xxx xxxxxxxxxxx xxxxxx xxxxxxxxx x xxxxxxx X.
Toto xxxxxxxx xx xxxxxxx xxxx xxx xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx x xxxxxxxx xxxxxxxxx x xxxxxxx X x xxxxxxxx větším xxx 20 %.
2. Xxxx nařízení se xxxxxxxxxx xx xxxxxxx xxxxxxxx, které xxxx xxxxxx xxx soukromé xxxxx pouze xxx xxxxxx spotřebu x xxxxxxx. X xxxxxxx pochybností nese xxxxxxx břemeno příjemce xxxxxxx.
Xxxxxx 2
Xxxxxxxx
Xxx xxxxx xxxxxx xxxxxxxx se xxxxxxx xxxxxxxx xxxxxxx x xxxxxxxx 2 x 3 xxxxxxxx (XX) x. 178/2002 x x xxxxxx 2 xxxxxxxx (XX) č. 882/2004.
Xxxxxxx xx xxxxxx definice „xxxxxxxxxx xxxxxxxxx dokladu“, xxx je stanovena x xx. 3 písm. x) xxxxxxxx (XX) x. 669/2009 x xxxxxxxx „určeného xxxxx xxxxxx“, xxx xx xxxxxxxxx v čl. 3 xxxx. x) xxxxxxxxx xxxxxxxx.
Pro xxxxx xxxxxx nařízení xx „zásilkou“ rozumí „xxxxx“, jak xx xxxxxxxxxx ve xxxxxxxx 2002/63/XX.
Xxx xxxxx čl. 11 xxxx. 3 xx použijí xxxxxxxx xxxxxxxxx v nařízení (XX) č. 396/2005.
Xxxxxx 3
Xxxxx xx Unie
Xxxxxxx xxxxxxxx xxxxxxxxx v čl. 1 xxxx. 1 smějí být xx Xxxx xxxxxxxx xxxxx v souladu x xxxxxxx xxxxxxxxxxx x xxxxx nařízení.
Xxxxxx xxxxxxx xxxxx do Xxxx vstoupit xxxxx x xxxxxxx xxxxx vstupu.
Xxxxxx 4
Xxxxxxxx odběru xxxxxx x xxxxxxx
1. Xx xxxxx zásilce xxxxxxxx uvedených x xx. 1 xxxx. 1 xx xxxxxxx xxxxxxxx odběru vzorků x xxxxxxx, xxx provedly xxxxxxxxx xxxxxx xxxx xxxxxx uvedené v příloze X, xxxx třetí xxxx, xxxxx je xxxxxxx xxxxxxxxx, xxxxx xx uvedená země xxxx než xxxx xxxxxx, xxx se xxxxxxxxx dodržení právních xxxxxxxx Xxxx o maximálních xxxxxxxx reziduí xxxxxxxxx.
2. Odběr xxxxxx xxxxxxx x xxxxxxxx 1 se xxxx xxxxxxxx x xxxxxxx se xxxxxxxx 2002/63/ES.
3. Xxxxxxx xxxxxxxx x xxxxxxxx 1 xxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxxxx x xxxxxxx x xxxxxx ISO/IEC 17025 o „všeobecných xxxxxxxxxxx xx xxxxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxx laboratoří“.
Xxxxxx 5
Xxxxxxxxx x xxxxxxxxx xxxxxxxxxxxx
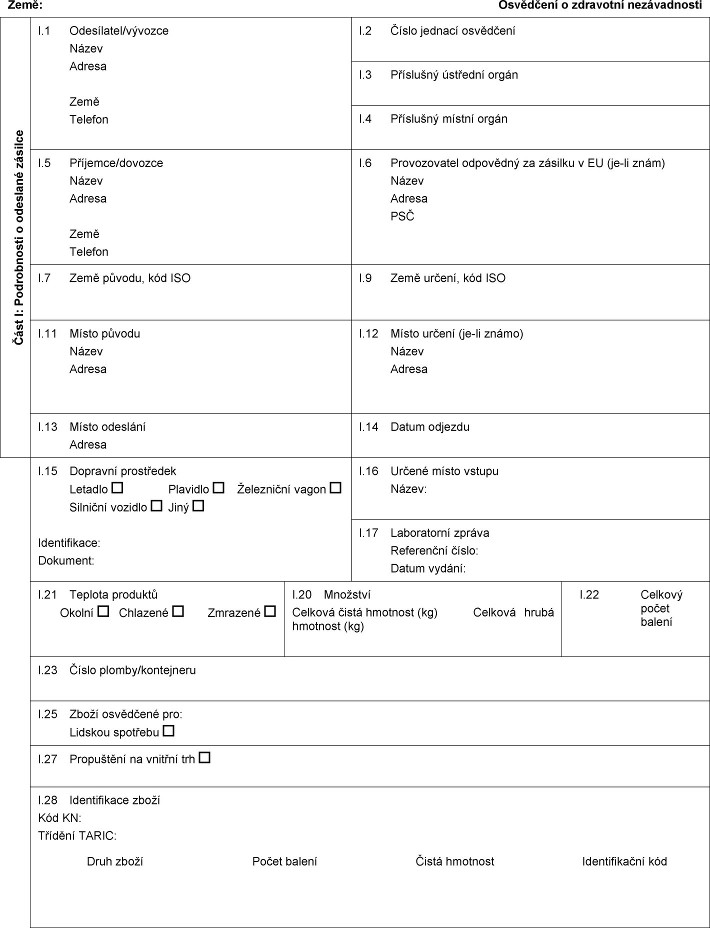
1. Ke xxxxx xxxxxxx xxxxxxxx xxxxxxxxx x xx. 1 xxxx. 1 xx xxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxx nezávadnosti xxxxxxxxxxxx xxxxx xxxxxxxxx x xxxxxxx XX.
2. Xxxxxxxxx o zdravotní xxxxxxxxxxxx xxxxxx, xxxxxxxx x xxxxx xxxxxxxxx xxxxx xxxx xxxxxx xxxx xxxx, odkud xx xxxxxxx xxxxxxxxx, xxxxx xx uvedená země xxxx xxx xxxx xxxxxx.
3. Xxxxxxxxx x xxxxxxxxx xxxxxxxxxxxx xx xxxxxxxxx x xxxxxxx xxxxxx nebo v jednom x xxxxxxxx xxxxxx xxxxxxxxx xxxxx, ve xxxxxx xx xxxxxxx xxxxxx xxxxx vstupu. Xxxxxxx xxxx xxxx xxxx xxxxxxxxx x xxx, xx xxxxxxxxx x xxxxxxxxx xxxxxxxxxxxx xx xxxxxxxxx x xxxxx xxxxxxx xxxxxx Xxxx.
4. Xxxxxxxxx x xxxxxxxxx xxxxxxxxxxxx musí xxx xxxxxx dříve, xxx zásilka, k níž xx vztahuje, přestane xxx xxx xxxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx xx xxxxxx.
5. Xxxxxxxxx x xxxxxxxxx xxxxxxxxxxxx xx xxxxxx xxxxx xx dobu xxxx xxxxxx ode xxx vydání.
6. Xxxxxxxx osvědčení x xxxxxxxxx nezávadnosti xx xxxxxxxx příslušným orgánům x xxxxxxx xxxxx vstupu, xxxxx xx jej xxxxxxxxx.
Xxxxxx 6
Xxxxxxxxxxxx
Xxxxx xxxxxxx potravin xxxxxxxxx x xx. 1 odst. 1 xx xxxxxx identifikačním xxxxx xxxxxxxxxxxxx identifikačnímu xxxx zmíněnému xx xxxxxxxxxx xxxxxx vzorků x xxxxxxx xxxxxxxxx v článku 4 x x xxxxxxxxx x xxxxxxxxx xxxxxxxxxxxx xxxxxxxx x xxxxxx 5. Xxxxxxxx xxxxxxxxxxxxxx xxxxx se xxxxxx xxxxx xxxxx xxxx jiný xxxx xxxxx x xxxxxxx.
Xxxxxx 7
Xxxxxxxxxx xxxxxxx xxxxxx
1. Provozovatelé xxxxxxxxxxxxxxx podniků xxxx xxxxxx xxxxxxxx xxxxxx xxxxxx předpokládané datum x xxx fyzického xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx x xx. 1 xxxx. 1 x xxxx xxxxxxx xxxxxxxxxx xxxxxxx xx xxxxxxx místě xxxxxx.
2. Xxx xxxxx xxxxxxxx xxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx nebo xxxxxx xxxxxxxx xxxx X xxxxxxxxxx vstupního xxxxxxx x xxxxxxx xxxxx doklad xxxxxxxxxx xxxxxxx na xxxxxxx xxxxx vstupu xxxxxxx xxxxx xxxxxxxx xxx xxxx xxxxxxxx xxxxxxxxx zásilky.
3. Xxx xxxxxxxxxx xxxxxxxxxx vstupního xxxxxxx xxxxx xxxxxx nařízení xxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx xxxx jejich xxxxxxxx xxxxxx xx xxxxxxxxxx vstupnímu dokladu xxxxxxxxx x xxxxxxx II xxxxxxxx (XX) x. 669/2009.
Xxxxxx 8
Xxxxxx xxxxxxxx
1. Xxxxxxxxx xxxxxx xx určeném xxxxx xxxxxx provedou xxxxxxxx xxxxxxx u každé zásilky xxxxxxxx xxxxxxxxx x xx. 1 xxxx. 1, xxx xx xxxxxxxxx dodržení požadavků xxxxxxxxxxx v článcích 4 x 5.
2. Xxxxxxx xxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx x xxxxxxx xxxxxxxx xxxxxxx, xxxxxx xxxxxx vzorků x xxxxxxx, x xxxxxxx s čl. 8 xxxx. 1 x xxxxxx 9 a 19 xxxxxxxx (XX) x. 669/2009 x xxxxxxxx xxxxxxxxxx x xxxxxxx X xxxxxx nařízení.
3. Xx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxx:
|
x) |
vyplní xxxxxxxxx xxxxxx xxxxx XX společného xxxxxxxxx xxxxxxx; |
|
x) |
xxxxxxx xx xxxxxxxxxx xxxxxxxxx xxxxxxx výsledky xxxxxx xxxxxx a analýzy xxxxxxxxxxx v souladu x xxxxxxxxx 2 xxxxxx xxxxxx; |
|
c) |
xxxxxxxxx x xxxxxx referenční xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxx; |
|
x) |
xxxxxxxxxx x xxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx; |
|
e) |
xxxxxx x xxxxxxxx xxxxx podepsaného x xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx. |
4. Xxxxxxxxx xxxxxx xxxxxxxx xxxxx xxxxxx vydají xxxxxxxxxxxxx odpovědnému xx xxxxxxx ověřenou xxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxxxxx xxxx, xx-xx xxxxxxx xxxxxxxxx, jednotlivě ověřené xxxxx takového xxxxxxxxx.
5. Xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx xxxx xxxxxxxxxx zásilku xxxxx její přepravy xx do xxxxxx xxxxxxxxxx do xxxxxxx xxxxx.
Xxxxxx 9
Xxxxxxxxx xxxxxxx
1. Zásilka xx xxxxx xxxxxxxx, xxxxx xxxxxx xxxxxxxxx xxxxxxx xxxxxx kontroly x xxxxx xxxxxxxxx orgány kompletně xxxxxxxxxx společný xxxxxxx xxxxxx, xxx xxxxxxx xxxxxx 8.
2. X xxxxxxx xxxxxxxxxx rozdělení xxxxxxx xxxx xxxxxx xxxx zásilky během xxxx přepravy xx xx xxxxxx propuštění xx xxxxxxx xxxxx xxxxxxxxxx xxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx dokladu.
Xxxxxx 10
Xxxxxxxxxx xx xxxxxxx xxxxx
Xxxxxxx mohou být xxxxxxxxxx xx xxxxxxx xxxxx pouze tehdy, xxxxx xxxxxxxxxxxx potravinářského xxxxxxx nebo jeho xxxxxxxx xxxxxxxx xxxxxx xxxxxxx xxxxxxxx vstupní xxxxxx, xxxxx xxxxxxxxx xxxxx xxxxx xxxxxxx xxxx, co xxxx xxxxxxxxx všechny xxxxxx xxxxxxxx. Celní xxxxxx xxxxxxxx xxxxxxx xx xxxxxxx xxxxx xxxxx xxxxx, xxxxxxxx xx x xxxxxxx II.14 společného xxxxxxxxx dokladu xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxxx je xxxxxxxx xxxxxxx xxxxxx x xxxxxxx XX.21 xxxxxxxx.
Xxxxxx 11
Xxxxxxxxxx xxxxxxxxx
1. Xxxxx xx xx xxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxxx x xxxxxxx x xxxxxxx 8 zjistí, že xxxxxxxxx xxxxxx xxxxxxx Xxxx, včetně xxxxxx xxxxxxxx, nebyly dodrženy, xxxxxx xxxxxxxxx xxxxx xxxx III xxxxxxxxxx xxxxxxxxx xxxxxxx a přijmou xx opatření xxxxx xxxxxx 19, 20 x 21 xxxxxxxx (XX) x. 882/2004.
2. Pokud x xxxxxxx xxxxxx xxxxxxxxx xxxxxxxx xxxxxx xxxxxx x xxxxxxx xxxxxxxxx v článku 4 xxx osvědčení o zdravotní xxxxxxxxxxxx xxxxxxx x xxxxxx 5 xxxx xxxxx tyto xxxxxxxx xxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxxxxx xxxxxx x xxxxxxx s požadavky xxxxxxxxxxx x xxxxx nařízení, xxxxx xxx xxxxxxx xxxxxxxx xx Xxxx x xxxxxx xx xxxx xxxx Xxxx nebo xx xxxxx.
3. Xxxxx xxxxxxxxx xxxxx xx určeném místě xxxxxx xxxxxxxx vstup xxxxxxx xxxxxxxx xxxxxxxxx x xx. 1 xxxx. 1 x xxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxx xxxxxxxxxxx x xxxxxxxx (XX) č. 396/2005, xxxxxxxxxx xxxx xxxxxxxxx zásilky xx xxxxxxxxx xxxxxx x xxxxxxx x xx. 19 odst. 3 xxxxxxxx (XX) č. 882/2004.
Xxxxxx 12
Xxxxxx
1. Xxxxxxx xxxxx Xxxxxx xxxxxxx xxxxx, do xxxxx xxxxxx xxxxxxxxxxxxx xx xxxxxx pololetí, xxxxxxxx xxxxxx x xxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxxx x xxxxxxx xxxxxxxx xxxxx tohoto xxxxxxxx.
Xxxxxxx zpráva xxxxxxxx xxxx informace:
|
x) |
počet dovezených xxxxxxx; |
|
x) |
xxxxx xxxxxxx, u kterých xxx xxxxxxxx odběr xxxxxx xxx xxxxxxx; |
|
x) |
výsledky xxxxxxx stanovených x xx. 8 xxxx. 2. |
2. Xx se xx xx, xx xxxxx xxxxxxx xxxxx registrují x XXXXXX společné xxxxxxx xxxxxxx vydané xxxxxx xxxxxxxxxxx orgány x xxxxxxx x xxxxx nařízením, oznamovací xxxxxxxxxx xxxxxxxxx x xxxxxxxx 1 byly splněny.
Xxxxxx 13
Xxxxxxx
Xxxx xxxxxxxx se xxxxxxxxx xxxx 31. xxxxxx 2019.
Xxxxxx 14
Xxxxxxx
Xxxxxxx náklady vyplývající x xxxxxxxx xxxxxxx, xxxxxx xxxxxx xxxxxx, analýzy, xxxxxxxxxx a jakýchkoli xxxxxxxx xxxxxxxxx v návaznosti xx xxxxxxxxxx xxxxxxxxx, xxxx xxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx xxxxxxxxx xx xxxxxxx.
Xxxxxx 15
Xxxxx xxxxxxxx (ES) x. 669/2009
Xxxxxxx I nařízení (XX) x. 669/2009 xx mění xxxxx:
|
x) |
x xxxxxxxxx pro Xxxxxxx xx xxxxxxx xxxxxxx xxxxxxxxxx xx „xxxxx xxxx vinné“; |
|
x) |
x xxxxxxxxx pro Xxxxxxx xx xxxxxxx xxxxxxx xxxxxxxxxx na „xxxxxxxx (xxxxx xxxxx)“. |
Xxxxxx 16
Xxxxxxx
Xxxxxxxxx xxxxxxxx (XX) x. 885/2014 xx xxxxxxx.
Xxxxxx 17
Xxxxxxxxx xxxxxxxx
Po dobu xxx měsíců od xxxx xxxxxx xxxxxx xxxxxxxx x xxxxxxxx povolí xxxxxxx xxxxx xxxxxx xxxxx xxxxxxx listů xxxxx pocházejících z Indie, xxxxx opustily xxxx xxxxxx xxxx xxxx xxxxxxxx, pokud xx xxxxxxx země xxxx xxx země původu, xxxx 8. xxxxxxxxx 2018, xx předpokladu, xx xxxxxxx xxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxx (XX) x. 885/2014.
Po dobu xxx xxxxxx xx xxxx vstupu xxxxxx xxxxxxxx v platnost xxxxxx xxxxxxx xxxxx xxxxxx xxxxx zásilek listů xxxx xxxxx xxxxxxxxxxxxx x Xxxxxxx x xxxxxxxx (dračího xxxxx) pocházejících z Vietnamu, xxxxx xxxxxxxx zemi xxxxxx xxxx zemi xxxxxxxx, pokud xx xxxxxxx xxxx xxxx xxx země původu, xxxx 8. xxxxxxxxx 2018, xx xxxxxxxxxxx, že xxxxxxx zásilky xxxxxxx xxxxxxxxx xxxxxxxx (XX) x. 669/2009 xxxxxxxx ke xxx 7. prosince 2018.
Xxxxxx 18
Xxxxx x xxxxxxxx x xxxxxxxxxxxx
Xxxx xxxxxxxx vstupuje v platnost xxxxxxxx dnem xx xxxxxxxxx v Úředním věstníku Xxxxxxxx xxxx.
Xxxxxxx xx xxx xxx 8. xxxxxxxx 2018.
Xxxx xxxxxxxx je xxxxxxx v celém xxxxxxx x xxxxx xxxxxxxxxx xx xxxxx členských xxxxxxx.
X Xxxxxxx xxx 7. xxxxxxxxx 2018.
Xx Xxxxxx
xxxxxxxx
Xxxx-Xxxxxx JUNCKER
(1)&xxxx;&xxxx;Xx.&xxxx;xxxx.&xxxx;X&xxxx;31, 1.2.2002, s. 1.
(2) Úř. věst. L 165, 30.4.2004, x.&xxxx;1.
(3)&xxxx;&xxxx;Xxxxxxxx Xxxxxx (ES) x.&xxxx;669/2009 ze xxx 24.&xxxx;xxxxxxxx&xxxx;2009, kterým xx xxxxxxx nařízení Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx (ES) x.&xxxx;882/2004, pokud jde x&xxxx;xxxxxxxx xxxxxx xxxxxxxx xxxxxx xxxxxxxxx xxxxx x&xxxx;xxxxxxxx xxxxxx xxx xxxxxxxxxxx xxxxxx, x&xxxx;xxxxxx xx xxxx rozhodnutí 2006/504/XX (Úř. věst. L 194, 25.7.2009, x.&xxxx;11).
(4)&xxxx;&xxxx;Xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx (XX) x.&xxxx;396/2005 xx xxx 23.&xxxx;xxxxx&xxxx;2005 x&xxxx;xxxxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxx a krmivech xxxxxxxxxxx a živočišného xxxxxx x&xxxx;xx xxxxxx povrchu x&xxxx;x&xxxx;xxxxx xxxxxxxx Xxxx 91/414/XXX (Úř. věst. L 70, 16.3.2005, x.&xxxx;1).
(5)&xxxx;&xxxx;Xxxxxxxxx nařízení Xxxxxx (XX) x.&xxxx;885/2014 ze xxx 13.&xxxx;xxxxx&xxxx;2014, xxxxxx xx xxxxxxx xxxxxxxx xxxxxxxx xxx dovoz xxxx x&xxxx;xxxxx curry x&xxxx;Xxxxx a zrušuje xxxxxxxxx xxxxxxxx (EU) č. 91/2013 (Xx.&xxxx;xxxx.&xxxx;X&xxxx;242, 14.8.2014, x.&xxxx;20).
(6) Směrnice Xxxxxx 2002/63/XX xx xxx 11.&xxxx;xxxxxxxx&xxxx;2002, xxxxxx se xxxxxxx xxxxxx Xxxxxxxxxxxx xxx xxxxx xxxxxx xxxxxxxx x&xxxx;xxxxxx kontrole reziduí xxxxxxxxx x&xxxx;xxxxxxxxxx rostlinného x&xxxx;xxxxxxxxxxx původu x&xxxx;xx xxxxxx xxxxxxx x&xxxx;xxxxxx xx xxxxxxx xxxxxxxx 79/700/XXX (Xx.&xxxx;xxxx.&xxxx;X&xxxx;187, 16.7.2002, x.&xxxx;30).
(7)&xxxx;&xxxx;Xxxxxxxxxx Xxxxxx 2003/24/ES xx dne 30.&xxxx;xxxxxxxx&xxxx;2002 x&xxxx;xxxxxx xxxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxxx systému (Xx.&xxxx;xxxx.&xxxx;X&xxxx;8, 14.1.2003, x.&xxxx;44).
(8) Rozhodnutí Komise 2004/292/XX xx xxx 30.&xxxx;xxxxxx&xxxx;2004 x&xxxx;xxxxxxxx xxxxxxx Traces x&xxxx;x&xxxx;xxxxx xxxxxxxxxx 92/486/XXX (Xx.&xxxx;xxxx.&xxxx;X&xxxx;94, 31.3.2004, s. 63).
XXXXXXX X
Xxxxxxxxx xxxxxx xxx xxxxxxxxxxx xxxxxx xxxxxxxxxxx zvláštním xxxxxxxxx, xxxxx jde x&xxxx;xxxxxx xxxxx xx Xxxxxxxx xxxx
|
Xxxxxxxxx (zamýšlené xxxxxxx) |
Xxx XX&xxxx;(1) |
Xxxxxxx XXXXX |
Xxxx původu |
Riziko (xxxxxx) |
Xxxxxxx fyzických xxxxxxx x xxxxxxx xxxxxxxxxx (%) xxx xxxxxx |
|
Xxxxxxxx (xxxxx ovoce) (Potraviny – xxxxxxx xxxx xxxxxxxx) |
xx&xxxx;0810&xxxx;90&xxxx;20 |
10 |
Xxxxxxx (VN) |
Rezidua xxxxxxxxx xxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxx x xxxxxxx x&xxxx;xx.&xxxx;29 xxxx. 2 nařízení (ES) x.&xxxx;396/2005 (pesticidy, xxxxx xxxx být xxxxxxxxxxxx xxxxx v xxxxxxxxxx xxxxxxxxxxx xxxxxx xxxx xx xxxxxx xxxxxxx)&xxxx;(2) x xxxxxxx xxxxxxxxxxxxxxx&xxxx;(3) (xxxxxxxxxxxxxxx, xxxxxxxxx xxxx XX2, včetně manebu (3), xxxxxxxxx&xxxx;(3), metiramu (3), propinebu (3), xxxxxxx&xxxx;(3) x ziramu (3)), xxxxxxxxx&xxxx;(2) x xxxxxxxxxx&xxxx;(2). |
10 |
|
Xxxxx xxxxx (Xxxxxxx/Xxxxxxx xxxxxxxx) (Xxxxxxxxx – xxxxxxx, xxxxxxxx, xxxxxxxx xxxx xxxxxx) |
xx&xxxx;1211&xxxx;90&xxxx;86 |
10 |
Xxxxx (XX) |
Xxxxxxx pesticidů xxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxx x xxxxxxx x&xxxx;xx.&xxxx;29 xxxx. 2 xxxxxxxx (XX) x.&xxxx;396/2005 (pesticidy, xxxxx xxxx xxx kontrolovány xxxxx x xxxxxxxxxx xxxxxxxxxxx xxxxxx xxxx xx jejich xxxxxxx)&xxxx;(2) x xxxxxxx xxxxxxx&xxxx;(2). |
20 |
|
Xxxxx xxxx xxxxx (Xxxxxxxxx) |
xx&xxxx;2008&xxxx;99&xxxx;99 |
11 , 19 |
Xxxxxxx (XX) |
Xxxxxxx xxxxxxxxx uvedených x xxxxxxxxxx xxxxxxxx xxxxxxxx x xxxxxxx s čl. 29 xxxx. 2 xxxxxxxx (XX) č. 396/2005 (xxxxxxxxx, xxxxx mají xxx xxxxxxxxxxxx xxxxx x xxxxxxxxxx xxxxxxxxxxx xxxxxx xxxx na jejich xxxxxxx)&xxxx;(2) a rezidua xxxxxxxxxxxxxxx&xxxx;(3) (xxxxxxxxxxxxxxx, xxxxxxxxx xxxx CS2, včetně xxxxxx&xxxx;(3), xxxxxxxxx&xxxx;(3), xxxxxxxx&xxxx;(3), xxxxxxxxx&xxxx;(3), xxxxxxx&xxxx;(3) x xxxxxx&xxxx;(3)) x xxxxxxxxxxx&xxxx;(2). |
20 |
(1)&xxxx;&xxxx;X xxxxxxx, xx se x daného xxxx XX xxxxxxxx xxxxxxxxx xxx x xxxxxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxx xxxxxxx x xxxxx kódu xxxxx xxxxxxxxxxx položky, označuje xx xxx XX xxxxxxxxx „ex“.
(2) Rezidua pesticidů xxxxxxxx multireziduálními xxxxxxxx xxxxxxxxxx na XX-XX x XX-XX.
(3)&xxxx;&xxxx;Xxxxxxx xxxxxxxxx xxxxxxxx metodami x xxxxxxxxx xxxxxxxx rezidua.