XXXXXXXXX XXXXXXXX XXXXXX (XX) 2019/1084
xx xxx 25. xxxxxx 2019,
kterým xx xxxx nařízení (XX) x. 142/2011, xxxxx xxx x xxxxxxxxxxx xxxxxxx xxxxxxxxxxx xxxx xxxxxxxxxxxxxx xxxxxxxx, xxxxxxx x xxxxxxxxxxxxx a o xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxxxx produktů
(Xxxx x xxxxxxxx xxx XXX)
EVROPSKÁ XXXXXX,
x xxxxxxx na xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 1069/2009 xx xxx 21. xxxxx 2009 x xxxxxxxxxxxx xxxxxxxxxx xxx xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxx xxxxxxxx, xxxxx xxxxxx xxxxxx x xxxxxx spotřebě, a o zrušení xxxxxxxx (ES) x. 1774/2002 (1), x xxxxxxx xx xx. 21 odst. 5 xxxx. a), xx. 23 xxxx. 3, xx. 41 xxxx. 4, xx. 47 odst. 2 x xx. 48 xxxx. 2 xxxxxxxxx xxxxxxxx,
xxxxxxxx x xxxxx xxxxxxx:
|
(1) |
Xxxxxxxx Xxxxxx (XX) x. 142/2011 (2) xxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxx (XX) x. 1069/2009, xxxxxx xxxxxxxxx xxxxxxxxxx xx xxxxxxxxxx xxxxxxx a sledovatelnosti xxxxxxxxxx produktů živočišného xxxxxx a získaných produktů. |
|
(2) |
Podle xxxxxx 21 nařízení (XX) x. 1069/2009 xxxx xxx xxxxx xxxxxxx vedlejších xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxxxx xxxxxxxx xxxxx xxxxxxxx doprovázena xxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxx xxxxx stanoveného x xxxxxxx XXXX xxxxxxxx (XX) x. 142/2011 x xxxxxxxxx xxxxxxxxxxxxxx. |
|
(3) |
Xxxxxxxxx xxxxx xxxxxxxxx xxxxx xxxxxx oznámí xxxxxxxx xxxxxxxxxx produktů xxxxxxxxxxx xxxxxx a získaných xxxxxxxx, xx xxxxx xx xxxxxxxx xx. 48 odst. 3 nařízení (XX) x. 1069/2009, xxxxxxxxxxx xxxxxx členského státu xxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxx veterinárního systému (XXXXXX), který xxx xxxxxxx xxxxxxxxxxx Komise 2004/292/XX (3). |
|
(4) |
Xxx xxxxx xxxxxxxx xxxxxxxx xxxxxxx x xxxxx xxxxxx xx xxxx xxx provozovatelé xxxxxxxxxx xx xx xxxxxxxxx xxxxxxx, xx xxx xx vztahuje xx. 48 odst. 3 xxxxxxxx (XX) č. 1069/2009, xxxxxxx xxxxxx xx xxxxx xxxxxx xxxxx xx xxxxxxx schválených xxxx xxxxxxxxxxxxxx xxxxxxxx a podniků xxxxxxxxxxx xx xxxxxxx XXXXXX, x xxxxxx xx xxxxxxx xxxxxxxxxxxxxx xxxxxxxxxxxxx xxxxxx xxxxxxxxxxx do systému XXXXXX. |
|
(5) |
Xxxxxxxx (XX) x. 142/2011 by xxxxx xxxx xxx xxxxxxx xxx, xxx xxxxxxxxxx požadavky na harmonizované xxxxxxx schválených nebo xxxxxxxxxxxxxx zařízení x xxxxxxx x xxx stanovilo, že harmonizované x xxxxxxxxxxxxx seznamy xxxxx xxxxxxxx xx xxxxxxx XXXXXX xxxx xxxxx xxxx prostřednictvím xxxxxxxxx. Xx xxxxxxxx VI xxxxxxxx (XX) č. 142/2011 xx xxxxx xxx xxx vložen xxxx xxxxxx. |
|
(6) |
Xxxxxxxxxxx seznamů v systému XXXXXX nebo xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxx systému může xxx xxxxxxxxx orgány x xxxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxxxxxxxxxxxx zátěž. Xxxxxxxxx xxxxxx xx xxxxx xxxx x provedení xxxxxx xxxxxxxxxx xxx x dispozici xxxxxx xxxxxxxxx xxxxxx. |
|
(7) |
Článek 30 xxxxxxxx (XX) č. 142/2011 xx xx xxxxx použít x xxxxxxx xxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx a získaných xxxxxxxx xxxx xxxxxxx Xxxxx xxxxxxxx xxxxxxxxx x xxxxxx 29 xxxxxxxxx nařízení x x xxxxxxx xxxxxxxxxx tranzitu xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxxxx xxxxxxxx xxxxxxxxxxxxx z Bosny x Xxxxxxxxxxx x xxxxxxxx xx xxxxxxx zemí xxxx Chorvatsko xxxxx xxxxxx 29x xxxxxxxxx xxxxxxxx. Xxxxxxxx požadavky xx xxxxxxxxxxxx x xxxxxxxx stanovené ve výše xxxxxxxxx xxxxxxxx zajišťují xxxxxxx úroveň xxxxxxx xxxxxxxxx zdraví a zdraví xxxxxx, x xxxxxxxx xxx xxxxxxxx xx xxxxxxx xxxxxxxx x xxxxxxx původu xx xxxxxxx x xxxxxxx XXXXXX. |
|
(8) |
Xxxxxx 30 xxxxxxxx (EU) č. 142/2011 xx xxxxx xxx být xxxxxxxxxxxxx xxxxxxxx xxxxxx. |
|
(9) |
Xxxxx xx. 21 xxxx. 2 xxxxxxxx (ES) x. 1069/2009 musí xxxxxxxxxxxxx zajistit, xxx xxxx vedlejší produkty xxxxxxxxxxx xxxxxx a získané xxxxxxxx xxxxx xxxxxxxx xxxxxxxxxxx obchodním xxxxxxxx. Xxx xx xxxxxxxxx xxxxxxxxx některých xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxxxx xxxxxxxx ve výrobním xxxxxxx xxxxx xxx xxxxxxxxxxx xxxxxxx, xxxx xx xxx činnosti xxxxxxxxxxxxxx xxxxxxxxxx odpovědných xx organizaci xxxxxxxx xxxxxxxx x xxxxxxxxxxxxxxxx xxx xxxxx úředních kontrol. Xxxx obchodního xxxxxxx, xxxxx má doprovázet xxxx uvedené xxxxxxxx xxxxxxxx živočišného původu x xxxxxxx xxxxxxxx, by xxx být xxxxxxx xxx, xxx xxxxxxxxxx xxxxxxxx informace. |
|
(10) |
Určité xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxx xxxxxxxx stanovené x xx. 48 xxxx. 3 nařízení (XX) x. 1069/2009 xxxxxxxxx řízenému xxxxxxxxxxxx. Xxxxxxxxxxxxx a příslušné orgány xx xxxx zajistit, xxx x xxxxxxxxx, xxx xx xxxxxxxx xxxxxxxxxx, takové vedlejší xxxxxxxx živočišného původu xxxx xxxxxxx xxxxxxxx xxxx xxxx xxxxxxxx xx xxxxxxxxxxxx xxxxxxxx xxxxxxxxxxxxxx x xxxxxxx s čl. 23 odst. 1 xxxx. x) nařízení (XX) x. 1069/2009, xxxxxxxx xxxx xxxxxxx xxxxxxxxxxx x xxxxxxx x xx. 24 xxxx. 1 xxxxxxxxx nařízení, xxxx xxx xxxx xxxxxxxx xx xxxxx určení xxxxxxx x xx. 24 xxxx. 1 xxxx. x) xxxxxx i) až xx) xxxxxxxxx xxxxxxxx. Xx xxxxx xxxxxxxx xxxxxxx vzor xxxxxxxxxx xxxxxxx xxxxxxxxxx stanoveným x xx. 48 xxxx. 3 nařízení (XX) č. 1069/2009. |
|
(11) |
Xxxx xxxxxxxx xxxx xxxxxx xxxxxx x xxxxxx xxxxxx xx xxxx být omezena xx 15 pracovních dnů, xxx xx xxxxxxxxx xxxxxxxxxxxxxx zásilek. Xxxxx x xxxxxxx xxxx xxxx xxxxxxx xx xxxxx xxxxxx xxxxxxxx, xxxxxxx dotčené xxxxxxxxx xxxxxx neprodleně xxxxxx místo, xxx xx daná zásilka xxxxxxx. |
|
(12) |
Xxxxxxxxx obchodu xxxx xxxxxxxxx státy xx xxxxxxx xxxxxx xxxxxxx. Xxxxxxxx xxxxxx xx xxx xxx upraven xxx, xxx xxxxxxx xxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxx. |
|
(13) |
Xxxxxxx XXXX xxxxxxxx (EU) x. 142/2011 xx xxxxx xxxx xxx xxxxxxxxxxxxx xxxxxxxx xxxxxxx. |
|
(14) |
Xxxxxxxxx xxxxxxxxxx produktů xxxxxxxxxxx xxxxxx a xxxxxxxxx produktů xxxxxxxxx x čl. 48 xxxx. 1 xxxxxxxx (XX) x. 1069/2009 xx xxxxxx xxxxxxxxx xxxxx musí xxx xx xxxxxxx xxxxxxx xxxxxxxxxxxxx předem schváleno xxxxxxxxxx xxxxxxx xxxxxxxxx xxxxx určení. Xxxxxxx XXX xxxxxxxx (XX) x. 142/2011 xxxxxxx xxxxxxxxxx xxxxxx xxx xxxxxxxx x odeslání xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx x získaných xxxxxxxx do xxxxxx xxxxxxxxx xxxxx. Xxxxxxx xxxxxx xx xxx xxx xxxxxx xxx, xxx xxxxxxxxx xxxxxxxxx x xxxxxxxxxx xxxxx xxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xxxx xxxxxxxxx xxxxxxxx. Povolení xxxxxxxxx vedlejších xxxxxxxx xxxxxxxxxxx xxxxxx a získaných xxxxxxxx v jednom xxxxxxxx xxxxx nebrání tomu, xxx xxxx xxxxxxxx xxxx xxxxxxxxxxx orgány x xxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx. Xxxxxxxxxx xxxxxx xxxxxxxx by xxx xxx zaveden xx xxxxxxx XXXXXX x xxx xx xxx xxxxxxxxxxxx propojen x xxxxxxxxx xxxxxxxx xxxxxxxxxx xxx schválené xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xxxx xxxxxxxxx produktů, xxx xx xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxx xxx xxxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxx v místě xxxxxx. |
|
(15) |
Xxxxxxx XXX xxxxxxxx (EU) č. 142/2011 xx měla xxx xxxxxxxxxxxxx xxxxxxxx xxxxxxx. |
|
(16) |
Xxxxxxxx xxxxxxxxx tímto xxxxxxxxx xxxx v souladu xx xxxxxxxxxxx Stálého výboru xxx xxxxxxxx, xxxxxxx, xxxxxxxxx x xxxxxx, |
XXXXXXX TOTO XXXXXXXX:
Xxxxxx 1
Xxxxxxxx (XX) x. 142/2011 se xxxx takto:
|
1) |
Xxxxxx xx xxxx článek 20a, xxxxx xxx: „Xxxxxx 20x Xxxxxxx xxxxxxxx, xxxxxxx x provozovatelů x xxxxxxxxx xxxxxxx Příslušný xxxxx členského státu xxxxxxx, xxx aktuální xxxxxxx xxxxxxxx, podniků x xxxxxxxxxxxxx xxxxx xx. 47 xxxx. 1 xxxxxxx xxxxxxxxxxx xxxxxxxx (ES) x. 1069/2009 xxxx:
(*1) xxxxx://xx.xxxxxx.xx/xxxx/xxxxx/xxxx/xxxxx/xxxxxx/xxxx/xx-xxxxxx-xxxxxxxx-xxx-xxx-xxxxxxxxx_xxxx_04032012_xx.xxx“." |
|
2) |
V článku 30 xx xxxxxxxx nový xxxxxxxxxxx, xxxxx xxx: „Xxxxx xxxxxx xx nepoužije na specifické xxxxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxx živočišného xxxxxx xxxxxxxxxxxxx z Ruské xxxxxxxx x xx xx určených xxxxx xxxxxx 29 a na přemísťování xxxxxxx xxxxxxxxxx produktů xxxxxxxxxxx xxxxxx a získaných xxxxxxxx xxxxxxxxxxxxx z Bosny x Xxxxxxxxxxx a určených xx xxxxxxx xxxx xxxxx xxxxxx 29x.“ |
|
3) |
V xxxxxx 32 xx xxxxxxxx 7 xxxxxxxxx xxxxx: „7. Xxxxxxxxxxxxx předkládají žádosti x xxxxxxxx xxxxxxx x xxxxxxxx 6 x souladu se xxxxxxxxxxx formátem, xxxxx xx xxxxxxxx x xxxxxx 10 xxxxxxxx XXX přílohy XXX xxxxxx nařízení, xxxxxxxxxxxxxxx xxxxxxx XXXXXX.“ |
|
4) |
Xxxxxxx XXXX x XVI xx xxxx x xxxxxxx s přílohou xxxxxx xxxxxxxx. |
Xxxxxx 2
Toto xxxxxxxx xxxxxxxx v xxxxxxxx xxxxxxxx xxxx xx xxxxxxxxx x Úředním xxxxxxxx Xxxxxxxx xxxx.
Xxxx xxxxxxxx xx xxxxxxx v xxxxx xxxxxxx x přímo xxxxxxxxxx xx xxxxx xxxxxxxxx státech.
V Bruselu xxx 25. xxxxxx 2019.
Xx Xxxxxx
xxxxxxxx
Xxxx-Xxxxxx XXXXXXX
(1)&xxxx;&xxxx;Xx.&xxxx;xxxx.&xxxx;X&xxxx;300, 14.11.2009, x.&xxxx;1.
(2) Nařízení Komise (EU) x. 142/2011 ze xxx 25.&xxxx;xxxxx 2011, xxxxxx se provádí xxxxxxxx Evropského xxxxxxxxxx x Rady (ES) x. 1069/2009 x xxxxxxxxxxxx pravidlech pro xxxxxxxx produkty živočišného xxxxxx x xxxxxxx xxxxxxxx, které nejsou xxxxxx x xxxxxx xxxxxxxx, x provádí xxxxxxxx Rady 97/78/ES, xxxxx xxx x xxxxxx xxxxxx x xxxxxxxx xxxxxxxxxx od xxxxxxxxxxxxx xxxxxxx xx xxxxxxx podle xxxxxxx xxxxxxxx (Xx.&xxxx;xxxx.&xxxx;X&xxxx;54, 26.2.2011, x.&xxxx;1).
(3) Rozhodnutí Xxxxxx 2004/292/ES xx dne 30.&xxxx;xxxxxx 2004 x xxxxxxxx xxxxxxx Xxxxxx x x xxxxx xxxxxxxxxx 92/486/XXX (Úř. věst. L 94, 31.3.2004, x.&xxxx;63).
XXXXXXX
Xxxxxxxx (EU) č. 142/2011 xx xxxx xxxxx:
|
1) |
X příloze VIII xxxxxxxx XXX xx xxx 6 mění xxxxx:
|
|
2) |
X&xxxx;xxxxxxx XXX xxxxxxxx XXX se xxxxx 10 nahrazuje tímto: „Oddíl 10 Xxxxxxxxxx formát pro xxxxxxx o xxxxxx xxxxxxxx týkající xx xxxxxxx x xxxxx Xxxx Xxxxxxxxxxxxx xxxxxxxxx příslušný xxxxx xxxxxxxxx xxxxx xxxxxx a podají žádost x&xxxx;xxxxxxxxxxx xxxxxx xxxxxxxxx xxxxx určení x&xxxx;xxxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx původu x&xxxx;xxxxxxxxx xxxxxxxx uvedených x&xxxx;xx.&xxxx;48 xxxx.&xxxx;1 xxxxxxxx (XX) x.&xxxx;1069/2009 a rybího xxxx xxxx xxxx xxxxxx x xxxxxxxxx xxxxxxxxx 3 xxxxxxxx xxx xxxxxxxxxxxxx x xxxxxxx s xxxxx xxxxxxxx v systému XXXXXX: 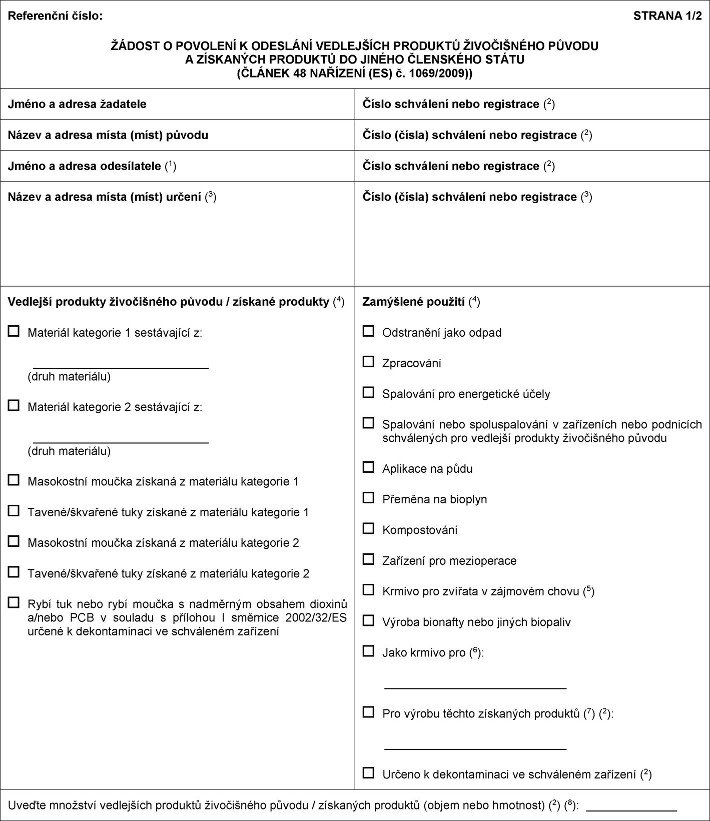 &xxxx;Text obrazu
&xxxx; &xxxx;Text obrazu
&xxxx;  Text obrazu
“ Text obrazu
“ |
(1) Nařízení Xxxxxxxxxx xxxxxxxxxx a Rady (ES) x.&xxxx;852/2004 xx xxx 29.&xxxx;xxxxx 2004 x&xxxx;xxxxxxx xxxxxxxx (Xx.&xxxx;xxxx.&xxxx;X&xxxx;139, 30.4.2004, x.&xxxx;1).
(2)&xxxx;&xxxx;Xxxxxxxx Evropského parlamentu x&xxxx;Xxxx (XX) x.&xxxx;853/2004 xx dne 29. dubna 2004, kterým se xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxxxxxx xxxxxx (Úř. věst. L 139, 30.4.2004, x.&xxxx;55).
(3)&xxxx;&xxxx;Xxxxxxxx Evropského xxxxxxxxxx a Xxxx (XX) x. 183/2005 xx dne 12. ledna 2005, kterým xx xxxxxxx xxxxxxxxx na xxxxxxx krmiv (Úř. věst. L 35, 8.2.2005, x.&xxxx;1).
(4)&xxxx;&xxxx;xxxxx://xxx.xxx-xxxx.xxx/xxxxxxxxxxxxxx-xxxxxx/
(5)&xxxx;&xxxx;Xxxxxxxxxx Xxxxxx 2009/821/XX xx xxx 28.&xxxx;xxxx 2009, kterým xx xxxxxxx seznam xxxxxxxxxxx xxxxxxxxx hraniční xxxxxxxx, xxxxxxx xxxxxxxxx xxxxxxxx týkající se xxxxxxxx xxxxxxxxxxx veterinárními xxxxxxxxx Komise x xxxxxxxxxxx xxxxxxxx v XXXXXX (Xx.&xxxx;xxxx.&xxxx;X&xxxx;296, 12.11.2009, x.&xxxx;1).