PROVÁDĚCÍ XXXXXXXXXX XXXXXX (XX) 2021/361
xx dne 22.&xxxx;xxxxx 2021,
kterým xx xxxxxxx xxxxxxxxx xxxxxxxx xxx xxxxxxxxxxxx xxxxxxx xxxxx xxxx xxxxxxxxx xxxxx x&xxxx;xxxxxx xxxxx xx Unie v souvislosti x&xxxx;xxxxxxx xxxxxxxxxx Xxxxxxxxxxxxxxxx xxxxxxxxxxxxxxxx
(xxxxxxxx xxx xxxxxx X(2021) 1018)
(Text x&xxxx;xxxxxxxx xxx XXX)
XXXXXXXX XXXXXX,
x&xxxx;xxxxxxx xx Xxxxxxx x&xxxx;xxxxxxxxx Xxxxxxxx xxxx,
x&xxxx;xxxxxxx xx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Rady (XX) 2016/429 xx dne 9.&xxxx;xxxxxx 2016 o nákazách xxxxxx x&xxxx;x&xxxx;xxxxx x&xxxx;xxxxxxx xxxxxxxxx aktů v oblasti xxxxxx zvířat („xxxxxx xxxxx xxx xxxxxx xxxxxx“)&xxxx;(1), a zejména xx xx.&xxxx;259 xxxx.&xxxx;1 xxxxxxxxx xxxx x&xxxx;xx.&xxxx;259 odst. 1 xxxx. x) a xx. 261 odst. 1 xxxxxxxxx nařízení,
vzhledem k těmto xxxxxxx:
|
(1) |
Xxxxxxxxxx Xxxxxxxxxxxxxxxx xxxxxxxxxxxxxxxx (xxxx xxx „Bsal“) xx xxxxxxxx patogen xxxxx, xxxx xxxxxx xxxxxxx x&xxxx;xxxxx xxxxxx xxxxxxxx mloků a může x&xxxx;xxxxxx populacích xxxxxxxx xxxxxxxxx xxxxxxxxx x&xxxx;xxxx. Xxxx xx xxx xxxxxxx xxxxx xxxxx xxxxxxx, zatímco xxxx xxxxx jsou xxxx xxxx xxxxx nebo xxxxxxxx xxxxxx, xxx xxxxx Xxxx xxxxxxxx xx xxxx x&xxxx;xxxxxxx xxxx xxxxxxxxx x&xxxx;xxxxx xxxxxxx pro xxxx xxxxx mloků nebo xxxxxxxxxxx jejich xxxxxxxxx xxxxxxxxx. |
|
(2) |
Xxxxxxx Xxxx xx xxxxx údajů shromážděných x&xxxx;xxxxx evropského xxxxxxxx x&xxxx;xxxxxx „Xxxxxxxxxx a new xxxxxxxxxx disease xx xxxxxxxxxxx to xxxxxxxxxx xxx xxxx of Xxxxxxxx xxxxxxxxxxxx“ („Zmírňování xxxx xxxxxxxx nákazy x&xxxx;xxxxx s cílem čelit xxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxxxx“)&xxxx;(2) x&xxxx;x&xxxx;xxxxxxxxxx xx xxx xxxxxxxxx v Belgii, Xxxxxxx, Xxxxxxxxxx, xx Xxxxxxxx xxxxxxxxxx x&xxxx;xx Xxxxxxxxx u chovaných x&xxxx;xxxxx xxxxxxxx xxxxxxxx xxxxx. Xx xx za xx, xx Xxxx xx xxxxx ve xxxxxxxx Xxxx, xxx xx xxxxx rozšířený, xxxxxxx xx xxxxxxxxx xxxxxxxxxxxx x&xxxx;Xxxxxxxx, Xxxxxxx x&xxxx;Xxxxxxxx. Xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx o jeho xxxxxxxxx v jiných xxxxxxx Xxxx x&xxxx;x&xxxx;xxxxxxxxxxxx xxxxxxx. X&xxxx;xxxxxx Xxxx přispívá xxxxxx x&xxxx;xxxxxxxxxxxx mloky xxxx mloky-přenašeči a nákaza xxxxxxxxxxx xxxxxxxx riziko xxx xxxxxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxx kolonizace. |
|
(3) |
Prováděcí xxxxxxxxxx Xxxxxx (EU) 2018/320&xxxx;(3) xx xxxxx xxxxxxxxxxx xxxxxxxxxx Xxxxxx (EU) 2019/1998&xxxx;(4) xxxxxxx xxxxxxxx xxxxxxxxxxx opatření xxx xxxxxx xx xxxxxxxxx xxxxx xxxxxx Xxxx x&xxxx;xxxxx xxxxxx zásilek xx Xxxx. Xxxxxxxxx xxxxxxxxxx Xxxxxx (EU) 2018/320 xxxx přijato xx xxxxxxx vědeckého xxxxxxxxxx Xxxxxxxxxx xxxxx xxx bezpečnost xxxxxxxx xx xxx 25.&xxxx;xxxxx 2017&xxxx;(5) (dále jen „xxxxxxxxxx EFSA“) a vědecké x&xxxx;xxxxxxxxx pomoci Xxxxxxxxxx xxxxx pro xxxxxxxxxx xxxxxxxx ze xxx 21.&xxxx;xxxxx 2017&xxxx;(6) (xxxx xxx „xxxxxxx x&xxxx;xxxxxxxxx xxxxx EFSA“). Xxxxxxx xxxxxxxxxx se použije xx xxx 20.&xxxx;xxxxx 2021. |
|
(4) |
Xxxxxxxxxx EFSA a technická xxxxx XXXX a novější xxxxxxx xxxxxxxxx&xxxx;(7) rovněž xxxxxxxxx xx&xxxx;xxxxx mezer x&xxxx;xxxxxxxxxx x&xxxx;xxxxxxxxxx, xxxxx xxx x&xxxx;xxxx xxxxxxx xxxxxx Bsal. Xxxxx xxxxxxxxxxxxx xxxxxxx x&xxxx;xxxxx Xxxxxxx organizace pro xxxxxx zvířat (OIE) xxxxx nejsou plně xxxxxxxxx s ohledem na xxxxxx xxxxxxxxxxx Xxxx x&xxxx;xxxxxx xxxxxxxxxxx, xxxxx xxx x&xxxx;xxxxxxxxxx xxx xxxxxxxxxxx xxxxxx s mloky. |
|
(5) |
Bsal xx xxxxxxx x&xxxx;xxxxxxx XX nařízení (XX) 2016/429, x&xxxx;xxxxx xxxxx xx definice xxxxxx xxxxxxx xx seznamu xxx účely nařízení (XX) 2016/429. Xxxx xxxxxx xxxxx do xxxxxxxx nákazy xxxxxxxxx X&xxxx;xxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxx Xxxxxx (XX) 2018/1882&xxxx;(8) xxx zvířata xxxx Xxxxxxx, xxxx xxxxxxxx xxxxx. Pravidla Xxxx xxxxxxxx xx xxxxxxxxxxxx xxxxxxx xxxxxxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxx v rámci Xxxx x&xxxx;xxxxxx xxxxxx xx Xxxx xxxxxxxxx v aktech Xxxxxx x&xxxx;xxxxxxxxx xxxxxxxxx x&xxxx;x&xxxx;xxxxxxxxxxx aktech xxxxxxxxx xxxxx xxxxxxxx (XX) 2016/429 se xxxx xx xxxxxxx xxxx Xxxxxxx xxxxxxxxxx, neboť xxxxxxx xxxx Xxxxxxx xxxxxxx xx xxxxxxxx „xxxxxx xxxxxx“ x&xxxx;xxxxxxxx xxxxxxxx. Xxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxx xxxxxxxx, pokud xxx o mnoho xxxxxxx xxxxxx Xxxx, x&xxxx;x&xxxx;xxxxxxxxxxx xxxxxxx xxxxxxxx mezinárodních xxxxxx a doporučení x&xxxx;xxxxxxx xx obchod x&xxxx;xxxxxx xxxxxxx nebyly xxx xxxxxxx řádu Caudata xxxxx xxxxxxx xxxx Xxxxxx v přenesené pravomoci xxx xxxxxxxxx akty, xxxxxxx xxx xxxxxxxxxxx x&xxxx;xxxxx xxxxxxxxx přijaty xxxx. |
|
(6) |
Xxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxx, pokud jde x&xxxx;Xxxx, x&xxxx;Xxxx a ochranná xxxxxxxxxxx xxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxx (XX) 2018/320, x&xxxx;xx s příslušnými xxxxxx xxxxxxxxx xxxxx. Xxxxxxx xxxx xxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxx (XX) 2018/320 xxxxxxxxxx xx vhodná, členské xxxxx nepřijaly žádná xxxxx obchodní opatření xxxxx xxxxxx Bsal. Xxxxxx xx xxx, xx ohniska Bsal xxxx x&xxxx;xxxxxxxxxxx xxxxxxx xx xxxxxx xxxxxxx xxxxxxxxx xxxxxxxxx xxxxx, xxxxx xxxxxx Xxxx x&xxxx;xxxxx xxxxxxx xxxxxx Xxxx xxxxxxxxxxx významné xxxxxx. |
|
(7) |
Xxxxx xx vhodné xxxxxxxx mimořádná opatření xx xxxxxx Unie x&xxxx;xxxxx zabránit šíření Xxxx x&xxxx;xxxxxxxx xxxxxxxxxxxxxxxx xxxxxxxx xxxxxxx x&xxxx;xxxxx. X&xxxx;xxxxxxxxxxxx k účinnosti opatření xxxxxxxxxxx x&xxxx;xxxxxxxxxx rozhodnutí (XX) 2018/320 xx xxxxxx přijmout xxxxxxx xxxxxxxx xxxxxxxx xx xxxxxxxxxxxx zásilek xxxxx x&xxxx;xxxxx Xxxx x&xxxx;xxxxxx xxxxxx do Xxxx, x&xxxx;xx xx 21. dubna 2021 na xxxxxxxx xxxx xx přijetí xxxxxxxxxxxxx opatření xxxxxxxxx xxxxxx, xxxx xx xxxx x&xxxx;xxxxxxx xxxxx xxxxxxxxxxxxx xxxxxxxxxxx a vodní xxxxxxxxx. |
|
(8) |
Xxxx xx xxxx xxxxxxxx xxxx druhy xxxxx xxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxx x&xxxx;xxxx docházet xx xxxxxxx kontaminaci x&xxxx;xxxxxxx xxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxxx, kteří xxxxxxx x&xxxx;xxxxxxxx xxxxx. To xxxxxxx xxxxxx xxxxxxx Xxxx x&xxxx;xxxxx, se xxxxxxx xx obchoduje, xxx xxxxxx xx xxxxxxxx xxxxxx xxxxx xxxxxx xxxxxx x&xxxx;xx xxxxxx xxxxxxxxx xxxxxxx xx&xxxx;xxxxx přírodě. Xx xxxxxxx mloků xxxxxx xxx xxxxxxxxxxxx mezi xxxxxxxxx státy xxxx xxx vstup xx Xxxx xx xx xxxxx měla vztahovat xxxxxxxx ke zmírnění tohoto xxxxxx. Xxxx xxxxxxxx xx se však xxxxxx xxxxxxxxx na neobchodní xxxxxxx xxxxx x&xxxx;xxxxxxxx xxxxx, neboť na xxxx xxxxxxxxxx xxxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxxxx v nařízení Evropského xxxxxxxxxx a Rady (EU) x.&xxxx;576/2013&xxxx;(9). Xxxxxxx neobchodní xxxxxxx se xxxxxx xxxxxxx xxxxxx, xxxxx xxxx x&xxxx;xxxx xxxxx xxxxxxxxx xxxx oprávněných xxxx a doprovázejí je, x&xxxx;xxxxxxxxxx převod vlastnictví. Xxxxxxxxxx xxxxxxx xxxxx x&xxxx;xxxxxxxx chovu xxxxx xxxxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxx Xxxx xxx x&xxxx;xxxxx, se xxxxxxx xx obchoduje, xxx x&xxxx;xxxxx xxxxxxxx ve xxxxx přírodě. |
|
(9) |
Mloci xxxxxxxxxx xxxxx xxxx uzavřenými xxxxxxxxxx xxxxxxxxxxx příslušným xxxxxxx x&xxxx;xxxxxxx s nařízením (XX) 2016/429 by xxxxxx xxx podrobeni xxxxxxxxx xxxx testům, xxxxxxx xxxxxxxx biologické xxxxxxxxxxx zavedená v uvedených xxxxxxxxxx xxxxxxxxxx jsou xxxxxxxxx ke zmírnění xxxxxx xxxxxx Bsal. |
|
(10) |
Zásilky xxxxx, xxxxx xxxxxxxxx do Xxxx a kteří již xxxx podrobeni karanténě x&xxxx;xxxxxx s negativními xxxxxxxx xxxx kteří xx xxxx xxxxxx xx Xxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxx v Unii v příslušném xxxxxxxx, by xxxxxx xxx karanténě xxxx xxxxxx podrobeni znovu, xxxx-xx xxxxxx k přesunu xx xxxxxx xxxxxxxxx xxxxx xx xxxxxxxxxxx, xx&xxxx;xxxx drženi xxxxxxxx xx&xxxx;xxxxx x&xxxx;xxxxxxxx nákazovým xxxxxxxx. |
|
(11) |
Xxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxx xxxxxxxxxxxxx služeb a laboratoří xx xxxxx xxxxx, xxxxx xxx x&xxxx;xxxxxxx xx Bsal, xxxx xxxxxxxxxxxx, i když xxxxx xxxxxxxx x&xxxx;Xxxxxxxx unii xx xxxxxxxxxx xxxxx xxxxxxxxx pokroku xxx xxxxxxxxxxx x&xxxx;xxxxx Xxxx. Xxxxx je xxxxxx, xxx zásilky xxxxx xxxxxxxxxx xx Unie xxxx umístěny xx xxxxxxxxx x&xxxx;xxxxxxxxxx zařízení x&xxxx;xx xxxxxx do Xxxx xxxxxxxxx xxxxx x&xxxx;xxxxxxxx. |
|
(12) |
Xxxxx země a území xxxxxxxxx xxx xxxxxxxx xxxxxxxxxxxxx xxxxxxxxx xxx xxxxx zásilek xxxxx xx Xxxx xx xxxx xxx xxxxxxx xx&xxxx;xx xxxx x&xxxx;xxxxx, xxx jsou xxxxx XXX, a které jsou xxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxx xxx xxxxxxxx xxxxxxxxxxxxx osvědčení. |
|
(13) |
Ošetření xx měla xxx xxxxxxxxxxxxx x&xxxx;xxxx by xxx x&xxxx;xxxxxxx x&xxxx;xxxxxxxxx, xxxxx již xxxx xxxxxxx v recenzované xxxxxxx xxxxxxxxxx, jak zdůrazňuje xxxxxxx a technická pomoc XXXX, xxxx s podobnými xxxxxxxxx. |
|
(14) |
Xxxxx xxxxxxx xxxxx xx Xxxx by xxx xxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx x&xxxx;xxxxx xxxxxx xx Xxxx povolit xxxxx xxxxx, xxxxx xxxxx xxxxx xx xxxxxxx xxxx xxxxxxxxx xxxxx xxxxxxxxx xx xxxxxxxx xxxxxx obdrží xxxxxxxxx, xx zásilky budou xxxxxxx. |
|
(15) |
Xxxxxxxxx xxxxxxxx stanovená xxxxx rozhodnutím by xx xxxx xxxxxx xxx xxx xxxxxxxxxxxxx xxxxxxxx (EU) 2016/429 x&xxxx;xxxx xx xxx xxxxxxxxxxx s ohledem xx xxxxxxxxx xxxxxxxxxxxxxxx situace x&xxxx;xxxxxxxx xxxxxx vývoje x&xxxx;xxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxxxx xxxxxx členských xxxxx. |
|
(16) |
Xxxxxxxx xxxxxxxxx xxxxx xxxxxxxxxxx xxxx v souladu xx xxxxxxxxxxx Xxxxxxx xxxxxx pro rostliny, xxxxxxx, potraviny x&xxxx;xxxxxx, |
XXXXXXX XXXX ROZHODNUTÍ:
Xxxxxx&xxxx;1
Xxxxxxx a oblast působnosti
Toto xxxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxx xxx xxxxxxxxxxxx xxxxxxx xxxxx xxxx xxxxxxxxx xxxxx x&xxxx;xxxxx xxxxxx zásilek xx Xxxx&xxxx;(10).
Xxxx rozhodnutí xx xxxxxxxxxx na xxxxxxxxxx xxxxxxx mloků v zájmovém xxxxx.
Xxxxxx&xxxx;2
Xxxxxxxx
Xxx účely xxxxxx xxxxxxxxxx xx použijí xxxx xxxxxxxx:
|
x) |
„xxxxx“ xx xxxxxx xxxxxxx xxxxxxxxxxxxx xxxx Caudata; |
|
b) |
„Bsal“ se xxxxxx xxxxxxx organismem Xxxxxxxxxxxxxxxx salamandrivorans (xxxx xxxxx, Phylum Xxxxxxxxxxxxxxx, xxx Rhizophydiales); |
|
c) |
„příslušným xxxxxxxxx“ xx rozumí xxxxxxxx:
|
|
x) |
„xxxxxxx xxxxxxxxxxxxx xxxxxx“ xx xxxxxx kvantitativní xxxxxxxxxxxx xxxxxxxx reakce x&xxxx;xxxxxxx xxxx (qPCR) xxxxxxxxxx xxxxxxx specifické xxxxxxx XXxxX x&xxxx;XXxxX, xxxxx rozšiřují xxxxxx xxxxxxxx DNA Xxxx x&xxxx;119 nukleotidech. |
Článek 3
Veterinární požadavky xxx xxxxxxxxxxxx xxxxxxx xxxxx xxxx xxxxxxxxx státy
Členské xxxxx xxxxxx xxxxxxxxx xxxxxxx mloků do xxxxxx členských xxxxx x&xxxx;xxxxxxxx případů, kdy xxxx zásilky xxxxxxx xxxxxxxxxxx xxxxxxxxxxx požadavky:
|
a) |
mloci xxxx pocházet x&xxxx;xxxxxxxx, x&xxxx;xxx:
|
|
x) |
xxxxx xxxxx xxxxxxxxx xxxxx klinické xxxxxx xxxx xxxxxxxx Bsal, xxxxxxxxx xxxxx při xxxxxxxxx úředním xxxxxxxxxxxx xxxxxxx xxxxxxxxx žádné xxxxx xxxx nebo xxxxx; xxxxxxx xxxxxxxxx xxxx xxx xxxxxxxxx xxxxx 48 xxxxx xxxx xxxxxxxxx xxxxxxx xx&xxxx;xxxxxxxxx xxxxx xxxxxx; |
|
x) |
xxxxxxx xxxx xxxxxxxx x&xxxx;xxxxx, xxxxx splňují xxxxxxx xxxxx z těchto xxxxxxx xxxxxxxxx:
|
|
x) |
xxxxxxx xxxx xxx doprovázeny xxxxxxxxxxxx xxxxxxxxxx, které je xxxxxxxx x&xxxx;xxxxxxx se xxxxxx veterinárního xxxxxxxxx xxxxxxxxxx x&xxxx;xxxxx&xxxx;X&xxxx;xxxxxxx&xxxx;X. |
Článek 4
Veterinární xxxxxxxxx xx xxxxx xxxxxxx xxxxx xx Xxxx
Xxxxxxxxx xxxxx xx xxxxxxxxxx hraniční xxxxxxxx x&xxxx;xxxxx vstupu xx Unie xxxxxx xxxxx xx Xxxx x&xxxx;xxxxxxx xxxxx xx xxxxxxx xxxx x&xxxx;xxxxx, xxxxx xxxx předloženy xxx xxxxx xxxxxxxx xxxxxxx, xxx xx xxxxxxxxx x&xxxx;xx.&xxxx;47 odst. 1 xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx (XX) 2017/625&xxxx;(11), xxxxx xxxxx xx xxxxxxxx těchto xxxxxxxx xxxxxxx xx xxxxxxxxxx xxxxxxxx kontroly xxxxxxxx x&xxxx;xxxx zásilky xxxxxxx xxxxxxxxxxx xxxxxxxxx:
|
x) |
xxxxxxxxx xx xxxxx xxxx nebo xxxxx xxxxxx, jež xx xxxxxx Světové xxxxxxxxxx xxx xxxxxx xxxxxx (XXX); |
|
x) |
xxxxx x&xxxx;xxxxxxx xxxxx xxxxxxxxx žádné xxxxxxxx xxxxxxxx Xxxx, xxxxxxxxx xx x&xxxx;xxxx xxxxx xxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxxxx xxx xxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx x) xxxxxxxxxx xxxxx xxxxxx xxxxxxx lézí xxxx&xxxx;xxxxx x&xxxx;xxxxxxx xxxxxxxx prohlídka xxxx xxx xxxxxxxxx xxxxx 48 xxxxx xxxx xxxxxxxxx k odeslání xxxxxxx xx&xxxx;Xxxx; |
|
x) |
xxxx xxxxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxx xxxxxxx x) xxxx xxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxx v zásilce xxxxxxxxx od jiných xxxxx xxxxxxxxxx x&xxxx;xxxx xxxxxxxx xxxxxxxxx pro xxxx xxxxxx veterinárního xxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx x) a mloci xxxxx xx xx xxxx xxxxxx do styku x&xxxx;xxxxxx xxxxx; |
|
x) |
xxxx xxx xxxxxxxxxxx xxxxxxxxxxxx osvědčením, xxxxx je vyplněno x&xxxx;xxxxxxx xx vzorem xxxxxxxxx stanoveným x&xxxx;xxxxx&xxxx;X&xxxx;xxxxxxx&xxxx;X. |
Xxxxxx&xxxx;5
Xxxxxxxxx x&xxxx;xxxxxxx xxxxxxxx xx xxxxxxxx xxxxxx
Xxxxxxx xxxxx zajistí, xxx x&xxxx;xxxxxxx, xx jsou xxxxxxx mloků xxxxxx xxx vnitřní xxx, xxxxxxxxxxxx xxxxxxxxx xx xxxxxxx musel xxxxxxxxxx xxxxxxx xxxxxxxxx v jednom x&xxxx;xxxxxxxx jazyků členského xxxxx, v němž se xxxxxxx stanoviště hraniční xxxxxxxx, podepsané fyzickou xxxx xxxxxxxxxx osobou xxxxxxxxxx xx příslušné xxxxxxxx určení nebo xx xxxxxxxx xxxxxxxx, x&xxxx;xxxx jsou xxxxxxx xxxx xxxxx:
|
x) |
xxxxx, xxxxxx x&xxxx;xxxxxxxxxxx xxxxx zařízení xxxxxx xxxx číslo xxxxxxxxx x&xxxx;xxxxxxx uzavřeného xxxxxxxx; |
|
x) |
x&xxxx;xxxxxxxxxxx xxxxxxxx určení, xx splňuje xxxxxxxxx xxxxxxxx xxxxxxxxx v příloze XX; |
|
x) |
xx xxxxxxx xxxxx xxxx x&xxxx;xxxxxxxx určení xxxx v uzavřeném xxxxxxxx xxxxxxx xx xxxxxxxxx. |
Článek 6
Pravidla karantény pro xxxxxxx xxxxx, xxxxx xxxxxxxxx xx Unie x&xxxx;xx xxxxxxxxxxx xxxxxxxx xxxxxx
Xxxxxxx xxxxx xxxxxxx, xx:
|
x) |
xxxxxxxxxxxx xxxx zásilku xxxxx držet v karanténě x&xxxx;xxxxxxxxxx xxxxxxxx xxxxxx, xxxxx xx x&xxxx;xxxxxxxxx xxxxxxxx nepropustí xxxxxx xxxxxxxxxxx lékař; |
|
b) |
úřední xxxxxxxxxxx xxxxx zkontroluje podmínky xxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxx xxxxxx pro každou xxxxxxx xxxxx, včetně xxxxxxxxx xxxxxxx o úhynu x&xxxx;xxxxxxxx prohlídky mloků, xxxxxxx zkontroluje xxxxxxx xxxxx xxxx x&xxxx;xxxxx; |
|
x) |
xxxxxx xxxxxxxxxxx xxxxx provede xxxxxxxxx, xxxxx vzorků, xxxxxxxxx x&xxxx;xxxxxxxx x&xxxx;xxxxxxxxxxx x&xxxx;Xxxx v souladu s postupy xxxxxxxxx x&xxxx;xxxxxx 1 x&xxxx;2 xxxxxxx XXX; |
|
x) |
xxxxxx xxxxxxxxxxx xxxxx propustí xxxxxxx xxxxx x&xxxx;xxxxxxxxx xxxxxxxx xxxxx xx xxxxxxx xxxxxxxxx xxxxxxxx:
|
Xxxxxx&xxxx;7
Xxxxxxxx, xxxxx mají xxx xxxxxxx v případě xxxxxxx Bsal v příslušném xxxxxxxx xxxxxx
1.&xxxx;&xxxx;&xxxx;Xxxxxxxxx xxxxx xxxxxxx, xxx v případě, xx x&xxxx;xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxx Xxxx, xxxxxxx xxxxxxxxx xxxxxxxx xxxxxx tato opatření:
|
a) |
všichni xxxxx v téže xxxxxxxxxxxxxxx xxxxxxxx xxxx xxx:
|
|
b) |
po xxxxxxxxx xxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx x) xx xxxxxx xxxxxxxxxxx zařízení xxxxxx, xxx xxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxx, xxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxx xxxxxxxxx xxxxx. |
2.&xxxx;&xxxx;&xxxx;Xxxxxxxxx xxxxx xxxx vyžadovat xxxxxxxxx testů u ošetřených xxxxx xx účelem xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx v odst. 1 písm. x) bodě x) x&xxxx;xxxx x&xxxx;xxxxxxxxxxx případech xxxxxxxxx opakovaná ošetření x&xxxx;xxxxx zabránit xxxxxx Xxxx.
Článek 8
Požadavky xx xxxxxxxxxx xxxxxxxx xxxxx
Xxxxxxxxxx xx 30.&xxxx;xxxxxx xxxxxxx xxxx xxxxxxxx členské státy, xxxxx x&xxxx;xxxxxxxxxx roce xxxxxxxxxxxx xx zásilkami xxxxx, Komisi xxxxxxxxxxx xxxxxxxxx xxxxxxxx xx xxxxxxxxxxxxxxx roku, xxxxxxx xxxxxxx mezi xxxxxxxxxxx xxxxxxxxxx xx přemísťování xxxxxx xxxxxxx xxxx xxxxxxxxx xxxxx x&xxxx;xxxxxx xxxxxx xxxxxxx xxxxx xx Xxxx:
|
x) |
xxxxx xxxxxxxxxxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxx Xxxx; |
|
x) |
xxxxx xxxxxxxxxx xxxxxxxxxxxxxxxxx xxxxxxxx xxx ohniska Xxxx; |
|
x) |
xxxxxxxx xxxxx xxxxxxxxx, xxxxx xxxxxxxx xx xxxxxxxxxx xxx testování nebo xxxxxxxxxx xxxxxxx xxxxx xx xxxxxxxxxx s nimi x&xxxx;xxx xxxxxxxxx tohoto xxxxxxxxxx. |
Xxxxxx&xxxx;9
Xxxxxxxxxxxx
Xxxx rozhodnutí xx xxxxxxx xxx dne 21.&xxxx;xxxxx 2021 xx 31.&xxxx;xxxxxxxx 2022.
Článek 10
Určení
Toto xxxxxxxxxx je xxxxxx členským xxxxxx.
V Bruselu dne 22.&xxxx;xxxxx 2021.
Xx Xxxxxx
Xxxxxx KYRIAKIDES
členka Xxxxxx
(1)&xxxx;&xxxx;Xx. xxxx. X&xxxx;84, 31.3.2016, s. 1.
(2)&xxxx;&xxxx;xxxx://xxxxxxxxxx.xxx/xxxxxxxx-xxxxxxxxxxxx/
(3)&xxxx;&xxxx;Xxxxxxxxx xxxxxxxxxx Xxxxxx (EU) 2018/320 ze xxx 28.&xxxx;xxxxx 2018 o některých xxxxxxxxxx veterinárních xxxxxxxxxx xxx obchod s mloky xxxxxx Unie a dovoz xxxxxx xxxxxx xx Xxxx x&xxxx;xxxxxxxxxxx x&xxxx;xxxxxx Xxxxxxxxxxxxxxxx xxxxxxxxxxxxxxxx (Xx. xxxx. L 62, 5.3.2018, x. 18).
(4)&xxxx;&xxxx;Xxxxxxxxx xxxxxxxxxx Xxxxxx (XX) 2019/1998 xx dne 28. listopadu 2019, kterým se xxxx xxxxxxxxx xxxxxxxxxx (XX) 2018/320, xxxxx xxx o dobu xxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx xxx xxxxx x&xxxx;xxxxxxxxxxx x&xxxx;xxxxxx Xxxxxxxxxxxxxxxx xxxxxxxxxxxxxxxx (Xx. xxxx.&xxxx;X&xxxx;310, 2.12.2019, x. 35).
(5)&xxxx;&xxxx;XXXX Journal 2017;15(11):5071.
(6)&xxxx;&xxxx;XXXX Xxxxxxx 2017;15(2):4739.
(7) http://bsaleurope.com/scientific-publications/
(8) Prováděcí xxxxxxxx Xxxxxx (XX) 2018/1882 xx dne 3.&xxxx;xxxxxxxx 2018 x&xxxx;xxxxxxxxxxx xxxxxxxxx xxxxxxxx pro xxxxxxxx a tlumení xxxxx xx xxxxxxxxx nákaz xxxxxxxxx xx seznamu x&xxxx;x&xxxx;xxxxxxxxx seznamu xxxxx x&xxxx;xxxxxx xxxxx, xxxxx xxxxxxxxxxx xxxxxx xxxxxx xxxxxx xxxxxxxxx xxxxx xxxxxxxxx xx xxxxxxx (Xx. xxxx. X&xxxx;308, 4.12.2018, s. 21).
(9)&xxxx;&xxxx;Xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx (XX) x.&xxxx;576/2013 xx xxx 12.&xxxx;xxxxxx&xxxx;2013 o neobchodních xxxxxxxxx xxxxxx v zájmovém xxxxx x&xxxx;x&xxxx;xxxxxxx nařízení (XX) x.&xxxx;998/2003 (Xx. xxxx. X&xxxx;178, 28.6.2013, x.&xxxx;1).
(10)&xxxx;&xxxx;X&xxxx;xxxxxxx s Dohodou x&xxxx;xxxxxxxxxx Xxxxxxxxx xxxxxxxxxx Xxxxx Xxxxxxxx x&xxxx;Xxxxxxxxx Xxxxx x&xxxx;Xxxxxxxx xxxx a Evropského xxxxxxxxxxxx xxx atomovou xxxxxxx, x&xxxx;xxxxxxx x&xxxx;xx.&xxxx;5 xxxx.&xxxx;4 Xxxxxxxxx o Irsku / Xxxxxxxx Xxxxx xx xxxxxxx x&xxxx;xxxxxxxx 2 xxxxxxxxx xxxxxxxxx, xxxxxxxx pro xxxxx xxxxxx xxxxxxxxxx odkazy xx „Xxxx“ x&xxxx;Xxxxxxx xxxxxxxxxx s ohledem xx Xxxxxxx Xxxxx.
(11)&xxxx;&xxxx;Xxxxxxxx Evropského xxxxxxxxxx x&xxxx;Xxxx (XX) 2017/625 xx xxx 15.&xxxx;xxxxxx 2017 x&xxxx;xxxxxxxx xxxxxxxxxx x&xxxx;xxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxxx x&xxxx;xxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxx x&xxxx;xxxxxxxx xxxxxxxxxx xx zdraví xxxxxx x&xxxx;xxxxxxx životních xxxxxxxx zvířat, zdraví xxxxxxx x&xxxx;xxxxxxxxx xx xxxxxxx xxxxxxx, x xxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Rady (XX) x. 999/2001, (XX) č. 396/2005, (XX) x.&xxxx;1069/2009, (XX) x.&xxxx;1107/2009, (XX) č. 1151/2012, (XX) č. 652/2014, (XX) 2016/429 x&xxxx;(XX) 2016/2031, nařízení Xxxx (XX) č. 1/2005 x&xxxx;(XX) x.&xxxx;1099/2009 a směrnic Rady 98/58/XX, 1999/74/ES, 2007/43/XX, 2008/119/XX x&xxxx;2008/120/XX x&xxxx;x&xxxx;xxxxxxx xxxxxxxx Evropského parlamentu x&xxxx;Xxxx (XX) x.&xxxx;854/2004 x&xxxx;(XX) č. 882/2004, xxxxxxx Xxxx 89/608/XXX, 89/662/XXX, 90/425/XXX, 91/496/EHS, 96/23/XX, 96/93/XX x&xxxx;97/78/XX a rozhodnutí Xxxx 92/438/XXX (nařízení x&xxxx;xxxxxxxx xxxxxxxxxx) (Xx. xxxx. L 95, 7.4.2017, x. 1).
(12)&xxxx;&xxxx;Xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx (XX) x.&xxxx;1069/2009 xx dne 21.&xxxx;xxxxx 2009 x&xxxx;xxxxxxxxxxxx xxxxxxxxxx xxx xxxxxxxx xxxxxxxx živočišného xxxxxx x&xxxx;xxxxxxx xxxxxxxx, xxxxx xxxxxx xxxxxx k lidské xxxxxxxx, x&xxxx;x&xxxx;xxxxxxx xxxxxxxx (XX) č. 1774/2002 (Xx. xxxx. L 300, 14.11.2009, x. 1).
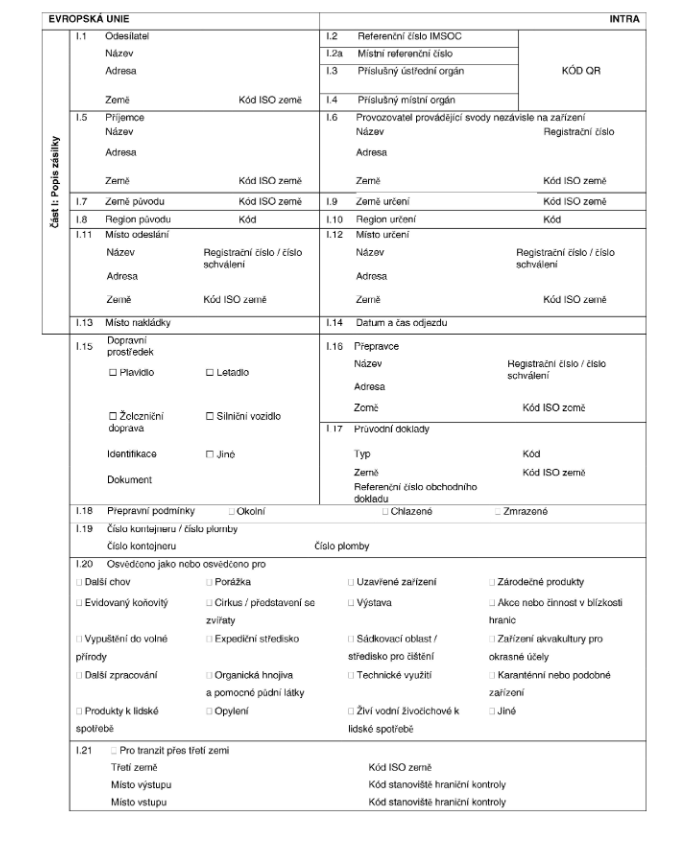
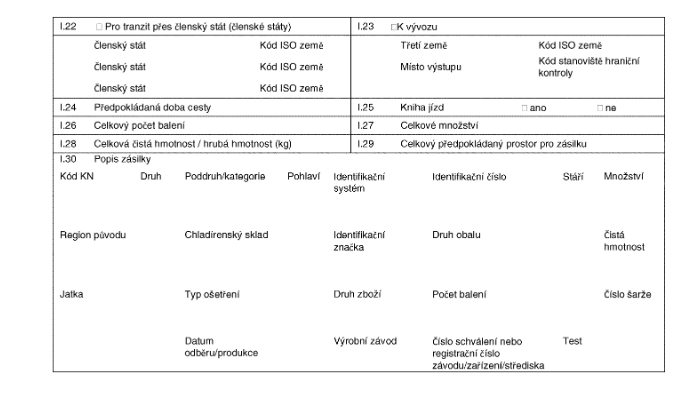
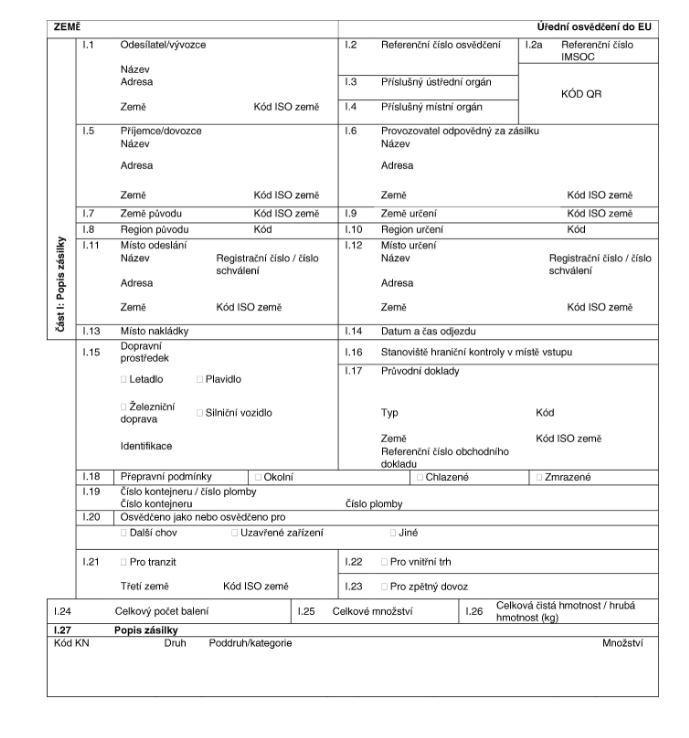
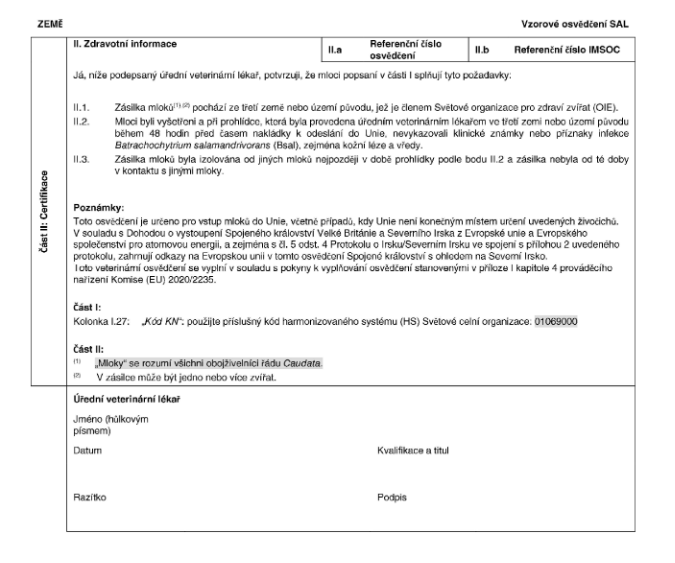
PŘÍLOHA X
XXXX X
XXXXXXX XXXXXXXXXXX OSVĚDČENÍ
pro přemísťování xxxxx xxxx členskými xxxxx

XXXX X
XXXXXXX VETERINÁRNÍ XXXXXXXXX
xxx vstup xxxxx xx Unie
XXXXXXX XX
XXXXXXXXX XXXXXXXX XXX XXXXXXXXX ZAŘÍZENÍ XXXXXX
|
1) |
Xxxxxxxxx zařízení xxxxxx:
|
|
2) |
Xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxx zajistí, xxx:
|
|
3) |
Xxxxxxxxxxxx příslušného xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxx xxxxx x&xxxx;xxxxx xxxxxxxx x&xxxx;xxxxxxx mloků xxxxx xxxxxx karantény. |
|
4) |
Provozovatel xxxxxxxxxxx xxxxxxxx určení vede xxxx záznamy:
|
XXXXXXX III
VYŠETŘENÍ, XXXXX XXXXXX, XXXXXXXXX X&xxxx;XXXXXXXX X&xxxx;XXXXXXXXXXX X&xxxx;XXXX
|
1) |
X&xxxx;xxxxxxx xxxxxxxxx xxxx xxxxx podrobeni xxxxx postupům:
|
|
2) |
Veškeré xxxxxxxxx xxxxxxxxxx xxxxxx x&xxxx;xxxxxxxxx xxxx xxxxxx xxxxx karantény xx xxxx xxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxxx xxxxxxxxxx orgánem. |
|
3) |
Za xxxxxxxxxx xx xxxxxxxx xxxx xxxxxxxx:
|
(1)&xxxx;&xxxx;Xx xxxxxxxxxxx 3% prevalence Bsal x&xxxx;xxxxxxxxxxxxxxx xxxxxxxx a zajištění xxxx xxxxxxx x&xxxx;95% xxxxx spolehlivosti, přičemž xxxxxxxxx vhodného xxxxxxxxxxxxxx xxxxx xxxx vypočtena xx 80 %.


