Xxxxxxxx Komise 96/54/xx
xx xxx 30. xxxxxxxx 1996,
xxxxxx xx po xxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxxxx směrnice Xxxx 67/548/XXX x xxxxxxxxxx xxxxxxxx x xxxxxxxxx předpisů týkajících xx xxxxxxxxxxx, xxxxxx x xxxxxxxxxx xxxxxxxxxxxx xxxxx
XXXXXX XXXXXXXXXX XXXXXXXXXXXX,
x xxxxxxx na Smlouvu x založení Xxxxxxxxxx xxxxxxxxxxxx,
x ohledem xx xxxxxxxx Rady 67/548/XXX xx xxx 27. xxxxxx 1967 o xxxxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxx týkajících xx xxxxxxxxxxx, balení x xxxxxxxxxx xxxxxxxxxxxx xxxxx [1], xxxxxxxxx xxxxxxxxxx xxxxxxxx Xxxxxx 94/96/XX [2], x xxxxxxx xx článek 28 xxxxxxx xxxxxxxx,
xxxxxxxx x xxxx, xx xxxxxxx X xxxxxxxx Xxxx 67/548/XXX xxxxxxxx xxxxxx xxxxxxxxxxxx látek, xxxxxx xxxxxxxxxxx, označování x v xxxxxxx xxxxxxx xxxxxx xxxxxxxxxxxxxx xxxxxxxxxxxxxxx koncentračních xxxxxx x xxxxxx parametrů xxxxxxxxxxxx zhodnocení xxxxxx xxxxxx pro zdraví xxxxxxx a xxxxxxx xxxxxxxxx; xx xxxxxx xxxxxxxxxxxx xxxxx v xxxxxxx I xxxxxxxx xxxxxx xxxxx současných xxxxxxxxx a xxxxxxxxxxx xxxxxxxx; xx x xxxxxxxx xxxx xx xxxxxxxx změnit xxxx xxxxxxx X xxx, xxx xxxxxxxxx xxxxxxxx xxxxxxxx xx xxxxxxxxxx xxxxxxxxx x novou xxxxxxx organických xxxxx x xxxxxxx X; xx xxxxxx xxxxxxxxxxxx xxxxx v příloze X xxxxxxxx látky, xxx xxxxx byly xxxxxxxxxx Rakousku x Xxxxxxx x aktu x xxxxxxxxxxx Xxxxxxxx, Xxxxxx x Xxxxxxx xxxxxxxxxx dočasné xxxxxxxx xxxxxxxx se klasifikace x xxxxxxxxxx; že xxx x přistoupení xxxxxxxxxxx přezkoumání xxxxxxxxx xx xxxxxxxxxxx x xxxxxxxxxx těchto xxxxx; xx xxxxx xxxx xxxxxxxxxxx xxxxxxxxxxx některých xxxxxx xxxxx;
xxxxxxxx k xxxx, xx příloha XXX xxxxxxxx 67/548/EHS xxxxxxxx xxxxxx xxx xxxxxxxxxxx xxxxxxxx rizika xxxxxxx x nebezpečnými xxxxxxx a xxxxxxxxx; xx xx potřeba xxxxxx xxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxx x xxxxxxxxx pro xxxxxx;
xxxxxxxx x xxxx, xx xxxxxxx V xxxxxxxx 67/548/XXX xxxxxxx xxxxxx xxx xxxxxxxxx xxxxxxxxx-xxxxxxxxxx xxxxxxxxxx, xxxxxxxx x ekotoxicity xxxxx x xxxxxxxxx; že xx xxxxxxxx xxxxxxxxxxxx xxxx přílohy xxxxxxxxxxx xxxxxxx;
xxxxxxxx k tomu, xx příloha VI xxxxxxxx 67/548/XXX xxxxxxxx xxxxxx kritéria pro xxxxxxxxxxx a xxxxxxxxxx xxxxxxxxxxxx látek x xxxxxxxxx; xx xx xxxxx xxxxxx xxxxxxxx xxx xxxxx x xxxxxxxxx xxxxxxxxxx xxx xxxxxx, xxxxx xxxx xxxxxxxxxx; xx xxxxxxxx xxx xxxxxxxxxxxxxxx xxxxx x přípravky xx xxxxx xxxxxx; že xx xxxxx zavést xxxxxxxx xxx xxxxxxxxxx xxxxxxxxx xxxxx určených xxx xxxxxx, butan x xxxxxxxxxx xxxxx xxxx (XXX);
xxxxxxxx k xxxx, xx xxxxxxxx xxxx xxxxxxxx jsou x souladu xx xxxxxxxxxxx Xxxxxx pro xxxxxxxxxxxx technickému pokroku xxxxxxx x xxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxx xx xxxxx nebezpečných xxxxx a xxxxxxxxx,
XXXXXXX XXXX XXXXXXXX:
Xxxxxx 1
Xxxxxxxx 67/548/XXX xx xxxx xxxxx:
1. Xxxxxxx X xx xxxx takto:
a) V xxxxxxxxx xx poznámka 4 xxxxxxxxx xxxxx:
"Xxxxxxxx 4
Xxxxxxxxx xxxxxxxxxx tyto xxxxx xxxx xxx xxxxxxxxxxxxx xxxx xxxxxx xxxxxxxx s xxxxx X 65, pokud xxxxxxx xxxxxxxx x xxxxxxx XX xxxxx 3.2.3.";
x) doplňuje se xxxxxxxx 5, xxxxx xxx:
"Xxxxxxxx 5
Xxxxxxxxxxxx limity xxx xxxxxx xxxxxxxxx xxxx vyjádřeny v xxxxxxxxxx xxxxxxxxxx";
x) x xxxxxxx X v xxxxxxxxx xxxxxxx X xxxxxxxx 67/548/EHS xx xxxxxx xxxx xxxxxxxxxxx xxx organické xxxxx:

x) xxxxxxxxxxxx položky uvedené xxxxxxxx se xxxxxxxxx xxxxxxxxx xxxxxxx I xxxx xxxxxxxx;
x) poprvé xx vkládají xxxxxxx xxxxxxx XX xxxx xxxxxxxx;
x) zrušují se xxxxxxx s xxxxxx xxxxx:
008-002-00-3
612-045-00-9
648-011-00-5
648-025-00-1
648-157-00-X
648-158-00-5
648-159-00-0
649-192-00-3
x) xxxxxxx x xxxxxxx XXX xxxxxxx xxxxxxxx se mění xxx, že všechny xxxxxx xx "R 22" xx nahrazují xxxxxx xx "X 65".
2. V xxxxxxx XXX xx vkládá xxxx věta, která xxx:

3. Xxxxxxx V xxxx B xx xxxx xxxxx:
x) xxxxxxx x xxxxxx xxxx x xxxxx X: Xxxxxx xxx xxxxxxxxx xxxxxxxx xx nahrazuje xxxxxx x xxxxxxx XX A xxxx xxxxxxxx;
x) xx xxxxxxxx X.1 x) se xxxxxx text v xxxxxxx XX B xxxx xxxxxxxx;
x) kapitola X.6 xx xxxxxxxxx xxxxxx x xxxxxxx XX C této xxxxxxxx;
x) kapitola X.7 xx nahrazuje xxxxxx x příloze XX X této xxxxxxxx;
x) xxxxxxxx xx xxxx x xxxxxxx IV X xxxx xxxxxxxx.
4. Xxxxxxx VI xx xxxx a zní xxxxxxxx xxxxxxxx x xxxxxxx X xxxx xxxxxxxx.
Xxxxxx 2
1. Xxxx xx xxxxxx odstavec 2, xxxxxxx xxxxx xxxxxx x účinnost xxxxxx x xxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxxxx souladu x xxxxx směrnicí xxxxxxxxxx xx 31. května 1998. Členské xxxxx x xxxx xxxxxxxxxx xxxxxxx Xxxxxx.
2. Nejpozději xx 31. října 1997 členské xxxxx xxxxxx x xxxxxxxx xxxxxx a správní xxxxxxxx xxxxxxxx x xxxxxxxx souladu x xxxxxxxx X body X, I a X xxxx směrnice. Xxxxxxx xxxxx x xxxx xxxxxxxxxx xxxxxxx Xxxxxx.
3. Xxxxxxxx xxxxx xxxxxxxx 1 x 2 xxxxxxx xxxxxxxxx xxxxx xxxx xxxxxxxxx xxxxx xx xxxx xxxxxxxx nebo xxxx xxx xxxxxx xxxxx xxxxxx xxx xxxxxx xxxxxxx xxxxxxxxx. Xxxxxx xxxxxx si xxxxxxx xxxxxxx xxxxx.
Článek 3
Xxxx směrnice xxxxxxxx v xxxxxxxx xxxxxxxx dnem po xxxxxxxxx x Úředním xxxxxxxx Xxxxxxxxxx xxxxxxxxxxxx.
Xxxxxx 4
Xxxx xxxxxxxx xx xxxxxx xxxxxxxx xxxxxx.
X Xxxxxxx xxx 30. xxxxxxxx 1996.
Za Xxxxxx
Xxxx Xxxxxxxxxxx
xxxxxx Xxxxxx
[1] Xx. xxxx. X 196, 16. 8. 1967, s. 1.
[2] Úř. xxxx. X 381, 31. 12. 1994, x. 1
XXXXX X — XXXXX X — XXXXXX X — ΠΑΡΑΡΤΗΜΑ X — XXXXX X — XXXXXX X — XXXXXXXX X — XXXXXXX X — XXXXX X — XXXXX X — XXXXXX X — XXXXXXX I
XXXXX XX — XXXXX XX — XXXXXX XX — ΠΑΡΑΡΤΗΜΑ XX — XXXXX XX — XXXXXX XX — XXXXXXXX XX — XXXXXXX XX — XXXXX XX — XXXXX XX — XXXXXX XX — XXXXXXX XX
XXXXX XXX — XXXXX XXX — XXXXXX III — ΠΑΡΑΡΤΗΜΑ XXX — XXXXX XXX — XXXXXX III — XXXXXXXX III — XXXXXXX XXX — XXXXX III — XXXXX XXX — XXXXXX III — XXXXXXX III
Indexové xxxxx

PŘÍLOHA IV X
" XXXX X: METODY XXXXXXXXX XXXXXXXX A XXXXXX ÚČINKŮ NA XXXXXX
XXXXXX ÚVOD: XXXX X
X. XXXXXXXXXXX
Xxx xxxxx xxxxxxxx úvodu je xxxxxxx xxxx číslování:
B.15 Xxxxxxx xx genové xxxxxx x Xxxxxxxxxxxxx xxxxxxxxxx
X.16 Xxxxxxx xx xxxxxxxxxx xxxxxxxxxxx u Xxxxxxxxxxxxx xxxxxxxxxx
X.17 Zkouška xx xxxxxx mutace x savčích xxxxxxx xx vitro
B.18 Zkouška xx poškození a xxxxxxxx XXX – xxxxxxxxxxxx xxxxxxx XXX – x xxxxxxx xxxxxxx xx vitro
B.19 Xxxxxxx na výměnu xxxxxxxxxxx xxxxxxxxx xx xxxxx
X.20 Xxxxxxx xx xxxxxxxxx xxxxxxx xxxxxx xxxxxx xx xxxxxxx x Drosophila xxxxxxxxxxxx
X.21 Xxxxxxx xx xxxxxxxxxxxx xxxxxxx xxxxx xx xxxxx
X.22 Xxxxxxxxxx letální xxxxxxx na xxxxxxxxxx
X.23 Xxxxxxxxxxxxx analýza xxxxxxx xxxxxxxxxxx xxxxx xx xxxx
X.24 Spot test xx xxxxxx
X.25 Zkouška xx dědičnou xxxxxxxxxxx x xxxx
X.26 Xxxxxxx xxxxxxxxxxxx orální xxxxxxxx: 90xxxxx xxxxxxxxx xxxxxx xxxxxxxx na xxxxxxxxxx
X.27 Xxxxxxx subchronické orální xxxxxxxx: 90denní xxxxxxxxx xxxxxx xxxxxxxx na xxxxxxxxxxxx
X.28 Xxxxxx subchronické xxxxxxxx xxxxxxxx: 90denní xxxxxxxxx xxxxx aplikace xx hlodavcích
B.29 Xxxxxx xxxxxxxxxxxx inhalační xxxxxxxx: 90xxxxx opakovaná xxxxxxxxx xxxxxxxx xx xxxxxxxxxx
X.30 Xxxxxxx xxxxxxxxx toxicity
B.31 Xxxxxxx teratogenity xx xxxxxxxxxx x xxxxxxxxxxxx
X.32 Xxxxxxx karcinogenity
B.33 Xxxxxxxxxxx xxxxxxx chronické toxicity x karcinogenity
B.34 Jednogenerační xxxxxxx toxicity pro xxxxxxxxxx
X.35 Dvougenerační zkouška xxxxxxxx xxx reprodukci
B.36 Xxxxxx xxxxxxxxxxxxxx
X. XXXXXX XXXXXXXX XXXXXXX XXXXXXXXX XX XXXXXXXXXX XXXXXXXX XXXXXXXXX V TÉTO XXXXXXX
x) Xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxx, xxxxx xx xxxxxxx x daném časovém xxxxxx (xxxxxxx 14 xxx) xx podání xxxxx xxxxx xxxxx.
xx) Xxxxxx xxxxxxxx xx xxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx toxicity xx podání xxxxxxxx xxxxx. Xxxx xxxxxxxx xx xxxx xxx xxxxxxxxxx zřetelné xxx xxxxxxxxx xxxxxxxxxxxxx a xxxx xx xxx xxx xxxxx, že xxx xxxxxxx xxxxxx xxxxx xxx xxxxxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxx x xxxxxxxxxxxxxx xxxxxxxxx.
xxx) Dávka xx xxxxxxxx xxxxxx xxxxxxxx xxxxx. Xxxxx xx xxxxxxxxx jako xxxxxxxx xxxxxxxx xxxxx (x xxxxxxx xxxx xxxxxxxxxxx) xxxx xxxx hmotnost xxxxxxxx xxxxx xx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxx (xxxx. x xxxxxxxxxxx xx kilogram xxxxxxx xxxxxxxxx) xxxx xxxx xxxxxxxxxx xxxxxxxxxxx x xxxxxxx (x xxx xxxx x xxxxxxxxxxx xx kilogram xxxxxxx).
xx) Xxxxxxxxxxxxxx xxxxx xx xxxxxxxx xx xxxx xxxxxxx xxxxxx xxxxx, xxxxx xxx xxxxx, xxxx xx xxxxxxxx xxxxxxxxx vyvolanou xxxxxx (xxxxxx humánního xxxxxxxx).
x) Xxxxxxxxx je xxxxxx termín xxxxxxxxxx xxxxx, xxxxxxx x xxxxxx xxxxxxxx látky.
vi) XX50 (xxxxxxx letální xxxxx) xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxx xxxxx, x xxx xxx xxxxxxxx, xx xxxxxxx xxxxxxx 50 % xxxxxx, xxxxxx xxxx xxxxxx. Xxxxxxx XX50 xx xxxxxxxxx x hmotnosti zkoušené xxxxx xx jednotku xxxxxxxxx xxxxxxxxx xxxxxxx (x xxxxxxxxxxx xx xxxxxxxx).
xxx) XX50 (střední xxxxxxx xxxxxxxxxxx) xx xxxxxxxxxxx vypočtená koncentrace xxxxx, x xxx xxx očekávat, xx xxxxxxx xxxxx expozice xxxx xx xxxxxx xxxx xx expozici xxxxxxx 50 % xxxxxx xxxxxxxxxxxx určitou xxxx.
Xxxxxxx LC50 se xxxxxxxxx xxxx xxxxxxxx xxxxxxxx xxxxx ve xxxxxxxxxxx objemu xxxxxxx (x miligramech xx xxxx).
xxxx) XXXXX je xxxxxxxx zkratka xxx "xx xxxxxxxx xxxxxxx xxxxxx level" (hladina xxx xxxxxxxxxxxx xxxxxxxxxxxx xxxxxx) x xxxxxxxx xxxxxxxx úrovni dávky xxxx expozice, xxx xxxxx nejsou xxxxxxxxxx xxxxx nepříznivé nálezy xxxxxxxxxxx x xxxxxxx xxxxx.
xx) Subchronická xxxxxxxx xxxx toxicita při xxxxxxxxx dávce xxxxxxxx xxxxxxxxxx účinky, xxxxx xx projeví x xxxxxxxxx xxxxxx xxxx xxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxx xxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxx xx xxxx xxxxxxxxxxxxx xxxxxx xxxx xxxxxxxxx xxxxx xxxxxx xxxxxxxxx xxxxxx.
x) Xxxxxxxxx xxxxxxxxxx xxxxx (XXX) xx nejvyšší xxxxxx xxxxx, xxxxx x zvířat vyvolá xxxxxx toxicity, aniž xx xxxx během xxxxxxx, xx xxxxx xx použita, xxxxx xxxx xx xxxxxxx xxxxxx.
xx) Xxxxx dráždivostí xx xxxxxx xxxxxxxx xxxxxxxxxxx změn na xxxx po aplikaci xxxxxxxx xxxxx.
xxx) Oční xxxxxxxxxxx se xxxxxx xxxxxxxx xxxx x xxx xx xxxxxxxx xxxxxxxx látky xx xxxxxx xxx.
xxxx) Xxxxxxxxxxxxx xxxx (xxxxxxxxx xxxxxxxxx xxxxxxxxxxx) je xxxxxxxxxxxx xxxxxxxx xxxxxx xxxx xx xxxxx.
xxx) Poleptání xxxx xx xxxxxxxx xxxxxxxxxx xxxxxxxxx kožní xxxxx xx xxxxxxxx xxxxxxxx látky po xxxx xx 3 xxx xx 4 x.
xx) Toxikokinetika je xxxxxx xxxxxxxx, distribuce, xxxxxxxxxxx a vylučování xxxxxxxxxx xxxxx.
xxx) Absorpce xx xxxxxx, xxxxxx xxxxxx látka vstupuje xx xxxx.
xxxx) Xxxxxxxxxx xx xxxxxx, kterým xxxx xxxxxx xxxxx x/xxxx xxxx xxxxxxxxxx xxxxxxxxx z xxxx.
xxxxx) Xxxxxxxxxx xx xxxxxx, xxxxxx xx xxxxxxxxxxx xxxxx a/nebo xxxx xxxxxxxxxx xxxxxxxxx v xxxx.
xxx) Metabolismus xx xxxxxx, kterým xx xxxxxx xxxxx x xxxx strukturně měněna xxxxxxxxxxxxx nebo xxxxxxxxxxxxxxx xxxxxxxx.
X.1 Xxxxxx toxicita xxx xxxxxxxxx xxxxx/xxxxxxxxxxxx x xxxxxxxxx toxicita
Akutní xxxxxxx xxxxxx látky x xxxx xxxxxxxxx xxxx xxxxxxxxxx toxicitu xxx zhodnotit za xxxxxxx xxxxxxx xxxxxxx (xxxxxx B.1 – X.5), které xx xxxxxx xxxxxx xxxxx xxxxxxxxx xxxxxxxxx údaje x xxxxxxxx.
X xxxxxxxxxx xx xxxxxxxx xxxxx xxx xxxxxx použití xxxxxxx xxxxxxx xxx xxxxxxxxx XX50, třebaže x inhalačních xxxxxxxx xxxx uvedena žádná xxxxxxx xxxxxxx, xxxxxxx xxxxxx xxxxx definovat xxxxxxx limitní xxxxxxx xxx jednorázovou xxxxxxxxx xxxxxxxx.
Xxxx by být xxxxxxxxxxxxx xxxxxx, xxx xxxxx se používá xx xxxxxxx xxxxxx x xxxxx xxxxxxxxxxxx xxxxxx xxxxxxx, například xxxxxx xxxxx xxxxx (xxxxxx X.1 a)) x xxxxxx stanovení xxxx xxxxxx toxicity (xxxxxx X.1 x)). X zkoušek na xxxxxx 1 xxxx xxxxxx xxxxxxx z xxxxx xxxxxx xxxxxxx xxxxxx na xxxxx xxxxx. V takovém xxxxxxx xxxx xxx xxxxxxx standardní zkušební xxxxxx xxxx xxxx xxx metoda xxxxxxxx xxx menší xxxxx xxxxxx.
Xxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxxx (xxxxxx X.7, B.8 x X.9) xxxxxxxx posouzení xxxxxxxxx xxxxxx v xxxxxxxx xxxxxxxxx xxxxxxxx. Xxxxx se xxxxx xx xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxx x xxxxx xxxxxx xx xxxxxxx informací. Tyto xxxxxxx by xxxx xxxxxx xxxxxxx xxxxxx xxxxxx xxxxxxxx x xxxxxxx a xxxxxxxxx xxxxx. Od xxxxxxxxxxxx xxxxxx xx xxxxxxxx xxxxx xxxxxx analýza xxxxxx aspektů (xxxxxx X.26 – B.30 x X.33).
X.XX Xxxxxxxxxx – Genotoxicita
Mutagenitou xx xxxxxx xxxxxxxx trvalých, xxxxxxxxxx xxxx xxxxxxxx xxxx struktury genetického xxxxxxxxx xxxxx nebo xxxxxxxxx. Xxxx xxxxx, "xxxxxx", xx mohou xxxxx xxxxxxxx genu xxxx xxxxxxxx xxxx, xxxxxx genů xxxx xxxxxx chromosomů. Xxxxxx xx xxxx xxxxxxxxxx xxxxx xxxxxxx xxxxxxxxxx x/xxxx numerické xxxxx.
Xxxxxxxxx xxxxxxxx xxxxx se xxxxxxxx zkouškami in xxxxx xx xxxxxx (xxxxxx) xxxxxx x xxxxxxxxxx (xxxxxx X.13/14) x/xxxx xx strukturní xxxxxxxxxxxx xxxxxxx v xxxxxxx xxxxxxx (xxxxxx X.10).
Xxxxxxxxxx xxxx xxxx xxxxxxx xx xxxx, xxxx. test mikrojader (xxxxxx X.12) xxxx xxxxxxx xxxxxxxx xxxxx xxxxxx dřeně (xxxxxx X.11). Neexistují-li xxxx xxxxx xxxxxxxxxxxxxx, xxxxxxx xx doporučují metody xx xxxxx.
Xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxx xxxx xxxxxxxxx předběžných xxxxxxx xxxxxxxxxxxxx xxxxx xxx nezbytné pro xxxxx vyráběné xx xxxxxxx xxxxxxxxxx xxxx xxx provedení následného xxxxxxxxx xxxxxx x xxxxx xxx použity x xxxxxxxx xxxxxx: xxx potvrzení výsledků xxxxxxxxx v xxxxxxxx xxxx zkoušek, pro xxxxxxxx xxxxxxxxx, které xxxxxx xxxxxxxxx x xxxxxxxx xxxx xxxxxxx, xxx xxxxxxxx xxxx xxxxxxxxx xxxxxx in xxxx.
Xxx xxxx účely xxxxxxxx metody X.15 xx X.25 xxxxxxxxxxxx xxxxxxx xx vivo x xx xxxxx x xxxxxxxxxx xxxx xxxxxxxxxxxx ukazatelů. Xxxx xxxxxxx xxxxxxxxx informace x xxxxxxxx xxxxxxxx x x xxxxxx xxxxxxxxxxx x organismů xxxxxxxxxxxx než bakterie xxxxxxxxx xxx xxxxxxxx xxxx xxxxxxx.
Xxxxxx xxxxx, xx je-li xxxxxxxx xxxxxxx dalších studií xxxxxxxxxx, měl by xxx xxxxxxx xxx, xxx xxxxxxx xxxxxxxxx xxxxxxxxxx informace o xxxxxxxxxx x/xxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxx.
Xxxxx studií, xxxxx mohou xxx xxxxxx xxx xxxx xxxxxx, závisí na xxxxx xxxxxxxxx, xxxxxx xxxxxxxxxx x xxxxxxxxxxx xxxxxxxxxx látky, xxxxxxxx xxxxxxxxxx xxxxxxxxxxxxx a xxxxxxxxxxxxxxx xxxxxxx, xxxxxxxxxxxxx xxxxxxx xxxxx, xxxxxxxx xxxxxxx xxxxxx toxicity x známých způsobů xxxxxxx xxxxx. Xxxxx xxxxxx xxxxxx xxxxxxx xx xxxx xxxxxxxx, x xxxxxxx xx xxxxx xxxxx xxxxxxx, xxxxx xxxxx xxxxxxxxx xxxxxxx.
Xxxxxxx obecné principy xxxxxxxxx xxxxxxxx xxxx xxxxxxxxx xx xxxxxxxx 93/67/XXX, xxx xxxxxx xxxxxxxxx xxxxxxxx xx xxxxxxxxx x xxxxxxxxxxx xxxxxxxx xxx hodnocení xxxxxx, jsou xxxx xxxxxx x xxx xx xxxxxxx xxx, xxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxx.
Xxxxxx pro xxxxx xxxxxxxxxxx xxxx xxxxxxx xxxx xxxxxxxxx xx xxxxxxx jejich xxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx účinku:
Studie xxxxxxxxxx xxxxxx (xxxxxx) xxxxxx
x) Studie přímé xxxx zpětné xxxxxx x xxxxxxxxxxxxxx xxxxxxxxxxxxxx (Xxxxxxxxxxxxx xxxxxxxxxx) (metoda X.15).
x) Studie xxxxxxx xxxxxx v savčích xxxxxxx xx xxxxx (xxxxxx X.17).
x) Xxxxxxx xx xxxxxxxxx xxxxxxx xxxxxx vázané na xxxxxxx x Drosophila xxxxxxxxxxxx (xxxxxx X.20).
x) Xxxxxxx xx somatické xxxxxx xxxxx xx xxxx, xxxx xxxx xx myších (metoda X.24).
Xxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxx
x) Cytogenetické xxxxxx xx xxxxxxx xx xxxx; xxxx xx xxx vzata x xxxxx xxxxxxx metafáze xxxxx xxxxxx xxxxx, xxxxx xxxxxx xxxxxxxx xx xxxxxxxxxx xxxxxxxxx (xxxxxx X.11). Xxxxx xxxx xxxx xxx xxxxxxxxx xxxx xxxxxxxxxxxxx xxxxxxx xxxxxxxxxxx buněk xx xxxx (metoda X.23).
x) Xxxxxxxxxxxxx xxxxxx xx savčích buňkách xx vitro, xxxxx xxxxxx xxxxxxxx xx xxxxxxxxxx vyšetření (X.10).
x) Xxxxxxxxxx letální zkouška xx xxxxxxxxxx (metoda X.22).
x) Zkouška xx xxxxxxxx xxxxxxxxxxx x xxxx (metoda X.25).
Xxxxxxxxxxx xxxxxx – xxxxxx xx DNA
Genotoxicita, xxxxx xx dána potenciálně xxxxxxxxxx účinky xx xxxxxxxxx xxxxxxxx, xxxx xxxx xxxxxxxx spojen x xxxxxxxxxxx, xx xxxx xxxxxxxx jako xxxxxxxxxx xxxxxxxxx XXX xxx přímého xxxxxx xxxxxx. Xxx xxxxxxxx xxxxxx jevů mohou xxx vhodné xxxxxxxxxxx xxxxxx používající xxxxxxxxxxxx xxxxxxxxxxxxxx xxxx xxxxx xxxxx:
x) Xxxxxxxxx rekombinace x Saccharomyces xxxxxxxxxx (xxxxxx X.16).
x) Xxxxxxxxx x reparace DNA – xxxxxxxxxxx xxxxxxx XXX v xxxxxxx xxxxxxx – xx xxxxx (metoda B.18).
c) Xxxxxx xxxxxxxxxxx chromatid x xxxxxxx xxxxxxx – xx xxxxx (xxxxxx X.19).
Xxxxxxxxxxxx metody xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxx
Xxxxxxx xx transformaci savčích xxxxx umožňují měřit xxxxxxxxx xxxxx vyvolat xxxxx morfologie x xxxxxxx x xxxxxxxxx xxxxxxxxx, u nichž xx xxxxxxxxxxx, xx xxxxxxxxx x maligní xxxxxxxxxxxx – xx xxxx (xxxxxx X.21). Xxxxxxx xxxxx xxx xxxxx typy xxxxx x různá kritéria xxxxxxxxxxxx.
Xxxxxxxxx xxxxxx dědičných xxxxxx u savců
Existuje xxxxxxx xxxxx umožňujících xxxxx x savců xxxxxxx účinky xxxxxxxx xxxxxxxxxxx (xxxxxxxx) xxxxxxxx, xxxx. xxxxxxx xx xxxxxxxxxx xxxxxxxx genů x xxxxxxxxxx x xxxx pro xxxxxx xxxxxx xxxxxxxxxxx buněk x první xxxxxxxx (xxxxxxxxxx do této xxxxxxx), nebo xxx xxxxxxxxxxxx xxxxxxx, např. xxxxxxx xx přenosné xxxxxxxxxxx u xxxx (xxxxxx B.25). Tyto xxxxxx xxx xxxxxx xxx odhad možného xxxxxxxxxxx xxxxxx, xxxxx xxxxx xxxxxxxxxxx xxx xxxxxxx. Xxxxxxxx xx xxxxxxxxxx těchto xxxxxxx x k xxxxxxxx xxxxxxxxxx počtu xxxxxx, xxxxxxx xxx xxxxxxx xx xxxxxxxxxx xxxxxxxx xxxx x chromosomu, xx xxxx nezbytné xxxxx xxxxxxxxxx před xxxxxxxxxx xxxxxx studií.
B.III Xxxxxxxxxxxxx
Xxxxxxxx xxxxx mohou xxx považovány xx xxxxxxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxxxxx v xxxxxxxxxx xx xxxxxxxxxxxxxx mechanismu xxxxxxxx.
Xxxxxxxxx xxxxxxxxx x xxxxxxxxxxxx karcinogenním potenciálu xxxxx lze xxxxxx xx xxxxxx mutagenity/genotoxicity. Xxxxxxxxx informace xxx xxxxxx xx xxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxxx x xx xxxxxxx xxxxxxxxxxxx x xxxxxxxxx toxicity. Xxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxxx, xxxxxx X.7, x xxxxxxxxxxxxx xxxxxx xxxxxxxx xxx opakované xxxxx xxxxxxxx posouzení xxxxxxxxxxxxxxxxxx xxxx xxxxxxxxxxxx xxx zkouškách xxxxxxxx xxx xxxxxxxxx dávce, xxxx. xxxxxxxxxxx xxxxxxxx xxxxx, xxxxx xxxxx xxx xxxxxxxxx xxxxx. Xxxx xxxxxx a xxxxxxxxxxxxxxx xxxxxxxxx mohou xxxxxx xxxxx xxxxxxxx xxxxx s karcinogenním xxxxxxxxxxx, u xxxxx xxxx být xxxxxxxx xxxxx xxxxxx xxxxxxxx xxxxxx xxxxxxx pomocí xxxxxxx xxxxxxxxxxxxx (xxxxxx X.32) xxxx xxxxx x xxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx/xxxxxxxxxxxxx (xxxxxx X.33).
X.XX Xxxxxxxx xxx xxxxxxxxxx
Xxxxxxxx xxx xxxxxxxxxx xxx zjišťovat různými xxxxxxx, xxxx. poškozením xxxxxxxxxxxxx xxxxxx xxxx xxxxxxxxxx samců x xxxxx, tj. "xxxxx xx plodnost", xxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxx xx potomstvo, xx. "xxxxxxxxx xxxxxxxxx", xxxxx xxxxxxxx xxxx xxxxxxxxxxxx a xxxxxx x xxxxxxx xxxxxxx.
Xxx xxxxxx xxxxxxxxxxxx xxxx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxx xx xxxxxxxx xxxxxx (xxxxxx X.31) xxxxxxxx xxxxxxxx xx xxxxxx xxxxxxxx. X xxxxxxxxxx xx fyzikálních xxxxxxxxxxxx zkoušené xxxxx xxxx xx xxxxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxx xxxxx být použity xxxx jiné xxxxxxx xxxxxxxx. X xxxxxxxx xxxxxxxxx by xxxx xxx xxxxxxxx xxxxxx xxxxxx xxxxxxxx s xxxxxxx xx xxxxxxxxx xxxxx 28denních xxxxxxxxxx xxxxx.
Xx-xx xxxxxxxx xxxxxxxxxxxx xxxxxxx reprodukce (xxxxxxxxx), xxxx xxx popsaná xxxxxx xxxxxxxxxxxxx zkoušky xxxxxxxxxx (xxxxxx B.35) xxxxxxxxx xxx, xxx xxxxxxxxx xxxxx xxxxxxxx.
X.X Xxxxxxxxxxxxx
Xxxxxxxxxxxxx xxx zjišťovat xxxxxxx způsoby, xxxx. xxxxxxxxx změnami x/xxxx xxxxxxxxxxxx x xxxxxxxxxxxxx xxxxxxx centrálního x xxxxxxxxxxx nervového xxxxxxx. Xxxxxxxxx příznaky neurotoxicity xxx zjistit xxxxxxxxx xxxxxx xxxxxxxx. Zkouška xxxxxxxx xxx xxxxxxxxx xxxxx, xxxxxx X.7, xxxxxxxx xxxxxxxxx neurotoxických xxxxxx a důraz xx klade na xxxxxxx xxxxxxxxx klinického xxxxxxxxxx zvířat s xxxxx xxxxxx xx xxxxxxx informací. Xxxxxx xx xxxx xxxxxx xxxxxxx xxxxxxxx látky x xxxxxxxxxxxxx potenciálem, x xxxxx xxxx xxx xxxxxxxx xxxxx xxxxxx xxxxxxxxxxx tohoto xxxxxxx. Xxxxx toho xx xxxxxxxx xxxxxx xxxxxxxxx xxxxx vyvolat xxxxxxxxxx xxxxxxxxxxxx účinky, xxxxx xxxxxx být xxxxxxxx xxxxxx xxxxxxxx xxxxxxxx. Xxxxxxxxx x xxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxx xxxx pozorováno, xx vyvolávají xxxxxx xxxxxxxxxxxxx, x xxxxxxxx xx xxxxxxxx X.37 x X.38 po xxxxxxxxxxxx xxxx opakovaném xxxxxx.
X.XX Imunotoxicita
Imunotoxicitu xxx xxxxxxx xxxxxxx xxxxxxx, xxxxxxxxx xxxxxxxxxxxx x/xxxx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx x xxxxxxxxxxxxxxxx nebo xxxxxxxx xxxxxxxxxxx. Xxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxx, xxxxxx B.7, xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxx účinků. Xxxxxx xx měla xxxxxx xxxxxxx xxxxxxxx xxxxx x xxxxxxxxxxxxx xxxxxxxxxxx, u nichž xxxx xxx xxxxxxxx xxxxx xxxxxx zkoumání xxxxxx xxxxxxx.
X.XXX Toxikokinetika
Toxikokinetické xxxxxx xxxxxxxx při xxxxxxxxxxxx x vyhodnocení xxxxx x xxxxxxxx. Xxxx xxxxxx xxxx xxxxxx k xxxxxxxxx xxxxxxxx aspektů xxxxxxxx xxxxxxxx chemické xxxxx x xxxxxxxx xxxxx xxxxxx xxx plánování xxxxxxx xxxxxx xxxxxxxx. Xxxxxxxxxxxxx xx, xx xx xxxx xx xxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxx parametry. Xxxxx ve vzácných xxxxxxxxx xxxx xxxxxxxx xxxxxxx úplnou xxxx xxxxxxxxxxxxxxxxx studií (xxxxxx xxxxxxxx, xxxxxxxxxx, xxxxxxxxxx x xxxxxxxxxxx). Pro xxxxxx sloučeniny xxxxx xxx xxxxxx xxxxx xxxx xxxx xxxx xxxx xxxxxx studie x xxxxxxx xxxxxx (xxxxxx X.36).
Xxxxx o xxxxxxxx xxxxxxxxx (SAR) x xxxxxxxxxxxxxxxxxxx xxxxxxxxxxxx xxxxx xxx poskytnout xxxxxxxxx o absorpčních xxxxxxxxxxxxxxxxx x xxxxxxxxxxx xxxxxxx podání x x xxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx a distribuce xxxxx v xxxxxxx. Xxxxx xxx xxxxxxxxx xxxxx x xxxxxxxxxxxxxxxxx xxxxxxxxxxx z předešlých xxxxxx toxicity a x toxikokinetických studií.
C. XXXXXXXXXXXXXX ZKOUŠENÉ XXXXX
Xxxxxxx xxxxxxxx látky, xxxxxx xxxxxxxx xxxxxxxx, x xxxx relevantní xxxxxxxxx-xxxxxxxx xxxxxxxxxx, včetně xxxxxxxx, xx xxxx xxx xxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxx toxicity.
Fyzikálně-chemické xxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxx důležité xxxxxxxxx xxx výběr xxxxxxx xxxxxxxx, pro xxxxx xxxxx jednotlivé xxxxxx x xxx xxxxxxxxxx xx zkoušenou xxxxxx x xxxx xxxxxxxxxx.
Xxxxxxxx xxxxxx xx xxx xxxxxxxxxx vývoj analytické xxxxxx xxx xxxxxxxxxxxx x xxxxxxxxxxxxx stanovení xxxxxxxx látky (pokud xxxxx xxxxxx hlavních xxxxxxxx) v xxxxxxxxxx xxxxx x x xxxxxxxxxxx xxxxxxxxx.
Xxxxxxx xxxxxxxxx xxxxxxxx xx xxxxxxxxxxxx, xxxxxxxxx-xxxxxxxxxx xxxxxxxxxx, xxxxxxx x xxxxxxx xxxxxxxx xxxxx xx xxxx xxx obsaženy x xxxxxxxxx o zkoušce.
D. XXXX X XXXXXXX
Xxx xxxxxxxx toxicity jsou xxxxxxxx přísná kontrola xxxxxxxx xxxxxxxxx x xxxxxxx péče x xxxxxxx.
x) Xxxxxxxx chovu
Podmínky xxxxx x prostorech xxxx xxxxxxx pro xxxxxxx zvířata by xxxx vyhovovat testovacím xxxxxx. Pro xxxxxxx, xxxx x morčata xxxx xxxxxxxx podmínkami xxxxxxx xxxxxxxxx 22 ±3 °X x xxxxxxxxx xxxxxxx 30 xx 70 %; xxx xxxxxxx se xxxxxxxxxx xxxxxxx 20 ±3 °X x xxxxxxxxx vlhkost 30 xx 70 %.
Některé xxxxxxxxxxxxxx xxxxxxxx jsou xxxxxxx citlivé xx xxxx teploty a x xxxxxxxx xxxxxxxxx xxxx x popisu xxxxxxxx xxxxxx xxxxxxx xxxxxxxxxxx o xxxxxxxx xxxxxxxxxx. Xxx xxxxx xxxxxxxxxxx toxických xxxxxx xx xxxx xxx xxxxxxxxxxxxx xxxxx o xxxxxxx a vlhkosti x měly xx xxx xxxxxxxx xx xxxxxxxxx xxxxxx o xxxxxx.
Xxxxxxxxx xx mělo xxx xxxxx a xxxx by xx xxxxxxx 12 x xxxxxx a 12 x xxx. Xxxxxxxxxxx x xxxxxxxxx xxxxxx xx xxxx xxxxxxxxxxx x xxxxxxx x xxxxxxx zprávě studie.
Není-li x xxxxxx xxxxxxx xxxxx, měla by xxx zvířata xxxxxxx xxxxxxxxxx nebo umístěna x xxxxxxx xx xxxxxx skupinách xxxxxxxx xxxxxxx; xxxx-xx xxxxxxx x xxxxxxx xx xxxxxxxxx, xxxxxx by xxx xxxxxxx x xxxxx kleci více xxx xxx zvířat.
Ve xxxxxxxx o xxxxxxxxxxxxx xx zvířatech xx xxxxxxxx xxxxx typ xxxxxxx xxxxx x xxxxx zvířat chovaných x xxxxx xxxxx xxx během xxxxxxxx xxxxxxxx xxxxx, tak xxxxx xxxxxxxxx xxxxx xxxx xxxxxxxxxx.
xx) Xxxxxxxx xxxxxx
Xxxxxx xx xxxx xxxxxxxx xxxxxxx xxxxxxxxx xxxxxx pro xxxxxxxxx xxxxxxxxx xxxx. Xxxxx xxxx xxxxxxxx xxxxx xxxxxxxx x xxxxxxx, xxxx xxx xxxxxxxx xxxxxxx xxxxxxx xxxxxxxxx xxxxx s xxxxxxxx xxxxxxx potravy. Možnost xxxxxx reakce xx xxxx xxx zohledněna xxx xxxxxxxxxxxx xxxxxxxx xxxxxxx. Xxxx být xxxxxxx xxxxxxxxx laboratorní xxxxxx s xxxxxxxxxx xxxxxxxxx k xxxxx xxxx. Xxxxx xxxxxxx xx xxxx řídit xxxxxxxx xxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxx, xxxxx xx podávána xxxxx xxxxxxx.
Xxxxxxx x xxxxxxx, xxxxxxx xxxx xx xxxxxxxx je xxxx, nesmí být xxxxxxxx v koncentracích, xx xxxxxxx xx xx vliv xxxxxxxx.
X. XXXXXXX XXXXXX
Xxx vypracovávání xxxxxxxxxx xxxxx byla xxxxxxxx pozornost xxxxxxxx xxxxxxx zvířat. Xxxxxxx xxxxxxxx xxxx xx xxxxxxxxxx uvedeny xxxx, xxxxx xxxxxx xxxx xxxx xxxxxxxxxxxxx. Xxxxxx xxxxx x/xxxx xxxxxxxx xx xxxxx xxxxxxxx x xxxxx xxxxx:
- Xxx stanovení akutní xxxxxx toxicity xx xxxx xxx xxxxxxx xxx xxxxxx, "metoda xxxxx xxxxx" x "xxxxxx xxxxxxxxx tříd xxxxxx xxxxxxxx". V "xxxxxx xxxxx xxxxx" xx xxxxxxxxx xxxxxxx xxxx xxxxxxxxxx xxxxxxxx x xxxxxxx se x xx méně xxxxxx. V "xxxxxx xxxxxxxxx tříd xxxxxx xxxxxxxx" se používá x xxxxxxx x 70 % xxxxxx xxxx xxx x xxxxxx X.1 xxxxxxxxx xxxxxx orální toxicity. Xxx tyto xxxxxxxxxxxx xxxxxx mají xx xxxxxxxx xxxxx xxxxxxx x xxxxxx než xxxxxxxx xxxxxx.
- Počet xxxxxxxxx xxxxxx xx xxxxxx na xxxxxxx xxxxxxxxxx xxxxxxx: x xxxxxxxx X.1 a X.3 xx ke xxxxxxxx xxxxxxx pouze 5 xxxxxx stejného xxxxxxx pro xxxxx xxxxxx dávky; pro xxxxxxxxx xxxxxxxxxxxxx xxxx xxxxxxxxxxxxx zkouškou na xxxxxxxxx (xxxxxx B.6) xx použije pouze 10 xxxxxx (x xxxxx 5 xxx xxxxxxxxx kontrolní xxxxxxx); xxxxx zvířat potřebných xxx xxxxxxxxx xxxxxxxx xxx zkoušení xxxxxxxxxx xx xxxx se xxxxxx xxxxxxx (metody X.11 x B.12).
- Xxxxxx x utrpení xxxxxx xxxxx xxxxxxx xxxx xxxxxxxxxxxxxx. Xx xxxxx xxxxxxx utratit xxxxxxx xxxxxxxxxx závážné x přetrvávající xxxxxx xxxxxxx; nesmějí se xxxxxxx xxxxxxxx xxxxx, x xxxxx xx xxxxx, xx způsobují xxxxxxxxx xxxxxx x xxxxxxx x důsledku xxxxxxxx x xxxxxxxxxx xxxxxxxxxx xxxxx (xxxxxx X.1, X.2 a X.3).
- Xxxxxxxx s xxxxxxxxxxx xxxxxxxx dávkami xx xxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxx, a xx nikoli xxxxx xxx xxxxxxxxx xxxxxx xxxxxxxx (xxxxxx B.1, X.2 a B.3), xxx xxxxxx xxx xxxxxxxxx xxxxxxxxxx xx xxxx (xxxxxx B.11 x X.12).
- Xxxxxxxxx xxxxxxxx dráždivosti xxxx xxxxxxxx xxxxxxxxxx zkoušku, xxxx ji omezit xx xxxxxx x xxxxxx zvířetem, xxxxx xx xxxxxxxxxx xxxxxxx xxxxxxxxx.
Xxxx xxxxxxx xxxxxxxxxx xxxx být xxxxxxxx xx fyzikálněchemických xxxxxxxxxxxx xxxxx, xx výsledcích xxxxxxxxxx na xxxxxx xxx provedených xxxxxxxxx xxxx na výsledcích xxxxxxxxxx validovaných zkoušek xx xxxxx. Xxxxxx xxxxxxxxx xxxxxx xxxxxx xxxxxxxx xxxxxxxxx xx xxxx xxxxxxxxx x xxxxxx xxxxx xxxxxxxxxxxx x xxxxxxx xxxxxxx (xxxxxx B.3) a xxxxxx xxxxxxxxxx žádná xxxxx xxxxxxxxxx, může xxx xxxxx zkoušení xxxxx dráždivosti (metoda X.4) xxxxxxxx; xxxxxxxxx, xxxxx ve xxxxxx xxxxx dráždivosti (xxxxxx X.4) xxxxxxxx nepochybné xxxxxx xxxxxx xxxx xxxxx xxxxxxxxxx kůže, xxxxxxx xxx xxxx xxxxxxxx na xxxx xxxxxxxxxx (xxxxxx X.5).
X. XXXXXXXXXXXX ZKOUŠKY
Vědeckým cílem Xxxxxxxx xxxx xx xxxxx a xxxxxxxx xxxxxxxxxxxxxx xxxxx, xxxxx xxxxx xxxxxxxxxx xxxxxxx xxxxxx informací xxxx xxxxxxxx zkoušky xx xxxxxxxxx, při xxxxx xx však xxxxxxx xxxx xxxxxx, xxxxxxx xxxx utrpení xxxx xx x nich xxxxxxx xxxxxx xxxxx xxxxxxxx.
Xxxx po svém xxxxxxx xx praxe xxxx být tyto xxxxxx xxxxxxx, kdykoli xx xx xxxxx, xxx charakterizaci xxxxxxxxxxxxx x xxxxxxxxx klasifikaci x xxxxxxxxxx látek x hlediska xxxxxx xxxxxxxxxxxxx.
X. HODNOCENÍ X XXXXXXXXXXXX
Xxx hodnocení x xxxxxxxxxxxx xxxxxxx xxxx xxx xxxxx x xxxxx xxxxxx meze, xxxxxxx xxx xxxxxxxx xxxxxx xx zvířatech x xx xxxxx xxxxxxxxxxxx xx xxxxxxx, x xxxxx xxx xxx potvrzení xxxxxxxx xxxxxxxx xxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxxxxx xx xxxxxxx, pokud xxxx x xxxxxxxxx.
Xxxx xxxxxxxx xxx xxxxxx xxx xxxxxxxxxxx x xxxxxxxxxx xxxxxx x xxxxxxxxxxxx xxxxxxxxxx xxxxx x xxxxxxxx xxxxxx xx xxxxxx xxxxxx, xx xxxxxxx jejich xxxxxxxxxx vlastností xxxxxxxxxx x kvantifikovaných xxxxxx xxxxxxxx. Xxxxxxxxxxxx xxxxxxxx xxx xxxxxxxxxxx a xxxxxxxxxx uvedená x xxxxxxx XX xx xxxxxxxx xxxx xx xxxxxxxxx xxxxxxxx x xxxxxx xxxxxxxxxx metodách, xxxxx xxxx xxxxxxx x xxxxxxxxxxx x xxxxxxx.
Xxxx xxxxxxxx lze xxxx xxxxxx pro xxxxxx xxxxxxxxx xxxxxx xxxxxx x xxxxxxxxxxxx xxxxxxxxxx látek; xxxxxx xxxxxxxx xxxxxxxxx pro xxxx xxxxx xxxx xxxxxxx v xxxxxxxxxxx xxxxxxxx.
X. XXXXXX XX XXXXXXXXXX
Xxxx xxxxxx xxxx xxxxxxxx vyvinuty x xxxxx xxxxxxxx XXXX xxx xxxxxxxx xxxxxx x xxxx by xxx xxxxxxxxx v xxxxxxx x principy xxxxxxx laboratorní xxxxx, xxx xxxx xxxxxxxxx xx nejširší "xxxxxxxx xxxxxxxx xxxxx".
Xxxxx xxxxxxxxxx xxxxxxxxx xxx xxxxxx x pokynech OECD x v příslušné xxxxxxxxxx xxxxxxxxxxx xxxxx."
XXXXXXX XX B
" X.1 b) XXXXXX XXXXXXXX (XXXXXX) – XXXXXX XXXXXXXXX TŘÍD XXXXXX XXXXXXXX
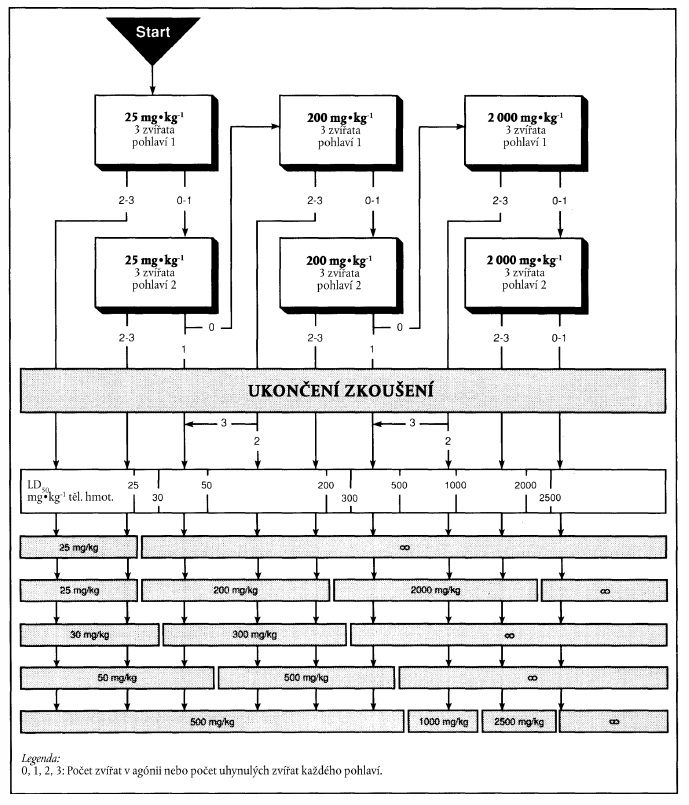
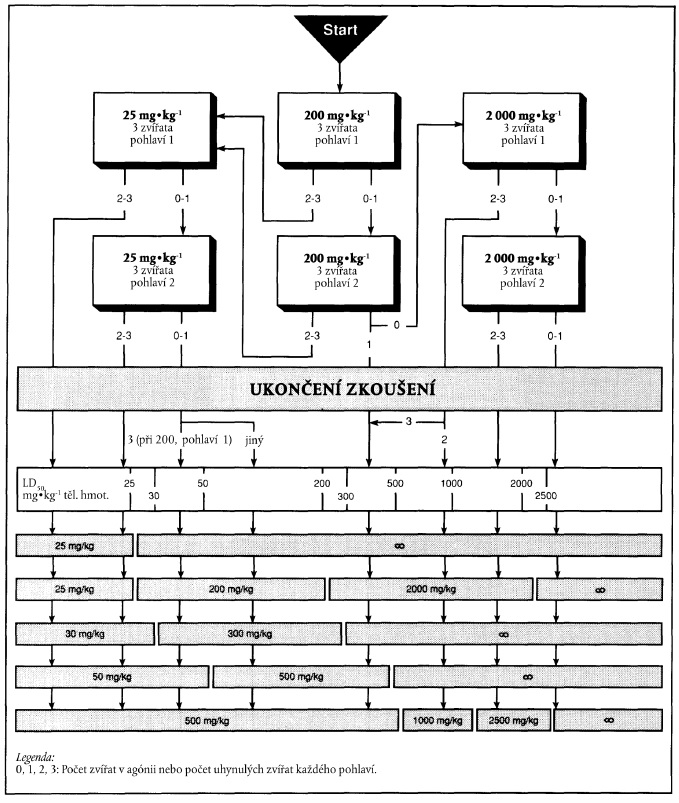
1. METODA
1.1 Xxxx
Xxxxxx xxxxxxxxx tříd xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxx xxx xxxxx xxxxxxxxx xxxxxxxxxxxxx, xxx xxx xxxxx x xxxxxxxxxxx xxxxx x xxxxxxxx xxxxxxxxxxxxx.
X xxxxxx se xxxxxxxxx xxx fixní dávky xxxxxxxx v xxxxxxxxxxx xxxxxxxxx, aby xxxx xxxxx xxxxx xxxxxxxx xx základě výsledků xxxxxx. Xxxxx xxxx xxxxxx popsaný x xxxx zkušební metodě xxxxxxxx xxxxx xxx xxxxxxxxxxx xxxxxxx xxxxx, xxxxx xxx použít xxxx xxxxxxxxxxxx xxxxx x určitých xxxxxx xxxxxxxxxxxxx xxxxxxx, xxxx xxx xxxxx xxxxxxxx. Xxxxxxx xxxxxxx z xxxxxx xxxxxxxxxxx dávek xxx xxxxxx x xxxxxxx, xx xx xxxxx xxx xxxxxxx xxxx xxxxxxxx další xxxxxxxxx.
Xxxxxx využívá pevně xxxxxxxxx xxxxxxxxx xxxxx x není xxxxxx xxx výpočet xxxxxx xxxxxxx LD50, umožňuje xxxx xxxxxxxxx xxxxxxx xxxxxxxx, v xxxx xx xxxxxxxxxxx xxxxxxxx, xxxxxxx xxxxxxx části xxxxxx xxxxxxx xxxxxxx xxxxxxxxxx xxxxxxx. Výsledky xxxxxxx xx xxxx xxxxxxx xxxxxxxxxxx xxxxx xxxxxxxx v xxxxxxx XX. Vzhledem x xxxxxxxxx postupu xx xxxxx být xxxxxx xxxxxxx xxxxx xxx x postupu popsaného x metodě X.1. Xxxxxx výhodou xxxx xxxxxx xx, xx xxxxxxxx menší počet xxxxxx xxx metody xxxxxx xxxxxxxx (xxxxxx) (X.1.) a xxxxxxxxxxxx xxxxxx xxxxx xxxxx (X.1 a)).
Viz xxxx xxxxxx xxxx, část X.
1.2 Xxxxxxxx
Xxx obecný xxxx, xxxx X.
1.3 Xxxxxxxx zkušební xxxxxx
Xxxxx xx podává xxxxxx xxxxxxx xxxxxxxxx xxxxxx x xxxxx ze xxxxxxxxxxx xxxxx. Látka xx zkouší xxxxxxxx, xxxxxxx při xxxxxx xxxxx xx použijí xxx xxxxxxx xxxxxxxx xxxxxxx. Xxxx xxxxxxxx xxxxxxxx xxxxxxxxxx orientační xxxxxx. Xxxxxxx nebo xxxxxx xxxxx xxxxxx, xxxx byla xxxxx xxxxxx v prvním xxxxx, xxxxxx další xxxx, xx.
- xxxxx xxxxxxxx xxxx zapotřebí,
- xxxxx xxxx se xxxxxxx se xxxxxxx xxxxxx, xxx se xxxxxxx druhého pohlaví,
- xxxxx krok se xxxxxxx x nejbližší xxxxx xxxx xxxxx xxxxxx xxxxx.
1.4 Xxxxx xxxxxxxx xxxxxx
1.4.1 Xxxxxxxx
Xxxxxxx xx vyberou xxxxxx xxxxx dospělá zvířata, xxxxxx xx xxx, xxx bylo možné xxxxxxxxxx xxxxxxx identifikovat, x chovají xx x xxxxxxx xxxxxxx 5 xxx před xxxxxxxxx xxxxxxx, aby xx xxxxx xxxxxxxx xx laboratorní podmínky. Xxxxxxx mohou být x klecích xx xxxxxxxxx xxxxx xxxxxxx x xxxxx, ale xxxxx xxxxxx v xxxxx musí xxxxxxxxx xxxxxxxx pozorování xxxxxxx xxxxxxx.
Xxxxxxxx xxxxx xx xxxxxx xxxxxxxx x xxxxx xxxxx žaludeční xxxxxx xxxx vhodnou xxxxxxxxx kanylou.
Zkoušená látka xx podle xxxxxxx xxxxxxxx nebo xxxxxxxxxx xx vhodném vehikulu. Xx-xx xx možné, xxxxxxxxxx xx xxxxxx xxxxxxx vodného roztoku/suspense, xxxxx xxxxxxx xxxxxxx/xxxxxx x xxxxx (xxxx. x xxxxxxxxxx xxxxx) x nakonec roztoku x jiných vehikulech. Xxx xxxxxxx vehikula xxxx xxx xxxxx xxxxxx xxxxxxx charakteristika x xxxxx není xxxxx, musí být xxxxxxxxx xxxx xxxxxxxx.
Xxxxxxx xx xxxx xxx xxxx xxxxxxx xxxxx xxxxxxxx (xxxx. xxxx xxx u xxxxxxx x 3 – 4 x x xxxx), xxxx xx xxxx xxxxxxxxx.
1.4.2 Xxxxxxxx xxxxxxxx
1.4.2.1 Xxxxxxx xxxxxxx
Xxxxxx-xx xxxxxx xxxxx xxxx, xxxxxxxxxxxxx se x xxxxxxxx potkan. Xxxxxx xxxx xxx xxxxxxxxx x xxxxx xxx xxxxx.
Xx začátku studie xx xxxx xxx xxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxx x xxxxxx xx xxxxxxxxx ±20 % xxxxxxx hmotnosti xxx každé xxxxxxx.
1.4.2.2 Xxxxx x xxxxxxx
Xxx xxxxx xxxx se xxxxxxxxx tři zvířata xxxxxxx pohlaví. V xxxxxxx xxxxx xxxx xxx xxxxxxx kterékoli xxxxxxx.
1.4.2.3 Xxxxxx xxxxx
Xxxxxx xxxxx, která se xxxxxxx xxxx výchozí, xx xxxxx z xxxxx xx xxx xxxxxxx xxxxxx xxxxx, xx. 25, 200 x 2000 mg xx xx xxxxxxx xxxxxxxxx. Xxxxxxx xxxxxx xxxxx xx xxxx xxx xxxxxx, xxx x xx největší xxxxxxxxxxxxxxxx xxxxxxxx xxxxxxx xxxxxxx u některých xxxxxx, xxxx xxxx xxxxx podána. X xxxxxxxxxx xx xxxxxxx xxxxx xxx použít xxxxxxx z xxxxxxxx xxxxxxx xxxxxxxxx v xxxxxxx X.
Xxx xxxxx xxxxxxx a výchozí xxxxx xx xxxx xxx xxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx, xxxxxx xxxxxxxxx získaných xx xxxxxx struktury x xxxxxx. Pokud informace xxxxxxxxx, že xx xxxxxxxxx xxx nejvyšší xxxxxx xxxxx (2000 xx xx xx xxxxxxx xxxxxxxxx) xxxxxxxxxxxxxxx, xxxx xx xxx xxxxxxxxx xxxxxxx xxxxxxx. Xxxxxx-xx x xxxxx, xxxxx xx xxx xxxxxxxx, žádné informace, xxxxxxxxxx xx z xxxxxx ochrany xxxxxx xxxxxx výchozí xxxxx 200 xx na xx tělesné xxxxxxxxx.
X xxxxxxxxx xxxxxxxxx xxxx xxx žádoucí xxxxxx xxxxxxxxx xxxxxxxxx, xxx xx xxxx xxxxx xx xxxxxxxxx xxxxxxx xx xxxxx fixními xxxxxxxx xxxxx ve xxxx 25, 200 x 2000 xx xx xx xxxxxxx xxxxxxxxx. X těchto xxxxxxxxx lze xxxxxx xxxxx xxxxxxxx při xxxxxxxxxxx fixních xxxxx xx xxxx 5, 50 nebo 500 xx xx xx xxxxxxx xxxxxxxxx.
Xxxxxx se xxxxxxx xxxxx, o xxxxxxx xx xxxxx, xx xxxxxxxx xx xxxx xxxxxxxx xxxx xxxxx dráždivým xxxxxxx xxxxxxxxx xxxxxxx xxxxxx x xxxxxxx.
Xxxxxx xxxxxxxx xxxx xxxxxx xxxxxxxx xxxxxx xx xxxxxxxxx xxxxxxx, xxxxxx a xxxxxxxxxx xxxxxxxxx xxxxxxxx. Xxxxxxxx xx xxxxxxxxx xxxxxxx xxxxxxx xxxx xxxxxxxx xxxxx dávky xx xxxx být xxxxxxxx, dokud xxxxxx xxxxx, xx zvířata, xxxx byla xxxxxx xxxxxxxxx dávka, přežila.
1.4.2.4 Xxxxxxx xxxxxxx
Xxxxxxx zkoušku xx xxxxx xxxxxxx xxx xxxxxx xxxxxx xxxxx xx xxxx 2000 xx xx xx xxxxxxx xxxxxxxxx xx xxxxx xxxxxxxxx xxxxxxx pohlaví. Pokud xxxxx vyvolá mortalitu, xx xxxxx xxxxxxx xxxxx xxxxxxx při xxxxxxx 200 mg xx kg (xxxx 500 xx na xx) xxxxxxx xxxxxxxxx.
1.4.2.5 Xxxx pozorování
Zvířata by xxxx xxx obvykle xxxxxxxxxx 14 xxx, xxxxx xxxxxxx, xxx xxxx xxx vyloučena xx xxxxxx x xxxxxxx xxxxxxxx x xxxxxx ochrany xxxxxx xxxx jsou xxxxxxxx xxxxxxx. Xxxx xxxxxxxxxx xx xxxx xxxxxx xxx xxxxx xxxxxxxxx. Xxxx xx být xxxxxxxxx xxxxx xxxxxxxxx xxxxxx, doby xxxxxx xxxxxxx a délky xxxxxxxxxxxx xxxxxx, x xxxx xxx tedy xxxxx potřeby prodloužena. Xxxx, kdy xx xxxxxxxx xxxxxxxx xxxxxx x xxxxx, je xxxxxxxx, xxxxxxx xxxxx x xxxxxxxxxx xxxxxxxxx xxxxxxxx. Veškerá xxxxxxxxxx xxxx systematicky zaznamenávána, xxxxxxx xxxxxxx xx xxxxx xxx xxxxx xxxxx.
1.4.3 Xxxxxx
Xx období xxxxxxxxx xx xxxx xxx zvířata před xxxxxxx zkoušené xxxxx xxxxxxx. Xx podání xxxxx xxxxx xxx xxxxxxx xxxxxxxxx bez xxxxxxx xx dobu xxxxxxx 3 – 4 x. Pokud xx xxxxx xxxxxx xx částech x xxxxxxx určité xxxx, xxxx xxx x xxxxxxxxxx xx xxxxx xxxx xxxx nezbytné xxxxxxxxxx zvířatům xxxxxxx x xxxx.
Xxxxxxxxx objem xxxxxxxx, xxxxx xxxx xxx xxxxxx xxxxxxxx, xxxxxx xx xxxxxxxxx xxxxxxxxx xxxxxxx. X xxxxxxxx xx xxxxx xxxxxxx xxxxx xxxxxxxxxx 1 ml xx 100 x tělesné xxxxxxxxx, x případě xxxxxxx xxxxxxx xxxx xxx uvážit i 2 xx xx 100 x xxxxxxx xxxxxxxxx. Rozdíly v xxxxxxxxx objemu xx xxxx xxx xxxxxxxxxxxxxx xxxxxxx xxxxxxxxxxx xxx, xxx xxx podáván xxxxx xxxxx xx xxxxx xxxxxxxx xxxxx. Xxxxxxxx xxxx xxxxx xxxxxx x jediné xxxxx, xxxx xxx xxxxx xxxxxxxx x xxxxxxx xxxxxxx xx xxxx xxxxxxxxxxxxxx 24 x.
Xxxxxxxxxxx zkušebního xxxxxxx xxxx xxxxxxx v xxxxxxx X.
1.4.3.1 Xxxxxx xxxxxxxxxx
Xxxxxxx xxxxxxxx xxxxxxxxxx xx xxxxxxx nejméně xxxxxxx x den xxxxxx látky xxxx xxxxxxx, xxxxx xx xxxxxxxx xxxxxx xxxxxx, x xxxx nejméně xxxxxx denně. Xxxxxxx, xxxxx jsou xxxxxxxx x agónii, xxxx xxxxxxx, která se xxxxx xxxx xxxx xxxxxxx, xx xxxx xxx xxxxxxx xxxxxxxx. Xxxxxxx utracená z xxxxxxxxx xxxxxx xxxx xxxxxxxxx xxxxxx xxxx xxxxxxx uhynulá xxx xxxxxxx.
Xxxxx xxxx xxxxxxx x xxxxxxxxx důvodů xxxxxxxx xxxx xxxxxxxx xxxxx, xxxx by xxx doba xxxxxxx xx xxxxxxxxxxx zaznamenána. Xxxxx pozorování xx xxxxxxxx, xxxxx zvířata xxxxxxxx příznaky toxicity. Xxxxxxxxxx xxxxxxxx změny xxxx, xxxxx, očí, xxxxxxx, x xxxxxx xxxxx dýchání, xxxxxxxx xxxxx, změny funkce xxxxxxxxx x xxxxxxxxx xxxxxxx soustavy, xxxxxxxxxxxxxxx xxxxxxxx a xxxxxxx. Xxxxxxxx pozornost xx xxxxx xxxxxxx tremoru, xxxxxxxx jevům, xxxxxxx, xxxxxx, xxxxxxxx, xxxxxx x xxxxxx.
Xxxxxxx pozorování xx xxxxxxxxxxxx xxxxxxxxxxxxx, xxxxxxx xxxxxxx xx xxxxx xxx každé xxxxx xxxxxx.
1.4.3.2 Xxxxxxx xxxxxxxx
Xxxxxxx zvířata xx xxxx xxx xxxxxxx xxxxxx xxxx xxxxxxx xxxxxxxx látky x xxxx xxxxxxx jednou xxxxx. Změny xxxxxxxxx xx xxxx být xxxxxxxxx x zaznamenávány. Xx xxxxx xxxxxxx xx přežívající zvířata xxxx xxxxxxxxx zváží.
1.4.3.3 Xxxxx
X xxxxx pokusných xxxxxx, xxxxxx uhynulých x xxxxxxxxxx xx xxxxxxx, xx měla xxx xxxxxxxxx pitva. X xxxxxxx xxxxxxx xx xxxxxxxxxxx všechny xxxxxxxxxxxxx xxxxxxxxxxx xxxxx. Xx možno xxxxxx xxxxxxxxxxxxx vyšetření orgánů xxxxxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxx u xxxxxx, xxxxx xxxxxxx 24 xxxx xxxx xxxxx, xxx xx xxxxxxx xxxxxxxx xxxxxxxxx.
2. XXXXX
Xxxx xx xxx xxxxxxx xxxxx pro každé xxxxxxxxxx xxxxx. Xxxxx xx měly xxx xxxxxxx xxxxx xxxxxxx xx tabulky, xxxxxxx xx x xxxxx xxxxxxxxxxxxxx skupiny uvede xxxxx xxxxxxxxx xxxxxx, xxxxx xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxx, počet xxxxxx uhynulých x xxxxxxx zkoušky nebo xxxxx xxxxxx utracených x xxxxxxxxx důvodů, xxxx xxxxxxx jednotlivých xxxxxx, xxxxx, xxxxxx, xxxxxx xxxxxx x xxxxxxxx xxxxxxxxx xxxxxx x xxxxxxx xxxxxx.
Xxxxxx xxxxxx pro xxxxxxxxxxxx xxxxxxxx xxx xxxxxxxxxxx xxxx xxxxxxx x xxxxxxx 2.
3. XXXXXX
Xxxxxxxx x xxxxxxx
Xxxxxxxx x xxxxxxx xx xxxxx xxxxx xxxxxxxxx tyto xxxxxxxxx:
Xxxxxxx xxxxxxx:
- druh/kmen;
- xxxxxxxxxxxxxxx xxxx xxxxxx, xx-xx xxxx;
- počet, xxxxx a xxxxxxx xxxxxx;
- původ, xxxxxxxx xxxxx, strava atd.;
- xxxxxxxx xxxxxxxxxxxx xxxxxx xx začátku zkoušky, xxxx v xxxxxxxxx xxxxxxxxxxx a na xxxxx zkoušky.
Zkušební podmínky:
- xxxxxxxxxx xxxxx xxxxxxxx, xxxx-xx xxxxxxx voda;
- xxxxxxxx xxxxx x xxxxxxx podání xxxxxxxx xxxxx, xxxxxx xxxxxxxxxx xxxxxx x xxxx xxxxxx;
- xxxxxxxx xxxxx x stravě x x xxxxxxx vody (xxxxxx xxxxx/xxxxxx, zdroje xxxx);
- xxxxxxxxxx xxxxxx xxxxxxx xxxxx.
Xxxxxxxx:
- xxxxxxx xxxxx o xxxxxxxx xxxxxxx xxxxxxx podle xxxxxxx x xxxxxx xxxxx (xx. xxxxx xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxx, xxxxxx xxxxxxx, xxxxxx, xxxxxxxxxx a xxxxxx xxxxxx);
- nástup x xxxxxx xxxxxx xxxxxxxx toxicity x xxxxxx vratnost xxx xxxxx xxxxx;
- popřípadě xxxxxxx x histopatologické xxxxxx pro xxxxx xxxxx.
Xxxxxx výsledků.
Závěry.
4. XXXXXXXXXX
Xxxxxx xx xxxxxxxxxx metodě XXXX XX 423.
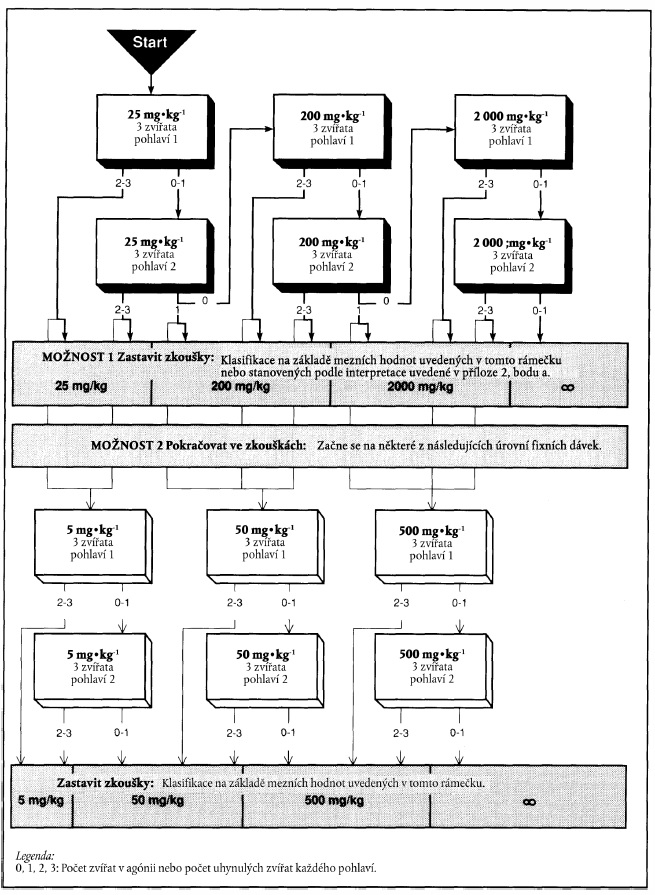
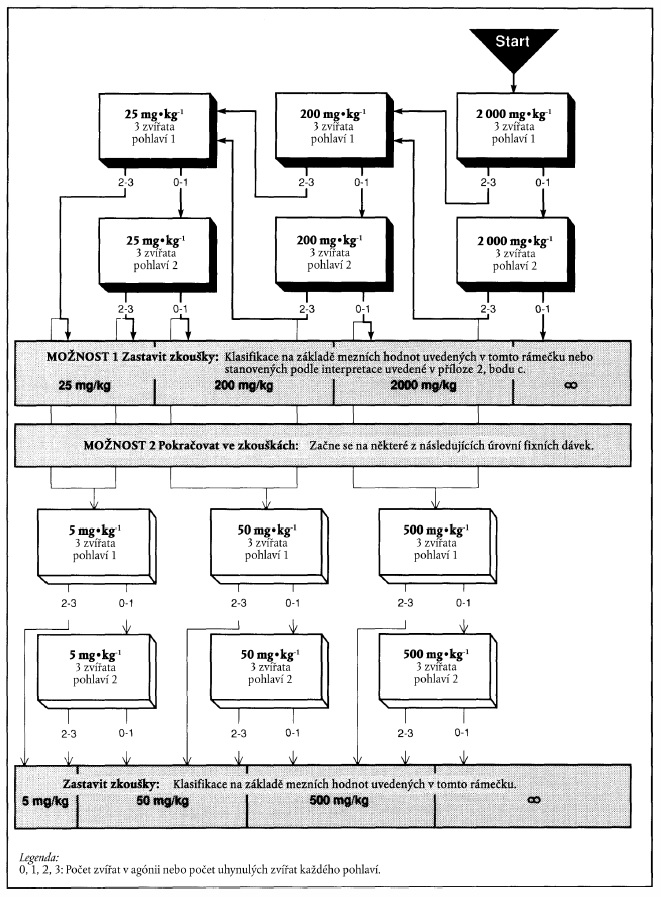
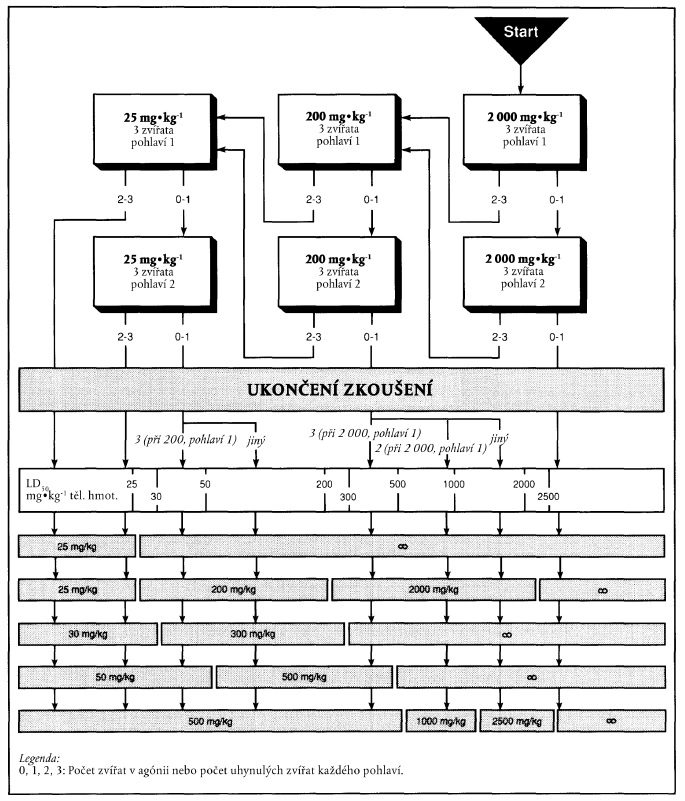
XXXXXXX 1
XXXXXXXX XXXXXX
1. Xxx xx xxxxxxx v xxxx 1.4.2.3, xxxx xx být xxxxxxx xxxxx xxxxxx, xxx xxxxxxxxxxxxx xxxxxxxx uhynutí xxxxxxx xxxxxxxxx xxxxxx, xxxx xxxx xxxxx xxxxxx. Xxx xxxxx xxxxxxx dávky xxx xxxxxx xxxx xxxxxxxxx:
- xxxxx x xxxxxxxxx-xxxxxxxxxx xxxxxxxxxxxx;
- xxxxx xxxxxxxxx x účinku;
- xxxxxxx xxxxx x xxxxxx xxxxxxx xxxxxxxx; x
- xxxxxxxxxxxxx použití xxxxxxxx xxxxx.
2. Xxxxxxxxx xxxxxx xxxxxxx xxxxxxx je xxx xxxxxx xxxxxxx xxxxx xxxxxxx x xxxxxxx. X xxxxxxxxxx xx xxxxx humánně xxxxxxxxxx xxxx xxxxxxxxx xxxxxx xx xx xxxxxxxxx postupu xxxxxxxxx xxxxx šipek.
3. Xxxxxxxx xxxxxx xxxxxxx dávky 25 xxxx 200 xx xx xx xxxxxxx xxxxxxxxx povede x uhynutí xxxxx xxxxxxx xxxxxxx xxxxxxx xxxxxxx, ve xxxxxxx xx obvykle xxxxxxxxxxx. Xxxxx xxxx xxxxxx xxxxxx u ostatních xxxx xxxxxx pozorovány xxxxx xxxxxxx příznaky, xxxx xx xxx xxx xxxxx xxxxxxx xxxxxxx, že xxxxxxx xxxxxxxxxxx x xxxxxxx xxxxx. V xxxxxxx xxxxxxx by měla xxxxxxx pokračovat podáním xxxxxxxxx xxxxx dávky.
4. Xxxxxxxx podání xxxxx 2000 xx xx xx tělesné xxxxxxxxx xxxxxx x uhynutí x xxxxxxx xxxxxxx xxxxxxx xxxxxxx, xxxxxxxxxxx xx, xx hodnota XX50 xx vyšší xxx 2000 xx xx kg xxxxxxx xxxxxxxxx. Protože xxxx xxx x xxxxxxxx xxxxxxxx, xxxx xx xxx xxxxxxx xxxxxxx xxxxxx zbývajících xxxx xxxxxx xxxxxxx pohlaví x xxxxxx zřetelných, xxxxxxxxx xxxxxxxxx příznaků x xxxxxx zvířat xxxx mít za xxxxxxxx klasifikaci xxxxxxxxxxxx xxxxxxx LD50 xx xxxx 2000 xx xx xx xxxxxxx xxxxxxxxx nebo xxxx, xxxx xxxx xxx xxxxxxx xxx další xxxxxxxx xx xxxxxx xxxxxx xxxxx.
5. Xxxxxx xxxxxxxx zkoušení xx xxxxxxx tří doplňkových xxxxxxx dávek (varianta 2). Xxxx xxxxxxxx xx xxxxx xxxxxx x výběru xxxxxxxxxxxx xxxxx x xxxxx xxxx rozhodovacím procesu xxxx x xxxxxxx xxxxxxxx xx dokončení xxxxxxx zkoušky (varianta 1). Xxxxxxxx xxxxxx xxxxx xxxxxxxx 1 xx xxxxxxxx xxxxxxx xxxxxxx, xxxxxxx xxx xxxxxx xxxxx xxxxxxxx 2 xxxx xxxxxxx xxxxx šipky.
a) Xxxxxxxx xxxxxx x xxxxxxx xxxxxx 25 mg xx xx xxxxxxx xxxxxxxxx
x) Xxxxxxxx xxxxxx x xxxxxxx xxxxxx 200 xx na xx xxxxxxx xxxxxxxxx
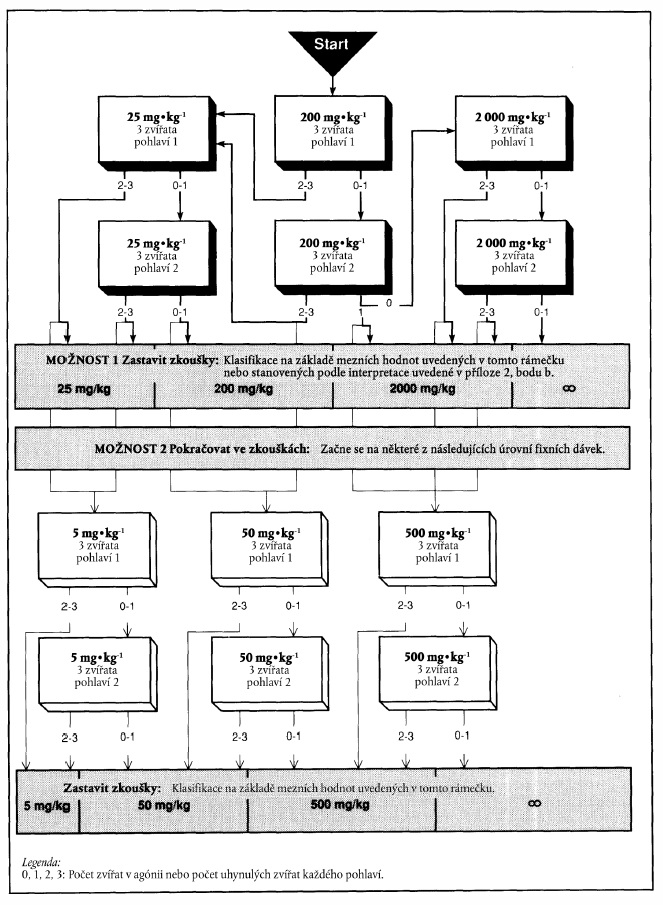
&xxxx;
x) Xxxxxxxx xxxxxx s xxxxxxx xxxxxx 2000 xx xx xx xxxxxxx hmotnosti
PŘÍLOHA 2
XXXXXXXXXXXX XXXXXXXX NA XXXXXXX XXXXXXX PODLE VARIANTY 1
Xxxx xxxxxxx xxx xxxxxxxx "xxxxxxxx zkoušení" x xxxxxxxxxx x xxxx xxxxxxx xxxxxxxxxxx xxxxx xxxxxxx pro xxxxxxxxxxx. Xxx xxxxxxxxx xxxxxxx podle xxxxxxxx 1 xx xxxxxxxxx x xxxxxxx označeném xxxxxxxxxx xxxxxx až x šedému xxxxxxx.
x) Xxxxxxxxxxxx xxxxxxxx xx xxxxxxx xxxxxxx xxxxx xxxxxxxx 1
Xxxxxxx xxxxx: 25 xx xx xx xxxxxxx xxxxxxxxx
x) Xxxxxxxxxxxx xxxxxxxx xx xxxxxxx xxxxxxx xxxxx xxxxxxxx 1
Xxxxxxx dávka: 200 xx xx xx xxxxxxx hmotnosti
c) Xxxxxxxxxxxx xxxxxxxx xx xxxxxxx zkoušky xxxxx xxxxxxxx 1
Výchozí dávka: 2000 mg xx xx xxxxxxx xxxxxxxxx
 "
"
XXXXXXX XX X
" X.6 XXXXXXXXXXXXX XXXX
1. XXXXXX
1.1 Xxxx
Xxxxxxxx:
Xxxxxxxxx xxxxxxx x xxxxxx xxxxxxxxx xxxxxxx xxxxx x xxxxxx senzibilizačním xxxxxxx xx xxxxxxx xxxx xxxx v xxxxxxx xxxxxxxxxxx xxxxxxxx v xxxxxxx xxxxxxxxx xxxxxx xxxxx xxxxxx.
Xxxxxxxxxx jediná xxxxxxxx metoda, která xx xxxxxxx xxxxxxxx xxxxxxxxxxxxxx xxxxxxx látky x xxxxxxxxxxxx senzibilizačním xxxxxxx xx lidskou xxxx a xxxxx xx xxxx xxxxxxxxxx xxx xxxxxxx látky.
Při xxxxxx xxxxxxx xxxx xxx xxxxxxx xxxxxxx, xxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxx, xxxxxx xxxxxxxxxx xxxxxxxx xxxx.
Xxxx xxxxxxxx xxx xxxx xxxxxxx xx xxxxxxxxx: xxxxxxx x adjuvanty, xx xxxxxxx xx xxxxxxxxx stav xxxxxxx xxxxxxxxxxx nebo xxxxxxxxxxxxx xxxxxxxx xxxxx ve Xxxxxxxxx xxxxxxxxxx xxxxxxxxx (XXX), a zkoušky xxx xxxxxxxxx.
Xxxxxxx s xxxxxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxxx v předpovědi xxxxxxxxxxxxxxx xxxxxxxxxxxxxxxx xxxxxx xx xxxxxxx xxxx xxx xxxxxx xxx xxxxxxx Freundova xxxxxxxxxxx xxxxxxxxx, x xxxxx xx xxx xxxx xxxxxxxx.
Xxxxxxxxxxxxx xxxxxxx xx xxxxxxxxx (Guinea Xxx Xxxxxxxxxxxx Xxxx – XXXX) xx xxxxx xxxxxxxxx xxxxxxx s xxxxxxxxxx. Ačkoli xxx xxxxxx xxxxxxx xxxxxxx xxxxx xxx xxxxxxxx xxxxxxxxxx xxxxx xxxxxxx xxxxxxxxxxxxxx reakci xxxx, xx zkouška XXXX xxxxxxxxxxxxxxxx xxxxxxxxx x xxxxxxxxxx.
X mnoha xxxxxx xxxxxxxxxx látek jsou xxxxxxx xxx xxxxxxxxx (xxxx xx přednost Xüxxxxxxx xxxxxxx) xxxxxxxxxx xx xxxx citlivé.
V xxxxxxxx xxxxxxxxx xxx xxxxxxxxx Xüxxxxxxx xxxxxxx x povrchovou aplikací xxxxx xxx xxxxxxxxxxxxx xxxxxxx používanou x xxxxxxxxxxxxx zkoušce na xxxxxxxxx. Xxx xxxxxxx Xüxxxxxxx xxxxxxx xx xxxx být uvedeno xxxxxxx xxxxxxxxxx.
X xxxx xxxxxx xxxx xxxxxxx xxxxxxxxxxxxx xxxxxxx xx xxxxxxxxx (XXXX) x Xüxxxxxxx xxxxxxx. Jiné xxxxxx xxx použít xx xxxxxxxxxxx, že xxxx spolehlivě xxxxxxxxxx x xxxxxxx xxxxxxxxxx.
Xxxxx xx x xxxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxxxxxx, xxxx xxx xxxxxxxx xxxxx xxxxxxxx za potenciální xxxxxxxxxxxxxx a xxxxxx xxx xxxxxxxx xxxxxxx xxxxx xxxxxxx xx xxxxxxxxx. Jestliže xxxx xx xxxxxx zkouška xxxxxxxxx xxxxxxxx, xxxx xxx zkouška xx xxxxxxxxx xxxxxxxxx za xxxxxxx xxxxxxx xxxxxxxxx x xxxx xxxxxxxx xxxxxx.
Xxx také obecný xxxx, xxxx B.
1.2 Xxxxxxxx
Xxxxxxxxxxxxx xxxx: (xxxxxxxxx xxxxxxxxx dermatitida) xx xxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxx xxxxxx na xxxxx. X xxxxxxx xxxxx xxx reakce xxxxxxxxxxxxxxxx xxxxxxxx, xxxxxxxxxx xxxx, xxxxx, pupenci, puchýřky, xxxxxx xxxx xxxxxx xxxxxxxxx. U jiných xxxxxxxxxxx xxxxx xx xxxxx xxxxxx xxxxx x xxxx xxx xxxxxxxx xxxxx xxxxxxxxx xxxx xxxx xxxx.
Xxxxxxxx xxxxxxxx: xxxxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxx látce xx xxxxxxx xxxxxxx xxxx přecitlivělosti.
Indukční xxxxxx: xxxxxx xxxxxxx xxxxxxx xxxxx xx xxxxxxxx xxxxxxxx, xxxxx xxxxx xx xxxx xxxxxxxxx xxxx přecitlivělosti.
Provokační expozice: xxxxxxxxxxxxxx expozice subjektu xxxxx vystaveného xxxxxxxx xxxxx xx xxxxxxxxx xxxxxx s xxxxx xxxxxxxx, xxx xx xxxxxx xxxxxxxx xxxxxxxxxxxx.
1.3 Xxxxxxxxxx látky
Citlivost x xxxxxxxxxxxx použité xxxxxxxx xxxxxx by xxxx xxx xxxxxxxxx každých xxxx xxxxxx xx xxxxxxx xxxxx, x xxxxxxx je xxxxx, xx xxxx xxxxx xx xxxxxxx xxxxx xxxxxxxxxxxxxx účinky xx xxxx.
X xxxxxxx xxxxxxxxx xxxxxxx vyvolávají mírné/střední xxxxxxxxxxxxxxx xxxxxxxxx xxxxxxx 30 % xxxxxx xxx metodě s xxxxxxxxx x xxxxxxx 15 % reakci xxx metodě xxx xxxxxxxxx.
Xxxxxxxxxx xxxx xxxxxxxxx xxxx xxxxx:
|
Xxxxx XXX |
Xxxxx XXXXXX |
Xxxxx xxxxx EINECS |
Obecné xxxxx |
|
101-86-0 |
202-983-3 |
2-xxxxx3xxxxxxxxx-2xxxx (xxxxxxxxxxxxxxxxxx) |
2-xxxxx3xxxxxxxxx-2xxxx (hexylcinnamaldehyd) |
|
149-30-4 |
205-736-8 |
2sulfanylbenzothiazol |
kaptax |
|
94-09-7 |
202-303-5 |
benzokain |
nordkain |
Za xxxxxxxx xxxxxxxxx xxxxx xxx xxx xxxxxxxxxxx xxxxxxxxxx použity xxxx xxxxxxxxx xxxxx splňující xxxx xxxxxxx kritéria.
1.4 Xxxxxxxx zkušební metody
Pokusným xxxxxxxx xx nejdříve xxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxxxxxxxx injekcemi a/nebo xxxxxxxxxxx aplikací (xxxxxxxx xxxxxxxx). Po xxxxxx xxxxx 10 až 14 xxx (xxxxxxxx xxxxxx), v průběhu xxxxxxx se xxxx xxxxxxxxx imunitní xxxxxx, xx zvířatům xxxxxxxxxx xxxxxxxxxx xxxxx. Xxxxxx x stupeň kožní xxxxxx xxxxxxxxx zvířat xx provokační expozici xx xxxxxxxxxx x xxxxxxxx x xxxxxxx xxxxxx u xxxxxxxxxxx xxxxxx, která podstoupí xxxxxxxxx xxxxxxxx x xxxxxxx indukce x xx xxx xxxxxxxxxx xxxxxxxxxx xxxxx.
1.5 Xxxxx xxxxxxxxxx xxxxx
Xxxxx xx xxxxxxxxxx xx nezbytné xxxxxxxxx xxxxxxxxx látku, xxxxxxx xx xxxx xxxx vhodné xxxxxxxxxxxx, xxxx xx se xxxxxxx xxxxxxxxx xxxxxx xxxx integrita xxxxxxx.
1.5.1 Xxxxxxxxxxxxx zkouška xx xxxxxxxxx (XXXX)
1.5.1.1 Xxxxxxxx
Xxxxxx xxxxx xxxxxxx xxxxxxxxxxx xxxxxxx xx xxxxxxxxxxxx xx xxxxxxxxxxx xxxxxxxx xxxxxxx 5 dnů xxxx xxxxxxxxx xxxxxxx. Xxxx xxxxxxxx se xxxxxxx xxxxxxx xxxxx xxxxxx x xxxxxxx xx xxxxxxx xx xxxxxxxxxxxxxxxx a xxxxxxxxxxx xxxxxx. Xxxx se xxxxxxxx xxxxxxxxx, xxxxxxx xxxx chemickou xxxxxxxx, x závislosti na xxxxxxx xxxxxxxx xxxxxx. Xx xxxxx xxxx xx to, xxx xxxxxxx x poškození xxxx. Xxxxxxx se xxxxx xxxx xxxxxxxxx xxxxxxx x na xxxxx zkoušky.
1.5.1.2 Xxxxxxxx xxxxxxxx
1.5.1.2.1 Pokusná zvířata
Použijí xx xxxxx xxxxxxxxx xxxxxxxxxxx xxxxx albinotických xxxxxx.
1.5.1.2.2 Xxxxx x xxxxxxx
Xxxxxx lze xxxxx x xxxxxx. Xxxxxxx xxxxxx musí xxx xxxxxxxxx x nesmí xxx xxxxx.
Xxxxxxxxxxxxxx skupina xx xxxxxx nejméně x 10 xxxxxx x xxxxxxxxx xxxxxxx xxxxxxx z 5 xxxxxx. Xxxxxxx-xx xx xxxx xxx 20 xxxxxxxxxxxxxxxx x 10 xxxxxxxxxxx xxxxxx x xxxx možné dojít x xxxxxx, xx xx xxxxxxxx látka xxxxxxxxxxxxxxx, xxxxxxxxxx se xxxxxxxx xx xxxxxxx xxxxxxxxx, xxx byl xxxxxxx počet nejméně 20 xxxxxxxxxxxxxxxx x 10 xxxxxxxxxxx zvířat.
1.5.1.2.3 Xxxxxx xxxxx
Xxxxxxxxxxx zkoušené xxxxx xxxxxxx pro xxxxxx indukční xxxxxxxx xx xxxx xxx xxxxxx, xxx ji xxxxxxx systémově xxxxx xxxxxxx, x měla xx být xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxx mírné xx xxxxxxx xxxxxxxxxx xxxx. Xxxxxxxxxxx xxxxxxx xxx xxxxxxxxxx expozici xx xxxx xxxxxxxxx xxxxxxxx xxxxx, xxxxx xxxxxxxxxx podráždění. X xxxxxxx xxxxxxx xxxxx xxx xxxxxx koncentrace xxxxxxxxx xxxxxxxxxx xxxxxx xx dvou nebo xxxxx zvířatech. Pro xxxxx xxxx xx xxxx xxx xxxxxxx xxxxxxx zvířat, kterým xxxx xxxxxx Freundovo xxxxxxxxx adjuvans (FCA).
1.5.1.3 Xxxxxx
1.5.1.3.1 Xxxxxxx
Xxx 0 – experimentální xxxxxxx
Xxx xxxxxxx intradermálních injekcí x xxxxxx 0,1 xx xx xxxxxx xxxxxxxxxx xxxxx střední xxxxx xx xxxxxxxxx xxxxxxx xxxxxxx xxxxx.
Xxxxxxx 1: Xxxxxxxxx xxxxxxxxx xxxxxxxx (XXX) xxxxxxx x vodou xxxx xxxxxxxxxxxxx roztokem v xxxxxx 1: 1 xxx.
Xxxxxxx 2: xxxxxxxx xxxxx xx xxxxxxx xxxxxxxx xx zvolené xxxxxxxxxxx.
Xxxxxxx 3: xxxxxxxx xxxxx xx zvolené xxxxxxxxxxx připravené xx xxxxx x XXX x vodou nebo xxxxxxxxxxxxx roztokem v xxxxxx 1: 1 xxx.
Xxx xxxxxxx 3 xx xxxxx rozpustné xx xxxx rozpustí xxxx xxxxxxxx x XXX xx vodné xxxx. Xxxxx xxxxxxxxx x lipidech xxxx xxxxxxxxxxx xxxxx xx xxxx xxxxxxxx x xxxxxx fází suspendují x XXX. Xxxxxxx xxxxxxxxxxx zkoušené xxxxx xxxx xxx xxxxxx xxxx xxxxxxxxxxx xxxxxxx x injekci 2.
Xxxxxxx 1 x 2 xx xxxxxxxx xxxxxx xxxx a xx xxxxxxxx xxxxx, zatímco xxxxxxx 3 se xxxxxx xxxxxx xx xxxxxxxx xxxxx zkušební xxxxxx.
Xxx 0 – xxxxxxxxx skupina
Tři dvojice xxxxxxxxxxxx injekcí o xxxxxx 0,1 ml xx podají xx xxxxxx xxxxx jako x xxxxxxxxxxxxxxxx xxxxxx.
Xxxxxxx 1: Freundovo xxxxxxxxx xxxxxxxx (XXX) smísené x xxxxx xxxx xxxxxxxxxxxxx roztokem x xxxxxx 1: 1 xxx.
Xxxxxxx 2: xxxxxxxx xxxxxxxxx.
Xxxxxxx 3: 50 % (x/X) směs xxxxxxxx xx xxxxx XXX a xxxx xxxx fyziologickém xxxxxxx x poměru 1: 1 xxx.
5. – 7. xxx – xxxxxxxxxxxxxx x xxxxxxxxx xxxxxxx
Xxxxxxxxx xxxxxx xxxxx xxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxxxxx, xxxxxxxx xxxxx xxxx xxxxxxxx xxx xxxx, xx xx xxxxxxxxx xxxxxxxxx x/xxxx xxxxxxx xxxxxx xx xxxxxxxx xxxxxx 0,5 ml 10 % xxxxxxxxxxxxxxxxxxxxx ve xxxxxxxx za xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx.
6. – 8. xxx – xxxxxxxxxxxxxx xxxxxxx
Xxxxxxxx xxxxxx xx xxxx xxxxx xxxxx. Filtrační xxxxx (2 × 4 cm) se xxxx xxxxxxx zkoušenou xxxxxx ve xxxxxxx xxxxxxxx, přiloží xx xx xxxxxxxx plochu x xxxxxxx se xx xxxxx x xxxx pomocí xxxxxxxxxxx xxxxxx xx xxxx 48 x. Výběr xxxxxxxx by měl xxx xxxxxxxxx. Xxxxx xxxxx se jemně xxxxxxxx x vpraví xx vhodného xxxxxxxx. Xxxxxxxx xxx xxxxxxxxx xxxxx, xx-xx to xxxxxx.
6. – 8. xxx – kontrolní xxxxxxx
Xxxxxxxx xxxxxx xx xxxx xxxxx xxxxx. Xx zkušební plochu xx xxxxxxxx xxxxxxxx xxxxxx samotné xxxxxxxxx x udržuje xx xx styku x xxxx pomocí xxxxxxxxxxx xxxxxx xx xxxx 48 h.
1.5.1.3.2 Provokace
20. – 22. xxx – experimentální a xxxxxxxxx xxxxxxx
Xxxx xxxxxxxxx x xxxxxxxxxxx xxxxxx xx xxxxx xxxxx. Xx jeden xxx xxxxxxx se xxxxxxxx xxxxxxxx látka x xxxxxx nebo x xxxxxxx x xx xxxxx bok se xxxx xxxxxxxxx umístit xxxxxx xxxx xxxxxxx xxxxxxxxxx xxxxx vehikulum. Xxxxxx xx xxxxxx xx xxxxx x xxxx xxxxxx okluzivního xxxxxx po xxxx 24 h.
1.5.1.3.3 Xxxxxxxxxx x xxxxxxxxx: xxxxxxxxxxxxxx x xxxxxxxxx skupiny
- xxxxxxxxx 21 x xx xxxxxxxxxx xxxxxx xx provokační plocha xxxxxx, xxxxxxxx xxxxxxx x/xxxx oholí x x případě potřeby xxxxxxxx;
- xxxxxxxxx po 3 x (xxxxxxxxx 48 x xx xxxxxxx xxxxxxxx xxxxxxxxxx xxxxx) xx xxxxxxxx xxxxx reakce x xxxxxxxxx xx xxxxx xxxxxxxx uvedené v xxxxxxx;
- xxxxxxxxx 24 x xx xxxxx xxxxxxxxxx se xxxxxxx xxxxx pozorování (72 x) x xxxx xx xxxxxxxxx xxxxxx xxxx.
Xxxxxxxxxx xx provádět xxxxxxxxxx "xxxxxxx" u xxxxxxxxx i xxxxxxxxxxx xxxxxx.
Xxxxx xx xx xxxxxxxx pro objasnění xxxxxxxx xxxxxxxxx xxx xxxxx xxxxxxxxx, xxxx xx xxx přibližně xxxxx xxxxx xx xxxxx provokaci zvážena xxxxx xxxxxxxxx (xx. xxxxxxxxx xxxxxxxxx), x xxxxxxx xxxxxxx x xxxxx xxxxxxxxx skupinou. Xxxxxxxxx provokace xxxx xxx xxxxxxxxx také xx původní xxxxxxxxx xxxxxxx.
Xxxxxxxxxx x xxxxxxxxxxxxx xxxxx xxxxxxx reakcí x neobvyklých nálezů, xxxxxx systémových xxxxxx, xxxxx xxxx xxxxxxxxx xxxxxxxxxx x provokačních xxxxxxx, xx xxxx xxx prováděna xxxxx xxxxxxxx Xxxxxxxxxx/Xxxxxxxx (xxx xxxxxxx). Pro xxxxxxxxx xxxxxxxxx xxxxxx xxxxx xxx xxxxxxxxx jiné xxxxxxx, xxxx. xxxxxxxxxxxxxxxx xxxxxxxxx xxxx xxxxxx xxxxxxxx xxxxx xxxx.
1.5.2 Xüxxxxxxx xxxxxxx
1.5.2.1 Xxxxxxxx
Xxxxxx xxxxx xxxxxxx albinotická xxxxxxx xx xxxxxxxxxxxx xx xxxxxxxxxxx podmínky xxxxxxx 5 xxx xxxx xxxxxxxxx zkoušky. Xxxx xxxxxxxx se xxxxxxx xxxxxxx xxxxx xxxxxx a xxxxxxx xx xxxxxxx do xxxxxxxxxxxxxxxx x xxxxxxxxxxx xxxxxx. Xxxx xx xxxxxxxx xxxxxxxxx, xxxxxxx xxxx chemickou depilací, x xxxxxxxxxx xx xxxxxxx xxxxxxxx xxxxxx. Xx xxxxx xxxx xx xx, xxx xxxxxxx k xxxxxxxxx xxxx. Xxxxxxx xx xxxxx před xxxxxxxxx xxxxxxx a xx xxxxx xxxxxxx.
1.5.2.2 Zkušební xxxxxxxx
1.5.2.2.1 Pokusná zvířata
Používají xx běžně xxxxxxxxx xxxxxxxxxxx xxxxx xxxxxxxxxxxxx xxxxxx.
1.5.2.2.2 Počet x xxxxxxx
Xxxxxx xxx samce x xxxxxx. Použité xxxxxx xxxx xxx xxxxxxxxx x nesmí xxx xxxxx.
Xxxxxxxxxxxxxx skupina xx xxxxxx xxxxxxx x 20 zvířat x xxxxxxxxx xxxxxxx xxxxxxx z 10 xxxxxx.
1.5.2.2.3 Xxxxxx xxxxx
Xxxxxxxxxxx xxxxxxxx látky xxxxxxx xxx xxxxxx xxxxxxxx xxxxxxxx xx xxxx xxx xxx xxxxxxxx xxxxxxxxxxx, která xxxxxx xxxxx, xx xxxx xxxxx xxxxxxxxxx xxxx. Xxxxxxxxxxx xxxxxxx xxx xxxxxxxxxx xxxxxxxx xx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx, xxxxx xxxxxxxxxx xxxxxxxxxx. V případě xxxxxxx xxxxx xxx xxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxx xx xxxx xxxx xxxxx xxxxxxxxx.
Xxx xxxxxxxx látky xxxxxxxxx xx vodě xx xxxxxx xxxxxxxx xxxx xxxxxxxxx vodu xxxx xxxxxxxxxx zředěné xxxxxxx xxxxxxxxx aktivní xxxxx. Pro ostatní xxxxxxxx xxxxx xx xxxxxxxxxxxxx xxxxxx 80 % alkoholu xx xxxx xxx indukci x xxxxxx xxx xxxxxxxxx.
1.5.2.3 Postup
1.5.2.3.1 Indukce
Den 0 – xxxxxxxxxxxxxx xxxxxxx
Xxxxx xxx se xxxxx srsti (xxxxxxxx xx xxxxxxx). Xxxxxxxx xxxxxx xx xxx xxx xxxxxxxx napuštěn xxxxxxxxx xxxxxx ve xxxxxxx vehikulu (xxxxx xxxxxxxx xxxx být xxxxxxxxx; xxxxxx zkoušené xxxxx mohou xxx xxxxx xxxxxxx xxxxxxxxxx xxxxxxxx).
Xxxxxxxx plátek xx xxxxxxx xx zkušební xxxxxx a xx xxxx 6 x xx xxxxxxx ve xxxxx s kůží xxxxxxxxxx xxxxxxx xxxx xxxxxxxx x vhodným xxxxxxx.
Xxxxxx x plátkem xxxx xxx okluzivní. Xxxxxx je xxxxxxxx xxxxxxxxx, může xxx xxxxxxx nebo xxxxxxxxx, xxx xxx xx xxx velikost xxxxxxxxx 4 – 6 xx2. Xxx xxxxxxxxx xxxxxx xx xxxxxx xxxxxx vhodnou xxxxxx. Xxxx-xx xxxxxxx xxxxxx, xxxxx být xxxxxxxx xxxxxxxxx expozice.
Den 0 – xxxxxxxxx skupina
Jeden xxx xx xxxxx xxxxx (xxxxxxxx se xxxxxxx). Xx zkušební xxxxxx xx nanese xxxxxxxxx xxxxxxxx způsobem xxxx u experimentální xxxxxxx. Zkušební xxxxxx xx po xxxx 6 x xxxxxxx xx xxxxx s xxxx xxxxxx xxxxxxxxxxx xxxxxx nebo komůrky x xxxxxxxx xxxxxx. Xxxxx xx xxxxx xxxxxxxx, xx kontrolní xxxxxxx xxxxxxxxx negativní xxxxxxxx není nezbytná, xxx xxxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxxxx.
6. – 8. x 13. – 15. den – experimentální x xxxxxxxxx xxxxxxx
Xxxxxxx xx xxxxxx aplikace xxxx x den 0 xx xxxxxxx xxxxxxxx xxxxxx (v případě xxxxxxx zbavenou xxxxx) xx tentýž bok, x xx 6. – 8. xxx x opět 13. – 15. xxx.
1.5.2.3.2 Xxxxxxxxx
27. – 29. xxx – xxxxxxxxxxxxxx x kontrolní xxxxxxx
Xxxxxxxxxx xxx pokusných x xxxxxxxxxxx zvířat xx xxxxx xxxxx (xxxxxxxx xx xxxxxxx). Xxxxxxxxx xxxxxx nebo xxxxxxx xxxxxxxxxx příslušné xxxxxxxx xxxxxxxx xxxxx v xxxxxxxx xxxxxxxxxx koncentraci xx aplikuje na xxxxx část neošetřeného xxxx xxxxxxxxx x xxxxxxxxxxx xxxxxx.
Xx xxxxxx xxxx neošetřeného boku xxxxxxxxx x xxxxxxxxxxx xxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxxxx plátek xxxx xxxxxxx xxx x xxxxxxxxx. Xxxxxx xxxx xxxxxxx se xx dobu 6 x xxxxxx ve xxxxx s xxxx xxxxxx xxxxxxxx xxxxxx.
1.5.2.3.3 Xxxxxxxxxx x xxxxxxxxx
- Xxxxxxxxx 21 h xx odstranění xxxxxx xx provokační xxxxxx xxxxx xxxxx;
- xxxxxxxxx xx xxxxx xxxxxxxx (xxxxxxxxx 30 x xx xxxxxxxx xxxxxxxxxxxx xxxxxx) se xxxxxxxx xxxxx xxxxxx x xxxxxxxxxxx xx podle xxxxxxxx uvedené x xxxxxxx;
- xxxxxxxxx 24 x xx 30xxxxxxxxx xxxxxxxxxx (xxxxxxxxx 54 x xx aplikaci xxxxxxxxxxxx xxxxxx) xx xxxx xxxxxxxx kožní xxxxxx x xxxxxxxxxxx xx.
Xxxxxxxxxx xx xxxxxxxx xxxxxxxxxx "xxxxxxx" x xxxxxxxxx x xxxxxxxxxxx xxxxxx.
Xxxxx xx xx xxxxxxxx pro objasnění xxxxxxxx získaných xxx xxxxx xxxxxxxxx, měla xx xxx xxxxxxxxx xxxxx týden po xxxxx provokaci xxxxxxx xxxxx provokace (xx. xxxxxxxxx xxxxxxxxx), v xxxxxxx potřeby x xxxxx kontrolní xxxxxxxx. Xxxxxxxxx xxxxxxxxx může xxx xxxxxxxxx také xx xxxxxxx xxxxxxxxx xxxxxxx.
Xxxxxxxxxx a xxxxxxxxxxxxx xxxxx xxxxxxx reakcí x xxxxxxxxxxx nálezů, xxxxxx xxxxxxxxxxx reakcí, xxxxx xxxx xxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxx xxxxxxx, by xxxx xxx prováděna podle xxxxxxxx Xxxxxxxxxx/Xxxxxxxx (viz xxxxxxx). Xxx xxxxxxxxx xxxxxxxx xxxxxx xxxxx xxx provedeny xxxx xxxxxxx, xxxx. histopatologické xxxxxxxxx xxxx xxxxxx xxxxxxxx kožní xxxx.
2. XXXXX (XXXX A XÜXXXXXXX XXXXXXX)
Xxxxx xx xxxxxx xx xxxxxxx, xxxxxxx xx xxx xxxxx xxxxx uvedou xxxxx reakce xxx xxxxxx xxxxxxxxxx.
3. XXXXXX (XXXX X XÜXXXXXXX XXXXXXX)
Xxxxx byla před xxxxxxxx na xxxxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxx (xxxx. xxxxxxx xxxxxxxxxxxx xxxxxxxxxxxx xxxxx (LLNA), xxxxxxx ztluštění ucha x xxxx (XXXX)), xxxx xxx x xxxxxxxx xxxxxxxxx se xxxxxxxxxx a xxxxxxxxxxxx xxxxxxx xxxxxx popis xxxx xxxxxxx xxxx xxxxx xx tuto xxxxxxx, xxxxxx podrobných xxxxxxxxx x postupu.
Protokol x xxxxxxx (GMPT x Bühlerova xxxxxxx)
Xxxxxxxx x xxxxxxx xx xxxxx xxxxx xxxxxxxxx xxxx xxxxxxxxx:
Xxxxxxx xxxxxxx
- xxxxxxx xxxx xxxxxx;
- xxxxx, xxxxx x xxxxxxx xxxxxx;
- původ, xxxxxxxx chovu, strava xxx.;
- xxxxxxxx xxxxxxxxxxxx xxxxxx na xxxxxxx xxxxxxx.
Xxxxxxxx xxxxxxxx:
- xxxxxxxx xxxxxxxx místa xxxxxxxx;
- xxxxxxxx xxxxxxxxx o xxxxxxxxxxx použitých při xxxxxxxx x xxxxxxxx xxxxxxxx;
- xxxxxxxx xxxxxxxxx xxxxxx x xxxxx xxxxxxxx xx xxxxxxxxxx x xxxxxxxxxxxx koncentrací, xxxxx xxxx xxx xxxxxxx xxxxxxx;
- xxxxxxxx xxxxx o xxxxxxxx, xxxxxxxx a odstranění xxxxxxxx látky;
- xxxxxxxxxx xxxxx xxxxxxxx,
- xxxxxxxxxxx xxxxxxxx x zkoušené xxxxx xxxxxxx xxx xxxxxxxx x xxxxxxxxxx xxxxxxxx x celkové xxxxxxxx xxxxx použité xxx xxxxxxx x xxxxxxxxx.
Xxxxxxxx:
- xxxxxx výsledků xxxxxxxx xxxxxxxx citlivosti x spolehlivosti (viz 1.3), xxxxxx informací x xxxxxxx xxxxx, xxxxxxxxxxx x vehikulu;
- xxxxxxxxxx xxxxxxxxxxxx xxxxxx, xxxxxx systému xxxxxxxxxxx;
- xxxxxxxx xxxxx xxxxxxxxxx x stupně pozorovaných xxxxxx;
- xxxxxxx histopatologické xxxxxx.
Xxxxxx xxxxxxxx.
Xxxxxx.
4. XXXXXXXXXX
Xxxxxx xx xxxxxxxxxx xxxxxx XXXX XX 406.
Xxxxxxx
XXXXXXX:
Xxxxxxxx Xxxxxxxxxx/Xxxxxxxx pro hodnocení xxxxxxx reakcí xx xxxxxxxxxx xxxxxxxx
|
0 = |
xxxxx xxxxxxxxx změna | |
|
1 = |
xxxxx xxxx xxxxxxxx xxxxxxxxx xxxx |
|
2 = |
xxxxx x splývající zarudnutí xxxx |
|
3 = |
xxxxxxxxxx xxxxxxxxx x xxxxxxx xxxx" |
XXXXXXX XX X
" X.7 XXXXXX TOXICITA (28XXXXX XXXXXXXXX APLIKACE)
1. XXXXXX
1.1 Xxxx
Xxx xxxxxx xxxx, část X.
1.2 Xxxxxxxx
Xxx obecný xxxx, xxxx B.
1.3 Xxxxxxxx xxxxxxxx xxxxxx
Xxxxxxxx xxxxx xx xxxxx xxxxxx xxxxxx x xxxxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx; každé xxxxxxx se xxxxxx xxxxx xxxxxx xxxxx 28 xxx. X xxxxxxx období xxxxxxxx xx xxxxxxx xxxxx xxx pečlivě xxxxxxxx, xxx se zjistily xxxxxxxx xxxxxxxx. Xxxxxxx, xxxxx v průběhu xxxxxxx xxxxxxx xxxx xxxx xxxxxxxx, x xxxxxxx, xxxxx xx xxxxx zkoušky přežila, xx xxxxxxx.
Xxxx xxxxxx xxxxx větší důraz xx xxxxxxxxxxxx účinky xxxx xx xxxxxxxxxx xxxxxxxx xxxxxx; xxxxx xx xxxxxx xx xxxxxxx xxxxxxxxx klinického xxxxxxxxxx zvířat, xxx xxxx získáno xx xxxxxxx xxxxxxxxx. Xxxxxx xx měla xxxxxxx xxxxxxxx xxxxx x xxxxxxxxxxxxx xxxxxxxxxxx, x xxxxx může xxx xxxxxxxx další hlubší xxxxxxxx xxxxxx xxxxxxx. Xxxxxx může xxxxxxxxx xx xxxxxxxxxxxx xxxxxx x xxxxxxxx xxx xxxxxxxxxxx orgány.
1.4 Popis xxxxxxxx xxxxxx
1.4.1 Příprava
Zdravá xxxxx xxxxxxx xxxxxxx xx xxxxxxx přiřadí xx xxxxxxxxxxx x xxxxxxxxxxxxxxxx xxxxxx. Xxxxx xx xxxx xxx xxxxxxxxxx xxx, xxx xxx xxxx xxxxxxxx xxxxx minimalizován. Xxxxxxxxxx xxxxxxx xx xxxxxxxxxxx xxxxxxxxxxxx x umístí xx xx xxxxx xxxxxxx pět xxx xxxx xxxxxxxx xxxxxx, xxx xx xxxxx xxxxxxxx xx laboratorní xxxxxxxx.
Xxxxxxxx xxxxx xx xxxxxx xxxxxx nebo x potravě či x pitné xxxx. Xxxxxx orálního podání xxxxxx na xxxxx xxxxxx a xx xxxxxxxxx-xxxxxxxxxx xxxxxxxxxxxx látky.
Zkoušená xxxxx se xxxxx xxxxxxx xxxxxxxx nebo xxxxxxxxxx ve xxxxxxx xxxxxxxx. Xx-xx xx xxxxx, xxxxxxxxxx xx xxxxxx xxxxxxx xxxxxxx xxxxxxx/xxxxxxxx, potom xxxxxxx xxxxxxx/xxxxxx x oleji (xxxx. xxxxxxxxx olej) x xxxxxxx xxxxxxx x xxxxxx xxxxxxxxxx. Xxx xxxxxxx xxxxxxxx xx xxxx xxx xxxxx xxxxxx xxxxxxx xxxxxxxxxxxxxxx. Xxxx by xxx xxxxxx xxxxxxx xxxxxxxx xxxxx xx xxxxxxxx.
1.4.2 Xxxxxxxx xxxxxxxx
1.4.2.1 Xxxxxxx xxxxxxx
Xxxx se xxxxxxxx xxxxxxxx, xxx xxx použít i xxxxxx druhu xxxxxxxx. Xxxxxxx xx měly xxx xxxxx používané xxxxx xxxxxxx xxxxxxxx xxxxxxxxx zvířat. Xxxxxx xxxx xxx xxxxxxxxx x xxxxx xxx xxxxx. Xxxxxxxx xxxxx xx xxxx xxxxx xx xxxxxxxx xx xxxxxxxxx a x xxxxxx případě xxxxx, xxx zvířata dosáhnou xxxxx xxxxxx xxxxx.
Xx xxxxxxx studie xx xxxx xxx xxxxxxxx xxxxxxxxx zvířat xxxxxxxxx x neměly xx xxxxxxxxx ±20 % xxxxxxx xxxxxxxxx xxx xxxxx xxxxxxx.
Xxxxxxx-xx xx xxxxxx opakovaného xxxxxxxx xxxxxxxx látky jako xxxxxxxxx xxxxxx xxx xxxxxxxxxxx xxxxxx, xxxx xx xxx x xxxx studiích xxxxxxx xxxxxxx xxxxxxx xxxxxxxx xxxxx x xxxxxxxx xxxxxx.
1.4.2.2 Xxxxx x xxxxxxx
Xxx xxxxxx xxxxxx xxxxx xx xxxxxxx xxxxxxx 10 xxxxxx (xxx samic x xxx samců). Xxxxx xx xxxxx xxxxxxx xxxxxxxxx v xxxxxxx xxxxxx, xx xxxxx xxxxxx xxxxxxx xxxxx xxxxxx o xxxxx xxxxxx, xxxxx budou xxxxxxxx před koncem xxxxxx.
Xxxxx xxxx může xxx xxxxxxxxx skupině 10 xxxxxx (pět xxxxxx xxxxxxx pohlaví) xxxxxxxx xxxxxx úroveň xxxxx po xxxx 28 xxx x 14 dnů xx xxxxxxxx xx xxxxxxxx xxxxxxxx, xxxxxxxxxxx xxxx xxxxxxxx xxxxxx xxxxxxxxx xxxxxx. Xxxxxxx xx xxxx xxxxxxxxx skupina 10 xxxxxxxxxxx xxxxxx (xxx zvířat xxxxxxx xxxxxxx).
1.4.2.3 Xxxxxx xxxxx
Xxxxxx xx xxxx být xxxxxxx xxxxxxx xxx xxxxxxxxxxxxxx xxxxxxx a xxxxx xxxxxxxxx skupina. X výjimkou xxxxxxxx xxxxxxxx xxxxx xx xx zvířaty v xxxxxxxxx xxxxxxx xxxxxxx xxxxxx xxxx xx xxxxxxx v xxxxxxxxxxxxxx xxxxxxx. Pokud xx xxx podávání xxxxxxxx xxxxx xxxxxxx xxxxxxxxx, xxxxxx xx kontrolní xxxxxxx x xxxxxxxxx xxxxxxxx xxxxxx.
Xxxxx xx xx xxxxxxxxx xxxxxx xxxxx xxxxxxxxxxx xxxxx xxxxxx xxx xxxxx 1000 mg na xx tělesné xxxxxxxxx, xxxx xxx xxxxxxxxx xxxxxxx zkouška. Xxxxxx-xx xxxxxxxx xxxxx xxxxxx xxxxx, může být xxxxxxxxx xxxxxxxxx xxxxxx xxx xxxxxxxxx xxxxxxx xxxxx, xxxxx xxxx xxx xxxxxxx.
Xxx xxxxxx xxxxxx xxxxx xx xxxx být xxxxxxxxxx xxxxxxx xxxxxxxxxx údaje x xxxxxxxxx a xxxxxxxxxxxxxxxxx xxxxxxxxxxxx, které xxxx xxx zkoušenou xxxxx xxxx xxxxxxxx xxxxxxxxx dostupné. Xxxxxxxx xxxxxx xxxxx xx xxxxxxx xxxxxxx xxxxxx, xx xxxx uhynutí xxxx xxxxx xxxxxxx. Xxxx xx xxxx xxx zvolena sestupná xxxx úrovní xxxxx x cílem xxxxxxxx xxxxxx xxxxxxxxxxx x xxxxxx x xxxxxxxxxxxx xxxxxxxxxxxx xxxxxx xxx xxxxxxxx úrovni xxxxx (XXXXX). Xxxxx je xxx xxxxxxxxx sestupných xxxxxx dávek xxxxxxxxx xxxx- xx xxxxxxxxxxx xxxxxxxx xxxx xxxxxxx x je vhodnější xxxxxx xxxxxxx xxxxxxxxxxxxxx xxxxxxx, xxx použít xxxxx xxxxx xxxxxxxxx (xxxxxxxxxxxx např. faktoru xxxxxxx než 10).
X xxxxx podávaných x xxxxxxx nebo x xxxxx vodě je xxxxxxxx xxxxxxxx, aby xxxxxxxx xxxxxxx zkoušené xxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxx xxxx xxxxx xxxxxxxxx. Xxxxxx-xx xx xxxxxxxx látka x xxxxxxx, může xx xxxxxx xxx xxxxxxxxxx xxxxxxxxxxx (v ppm) xxxx xxxxxxxxxx dávkování xxxxxxxx k xxxxxxx xxxxxxxxx zvířete; xxxxxxx xxxxxxx xxxx být xxxxxxxxxxxxx. Xxxxxxxx-xx xx xxxxx xxxxxx, xxxx xx xx xxx xxxx xxxxx xxx xxxxxxxxx xx xxxxxxx xxxx, x xxxxxxxxx xx mělo xxx xxxxx xxxxxxx xxxxxxxx xxx, xxx xxxx xxxxxxxxxx vzhledem x xxxxxxx xxxxxxxxx xxxxxxx.
Xxxxx xx xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxx xxxxxxxxx xxxxxx k xxxxxxxxxx xxxxxx, xxxx xx být v xxxx xxxxxxxx použita xxxxxx xxxxxxx.
1.4.2.4 Limitní xxxxxxx
Xxxxx xxxxxxx provedená xxxxx xxxxxxx xxxxxxxxx x xxxx xxxxxx xxx xxxxx dávce xxxxxxx 1000 mg xx xx xxxxxxx xxxxxxxxx na xxx xxxx x xxxxxxx xxxxxxxx x xxxxxxx xxxx v pitné xxxx v xxxxxxxxxxxx xxxxxxxxxxx (na xxxxxxx xxxxxxxxx xxxxxxx hmotnosti) xxxxxxxx pozorovatelné toxické xxxxxx x pokud xx na xxxxxxx xxxxx x xxxxxxx x podobnou strukturou xxxxxxxxxxxxx xxxxxxxx, xxxx xxxxx xxxxxx xx xxxxxxx tří úrovní xxxxx xxxxx. Limitní xxxxxxx xx xxxxxxx x výjimkou xxxxxxx, xxx údaje x xxxxxxxx člověka naznačují, xx xx xxxxxxxx xxxxxxx xxxxx úrovně xxxxx.
1.4.2.5 Xxxx pozorování
Doba xxxxxxxxxx xx xxxx xxx 28 xxx. Xxxxxxx x xxxxxxxxx xxxxxxx xxxxxx pro xxxxxxxx xxxxxxxxxx by xxxx být po xxxxxxx nejméně 14 xxx bez xxxxxxxx, xxx xx xxxxxxxx xxxxxxxx xxxxxx, přetrvávání xxxx zotavení z xxxxxxxxx účinků.
1.4.3 Xxxxxx
Xxxxxxxx xxxxx xx podává xxxxxxxx sedm xxx x týdnu xx xxxx 28 xxx. Xxxxx se xxxxx xxxxxx xxx dnů x xxxxx, xxxx xx xxx zdůvodněno. Xxxxx xx zkoušená xxxxx xxxxxx xxxxxx, xxxxxx xx zvířatům x xxxxxx dávce xx použití xxxxxxxxx xxxxx nebo xxxxxx xxxxxxxxx kanyly. Maximální xxxxx xxxxxxxx, xxxxx xxx xxxxx xxxxxxxx, xxxxxx na xxxxxxxxx xxxxxxxxx zvířete. Xxxxx xx neměl překročit 1 xx na 100 g xxxxxxx xxxxxxxxx, s výjimkou xxxxxxx xxxxxxx, kdy xxx xxxxxx 2 xx xx 100 x xxxxxxx xxxxxxxxx. X xxxxxxxx xxxxxxxxxx xxxx žíravých xxxxx, x xxxxxxx xx xx xxxxxxx xxxxxxxxxxxxx xxxxxxxx účinky, xx xxxx xxx rozdíly xx zkušebním xxxxxx xxxxxxxxxxxxxx xxxxxxx koncentrace xxx, aby byl xxx všech xxxxxxxx xxxxx xxxxxxx xxxxxxxxxx xxxxx.
1.4.3.1 Obecná xxxxxxxxxx
Xxxxxxxxx xxxxxxxx pozorování xx xx mělo provádět xxxxxxx xxxxxx xxxxx, xxxxxxx xx xxxxxxx xxxx (xxxxxx doby) x s xxxxxxxx xxxx xxxxxxxxxxx xxxxxx xxxxxx xx podání xxxxx. Xxxxxxxxxxx xx xxxxxxxxx xxxx zvířat. Xxxxxxx dvakrát denně xx xxxxxxx xxxxxxxxx xxxxx xxxxxx xx xxxxxx zjištění xxxxxxxxx x xxxxxxxxx. Xxxxxxx x xxxxxx x xxxxxxx, která se xxxxx xxxx xxxx xxxxxxx, xx ihned xxxxxx, xxxxxxx utratí x xxxxxxx.
Xxxx xxxxxx xxxxxxx látky a xxxx nejméně xxxxxx xxxxx se provede xxxxxxxx klinické xxxxxxxxx xxxxx zvířat (xx xxxxxx xxxxxxxxxxxxxx xxxxxxxxx). Xxxx xxxxxxxxxx xx xx mělo xxxxxxxx xxxx xxxxxxx xxxx xx xxxxxxxxxxx pozorovacím xxxxxxxx a xxxxxxx xxxxxxx xx xxxxxxx xxxx. Xxxxxxxxxx xx xxxx xxx xxxxxxx xxxxxxxxxxxxx, xxxxxxx xx xxxxxxx systému xxxxxxxx xxxxxxxxxx xxxxxxxxxxxx ve xxxxxxxx laboratoři. Xxxx xx xx usilovat x xx, aby xxxx rozdíly ve xxxxxxxxxx xxxxxxxxxx co xxxxxxxx x xxx xxxxxxxxx prováděly xxxxxxx xxxxx, xxxxx nejsou x zařazení xx xxxxxxx xxxxxxxxxxx. Xxxxxxxxx xx xxxx xxxx xxxx xxxxxxxxx xxxxx xxxx, srsti, xxx x xxxxxxx, xxxxxx xxxxxxx x exkretů x xxxxxxxxxxxxx xxxxxx (xxxxxx, xxxxxxx srsti, xxxxxxxx xxxxxx, xxxxxxxx xxxxxxx). Xxxxxxxxxxxx xx xx xxxx xxxxx xxxxx, xxxxxx x xxxxxx xx xxxxxxxxxx, xxxx přítomnost xxxxxxxxxx x xxxxxxxxx xxxxxx, xxxxxxxxxx x chování (xxxx. vytrvalých čistících xxxxxx xxxx xxxxxxxxxxx xxxxxxxx) xxxx xxxxxxxxx xxxxxxx (xxxx. xxxxxxxxxxxxxxx, xxxxxx xxxxxxxx).
Xx xxxxxxx xxxxx xxxxxxxx xxxxx xx xxxxxxxx reakce xx xxxxx xxxxxxxx xxxxxxx (xxxx. sluchové, xxxxxxx, proprioceptivní) x xxxxx xx xxxx xxxxxx x motorické xxxxxxxx. Xxxxx xxxxxxxx xxxxxxxxx o xxxxxxxxx, xxxxx je možno xxxxxx, xxxx xxxxxxx x xxxxxxxxxx (viz xxxxxx xxxx, xxxx X).
Xxxxxxxxxx xxxxxxxxx xxxxxx xx čtvrtém xxxxx xxxxxxxx xxxxx xxx xxxxxxxx xxxxxxxx, xxxxx xx xxxxxx xxxxxxxxx xxxx xxxxxxxxx xxx xxxxxxxxx xxxxxxxxxxxxx (90denní) xxxxxx. X xxxxxxx xxxxxxx xx xxxxxxxxxx xxxxxxxxx poruch zahrnuto xx dlouhodobé xxxxxx. Xxxxxxxxxx údajů x xxxxxxxxxxxx xxxxxxxxx poruchách xx studie xxxxxxxxxxx xxxxxxxx xxxxx xxxx xx druhé straně xxxxxxxx výběr úrovní xxxxx pro xxxxxxxxx xxxxxxxxxxxxx xxxxxx.
Xxxxxxxxxx xxxxxxxxx xxxxxx xxx xxxxxxxxx xxxxxxxx u xxxxxx, xxxxx xxxxxxxx příznaky xxxxxxxx v takové xxxx, xx xx xxxxxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxxx xxxx.
1.4.3.2 Xxxxxxx hmotnost x xxxxxxxx potravy/vody
Všechna xxxxxxx xx xx xxxx xxxxxxx xxxxxx xxxxx xxxxxx. Xxxxxx xxxxxxxx xxxxxxx x vody xx xx mělo xxxxxxxx nejméně xxxxxx xxxxx. Pokud xx xxxxx podává x xxxxx xxxx, xxxx xx se xxxxxxx xxxxxx týdně měřit xxxxxxxx xxxx.
1.4.3.3 Xxxxxxxxxxxxx xxxxxxxxx
Xx konci xxxxxxx xx měla být xxxxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxxx: xxxxxxxxx xxxxxxxxxxx, xxxxxxxxxxx xxxxxxxxxxx, xxxxx xxxxxxxxxx, celkového a xxxxxxxxxxxxxxx počtu xxxxxxxxx, xxxxx trombocytů x xxxxxxx xx protrombinový xxx.
Xxxxxx vzorky xx xx měly odebírat x xxxxxxxx místa xxxxx xxxx usmrcením xxxxxx xxxx x xxxx xxxxxxx a xxxx xx se xxxxxxxxx xx xxxxxxxx xxxxxxxx.
1.4.3.4 Xxxxxxxx xxxxxxxxxxx xxxxxxxxx
Xxxxxxxx xxxxxxxxxxx xxxxxxx xx účelem xxxxxxxxx xxxxxxxx xxxxxxxxx účinků xx tkáně x xxxxxxx na játra x xxxxxxx xx xxxxxxxx na krevních xxxxxxxx odebraných všem xxxxxxxx xxxx utracením xxxx x xxxx xxxxxxx (xxxxx xxxxxx xxxxxxxxxx x xxxxxx x/xxxx xxxxxx xxxxxxxxxx x xxxxxxx xxxxxxx). Xxxx odebráním xxxxxxxx xxxxxx xx xxxxxxxxxx xxxxxxxx xxxxxxx xxxx xxx xxx potravy [1].Xxxxxxxxx xxxxxx x xxxx zahrnuje xxxxxxxxx xxxxxx, xxxxxxxx, glukosy, xxxxxxxxx xxxxxxxxxxxx, močoviny, xxxxxxxxxx, xxxxxxxxx bílkovin x albuminu, nejméně xxxx xxxxxx xxxxxxxxxxxx xxxxxx xx jaterní xxxxx (xxxx xxxxxxxxxxxxxxxxxxxxxx, xxxxxxxxxxxxxxxxxxxxxxxx, alkalická fosfatasa, xxxx xxxxxxxxxxxxxxxxxxxxxx x xxxxxxxxxxxxxxxxxxxxx). Stanovení xxxxxxx xxxxxx (xxxxxxxxx xxxx xxxxxx xxxxxx) a xxxxxxxxx xxxxxxx xxxx xx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxx xx xxxxx x xxxxxxx posledního xxxxx xxxxxx xxxxxxx xxxxxxxxxxx xxxxxxx moči za xxxxxxx časově definovaného xxxxx: vzhled, xxxxx, xxxxxxxxxx nebo xxxxxxxxxx xxxxxxxx, xX, bílkoviny, xxxxxxx x xxxx/xxxxxxx.
Xxxx xx se mělo xxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx x séru. Další xxxxxxxxx xx mělo xxx xxxxxxxxx, xxxxx xxxxx xxxxx xxxxxxxxxx xxxxxxxx xxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxxxx, xxxxxx xxxxxxx, xxxxxxx, xxxxxxxxxxxx xx xxxxx, xxxxxxxxxxxx xxxxxxx, xxxxxxxxxxxxxx x cholinesterasy. Xxxx xxxxxxx xx xxxxx xxxxxxxxxxxxx pro xxxxx xxxxxxxx xxxxxx xxxx xxxxxx xx případu.
Obecně xx xxxxx xxxxxxxxxx xxxxxx x xxxxxxxxxx xx xxxxx x xx pozorovaných x/xxxx xxxxxxxxxxxxxxx xxxxxxxx xxxx xxxxx.
Xxxxx nejsou xxxxx x xxxxxxxxxxx výchozích xxxxxxxxx xxxxxxxxxx, mělo xx se xxxxxx xxxxxxxxx xxxxxxxxxxxxxxx x xxxxxxxxxx biochemických xxxxxxxxx xxxx xxxxxxxx xxxxxxx.
1.4.3.5 Xxxxx
X xxxxx xxxxxxxxx xxxxxx xxxxxxxxxx xx xxxxxx xx xxxx xxx xxxxxxxxx xxxxxxx, xxxxxxxx pitva, zahrnující xxxxxxx zkoumání vnějšího xxxxxxx xxxx, všech xxxxxx x dutiny xxxxxxx, hrudní x xxxxxx x jejich xxxxxx. Játra, xxxxxxx, xxxxxxxxxxx, xxxxxxx, xxxxxxxxxx, xxxxxx, slezina, xxxxx x srdce všech xxxxxx xx xxxx xxx xxxxxxx xxxxx xxxxxxxx xxxxx x xx xxxxxxxx xx xxxxx se xx xxxxxx stavu xxxxx, xxx xxxxxxx x xxxxxxxxx.
Xxxxxxxxxxx tkáně xx xxxx být xxxxxxxxxx x xxxxxxxxxxxxx xxxxxxxx xxxxx s xxxxxxx xx xxx xxxxx x xxxxxxxxx následná xxxxxxxxxxxxxxxx xxxxxxxxx: xxxxxxx xxxxx x xxxxxx, xxxxx (reprezentativní xxxxxxx, xxxxxx xxxxxxxx, mozečku x xxxxx), mícha, xxxxxxx, xxxxx x xxxxxx xxxxxx (xxxxxx Xxxxxxxxxx xxxxx), xxxxx, xxxxxxx, xxxxxxxxxxx, xxxxxxx, xxxxx, xxxxxx, xxxxxx xxxxx, xxxxxxxxxx x xxxxx (xxxxxxxxxxxx naplněním xxxxxxxx roztokem a xxxxxxxxx), gonády x xxxxxxxx xxxxxxxx xxxxxx (xxxx. xxxxxx, xxxxxxxx), xxxxxx xxxxxx, xxxxxxxxxx xxxxxx (xxxxxxxxxx jedna xxx xxxxxx xxxxxxxx x xxxxx vzdálená xxx pokrytí xxxxxxxxxxx xxxxxx), xxxxxxxxx xxxx (x. xxxxxxxxxxx xxxx x. tibialis), xxxxxxx x blízkosti xxxxx, xxx xxxxxx xxxxx (xxxx čerstvý xxxxx x xxxxxx kostní xxxxx). Podle xxxxxxxxxx xxxx xxxxxx nálezů xxxx xxx xxxxxxxx xxxxxxx x další xxxxx. Xxxxxxx xxxxxx xxxxxxxxxx xx xxxxx xxxxxx orgány pro xxxxxxxx xxxxxxxx xxxxx xx měly xxx xxxxxxxx.
1.4.3.6 Xxxxxxxxxxxxxxxx xxxxxxxxx
X xxxxx xxxxxx xxxxxxxxx xxxxxxx a xxxxxxx, xxxxx byla xxxxxx xxxxxx xxxxx, by xxxx být xxxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxx x xxxxx. Xxxx vyšetření xx xxxx xxx xxxxxxxxx na xxxxxxx xxxxx ostatních xxxxxxxxx xxxxxx, pokud xxxx x skupiny x xxxxxxx xxxxxx pozorovány xxxxx xxxxxx xxxxxxxx xxxxxxxxx dávkou.
Všechny makroskopické xxxx xx xxxx xxx xxxxxxxx.
X případě xxxxxxx xxxxxxxxx xxxxxxx xx xxxx být xxxxxxxxx xxxxxxxxxxxxxxxx xxxxxxxxx xxxxx a xxxxxx, xx kterých xxxx xxxxxxxxxx xxxxxx x xxxxxxxxxxxx skupin.
2. XXXXX
Xxxx xx xxx xxxxxxx xxxxx pro xxxxx xxxxxxxxxx xxxxx. Navíc xx xxxx být xxxxxxx xxxxx shrnuty xx xxxxxxx, xxxxxxx xx uvede x xxxxx xxxxxxxxxxxxxx skupiny xxxxx xxxxxx xx xxxxxxx xxxxxxx, xxxxx xxxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxx zkoušky xxxx xxxxxxxxxx x xxxxxxxxx xxxxxx x xxxx xxxxx nebo xxxxxxxxx utracení, xxxxx xxxxxx xxxxxxxxxxxx příznaky xxxxxxxx, xxxxx xxxxxxxxx xxxxxxxx, včetně xxxx xxxxxxx, trvání a xxxxxxxxxx xxxxxxx toxického xxxxxx, xxxxx xxxxxx xxxxxxxxxxxx xxxx, xxx xxxx a xxxxxxxx xxxxxx xxxxxxxxxxxx xxxxx xxx léze.
Číselné xxxxxxxx xx měly být xxxxx možno xxxxxxxxxxx xxxxxxx a obecně xxxxxxxxx xxxxxxxxxxxx metodou. Xxxxxxxxxxx xxxxxx xx xxxx xxx xxxxxxx xxx xxx plánování xxxxxx.
3. XXXXXX
Xxxxxxxx o xxxxxxx
Xxxxxxxx x xxxxxxx xx xxxxx xxxxx xxxxxxxxx tyto informace:
Pokusná xxxxxxx:
- xxxxxxx xxxx/xxxx;
- xxxxx, stáří x xxxxxxx xxxxxx;
- původ, xxxxxxxx xxxxx, xxxxxx xxx.;
- xxxxxxxx xxxxxxxxxxxx xxxxxx xx začátku xxxxxxx, xxxx v xxxxxxxxx xxxxxxxxxxx x xx xxxxx xxxxxxx.
Xxxxxxxx xxxxxxxx:
- xxxxxxxxxx volby xxxxxxxx, xxxx-xx xxxxxxx xxxx;
- xxxxxxxxxx xxxxxx xxxxxx xxxxx;
- podrobné xxxxx x složení xxxxx xxxx xxxxxx xxxxxxx, x xxxxxxxx xxxxxxxxxxx, xxxxxxxx x xxxxxxxxxx přípravku;
- podrobné xxxxx o xxxxxxx xxxxxx xxxxxxxx látky;
- xxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxx látky v xxxxxxx/xxxxx xxxx (xxx) xx xxxxxxxxx denní xxxxx (mg xx xx tělesné xxxxxxxxx);
- xxxxxxxx údaje x xxxxxx x kvalitě xxxx.
Xxxxxxxx:
- tělesná hmotnost/změny xxxxxxx xxxxxxxxx;
- xxxxxxxx xxxxxxx x xxxxxxxxx xxxxxxxx vody;
- xxxxx x xxxxxxxxx reakcích xxxxx xxxxxxx x xxxxxx dávky, xxxxxx xxxxxxxx xxxxxxxx;
- charakter, xxxxxxxxx a trvání xxxxxxxxxx projevů (xxx xxxx xxxxxx xxxx xxxxxxxx);
- posouzení xxxxxxxxxx xx xxxxxxxx podněty, xxxxxxxx síly x xxxxxxxxx xxxxxxxx;
- xxxxxxxxxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxx xxxxxxxxx (xxxxxxx);
- xxxxxxxx biochemická vyšetření x xxxxxxxxxxx xxxxxxxxx xxxxxxxxx;
- tělesná xxxxxxxx xxx xxxxxxxx x xxxxx x hmotnosti xxxxxx;
- xxxxxxx xxxxxx;
- xxxxxxxx xxxxx xxxxx xxxxxxxxxxxxxxxxxx xxxxxx;
- xxxxx x xxxxxxxx, xxxxx xxxx xxxxxxxx;
- xxxxxxxxx xxxxxxxxxxx zpracování xxxxxxxx.
Xxxxxx xxxxxxxx.
Xxxxxx.
4. LITERATURA
Metoda je xxxxxxxxxx xxxxxx OECD XX 407."
[1] Vyšetření xx lačno je xxxxxxx xxx xxxx xxxxxx x xxxx x plazmě, xxxxxxx xxx xxxxxx xxxxxxx. Xxxxxxx xxxxxxx xxx xxxx doporučení je xx, xx u xxxxxxxxxxxxxxx zvířat je xxxxx variabilita xxxxxxxx, xxxxx by xxxxx xxxxxxxx méně xxxxxxx xxxxx a ztížit xxxxxxxxxxxx. Xx druhé xxxxxx by xxxxxxxxx xxxx noc xxxxx xxx xxxx na xxxxxxx xxxxxxxxxxxx x xxx podávání x xxxxxxx xx xxxxxxx xx xxxxxxxxxxxxx expozice xxxxxxxx xxxxx. Xxxxx xx xxxxxxx xxxx xx lačno, je xxxxx provést biochemické xxxxxxxxx xx xx xxxxxxxxxx xxxxxxxxx xxxxxx xx 4. xxxxx xxxxxxx.
XXXXXXX IV E
" X.37 POZDNÍ XXXXXXXXXXXXX XXXXXXXXXXX XXXXXXXXX XXXXXXX XX XXXXXX EXPOZICI
1. XXXXXX
1.1 Xxxx
Xxx xxxxxxxxx x xxxxxxxxx toxických xxxxxx látek xx xxxxxxxx vzít x xxxxx xxxxxxxxx xxxxxxxx xxxxxx xxxxx xxxxxxx xxxxxxxxxx typy xxxxxxxxxxxxx, xxxxx xxxxxxx xxx xxxxxxxx xxxxxx xxxxxxxx xxxxxxxx. X xxxxxxxx xxxxxxxxxxx sloučenin xxxxxxx xxxx xxxxxxxxxx xxxxxx xxxxxxxxxxxxx; xxxx xxxxx xxxx xxx podrobeny xxxxxxxx xxxxx xxxxxxx.
Xxxxxxxxxxxx xxxxxxx xx vitro xxx xxxxxx xxx xxxxxxxxx xxxxx, které xxxxx xxxxxxx xxxxxx xxxxxxxxxxxxxx; xxxxxxxxx xxxxx xx xxxxxxx xx xxxxx však xxxxxxxxxxx xxxxx, xx xxxxx xxxx xxxxxxxxx vyvolat xxxxxx xxxxxxxxxxxxx.
Xxx xxxxxx xxxx, část X.
1.2 Xxxxxxxx
Xxxx "organické sloučeniny xxxxxxx" xxxxx neutrální xxxxxxxxx estery, xxxxxxxxxx xxxx anhydridy xxxxxxxx xxxxxxxxxx, xxxxxxxxx nebo xxxxxxxxxxxxxxx xxxx xxxxxxxxxxx xxxxxxx xxxxxxxxxxxxxxxx, xxxxxxxxxxxxxxx xxxx xxxxxxxxxxxxxxxxxxxxx, xxxx xxxx xxxxx, které xxxxx xxxxxxxx pozdní xxxxxxxxxxxxx xxxxxxxxxxx x xxxxxxxxx xxxxx této xxxxxxx.
Xxxxxx xxxxxxxxxxxxx xx xxxxxxx xxxxxxxxxxx xx xxxxxxx xxxxxxxx ataxie, xxxxxxxx xxxxxxxxxx x xxxx x xxxxxxxxxx xxxxx x dále xxxxxxxx a xxxxxxxxx xxxxxxxxxx xxxxxxxx – XXX (xxxxxxxxxx xxxxxx xxxxxxxx) x xxxxxxx xxxxx.
1.3 Referenční látky
Referenční xxxxx xxxx být xxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxx s xxxxx xxxxxxxx, xx xx x laboratorních xxxxxxxxxx xxxxxx xxxxxxxxx xxxxx podstatně xxxxxxxxx.
Xxxxxxxxx xxxxxx xxxxxxxxx xxxxx x xxxxxxx toxickým xxxxxxx je tri-o-tolyl-fosfát (XXX 78308, XXXXXX 2011035, xxxxx podle XXX: xxxx(2xxxxxxxxxxx)xxxxxx), xxxxx xxxx pod názvem xxxxxxxxxxxxxxxx (TOCP).
1.4 Xxxxxxxx xxxxxxxx xxxxxx
Xxxxxxxx xxxxx xx xxxxxx orálně x jediné dávce xxxxxxxx xxxxxxx, xxxxxxxxx xxxx možnými xxxxxxxx xxxxxxxxxxxxx xxxxxx. Xxxxxxx xx xxxxxxxx xx xxxx 21 xxx, xxxxxxxxxxx xx xxxxxxxxxx xxxxxxx, ataxie x xxxxxx. Xxxxxxxxxxx vyšetření, xxxxxxx xxxxxxxx XXX (xxxxxxxxx xxxxxx xxxxxxxx), xx xxxxxxxxx u xxxxxx náhodně xxxxxxxxx x xxxxx xxxxxxx, xxxxxxx 24 x 48 x xx xxxxxx xxxxx. Xxxxxx xxxxx xxx po xxxxxx látky xx xxxxxxxxx xxxxxxx xxxxxx x provede xx xxxxxxxxxxxxxxxx vyšetření xxxxxxxxx xxxxxxxxx xxxxx.
1.5 Xxxxx xxxxxxxx xxxxxx
1.5.1 Xxxxxxxx
Xxxxxxx xx xxxxxxx xxxxx xxxxxxx xxxxxxxx dospělých xxxxxx, xxxxx nejsou xxxxxxxxx virovými xxxxxxxxxxxx x xxxxxxxxxxxxxxx xxxxxx x mají normální xxxxx, xxxxxxx xx xx xxxxxxxxxxxxxx x xxxxxxxxx skupiny x xxxxxxx 5 dnů xxxx xxxxxxxxx xxxxxx xx aklimatizují xx xxxxxxxxxxx xxxxxxxx.
Xxxxxxxxx se xxxxxxxxxx xxxxx xxxxx xxxx xxxxxx xxxxxxxxxx xxxxx xxxxx slepic x xxxxxx xxxxxxxxxx xxxxx.
Xxxxxxxx látka se xxxxxxx xxxxxx xxxxxx xxxxxx, xxxxxxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxxx metodou. Xxxxxxxx xx xxxxxxxx xxxxxxxx xxxx rozpuštěné xx xxxxxxx xxxxxxxx, xxxx je xxxx. xxxxxxxxx olej, xxxxx xxxxx xx se xxxx xxxxxx xxxxxxxxx, xxxxxxx velké xxxxx xxxxxxx látek x xxxxxxxxxxxx tobolkách xx xx nemusely dostatečně xxxxxxxx. Xxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx xx xxxx xxx xxxxx xxxx xxxxxxxx, x xxxxx xxxxxx xxxxx, xxxx xx být xxxxxx určeny.
1.5.2 Zkušební xxxxxxxx
1.5.2.1 Pokusná zvířata
Doporučuje xx xxxxx xxxxxxx xxxx domácího (Xxxxxx xxxxxx xxxxxxxxxx), stará 8 – 12 xxxxxx. Používají xx xxxxxxx x xxxxxxxxxx xxxxxxxxx a xxxxxxx xx xxxx xxx xxxxxxx za xxxxxxxx xxxxxxxxxxxx xxxxx xxxxx.
1.5.2.2 Xxxxx x xxxxxxx
Xxxxx xxxxxxxxxxxxxx xxxxxxx xx xxxx xxx xxxxxxx xxxxxxxxx xxxxxxx x xxxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxx. X xxxxxxxx podání xxxxxxxx xxxxx se s xxxxxxxxx xxxxxxxx xxxxxxx xxxxxx xxxx x xxxxxxxxxxxxxx skupinou.
V xxxxx xxxxxxx xx xxx xxx xxxxxx dostatečný xxxxx xxxxxx, aby xxxxx šest xxxxxx xxxxx xxx xxxxxxxx xxx biochemické vyšetření (xxx x první x xxx x xxxxx xxx xx xxxxxx) x xxxx xxxxxxx 21denní xxxxxxxxxx xxxxxxxxxxxxx příznaků.
Pozitivní xxxxxxxxx xxxxxxx xxxx xxx xxxxxxxx souběžně xxxx xxxxx xxx xxxxxxx xxxxx x nedávno xxxxxxx xxxxxxxxx xxxxxxx. Xxxx xx xxxxxxxxx xxxxxxx šest xxxxxx, xxxxxx se xxxx xxxxx, o níž xx xxxxx, xx xxxxxxxx xxxxxx xxxxxxxxxxxxx, xxx xxxxxxx pro xxxxxxxxxxx xxxxxxxxx a xxx xxxxxxx xxx xxxxxxxxxxxxxxxx vyšetření. Doporučuje xx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx údaje. Xxxx xxxxxxxxx xxxxxxxxx údaje xx měly být xxxxxxxx, pokud xxxxxxxxxxx xxxxxxxxx x xxxxxxx xxxxx xxxxx xxxxxxx xxxxxxxx prvek xxxxxxx (xxxx. xxxxxxx, xxxxxx, xxxxxxxx chovu).
1.5.2.3 Xxxxxx xxxxx
Xxxx by se xxxxxxx xxxxxxxxx studie xx použití xxxxxxxx xxxxx xxxxxx a xxxxxx s různými xxxxxxxx dávek, xxx xxxx xxxxx xxxxxxxx xxxxxx, xxxxx xx xxx xxxxxxx x xxxxxx xxxxxx. Xxx xxxxxxxxx přiměřené xxxxx x xxxxxx xxxxxx xx v této xxxxxxxxx studii xxxxxxxx xxxxxx letalita. Xxx xx xxxx xxxxxxxxx xxxxx vlivem akutních xxxxxxxxxxxxx účinků, lze xxxxxx xxxxxxx xxxx xxxx ochranný xxxxxxxxx, x xxxxxx xx xxxxx, xx xxxx xxxx na xxxxxx xxxxxxxxxxxx xxxxxx. Xxx xxxxx xxxxxxxx xxxxxxxxx xxxxx zkoušených xxxxx xxx xxxxxx xxxx xxxxx (xxx metoda X.1 a)). Xxx xxxxxx xxxxx mohou xxx xxxxxxxx xxxx xxxxxxxxx xxxxx x xxxxxxxxx xxxx xxxx xxxxxxxxxxxxx xxxxxxxxx.
Xxxxxx dávky xxxxxxxx xxxxx x xxxxxx xxxxxx xx xxxx být co xxxxxxxx, xxxxxxx xx xxxxx x xxxxx xxxxxxxx předběžné studie xxxxxx xxxxx x xxxxx limit xxxxx 2000 xx na xx xxxxxxx xxxxxxxxx. Xxxxxxxx úhyn xx xxxxx xxxxxxx xxxxxxxxxx xxxxx zvířat xxx xxxxxxxxxxx xxxxxxxxx (xxxx) x xxx histologická xxxxxxxxx (šest) xx 21 xxxxx. Xxx xx xxxxxxxxx úmrtí xxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxx, xxxxxxx se xxxxxxx xxxx xxxx xxxxxxxx xxxxxxxxx, x xxxxxx xx xxxxx, xx xxxx vliv xx xxxxxx neurotoxické xxxxxx.
1.5.2.4 Xxxxxxx zkouška
Pokud xxxxxxx xxxxxxxxx xxxxx xxxxxxx xxxxxxxxx x xxxx studii xxx xxxxx dávce xxxxxxx 2000 mg na xx xxxxxxx xxxxxxxxx xx xxx xxxxxxxx xxxxxxxxxxxxx xxxxxxx účinky x xxxxx xx xx základě xxxxx x xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx, xxxx xxxxx xxxxxx xx použití xxxxx xxxxx nezbytná. Xxxxxxx xxxxxxx xx xxxxxxx x xxxxxxxx xxxxxxx, xxx xxxxx x expozici xxxxxxx xxxxxxxxx, xx xx xxxxxxxx xxxxxxx vyšší xxxxxx dávek.
1.5.2.5 Xxxx xxxxxxxxxx
Xxxx pozorování by xxxx být 21 xxx.
1.5.3 Xxxxxx
Xx xxxxxx xxxxxxxxx chránícího xxxx xxxxxxxx xx následky xxxxxxxx xxxxxxxxxxxxx xxxxxx xx podá xxxxxxxx xxxxx v xxxxx xxxxx.
1.5.3.1 Xxxxxx xxxxxxxxxx
Xxxxxxxxxx xx xxxx začít xxxxxxxx xx podání. Xxxxxxx slepice se xxxxxxx xxxxxxxxxx xxxxx xxxxxxxx x průběhu xxxxxxx dvou xxx x xxxx nejméně xxxxxx xxxxx xx xxxx 21 xxx xxxx xx plánovaného xxxxxxxx. Xxxxxxx xxxxxxxx xxxxxxxx by měly xxx xxxxxxxxxxx, včetně xxxx nástupu, xxxx, xxxxxxxxxx x xxxxxx xxxxxxxxxxxx chování. Xxxxxx xx xxxx být xxxxxxxxx xxxxx xxxxxxx xxxxxxxxxxxx xxxxxxxx stupnice x xxxxxxxxxxx xx xxxxxx. Xxxxxxx xxxxxxx xxxxx xx slepice xxxxxx x xxxxxxxxxxxxx xxxxxxxx vyjmou x xxxxx x xxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxxxxxx, jako xxxx. xxxxxxxx xx žebříku, xxx se xxxxxxxxx xxxxxxxxx xxxxxxxxxxx toxických xxxxxx. Xxxxxxx x xxxxxx a xxxxxxx, xxxxx xx trápí xxxx xxxx xxxxxxx, xx xxxxx xxxxxx, xxxxxxx xxxxxx a xxxxxxx.
1.5.3.2 Tělesná xxxxxxxx
Xxxxxxx xxxxxxx xx xxxxx xxxxx xxxx xxxxxxx xxxxxxxx látky a xxxx xxxxxxx xxxxxx xxxxx.
1.5.3.3 Xxxxxxxxxxx xxxxxxxxx
Xxxx xxxxxx náhodně xxxxxxxxx x xxxxx xxxxxxxxxxxxxx xxxxxxx x xxxxxxxxx xxxxxxx x xxxxxxxxx x xxx xxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxx (pokud xx xxxxxxx souběžně xxxxxxx x xxxxx xxxxxxxx) xx xxxxxx x xxxxxxx dnech xx xxxxxx xxxxx, xxxxx x xxxxxxxx mícha xx xxxxxxxxxxx x xxxxxxx xx xx xxxxxxxx XXX. Dále xxxx xxx xxxxxx xxxxxx xxxxxxxxxxxx x. xxxxxxxxxxx x xxxxxxxxxx xxxx xxxx xx xxxxxxxx xxxxxxxx XXX. Xxxxxxxxx xx xxxxxx xxx xxxxxxx x xxxxxxxxx xxxxxxx x x xxxxx xxxxxxxxxxxxxx xxxxxxx po 24 x x xxxxx xxx po 48 x, xxxxxxx xxx xxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxx se xxxxxx xx 24 x. Xxxxx xxxxxxxxxx xxxxxxxxxx příznaků toxicity xxxxxxxxx, xx xx xxxxxxx xxxxx v xxxxxxxxx xxxxxxxxx xxxxx xxxxxx (xx lze xxxxx xxxxxxxx xxxxxxxxxxx xxxx nástupu cholinergních xxxxxxxx), xxxx xxx xxxxxxxxx odebrat xxxxxx xxxxx xxxxxxx ze xxx xxxxxx xxxx 24 xx 72 x po xxxxxx xxxxx.
Xx xxxxxx xxxxxxxx xxxxx mohou xxx xxxxxxxxx také xxxxxxx xxxxxxxxxxxxxxxxxxxx (XXxX), xx-xx xx xxxxxxxxxx xx xxxxxx. Xx xxxx xxxx xxxx nastat xxxxxxxxx xxxxxxxxxx XXxX, xxx xxxx xxxx x xxxxxxxxx xxxxx xxxx xxxxxxxxxx XXxX.
1.5.3.4 Xxxxx
Xxxxx xxxxx zvířat (xxxxxxxxxx xxxxx plánu x xxxxxxxxxx x xxxxxx) by xxxx xxxxxxxxx xxxxxxxxx xxxxx xxxxx a xxxxx.
1.5.3.5 Xxxxxxxxxxxxxxxx vyšetření
Nervová xxxx xxxxxx, která přežila xxxx xxxxxxxxxx x xxxxxx xxxxxxx pro xxxxxxxxxxx xxxxxx, xx xxxx být xxxxxxxxxxxxx xxxxxxxxx. Xxxxx xx xxxx být fixovány xx situ xx xxxxxxx perfúzních xxxxxxx. Xxxxxxx se xxxxxxx (xxxxxxx xxxxxxx řez), xxxxxxxxxxx mícha, xxxxx x xxxxxxxxx xxxxx. Xxxx xxxxx xx xxxx xxx xxxxxxxx x xxxxx xxxxx xxxxx, střední hrudní x xxxxxxxxxxxxx xxxxxxx. Xxxx by xxx xxxxxxxx xxxx xxxxxxxx xxxxx n. tibialis x jeho větví x x. xxxxxxxxxxxxx x x x. xxxxxxxxxxx. Xxxx se xxxxx xxxxxxxx xxxxxxx xx myelin x xxxxx.
2. XXXXX
Xxxxxxxxx xxxxxxxx xxxxxxx xxx xxxxxxxx xxxxxx zvolené v xxxx xxxxxx (xxxxxxxxxxx x xxxxxxxxxxxxxxxx xxxxxxxxx x xxxxxxxxx změn xxxxxxx) xxxxxxxxxx xxxxxxxxx xxxxx xxxxxxxx pozdní xxxxxxxxxxxxx. Xxx dvojznačných xxxx neprůkazných xxxxxxxxxx xxxxxx xxxxxxxxx xxxx xxx nezbytné xxxxx xxxxxxxxx.
Xxxx xx xxx xxxxxxx xxxxx xxx xxxxx jednotlivé zvíře. Xxxxx by xxxx xxx xxxxxxx xxxxx xxxxxxx xx tabulky, xxxxxxx se xxxxx x xxxxx xxxxxxxxxxxxxx xxxxxxx xxxxx xxxxxx xx xxxxxxx xxxxxxx, xxxxx zvířat xxxxxxxxxxxx xxxx, xxxxxx na xxxxxxx xxxx xxxxxxxxxxx xxxxxx, typ x xxxxxxxxx těchto xxxx xxxx xxxxxx x xxxxxxxx xxxxxx xxxxxxxxxx xxxxx xxx x xxxxxxxxx léze xxxx xxxxxx.
Xxxxx x této xxxxxx xx xxxx xxx xxxxxxxxxxx x xxxxxxxx výskytu, xxxxxxxxxx x xxxxxxxx xxxxxx xx chování x xxxxxxxxxxxxx a xxxxxxxxxxxxxxxxxx xxxxxx a dále xxxxxxxxxx dalších xxxxxxxxxxxx xxxxxx xx xxxxxxxxxxxxxx x xxxxxxxxx xxxxxxx.
Xxxxxxx xxxxxxxx xx xxxx xxx xxxxx xxxxx xxxxxxxxxxx xxxxxxx x xxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxx. Xxxxxxxxxxx xxxxxx xx xxxx xxx xxxxxxx již xxx xxxxxxxxx xxxxxx.
3. ZPRÁVY
Protokol x xxxxxxx
Xxxxxxxx x xxxxxxx má xxxxx xxxxx xxxxxxxxx tyto xxxxxxxxx:
Xxxxxxx xxxxxxx
- xxxxxxx xxxxxxx;
- xxxxx a xxxxx xxxxxx;
- původ, xxxxxxxx xxxxx xxx.;
- xxxxxxxx xxxxxxxxxxxx xxxxxx xx xxxxxxx xxxxxxx.
Xxxxxxxx xxxxxxxx:
- podrobné xxxxx x xxxxxxxx xxxxxxxx xxxxx, xxxxxxxxx x xxxx stálosti a xxxxxxxxxx;
- xxxxxxxxxx xxxxx xxxxxxxx;
- xxxxxxxx údaje x způsobu xxxxxx xxxxxxxx xxxxx;
- xxxxxxxx xxxxx o stravě x x kvalitě xxxx;
- xxxxxxxxxx výběru xxxxxx xxxxx;
- xxxxxxxxxxx xxxxxxxxxx xxxxx, xxxxxx xxxxxxxxxx informací x xxxxxxxx, xxxxxx a xxxxxxxxx formě podané xxxxx;
- xxxxxxxxxxxx jakéhokoli xxxxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxx x xxxx xxxxxx.
Xxxxxxxx:
- xxxxx x tělesné xxxxxxxxx;
- xxxxx x xxxxxxxxx xxxxxxxx podle xxxxxx, xxxxxx mortality;
- xxxxxxxxx, xxxxxxxxx x trvání xxxxxxxxxx xxxxxxx (xxx xxxx xxxxxx xxxx xxxxxxxx);
- xxxxxxxx popis xxxxxxxxxxxxx xxxxxxxxx x xxxxxx;
- xxxxxxx nálezy;
- xxxxxxxx xxxxx xxxxx xxxxxxxxxxxxxxxxxx nálezů;
- popřípadě xxxxxxxxxxx vyhodnocení výsledků.
Rozbor xxxxxxxx.
Xxxxxx.
4. XXXXXXXXXX
Xxxxxx xx xxxxxxxxxx xxxxxx OECD XX 418.
X.38 XXXXXX XXXXXXXXXXXXX ORGANICKÝCH XXXXXXXXX XXXXXXX – 28XXXXX XXXXXXXXX XXXXXXXX
1. XXXXXX
1.1 Xxxx
Xxx xxxxxxxxx a xxxxxxxxx toxických xxxxxx xxxxx xx xxxxxxxx xxxx x úvahu xxxxxxxxx xxxxxxxx xxxxxx xxxxx xxxxxxx xxxxxxxxxx xxxx neurotoxicity, xxxxx xxxxxxx xxx xxxxxxxx xxxxxx studiemi xxxxxxxx. X xxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxx xxxx xxxxxxxxxx xxxxxx xxxxxxxxxxxxx; xxxx xxxxx mají xxx xxxxxxxxx zkoumání xxxxx metodou.
Screeningové xxxxxxx xx xxxxx lze xxxxxx pro xxxxxxxxx xxxxx, xxxxx xxxxx xxxxxxx pozdní xxxxxxxxxxxxxx; xxxxxxxxx nález xx xxxxxxx in vitro xxxx neposkytuje xxxxx, xx látka xxxx xxxxxxxxx xxxxxxx pozdní xxxxxxxxxxxxx.
28xxxxx xxxxxxx pozdní xxxxxxxxxxxxx poskytuje xxxxxxxxx x xxxxxx xxxxxxxxx xxx xxxxxx, xxxxx xx xx xxxxx xxxxxxxx z opakovaných xxxxxxx během omezeného xxxxxxxx xxxxxx. Poskytne xxxxxxxxx x xxxxxx xx xxxxx x xxxx poskytnout odhad xxxxxx bez xxxxxxxxxxxxxxx xxxxxxxxxxxx xxxxxx, xxx xxxx být xxxxxxxx xxx xxxxxxxxx xxxxxxxx xxx bezpečnou xxxxxxxx xxxxxxx.
Xxx také xxxxxx xxxx, xxxx X.
1.2 Xxxxxxxx
Xxxx "xxxxxxxxx xxxxxxxxxx xxxxxxx" xxxxx xxxxxxxxx xxxxxxxxx xxxxxx, xxxxxxxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxxx, xxxxxxxxx xxxx xxxxxxxxxxxxxxx xxxx xxxxxxxxxxx xxxxxxx thiofosforečných, xxxxxxxxxxxxxxx xxxx xxxxxxxxxxxxxxxxxxxxx, xxxx xxxx látky, xxxxx xxxxx xxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxxxx u xxxxxxxxx látek této xxxxxxx.
Xxxxxx xxxxxxxxxxxxx xx xxxxxxx xxxxxxxxxxx xx xxxxxxx xxxxxxxx xxxxxx, xxxxxxxx axonopatií x xxxx x periferním xxxxx a xxxx x xxxxxxxx x xxxxxxxxx specifické xxxxxxxx - XXX (xxxxxxxxxx xxxxxx esterase) x xxxxxxx xxxxx.
1.3 Podstata xxxxxxxx xxxxxx
Xxxxxxxx xxxxx xx xxxxxxxx xxxxx xxxxxx slepicím xxxxxxx xx dobu 28 xxx. Xxxxxxx xx xxxxxxxx xxxxxxx xxxxxx xxxxx, xxxxxxxxxxx xx xxxxxxxxxx chování, xxxxxx x paréza xxxxx 14 xxx xx xxxxxxxx xxxxx. Biochemická xxxxxxxxx, xxxxxxx xxxxxxxx XXX (neropathy xxxxxx xxxxxxxx), xx xxxxxxx x xxxxxx xxxxxxx xxxxxxxxx z xxxxx xxxxxxx, xxxxxxx 24 x 48 x xx xxxxxx xxxxx. Xxx xxxxx xx xxxxxxxx xxxxx se xxxxxxxxx slepice xxxxxx x xxxxxxx xx xxxxxxxxxxxxxxxx vyšetření xxxxxxxxx xxxxxxxxx xxxxx.
1.4 Popis xxxxxxxx xxxxxx
1.4.1 Příprava
Provede xx xxxxxxx xxxxx xxxxxxx zdravých xxxxxxxxx xxxxxx, xxxxx xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxxx x farmakologickou xxxxxx x mají xxxxxxxx xxxxx, xxxxxxx xx xx xxxxxxxxxxxxxxxx x xxxxxxxxxxx xxxxxx x xxxxxxx 5 dnů xxxx zahájením studie xx xxxxxxxxxxxx xx xxxxxxxxxxx xxxxxxxx.
Xxxxxxxxx xx xxxxxxxxxx xxxxx klece xxxx xxxxxx umožňující xxxxx xxxxx xxxxxx x xxxxxx pozorování xxxxx.
Xxxxxxxx xxxxx xx xxxxxx xxxxx xxx, 7 xxx x xxxxx, nejlépe xxxxxx xxxxxx nebo xxxxxxxxxxxx xxxxxxxxx. Xxxxxxxx xx xxxxxxxx neředěné xxxx xxxxxxxxxx ve vhodném xxxxxxxx, xxxx je xxxx. xxxxxxxxx xxxx, xxxxx látky xx xx xxxx nechat xxxxxxxxx, xxxxxxx xxxxx xxxxx xxxxxxx látek x želatinových tobolkách xx xx nemusely xxxxxxxxxx vstřebat. Toxické xxxxxxxxxx nevodných vehikul xx měly být xxxxx xxxx xxxxxxxx, x pokud xxxxxx xxxxx, xxxx by xxx xxxxxx xxxxxx.
1.4.2 Xxxxxxxx xxxxxxxx
1.4.2.1 Xxxxxxx xxxxxxx
Xxxxxxxxxx xx xxxxx xxxxxxx xxxx domácího (Xxxxxx xxxxxx xxxxxxxxxx), xxxxx 8 – 12 xxxxxx. Xxxxxxxxx xx plemena x xxxxxxxxxx xxxxxxxxx x xxxxxxx by měly xxx xxxxxxx xx xxxxxxxx xxxxxxxxxxxx volný xxxxx.
1.4.2.2 Xxxxx a xxxxxxx
Xxxxxx xx měly xxx xxxxxxx xxxxxxx xxx xxxxxxxxxxxxxx xxxxxxx x xxxxxxxxx skupina x xxxxxxxxx. S xxxxxxxx xxxxxx zkoušené xxxxx se s xxxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxx xxxxxx xxxx x experimentální xxxxxxxx.
X každé xxxxxxx xx xxx xxx xxxxxx xxxxxxxxxx xxxxx xxxxxx, xxx xxxxx xxxx xxxxxx xxxxx xxx usmrceno xxx xxxxxxxxxxx vyšetření (xxx x xxxxx x xxx x xxxxx xxx xx podání) x xxxx přežilo 14xxxxx xxxxxxxxxx patologických xxxxxxxx.
1.4.2.3 Xxxxxx xxxxx
Xxx xxxxxx úrovní xxxxx xx xxxx xxx xxxxx v xxxxx xxx xxxxxxxx xxxxxx xxxxxxx xxxxxx xxxxxxxxxxxxx x xxxxxxxx další xxxxxxxx xxxxx o xxxxxxxx x xxxxxxxx xxxxxxxx xxxxxxxxxx. Nejvyšší xxxxxx dávky by xxxx xxx vybrána x cílem xxxxxxx xxxxxxx xxxxxx, xxxxxxx xxxxxx xxxxxxxxxxxxx, xx xxxx xxxxxxx nebo xxxxxx utrpení. Xxxx xx xxxx být xxxxxxx xxxxxxxx xxxx xxxxx x xxxxx xxxxxxxx, xx xxxxxxxx xxxxxxxxx účinku na xxxxx x xx xxxxxxxx xxxxx xxxxxxxxxx xxxxx projevy xxxxxxxx.
1.4.2.4 Xxxxxxx xxxxxxx
Xxxxx xxxxxxx xxxxxxxxx podle xxxxxxx xxxxxxxxx v xxxx xxxxxx při xxxxx xxxxx xxxxxxx 1000 xx xx xx xxxxxxx hmotnosti x xxx nevyvolá xxxxxxxxxxxxx xxxxxxx xxxxxx x xxxxx xx na xxxxxxx xxxxx x xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx, xxxx úplná xxxxxx xx xxxxxxx xxxxx xxxxx nezbytná. Limitní xxxxxxx xx provádí x výjimkou xxxxxxx, xxx xxxxx o xxxxxxxx xxxxxxx naznačují, xx xx xxxxxxxx xxxxxxx xxxxx xxxxxx xxxxx.
1.4.2.5 Xxxx xxxxxxxxxx
Xxxxxxx xxxxxxx xx měla xxx xxxxxxxxxx xxxxxxx xxxxxx denně po xxxx xxxxxxxx x 14 xxx xx xx, xx xx xxxxxxxxx xxxxx podle xxxxx.
1.4.3 Postup
Zvířatům se xxxxxx xxxxxxxx xxxxx xxxx dnů x xxxxx po dobu 28 xxx.
1.4.3.1 Xxxxxx xxxxxxxxxx
Xxxxxxxxxx xx xxxx xxxxx okamžitě xx xxxxxx. Všechny xxxxxxx xx xxxxxxx xxxxxxxx xxxxxx xxxxx xxxxx xxx x 28 xxx xxxxxxxx x 14 dnů xx xxxxxxxx xxxx xx xxxxxxxxxxx xxxxxxxx. Xxxxxxx xxxxxxxx xxxxxxxx by xxxx být zaznamenány, xxxxxx xxxx nástupu, xxxx, xxxxxxxxxx x xxxxxx. Pozorování xx xxxxxxxxx xxxxxxxxxxx xxxxxxx, xxx xxxx xx xx xx xxxxxxxx. Xxxxxx xx xxxx xxx hodnocena podle xxxxxxx čtyřstupňové xxxxxxxx xxxxxxxx a xxxxxxxxxxx xx xxxxxx. Xxxxxxx xxxxxxx xxxxx xx xxxxxxx x xxxxxxxxxxxxx xxxxxxxx xxxxxx x xxxxx a xxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxxxxxx, jako xxxx. xxxxxxxx po xxxxxxx, xxx xx usnadnilo xxxxxxxxx xxxxxxxxxxx toxických xxxxxx. Xxxxxxx x xxxxxx x xxxxxxx, xxxxx xx xxxxx xxxx xxxx xxxxxxx, xx xxxxx vyřadí, xxxxxxx utratí x xxxxxxx.
1.4.3.2 Xxxxxxx xxxxxxxx
Xxxxxxx xxxxxxx xx xxxxx xxxxx xxxx xxxxxx xxxxxxx xxxxxxxx látky x xxxx xxxxxxx xxxxxx týdně.
1.4.3.3 Xxxxxxxxxxx xxxxxxxxx
Xxxx slepic xxxxxxx xxxxxxxxx z xxxxx xxxxxxxxxxxxxx xxxxxxx x xxxxxxxxx xxxxxxx x xxxxxxxxx x xxx xxxxxxx x pozitivní xxxxxxxxx xxxxxxx xx xxxxxx x xxxxxxx xxxxx xx podání xxxxxxxx dávky, mozek x xxxxxxxx xxxxx xx xxxxxxxxxxx x xxxxxxx xx na xxxxxxxx XXX. Dále xxxx xxx vhodné xxxxxxxxxxxx x. xxxxxxxxxxx x xxxxxxxxxx xxxx xxxx xx xxxxxxxx xxxxxxxx NTE. Zpravidla xx xxxxxx tři xxxxxxx x xxxxxxxxx xxxxxxx a x xxxxx xxxxxxxxxxxxxx skupiny xx 24 x x xxxxx tři xx 48 x xx xxxxxxxx xxxxx. Xxxxx údaje x xxxxxx xxxxxx nebo x xxxxxx xxxxxx (xxxx. toxikokinetických) naznačují, xx jsou vhodné xxxx xxxx xxxxxxxx xx poslední dávce xxx tyto doby, xxxx by xxx xxxxxxx a zdůvodnění xx xxxx xxx xxxxxxx x dokumentaci.
Na xxxxxx vzorcích xxxxx xxxxx xxx provedeny xxxx analýza xxxxxxxxxxxxxxxxxxxx (XXxX), je-li xx xxxxxxxxxx xx xxxxxx. Xx xxxx xxxx xxxx xxxxxx spontánní xxxxxxxxxx XXxX, což xxxx xxxx x xxxxxxxxx látky xxxx xxxxxxxxxx XXxX.
1.4.3.4 Xxxxx
Xxxxx xxxxx xxxxxx (xxxxxxxxxx xxxxx xxxxx a xxxxxxxxxx x agónii) xx xxxx zahrnovat xxxxxxxxx stavu xxxxx x xxxxx.
1.4.3.5 Histopatologické xxxxxxxxx
Xxxxxxx xxxx xxxxxx, xxxxx xxxxxxx xxxx xxxxxxxxxx x xxxxxx xxxxxxx xxx biochemické xxxxxx, xx xxxx xxx mikroskopicky xxxxxxxxx. Xxxxx xx xxxx xxx fixovány xx xxxx za xxxxxxx xxxxxxxxxx xxxxxxx. Xxxxxxx xx mozeček (xxxxxxx xxxxxxx řez), xxxxxxxxxxx xxxxx, xxxxx a xxxxxxxxx xxxxx. Xxx xxxxx xx xxx xxx xxxxxxxx x xxxxx krční xxxxx, xxxxxxx xxxxxx x xxxxxxxxxxxxx xxxxxxx. Xxxx xx xxx xxxxxxxx xxxx distální xxxxx x. tibialis x xxxx xxxxx x x. xxxxxxxxxxxxx x x x. ischiadicus. Xxxx se barví xxxxxxxx xxxxxxx xx xxxxxx x xxxxx. Xxxxxxx xx xxxx xxx provedeno mikroskopické xxxxxxxxx xxxxxxxx tkáně xxxxx zvířat xxxxxxxxx xxxxxxx x xxxxxxx x xxxxxxx xxxxxx. Xxxxx se x xxxxxxx s vysokou xxxxxx xxxxxxx xxxxxx, xxxx xx být xxxxxxxxxxxxx xxxxxxxxx provedeno xxxx xx slepicích xx xxxxxxx xx xxxxxxx x xxxxxx xxxxxx.
2. XXXXX
Xxxxxxxxx xxxxxxxx xxxxxxx touto xxxxxxx (xxxxxxxxxxx x xxxxxxxxxxxxxxxx xxxxxxxxx a xxxxxxxxx xxxx xxxxxxx) xxxxxxxxxx xxxxxxxxx xxxxx xxxxxxxx xxxxxx xxxxxxxxxxxxx. Xxx xxxxxxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxxx těchto xxxxxxxxx xxxx být xxxxxxxx xxxxx xxxxxxxxx.
Xxxx by xxx xxxxxxx xxxxx xxx xxxxx jednotlivé xxxxx. Xxxxx by xxxx xxx všechny xxxxx shrnuty do xxxxxxx, xxxxxxx xx x každé experimentální xxxxxxx uvede xxxxx xxxxxx xx xxxxxxx xxxxxxx, xxxxx zvířat xxxxxxxxxxxx léze, xxxxxx xx chování nebo xxxxxxxxxxx účinky, typ x xxxxxxxxx xxxxxx xxxx nebo xxxxxx x xxxxxxxx xxxxxx xxxxxxxxxx xxxxx xxx x závažnost léze xxxx xxxxxx.
Xxxxx x xxxx xxxxxx xx xxxx xxx vyhodnoceny x xxxxxxxx xxxxxxx, xxxxxxxxxx x xxxxxxxx xxxxxx xx chování x biochemických x xxxxxxxxxxxxxxxxxx nálezů x xxxx xxxxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxxx xx xxxxxxxxxxxxxx x kontrolní xxxxxxx.
Xxxxxxx výsledky xx xxxx xxx xxxxx xxxxx xxxxxxxxxxx xxxxxxx x xxxxxx uznávanou xxxxxxxxxxxx xxxxxxx. Xxxxxxxxxxx xxxxxx by xxxx xxx xxxxxxx již xxx plánování xxxxxx.
3. XXXXXX
Xxxxxxxx x xxxxxxx
Xxxxxxxx x zkoušce obsahuje xxxxx xxxxx tyto xxxxxxxxx:
Xxxxxxx xxxxxxx:
- xxxxxxx xxxxxxx;
- počet x xxxxx zvířat;
- původ, xxxxxxxx xxxxx xxx.;
- xxxxxxxx xxxxxxxxxxxx xxxxxx xx xxxxxxx xxxxxxx.
Xxxxxxxx xxxxxxxx:
- xxxxxxxx xxxxx x xxxxxxxx xxxxxxxx xxxxx, xxxxxxxxx o xxxx xxxxxxxx x xxxxxxxxxx;
- xxxxxxxxxx xxxxx xxxxxxxx;
- xxxxxxxx xxxxx x xxxxxxx podání xxxxxxxx xxxxx;
- xxxxxxxx xxxxx x stravě x x kvalitě xxxx;
- xxxxxxxxxx xxxxxx xxxxxx dávek;
- xxxxxxxxxxx xxxxxxxxxx xxxxx, včetně xxxxxxxxxx xxxxxxxxx x xxxxxxxx, xxxxxx x xxxxxxxxx xxxxx xxxxxx xxxxx;
- zdůvodnění jiných xxxx xxxxxx xxx xxxxxxxxxxx xxxxxxxxx, není-li xxxxxxx 24 a 48 h.
Výsledky:
- xxxxx x xxxxxxx xxxxxxxxx;
- xxxxx x xxxxxxxxx xxxxxxxx xxxxx xxxxxx, xxxxxx mortality;
- xxxxxx xxx xxxxxxxxxxxxxxx xxxxxxxxxxxx xxxxxx;
- xxxxxxxxx, xxxxxxxxx x trvání xxxxxxxxxx xxxxxxx (xxx xxxx xxxxxx xxxx nevratné);
- xxxxxxxx xxxxx xxxxxxxxxxxxx xxxxxxxxx x nálezů;
- xxxxxxx xxxxxx;
- xxxxxxxx xxxxx všech xxxxxxxxxxxxxxxxxx xxxxxx;
- xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx výsledků.
Rozbor xxxxxxxx.
Xxxxxx.
4. XXXXXXXXXX
Xxxxxx je xxxxxxxxxx xxxxxx XXXX XX 419."
XXXXXXX V
Obecné xxxxxxxxx xx klasifikaci a xxxxxxxxxx xxxxxxxxxxxx xxxxx x xxxxxxxxx
Xxx xxxxxxxx Xxxxxx 2001/59/XX, Xx. xxxx. X 332, 28. 12. 2000, x. 81.


