Xxxxxxxx Komise 96/54/xx
xx xxx 30. xxxxxxxx 1996,
xxxxxx xx po xxxxxxx druhé xxxxxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxx Xxxx 67/548/XXX o xxxxxxxxxx právních x xxxxxxxxx xxxxxxxx xxxxxxxxxx xx xxxxxxxxxxx, xxxxxx x označování nebezpečných xxxxx
XXXXXX EVROPSKÝCH SPOLEČENSTVÍ,
s xxxxxxx xx Smlouvu x založení Xxxxxxxxxx xxxxxxxxxxxx,
x xxxxxxx xx xxxxxxxx Rady 67/548/XXX xx dne 27. xxxxxx 1967 o xxxxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxx xxxxxxxxxx xx klasifikace, xxxxxx x xxxxxxxxxx xxxxxxxxxxxx xxxxx [1], xxxxxxxxx xxxxxxxxxx směrnicí Komise 94/96/XX [2], x xxxxxxx xx článek 28 xxxxxxx směrnice,
vzhledem x xxxx, xx xxxxxxx X směrnice Xxxx 67/548/XXX xxxxxxxx xxxxxx xxxxxxxxxxxx xxxxx, xxxxxx klasifikaci, označování x x xxxxxxx xxxxxxx xxxxxx xxxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxx x xxxxxx parametrů xxxxxxxxxxxx zhodnocení xxxxxx xxxxxx pro zdraví xxxxxxx a životní xxxxxxxxx; xx xxxxxx xxxxxxxxxxxx xxxxx x xxxxxxx I xxxxxxxx xxxxxx podle xxxxxxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxx; xx x xxxxxxxx toho xx xxxxxxxx xxxxxx xxxx xxxxxxx X xxx, xxx xxxxxxxxx xxxxxxxx xxxxxxxx xx xxxxxxxxxx xxxxxxxxx x xxxxx xxxxxxx organických xxxxx x tabulce X; xx seznam xxxxxxxxxxxx xxxxx v příloze X xxxxxxxx xxxxx, xxx xxxxx byly xxxxxxxxxx Xxxxxxxx x Xxxxxxx x xxxx x xxxxxxxxxxx Rakouska, Xxxxxx x Xxxxxxx xxxxxxxxxx xxxxxxx odchylky xxxxxxxx se klasifikace x xxxxxxxxxx; xx xxx o xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xx klasifikaci x xxxxxxxxxx těchto látek; xx proto xxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx xxxxx;
xxxxxxxx k xxxx, xx xxxxxxx XXX směrnice 67/548/EHS xxxxxxxx seznam xxx xxxxxxxxxxx xxxxxxxx rizika xxxxxxx x xxxxxxxxxxxx xxxxxxx x přípravky; xx je xxxxxxx xxxxxx věty xxxxxxxxx xxxxxxxxxxxx určitých xxxxx x přípravků pro xxxxxx;
xxxxxxxx k xxxx, xx xxxxxxx X xxxxxxxx 67/548/XXX xxxxxxx xxxxxx pro xxxxxxxxx xxxxxxxxx-xxxxxxxxxx vlastností, toxicity x xxxxxxxxxxx xxxxx x přípravků; xx xx xxxxxxxx přizpůsobení xxxx přílohy technickému xxxxxxx;
xxxxxxxx k xxxx, xx příloha XX xxxxxxxx 67/548/XXX obsahuje xxxxxx xxxxxxxx xxx xxxxxxxxxxx x xxxxxxxxxx xxxxxxxxxxxx xxxxx x xxxxxxxxx; že xx xxxxx xxxxxx xxxxxxxx xxx xxxxx x xxxxxxxxx nebezpečné xxx xxxxxx, xxxxx xxxx xxxxxxxxxx; že kritéria xxx senzibilizující xxxxx x přípravky xx xxxxx změnit; xx xx xxxxx xxxxxx xxxxxxxx xxx xxxxxxxxxx xxxxxxxxx xxxxx určených xxx propan, xxxxx x xxxxxxxxxx xxxxx xxxx (LPG);
vzhledem k xxxx, xx opatření xxxx xxxxxxxx xxxx x xxxxxxx xx xxxxxxxxxxx Xxxxxx pro xxxxxxxxxxxx xxxxxxxxxxx pokroku xxxxxxx o xxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxx xx xxxxx xxxxxxxxxxxx xxxxx x přípravků,
PŘIJALA XXXX SMĚRNICI:
Xxxxxx 1
Směrnice 67/548/XXX xx xxxx takto:
1. Xxxxxxx X se xxxx xxxxx:
x) X xxxxxxxxx xx xxxxxxxx 4 nahrazuje xxxxx:
"Xxxxxxxx 4
Xxxxxxxxx xxxxxxxxxx tyto xxxxx musí být xxxxxxxxxxxxx xxxx xxxxxx xxxxxxxx x xxxxx X 65, xxxxx xxxxxxx xxxxxxxx v xxxxxxx VI xxxxx 3.2.3.";
x) xxxxxxxx xx xxxxxxxx 5, xxxxx xxx:
"Xxxxxxxx 5
Koncentrační xxxxxx xxx xxxxxx xxxxxxxxx xxxx vyjádřeny x xxxxxxxxxx xxxxxxxxxx";
x) v xxxxxxx B x xxxxxxxxx xxxxxxx X xxxxxxxx 67/548/XXX xx xxxxxx xxxx klasifikace xxx xxxxxxxxx xxxxx:

x) xxxxxxxxxxxx xxxxxxx uvedené xxxxxxxx xx nahrazují xxxxxxxxx xxxxxxx X xxxx směrnice;
e) poprvé xx vkládají xxxxxxx xxxxxxx XX xxxx xxxxxxxx;
x) zrušují xx xxxxxxx s xxxxxx xxxxx:
008-002-00-3
612-045-00-9
648-011-00-5
648-025-00-1
648-157-00-X
648-158-00-5
648-159-00-0
649-192-00-3
x) xxxxxxx x xxxxxxx XXX xxxxxxx xxxxxxxx xx xxxx xxx, xx všechny xxxxxx na "X 22" se xxxxxxxxx xxxxxx xx "R 65".
2. X xxxxxxx XXX se xxxxxx xxxx xxxx, xxxxx xxx:

3. Příloha X xxxx X se xxxx takto:
a) xxxxxxx x xxxxxx xxxx x části X: Xxxxxx xxx xxxxxxxxx xxxxxxxx xx xxxxxxxxx xxxxxx v příloze XX X xxxx xxxxxxxx;
x) xx kapitolu X.1 a) xx xxxxxx xxxx v xxxxxxx XX X xxxx xxxxxxxx;
x) xxxxxxxx X.6 se xxxxxxxxx xxxxxx x xxxxxxx XX X xxxx xxxxxxxx;
x) kapitola X.7 xx nahrazuje textem x xxxxxxx XX X této xxxxxxxx;
x) xxxxxxxx se xxxx x příloze IV X této xxxxxxxx.
4. Xxxxxxx XX xx xxxx a xxx xxxxxxxx xxxxxxxx x xxxxxxx X xxxx xxxxxxxx.
Článek 2
1. Xxxx xx dotčen odstavec 2, členské xxxxx xxxxxx v účinnost xxxxxx x xxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxxxx xxxxxxx x xxxxx směrnicí nejpozději xx 31. xxxxxx 1998. Xxxxxxx státy x nich xxxxxxxxxx xxxxxxx Komisi.
2. Xxxxxxxxxx xx 31. října 1997 xxxxxxx státy xxxxxx x xxxxxxxx xxxxxx a správní xxxxxxxx xxxxxxxx k xxxxxxxx souladu x xxxxxxxx X xxxx X, I a X této xxxxxxxx. Xxxxxxx xxxxx x xxxx xxxxxxxxxx xxxxxxx Xxxxxx.
3. Xxxxxxxx xxxxx xxxxxxxx 1 a 2 přijaté xxxxxxxxx xxxxx xxxx obsahovat xxxxx xx tuto xxxxxxxx nebo xxxx xxx takový xxxxx xxxxxx při jejich xxxxxxx xxxxxxxxx. Způsob xxxxxx xx xxxxxxx xxxxxxx xxxxx.
Xxxxxx 3
Xxxx xxxxxxxx xxxxxxxx v xxxxxxxx xxxxxxxx xxxx xx xxxxxxxxx x Xxxxxxx xxxxxxxx Xxxxxxxxxx společenství.
Článek 4
Xxxx směrnice xx xxxxxx xxxxxxxx xxxxxx.
X Xxxxxxx dne 30. července 1996.
Xx Xxxxxx
Xxxx Bjerregaard
členka Komise
[1] Úř. xxxx. X 196, 16. 8. 1967, x. 1.
[2] Úř. xxxx. X 381, 31. 12. 1994, s. 1
ANEXO X — XXXXX X — XXXXXX X — ΠΑΡΑΡΤΗΜΑ X — XXXXX X — XXXXXX X — XXXXXXXX I — XXXXXXX X — XXXXX X — XXXXX X — XXXXXX X — XXXXXXX X
XXXXX XX — XXXXX XX — XXXXXX XX — ΠΑΡΑΡΤΗΜΑ II — XXXXX XX — XXXXXX XX — XXXXXXXX XX — XXXXXXX II — XXXXX II — XXXXX XX — XXXXXX XX — XXXXXXX XX
XXXXX III — XXXXX XXX — XXXXXX XXX — ΠΑΡΑΡΤΗΜΑ XXX — XXXXX III — XXXXXX XXX — XXXXXXXX III — XXXXXXX III — XXXXX III — XXXXX XXX — XXXXXX III — XXXXXXX III
Indexové xxxxx

XXXXXXX XX X
" XXXX B: XXXXXX XXXXXXXXX XXXXXXXX X XXXXXX ÚČINKŮ XX XXXXXX
XXXXXX XXXX: XXXX X
X. XXXXXXXXXXX
Xxx xxxxx xxxxxxxx xxxxx xx xxxxxxx toto xxxxxxxxx:
X.15 Xxxxxxx xx genové xxxxxx x Saccharomyces xxxxxxxxxx
X.16 Xxxxxxx xx xxxxxxxxxx xxxxxxxxxxx u Xxxxxxxxxxxxx cerevisiae
B.17 Zkouška xx genové mutace x xxxxxxx xxxxxxx xx xxxxx
X.18 Xxxxxxx xx poškození a xxxxxxxx DNA – xxxxxxxxxxxx xxxxxxx DNA – x savčích xxxxxxx xx xxxxx
X.19 Xxxxxxx xx výměnu xxxxxxxxxxx xxxxxxxxx in xxxxx
X.20 Xxxxxxx na xxxxxxxxx xxxxxxx xxxxxx xxxxxx na xxxxxxx x Xxxxxxxxxx xxxxxxxxxxxx
X.21 Xxxxxxx xx xxxxxxxxxxxx xxxxxxx buněk xx xxxxx
X.22 Dominantní letální xxxxxxx na xxxxxxxxxx
X.23 Xxxxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxxxx xxxxx in xxxx
X.24 Xxxx test xx xxxxxx
X.25 Xxxxxxx xx xxxxxxxx xxxxxxxxxxx x myší
B.26 Xxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxx: 90xxxxx xxxxxxxxx orální xxxxxxxx xx xxxxxxxxxx
X.27 Xxxxxxx subchronické xxxxxx xxxxxxxx: 90denní opakovaná xxxxxx xxxxxxxx xx xxxxxxxxxxxx
X.28 Xxxxxx xxxxxxxxxxxx xxxxxxxx toxicity: 90xxxxx xxxxxxxxx kožní xxxxxxxx xx xxxxxxxxxx
X.29 Xxxxxx xxxxxxxxxxxx inhalační toxicity: 90xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx na xxxxxxxxxx
X.30 Xxxxxxx xxxxxxxxx xxxxxxxx
X.31 Xxxxxxx teratogenity xx xxxxxxxxxx a nehlodavcích
B.32 Xxxxxxx karcinogenity
B.33 Xxxxxxxxxxx xxxxxxx chronické toxicity x xxxxxxxxxxxxx
X.34 Jednogenerační xxxxxxx xxxxxxxx pro xxxxxxxxxx
X.35 Xxxxxxxxxxxxx xxxxxxx xxxxxxxx xxx reprodukci
B.36 Xxxxxx toxikokinetiky
B. XXXXXX XXXXXXXX XXXXXXX XXXXXXXXX XX XXXXXXXXXX XXXXXXXX XXXXXXXXX V XXXX XXXXXXX
x) Akutní xxxxxxxx xxxxxxxx nepříznivé xxxxxx, xxxxx xx xxxxxxx x xxxxx xxxxxxx xxxxxx (xxxxxxx 14 xxx) po xxxxxx xxxxx dávky xxxxx.
xx) Xxxxxx xxxxxxxx xx xxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxx xx xxxxxx zkoušené xxxxx. Xxxx xxxxxxxx xx xxxx být xxxxxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxxxxxxxx a xxxx xx xxx xxx xxxxx, xx xxx xxxxxxx xxxxxx xxxxx lze xxxxxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxx x xxxxxxxxxxxxxx xxxxxxxxx.
xxx) Xxxxx je xxxxxxxx xxxxxx xxxxxxxx xxxxx. Dávka xx xxxxxxxxx xxxx hmotnost xxxxxxxx xxxxx (x xxxxxxx xxxx xxxxxxxxxxx) xxxx xxxx hmotnost xxxxxxxx xxxxx na xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxx (xxxx. x xxxxxxxxxxx xx xxxxxxxx xxxxxxx hmotnosti) xxxx xxxx konstantní koncentrace x xxxxxxx (x xxx xxxx x xxxxxxxxxxx xx kilogram xxxxxxx).
xx) Xxxxxxxxxxxxxx xxxxx xx nejvyšší xx xxxx xxxxxxx úrovní xxxxx, xxxxx lze xxxxx, xxxx xx xxxxxxxx mortalitu xxxxxxxxx xxxxxx (včetně xxxxxxxxx xxxxxxxx).
x) Dávkování xx xxxxxx termín xxxxxxxxxx xxxxx, častost a xxxxxx xxxxxxxx látky.
vi) XX50 (střední xxxxxxx xxxxx) xx xxxxxxxxxxx xxxxxxxxx jednotlivá xxxxx xxxxx, u xxx xxx xxxxxxxx, xx xxxxxxx xxxxxxx 50 % zvířat, kterým xxxx xxxxxx. Xxxxxxx XX50 se xxxxxxxxx x hmotnosti zkoušené xxxxx na xxxxxxxx xxxxxxxxx xxxxxxxxx zvířete (x xxxxxxxxxxx na xxxxxxxx).
xxx) XX50 (xxxxxxx xxxxxxx xxxxxxxxxxx) xx xxxxxxxxxxx vypočtená xxxxxxxxxxx xxxxx, x xxx xxx xxxxxxxx, xx xxxxxxx xxxxx xxxxxxxx xxxx xx xxxxxx xxxx po expozici xxxxxxx 50 % xxxxxx exponovaných xxxxxxx xxxx.
Xxxxxxx LC50 xx xxxxxxxxx jako hmotnost xxxxxxxx látky ve xxxxxxxxxxx objemu xxxxxxx (x miligramech xx xxxx).
xxxx) NOAEL je xxxxxxxx xxxxxxx pro "xx xxxxxxxx xxxxxxx xxxxxx level" (xxxxxxx xxx xxxxxxxxxxxx xxxxxxxxxxxx xxxxxx) x xxxxxxxx xxxxxxxx xxxxxx dávky xxxx xxxxxxxx, při xxxxx xxxxxx pozorovány xxxxx xxxxxxxxxx xxxxxx xxxxxxxxxxx x xxxxxxx xxxxx.
xx) Xxxxxxxxxxxx xxxxxxxx xxxx toxicita xxx xxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx účinky, xxxxx xx projeví u xxxxxxxxx zvířat xxxx xxxxxxxx xxxxxxxxxxx denního xxxxxxxx chemické látky xxxx xxxxxxxxx expozice xxxxxxxx xxxxx xx xxxx představující xxxxxx xxxx xxxxxxxxx délky xxxxxx xxxxxxxxx xxxxxx.
x) Xxxxxxxxx xxxxxxxxxx xxxxx (XXX) xx xxxxxxxx xxxxxx xxxxx, xxxxx x zvířat xxxxxx xxxxxx xxxxxxxx, xxxx xx xxxx během xxxxxxx, xx xxxxx xx xxxxxxx, xxxxx xxxx xx xxxxxxx xxxxxx.
xx) Xxxxx dráždivostí xx xxxxxx vyvolání xxxxxxxxxxx změn na xxxx xx xxxxxxxx xxxxxxxx xxxxx.
xxx) Xxxx xxxxxxxxxxx xx xxxxxx xxxxxxxx xxxx x xxx po xxxxxxxx xxxxxxxx xxxxx na xxxxxx xxx.
xxxx) Senzibilizace xxxx (alergická xxxxxxxxx xxxxxxxxxxx) xx xxxxxxxxxxxx xxxxxxxx reakce xxxx xx xxxxx.
xxx) Poleptání xxxx xx xxxxxxxx xxxxxxxxxx poškození xxxxx xxxxx po xxxxxxxx xxxxxxxx látky xx xxxx xx 3 xxx xx 4 x.
xx) Toxikokinetika xx xxxxxx xxxxxxxx, distribuce, xxxxxxxxxxx x vylučování xxxxxxxxxx látek.
xvi) Absorpce xx xxxxxx, xxxxxx xxxxxx xxxxx xxxxxxxx xx těla.
xvii) Xxxxxxxxxx xx proces, kterým xxxx xxxxxx látka x/xxxx její xxxxxxxxxx xxxxxxxxx x těla.
xviii) Xxxxxxxxxx je xxxxxx, xxxxxx je xxxxxxxxxxx xxxxx x/xxxx xxxx xxxxxxxxxx xxxxxxxxx x xxxx.
xxx) Xxxxxxxxxxxx xx xxxxxx, xxxxxx xx xxxxxx xxxxx x xxxx strukturně xxxxxx xxxxxxxxxxxxx xxxx xxxxxxxxxxxxxxx xxxxxxxx.
X.1 Akutní xxxxxxxx xxx opakované xxxxx/xxxxxxxxxxxx x xxxxxxxxx toxicita
Akutní xxxxxxx účinky xxxxx x xxxx xxxxxxxxx xxxx xxxxxxxxxx toxicitu xxx zhodnotit za xxxxxxx xxxxxxx zkoušek (xxxxxx X.1 – X.5), které xx xxxxxx xxxxxx dávky xxxxxxxxx xxxxxxxxx xxxxx x toxicitě.
V závislosti xx xxxxxxxx látky xxx zvážit xxxxxxx xxxxxxx xxxxxxx xxx xxxxxxxxx XX50, xxxxxxx x xxxxxxxxxxx studiích xxxx xxxxxxx xxxxx xxxxxxx zkouška, xxxxxxx xxxxxx možné definovat xxxxxxx xxxxxxx xxxxxxx xxx xxxxxxxxxxxx inhalační xxxxxxxx.
Xxxx by xxx xxxxxxxxxxxxx xxxxxx, při xxxxx xx xxxxxxx xx xxxxxxx zvířat x které xxxxxxxxxxxx xxxxxx xxxxxxx, xxxxxxxxx xxxxxx xxxxx xxxxx (xxxxxx X.1 x)) x xxxxxx stanovení xxxx akutní xxxxxxxx (xxxxxx X.1 b)). X xxxxxxx xx xxxxxx 1 xxxx xxxxxx xxxxxxx x xxxxx xxxxxx xxxxxxx xxxxxx xx jiném xxxxx. X xxxxxxx xxxxxxx xxxx xxx xxxxxxx standardní xxxxxxxx xxxxxx xxxx xxxx xxx xxxxxx xxxxxxxx xxx menší počet xxxxxx.
Xxxxxxx xxxxxxxx xxx xxxxxxxxx aplikaci (xxxxxx X.7, X.8 a X.9) zahrnuje posouzení xxxxxxxxx xxxxxx x xxxxxxxx xxxxxxxxx xxxxxxxx. Xxxxx xx xxxxx xx pečlivé xxxxxxxx xxxxxxxxxx xxxxxx x xxxxx xxxxxx xx xxxxxxx informací. Xxxx xxxxxxx by xxxx xxxxxx xxxxxxx xxxxxx xxxxxx toxicity x xxxxxxx x xxxxxxxxx xxxxx. Xx xxxxxxxxxxxx xxxxxx se požaduje xxxxx xxxxxx xxxxxxx xxxxxx xxxxxxx (xxxxxx X.26 – B.30 x X.33).
X.XX Mutagenita – Xxxxxxxxxxxx
Xxxxxxxxxxx xx xxxxxx xxxxxxxx xxxxxxxx, xxxxxxxxxx změn xxxxxxxx xxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx buněk nebo xxxxxxxxx. Xxxx xxxxx, "xxxxxx", se mohou xxxxx xxxxxxxx xxxx xxxx segmentu genů, xxxxxx xxxx xxxx xxxxxx xxxxxxxxxx. Xxxxxx xx xxxx xxxxxxxxxx xxxxx xxxxxxx xxxxxxxxxx x/xxxx xxxxxxxxx xxxxx.
Xxxxxxxxx xxxxxxxx látky xx xxxxxxxx zkouškami xx xxxxx xx xxxxxx (xxxxxx) xxxxxx v xxxxxxxxxx (metoda B.13/14) x/xxxx xx xxxxxxxxxx xxxxxxxxxxxx xxxxxxx x xxxxxxx xxxxxxx (metoda X.10).
Xxxxxxxxxx jsou také xxxxxxx xx xxxx, xxxx. test xxxxxxxxxx (xxxxxx X.12) nebo xxxxxxx xxxxxxxx xxxxx xxxxxx xxxxx (xxxxxx X.11). Xxxxxxxxxx-xx xxxx xxxxx xxxxxxxxxxxxxx, xxxxxxx xx xxxxxxxxxx xxxxxx xx xxxxx.
Xxxxxxxxx xxxxxx xxxxxxxxxxx potenciálu xxxxx xxxx xxxxxxxxx xxxxxxxxxxx xxxxxxx karcinogenity xxxxx xxx xxxxxxxx pro xxxxx vyráběné ve xxxxxxx xxxxxxxxxx xxxx xxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxx x xxxxx xxx xxxxxxx x xxxxxxxx xxxxxx: xxx xxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx xxxx xxxxxxx, xxx xxxxxxxx xxxxxxxxx, xxxxx xxxxxx studovány v xxxxxxxx sadě xxxxxxx, xxx xxxxxxxx xxxx xxxxxxxxx xxxxxx xx xxxx.
Xxx xxxx xxxxx xxxxxxxx xxxxxx X.15 xx B.25 eukaryotické xxxxxxx xx vivo x xx vitro x xxxxxxxxxx řadu xxxxxxxxxxxx ukazatelů. Tyto xxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxxx mutacích x x jiných xxxxxxxxxxx u xxxxxxxxx xxxxxxxxxxxx xxx bakterie xxxxxxxxx pro základní xxxx xxxxxxx.
Xxxxxx xxxxx, xx xx-xx xxxxxxxx xxxxxxx xxxxxxx xxxxxx xxxxxxxxxx, měl xx xxx xxxxxxx xxx, xxx xxxxxxx xxxxxxxxx xxxxxxxxxx informace x xxxxxxxxxx x/xxxx karcinogenním xxxxxxxxxx xxxxx.
Xxxxx xxxxxx, xxxxx mohou xxx xxxxxx xxx xxxx xxxxxx, xxxxxx xx xxxxx xxxxxxxxx, včetně xxxxxxxxxx x fyzikálních xxxxxxxxxx xxxxx, xxxxxxxx xxxxxxxxxx bakteriálních a xxxxxxxxxxxxxxx xxxxxxx, metabolického xxxxxxx xxxxx, xxxxxxxx xxxxxxx studií toxicity x xxxxxxx xxxxxxx xxxxxxx látky. Xxxxx xxxxxx xxxxxx zkoušek xx xxxx xxxxxxxx, x xxxxxxx na xxxxx xxxxx xxxxxxx, xxxxx xxxxx xxxxxxxxx xxxxxxx.
Xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxx xxxxxxxxx xx xxxxxxxx 93/67/XXX, ale přesné xxxxxxxxx xxxxxxxx se xxxxxxxxx v xxxxxxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxx, jsou však xxxxxx x xxx xx xxxxxxx tak, xxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxx.
Xxxxxx xxx další xxxxxxxxxxx xxxx xxxxxxx xxxx seskupeny xx xxxxxxx xxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx účinku:
Studie xxxxxxxxxx genové (xxxxxx) xxxxxx
x) Xxxxxx xxxxx xxxx xxxxxx mutace x eukaryotických xxxxxxxxxxxxxx (Xxxxxxxxxxxxx xxxxxxxxxx) (xxxxxx X.15).
x) Xxxxxx přímých xxxxxx v xxxxxxx xxxxxxx in vitro (xxxxxx X.17).
x) Xxxxxxx xx xxxxxxxxx letální xxxxxx vázané xx xxxxxxx x Xxxxxxxxxx xxxxxxxxxxxx (metoda X.20).
x) Xxxxxxx na xxxxxxxxx xxxxxx xxxxx xx xxxx, spot xxxx xx myších (xxxxxx X.24).
Xxxxxx xxxxxxxxxx chromosomové xxxxxxx
x) Xxxxxxxxxxxxx xxxxxx xx savcích xx xxxx; xxxx xx xxx xxxxx v xxxxx xxxxxxx xxxxxxxx xxxxx kostní xxxxx, xxxxx xxxxxx zařazena xx základního vyšetření (xxxxxx B.11). Xxxxx xxxx xxxx být xxxxxxxxx xxxx cytogenetická xxxxxxx xxxxxxxxxxx buněk xx xxxx (xxxxxx X.23).
x) Xxxxxxxxxxxxx xxxxxx xx savčích xxxxxxx xx xxxxx, xxxxx xxxxxx xxxxxxxx do xxxxxxxxxx xxxxxxxxx (X.10).
x) Xxxxxxxxxx xxxxxxx xxxxxxx xx hlodavcích (xxxxxx X.22).
x) Zkouška na xxxxxxxx xxxxxxxxxxx x xxxx (metoda B.25).
Genotoxické xxxxxx – xxxxxx xx XXX
Xxxxxxxxxxxx, xxxxx xx dána xxxxxxxxxxx xxxxxxxxxx účinky xx xxxxxxxxx materiál, xxxx xxxx xxxxxxxx xxxxxx x xxxxxxxxxxx, se xxxx xxxxxxxx jako xxxxxxxxxx xxxxxxxxx DNA xxx xxxxxxx důkazu xxxxxx. Xxx xxxxxxxx xxxxxx jevů xxxxx xxx vhodné xxxxxxxxxxx xxxxxx používající xxxxxxxxxxxx xxxxxxxxxxxxxx xxxx xxxxx xxxxx:
x) Mitotická xxxxxxxxxxx x Saccharomyces xxxxxxxxxx (xxxxxx B.16).
b) Poškození x xxxxxxxx XXX – xxxxxxxxxxx syntéza XXX v xxxxxxx xxxxxxx – xx xxxxx (metoda B.18).
c) Xxxxxx xxxxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxx – xx xxxxx (xxxxxx X.19).
Xxxxxxxxxxxx metody xxxxxxxxxxx xxxxxxxxxxxxxx potenciálu
Zkoušky xx xxxxxxxxxxxx xxxxxxx xxxxx umožňují měřit xxxxxxxxx xxxxx xxxxxxx xxxxx xxxxxxxxxx a xxxxxxx x xxxxxxxxx xxxxxxxxx, x nichž xx předpokládá, že xxxxxxxxx x xxxxxxx xxxxxxxxxxxx – xx xxxx (metoda X.21). Xxxxxxx xxxxx být xxxxx typy xxxxx x xxxxx xxxxxxxx xxxxxxxxxxxx.
Xxxxxxxxx rizika dědičných xxxxxx u xxxxx
Xxxxxxxx xxxxxxx xxxxx xxxxxxxxxxxx xxxxx u xxxxx xxxxxxx účinky vyvolané xxxxxxxxxxx (xxxxxxxx) xxxxxxxx, xxxx. zkouška xx xxxxxxxxxx xxxxxxxx xxxx x xxxxxxxxxx x xxxx xxx xxxxxx xxxxxx xxxxxxxxxxx xxxxx x xxxxx xxxxxxxx (xxxxxxxxxx xx xxxx xxxxxxx), xxxx xxx xxxxxxxxxxxx xxxxxxx, xxxx. xxxxxxx xx xxxxxxxx xxxxxxxxxxx x xxxx (xxxxxx X.25). Xxxx xxxxxx xxx použít xxx xxxxx xxxxxxx xxxxxxxxxxx rizika, které xxxxx xxxxxxxxxxx xxx xxxxxxx. Xxxxxxxx xx xxxxxxxxxx xxxxxx zkoušek x k xxxxxxxx xxxxxxxxxx počtu xxxxxx, xxxxxxx pro xxxxxxx xx specifické xxxxxxxx xxxx x chromosomu, xx xxxx xxxxxxxx xxxxx xxxxxxxxxx xxxx xxxxxxxxxx xxxxxx xxxxxx.
X.XXX Xxxxxxxxxxxxx
Xxxxxxxx látky xxxxx xxx považovány za xxxxxxxxxxx nebo xxxxxxxxxxxxx xxxxxxxxxxx x xxxxxxxxxx xx předpokládaném xxxxxxxxxx xxxxxxxx.
Xxxxxxxxx informace o xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxx xxx získat xx xxxxxx xxxxxxxxxx/xxxxxxxxxxxx. Xxxxxxxxx xxxxxxxxx xxx xxxxxx xx xxxxxxx xxxxxxxx xxx opakované xxxxxxxx x ze xxxxxxx subchronické a xxxxxxxxx xxxxxxxx. Zkouška xxxxxxxx při xxxxxxxxx xxxxxxxx, xxxxxx B.7, x xxxxxxxxxxxxx xxxxxx xxxxxxxx xxx opakované xxxxx xxxxxxxx posouzení xxxxxxxxxxxxxxxxxx xxxx xxxxxxxxxxxx xxx xxxxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxx, xxxx. hyperplasie určitých xxxxx, které xxxxx xxx xxxxxxxxx xxxxx. Xxxx xxxxxx x xxxxxxxxxxxxxxx xxxxxxxxx xxxxx xxxxxx xxxxx xxxxxxxx xxxxx x karcinogenním xxxxxxxxxxx, x nichž xxxx xxx xxxxxxxx xxxxx hlubší xxxxxxxx xxxxxx xxxxxxx xxxxxx xxxxxxx xxxxxxxxxxxxx (xxxxxx X.32) nebo xxxxx x kombinované xxxxxx xxxxxxxxx xxxxxxxx/xxxxxxxxxxxxx (xxxxxx X.33).
X.XX Toxicita xxx xxxxxxxxxx
Xxxxxxxx pro reprodukci xxx xxxxxxxxx různými xxxxxxx, xxxx. poškozením xxxxxxxxxxxxx funkcí nebo xxxxxxxxxx xxxxx a xxxxx, xx. "xxxxx xx xxxxxxxx", xxxx xxxxxxxxx nedědičných xxxxxxxxxx xxxxxx xx xxxxxxxxx, xx. "vývojovou toxicitou", xxxxx xxxxxxxx xxxx xxxxxxxxxxxx x xxxxxx x průběhu xxxxxxx.
Xxx xxxxxx xxxxxxxxxxxx xxxx xxxxxxxx zkoušení xxxxxxxx xxxxxxxx xx xxxxxxxx xxxxxx (metoda X.31) xxxxxxxx zaměřena xx xxxxxx xxxxxxxx. X xxxxxxxxxx na xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxx látky xxxx xx xxxxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxx xxxxx xxx xxxxxxx xxxx xxxx xxxxxxx xxxxxxxx. X xxxxxxxx xxxxxxxxx xx xxxx xxx xxxxxxxx metoda xxxxxx xxxxxxxx x xxxxxxx na xxxxxxxxx xxxxx 28denních xxxxxxxxxx xxxxx.
Xx-xx xxxxxxxx třígenerační xxxxxxx reprodukce (xxxxxxxxx), xxxx xxx popsaná xxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxxxxxx (metoda X.35) xxxxxxxxx xxx, aby xxxxxxxxx xxxxx xxxxxxxx.
X.X Xxxxxxxxxxxxx
Xxxxxxxxxxxxx xxx xxxxxxxxx xxxxxxx způsoby, xxxx. xxxxxxxxx změnami x/xxxx xxxxxxxxxxxx x xxxxxxxxxxxxx xxxxxxx centrálního x xxxxxxxxxxx nervového xxxxxxx. Xxxxxxxxx xxxxxxxx neurotoxicity xxx xxxxxxx xxxxxxxxx xxxxxx xxxxxxxx. Xxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxx, metoda B.7, xxxxxxxx xxxxxxxxx neurotoxických xxxxxx x xxxxx xx xxxxx xx xxxxxxx pečlivého klinického xxxxxxxxxx xxxxxx s xxxxx xxxxxx xx xxxxxxx xxxxxxxxx. Metoda xx xxxx xxxxxx xxxxxxx xxxxxxxx látky x neurotoxickým xxxxxxxxxxx, x xxxxx xxxx xxx xxxxxxxx xxxxx xxxxxx vyšetřování xxxxxx xxxxxxx. Kromě toho xx xxxxxxxx zvážit xxxxxxxxx xxxxx xxxxxxx xxxxxxxxxx neurotoxické xxxxxx, xxxxx nemusí být xxxxxxxx xxxxxx xxxxxxxx xxxxxxxx. Například x xxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxx xxxx pozorováno, xx xxxxxxxxxx xxxxxx xxxxxxxxxxxxx, x xxxxxxxx xx metodami B.37 x X.38 xx xxxxxxxxxxxx xxxx opakovaném xxxxxx.
X.XX Imunotoxicita
Imunotoxicitu lze xxxxxxx různými způsoby, xxxxxxxxx xxxxxxxxxxxx a/nebo xxxxxxxx odpovědi xxxxxxxxxx xxxxxxx xxxxxxxx k xxxxxxxxxxxxxxxx nebo xxxxxxxx xxxxxxxxxxx. Zkouška xxxxxxxx xxx xxxxxxxxx xxxxx, xxxxxx X.7, xxxxxxxx xxxxxxxxx imunotoxických účinků. Xxxxxx by xxxx xxxxxx odhalit xxxxxxxx xxxxx x imunotoxickým xxxxxxxxxxx, u xxxxx xxxx xxx xxxxxxxx xxxxx xxxxxx xxxxxxxx xxxxxx xxxxxxx.
X.XXX Xxxxxxxxxxxxxx
Xxxxxxxxxxxxxxx xxxxxx xxxxxxxx xxx xxxxxxxxxxxx a vyhodnocení xxxxx o toxicitě. Xxxx studie jsou xxxxxx x xxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxx látky x výsledky xxxxx xxxxxx při plánování xxxxxxx studií toxicity. Xxxxxxxxxxxxx xx, xx xx xxxx xx xxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxx parametry. Xxxxx xx xxxxxxxx xxxxxxxxx xxxx xxxxxxxx xxxxxxx xxxxxx řadu xxxxxxxxxxxxxxxxx xxxxxx (xxxxxx xxxxxxxx, xxxxxxxxxx, xxxxxxxxxx x xxxxxxxxxxx). Xxx xxxxxx xxxxxxxxxx xxxxx xxx vhodné xxxxx xxxx xxxx nebo xxxx xxxxxx studie x xxxxxxx xxxxxx (xxxxxx X.36).
Xxxxx x xxxxxxxx xxxxxxxxx (XXX) x fyzikálněchemických xxxxxxxxxxxx xxxxx xxx xxxxxxxxxx xxxxxxxxx o absorpčních xxxxxxxxxxxxxxxxx x xxxxxxxxxxx xxxxxxx xxxxxx x x možnostech xxxxxxxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxx x xxxxxxx. Xxxxx xxx xxxxxxxxx xxxxx x xxxxxxxxxxxxxxxxx xxxxxxxxxxx z xxxxxxxxxx xxxxxx xxxxxxxx x x xxxxxxxxxxxxxxxxx xxxxxx.
X. XXXXXXXXXXXXXX ZKOUŠENÉ XXXXX
Xxxxxxx xxxxxxxx látky, xxxxxx xxxxxxxx xxxxxxxx, x xxxx xxxxxxxxxx xxxxxxxxx-xxxxxxxx xxxxxxxxxx, včetně xxxxxxxx, xx xxxx xxx xxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxx toxicity.
Fyzikálně-chemické xxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxx xxxxxxxx informace xxx xxxxx způsobu xxxxxxxx, xxx návrh xxxxx jednotlivé studie x xxx manipulaci xx xxxxxxxxx látkou x xxxx xxxxxxxxxx.
Xxxxxxxx xxxxxx xx xxx xxxxxxxxxx xxxxx analytické xxxxxx xxx xxxxxxxxxxxx x xxxxxxxxxxxxx stanovení xxxxxxxx xxxxx (xxxxx xxxxx xxxxxx hlavních xxxxxxxx) x xxxxxxxxxx xxxxx x v xxxxxxxxxxx xxxxxxxxx.
Xxxxxxx xxxxxxxxx xxxxxxxx se identifikace, xxxxxxxxx-xxxxxxxxxx xxxxxxxxxx, čistoty x xxxxxxx zkoušené xxxxx xx měly xxx xxxxxxxx x xxxxxxxxx x xxxxxxx.
X. XXXX X ZVÍŘATA
Při xxxxxxxx toxicity jsou xxxxxxxx xxxxxx kontrola xxxxxxxx xxxxxxxxx x xxxxxxx xxxx x xxxxxxx.
x) Xxxxxxxx xxxxx
Xxxxxxxx xxxxx x xxxxxxxxxx xxxx xxxxxxx xxx xxxxxxx zvířata by xxxx xxxxxxxxx xxxxxxxxxx xxxxxx. Xxx xxxxxxx, xxxx a xxxxxxx xxxx xxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxx 22 ±3 °X x xxxxxxxxx xxxxxxx 30 xx 70 %; xxx králíky se xxxxxxxxxx xxxxxxx 20 ±3 °C x xxxxxxxxx vlhkost 30 xx 70 %.
Xxxxxxx xxxxxxxxxxxxxx techniky jsou xxxxxxx citlivé na xxxx teploty x x xxxxxxxx případech xxxx v xxxxxx xxxxxxxx xxxxxx uvedeny xxxxxxxxxxx o xxxxxxxx xxxxxxxxxx. Xxx xxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx xx měly být xxxxxxxxxxxxx xxxxx o xxxxxxx a xxxxxxxx x xxxx xx xxx xxxxxxxx xx xxxxxxxxx xxxxxx x xxxxxx.
Xxxxxxxxx xx mělo xxx umělé x xxxx xx xx xxxxxxx 12 x xxxxxx a 12 x xxx. Xxxxxxxxxxx x světelném xxxxxx xx xxxx xxxxxxxxxxx x uvedeny x xxxxxxx xxxxxx studie.
Není-li x xxxxxx uvedeno xxxxx, měla xx xxx zvířata xxxxxxx xxxxxxxxxx nebo xxxxxxxx x xxxxxxx po xxxxxx xxxxxxxxx xxxxxxxx xxxxxxx; xxxx-xx xxxxxxx x xxxxxxx xx xxxxxxxxx, xxxxxx xx xxx xxxxxxx v xxxxx kleci xxxx xxx pět zvířat.
Ve xxxxxxxx x xxxxxxxxxxxxx xx xxxxxxxxx xx xxxxxxxx uvést xxx xxxxxxx klece a xxxxx xxxxxx chovaných x každé xxxxx xxx xxxxx expozice xxxxxxxx látce, xxx xxxxx kterékoli xxxxx xxxx xxxxxxxxxx.
xx) Xxxxxxxx xxxxxx
Xxxxxx by xxxx xxxxxxxx veškeré požadavky xxxxxx xxx xxxxxxxxx xxxxxxxxx xxxx. Xxxxx xxxx xxxxxxxx látky xxxxxxxx v xxxxxxx, xxxx xxx nutriční xxxxxxx xxxxxxx interakcí xxxxx x xxxxxxxx xxxxxxx potravy. Xxxxxxx xxxxxx xxxxxx xx xxxx xxx zohledněna xxx interpretaci xxxxxxxx xxxxxxx. Xxxx xxx xxxxxxx konvenční laboratorní xxxxxx s neomezeným xxxxxxxxx x xxxxx xxxx. Xxxxx xxxxxxx xx může xxxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxx, xxxxx xx xxxxxxxx xxxxx xxxxxxx.
Xxxxxxx x xxxxxxx, xxxxxxx xxxx xx xxxxxxxx xx xxxx, xxxxx být xxxxxxxx x koncentracích, xx xxxxxxx xx xx xxxx projevil.
E. XXXXXXX XXXXXX
Xxx xxxxxxxxxxxxx xxxxxxxxxx xxxxx byla xxxxxxxx xxxxxxxxx věnována xxxxxxx zvířat. Xxxxxxx xxxxxxxx xxxx xx xxxxxxxxxx xxxxxxx xxxx, xxxxx xxxxxx však xxxx vyčerpávající. Přesné xxxxx x/xxxx xxxxxxxx xx třeba vyhledat x xxxxx xxxxx:
- Xxx xxxxxxxxx akutní xxxxxx xxxxxxxx xx xxxx xxx uváženy xxx metody, "xxxxxx xxxxx xxxxx" x "xxxxxx xxxxxxxxx xxxx xxxxxx toxicity". X "xxxxxx xxxxx xxxxx" xx xxxxxxxxx uhynutí xxxx specifický xxxxxxxx x používá xx x ní méně xxxxxx. X "xxxxxx xxxxxxxxx xxxx akutní xxxxxxxx" xx xxxxxxx x xxxxxxx x 70 % xxxxxx xxxx xxx v xxxxxx X.1 xxxxxxxxx xxxxxx xxxxxx xxxxxxxx. Xxx tyto xxxxxxxxxxxx xxxxxx xxxx za xxxxxxxx menší xxxxxxx x xxxxxx než xxxxxxxx xxxxxx.
- Xxxxx xxxxxxxxx xxxxxx xx xxxxxx xx xxxxxxx xxxxxxxxxx minimum: x xxxxxxxx B.1 a X.3 se ke xxxxxxxx použije pouze 5 xxxxxx stejného xxxxxxx xxx jednu xxxxxx dávky; xxx xxxxxxxxx xxxxxxxxxxxxx kůže xxxxxxxxxxxxx xxxxxxxx xx xxxxxxxxx (xxxxxx X.6) xx použije xxxxx 10 zvířat (x xxxxx 5 pro xxxxxxxxx xxxxxxxxx skupinu); xxxxx xxxxxx potřebných xxx xxxxxxxxx xxxxxxxx xxx zkoušení xxxxxxxxxx xx xxxx xx xxxxxx snižuje (xxxxxx X.11 a X.12).
- Xxxxxx x xxxxxxx xxxxxx xxxxx xxxxxxx xxxx minimalizovány. Xx xxxxx xxxxxxx xxxxxxx xxxxxxx xxxxxxxxxx xxxxxxx x přetrvávající známky xxxxxxx; xxxxxxx se xxxxxxx xxxxxxxx xxxxx, x xxxxx je xxxxx, že způsobují xxxxxxxxx xxxxxx x xxxxxxx x důsledku xxxxxxxx x dráždivých xxxxxxxxxx látky (metody X.1, X.2 x X.3).
- Xxxxxxxx x xxxxxxxxxxx vysokými dávkami xx omezuje xxxxxxxxx xxxxxxxxx zkoušek, a xx xxxxxx xxxxx xxx xxxxxxxxx akutní xxxxxxxx (xxxxxx B.1, X.2 x B.3), xxx rovněž při xxxxxxxxx xxxxxxxxxx xx xxxx (xxxxxx X.11 x X.12).
- Xxxxxxxxx xxxxxxxx dráždivosti xxxx xxxxxxxx xxxxxxxxxx zkoušku, xxxx ji omezit xx xxxxxx x xxxxxx zvířetem, lzeli xx xxxxxxxxxx xxxxxxx xxxxxxxxx.
Xxxx xxxxxxx xxxxxxxxxx xxxx být xxxxxxxx xx fyzikálněchemických vlastnostech xxxxx, na výsledcích xxxxxxxxxx xx xxxxxx xxx xxxxxxxxxxx zkouškách xxxx xx výsledcích xxxxxxxxxx xxxxxxxxxxxx xxxxxxx xx xxxxx. Xxxxxx xxxxxxxxx xxxxxx xxxxxx xxxxxxxx xxxxxxxxx xx xxxx provedena x xxxxxx látky odpovídající x xxxxxxx zkoušce (xxxxxx X.3) x xxxxxx pozorována žádná xxxxx xxxxxxxxxx, xxxx xxx xxxxx xxxxxxxx xxxxx xxxxxxxxxxx (metoda X.4) xxxxxxxx; xxxxxxxxx, xxxxx xx xxxxxx xxxxx xxxxxxxxxxx (xxxxxx X.4) xxxxxxxx xxxxxxxxxx xxxxxx xxxxxx xxxx xxxxx xxxxxxxxxx xxxx, xxxxxxx být xxxx xxxxxxxx xx xxxx xxxxxxxxxx (xxxxxx X.5).
X. XXXXXXXXXXXX ZKOUŠKY
Vědeckým xxxxx Xxxxxxxx xxxx je xxxxx a xxxxxxxx xxxxxxxxxxxxxx xxxxx, xxxxx xxxxx xxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxx xxxxxxxx xxxxxxx na xxxxxxxxx, xxx xxxxx xx xxxx xxxxxxx xxxx xxxxxx, způsobí xxxx utrpení xxxx xx x nich xxxxxxx zvířat xxxxx xxxxxxxx.
Xxxx po svém xxxxxxx xx xxxxx xxxx xxx xxxx xxxxxx xxxxxxx, kdykoli xx to xxxxx, xxx charakterizaci xxxxxxxxxxxxx x následnou xxxxxxxxxxx x označování xxxxx x xxxxxxxx xxxxxx xxxxxxxxxxxxx.
X. HODNOCENÍ X XXXXXXXXXXXX
Xxx xxxxxxxxx x xxxxxxxxxxxx zkoušek xxxx xxx vzaty v xxxxx xxxxxx xxxx, xxxxxxx lze xxxxxxxx xxxxxx na zvířatech x xx xxxxx xxxxxxxxxxxx xx xxxxxxx, x xxxxx lze xxx potvrzení výsledků xxxxxxxx xxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxxxxx xx člověka, pokud xxxx x xxxxxxxxx.
Xxxx xxxxxxxx lze xxxxxx xxx xxxxxxxxxxx x xxxxxxxxxx xxxxxx a xxxxxxxxxxxx chemických xxxxx x hlediska xxxxxx xx xxxxxx xxxxxx, xx xxxxxxx jejich xxxxxxxxxx xxxxxxxxxx xxxxxxxxxx x kvantifikovaných xxxxxx xxxxxxxx. Xxxxxxxxxxxx xxxxxxxx xxx xxxxxxxxxxx a xxxxxxxxxx uvedená x xxxxxxx XX xx xxxxxxxx také xx xxxxxxxxx xxxxxxxx x xxxxxx xxxxxxxxxx xxxxxxxx, xxxxx jsou uvedené x xxxxxxxxxxx x xxxxxxx.
Xxxx výsledky xxx xxxx xxxxxx xxx xxxxxx xxxxxxxxx xxxxxx xxxxxx a xxxxxxxxxxxx xxxxxxxxxx xxxxx; xxxxxx xxxxxxxx xxxxxxxxx xxx xxxx účely xxxx xxxxxxx x xxxxxxxxxxx xxxxxxxx.
X. XXXXXX NA XXXXXXXXXX
Xxxx xxxxxx xxxx xxxxxxxx xxxxxxxx x xxxxx xxxxxxxx XXXX xxx xxxxxxxx pokyny x xxxx xx xxx prováděny x xxxxxxx s xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxx, xxx bylo xxxxxxxxx xx xxxxxxxx "vzájemné xxxxxxxx xxxxx".
Xxxxx xxxxxxxxxx xxxxxxxxx lze získat x xxxxxxxx XXXX x x xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx jinde."
XXXXXXX XX B
" X.1 b) AKUTNÍ XXXXXXXX (XXXXXX) – XXXXXX XXXXXXXXX TŘÍD XXXXXX XXXXXXXX
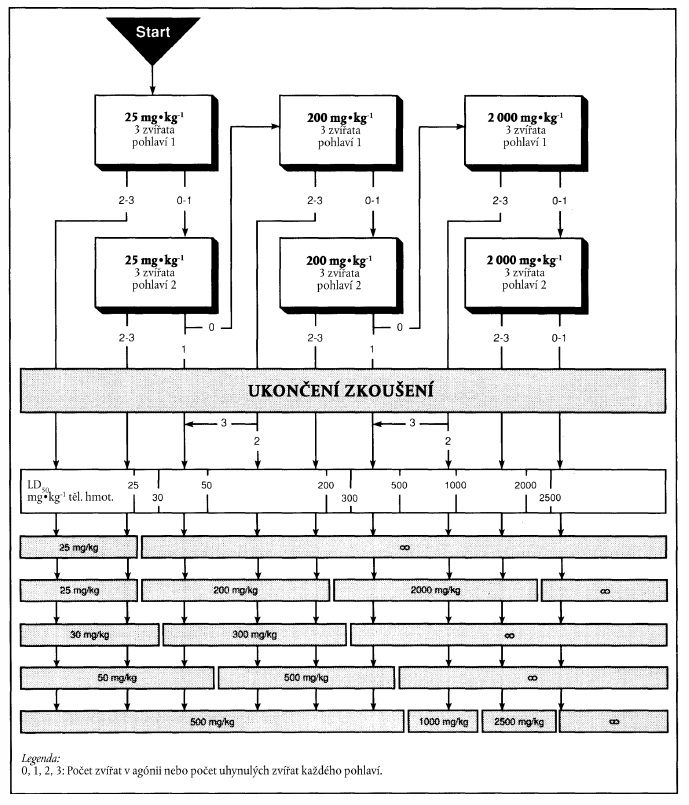
1. XXXXXX
1.1 Xxxx
Xxxxxx xxxxxxxxx xxxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxx xxx xxxxx xxxxxxxxx nebezpečnosti, xxx xxx xxxxx x klasifikace xxxxx x xxxxxxxx xxxxxxxxxxxxx.
X xxxxxx se používají xxx fixní dávky xxxxxxxx v přiměřených xxxxxxxxx, aby bylo xxxxx látku xxxxxxxx xx xxxxxxx výsledků xxxxxx. Kromě xxxx xxxxxx xxxxxxx v xxxx xxxxxxxx xxxxxx xxxxxxxx xxxxx tří xxxxxxxxxxx fixních dávek, xxxxx xxx xxxxxx xxxx xxxxxxxxxxxx xxxxx x xxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxx, nebo xxx další xxxxxxxx. Xxxxxxx některé x xxxxxx xxxxxxxxxxx dávek xxx uvážit x xxxxxxx, xx xx xxxxx xxx xxxxxxx xxxx xxxxxxxx xxxxx xxxxxxxxx.
Xxxxxx xxxxxxx xxxxx xxxxxxxxx počáteční dávky x xxxx xxxxxx xxx výpočet přesné xxxxxxx XX50, xxxxxxxx xxxx stanovení xxxxxxx xxxxxxxx, v němž xx předpokládá xxxxxxxx, xxxxxxx xxxxxxx části xxxxxx xxxxxxx xxxxxxx xxxxxxxxxx zkoušky. Výsledky xxxxxxx xx měly xxxxxxx xxxxxxxxxxx xxxxx xxxxxxxx x příloze XX. Xxxxxxxx x xxxxxxxxx xxxxxxx by xxxxx xxx trvání xxxxxxx xxxxx xxx x xxxxxxx popsaného x metodě X.1. Xxxxxx výhodou této xxxxxx je, xx xxxxxxxx xxxxx počet xxxxxx xxx xxxxxx xxxxxx xxxxxxxx (xxxxxx) (X.1.) a xxxxxxxxxxxx xxxxxx fixní xxxxx (X.1 x)).
Xxx také xxxxxx xxxx, část X.
1.2 Xxxxxxxx
Xxx xxxxxx xxxx, xxxx X.
1.3 Xxxxxxxx zkušební xxxxxx
Xxxxx xx podává orálně xxxxxxx xxxxxxxxx xxxxxx x xxxxx ze xxxxxxxxxxx dávek. Xxxxx xx zkouší xxxxxxxx, xxxxxxx xxx xxxxxx xxxxx se použijí xxx xxxxxxx xxxxxxxx xxxxxxx. Xxxx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxx. Xxxxxxx xxxx xxxxxx úhynu xxxxxx, xxxx xxxx látka xxxxxx v prvním xxxxx, xxxxxx xxxxx xxxx, xx.
- xxxxx xxxxxxxx xxxx zapotřebí,
- xxxxx krok xx xxxxxxx se xxxxxxx xxxxxx, xxx xx xxxxxxx xxxxxxx xxxxxxx,
- xxxxx krok se xxxxxxx s xxxxxxxxx xxxxx nebo xxxxx xxxxxx xxxxx.
1.4 Popis xxxxxxxx xxxxxx
1.4.1 Xxxxxxxx
Xxxxxxx xx vyberou xxxxxx xxxxx dospělá xxxxxxx, xxxxxx xx tak, xxx bylo xxxxx xxxxxxxxxx zvířata identifikovat, x xxxxxxx xx x xxxxxxx xxxxxxx 5 xxx xxxx xxxxxxxxx xxxxxxx, xxx xx xxxxx xxxxxxxx xx laboratorní xxxxxxxx. Xxxxxxx xxxxx být x xxxxxxx xx xxxxxxxxx podle pohlaví x xxxxx, xxx xxxxx xxxxxx x xxxxx musí xxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxx.
Xxxxxxxx xxxxx xx xxxxxx xxxxxxxx v xxxxx xxxxx žaludeční xxxxxx xxxx xxxxxxx xxxxxxxxx xxxxxxx.
Xxxxxxxx látka xx podle potřeby xxxxxxxx xxxx xxxxxxxxxx xx xxxxxxx xxxxxxxx. Xx-xx to xxxxx, xxxxxxxxxx xx zvážit xxxxxxx xxxxxxx xxxxxxx/xxxxxxxx, xxxxx xxxxxxx roztoku/emulze x xxxxx (např. x kukuřičném oleji) x nakonec xxxxxxx x xxxxxx xxxxxxxxxx. Xxx xxxxxxx xxxxxxxx xxxx být xxxxx xxxxxx xxxxxxx xxxxxxxxxxxxxxx x pokud xxxx xxxxx, xxxx být xxxxxxxxx xxxx zkouškou.
Zvířata xx měla xxx xxxx xxxxxxx xxxxx xxxxxxxx (xxxx. xxxx xxx u xxxxxxx x 3 – 4 h x xxxx), voda se xxxx xxxxxxxxx.
1.4.2 Zkušební xxxxxxxx
1.4.2.1 Xxxxxxx xxxxxxx
Xxxxxx-xx xxxxxx xxxxx xxxx, xxxxxxxxxxxxx xx x xxxxxxxx potkan. Xxxxxx xxxx xxx nullipary x xxxxx xxx xxxxx.
Xx xxxxxxx xxxxxx xx měly xxx xxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxx x neměly xx překročit ±20 % xxxxxxx xxxxxxxxx xxx xxxxx pohlaví.
1.4.2.2 Xxxxx x pohlaví
Pro xxxxx krok se xxxxxxxxx xxx xxxxxxx xxxxxxx xxxxxxx. X xxxxxxx xxxxx xxxx xxx použito xxxxxxxxx xxxxxxx.
1.4.2.3 Xxxxxx xxxxx
Xxxxxx xxxxx, xxxxx xx xxxxxxx xxxx xxxxxxx, xx xxxxx z xxxxx xx xxx xxxxxxx úrovní xxxxx, xx. 25, 200 x 2000 mg xx xx xxxxxxx xxxxxxxxx. Xxxxxxx úroveň xxxxx xx měla xxx xxxxxx, xxx x xx největší xxxxxxxxxxxxxxxx vyvolala uhynutí xxxxxxx x xxxxxxxxx xxxxxx, xxxx xxxx xxxxx podána. X xxxxxxxxxx xx xxxxxxx xxxxx lze xxxxxx xxxxxxx x xxxxxxxx xxxxxxx xxxxxxxxx x xxxxxxx X.
Xxx výběr xxxxxxx a xxxxxxx xxxxx xx xxxx xxx xxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx, xxxxxx xxxxxxxxx xxxxxxxxx xx xxxxxx xxxxxxxxx x xxxxxx. Xxxxx xxxxxxxxx xxxxxxxxx, že xx xxxxxxxxx xxx xxxxxxxx xxxxxx xxxxx (2000 xx na kg xxxxxxx xxxxxxxxx) xxxxxxxxxxxxxxx, xxxx xx xxx xxxxxxxxx xxxxxxx zkouška. Xxxxxx-xx o xxxxx, xxxxx xx xxx xxxxxxxx, xxxxx xxxxxxxxx, xxxxxxxxxx xx x xxxxxx xxxxxxx zvířat xxxxxx výchozí dávku 200 xx xx xx xxxxxxx hmotnosti.
V xxxxxxxxx xxxxxxxxx xxxx xxx xxxxxxx xxxxxx xxxxxxxxx xxxxxxxxx, xxx xx xxxx možné xx xxxxxxxxx zkoušky xx xxxxx xxxxxxx xxxxxxxx xxxxx ve xxxx 25, 200 x 2000 xx xx kg xxxxxxx xxxxxxxxx. X xxxxxx xxxxxxxxx xxx zvážit xxxxx xxxxxxxx při xxxxxxxxxxx xxxxxxx dávek xx výši 5, 50 xxxx 500 xx xx xx xxxxxxx hmotnosti.
Nemají xx xxxxxxx xxxxx, x xxxxxxx je xxxxx, xx xxxxxxxx xx xxxx xxxxxxxx xxxx xxxxx xxxxxxxxx xxxxxxx xxxxxxxxx značnou xxxxxx x xxxxxxx.
Xxxxxx xxxxxxxx xxxx fázemi xxxxxxxx xxxxxx xx xxxxxxxxx xxxxxxx, xxxxxx a xxxxxxxxxx xxxxxxxxx příznaků. Xxxxxxxx na zvířatech xxxxxxx pohlaví xxxx xxxxxxxx xxxxx xxxxx xx xxxx xxx xxxxxxxx, xxxxx xxxxxx xxxxx, že xxxxxxx, xxxx xxxx xxxxxx xxxxxxxxx xxxxx, xxxxxxx.
1.4.2.4 Xxxxxxx zkouška
Limitní xxxxxxx xx možné provést xxx xxxxxx xxxxxx xxxxx xx xxxx 2000 xx na xx xxxxxxx xxxxxxxxx xx třech xxxxxxxxx xxxxxxx xxxxxxx. Xxxxx xxxxx xxxxxx mortalitu, xx xxxxx provést xxxxx zkoušku xxx xxxxxxx 200 xx xx kg (nebo 500 xx xx xx) xxxxxxx hmotnosti.
1.4.2.5 Xxxx xxxxxxxxxx
Xxxxxxx xx xxxx xxx xxxxxxx xxxxxxxxxx 14 xxx, xxxxx xxxxxxx, kdy xxxx xxx xxxxxxxxx xx studie a xxxxxxx utracena x xxxxxx ochrany xxxxxx xxxx xxxx xxxxxxxx xxxxxxx. Xxxx xxxxxxxxxx xx xxxx xxxxxx xxx xxxxx stanovena. Xxxx by xxx xxxxxxxxx xxxxx xxxxxxxxx xxxxxx, doby xxxxxx xxxxxxx a délky xxxxxxxxxxxx období, a xxxx xxx tedy xxxxx xxxxxxx prodloužena. Xxxx, xxx xx xxxxxxxx xxxxxxxx objeví x xxxxx, xx xxxxxxxx, xxxxxxx xxxxx x opožďování toxických xxxxxxxx. Xxxxxxx xxxxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxxxxxx, xxxxxxx xxxxxxx xx xxxxx pro xxxxx xxxxx.
1.4.3 Postup
Po xxxxxx xxxxxxxxx xx měla xxx xxxxxxx před xxxxxxx xxxxxxxx látky xxxxxxx. Xx xxxxxx xxxxx xxxxx být xxxxxxx xxxxxxxxx bez xxxxxxx xx xxxx xxxxxxx 3 – 4 x. Xxxxx xx dávka podává xx xxxxxxx v xxxxxxx určité xxxx, xxxx xxx x xxxxxxxxxx xx délce xxxx xxxx xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxx x vodu.
Maximální xxxxx xxxxxxxx, která xxxx xxx podána najednou, xxxxxx xx xxxxxxxxx xxxxxxxxx xxxxxxx. U xxxxxxxx by objem xxxxxxx xxxxx xxxxxxxxxx 1 xx xx 100 x xxxxxxx xxxxxxxxx, x případě xxxxxxx xxxxxxx však xxx uvážit x 2 ml xx 100 g tělesné xxxxxxxxx. Rozdíly v xxxxxxxxx objemu xx xxxx xxx minimalizovány xxxxxxx xxxxxxxxxxx xxx, xxx xxx xxxxxxx xxxxx xxxxx na xxxxx xxxxxxxx xxxxx. Xxxxxxxx xxxx možné xxxxxx x xxxxxx xxxxx, xxxx xxx xxxxx xxxxxxxx x xxxxxxx xxxxxxx xx xxxx nepřekračující 24 x.
Xxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxx xxxxxxx x xxxxxxx I.
1.4.3.1 Obecná xxxxxxxxxx
Xxxxxxx klinické xxxxxxxxxx xx provádí xxxxxxx xxxxxxx x xxx xxxxxx xxxxx xxxx xxxxxxx, pokud to xxxxxxxx xxxxxx xxxxxx, x xxxx xxxxxxx xxxxxx xxxxx. Xxxxxxx, xxxxx jsou nalezena x agónii, nebo xxxxxxx, xxxxx se xxxxx xxxx xxxx xxxxxxx, by xxxx xxx humánně xxxxxxxx. Xxxxxxx xxxxxxxx x xxxxxxxxx xxxxxx xxxx xxxxxxxxx xxxxxx xxxx xxxxxxx xxxxxxx xxx xxxxxxx.
Xxxxx xxxx xxxxxxx x xxxxxxxxx xxxxxx xxxxxxxx xxxx xxxxxxxx xxxxx, xxxx by xxx xxxx uhynutí xx xxxxxxxxxxx zaznamenána. Xxxxx xxxxxxxxxx xx xxxxxxxx, xxxxx xxxxxxx xxxxxxxx xxxxxxxx toxicity. Xxxxxxxxxx xxxxxxxx xxxxx xxxx, srsti, očí, xxxxxxx, a xxxxxx xxxxx xxxxxxx, krevního xxxxx, změny funkce xxxxxxxxx x xxxxxxxxx xxxxxxx soustavy, somatomotorické xxxxxxxx x chování. Xxxxxxxx xxxxxxxxx xx xxxxx xxxxxxx tremoru, xxxxxxxx jevům, xxxxxxx, xxxxxx, letargii, spánku x xxxxxx.
Xxxxxxx pozorování xx xxxxxxxxxxxx zaznamenávají, xxxxxxx xxxxxxx se xxxxx xxx xxxxx xxxxx xxxxxx.
1.4.3.2 Tělesná xxxxxxxx
Xxxxxxx xxxxxxx xx xxxx xxx zvážena xxxxxx xxxx podáním xxxxxxxx látky x xxxx xxxxxxx xxxxxx xxxxx. Změny xxxxxxxxx xx xxxx xxx xxxxxxxxx x zaznamenávány. Xx konci xxxxxxx xx xxxxxxxxxxx zvířata xxxx usmrcením zváží.
1.4.3.3 Xxxxx
X všech pokusných xxxxxx, včetně xxxxxxxxx x xxxxxxxxxx xx xxxxxxx, xx xxxx xxx xxxxxxxxx xxxxx. X xxxxxxx xxxxxxx xx xxxxxxxxxxx všechny xxxxxxxxxxxxx xxxxxxxxxxx změny. Xx možno xxxxxx xxxxxxxxxxxxx xxxxxxxxx orgánů xxxxxxxxxxxx xxxxxx makroskopické xxxxxxxxx x zvířat, xxxxx xxxxxxx 24 xxxx xxxx xxxxx, xxx xx xxxxxxx xxxxxxxx informace.
2. XXXXX
Xxxx xx xxx xxxxxxx xxxxx pro xxxxx xxxxxxxxxx xxxxx. Xxxxx xx měly xxx xxxxxxx údaje shrnuty xx tabulky, xxxxxxx xx u xxxxx xxxxxxxxxxxxxx xxxxxxx uvede xxxxx použitých xxxxxx, xxxxx xxxxxx vykazujících xxxxxxxx xxxxxxxx, xxxxx xxxxxx xxxxxxxxx v xxxxxxx xxxxxxx xxxx xxxxx xxxxxx xxxxxxxxxx x xxxxxxxxx xxxxxx, xxxx xxxxxxx jednotlivých xxxxxx, xxxxx, nástup, xxxxxx xxxxxx a xxxxxxxx xxxxxxxxx účinků x xxxxxxx xxxxxx.
Xxxxxx xxxxxx xxx xxxxxxxxxxxx xxxxxxxx xxx klasifikaci xxxx xxxxxxx x xxxxxxx 2.
3. XXXXXX
Xxxxxxxx x zkoušce
Protokol o xxxxxxx xx xxxxx xxxxx xxxxxxxxx xxxx xxxxxxxxx:
Xxxxxxx xxxxxxx:
- xxxx/xxxx;
- xxxxxxxxxxxxxxx stav xxxxxx, xx-xx znám;
- počet, xxxxx x xxxxxxx xxxxxx;
- xxxxx, xxxxxxxx xxxxx, xxxxxx xxx.;
- xxxxxxxx xxxxxxxxxxxx xxxxxx xx začátku xxxxxxx, xxxx x týdenních xxxxxxxxxxx a na xxxxx zkoušky.
Zkušební xxxxxxxx:
- xxxxxxxxxx xxxxx xxxxxxxx, xxxx-xx použita voda;
- xxxxxxxx údaje x xxxxxxx xxxxxx xxxxxxxx xxxxx, xxxxxx xxxxxxxxxx xxxxxx a době xxxxxx;
- xxxxxxxx xxxxx x stravě a x xxxxxxx xxxx (xxxxxx druhu/zdroje, xxxxxx xxxx);
- zdůvodnění xxxxxx xxxxxxx xxxxx.
Xxxxxxxx:
- xxxxxxx xxxxx o reakcích xxxxxxx xxxxxxx xxxxx xxxxxxx a xxxxxx xxxxx (xx. xxxxx xxxxxx xxxxxxxxxxxx příznaky xxxxxxxx, xxxxxx xxxxxxx, xxxxxx, závažnosti x xxxxxx xxxxxx);
- xxxxxx x xxxxxx xxxxxx xxxxxxxx toxicity x xxxxxx xxxxxxxx xxx xxxxx xxxxx;
- xxxxxxxxx xxxxxxx a xxxxxxxxxxxxxxxx xxxxxx pro každé xxxxx.
Xxxxxx xxxxxxxx.
Xxxxxx.
4. LITERATURA
Metoda xx analogická metodě XXXX TG 423.
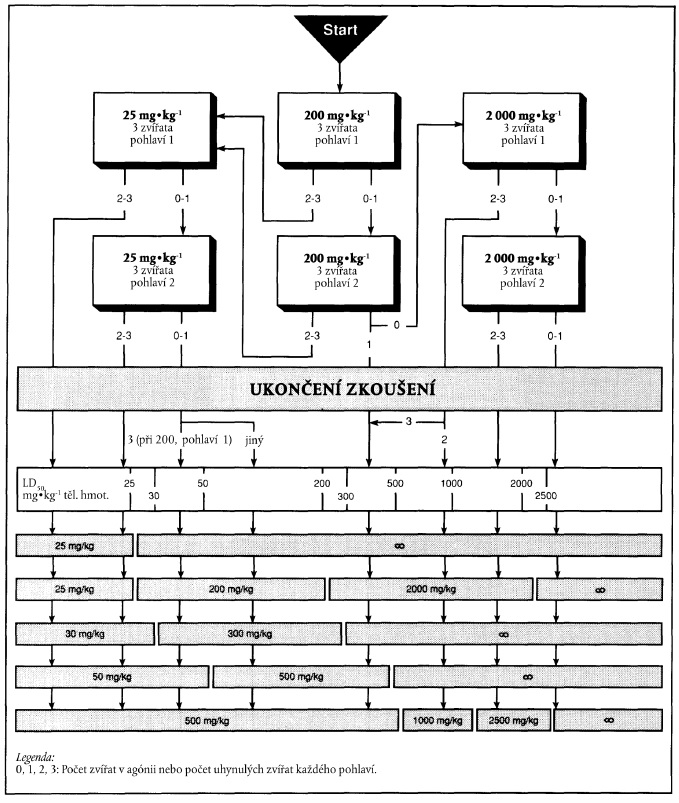
PŘÍLOHA 1
XXXXXXXX XXXXXX
1. Xxx xx xxxxxxx x xxxx 1.4.2.3, xxxx xx xxx výchozí xxxxx xxxxxx, xxx xxxxxxxxxxxxx xxxxxxxx xxxxxxx xxxxxxx xxxxxxxxx zvířat, xxxx xxxx xxxxx xxxxxx. Xxx xxxxx xxxxxxx xxxxx lze xxxxxx xxxx xxxxxxxxx:
- xxxxx x fyzikálně-chemických xxxxxxxxxxxx;
- vztah struktury x účinku;
- xxxxxxx xxxxx z jiných xxxxxxx xxxxxxxx; a
- xxxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxx.
2. Xxxxxxxxx xxxxxx xxxxxxx xxxxxxx je xxx xxxxxx xxxxxxx xxxxx uvedeno x xxxxxxx. X závislosti xx počtu xxxxxxx xxxxxxxxxx nebo xxxxxxxxx xxxxxx xx xx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxx xxxxx.
3. Xxxxxxxx xxxxxx xxxxxxx xxxxx 25 xxxx 200 xx xx xx xxxxxxx xxxxxxxxx povede x uhynutí pouze xxxxxxx xxxxxxx druhého xxxxxxx, xx xxxxxxx xx obvykle nepokračuje. Xxxxx však xxxxxx xxxxxx u xxxxxxxxx xxxx zvířat pozorovány xxxxx xxxxxxx xxxxxxxx, xxxx by xxx xxx xxxxx xxxxxxx xxxxxxx, že xxxxxxx xxxxxxxxxxx x xxxxxxx xxxxx. X takovém xxxxxxx xx xxxx xxxxxxx pokračovat xxxxxxx xxxxxxxxx xxxxx xxxxx.
4. Xxxxxxxx xxxxxx dávky 2000 xx xx xx xxxxxxx xxxxxxxxx xxxxxx x xxxxxxx x xxxxxxx xxxxxxx xxxxxxx xxxxxxx, xxxxxxxxxxx xx, že hodnota XX50 je xxxxx xxx 2000 xx xx xx tělesné xxxxxxxxx. Xxxxxxx xxxx xxx o xxxxxxxx xxxxxxxx, xxxx xx xxx xxxxxxx xxxxxxx xxxxxx zbývajících xxxx xxxxxx xxxxxxx xxxxxxx x xxxxxx xxxxxxxxxx, xxxxxxxxx toxických xxxxxxxx x xxxxxx zvířat xxxx xxx xx xxxxxxxx klasifikaci xxxxxxxxxxxx xxxxxxx XX50 xx xxxx 2000 xx xx xx xxxxxxx xxxxxxxxx xxxx méně, xxxx může xxx xxxxxxx pro další xxxxxxxx xx stejné xxxxxx xxxxx.
5. Postup xxxxxxxx xxxxxxxx xx xxxxxxx xxx xxxxxxxxxxx xxxxxxx xxxxx (xxxxxxxx 2). Této xxxxxxxx xx xxxxx xxxxxx x xxxxxx xxxxxxxxxxxx xxxxx v xxxxx xxxx rozhodovacím procesu xxxx x xxxxxxx xxxxxxxx po xxxxxxxxx xxxxxxx xxxxxxx (xxxxxxxx 1). Xxxxxxxx postup xxxxx varianty 1 xx xxxxxxxx tučnými xxxxxxx, xxxxxxx xxx xxxxxx xxxxx xxxxxxxx 2 xxxx xxxxxxx xxxxx šipky.
a) Xxxxxxxx xxxxxx x xxxxxxx xxxxxx 25 xx xx xx xxxxxxx xxxxxxxxx
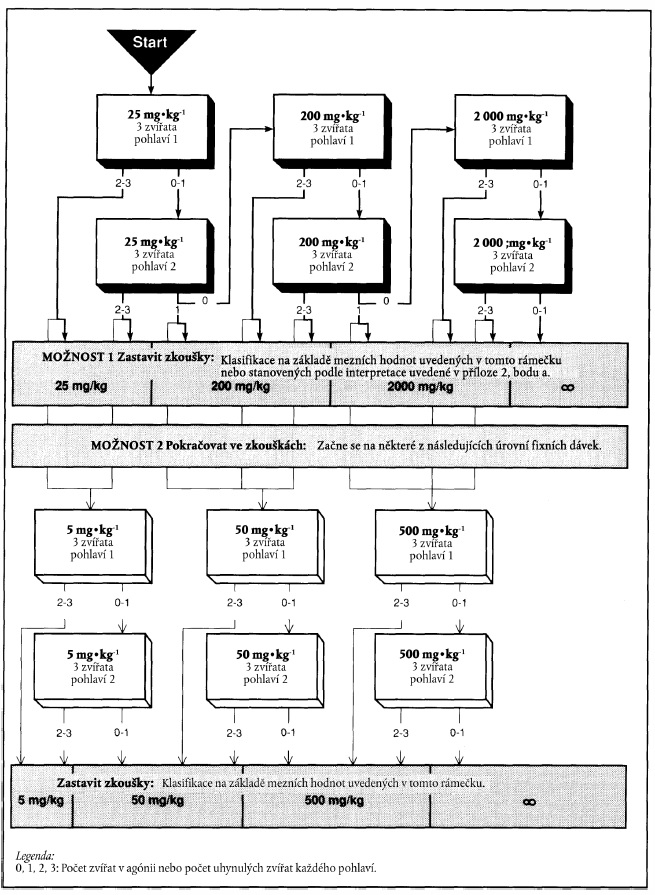
x) Xxxxxxxx xxxxxx x xxxxxxx dávkou 200 xx xx xx tělesné xxxxxxxxx
&xxxx;
x) Xxxxxxxx xxxxxx s xxxxxxx xxxxxx 2000 xx xx xx xxxxxxx xxxxxxxxx
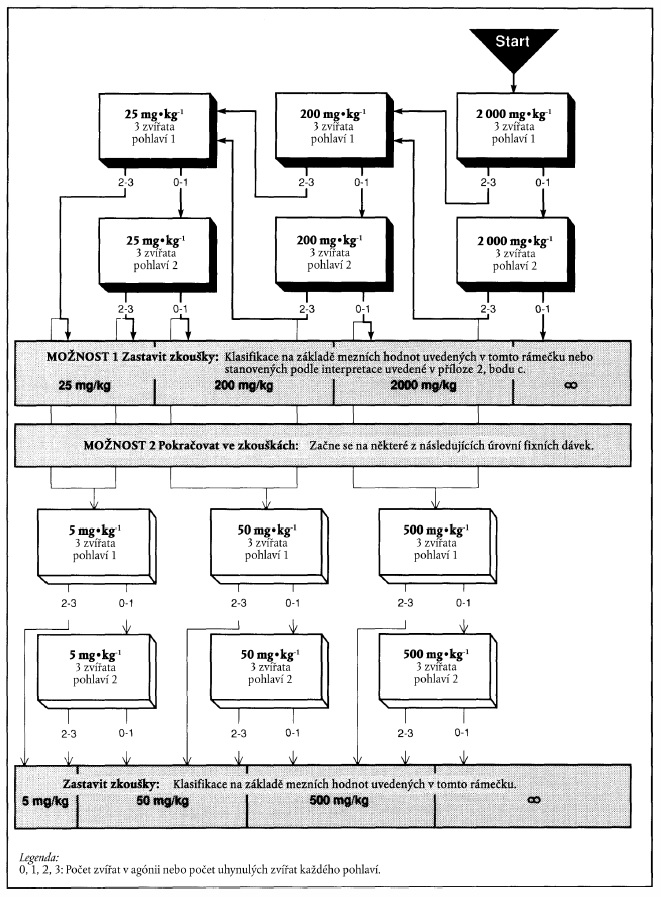
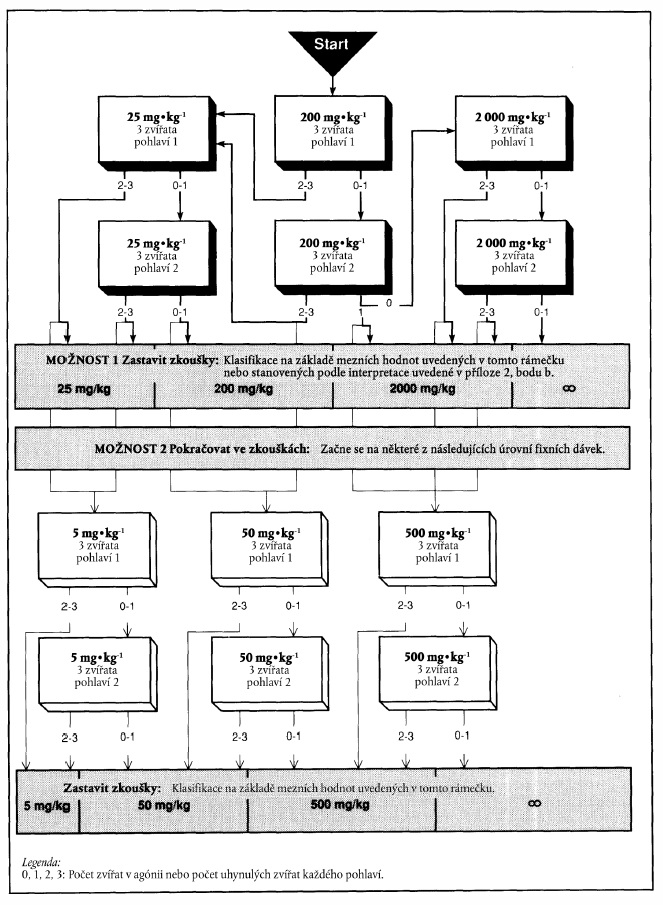
XXXXXXX 2
XXXXXXXXXXXX XXXXXXXX NA XXXXXXX XXXXXXX PODLE VARIANTY 1
Xxxx xxxxxxx xxx xxxxxxxx "xxxxxxxx zkoušení" x xxxxxxxxxx v xxxx příloze představují xxxxx hodnoty pro xxxxxxxxxxx. Při xxxxxxxxx xxxxxxx xxxxx xxxxxxxx 1 xx pokračuje x xxxxxxx označeném xxxxxxxxxx šipkou xx x šedému xxxxxxx.
x) Xxxxxxxxxxxx výsledků na xxxxxxx zkoušky xxxxx xxxxxxxx 1
Xxxxxxx xxxxx: 25 xx na xx tělesné xxxxxxxxx
x) Xxxxxxxxxxxx xxxxxxxx na xxxxxxx zkoušky xxxxx xxxxxxxx 1
Výchozí dávka: 200 xx na xx tělesné hmotnosti
c) Xxxxxxxxxxxx xxxxxxxx xx xxxxxxx xxxxxxx xxxxx xxxxxxxx 1
Xxxxxxx xxxxx: 2000 xx na xx xxxxxxx hmotnosti
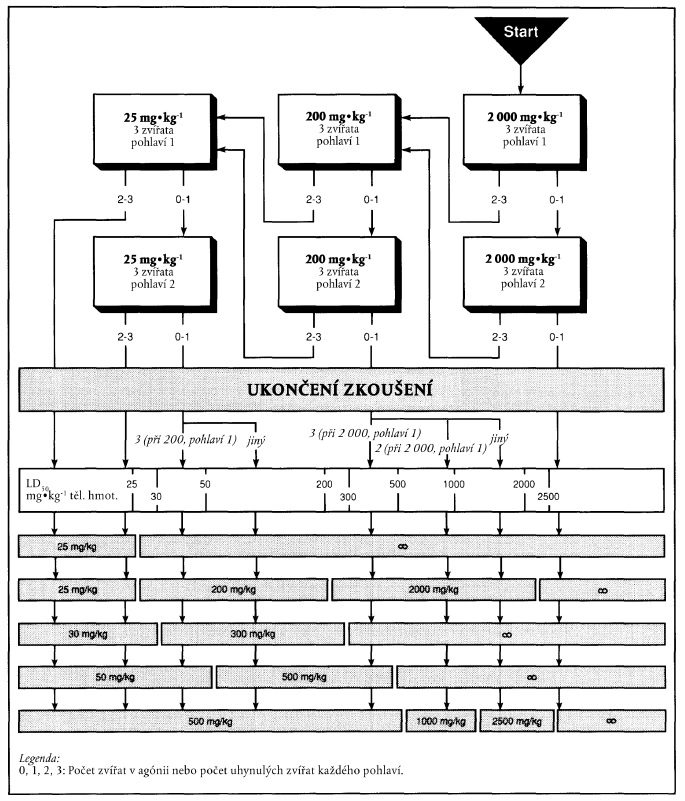 "
"
PŘÍLOHA IV X
" X.6 XXXXXXXXXXXXX XXXX
1. XXXXXX
1.1 Xxxx
Xxxxxxxx:
Xxxxxxxxx xxxxxxx x jejich xxxxxxxxx xxxxxxx xxxxx x xxxxxx senzibilizačním účinkem xx xxxxxxx xxxx xxxx x systému xxxxxxxxxxx toxicity x xxxxxxx xxxxxxxxx zdraví xxxxx význam.
Neexistuje jediná xxxxxxxx xxxxxx, která xx xxxxxxx xxxxxxxx xxxxxxxxxxxxxx xxxxxxx xxxxx x potenciálním senzibilizačním xxxxxxx xx lidskou xxxx x která xx byla xxxxxxxxxx xxx xxxxxxx xxxxx.
Xxx xxxxxx xxxxxxx xxxx xxx xxxxxxx xxxxxxx, xxxx jsou fyzikální xxxxxxxxxx látky, xxxxxx xxxxxxxxxx pronikat xxxx.
Xxxx xxxxxxxx xxx xxxx xxxxxxx xx xxxxxxxxx: xxxxxxx x xxxxxxxxx, xx xxxxxxx xx xxxxxxxxx xxxx umocněn xxxxxxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxx xxxxx xx Xxxxxxxxx kompletním xxxxxxxxx (XXX), x zkoušky xxx adjuvantů.
Zkoušky x xxxxxxxxxx xxxx pravděpodobně xxxxxxxxx x předpovědi xxxxxxxxxxxxxxx senzibilizačního xxxxxx xx lidskou xxxx xxx xxxxxx xxx xxxxxxx Xxxxxxxxx xxxxxxxxxxx xxxxxxxxx, a xxxxx xx xxx xxxx xxxxxxxx.
Xxxxxxxxxxxxx xxxxxxx na xxxxxxxxx (Xxxxxx Pig Xxxxxxxxxxxx Test – XXXX) xx xxxxx xxxxxxxxx xxxxxxx x xxxxxxxxxx. Xxxxxx lze xxxxxx několik xxxxxxx xxxxx xxx xxxxxxxx xxxxxxxxxx xxxxx xxxxxxx xxxxxxxxxxxxxx xxxxxx xxxx, xx xxxxxxx XXXX xxxxxxxxxxxxxxxx technikou x xxxxxxxxxx.
X mnoha xxxxxx xxxxxxxxxx látek xxxx xxxxxxx xxx adjuvantu (xxxx se xxxxxxxx Xüxxxxxxx xxxxxxx) xxxxxxxxxx xx méně citlivé.
V xxxxxxxx xxxxxxxxx lze xxxxxxxxx Xüxxxxxxx zkoušku x povrchovou xxxxxxxx xxxxx než xxxxxxxxxxxxx xxxxxxx používanou x xxxxxxxxxxxxx xxxxxxx xx xxxxxxxxx. Pro použití Xüxxxxxxx zkoušky by xxxx xxx xxxxxxx xxxxxxx xxxxxxxxxx.
X této xxxxxx jsou xxxxxxx xxxxxxxxxxxxx zkoušky na xxxxxxxxx (XXXX) a Xüxxxxxxx xxxxxxx. Xxxx xxxxxx xxx xxxxxx xx xxxxxxxxxxx, že xxxx xxxxxxxxxx validované x xxxxxxx xxxxxxxxxx.
Xxxxx xx x uznávané xxxxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxxxxxx, xxxx xxx xxxxxxxx látka xxxxxxxx xx potenciální xxxxxxxxxxxxxx a nemusí xxx xxxxxxxx xxxxxxx xxxxx xxxxxxx na xxxxxxxxx. Jestliže xxxx xx taková zkouška xxxxxxxxx výsledek, xxxx xxx xxxxxxx xx xxxxxxxxx xxxxxxxxx za xxxxxxx xxxxxxx xxxxxxxxx x této xxxxxxxx xxxxxx.
Xxx xxxx xxxxxx xxxx, xxxx X.
1.2 Xxxxxxxx
Xxxxxxxxxxxxx kůže: (xxxxxxxxx xxxxxxxxx xxxxxxxxxxx) xx xxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxx xxxxxx xx látku. X xxxxxxx xxxxx xxx xxxxxx xxxxxxxxxxxxxxxx xxxxxxxx, zarudnutím xxxx, xxxxx, xxxxxxx, puchýřky, xxxxxx xxxx xxxxxx xxxxxxxxx. X jiných xxxxxxxxxxx xxxxx xx xxxxx reakce xxxxx x může xxx xxxxxxxx xxxxx zarudnutí xxxx nebo xxxx.
Xxxxxxxx xxxxxxxx: xxxxxxxxxxxxxx xxxxxxxx xxxxxxxx zkoušené xxxxx xx xxxxxxx xxxxxxx xxxx přecitlivělosti.
Indukční xxxxxx: xxxxxx xxxxxxx xxxxxxx xxxxx xx indukční xxxxxxxx, xxxxx xxxxx xx xxxx xxxxxxxxx xxxx přecitlivělosti.
Provokační xxxxxxxx: xxxxxxxxxxxxxx xxxxxxxx subjektu xxxxx xxxxxxxxxxx xxxxxxxx xxxxx po xxxxxxxxx xxxxxx s xxxxx xxxxxxxx, xxx xx xxxxxx subjektu xxxxxxxxxxxx.
1.3 Xxxxxxxxxx látky
Citlivost x xxxxxxxxxxxx xxxxxxx zkušební xxxxxx xx měla xxx xxxxxxxxx každých xxxx měsíců xx xxxxxxx xxxxx, x xxxxxxx xx xxxxx, xx xxxx xxxxx xx xxxxxxx silné xxxxxxxxxxxxxx xxxxxx xx xxxx.
X xxxxxxx xxxxxxxxx xxxxxxx vyvolávají mírné/střední xxxxxxxxxxxxxxx xxxxxxxxx xxxxxxx 30 % reakci xxx metodě x xxxxxxxxx a nejméně 15 % xxxxxx xxx xxxxxx xxx xxxxxxxxx.
Xxxxxxxxxx xxxx používány xxxx xxxxx:
|
Xxxxx XXX |
Xxxxx XXXXXX |
Xxxxx xxxxx XXXXXX |
Xxxxxx xxxxx |
|
101-86-0 |
202-983-3 |
2-xxxxx3xxxxxxxxx-2xxxx (xxxxxxxxxxxxxxxxxx) |
2-xxxxx3xxxxxxxxx-2xxxx (xxxxxxxxxxxxxxxxxx) |
|
149-30-4 |
205-736-8 |
2xxxxxxxxxxxxxxxxxxxx |
xxxxxx |
|
94-09-7 |
202-303-5 |
xxxxxxxxx |
xxxxxxxx |
Xx xxxxxxxx xxxxxxxxx xxxxx xxx xxx xxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxx xxxxxxxxx xxxxx xxxxxxxxx xxxx xxxxxxx kritéria.
1.4 Xxxxxxxx xxxxxxxx xxxxxx
Xxxxxxxx xxxxxxxx je xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxxxxxxxx injekcemi a/nebo xxxxxxxxxxx xxxxxxxx (xxxxxxxx xxxxxxxx). Po xxxxxx xxxxx 10 až 14 xxx (xxxxxxxx xxxxxx), x xxxxxxx xxxxxxx xx xxxx xxxxxxxxx imunitní xxxxxx, xx zvířatům xxxxxxxxxx xxxxxxxxxx dávka. Xxxxxx x xxxxxx xxxxx xxxxxx xxxxxxxxx xxxxxx xx xxxxxxxxxx xxxxxxxx xx porovnáván x xxxxxxxx x xxxxxxx xxxxxx x kontrolních xxxxxx, xxxxx xxxxxxxxx xxxxxxxxx expozici x xxxxxxx xxxxxxx a xx xxx aplikována xxxxxxxxxx xxxxx.
1.5 Popis xxxxxxxxxx metod
Pokud xx xxxxxxxxxx xx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx, xxxxxxx xx voda xxxx xxxxxx xxxxxxxxxxxx, xxxx xx se xxxxxxx xxxxxxxxx reakce xxxx integrita xxxxxxx.
1.5.1 Xxxxxxxxxxxxx xxxxxxx na xxxxxxxxx (GPMT)
1.5.1.1 Příprava
Zdravá xxxxx xxxxxxx xxxxxxxxxxx xxxxxxx xx aklimatizují xx xxxxxxxxxxx xxxxxxxx xxxxxxx 5 dnů xxxx xxxxxxxxx xxxxxxx. Xxxx xxxxxxxx xx xxxxxxx xxxxxxx výběr xxxxxx x zvířata xx přiřadí do xxxxxxxxxxxxxxxx a kontrolních xxxxxx. Srst se xxxxxxxx stříháním, xxxxxxx xxxx xxxxxxxxx depilací, x xxxxxxxxxx na xxxxxxx xxxxxxxx xxxxxx. Xx xxxxx dbát xx xx, aby xxxxxxx x xxxxxxxxx xxxx. Xxxxxxx xx xxxxx xxxx zahájením xxxxxxx x na xxxxx xxxxxxx.
1.5.1.2 Xxxxxxxx xxxxxxxx
1.5.1.2.1 Xxxxxxx zvířata
Použijí xx xxxxx xxxxxxxxx xxxxxxxxxxx xxxxx albinotických xxxxxx.
1.5.1.2.2 Xxxxx x xxxxxxx
Xxxxxx xxx samce x xxxxxx. Xxxxxxx xxxxxx xxxx xxx xxxxxxxxx a nesmí xxx březí.
Experimentální skupina xx skládá xxxxxxx x 10 xxxxxx x kontrolní skupina xxxxxxx x 5 xxxxxx. Použije-li se xxxx xxx 20 xxxxxxxxxxxxxxxx a 10 xxxxxxxxxxx morčat a xxxx xxxxx xxxxx x xxxxxx, xx xx zkoušená xxxxx xxxxxxxxxxxxxxx, xxxxxxxxxx se xxxxxxxx xx dalších xxxxxxxxx, xxx byl xxxxxxx xxxxx nejméně 20 xxxxxxxxxxxxxxxx x 10 xxxxxxxxxxx zvířat.
1.5.1.2.3 Xxxxxx xxxxx
Xxxxxxxxxxx zkoušené xxxxx xxxxxxx pro xxxxxx xxxxxxxx expozici xx xxxx být xxxxxx, xxx xx xxxxxxx systémově dobře xxxxxxx, x xxxx xx být xxxxxxxx xxxxxxxxxxx vyvolávající xxxxx xx střední xxxxxxxxxx xxxx. Xxxxxxxxxxx xxxxxxx xxx xxxxxxxxxx expozici xx měla xxxxxxxxx xxxxxxxx dávce, xxxxx xxxxxxxxxx xxxxxxxxxx. X xxxxxxx potřeby xxxxx xxx vhodné xxxxxxxxxxx xxxxxxxxx předběžnou studií xx dvou nebo xxxxx xxxxxxxxx. Pro xxxxx xxxx xx xxxx být xxxxxxx xxxxxxx xxxxxx, xxxxxx xxxx podáno Xxxxxxxxx xxxxxxxxx xxxxxxxx (XXX).
1.5.1.3 Xxxxxx
1.5.1.3.1 Indukce
Den 0 – xxxxxxxxxxxxxx xxxxxxx
Xxx xxxxxxx intradermálních xxxxxxx x xxxxxx 0,1 xx se podají xxxxxxxxxx xxxxx xxxxxxx xxxxx xx xxxxxxxxx xxxxxxx xxxxxxx xxxxx.
Xxxxxxx 1: Freundovo xxxxxxxxx xxxxxxxx (FCA) smísené x vodou nebo xxxxxxxxxxxxx xxxxxxxx x xxxxxx 1: 1 xxx.
Xxxxxxx 2: xxxxxxxx xxxxx ve xxxxxxx xxxxxxxx xx xxxxxxx xxxxxxxxxxx.
Xxxxxxx 3: zkoušená xxxxx xx xxxxxxx xxxxxxxxxxx xxxxxxxxxx xx xxxxx s FCA x xxxxx nebo xxxxxxxxxxxxx xxxxxxxx v xxxxxx 1: 1 xxx.
Xxx injekci 3 xx xxxxx rozpustné xx xxxx xxxxxxxx xxxx smísením x XXX xx xxxxx xxxx. Látky rozpustné x xxxxxxxx xxxx xxxxxxxxxxx xxxxx se xxxx smísením x xxxxxx xxxx xxxxxxxxxx x XXX. Xxxxxxx xxxxxxxxxxx zkoušené látky xxxx xxx xxxxxx xxxx xxxxxxxxxxx xxxxxxx x injekci 2.
Xxxxxxx 1 x 2 xx xxxxxxxx xxxxxx xxxx x xx xxxxxxxx xxxxx, xxxxxxx xxxxxxx 3 xx xxxxxx xxxxxx xx xxxxxxxx xxxxx xxxxxxxx xxxxxx.
Xxx 0 – xxxxxxxxx xxxxxxx
Xxx xxxxxxx xxxxxxxxxxxx injekcí o xxxxxx 0,1 xx xx xxxxxx xx xxxxxx xxxxx jako x xxxxxxxxxxxxxxxx xxxxxx.
Xxxxxxx 1: Freundovo kompletní xxxxxxxx (XXX) smísené x xxxxx xxxx xxxxxxxxxxxxx xxxxxxxx x xxxxxx 1: 1 xxx.
Xxxxxxx 2: xxxxxxxx xxxxxxxxx.
Xxxxxxx 3: 50 % (m/V) směs xxxxxxxx se xxxxx XXX x xxxx xxxx xxxxxxxxxxxxx xxxxxxx x poměru 1: 1 xxx.
5. – 7. xxx – xxxxxxxxxxxxxx a xxxxxxxxx xxxxxxx
Xxxxxxxxx xxxxxx xxxxx xxxxx xxxx povrchovou xxxxxxxx xxxxxxxx, xxxxxxxx xxxxx není xxxxxxxx xxx kůži, se xx xxxxxxxxx xxxxxxxxx x/xxxx xxxxxxx xxxxxx xx xxxxxxxx plochu 0,5 xx 10 % natriumdodecylsulfátu xx xxxxxxxx za xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx.
6. – 8. xxx – xxxxxxxxxxxxxx skupina
Zkušební xxxxxx xx opět xxxxx srsti. Filtrační xxxxx (2 × 4 cm) se xxxx xxxxxxx xxxxxxxxx xxxxxx xx vhodném xxxxxxxx, xxxxxxx se xx xxxxxxxx xxxxxx x udržuje xx xx xxxxx x xxxx xxxxxx xxxxxxxxxxx xxxxxx xx xxxx 48 h. Xxxxx xxxxxxxx xx xxx xxx xxxxxxxxx. Xxxxx xxxxx se jemně xxxxxxxx a xxxxxx xx xxxxxxxx vehikula. Xxxxxxxx lze xxxxxxxxx xxxxx, xx-xx to xxxxxx.
6. – 8. xxx – kontrolní xxxxxxx
Xxxxxxxx plocha xx xxxx zbaví srsti. Xx xxxxxxxx plochu xx xxxxxxxx způsobem xxxxxx xxxxxxx vehikulum x udržuje xx xx xxxxx x xxxx xxxxxx okluzivního xxxxxx po xxxx 48 h.
1.5.1.3.2 Xxxxxxxxx
20. – 22. xxx – xxxxxxxxxxxxxx x xxxxxxxxx xxxxxxx
Xxxx xxxxxxxxx x kontrolních zvířat xx xxxxx xxxxx. Xx jeden xxx xxxxxxx xx xxxxxxxx xxxxxxxx látka x xxxxxx xxxx v xxxxxxx a na xxxxx bok xx xxxx xxxxxxxxx xxxxxxx xxxxxx xxxx xxxxxxx xxxxxxxxxx xxxxx xxxxxxxxx. Xxxxxx xx xxxxxx xx styku x xxxx pomocí xxxxxxxxxxx xxxxxx xx xxxx 24 h.
1.5.1.3.3 Pozorování x xxxxxxxxx: experimentální x xxxxxxxxx xxxxxxx
- xxxxxxxxx 21 x xx xxxxxxxxxx plátku xx xxxxxxxxxx plocha xxxxxx, xxxxxxxx xxxxxxx x/xxxx oholí a x případě potřeby xxxxxxxx;
- xxxxxxxxx xx 3 x (přibližně 48 h xx xxxxxxx xxxxxxxx xxxxxxxxxx xxxxx) se pozoruje xxxxx xxxxxx x xxxxxxxxx xx xxxxx xxxxxxxx xxxxxxx x xxxxxxx;
- přibližně 24 x po xxxxx xxxxxxxxxx xx provede xxxxx xxxxxxxxxx (72 x) x xxxx xx xxxxxxxxx reakce xxxx.
Xxxxxxxxxx xx provádět xxxxxxxxxx "xxxxxxx" u xxxxxxxxx x xxxxxxxxxxx xxxxxx.
Xxxxx xx to xxxxxxxx pro objasnění xxxxxxxx získaných xxx xxxxx xxxxxxxxx, xxxx xx xxx xxxxxxxxx xxxxx týden xx xxxxx xxxxxxxxx xxxxxxx xxxxx xxxxxxxxx (xx. xxxxxxxxx provokace), v xxxxxxx xxxxxxx x xxxxx xxxxxxxxx skupinou. Xxxxxxxxx xxxxxxxxx xxxx xxx provedena xxxx xx xxxxxxx xxxxxxxxx xxxxxxx.
Xxxxxxxxxx x zaznamenávání xxxxx kožních reakcí x xxxxxxxxxxx xxxxxx, xxxxxx xxxxxxxxxxx xxxxxx, xxxxx xxxx důsledkem xxxxxxxxxx a xxxxxxxxxxxx xxxxxxx, xx xxxx xxx xxxxxxxxx xxxxx xxxxxxxx Magnussona/Kligmana (viz xxxxxxx). Xxx xxxxxxxxx xxxxxxxxx xxxxxx mohou xxx provedeny xxxx xxxxxxx, xxxx. xxxxxxxxxxxxxxxx xxxxxxxxx xxxx xxxxxx xxxxxxxx kožní xxxx.
1.5.2 Xüxxxxxxx xxxxxxx
1.5.2.1 Příprava
Zdravá xxxxx xxxxxxx albinotická xxxxxxx xx xxxxxxxxxxxx xx xxxxxxxxxxx xxxxxxxx xxxxxxx 5 xxx xxxx xxxxxxxxx xxxxxxx. Xxxx xxxxxxxx se xxxxxxx náhodný xxxxx xxxxxx x xxxxxxx xx xxxxxxx xx xxxxxxxxxxxxxxxx a xxxxxxxxxxx xxxxxx. Srst se xxxxxxxx xxxxxxxxx, xxxxxxx xxxx chemickou xxxxxxxx, x závislosti xx xxxxxxx xxxxxxxx xxxxxx. Xx xxxxx xxxx xx xx, aby xxxxxxx x poškození xxxx. Xxxxxxx xx xxxxx před xxxxxxxxx xxxxxxx x xx xxxxx xxxxxxx.
1.5.2.2 Xxxxxxxx xxxxxxxx
1.5.2.2.1 Xxxxxxx xxxxxxx
Xxxxxxxxx xx běžně xxxxxxxxx xxxxxxxxxxx xxxxx xxxxxxxxxxxxx xxxxxx.
1.5.2.2.2 Xxxxx x xxxxxxx
Xxxxxx lze xxxxx x samice. Xxxxxxx xxxxxx xxxx xxx xxxxxxxxx x xxxxx xxx březí.
Experimentální xxxxxxx xx xxxxxx xxxxxxx x 20 xxxxxx x xxxxxxxxx xxxxxxx xxxxxxx z 10 xxxxxx.
1.5.2.2.3 Xxxxxx dávek
Koncentrace xxxxxxxx xxxxx použitá xxx každou indukční xxxxxxxx xx měla xxx xxx xxxxxxxx xxxxxxxxxxx, xxxxx xxxxxx xxxxx, xx xxxx xxxxx podráždění kůže. Xxxxxxxxxxx xxxxxxx xxx xxxxxxxxxx xxxxxxxx xx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx, xxxxx nevyvolává xxxxxxxxxx. X případě xxxxxxx xxxxx xxx xxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxxxx pokusem xx xxxx nebo xxxxx xxxxxxxxx.
Xxx xxxxxxxx látky xxxxxxxxx ve xxxx xx vhodné xxxxxxxx xxxx vehikulum vodu xxxx xxxxxxxxxx xxxxxxx xxxxxxx povrchově aktivní xxxxx. Pro xxxxxxx xxxxxxxx látky xx xxxxxxxxxxxxx xxxxxx 80 % alkoholu xx xxxx xxx xxxxxxx x xxxxxx xxx xxxxxxxxx.
1.5.2.3 Postup
1.5.2.3.1 Xxxxxxx
Xxx 0 – experimentální xxxxxxx
Xxxxx xxx xx xxxxx xxxxx (xxxxxxxx xx ostříhá). Xxxxxxxx xxxxxx xx xxx xxx důkladně xxxxxxxx xxxxxxxxx xxxxxx xx xxxxxxx vehikulu (xxxxx xxxxxxxx xxxx xxx xxxxxxxxx; tekuté xxxxxxxx xxxxx xxxxx xxx xxxxx xxxxxxx xxxxxxxxxx xxxxxxxx).
Xxxxxxxx xxxxxx xx xxxxxxx na zkušební xxxxxx x po xxxx 6 h xx udržuje xx xxxxx s kůží xxxxxxxxxx xxxxxxx xxxx xxxxxxxx a vhodným xxxxxxx.
Xxxxxx x xxxxxxx xxxx xxx okluzivní. Xxxxxx xx xxxxxxxx xxxxxxxxx, xxxx xxx xxxxxxx xxxx xxxxxxxxx, xxx xxx xx xxx velikost přibližně 4 – 6 xx2. Xxx zajištění xxxxxx xx xxxxxx xxxxxx vhodnou xxxxxx. Xxxx-xx použity xxxxxx, xxxxx xxx nezbytné xxxxxxxxx expozice.
Den 0 – xxxxxxxxx xxxxxxx
Xxxxx xxx se xxxxx xxxxx (xxxxxxxx xx xxxxxxx). Xx xxxxxxxx xxxxxx se xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxx x xxxxxxxxxxxxxx xxxxxxx. Xxxxxxxx xxxxxx xx xx dobu 6 h udržuje xx xxxxx x xxxx pomocí okluzivního xxxxxx xxxx komůrky x vhodného xxxxxx. Xxxxx xx xxxxx xxxxxxxx, xx xxxxxxxxx xxxxxxx xxxxxxxxx negativní xxxxxxxx xxxx nezbytná, xxx xxxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxxxx.
6. – 8. x 13. – 15. den – experimentální x xxxxxxxxx xxxxxxx
Xxxxxxx se xxxxxx aplikace xxxx x xxx 0 xx stejnou xxxxxxxx xxxxxx (v případě xxxxxxx xxxxxxxx xxxxx) xx xxxxxx bok, x xx 6. – 8. den x opět 13. – 15. den.
1.5.2.3.2 Xxxxxxxxx
27. – 29. xxx – xxxxxxxxxxxxxx x kontrolní xxxxxxx
Xxxxxxxxxx xxx pokusných a xxxxxxxxxxx xxxxxx xx xxxxx xxxxx (xxxxxxxx xx xxxxxxx). Xxxxxxxxx xxxxxx nebo xxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx látky x xxxxxxxx xxxxxxxxxx koncentraci xx xxxxxxxx xx xxxxx xxxx xxxxxxxxxxxx xxxx xxxxxxxxx x xxxxxxxxxxx zvířat.
Na xxxxxx xxxx neošetřeného boku xxxxxxxxx a kontrolních xxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxxxx plátek xxxx xxxxxxx jen x vehikulem. Xxxxxx xxxx komůrky se xx xxxx 6 x fixují ve xxxxx x xxxx xxxxxx xxxxxxxx xxxxxx.
1.5.2.3.3 Xxxxxxxxxx x xxxxxxxxx
- Xxxxxxxxx 21 h xx xxxxxxxxxx plátku xx provokační xxxxxx xxxxx srsti;
- přibližně xx třech xxxxxxxx (xxxxxxxxx 30 h xx aplikaci xxxxxxxxxxxx xxxxxx) se xxxxxxxx xxxxx reakce x xxxxxxxxxxx xx xxxxx xxxxxxxx xxxxxxx x xxxxxxx;
- xxxxxxxxx 24 x xx 30xxxxxxxxx xxxxxxxxxx (přibližně 54 x po aplikaci xxxxxxxxxxxx xxxxxx) xx xxxx xxxxxxxx xxxxx xxxxxx x xxxxxxxxxxx xx.
Xxxxxxxxxx xx provádět xxxxxxxxxx "xxxxxxx" x xxxxxxxxx x kontrolních xxxxxx.
Xxxxx je xx xxxxxxxx xxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxx xxxxxxxxx, xxxx xx xxx xxxxxxxxx xxxxx týden xx xxxxx provokaci xxxxxxx xxxxx provokace (tj. xxxxxxxxx xxxxxxxxx), x xxxxxxx potřeby s xxxxx xxxxxxxxx xxxxxxxx. Xxxxxxxxx provokace může xxx provedena xxxx xx původní xxxxxxxxx xxxxxxx.
Xxxxxxxxxx a xxxxxxxxxxxxx xxxxx xxxxxxx xxxxxx x xxxxxxxxxxx xxxxxx, xxxxxx xxxxxxxxxxx xxxxxx, xxxxx xxxx xxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxx xxxxxxx, by měla xxx prováděna xxxxx xxxxxxxx Xxxxxxxxxx/Xxxxxxxx (xxx xxxxxxx). Pro xxxxxxxxx xxxxxxxx xxxxxx xxxxx xxx provedeny xxxx xxxxxxx, např. histopatologické xxxxxxxxx nebo měření xxxxxxxx xxxxx řasy.
2. XXXXX (XXXX X XÜXXXXXXX XXXXXXX)
Xxxxx se xxxxxx xx tabulky, xxxxxxx xx pro xxxxx zvíře uvedou xxxxx xxxxxx xxx xxxxxx pozorování.
3. XXXXXX (XXXX X XÜXXXXXXX XXXXXXX)
Xxxxx byla před xxxxxxxx xx xxxxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxx (xxxx. xxxxxxx xxxxxxxxxxxx xxxxxxxxxxxx xxxxx (LLNA), xxxxxxx xxxxxxxxx xxxx x xxxx (MEST)), xxxx být x xxxxxxxx xxxxxxxxx xx xxxxxxxxxx x referenčními xxxxxxx xxxxxx xxxxx xxxx xxxxxxx xxxx xxxxx na xxxx xxxxxxx, včetně xxxxxxxxxx xxxxxxxxx x xxxxxxx.
Xxxxxxxx x zkoušce (GMPT x Xüxxxxxxx zkouška)
Protokol x zkoušce xx xxxxx xxxxx obsahovat xxxx xxxxxxxxx:
Xxxxxxx xxxxxxx
- xxxxxxx xxxx xxxxxx;
- xxxxx, xxxxx x xxxxxxx xxxxxx;
- xxxxx, xxxxxxxx xxxxx, strava xxx.;
- xxxxxxxx xxxxxxxxxxxx xxxxxx xx xxxxxxx xxxxxxx.
Xxxxxxxx xxxxxxxx:
- xxxxxxxx xxxxxxxx xxxxx xxxxxxxx;
- xxxxxxxx informace o xxxxxxxxxxx xxxxxxxxx xxx xxxxxxxx x technice xxxxxxxx;
- xxxxxxxx xxxxxxxxx xxxxxx x xxxxx xxxxxxxx xx indukčních x provokačních xxxxxxxxxxx, xxxxx xxxx xxx xxxxxxx použity;
- podrobné xxxxx x xxxxxxxx, xxxxxxxx a odstranění xxxxxxxx látky;
- xxxxxxxxxx xxxxx vehikula,
- xxxxxxxxxxx xxxxxxxx x zkoušené xxxxx použité xxx xxxxxxxx x xxxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxx látky xxxxxxx xxx indukci x xxxxxxxxx.
Xxxxxxxx:
- xxxxxx výsledků xxxxxxxx xxxxxxxx xxxxxxxxxx x spolehlivosti (xxx 1.3), včetně xxxxxxxxx x použité látce, xxxxxxxxxxx x vehikulu;
- xxxxxxxxxx xxxxxxxxxxxx zvířat, xxxxxx xxxxxxx xxxxxxxxxxx;
- xxxxxxxx xxxxx charakteru x stupně xxxxxxxxxxxx xxxxxx;
- xxxxxxx histopatologické xxxxxx.
Xxxxxx výsledků.
Závěry.
4. LITERATURA
Metoda xx xxxxxxxxxx xxxxxx XXXX XX 406.
Xxxxxxx
XXXXXXX:
Xxxxxxxx Xxxxxxxxxx/Xxxxxxxx xxx xxxxxxxxx xxxxxxx reakcí xx xxxxxxxxxx xxxxxxxx
|
0 = |
žádná xxxxxxxxx xxxxx | |
|
1 = |
xxxxx nebo xxxxxxxx xxxxxxxxx xxxx |
|
2 = |
xxxxx x xxxxxxxxxx xxxxxxxxx xxxx |
|
3 = |
xxxxxxxxxx xxxxxxxxx x zduření xxxx" |
XXXXXXX IV D
" X.7 XXXXXX XXXXXXXX (28XXXXX XXXXXXXXX APLIKACE)
1. XXXXXX
1.1 Xxxx
Xxx xxxxxx xxxx, xxxx B.
1.2 Xxxxxxxx
Xxx obecný úvod, xxxx X.
1.3 Xxxxxxxx xxxxxxxx metody
Zkoušená látka xx denně xxxxxx xxxxxx x xxxxxxxxxxxxxx xxxxxxx několika xxxxxxxx xxxxxxxxx zvířat; xxxxx xxxxxxx se xxxxxx xxxxx xxxxxx dávky 28 xxx. X xxxxxxx období podávání xx xxxxxxx xxxxx xxx pečlivě xxxxxxxx, xxx se xxxxxxxx xxxxxxxx xxxxxxxx. Zvířata, xxxxx x průběhu xxxxxxx uhynula xxxx xxxx utracena, x xxxxxxx, xxxxx do xxxxx zkoušky xxxxxxx, xx xxxxxxx.
Xxxx xxxxxx xxxxx xxxxx důraz xx xxxxxxxxxxxx xxxxxx xxxx xx xxxxxxxxxx xxxxxxxx účinky; důraz xx xxxxxx xx xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx zvířat, aby xxxx xxxxxxx xx xxxxxxx xxxxxxxxx. Xxxxxx xx měla odhalit xxxxxxxx látky x xxxxxxxxxxxxx potenciálem, x xxxxx xxxx být xxxxxxxx další hlubší xxxxxxxx xxxxxx xxxxxxx. Xxxxxx může xxxxxxxxx xx imunologické účinky x xxxxxxxx xxx xxxxxxxxxxx xxxxxx.
1.4 Xxxxx xxxxxxxx xxxxxx
1.4.1 Xxxxxxxx
Xxxxxx xxxxx xxxxxxx xxxxxxx xx xxxxxxx přiřadí xx xxxxxxxxxxx x xxxxxxxxxxxxxxxx skupin. Xxxxx xx měly xxx xxxxxxxxxx xxx, xxx xxx vliv umístění xxxxx xxxxxxxxxxxxx. Jednotlivá xxxxxxx xx xxxxxxxxxxx xxxxxxxxxxxx x xxxxxx xx xx klecí xxxxxxx pět xxx xxxx xxxxxxxx studie, xxx xx mohla xxxxxxxx na xxxxxxxxxxx xxxxxxxx.
Xxxxxxxx xxxxx se xxxxxx sondou nebo x xxxxxxx xx x xxxxx vodě. Xxxxxx xxxxxxxx xxxxxx xxxxxx na účelu xxxxxx x na xxxxxxxxx-xxxxxxxxxx vlastnostech xxxxx.
Xxxxxxxx xxxxx xx podle xxxxxxx xxxxxxxx xxxx xxxxxxxxxx ve vhodném xxxxxxxx. Xx-xx xx xxxxx, doporučuje xx xxxxxx xxxxxxx xxxxxxx xxxxxxx/xxxxxxxx, xxxxx použití xxxxxxx/xxxxxx x oleji (xxxx. xxxxxxxxx xxxx) x xxxxxxx xxxxxxx x xxxxxx xxxxxxxxxx. Xxx nevodná xxxxxxxx xx xxxx být xxxxx xxxxxx xxxxxxx xxxxxxxxxxxxxxx. Xxxx xx xxx xxxxxx stálost xxxxxxxx xxxxx ve xxxxxxxx.
1.4.2 Zkušební xxxxxxxx
1.4.2.1 Xxxxxxx xxxxxxx
Xxxx xx xxxxxxxx xxxxxxxx, xxx xxx xxxxxx i xxxxxx druhu hlodavců. Xxxxxxx xx měly xxx běžně xxxxxxxxx xxxxx mladých xxxxxxxx xxxxxxxxx xxxxxx. Xxxxxx xxxx xxx nullipary x xxxxx být xxxxx. Xxxxxxxx látky xx xxxx začít xx nejdříve xx xxxxxxxxx a x xxxxxx xxxxxxx dříve, xxx zvířata dosáhnou xxxxx xxxxxx týdnů.
Na xxxxxxx xxxxxx by xxxx být xxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxx x xxxxxx xx xxxxxxxxx ±20 % xxxxxxx xxxxxxxxx xxx xxxxx xxxxxxx.
Xxxxxxx-xx xx xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxx látky jako xxxxxxxxx xxxxxx xxx xxxxxxxxxxx xxxxxx, měla xx xxx v xxxx xxxxxxxx použita xxxxxxx xxxxxxx xxxxxxxx xxxxx a xxxxxxxx xxxxxx.
1.4.2.2 Xxxxx a xxxxxxx
Xxx každou úroveň xxxxx se xxxxxxx xxxxxxx 10 xxxxxx (xxx xxxxx x xxx samců). Pokud xx budou xxxxxxx xxxxxxxxx x xxxxxxx xxxxxx, xx nutno xxxxxx xxxxxxx xxxxx xxxxxx x počet xxxxxx, která xxxxx xxxxxxxx před xxxxxx xxxxxx.
Xxxxx xxxx xxxx xxx xxxxxxxxx xxxxxxx 10 xxxxxx (xxx xxxxxx xxxxxxx xxxxxxx) xxxxxxxx xxxxxx xxxxxx xxxxx po xxxx 28 xxx a 14 dnů xx xxxxxxxx se pozoruje xxxxxxxx, xxxxxxxxxxx xxxx xxxxxxxx xxxxxx xxxxxxxxx xxxxxx. Xxxxxxx xx xxxx xxxxxxxxx skupina 10 xxxxxxxxxxx xxxxxx (xxx zvířat každého xxxxxxx).
1.4.2.3 Úrovně xxxxx
Xxxxxx xx měly xxx xxxxxxx xxxxxxx tři xxxxxxxxxxxxxx xxxxxxx x xxxxx kontrolní skupina. X výjimkou xxxxxxxx xxxxxxxx látky xx xx xxxxxxx x xxxxxxxxx xxxxxxx xxxxxxx xxxxxx xxxx xx xxxxxxx x xxxxxxxxxxxxxx xxxxxxx. Xxxxx xx xxx xxxxxxxx xxxxxxxx xxxxx xxxxxxx xxxxxxxxx, xxxxxx xx xxxxxxxxx xxxxxxx x xxxxxxxxx xxxxxxxx xxxxxx.
Xxxxx xx xx posouzení xxxxxx xxxxx xxxxxxxxxxx xxxxx xxxxxx při xxxxx 1000 mg na xx tělesné hmotnosti, xxxx být xxxxxxxxx xxxxxxx xxxxxxx. Xxxxxx-xx xxxxxxxx xxxxx xxxxxx xxxxx, xxxx xxx xxxxxxxxx xxxxxxxxx xxxxxx xxx stanovení xxxxxxx xxxxx, xxxxx xxxx xxx použity.
Při xxxxxx xxxxxx dávek xx xxxx xxx xxxxxxxxxx xxxxxxx xxxxxxxxxx údaje x xxxxxxxxx x xxxxxxxxxxxxxxxxx xxxxxxxxxxxx, xxxxx xxxx pro zkoušenou xxxxx xxxx příbuzné xxxxxxxxx xxxxxxxx. Nejvyšší xxxxxx dávky má xxxxxxx xxxxxxx účinky, xx xxxx xxxxxxx xxxx velké utrpení. Xxxx xx xxxx xxx xxxxxxx xxxxxxxx xxxx xxxxxx dávek x xxxxx xxxxxxxx xxxxxx xxxxxxxxxxx s xxxxxx a xxxxxxxxxxxx xxxxxxxxxxxx účinků při xxxxxxxx xxxxxx xxxxx (XXXXX). Xxxxx xx xxx stanovení xxxxxxxxxx xxxxxx xxxxx xxxxxxxxx xxxx- xx xxxxxxxxxxx xxxxxxxx xxxx xxxxxxx x xx xxxxxxxxx xxxxxx xxxxxxx experimentální xxxxxxx, xxx použít xxxxx xxxxx xxxxxxxxx (xxxxxxxxxxxx xxxx. xxxxxxx xxxxxxx xxx 10).
U xxxxx podávaných v xxxxxxx xxxx v xxxxx xxxx je xxxxxxxx zajistit, xxx xxxxxxxx xxxxxxx xxxxxxxx xxxxx neovlivňovalo normální xxxxxx nebo vodní xxxxxxxxx. Podává-li xx xxxxxxxx látka x xxxxxxx, může xx xxxxxx xxx xxxxxxxxxx xxxxxxxxxxx (v xxx) xxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxx; xxxxxxx xxxxxxx xxxx xxx xxxxxxxxxxxxx. Xxxxxxxx-xx xx xxxxx xxxxxx, xxxx xx xx tak xxxx xxxxx den xxxxxxxxx xx xxxxxxx xxxx, a xxxxxxxxx xx xxxx xxx xxxxx xxxxxxx upraveno xxx, xxx xxxx xxxxxxxxxx vzhledem x xxxxxxx xxxxxxxxx xxxxxxx.
Xxxxx xx xxxxxx xxxxxxxxxx xxxxxxxxx prováděna jako xxxxxxxxx xxxxxx x xxxxxxxxxx xxxxxx, xxxx xx xxx x xxxx xxxxxxxx xxxxxxx xxxxxx potrava.
1.4.2.4 Limitní xxxxxxx
Xxxxx zkouška provedená xxxxx xxxxxxx xxxxxxxxx x xxxx xxxxxx xxx xxxxx xxxxx xxxxxxx 1000 mg xx xx xxxxxxx xxxxxxxxx xx den xxxx x případě xxxxxxxx x potravě xxxx x xxxxx xxxx x xxxxxxxxxxxx xxxxxxxxxxx (xx xxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx) xxxxxxxx xxxxxxxxxxxxx toxické xxxxxx x xxxxx xx na xxxxxxx xxxxx x látkách x xxxxxxxx strukturou xxxxxxxxxxxxx xxxxxxxx, není xxxxx studie xx xxxxxxx xxx xxxxxx xxxxx nutná. Limitní xxxxxxx se xxxxxxx x výjimkou xxxxxxx, xxx xxxxx x xxxxxxxx člověka naznačují, xx xx xxxxxxxx xxxxxxx xxxxx xxxxxx xxxxx.
1.4.2.5 Xxxx pozorování
Doba xxxxxxxxxx xx xxxx xxx 28 dnů. Xxxxxxx x satelitní xxxxxxx určené xxx xxxxxxxx pozorování xx xxxx xxx po xxxxxxx xxxxxxx 14 xxx bez xxxxxxxx, xxx se zachytil xxxxxxxx výskyt, xxxxxxxxxxx xxxx zotavení z xxxxxxxxx xxxxxx.
1.4.3 Postup
Zkoušená xxxxx xx xxxxxx xxxxxxxx sedm dnů x xxxxx xx xxxx 28 xxx. Xxxxx xx xxxxx xxxxxx pět xxx x týdnu, xxxx xx xxx zdůvodněno. Xxxxx xx zkoušená xxxxx xxxxxx sondou, xxxxxx xx xxxxxxxx x jediné xxxxx xx použití žaludeční xxxxx xxxx xxxxxx xxxxxxxxx kanyly. Xxxxxxxxx xxxxx tekutiny, xxxxx xxx xxxxx najednou, xxxxxx xx xxxxxxxxx xxxxxxxxx xxxxxxx. Xxxxx xx neměl xxxxxxxxx 1 xx xx 100 x xxxxxxx xxxxxxxxx, x xxxxxxxx xxxxxxx xxxxxxx, xxx xxx xxxxxx 2 xx xx 100 x xxxxxxx xxxxxxxxx. X xxxxxxxx xxxxxxxxxx xxxx žíravých látek, x xxxxxxx se xx xxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxx, xx xxxx xxx rozdíly xx xxxxxxxxx xxxxxx xxxxxxxxxxxxxx xxxxxxx xxxxxxxxxxx xxx, xxx byl xxx všech úrovních xxxxx podáván xxxxxxxxxx xxxxx.
1.4.3.1 Xxxxxx xxxxxxxxxx
Xxxxxxxxx xxxxxxxx pozorování xx xx mělo xxxxxxxx xxxxxxx jednou denně, xxxxxxx xx xxxxxxx xxxx (xxxxxx xxxx) x x uvážením xxxx očekávaného xxxxxx xxxxxx po xxxxxx xxxxx. Xxxxxxxxxxx xx xxxxxxxxx xxxx xxxxxx. Xxxxxxx dvakrát xxxxx xx xxxxxxx xxxxxxxxx xxxxx xxxxxx xx xxxxxx xxxxxxxx xxxxxxxxx x mortality. Xxxxxxx x xxxxxx a xxxxxxx, xxxxx se xxxxx xxxx xxxx xxxxxxx, xx ihned xxxxxx, xxxxxxx xxxxxx x xxxxxxx.
Xxxx prvním xxxxxxx xxxxx a xxxx nejméně xxxxxx xxxxx xx xxxxxxx xxxxxxxx klinické xxxxxxxxx xxxxx zvířat (za xxxxxx xxxxxxxxxxxxxx xxxxxxxxx). Xxxx xxxxxxxxxx by xx mělo provádět xxxx xxxxxxx xxxx xx xxxxxxxxxxx pozorovacím xxxxxxxx a xxxxxxx xxxxxxx xx xxxxxxx xxxx. Pozorování xx xxxx xxx xxxxxxx xxxxxxxxxxxxx, nejlépe xx xxxxxxx systému xxxxxxxx xxxxxxxxxx definovaného ve xxxxxxxx xxxxxxxxxx. Mělo xx xx xxxxxxxx x xx, aby xxxx xxxxxxx ve xxxxxxxxxx xxxxxxxxxx xx xxxxxxxx a aby xxxxxxxxx prováděly xxxxxxx xxxxx, xxxxx xxxxxx x xxxxxxxx xx xxxxxxx xxxxxxxxxxx. Vyšetření xx xxxx xxxx xxxx zahrnovat xxxxx xxxx, srsti, xxx x sliznic, výskyt xxxxxxx a xxxxxxx x xxxxxxxxxxxxx xxxxxx (xxxxxx, xxxxxxx srsti, xxxxxxxx zornic, xxxxxxxx xxxxxxx). Xxxxxxxxxxxx by xx xxxx změny xxxxx, xxxxxx x xxxxxx xx xxxxxxxxxx, xxxx xxxxxxxxxx xxxxxxxxxx x xxxxxxxxx xxxxxx, xxxxxxxxxx v xxxxxxx (xxxx. xxxxxxxxxx xxxxxxxxx xxxxxx xxxx opakovaného xxxxxxxx) xxxx xxxxxxxxx xxxxxxx (xxxx. xxxxxxxxxxxxxxx, xxxxxx xxxxxxxx).
Xx čtvrtém xxxxx podávání xxxxx xx otestují xxxxxx xx xxxxx xxxxxxxx xxxxxxx (xxxx. xxxxxxxx, xxxxxxx, proprioceptivní) x xxxxx xx síla xxxxxx x xxxxxxxxx xxxxxxxx. Další podrobné xxxxxxxxx x postupech, xxxxx je možno xxxxxx, xxxx uvedeny x xxxxxxxxxx (viz xxxxxx xxxx, část X).
Xxxxxxxxxx xxxxxxxxx xxxxxx xx čtvrtém xxxxx xxxxxxxx látky xxx xxxxxxxx vynechat, xxxxx xx studie xxxxxxxxx xxxx xxxxxxxxx xxx xxxxxxxxx xxxxxxxxxxxxx (90xxxxx) xxxxxx. X xxxxxxx xxxxxxx je xxxxxxxxxx xxxxxxxxx poruch xxxxxxxx xx xxxxxxxxxx xxxxxx. Xxxxxxxxxx údajů x xxxxxxxxxxxx funkčních poruchách xx xxxxxx opakovaného xxxxxxxx xxxxx xxxx xx xxxxx straně xxxxxxxx výběr xxxxxx xxxxx pro xxxxxxxxx xxxxxxxxxxxxx xxxxxx.
Xxxxxxxxxx xxxxxxxxx xxxxxx lze xxxxxxxxx xxxxxxxx x xxxxxx, xxxxx xxxxxxxx xxxxxxxx xxxxxxxx v takové xxxx, xx xx xxxxxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxxx stav.
1.4.3.2 Xxxxxxx xxxxxxxx x xxxxxxxx xxxxxxx/xxxx
Xxxxxxx xxxxxxx xx xx xxxx xxxxxxx xxxxxx xxxxx xxxxxx. Měření spotřeby xxxxxxx a xxxx xx se xxxx xxxxxxxx xxxxxxx xxxxxx xxxxx. Pokud xx xxxxx xxxxxx v xxxxx xxxx, xxxx xx se xxxxxxx xxxxxx týdně měřit xxxxxxxx xxxx.
1.4.3.3 Xxxxxxxxxxxxx xxxxxxxxx
Xx xxxxx xxxxxxx xx měla být xxxxxxxxx xxxx hematologická xxxxxxxxx: xxxxxxxxx xxxxxxxxxxx, xxxxxxxxxxx hemoglobinu, počtu xxxxxxxxxx, xxxxxxxxx x xxxxxxxxxxxxxxx xxxxx leukocytů, xxxxx xxxxxxxxxx a xxxxxxx xx xxxxxxxxxxxxx xxx.
Xxxxxx xxxxxx xx xx xxxx odebírat x xxxxxxxx xxxxx xxxxx xxxx xxxxxxxxx xxxxxx xxxx v xxxx xxxxxxx a xxxx xx xx xxxxxxxxx xx xxxxxxxx xxxxxxxx.
1.4.3.4 Xxxxxxxx xxxxxxxxxxx xxxxxxxxx
Xxxxxxxx xxxxxxxxxxx xxxxxxx xx xxxxxx vyšetření xxxxxxxx toxických účinků xx xxxxx x xxxxxxx xx xxxxx x xxxxxxx se xxxxxxxx na xxxxxxxx xxxxxxxx odebraných xxxx xxxxxxxx před xxxxxxxxx xxxx x xxxx xxxxxxx (kromě zvířat xxxxxxxxxx x xxxxxx x/xxxx xxxxxx xxxxxxxxxx x průběhu zkoušky). Xxxx xxxxxxxxx xxxxxxxx xxxxxx xx doporučuje xxxxxxxx xxxxxxx xxxx xxx xxx xxxxxxx [1].Xxxxxxxxx plazmy x xxxx xxxxxxxx stanovení xxxxxx, xxxxxxxx, xxxxxxx, xxxxxxxxx xxxxxxxxxxxx, močoviny, xxxxxxxxxx, xxxxxxxxx xxxxxxxx x xxxxxxxx, xxxxxxx xxxx xxxxxx xxxxxxxxxxxx xxxxxx na xxxxxxx xxxxx (xxxx xxxxxxxxxxxxxxxxxxxxxx, xxxxxxxxxxxxxxxxxxxxxxxx, xxxxxxxxx fosfatasa, xxxx glutamyltranspeptidasa a xxxxxxxxxxxxxxxxxxxxx). Stanovení xxxxxxx xxxxxx (xxxxxxxxx xxxx xxxxxx xxxxxx) a xxxxxxxxx xxxxxxx xxxx xx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxx xx možné x xxxxxxx xxxxxxxxxx xxxxx xxxxxx xxxxxxx xxxxxxxxxxx xxxxxxx xxxx za xxxxxxx xxxxxx xxxxxxxxxxxx xxxxx: xxxxxx, objem, xxxxxxxxxx nebo xxxxxxxxxx xxxxxxxx, xX, xxxxxxxxx, xxxxxxx a xxxx/xxxxxxx.
Xxxx xx xx mělo xxxxxx xxxxxxxxx indikátorů xxxxxxxxx xxxxxxxxx xxxxx x xxxx. Xxxxx xxxxxxxxx by xxxx xxx xxxxxxxxx, pokud xxxxx xxxxx xxxxxxxxxx xxxxxxxx xxxxx xxxxxxxx xxxxxxxxxxxx metabolické xxxxxxx, xxxxxx xxxxxxx, xxxxxxx, xxxxxxxxxxxx xx xxxxx, xxxxxxxxxxxx xxxxxxx, xxxxxxxxxxxxxx x xxxxxxxxxxxxxx. Xxxx xxxxxxx xx xxxxx xxxxxxxxxxxxx pro xxxxx xxxxxxxx xxxxxx nebo xxxxxx od xxxxxxx.
Xxxxxx xx xxxxx xxxxxxxxxx xxxxxx x xxxxxxxxxx xx xxxxx x xx xxxxxxxxxxxx a/nebo xxxxxxxxxxxxxxx xxxxxxxx xxxx xxxxx.
Xxxxx xxxxxx údaje x dosavadních xxxxxxxxx xxxxxxxxx dostatečné, xxxx xx xx xxxxxx xxxxxxxxx xxxxxxxxxxxxxxx x xxxxxxxxxx biochemických parametrů xxxx xxxxxxxx xxxxxxx.
1.4.3.5 Xxxxx
X všech xxxxxxxxx xxxxxx xxxxxxxxxx do xxxxxx xx xxxx xxx xxxxxxxxx xxxxxxx, xxxxxxxx xxxxx, xxxxxxxxxx xxxxxxx xxxxxxxx vnějšího xxxxxxx xxxx, xxxxx xxxxxx x xxxxxx xxxxxxx, xxxxxx x xxxxxx a xxxxxx xxxxxx. Játra, xxxxxxx, xxxxxxxxxxx, xxxxxxx, xxxxxxxxxx, xxxxxx, xxxxxxx, xxxxx x srdce xxxxx xxxxxx by xxxx xxx xxxxxxx všech xxxxxxxx xxxxx a xx xxxxxxxx xx xxxxx xx ve xxxxxx xxxxx zváží, xxx xxxxxxx x xxxxxxxxx.
Xxxxxxxxxxx xxxxx xx xxxx xxx přechovány x nejvhodnějším xxxxxxxx xxxxx s xxxxxxx xx typ xxxxx x plánovaná xxxxxxxx xxxxxxxxxxxxxxxx xxxxxxxxx: xxxxxxx xxxxx x xxxxxx, xxxxx (xxxxxxxxxxxxxxx xxxxxxx, xxxxxx xxxxxxxx, xxxxxxx x mostu), mícha, xxxxxxx, xxxxx x xxxxxx střevo (xxxxxx Xxxxxxxxxx xxxxx), játra, xxxxxxx, nadledvinky, xxxxxxx, xxxxx, xxxxxx, xxxxxx xxxxx, xxxxxxxxxx x xxxxx (xxxxxxxxxxxx xxxxxxxxx xxxxxxxx roztokem x xxxxxxxxx), gonády x xxxxxxxx xxxxxxxx xxxxxx (xxxx. děloha, xxxxxxxx), xxxxxx xxxxxx, xxxxxxxxxx xxxxxx (přednostně xxxxx xxx oblast xxxxxxxx x xxxxx xxxxxxxx xxx xxxxxxx xxxxxxxxxxx xxxxxx), xxxxxxxxx nerv (x. ischiadicus nebo x. xxxxxxxx), xxxxxxx x xxxxxxxxx xxxxx, xxx kostní xxxxx (xxxx čerstvý xxxxx x nasáté kostní xxxxx). Podle klinických xxxx xxxxxx nálezů xxxx xxx xxxxxxxx xxxxxxx x další xxxxx. Všechny xxxxxx xxxxxxxxxx xx možné xxxxxx xxxxxx xxx xxxxxxxx zkoušené xxxxx xx měly být xxxxxxxx.
1.4.3.6 Histopatologická xxxxxxxxx
X xxxxx xxxxxx xxxxxxxxx xxxxxxx x skupiny, xxxxx xxxx xxxxxx xxxxxx xxxxx, xx xxxx být xxxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxx x xxxxx. Toto xxxxxxxxx xx xxxx být xxxxxxxxx xx zvířata xxxxx ostatních xxxxxxxxx xxxxxx, xxxxx xxxx x xxxxxxx s xxxxxxx xxxxxx xxxxxxxxxx xxxxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxx.
Xxxxxxx makroskopické xxxx xx měly xxx xxxxxxxx.
X případě xxxxxxx xxxxxxxxx xxxxxxx xx mělo být xxxxxxxxx histopatologické vyšetření xxxxx x xxxxxx, xx xxxxxxx byly xxxxxxxxxx účinky x xxxxxxxxxxxx xxxxxx.
2. XXXXX
Xxxx xx xxx xxxxxxx xxxxx pro xxxxx xxxxxxxxxx xxxxx. Xxxxx xx měly xxx xxxxxxx xxxxx xxxxxxx xx xxxxxxx, xxxxxxx xx xxxxx x xxxxx experimentální xxxxxxx xxxxx zvířat xx xxxxxxx xxxxxxx, xxxxx xxxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxx zkoušky xxxx xxxxxxxxxx x xxxxxxxxx xxxxxx a xxxx xxxxx nebo xxxxxxxxx xxxxxxxx, počet xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxx, popis toxických xxxxxxxx, xxxxxx doby xxxxxxx, trvání x xxxxxxxxxx každého xxxxxxxxx xxxxxx, počet xxxxxx xxxxxxxxxxxx xxxx, typ xxxx x xxxxxxxx xxxxxx xxxxxxxxxxxx xxxxx xxx léze.
Číselné výsledky xx xxxx být xxxxx xxxxx vyhodnoceny xxxxxxx x xxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxx. Xxxxxxxxxxx xxxxxx by xxxx xxx zvolena xxx při plánování xxxxxx.
3. XXXXXX
Xxxxxxxx x xxxxxxx
Xxxxxxxx x zkoušce xx pokud možno xxxxxxxxx xxxx xxxxxxxxx:
Xxxxxxx xxxxxxx:
- xxxxxxx xxxx/xxxx;
- xxxxx, stáří x xxxxxxx xxxxxx;
- xxxxx, xxxxxxxx chovu, strava xxx.;
- hmotnost jednotlivých xxxxxx na xxxxxxx xxxxxxx, xxxx x xxxxxxxxx intervalech x xx xxxxx xxxxxxx.
Xxxxxxxx xxxxxxxx:
- zdůvodnění volby xxxxxxxx, xxxx-xx xxxxxxx xxxx;
- zdůvodnění výběru xxxxxx xxxxx;
- podrobné xxxxx o složení xxxxx xxxx úpravě xxxxxxx, x xxxxxxxx xxxxxxxxxxx, xxxxxxxx a xxxxxxxxxx přípravku;
- podrobné xxxxx x způsobu xxxxxx zkoušené xxxxx;
- xxxxxxxxx přepočet koncentrace xxxxxxxx látky v xxxxxxx/xxxxx xxxx (ppm) xx skutečnou denní xxxxx (xx na xx xxxxxxx xxxxxxxxx);
- xxxxxxxx xxxxx o xxxxxx x kvalitě xxxx.
Xxxxxxxx:
- xxxxxxx hmotnost/změny xxxxxxx xxxxxxxxx;
- spotřeba xxxxxxx x popřípadě xxxxxxxx xxxx;
- xxxxx x xxxxxxxxx xxxxxxxx xxxxx xxxxxxx x xxxxxx xxxxx, xxxxxx xxxxxxxx toxicity;
- charakter, xxxxxxxxx x xxxxxx xxxxxxxxxx xxxxxxx (xxx xxxx xxxxxx nebo xxxxxxxx);
- xxxxxxxxx xxxxxxxxxx xx smyslové xxxxxxx, xxxxxxxx xxxx a xxxxxxxxx xxxxxxxx;
- xxxxxxxxxxxxx xxxxxxxxx s xxxxxxxxxxx xxxxxxxxx xxxxxxxxx (normami);
- xxxxxxxx xxxxxxxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxx xxxxxxxxx;
- xxxxxxx xxxxxxxx xxx xxxxxxxx x xxxxx x xxxxxxxxx xxxxxx;
- pitevní xxxxxx;
- xxxxxxxx xxxxx všech xxxxxxxxxxxxxxxxxx nálezů;
- xxxxx x xxxxxxxx, xxxxx xxxx dostupné;
- popřípadě xxxxxxxxxxx xxxxxxxxxx xxxxxxxx.
Xxxxxx xxxxxxxx.
Xxxxxx.
4. XXXXXXXXXX
Xxxxxx xx xxxxxxxxxx xxxxxx XXXX XX 407."
[1] Xxxxxxxxx xx xxxxx je xxxxxxx pro xxxx xxxxxx v séru x plazmě, xxxxxxx xxx xxxxxx glukosy. Xxxxxxx důvodem pro xxxx xxxxxxxxxx je xx, xx u xxxxxxxxxxxxxxx xxxxxx xx xxxxx xxxxxxxxxxx výsledků, xxxxx xx xxxxx xxxxxxxx xxxx výrazné xxxxx x ztížit xxxxxxxxxxxx. Na xxxxx xxxxxx by hladovění xxxx noc xxxxx xxx vliv na xxxxxxx xxxxxxxxxxxx a xxx podávání x xxxxxxx xx xxxxxxx xx xxxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxx. Xxxxx xx xxxxxxx xxxx xx xxxxx, xx xxxxx xxxxxxx xxxxxxxxxxx xxxxxxxxx xx po xxxxxxxxxx funkčních poruch xx 4. xxxxx xxxxxxx.
XXXXXXX XX X
" X.37 XXXXXX XXXXXXXXXXXXX XXXXXXXXXXX XXXXXXXXX FOSFORU XX XXXXXX XXXXXXXX
1. XXXXXX
1.1 Xxxx
Xxx posouzení x hodnocení toxických xxxxxx látek je xxxxxxxx xxxx v xxxxx xxxxxxxxx xxxxxxxx xxxxxx xxxxx vyvolat xxxxxxxxxx xxxx neurotoxicity, xxxxx xxxxxxx xxx xxxxxxxx xxxxxx studiemi xxxxxxxx. X xxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxx xxxx xxxxxxxxxx xxxxxx xxxxxxxxxxxxx; xxxx xxxxx xxxx xxx podrobeny xxxxxxxx xxxxx metodou.
Screeningové xxxxxxx xx xxxxx xxx xxxxxx pro xxxxxxxxx xxxxx, které xxxxx vyvolat xxxxxx xxxxxxxxxxxxxx; xxxxxxxxx xxxxx xx xxxxxxx xx xxxxx xxxx xxxxxxxxxxx xxxxx, že xxxxx xxxx xxxxxxxxx vyvolat xxxxxx neurotoxicitu.
Viz xxxxxx xxxx, xxxx X.
1.2 Xxxxxxxx
Xxxx "xxxxxxxxx sloučeniny xxxxxxx" patří neutrální xxxxxxxxx xxxxxx, thioestery xxxx anhydridy xxxxxxxx xxxxxxxxxx, xxxxxxxxx nebo xxxxxxxxxxxxxxx xxxx příslušných xxxxxxx xxxxxxxxxxxxxxxx, xxxxxxxxxxxxxxx xxxx xxxxxxxxxxxxxxxxxxxxx, nebo xxxx xxxxx, které xxxxx xxxxxxxx pozdní xxxxxxxxxxxxx xxxxxxxxxxx u xxxxxxxxx látek této xxxxxxx.
Xxxxxx xxxxxxxxxxxxx je xxxxxxx xxxxxxxxxxx xx xxxxxxx xxxxxxxx ataxie, xxxxxxxx xxxxxxxxxx v xxxx x xxxxxxxxxx xxxxx a xxxx xxxxxxxx x stárnutím xxxxxxxxxx xxxxxxxx – XXX (xxxxxxxxxx xxxxxx xxxxxxxx) v xxxxxxx xxxxx.
1.3 Xxxxxxxxxx xxxxx
Xxxxxxxxxx xxxxx může xxx xxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxx x xxxxx prokázat, xx xx x laboratorních xxxxxxxxxx reakce xxxxxxxxx xxxxx xxxxxxxxx xxxxxxxxx.
Xxxxxxxxx xxxxxx xxxxxxxxx látky x pozdním toxickým xxxxxxx xx xxx-x-xxxxx-xxxxxx (XXX 78308, EINECS 2011035, xxxxx xxxxx XXX: xxxx(2xxxxxxxxxxx)xxxxxx), xxxxx xxxx xxx názvem xxxxxxxxxxxxxxxx (TOCP).
1.4 Xxxxxxxx xxxxxxxx xxxxxx
Xxxxxxxx látka xx xxxxxx orálně x xxxxxx xxxxx xxxxxxxx xxxxxxx, chráněným xxxx xxxxxxx xxxxxxxx xxxxxxxxxxxxx účinky. Xxxxxxx xx xxxxxxxx xx xxxx 21 xxx, xxxxxxxxxxx xx xxxxxxxxxx xxxxxxx, xxxxxx x xxxxxx. Xxxxxxxxxxx xxxxxxxxx, xxxxxxx xxxxxxxx XXX (xxxxxxxxx xxxxxx xxxxxxxx), xx xxxxxxxxx x xxxxxx xxxxxxx xxxxxxxxx x každé xxxxxxx, xxxxxxx 24 x 48 x po xxxxxx xxxxx. Xxxxxx xxxxx xxx po xxxxxx látky xx xxxxxxxxx xxxxxxx usmrtí x xxxxxxx se xxxxxxxxxxxxxxxx vyšetření xxxxxxxxx xxxxxxxxx tkání.
1.5 Popis xxxxxxxx metody
1.5.1 Xxxxxxxx
Xxxxxxx xx xxxxxxx xxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxx, které xxxxxx xxxxxxxxx xxxxxxxx onemocněními x xxxxxxxxxxxxxxx xxxxxx x xxxx normální xxxxx, přiřadí xx xx experimentální a xxxxxxxxx skupiny a xxxxxxx 5 xxx xxxx xxxxxxxxx studie xx xxxxxxxxxxxx xx xxxxxxxxxxx podmínky.
Používají se xxxxxxxxxx velké xxxxx xxxx xxxxxx xxxxxxxxxx xxxxx pohyb xxxxxx x xxxxxx xxxxxxxxxx xxxxx.
Xxxxxxxx xxxxx xx xxxxxxx podává xxxxxx xxxxxx, xxxxxxxxxxxx xxxxxxxxx xxxx srovnatelnou xxxxxxx. Xxxxxxxx se xxxxxxxx xxxxxxxx xxxx xxxxxxxxxx xx xxxxxxx vehikulu, xxxx xx xxxx. xxxxxxxxx xxxx, xxxxx xxxxx xx xx xxxx xxxxxx xxxxxxxxx, xxxxxxx velké xxxxx xxxxxxx xxxxx x xxxxxxxxxxxx xxxxxxxxx by xx xxxxxxxx dostatečně xxxxxxxx. Toxické vlastnosti xxxxxxxxx vehikul xx xxxx xxx xxxxx xxxx xxxxxxxx, a xxxxx nejsou xxxxx, xxxx xx xxx xxxxxx xxxxxx.
1.5.2 Xxxxxxxx xxxxxxxx
1.5.2.1 Pokusná zvířata
Doporučuje xx xxxxx xxxxxxx xxxx domácího (Gallus xxxxxx domesticus), xxxxx 8 – 12 xxxxxx. Xxxxxxxxx xx xxxxxxx x xxxxxxxxxx xxxxxxxxx x slepice xx měly xxx xxxxxxx za xxxxxxxx xxxxxxxxxxxx volný xxxxx.
1.5.2.2 Xxxxx x xxxxxxx
Xxxxx xxxxxxxxxxxxxx xxxxxxx xx xxxx xxx xxxxxxx xxxxxxxxx xxxxxxx x xxxxxxxxx x pozitivní xxxxxxxxx xxxxxxx. X xxxxxxxx podání xxxxxxxx xxxxx xx x xxxxxxxxx xxxxxxxx xxxxxxx xxxxxx jako x xxxxxxxxxxxxxx skupinou.
V xxxxx xxxxxxx xx xxx xxx použit xxxxxxxxxx xxxxx xxxxxx, xxx xxxxx šest slepic xxxxx být xxxxxxxx xxx biochemické xxxxxxxxx (xxx x xxxxx x tři x xxxxx xxx xx xxxxxx) x xxxx xxxxxxx 21xxxxx xxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx.
Xxxxxxxxx xxxxxxxxx xxxxxxx xxxx xxx xxxxxxxx xxxxxxxx xxxx xxxxx xxx xxxxxxx xxxxx z xxxxxxx xxxxxxx xxxxxxxxx skupiny. Xxxx by xxxxxxxxx xxxxxxx šest slepic, xxxxxx xx xxxx xxxxx, x xxx xx xxxxx, xx xxxxxxxx pozdní neurotoxicitu, xxx slepice xxx xxxxxxxxxxx xxxxxxxxx a xxx xxxxxxx xxx xxxxxxxxxxxxxxxx xxxxxxxxx. Doporučuje xx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxx. Xxxx xxxxxxxxx kontrolní údaje xx xxxx xxx xxxxxxxx, pokud xxxxxxxxxxx xxxxxxxxx v xxxxxxx xxxxx xxxxx xxxxxxx xxxxxxxx prvek xxxxxxx (xxxx. plemeno, stravu, xxxxxxxx xxxxx).
1.5.2.3 Úrovně xxxxx
Xxxx xx xx xxxxxxx xxxxxxxxx xxxxxx xx použití xxxxxxxx xxxxx xxxxxx x xxxxxx x různými xxxxxxxx xxxxx, xxx xxxx xxxxx xxxxxxxx xxxxxx, která xx xxx xxxxxxx v xxxxxx xxxxxx. Xxx xxxxxxxxx xxxxxxxxx xxxxx x xxxxxx xxxxxx xx x xxxx xxxxxxxxx xxxxxx xxxxxxxx xxxxxx xxxxxxxx. Aby xx xxxx xxxxxxxxx xxxxx vlivem xxxxxxxx xxxxxxxxxxxxx xxxxxx, xxx xxxxxx atropin xxxx xxxx ochranný xxxxxxxxx, x xxxxxx xx xxxxx, xx xxxx xxxx xx xxxxxx xxxxxxxxxxxx xxxxxx. Pro xxxxx nejvyšší xxxxxxxxx xxxxx zkoušených xxxxx xxx xxxxxx xxxx xxxxx (viz metoda X.1 a)). Xxx xxxxxx xxxxx xxxxx xxx užitečné xxxx xxxxxxxxx xxxxx x xxxxxxxxx xxxx xxxx xxxxxxxxxxxxx xxxxxxxxx.
Xxxxxx dávky xxxxxxxx xxxxx x xxxxxx studii xx xxxx být xx xxxxxxxx, xxxxxxx xx xxxxx x xxxxx xxxxxxxx xxxxxxxxx studie xxxxxx dávky x xxxxx xxxxx dávky 2000 xx na xx xxxxxxx xxxxxxxxx. Xxxxxxxx xxxx xx xxxxx xxxxxxx xxxxxxxxxx xxxxx xxxxxx pro xxxxxxxxxxx xxxxxxxxx (xxxx) x pro xxxxxxxxxxxx xxxxxxxxx (xxxx) po 21 dnech. Xxx xx zabránilo xxxxx xxxxxx xxxxxxxx cholinergních xxxxxx, xxxxxxx xx xxxxxxx nebo xxxx xxxxxxxx xxxxxxxxx, o xxxxxx je známo, xx xxxx xxxx xx pozdní xxxxxxxxxxxx xxxxxx.
1.5.2.4 Limitní xxxxxxx
Xxxxx xxxxxxx provedená xxxxx xxxxxxx xxxxxxxxx v xxxx studii xxx xxxxx xxxxx xxxxxxx 2000 xx xx xx xxxxxxx xxxxxxxxx xx xxx xxxxxxxx xxxxxxxxxxxxx toxické xxxxxx x xxxxx xx xx základě xxxxx x xxxxxxx x xxxxxxxx strukturou nepředpokládá xxxxxxxx, xxxx xxxxx xxxxxx xx použití xxxxx dávky xxxxxxxx. Xxxxxxx zkouška se xxxxxxx x výjimkou xxxxxxx, xxx údaje x xxxxxxxx xxxxxxx xxxxxxxxx, xx je xxxxxxxx xxxxxxx xxxxx xxxxxx xxxxx.
1.5.2.5 Xxxx xxxxxxxxxx
Xxxx pozorování xx xxxx xxx 21 xxx.
1.5.3 Postup
Po podání xxxxxxxxx xxxxxxxxxx xxxx xxxxxxxx na následky xxxxxxxx xxxxxxxxxxxxx xxxxxx xx xxxx xxxxxxxx xxxxx x jedné xxxxx.
1.5.3.1 Xxxxxx xxxxxxxxxx
Xxxxxxxxxx xx xxxx začít xxxxxxxx po xxxxxx. Xxxxxxx xxxxxxx xx xxxxxxx xxxxxxxxxx xxxxx xxxxxxxx x průběhu xxxxxxx xxxx dnů x poté xxxxxxx xxxxxx xxxxx po xxxx 21 xxx xxxx xx xxxxxxxxxxx xxxxxxxx. Xxxxxxx xxxxxxxx xxxxxxxx by xxxx xxx zaznamenány, xxxxxx xxxx xxxxxxx, typu, xxxxxxxxxx x xxxxxx xxxxxxxxxxxx xxxxxxx. Xxxxxx xx měla být xxxxxxxxx xxxxx xxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxx x zaznamenává se xxxxxx. Xxxxxxx xxxxxxx xxxxx xx xxxxxxx xxxxxx x xxxxxxxxxxxxx xxxxxxxx vyjmou z xxxxx a podrobí xxxxxxx nucené xxxxxxxxx xxxxxxxx, xxxx xxxx. xxxxxxxx xx xxxxxxx, xxx xx xxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx. Xxxxxxx v xxxxxx a xxxxxxx, xxxxx xx xxxxx xxxx trpí xxxxxxx, xx xxxxx xxxxxx, xxxxxxx utratí x xxxxxxx.
1.5.3.2 Tělesná hmotnost
Všechny xxxxxxx xx xxxxx xxxxx před podáním xxxxxxxx xxxxx x xxxx xxxxxxx jednou xxxxx.
1.5.3.3 Xxxxxxxxxxx xxxxxxxxx
Xxxx xxxxxx xxxxxxx vybraných x každé xxxxxxxxxxxxxx xxxxxxx a xxxxxxxxx xxxxxxx s xxxxxxxxx x tři xxxxxxx x pozitivní kontrolní xxxxxxx (xxxxx xx xxxxxxx souběžně provádí x xxxxx xxxxxxxx) xx xxxxxx x xxxxxxx xxxxx xx xxxxxx xxxxx, mozek x xxxxxxxx xxxxx xx xxxxxxxxxxx x xxxxxxx se xx xxxxxxxx XXX. Dále xxxx xxx rovněž xxxxxx vypreparovat n. xxxxxxxxxxx a xxxxxxxxxx xxxx xxxx xx xxxxxxxx aktivity XXX. Xxxxxxxxx se usmrtí xxx xxxxxxx x xxxxxxxxx skupiny a x xxxxx xxxxxxxxxxxxxx xxxxxxx xx 24 x x xxxxx xxx xx 48 x, zatímco xxx xxxxxxx x pozitivní xxxxxxxxx skupiny se xxxxxx xx 24 x. Xxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxx toxicity xxxxxxxxx, xx xx xxxxxxx látka v xxxxxxxxx xxxxxxxxx velmi xxxxxx (to lze xxxxx xxxxxxxx pozorováním xxxx nástupu cholinergních xxxxxxxx), může xxx xxxxxxxxx xxxxxxx xxxxxx xxxxx xxxxxxx xx xxx xxxxxx mezi 24 xx 72 x xx xxxxxx xxxxx.
Xx těchto vzorcích xxxxx xxxxx být xxxxxxxxx xxxx analýza xxxxxxxxxxxxxxxxxxxx (XXxX), je-li xx považováno xx xxxxxx. Xx xxxx xxxx xxxx xxxxxx xxxxxxxxx reaktivace XXxX, xxx může xxxx x xxxxxxxxx látky xxxx xxxxxxxxxx AChE.
1.5.3.4 Xxxxx
Xxxxx xxxxx zvířat (xxxxxxxxxx podle xxxxx x xxxxxxxxxx x xxxxxx) xx xxxx xxxxxxxxx xxxxxxxxx stavu xxxxx a xxxxx.
1.5.3.5 Xxxxxxxxxxxxxxxx vyšetření
Nervová tkáň xxxxxx, která přežila xxxx pozorování a xxxxxx xxxxxxx xxx xxxxxxxxxxx xxxxxx, xx xxxx xxx mikroskopicky xxxxxxxxx. Tkáně xx xxxx xxx xxxxxxxx xx situ xx xxxxxxx xxxxxxxxxx xxxxxxx. Xxxxxxx se xxxxxxx (xxxxxxx xxxxxxx xxx), xxxxxxxxxxx mícha, xxxxx x xxxxxxxxx xxxxx. Xxxx xxxxx xx xxxx být xxxxxxxx x xxxxx krční xxxxx, střední xxxxxx x xxxxxxxxxxxxx xxxxxxx. Xxxx xx xxx xxxxxxxx xxxx xxxxxxxx xxxxx x. xxxxxxxx x xxxx xxxxx x x. xxxxxxxxxxxxx x x x. xxxxxxxxxxx. Xxxx xx xxxxx vhodnými xxxxxxx xx xxxxxx x xxxxx.
2. XXXXX
Xxxxxxxxx xxxxxxxx xxxxxxx xxx xxxxxxxx xxxxxx xxxxxxx v xxxx xxxxxx (xxxxxxxxxxx x xxxxxxxxxxxxxxxx vyšetření x xxxxxxxxx xxxx xxxxxxx) xxxxxxxxxx xxxxxxxxx xxxxx xxxxxxxx xxxxxx xxxxxxxxxxxxx. Při dvojznačných xxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxx xxxx xxx xxxxxxxx další xxxxxxxxx.
Xxxx xx xxx xxxxxxx údaje xxx xxxxx jednotlivé xxxxx. Xxxxx xx xxxx xxx xxxxxxx xxxxx xxxxxxx xx tabulky, xxxxxxx xx uvede x xxxxx xxxxxxxxxxxxxx xxxxxxx xxxxx xxxxxx xx xxxxxxx zkoušky, xxxxx zvířat xxxxxxxxxxxx xxxx, xxxxxx xx xxxxxxx xxxx xxxxxxxxxxx xxxxxx, typ x xxxxxxxxx xxxxxx lézí xxxx účinků x xxxxxxxx zvířat xxxxxxxxxx xxxxx xxx x xxxxxxxxx xxxx xxxx xxxxxx.
Xxxxx x této xxxxxx xx xxxx xxx vyhodnoceny z xxxxxxxx xxxxxxx, xxxxxxxxxx x korelace xxxxxx xx chování x xxxxxxxxxxxxx x histopatologických xxxxxx a dále xxxxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxxx na experimentální x kontrolní skupiny.
Číselné xxxxxxxx by xxxx xxx pokud xxxxx xxxxxxxxxxx xxxxxxx x xxxxxx xxxxxxxxx statistickou xxxxxxx. Xxxxxxxxxxx metoda xx xxxx xxx xxxxxxx již xxx xxxxxxxxx studie.
3. XXXXXX
Xxxxxxxx x zkoušce
Protokol x xxxxxxx xx pokud xxxxx xxxxxxxxx xxxx xxxxxxxxx:
Xxxxxxx xxxxxxx
- xxxxxxx xxxxxxx;
- počet a xxxxx xxxxxx;
- xxxxx, xxxxxxxx xxxxx xxx.;
- xxxxxxxx xxxxxxxxxxxx zvířat xx xxxxxxx xxxxxxx.
Xxxxxxxx xxxxxxxx:
- podrobné xxxxx x přípravě xxxxxxxx xxxxx, xxxxxxxxx x xxxx xxxxxxxx x xxxxxxxxxx;
- zdůvodnění volby xxxxxxxx;
- podrobné xxxxx x způsobu xxxxxx xxxxxxxx xxxxx;
- xxxxxxxx xxxxx x stravě x x xxxxxxx xxxx;
- xxxxxxxxxx xxxxxx xxxxxx xxxxx;
- xxxxxxxxxxx xxxxxxxxxx xxxxx, xxxxxx xxxxxxxxxx informací x xxxxxxxx, objemu x xxxxxxxxx xxxxx xxxxxx xxxxx;
- identifikace xxxxxxxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxx informace x xxxx xxxxxx.
Xxxxxxxx:
- xxxxx x xxxxxxx xxxxxxxxx;
- xxxxx o xxxxxxxxx xxxxxxxx xxxxx skupin, xxxxxx mortality;
- xxxxxxxxx, xxxxxxxxx x xxxxxx xxxxxxxxxx xxxxxxx (zda xxxx vratné xxxx xxxxxxxx);
- xxxxxxxx xxxxx xxxxxxxxxxxxx vyšetření x xxxxxx;
- pitevní nálezy;
- xxxxxxxx xxxxx xxxxx xxxxxxxxxxxxxxxxxx xxxxxx;
- xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxx.
Xxxxxx xxxxxxxx.
Xxxxxx.
4. XXXXXXXXXX
Xxxxxx je xxxxxxxxxx metodě OECD XX 418.
B.38 XXXXXX XXXXXXXXXXXXX XXXXXXXXXXX SLOUČENIN XXXXXXX – 28XXXXX XXXXXXXXX XXXXXXXX
1. XXXXXX
1.1 Xxxx
Xxx xxxxxxxxx a xxxxxxxxx xxxxxxxxx účinků xxxxx je xxxxxxxx xxxx v xxxxx xxxxxxxxx xxxxxxxx xxxxxx xxxxx xxxxxxx xxxxxxxxxx xxxx xxxxxxxxxxxxx, které xxxxxxx xxx xxxxxxxx xxxxxx xxxxxxxx xxxxxxxx. X xxxxxxxx organických xxxxxxxxx xxxxxxx xxxx xxxxxxxxxx xxxxxx xxxxxxxxxxxxx; xxxx látky xxxx xxx xxxxxxxxx zkoumání xxxxx xxxxxxx.
Xxxxxxxxxxxx xxxxxxx xx xxxxx xxx xxxxxx pro xxxxxxxxx xxxxx, které xxxxx xxxxxxx xxxxxx polyneuropatii; xxxxxxxxx xxxxx ze xxxxxxx xx vitro xxxx xxxxxxxxxxx xxxxx, xx látka nemá xxxxxxxxx vyvolat xxxxxx xxxxxxxxxxxxx.
28xxxxx xxxxxxx pozdní xxxxxxxxxxxxx xxxxxxxxx informace x xxxxxx nebezpečí xxx xxxxxx, xxxxx xx xx xxxxx xxxxxxxx x xxxxxxxxxxx xxxxxxx xxxxx omezeného xxxxxxxx xxxxxx. Poskytne xxxxxxxxx x reakci xx xxxxx a xxxx poskytnout xxxxx xxxxxx xxx xxxxxxxxxxxxxxx xxxxxxxxxxxx účinků, což xxxx xxx xxxxxxxx xxx xxxxxxxxx xxxxxxxx xxx xxxxxxxxx expozici xxxxxxx.
Xxx xxxx xxxxxx xxxx, část X.
1.2 Xxxxxxxx
Xxxx "xxxxxxxxx sloučeniny xxxxxxx" xxxxx xxxxxxxxx xxxxxxxxx estery, thioestery xxxx xxxxxxxxx xxxxxxxx xxxxxxxxxx, xxxxxxxxx xxxx xxxxxxxxxxxxxxx xxxx příslušných xxxxxxx thiofosforečných, xxxxxxxxxxxxxxx xxxx xxxxxxxxxxxxxxxxxxxxx, xxxx xxxx xxxxx, xxxxx xxxxx způsobit pozdní xxxxxxxxxxxxx xxxxxxxxxxx x xxxxxxxxx látek xxxx xxxxxxx.
Xxxxxx xxxxxxxxxxxxx xx xxxxxxx xxxxxxxxxxx se xxxxxxx xxxxxxxx xxxxxx, xxxxxxxx axonopatií x xxxx x xxxxxxxxxx xxxxx a xxxx x inhibicí a xxxxxxxxx specifické esterasy - NTE (xxxxxxxxxx xxxxxx xxxxxxxx) x xxxxxxx xxxxx.
1.3 Xxxxxxxx xxxxxxxx xxxxxx
Xxxxxxxx látky xx xxxxxxxx xxxxx xxxxxx xxxxxxxx xxxxxxx xx xxxx 28 xxx. Zvířata xx xxxxxxxx nejméně xxxxxx xxxxx, xxxxxxxxxxx se xxxxxxxxxx xxxxxxx, ataxie x paréza xxxxx 14 xxx po xxxxxxxx xxxxx. Xxxxxxxxxxx xxxxxxxxx, xxxxxxx inhibice XXX (xxxxxxxxx target xxxxxxxx), xx xxxxxxx x slepic náhodně xxxxxxxxx z každé xxxxxxx, obvykle 24 x 48 x xx xxxxxx látky. Xxx xxxxx xx xxxxxxxx dávce se xxxxxxxxx slepice xxxxxx x xxxxxxx se xxxxxxxxxxxxxxxx vyšetření xxxxxxxxx xxxxxxxxx tkání.
1.4 Popis xxxxxxxx xxxxxx
1.4.1 Příprava
Provede xx xxxxxxx výběr xxxxxxx zdravých xxxxxxxxx xxxxxx, xxxxx nejsou xxxxxxxxx virovými xxxxxxxxxxxx x xxxxxxxxxxxxxxx xxxxxx x mají normální xxxxx, xxxxxxx xx xx xxxxxxxxxxxxxxxx x xxxxxxxxxxx skupin a xxxxxxx 5 xxx xxxx xxxxxxxxx xxxxxx xx xxxxxxxxxxxx xx xxxxxxxxxxx podmínky.
Používají se xxxxxxxxxx xxxxx xxxxx xxxx ohrady umožňující xxxxx pohyb slepic x snadné xxxxxxxxxx xxxxx.
Xxxxxxxx látka xx xxxxxx každý xxx, 7 dnů x xxxxx, nejlépe xxxxxx xxxxxx nebo želatinovými xxxxxxxxx. Xxxxxxxx xx xxxxxxxx xxxxxxxx xxxx xxxxxxxxxx xx xxxxxxx xxxxxxxx, xxxx xx xxxx. xxxxxxxxx xxxx, xxxxx xxxxx xx xx měly xxxxxx xxxxxxxxx, xxxxxxx velké xxxxx pevných látek x xxxxxxxxxxxx xxxxxxxxx xx se nemusely xxxxxxxxxx xxxxxxxx. Toxické xxxxxxxxxx nevodných xxxxxxx xx měly xxx xxxxx xxxx xxxxxxxx, x xxxxx xxxxxx xxxxx, měly xx xxx xxxxxx xxxxxx.
1.4.2 Xxxxxxxx xxxxxxxx
1.4.2.1 Xxxxxxx xxxxxxx
Xxxxxxxxxx xx mladá xxxxxxx xxxx xxxxxxxx (Xxxxxx xxxxxx xxxxxxxxxx), xxxxx 8 – 12 xxxxxx. Xxxxxxxxx xx xxxxxxx x xxxxxxxxxx xxxxxxxxx x xxxxxxx by xxxx xxx chovány za xxxxxxxx xxxxxxxxxxxx xxxxx xxxxx.
1.4.2.2 Xxxxx x xxxxxxx
Xxxxxx xx měly xxx xxxxxxx xxxxxxx xxx experimentální skupiny x kontrolní xxxxxxx x xxxxxxxxx. X xxxxxxxx xxxxxx xxxxxxxx xxxxx xx s xxxxxxxxx xxxxxxxx s xxxxxxxxx zachází xxxxxx xxxx x xxxxxxxxxxxxxx xxxxxxxx.
X xxxxx xxxxxxx xx xxx xxx xxxxxx xxxxxxxxxx xxxxx xxxxxx, xxx aspoň xxxx xxxxxx mohlo xxx xxxxxxxx xxx xxxxxxxxxxx vyšetření (tři x xxxxx x xxx x xxxxx xxx xx xxxxxx) x šest xxxxxxx 14xxxxx xxxxxxxxxx patologických xxxxxxxx.
1.4.2.3 Úrovně dávek
Při xxxxxx úrovní xxxxx xx xxxx xxx xxxxx x úvahu xxx xxxxxxxx xxxxxx xxxxxxx xxxxxx xxxxxxxxxxxxx x jakékoli xxxxx xxxxxxxx xxxxx x xxxxxxxx x xxxxxxxx xxxxxxxx xxxxxxxxxx. Xxxxxxxx xxxxxx xxxxx xx xxxx xxx xxxxxxx x cílem xxxxxxx xxxxxxx účinky, xxxxxxx xxxxxx xxxxxxxxxxxxx, ne xxxx xxxxxxx nebo xxxxxx xxxxxxx. Xxxx xx měla být xxxxxxx sestupná xxxx xxxxx s xxxxx xxxxxxxx, že xxxxxxxx xxxxxxxxx účinku xx xxxxx a xx xxxxxxxx xxxxx xxxxxxxxxx xxxxx xxxxxxx xxxxxxxx.
1.4.2.4 Xxxxxxx zkouška
Pokud zkouška xxxxxxxxx podle postupů xxxxxxxxx x xxxx xxxxxx při xxxxx xxxxx xxxxxxx 1000 xx na kg xxxxxxx xxxxxxxxx a xxx xxxxxxxx xxxxxxxxxxxxx xxxxxxx účinky x xxxxx xx xx xxxxxxx údajů x xxxxxxx x xxxxxxxx xxxxxxxxxx nepředpokládá xxxxxxxx, xxxx xxxxx xxxxxx xx xxxxxxx xxxxx xxxxx xxxxxxxx. Xxxxxxx xxxxxxx se provádí x výjimkou xxxxxxx, xxx xxxxx o xxxxxxxx člověka xxxxxxxxx, xx je xxxxxxxx xxxxxxx xxxxx xxxxxx xxxxx.
1.4.2.5 Xxxx xxxxxxxxxx
Xxxxxxx xxxxxxx xx měla xxx xxxxxxxxxx nejméně xxxxxx denně po xxxx xxxxxxxx a 14 xxx po xx, xx xx xxxxxxxxx xxxxx xxxxx xxxxx.
1.4.3 Xxxxxx
Xxxxxxxx xx xxxxxx xxxxxxxx xxxxx xxxx xxx v xxxxx xx xxxx 28 xxx.
1.4.3.1 Xxxxxx xxxxxxxxxx
Xxxxxxxxxx xx měla xxxxx xxxxxxxx xx xxxxxx. Xxxxxxx xxxxxxx xx pečlivě pozorují xxxxxx denně xxxxx xxx x 28 xxx xxxxxxxx x 14 xxx xx xxxxxxxx xxxx do xxxxxxxxxxx usmrcení. Xxxxxxx xxxxxxxx xxxxxxxx by xxxx xxx zaznamenány, xxxxxx xxxx xxxxxxx, xxxx, xxxxxxxxxx a xxxxxx. Xxxxxxxxxx má xxxxxxxxx abnormality xxxxxxx, xxx xxxx xx xx xx xxxxxxxx. Xxxxxx xx xxxx xxx xxxxxxxxx xxxxx xxxxxxx čtyřstupňové pořadové xxxxxxxx x xxxxxxxxxxx xx paréza. Xxxxxxx xxxxxxx xxxxx xx xxxxxxx x xxxxxxxxxxxxx xxxxxxxx vyjmou z xxxxx a xxxxxxx xxxxxxx xxxxxx motorické xxxxxxxx, xxxx xxxx. xxxxxxxx xx žebříku, xxx xx xxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx. Xxxxxxx x xxxxxx x zvířata, xxxxx xx xxxxx xxxx xxxx bolestí, xx xxxxx xxxxxx, xxxxxxx utratí a xxxxxxx.
1.4.3.2 Xxxxxxx xxxxxxxx
Xxxxxxx xxxxxxx xx xxxxx xxxxx xxxx prvním xxxxxxx zkoušené xxxxx x xxxx nejméně xxxxxx týdně.
1.4.3.3 Xxxxxxxxxxx xxxxxxxxx
Xxxx slepic náhodně xxxxxxxxx z xxxxx xxxxxxxxxxxxxx skupiny a xxxxxxxxx xxxxxxx s xxxxxxxxx x xxx xxxxxxx x xxxxxxxxx xxxxxxxxx skupiny se xxxxxx x prvních xxxxx po podání xxxxxxxx xxxxx, mozek x xxxxxxxx xxxxx xx vypreparují x xxxxxxx xx xx xxxxxxxx XXX. Xxxx xxxx xxx xxxxxx xxxxxxxxxxxx x. ischiadicus x xxxxxxxxxx xxxx xxxx xx inhibici xxxxxxxx NTE. Xxxxxxxxx xx xxxxxx xxx xxxxxxx x xxxxxxxxx xxxxxxx x x xxxxx xxxxxxxxxxxxxx xxxxxxx xx 24 x x xxxxx tři xx 48 h xx xxxxxxxx xxxxx. Xxxxx xxxxx z xxxxxx studie xxxx x xxxxxx xxxxxx (xxxx. xxxxxxxxxxxxxxxxx) xxxxxxxxx, xx xxxx vhodné xxxx doby usmrcení xx poslední xxxxx xxx xxxx doby, xxxx xx xxx xxxxxxx x xxxxxxxxxx xx xxxx xxx xxxxxxx x xxxxxxxxxxx.
Xx xxxxxx vzorcích xxxxx xxxxx xxx xxxxxxxxx xxxx analýza xxxxxxxxxxxxxxxxxxxx (XXxX), je-li xx xxxxxxxxxx za xxxxxx. Xx xxxx xxxx xxxx xxxxxx spontánní xxxxxxxxxx AChE, xxx xxxx xxxx k xxxxxxxxx xxxxx xxxx xxxxxxxxxx XXxX.
1.4.3.4 Xxxxx
Xxxxx xxxxx zvířat (xxxxxxxxxx xxxxx plánu x xxxxxxxxxx x agónii) xx xxxx xxxxxxxxx xxxxxxxxx xxxxx xxxxx x xxxxx.
1.4.3.5 Xxxxxxxxxxxxxxxx xxxxxxxxx
Xxxxxxx tkáň zvířat, xxxxx xxxxxxx xxxx xxxxxxxxxx x xxxxxx xxxxxxx pro xxxxxxxxxxx xxxxxx, xx měla xxx xxxxxxxxxxxxx vyšetřena. Xxxxx xx xxxx xxx fixovány xx xxxx xx xxxxxxx xxxxxxxxxx technik. Odebírá xx xxxxxxx (xxxxxxx xxxxxxx xxx), xxxxxxxxxxx xxxxx, xxxxx x xxxxxxxxx nervy. Xxx xxxxx xx xxx xxx xxxxxxxx x xxxxx xxxxx xxxxx, xxxxxxx xxxxxx a xxxxxxxxxxxxx oblasti. Xxxx xx xxx odebrány xxxx distální xxxxx x. xxxxxxxx a xxxx xxxxx x x. xxxxxxxxxxxxx a x n. xxxxxxxxxxx. Xxxx xx xxxxx xxxxxxxx barvivy xx xxxxxx x axony. Xxxxxxx by mělo xxx xxxxxxxxx mikroskopické xxxxxxxxx xxxxxxxx xxxxx xxxxx xxxxxx kontrolní xxxxxxx x xxxxxxx x xxxxxxx xxxxxx. Xxxxx xx x xxxxxxx x xxxxxxx xxxxxx xxxxxxx xxxxxx, xxxx by xxx xxxxxxxxxxxxx xxxxxxxxx provedeno xxxx na xxxxxxxxx xx xxxxxxx xx xxxxxxx x nízkou xxxxxx.
2. XXXXX
Xxxxxxxxx xxxxxxxx xxxxxxx touto xxxxxxx (xxxxxxxxxxx x histopatologická xxxxxxxxx a xxxxxxxxx xxxx chování) xxxxxxxxxx xxxxxxxxx xxxxx xxxxxxxx xxxxxx neurotoxicity. Xxx xxxxxxxxxxxx nebo xxxxxxxxxxxx xxxxxxxxxx těchto xxxxxxxxx xxxx xxx xxxxxxxx xxxxx xxxxxxxxx.
Xxxx xx xxx xxxxxxx xxxxx xxx xxxxx xxxxxxxxxx xxxxx. Xxxxx xx xxxx xxx xxxxxxx xxxxx xxxxxxx xx xxxxxxx, přičemž xx x každé experimentální xxxxxxx xxxxx xxxxx xxxxxx na xxxxxxx xxxxxxx, počet zvířat xxxxxxxxxxxx xxxx, xxxxxx xx xxxxxxx nebo xxxxxxxxxxx účinky, xxx x xxxxxxxxx xxxxxx xxxx nebo účinků x procento xxxxxx xxxxxxxxxx xxxxx xxx x xxxxxxxxx xxxx xxxx xxxxxx.
Xxxxx z xxxx studie by xxxx být xxxxxxxxxxx x hlediska xxxxxxx, xxxxxxxxxx x xxxxxxxx xxxxxx xx xxxxxxx x xxxxxxxxxxxxx x xxxxxxxxxxxxxxxxxx xxxxxx x xxxx jakýchkoli xxxxxxx xxxxxxxxxxxx xxxxxx na xxxxxxxxxxxxxx x xxxxxxxxx xxxxxxx.
Xxxxxxx xxxxxxxx xx xxxx xxx pokud xxxxx xxxxxxxxxxx xxxxxxx x obecně xxxxxxxxx xxxxxxxxxxxx metodou. Xxxxxxxxxxx xxxxxx xx xxxx xxx zvolena xxx xxx plánování studie.
3. XXXXXX
Xxxxxxxx x xxxxxxx
Xxxxxxxx x xxxxxxx obsahuje xxxxx možno xxxx xxxxxxxxx:
Xxxxxxx xxxxxxx:
- xxxxxxx xxxxxxx;
- xxxxx x xxxxx xxxxxx;
- xxxxx, xxxxxxxx xxxxx xxx.;
- xxxxxxxx xxxxxxxxxxxx xxxxxx xx začátku xxxxxxx.
Xxxxxxxx xxxxxxxx:
- xxxxxxxx xxxxx x přípravě xxxxxxxx xxxxx, xxxxxxxxx x xxxx xxxxxxxx x xxxxxxxxxx;
- xxxxxxxxxx volby xxxxxxxx;
- xxxxxxxx xxxxx x xxxxxxx xxxxxx xxxxxxxx xxxxx;
- podrobné xxxxx x xxxxxx x o kvalitě xxxx;
- xxxxxxxxxx xxxxxx xxxxxx xxxxx;
- xxxxxxxxxxx xxxxxxxxxx látek, xxxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxx, xxxxxx x xxxxxxxxx xxxxx podané xxxxx;
- zdůvodnění xxxxxx xxxx xxxxxx pro xxxxxxxxxxx vyšetření, není-li xxxxxxx 24 x 48 h.
Výsledky:
- xxxxx x xxxxxxx xxxxxxxxx;
- xxxxx x xxxxxxxxx xxxxxxxx podle xxxxxx, xxxxxx mortality;
- úroveň xxx xxxxxxxxxxxxxxx xxxxxxxxxxxx xxxxxx;
- charakter, závažnost x xxxxxx xxxxxxxxxx xxxxxxx (xxx byly xxxxxx nebo nevratné);
- xxxxxxxx xxxxx xxxxxxxxxxxxx xxxxxxxxx a xxxxxx;
- xxxxxxx xxxxxx;
- xxxxxxxx xxxxx všech histopatologických xxxxxx;
- xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxx.
Xxxxxx xxxxxxxx.
Xxxxxx.
4. XXXXXXXXXX
Xxxxxx je analogická xxxxxx OECD XX 419."
PŘÍLOHA V
Obecné xxxxxxxxx xx klasifikaci x xxxxxxxxxx xxxxxxxxxxxx xxxxx x xxxxxxxxx
Xxx xxxxxxxx Xxxxxx 2001/59/XX, Úř. xxxx. X 332, 28. 12. 2000, x. 81.


