Vládní návrh zákona, kterým se mění zákon č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů (zákon o léčivech), ve znění pozdějších předpisů, a zákon č. 234/2014 Sb., o státní službě, ve znění pozdějších předpisů
706/0
Xxxxxx xxxxx
XXXXX
xx xxx … 2016,
xxxxxx xx xxxx zákon č. 378/2007 Sb., x xxxxxxxx x x xxxxxxx některých xxxxxxxxxxxxx xxxxxx (zákon x xxxxxxxx), xx xxxxx xxxxxxxxxx xxxxxxxx, x zákon č. 234/2014 Sb., x státní službě, xx xxxxx xxxxxxxxxx xxxxxxxx
Xxxxxxxxx xx xxxxxx xx xxxxx xxxxxx Xxxxx xxxxxxxxx:
XXXX PRVNÍ
Změna xxxxxx x léčivech
Xx. I
Zákon č. 378/2007 Sb., x xxxxxxxx x x xxxxxxx některých xxxxxxxxxxxxx xxxxxx (xxxxx x xxxxxxxx), xx xxxxx xxxxxx x. 124/2008 Sb., xxxxxx x. 296/2008 Xx., xxxxxx x. 141/2009 Xx., xxxxxx x. 281/2009 Xx., xxxxxx x. 291/2009 Xx., xxxxxx x. 75/2011 Xx., xxxxxx x. 375/2011 Xx., xxxxxx x. 50/2013 Xx., xxxxxx x. 70/2013 Xx., xxxxxx x. 250/2014 Xx. x xxxxxx x. 80/2015 Xx., xx xxxx xxxxx:
1. Na konec xxxxxxxx xxx čarou x. 2 se xxxxxxxx xxxx:
„Xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Rady (XX) č. 536/2014 xx xxx 16. xxxxx 2014 x xxxxxxxxxx xxxxxxxxxxx humánních léčivých xxxxxxxxx x x xxxxxxx xxxxxxxx 2001/20/XX.
Xxxxxxxx Xxxxxx v xxxxxxxxx xxxxxxxxx (XX) č. 1252/2014 xx xxx 28. xxxxxx 2014 doplňující xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX, xxxxx jde o xxxxxx x pokyny xxxxxxx výrobní xxxxx xxx xxxxxx xxxxx xxx xxxxxxx xxxxxx xxxxxxxxx.“.
2. V §5 xx xxxxxxxx odstavec 16, xxxxx včetně xxxxxxxx pod xxxxx x. 101 zní:
„(16) Xxxxxxx xxxxxx látky xx xxx účely xxxxxx xxxxxx, jde-li x její xxxxxxx x xxxxxxxxxxx humánních xxxxxxxx xxxxxxxxxxx xxxx xx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxx, xxxxxx jakýkoli xxxxx xxxx částečný xxxx xxxxxxxx xxxxxxxxx, xxxxxx, balení, přebalování, xxxxxxxxxx, xxxxxxxxxxxx, xxxxxxxx xxxxxxx xxxx xxxxxxxxxxx xxxxxx xxxxx, jakož x související xxxxxxxx. Xxxxxxxx toho, co xx xxxxxx výrobou xxxxxx xxxxx, xxx-xx x její použití x xxxxxxxxx léčivých xxxxxxxxxxx, stanoví přímo xxxxxxxxxx xxxxxxx Xxxxxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxxxx xxxxx pro xxxxxx xxxxx101).
XXXXX: 32014R1252
3. V §11 xxxxxxx g) xxx:
„x) xxxxxx xxxxxxxx xxxxxx xxxxxx podle §77x, xxxxxx xxxxxxx nebo xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx do xxxxxxxxx,“.
4. X §11 xxxxxxx x) zní:
„h) xxxxxxx podmínky xxx xxxxxxxxx xxxxxxxxxxx léčivých xxxxxxxxx xxxxxxxxxx pro xxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxxxxxx xxxxxxxx-xx xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxx xxxxxxxx xxxxxx xxxxxx x xxxx-xx xxxxxxx xxxxxxxx xxx jeho xxxxxx, xxxxxxxxx xxxxx xxxxxxx x) xxxx x), x xxxxxxx xxxxxxxx xx xxxxxxx xxxxxxx, xxxxxx x xxxxxxxxxxx léčivých přípravků xxx xxxxxx xxxxxxxxxx x xxxxxxxx přípravků, xxxxx mohou xxx xxxx takové xxxxxxxxx, xxxxx x léčivých xxxxxxxxx xxx použití x xxxxxxx xxxxxxxxx,“.
5. V §11 xx na xxxxx xxxxxxx x) xxxxx xxxxxxxxx xxxxxx x xxxxxxxx xx písmeno x), které xxx:
„x) xxxxxx opatření xxxxxx xxxxxx xxxxx §77x, xxxxxx xx stanoví xxxxxx přípravek, xxx xxxxx xxxxxxxxxx xxxx xxxxxxxx xxxxxxxxxx a xxxxxxxx léčby pacientů x Xxxxx xxxxxxxxx x xxxxxx dopadem xx xxxxxxx xxxxxx xxxxxxxxxxxx a x xxxxxxxxx xxxxxxxxxx poskytování xxxxxxxxxxx xxxxxx, x xxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx.“.
6. X §13 xxxx. 2 xxxx. x) xxxx 1 xx za xxxxx „xxxxxxxxxx o xxxxxxxx xxxxxxxxxx xxxxxx,“ vkládají xxxxx „xxxxxxxxxx o xxxxxxxxxx xxxxxxxx xxxxxxxxx,“.
7. X §13 xxxx. 2 xxxx. x) xxxx 3 xx xxxxx „xxxxxxxxxxxxxx“ xxxxxxx.
8. X §13 xxxx. 2 xxxxxxx x) xxxxxx poznámky xxx čarou x. 104 xxx:
&xxxx;„x) xxxxxx xxxxxxxxxx xxxxxxxx xx xxxxxxxxxx xxxxxxxxx xxxxx §51 a xxxxxx xxxxxxxx xxxxxxxx ve xxxxxx čl. 77 xxxxx xxxxxxxxxxxx předpisu Xxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx humánních xxxxxxxx přípravků104) (xxxx xxx „xxxxxxxx x xxxxxxxxx hodnocení“)“.
CELEX: 32014R0536
9. V §13 xxxx. 2 xx xx xxxxx xxxxxxx x) xxxxx xxxxxxxxx xxxxxx x doplňuje xx xxxxxxx x), xxxxx zní:
„n) v xxxxxxx xxxxxxxx xxxxxx x xxxxxxx léčiva, xxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxx xxxx xxxxxx xxxx, xxxxxxxxx o xxx, zda se xxxxxx léčivo xxxx xxxx xxxxxxxxxx xxxxx xxxx xxxxxxxxxxxx, xxxxxxx, xxxxxx do xxxxx xxxx používat xxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx.“.
10. V §13 xxxx. 3 xx xx konci xxxxxxx x) xxxxx xxxxxxxxx xxxxxx a xxxxxxxx xx písmena x) x x), xxxxx xxxxx:
„x) xxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxx xxxxx pro xxxxxx xxxxxxxx xxxxxx xxxxxx xxxxx §77c,
r) xx xxxxxxx xxxxxxxxxxx xxxxxxx xx xxxx s xxxxxxxx xxxxxxxxx sděluje Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxx §77x a xxxxxxx xx xxxxxx x xxxxxx xxxxxxxx xxxxxx xxxxxx xxxxx §77x.“.
11. X §16 xxxx. 2 písm. x) bodu 1 xx xx slova „xxxxxxxxxx o xxxxxxxx xxxxxxxxxx xxxxxx,“ xxxxxxxx xxxxx „rozhodnutí o xxxxxxxxxx xxxxxxxx xxxxxxxxx,“.
12. Xx §19 xx vkládá xxxx §19x, xxxxx včetně xxxxxxx xxx:
„§19x
Xxxxxxxxx xxxxxxxxxxx xxx
(1) Xxxxxxxxx xxxxxxxxxxx xxx xxxxxxxxx xx xxxxxxxx Xxxxxx x xxxxxxxxxxxx xxxxx, xxxxx xxxxx xx trh xxxx vyváží léčivo, xxxx xxxxxxxxx:
x) xxxxxxxxxxxxx xxxxx takové xxxxx, x to zejména xxxxx xxxx xxxxx x xxxxx,
x) xxxxx xxxxxx, xxxxxx obchodního xxxxx,
x) x případě xxxxxxx xxxxxxxxx o xxxx xxxxxxxx x xxxx původu xxxxxx x
x) xxxxxxxx xxxxxx xxxxxxxxx x xxxxxxx xxxxxxxxxx.
(2) Poskytnutí xxxxxxxxx xxxxx odstavce 1 xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxx xxxxxxxx xxxx.“.
13. X §21 xx xxxxxxxx 1 xxxxxxx.
Xxxxxxxxx xxxxxxxx 2 x 3 xx xxxxxxxx jako odstavce 1 x 2.
14. V §23 xxxx. 2 xxxx. x) xx xx xxxxx „xxxxxxx“ xxxxxxxx xxxxx „, xxxxx Xxxxx xxxxxxx xxxxxxxxxx xxxxx §13 odst. 2 xxxx. n)“.
15. V §33 xxxx. 2 se xx xxxx první xx xxxxx „xxxx xxxxx“ xxxxxxxx slova „x xxxx xxxxxxxxxxx Xxxxxxx xxxx Xxxxxxxxxxxx xxxxxxx“.
16. V §33 xxxx. 2 xx xxxx poslední xxxxxxxxx xxxxxx „Držitel xxxxxxxxxx x xxxxxxxxxx xxxxxxxxx Xxxxxx xxxxx a xxxxxxx údaje x xxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xx xxx v České xxxxxxxxx xxxxxxxxxxxx; xxxxxxxxxxx xxxxx xxxxxxxx identifikaci xxxxxxxx xxxxxxxxxx o xxxxxxxxxx, xxxxxxxxxxxx xxxxxxxx xxxxxxxxx x informaci x tom, xxx xxx léčivý xxxxxxxxx xxxxx lékárně xxxx xxxxxxxxxxxxxx; xxxxxxxxx, způsob, xxxxx x časový xxxxxxxx jejich poskytování xxxxxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxx xxxxxxx prováděcí právní xxxxxxx. Xx xxxxx Xxxxxx xxxx Xxxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxx xxxxxxxxxx x xxxxxxxxxx Xxxxxx xxxx Xxxxxxxxxxxxx xxxxxx xxxxx xxxxxxxx xx xxxxxx předepisování xxxxxxxx xxxxxxxxx x xxxxx x xxxxxx xxxxxxx léčivých xxxxxxxxx xxxxxxxxx na trh x Xxxxx xxxxxxxxx, xxxxx má x xxxxxxxxx.“.
XXXXX: 32001L0083, 32004L0027
17. X §33 xxxx. 3 písm. x) xx xxxxx „xx distribuce nebo xxxxxxx“ nahrazují xxxxx „xxxxxxxxx xx trh x Xxxxx republice“.
18. V §34 xx na xxxxx xxxxxxxx 2 doplňují xxxx „Léčivý přípravek xxxxxxxxxxxx xxxxxx a xxxxxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxxx xxx, xxxxx xxxxxx v xxxxxxxxxx x xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx, xxxxxx xxxxxx na xxx xxxxxxx xx xxxx 180 dnů xx xxxxxxxxx prodloužení xxxxxxxxxx. Xxxxxxxxxxxx, xxxxxxx, x xxxxxxx xxxxxxxxxxx léčivých xxxxxxxxx prodávat, x xxxxxxxx xxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxx xxxxxxxxxxx xxxx je xxxxxx léčivý přípravek xxxxx xxxx xx xxxx xxxx xxxxxxxxxxxxx.“.
19. X xxxxxxx xxxxx IV se xxxxx „VÝROBY“ xxxxxxxxx xxxxxx „XXXXXX“.
20. Nadpis xxxx 1 hlavy XX xxx: „Xxxxxxxx studie“.
21. §51 až 53 xxxxx:
„§51
Xxxxxxxx xxxxxxxxx xxxxxxxxx léčivých přípravků
(1) Xxxxx xxxxxxxx xxxxxxx x xxxxxxxx klinického xxxxxxxxx xxxxxxxxx léčivých xxxxxxxxx xxxxx x xx. 5, 13 x 14 xxxxxxxx x xxxxxxxxx hodnocení x žádosti x xxxxxxxx významné xxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxx x xx. 16 Xxxxxxxx XX x klinickém hodnocení. Xxxxx xxxx xxxxxxx xxxxxx nad xxxxxxxx xxxxxxxxxx hodnocení. Xxxxxxx xxxxx xxxxxxxxx x xxxxxxxxxxx x vyřízením xxxxxxx x xxxxxxxx xxxxxxxxxx hodnocení x xxxxxxx x xxxxxxxx xxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxxxx xxxxxxx se xxxxxxxx xx odborné xxxxx.
(2) Xxxxx xx x Xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxx xx. 83 xxxxxxxx x klinickém xxxxxxxxx.
(3) Xxxxx v rámci xxxxxxxxxx xxxxxxx x xxxxxxxx klinického xxxxxxxxx xxxxxxxxx xxxxxxxx přípravků xxxx xxxxxxxx změny xxxxxxxxxx hodnocení
a) v xxxxxxx, že xx Xxxxx republika ve xxxxxx k příslušnému xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxxxx xxxxx xx. 5 xxxx. 1 xxxx čl. 14 xxxx. 2 xxxxxxxx o klinickém xxxxxxxxx, xxxxxxxx xxxxxxxx xxxxxxxxx státu xxxxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxxxx hodnocení, xxxxxxxx xx xxxxxxx, xx xxxxx xx vztahuje xxxx X xxxxxxxxx xxxxxx,
x) x xxxxxxx, xx Xxxxx republika xxxx xx xxxxxx x příslušnému xxxxxxxxxx xxxxxxxxx xxxxxxxx státem xxxxxxxxxxx, vykonává činnosti xxxxxxxxx xxxxxxxxx xxxxx xxxxx xx. 2 xxxx. 12 xxxx xx. 14 xxxxxxxx x xxxxxxxxx hodnocení, xxxxxxxx xx xxxxxxx, xx xxxxx xx xxxxxxxx xxxx X xxxxxxxxx xxxxxx, x
x) xxxxxxxxxxx xxxx XX xxxxxxxxx zprávy k xxxxxxx x xxxxxxxx xxxxxxxxxx hodnocení xxxxxxxx xx Xxxxx republiky x x xxxxxxx x xxxxxxxx xxxxxxxx xxxxx xxxxxxxx xx Xxxxx republiky, xxxxx xxxxxxxx xx xxxxxxxxxx xxxxxxxxxxx xxxxxxx komisí.
(4) Xxxxx xxxxxxxxx x xxxxxxx x povolení xxxxxxxxxx xxxxxxxxx a x xxxxxxx x xxxxxxxx významné změny xxxxxxxxxx xxxxxxxxx xxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxx. Xxxx xxxxxxxxxx xxxxx pro xxxxx Xxxxx xxxxxxxxx.“.
XXXXX: 32014R0536
§52
Xxxxxxx xxxxxxxxx skupin xxxxxxxx xxxxxxxxx
(1) Klinické xxxxxxxxx xxx xxxxxxxx x xxxxxxxxx xxxxx za xxxxxxxxxxx, xx vedle xxxxxxxxxxxxx xxxxxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxx x xxxxxx x xxxxxxxxx hodnocení podpisem xxxxxxxxx souhlasu x xxxxxxx xxxxxxxxx xxxxx, xx-xx xx xxxxxxxxx xxxx xxxxxxxx x xxxxx xxxxxxxxxx.
(2) Xxxxxxxx xxxxxxxxx xxx provádět xx xxxxxxxx xxxxxxxxxxx xxxxx xxxxxxx xxxx x specifických xxxxxx xxxxxxxx, do xxxxxxx xxxxxx xxxxx
x) nacházející xx xx vazbě, xxxxxxxxxxxxx xxxxxxx xxxx xx xxxxxx xxxxxx xxxxxx xxxxxxx,
x) xxxxxxxxxx x xxxxxxxx ústavní xxxx,
x) xxxxxxx xxxxxxxxxxx xxxx xxxxxxx xxxxxx.
(3) Xxxxxxxx xxxxxxxxx xxx xxxxxxxx u xxxx xxxxxxxxx x xxxxxxxx 2 xxx xxxxx, xxxxx k xxxx xxxx osoby xxxxxxx xxxxxxxxx a xxxxxxxxxxxx xxxxxxxxx x pokud xxxxxxxx xxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxx k xxxxxxxxx, že účast x klinickém hodnocení xxxx xxx xxx xxxx osoby přímý xxxxxxx nebo zdravotně xxxxxxxxxxx přínos, xxxxx xxxxxxx xxx xxxxxxxxxxxxx xxxxxx x xxxxxx, xxxx xxx xx xxxxxxxx do klinického xxxxxxxxx xxxx xxxxxxx xxxxxxxx xxxxxxxxxxx, xxxxxxxxx xxxxxxxx, xxxxxxxxxxxx xxxxxxxxxxx xxxxx.
XXXXX: 32014R0536
§53
Xxxxxx xxxxxx
(1) Xxxxxx xxxxxx xx xxxxxxx Xxxxxx.
(2) Xxxxxx xxxxxx xxxxxxxx xxxxxx xxxxxx xxx xxxxxxxxx xxxxxxxxxx x xxxxxxx xxxxxx xxxxxxx, xxxxxxxxxx xxxxxx, xxxxxxxx x xxxxxxx xxxxxxx, žádostí x povolení xxxxxxxxxx xxxxxxxxx, xxxxxxx o xxxxxxxx xxxxxxxx změny xxxxxxxxxx xxxxxxxxx x xxxxxx stanoviska x xxxxxxx a způsobem xxxxx xxxxxx xxxxxx x xxxxxxxx x xxxxxxxxx hodnocení.
(3) Ústav xxxxxxxxx pro xxxxxxx xxxxxx xxxxxxxx xxx xxxx xxxxxxx.
(4) Xxxxx xx předchozím xxxxxxxx Xxxxxxxxxxxx zdravotnictví xxxx Xxxxxx etické xxxxxx. Xxxxxxx xxx xxxxxx xxxxxx (xxxx xxx „Xxxxxxx xxx“) xxxxxx xxxx etická xxxxxx. Xxxxxx etické xxxxxx x Xxxxxxx xxx Xxxxx xxxxxxxx na xxxxx xxxxxxxxxxxxx stránkách.“.
CELEX: 32014R0536
22. Xx §53 xx xxxxxxxx xxxx §53x xx 53x, xxxxx xxxxx:
„§53x
Xxxxxxx etické xxxxxx
(1) Etická xxxxxx xx xxxxxxx xx xxxxxx. Xxxxxxx jsou xxxxxxx z xxxxxxxxx x xxxxxxx xxxxxxxxxxxxx x osob bez xxxxxxxxxxxxxx xxxxxxxx. Xxxxx xxxxxx a xxxxx xxxxx xxxxxxxxxxxx xxxxxx xxxxxx komise xxxxxxx Xxxxxx xxxxxx xxxxxx. Xxxxxxx etické komise xxxx jmenováni xxx, xxx x xxxxx xxxxxxx etické xxxxxx xxxx nejméně 5 xxxx, z nichž xxxxxxx 1 xxxxx xxxx bez xxxxxxxxxxxxxx xxxxxxxx.
(2) Xxxxx etické xxxxxx jmenuje x xxxxxxxx xxxxxxx xxxxxxxxxxxxx, x xx do xxxxxxxxxxxx xxxxxx. Xxxxxxx xxxxxx xxxxxx xx xxxxxxxx x xxxxxxxx, xxxxxxxxxxxxx x dalších xxxxx. Xxxxxxxx a xxxxxxxxxxxxx xxxx voleni xxxxx xxxxxxx x xxxxxxx x Xxxxxxxx xxxxx etické xxxxxx.
(3) Xxxxxxx etické komise xxxx xxxxxxxx xxxxxxxxx xx. 9 xxxxxxxx x klinickém hodnocení x dále xxxx xxx kvalifikaci x xxxxxxxxx xxxxxxxxx a xxxxxxxx žádost x xxxxxxxx xxxxxxxxx z xxxxxxxx xxxxxxxx, xxxxxxxxxx x xxxxxxxxx, x xxxxxxxx xxxxx bez xxxxxxxxxxxxxx vzdělání, xxxxx xxxxxxxx xxxxxx x xxxxxxxx hodnocení zejména x hlediska etického.
(4) Xxxxxxx xxxxxx komise xx xxxxx vyjádření x žádostem x xxxxxxxx xxxxxxxxxx xxxxxxxxx, xx xxxxx xxxxxxxxx xxxx xxxxxx zájem, xxxxx x vyjádření x xxxxxxxxx xxxxxxxx x xxxxxxxx významné xxxxx x vykonávání xxxxxxxxx xxxxxxx xxx xxxxxxx xxxxxxxxx hodnocením x neprodleně xxxxxx xxxxx osobního xxxxx xx xxxxxxxxxxx klinickém xxxxxxxxx xxxxxx xxxxxx x Xxxxxx.
(5) Členové xxxxxx xxxxxx mají xxxxxxxxx zachovávat xxxxxxxxxxx x xxxxxxxxxxx x xxxxxxxxxxxxx, xxxxx se xxxxx x xxxxxxxxxxx xx xxxx členstvím x etické xxxxxx.
(6) Xxxxxx xxxxxx komise xxxxxx xxx xxxxx, xxxxx xx xxxxxxxxx xxxxxxxxx podle §108 xxxx. 8. Xxxxxxxx-xx xx xxxx xxxxxx xxxxxx xxxxxxxx přestupku, xxxx xxxxxxxx x xxxxxx komisi xxxxxx.“.
XXXXX: 32014R0536
§53x
Xxxxxxx xxxxxx xxxxxx
(1) Xxxxxxxxxx etické xxxxxx xx xxxxxxxxx x xxxxxxx xxxx, xxxxxxxxxxx x xxxxxx xxxxxxxx xxxxxxxxx.
(2) Etická komise xxxxxxxxxxx xxxxxx xxx xxxxxxxxx hodnocením xx xxxxxxx xxxxxx x xxxxxxx xxxxxxxxxx xxxxxxxxx xx xxxxxxxxxxxxx xxxxxxxx, x xxxx xxxxxxxx xxxxxxxxx probíhá, (dále xxx „xxxxx xxxxxxxxxx xxxxxxxxx“) xxxxxxxxxx podle xxxxx správné xxxxxxxx xxxxx xxxxxxxxxxx xxxx xxxxxxx xxxxxxxxxxx. Náležitosti xxxxxx x xxxxxxx xxxxxxxxxx xxxxxxxxx a xxxxxx xxxxxxxxx xxx xxxx xxxxxxxxxxx stanoví xxxxxxxxx xxxxxx předpis.
(3) Xxxxxx xxxxxx xxxx xxx získání názoru xxxxxxx xxxxx xxxxxxxxx. Xxxx xxxxxxxxx musí xxxxxxxx xxxxxxxxx xx. 9 xxxxxxxx x xxxxxxxxx xxxxxxxxx. Xxxx xxxxxxxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx x xxxxxxxxxxx x xxxxxxxxxxxxx, xxxxx xx xxxxx x xxxxxxxxxxx xx xxxx xxxxxxxx v xxxxxx xxxxxx.
(4) Xxxxxx xxxxxx xxxxxxxx xxxx xxxxxxx x xxxxxxx x Xxxxxxxx řádem, xxxxx xxxxxxxx xxxxxxx
x) xxxxxx xxxxxxxxx zasedání, xxxxxxxxxx xxxxx skupiny x xxxxxx xxxxxx xxxxxxxx.
x) xxxxxx xxxxxxxx xxxxxxxxxxx stanoviska xxxxxx xxxxxx.
(5) Xxxxxx komise xxxx xxxxxxxx xxxx xxxxxxx xxxxx xxxxxxxxxx xxxxxxx xxxxxx xxxxxx, xxxxx xxxxxxx Xxxxx x které xxxxxxxx xxxxxxx
x) xxxxxx xxxxxxxxxx xxxxxxx o xxxxxxxx xxxxxxxxxx xxxxxxxxx a xxxxxxx x xxxxxxxx xxxxxxxx xxxxx klinického xxxxxxxxx x xxxxxxx xxxxxxxxxx xxxxxxxxx o xxxxxxxxx xxxxxxxxx,
x) xxxxxxx xxx nakládání x xxxxxxxx zkoušejících xxxx xxxxxxxx xxxxxxxxxxxx, xxxx-xx xxxxxxxx, x zadavatelů x x xxxxxxxxxxx xxxxxxxxx dohledem xxx xxxxxxxxx hodnocením xx xxxxxxxxx xxxxx způsobem xxxxx xx. 52 xx 54 nařízení x xxxxxxxxx hodnocení,
c) xxxxxx, xxxxx xxxxxx xxxxxx předává Xxxxxx xxx xxxxxxxxxx xx xxxxxxxxxx xxxxxxxxx xxxxxx xxxx xxxxxxxxxx.
XXXXX: 32014R0536
§53x
Xxxxxxxxxx
(1) Xxx xxxxxxxx xxxxxxxxxx, xxxxxxxxxx xx aspektů, xx které xx xxxxxxxx část I xxxxxxxxx zprávy x xxxxxxx x povolení xxxxxxxxxx hodnocení nebo xxxxxxx x xxxxxxxx xxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx v rozsahu xxxxxxx, xx xxxxx xx xxxxxxxx xxxx X xxxxxxxxx xxxxxx, xxxxxx xxxxxx xxxxxxx xxxxxxxx klinického xxxxxxxxx x xxxxxxx
x) xxxxxxxxxxxxxxx xxxxxxxxxx hodnocení x xxxx xxxxxxxxxx,
x) xxxxxxxxxxxxx xxxxxx xxxxxxxxxxxxxxx xxxxxxx x xxxxx x xxxxxxxxxxxxx jeho závěrů, x
x) etických aspektů xxxxxxxxxx xxxxxxxxx.
(2) Xxxxxx-xx xxxxxx xxxxxx v xxxxxxx x nařízením x xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxx, je xxxx xxxxxxxxxx xxxxxxx x xxxxxx x xxxxxxxx klinického hodnocení xxxx x povolení xxxxxxxx xxxxx klinického xxxxxxxxx x Xxxxx xxxxxxxxx Ústav xxxxxxxxxxx xxxxxxx. Xxxxxxxxx xxxxxxxxxx, xxxxxxxx xx xxxxxxx, xx xxxxx xx xxxxxxxx xxxx I xxxxxxxxx xxxxxx x xxxxxxx x povolení xxxxxxxxxx hodnocení xxxx x žádosti x xxxxxxxx xxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx týkající xx dodatku xxxxxxxxx xxxx xxx vydáno xxxxx x xxxxxx xxxxxxxxx x nařízení x xxxxxxxxx xxxxxxxxx. Xxxxxxxxxx xxxx xxxxxxxxx xxxxxxxxxx, ve xxxxxx xx uveden výčet x xxxxx xxxxxxxxxxx x xxxxxxxxxxxx xxxxxx, xxx které zaujala xxxxxx xxxxxx xxx xxxxxxxxxx. Xx řádné xxxxxxxxxx xxxxxxxxxx x xxxx xxxxxx xxxxxxx Xxxxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxx.
(3) Xxxxxx xxxxxx vydá xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xx xxxxxxx, xx které xx xxxxxxxx část XX xxxxxxxxx xxxxxx x xxxxxxx x xxxxxxxxx zdůvodněním xxxxx xxxxxxxxxx. Při přípravě xxxxxx stanoviska etická xxxxxx postupuje v xxxxxxx s xxxxxxxxx x xxxxxxxxx xxxxxxxxx.
(4) Xxx zpracování xxxxxxxxxx xxxxxx xxxxxx xxxxx xxxxxxxx 3 skupina xxxxxx komise určená xxx xxxxxxxxx konkrétního xxxxxxxxxx xxxxxxxxx xxxxxxx xxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxxxxxx předloženou xxxxxxxxx x xxx, xx tuto xxxxxxxxxxx xxxxxxx x xxxxxxxx, xxx
x) xxxxxxxxxx nebo xxxxxxxxx odškodnění xxxxxxxx xxxxxxxxx xxx případ xxxxxxxxx xxxx x xxxxxxxx xxxx účasti x klinickém xxxxxxxxx xxxx zajištěny xxxxxxxxx xxxxxxxx,
x) xxxxxxxxx xxxxxxxxxxxx xxx xxxxxxxxxx a xxxxxx xxxxxxxxxx, xxxx-xx xxxxxxxx, a zadavatele xx xxxxxxxxx pojistnou xxxxxxxx, xxxxxxxxx xxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxx x xxxxxxxx zkoušejících, xxxx-xx xxxxxxxx, xxxx xxxxxxxxxx xxxx xxxxxxxx xxxxxx xxxxxxxxxxxxxxxx vztahů,
c) xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxx xxxxxx xxxxxxxxxx subjektem xxxxxxxxx x xxxxxxxxxxx x xxxx xxxxxx x xxxxxxxxx xxxxxxxxx,
x) xxxx xxxxxx pro xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxx, x to xxxxxxx xx xxxxxx x xxx xxxxxxxxx xxxxxxx, x xxxxx nemá xxxxxxx hodnocení přímý xxxxxxxx,
x) xx xxxxxxxx xxxxxx zajištění xxxxxx xxx xxxxxxxxxx x xxxxxxxx xxxxxxxxxxxx, xx-xx xxxxxxx,
x) xxxxxxxxxx x xxxxxx zkoušející, xx-xx xxxxxxx, xxxxxxx xxxxxxxxx xxxxxxxxx x §54,
g) xxxxx xxxxxxxxxx xxxxxxxxx xx xxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx.
(5) Xxxxxx xxxxxx xxxxxxxx x xxxxxxxx xxxxxxx xxxx, xxxxxxxxxxx x xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx a xxxxxxx xxxx xxxxxxxx xxxxxxxxx x jejich xxxxxx a xxxxxxxxxx xxxxxxxxxxxx, xxxx xxxxxxxx xxxxxxxxxxxx, xxxx-xx ustaveni, xxxxxxx x xxxxxxxxxxx x xxxxxxx o xxxxxxxx xxxxxxxxxx hodnocení.
(6) Xx řádné zpracování xxxxxxxxxx xxxxx xxxxxxxx 3 x xxxx xxxxxx xxxxxxx Ústavu xxxxxxxx xxxxxxxx etické xxxxxx. Stanovisko xxxx xxxxxxxxx odůvodnění xxxxxxxxxx.
(7) Xxxxxx komise může xxxxxxx xxxxxx xxxx xxxxxxx xxx xxxxxxxxx xxxxxxxxxx x prováděním xxxxxxxxxx xxxxxxxxx, xxxxxxxx xx xxxxxxxxx xxxx xxxxxxxxxxx xxxxxxxxx pro xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxxx nebo xxxxxx xxxxxxxxxx nebo xxxxxxxxxx xxxxxx závažným xxxxxxxx podmínky provádění xx uspořádání xxxxxxxxxx xxxxxxxxx, k němuž xxxxxx komise xxxxxx xxx xxxxxxxxx xxxxxxxxxx. Xxxxxx-xx xxxxxx xxxxxx, xx xx vyskytly xxxxxx pro odvolání xxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xx xxxx xxxxx, požádá Xxxxx, xxx xx xxxxxxx xxxxxxxxxx xxxxxxxxxx, popřípadě xxxxxxxxxxxx xxxx hlavního xxxxxxxxxxxx x těmto xxxxxxx, s xxxxxxxx xxxxxxx, kdy je xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx. Xxxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxx xxxxxxxx
x) xxxxxxxxxxxxx xxxxx x xxxxxxxxx xxxxxxxxx, xxxxxxx xxxx xxxxx, xxxxxxx xxxxxxxxxx xxxx xxxxxxxxxx, xxxxxxxx identifikační xxxxx x číslo xxxxxxxxx,
x) xxxxxxxx xxxxxxx, xxx xx jedná x xxxxxxx xxxx xxxxxx odvolání xxxxxxxxxxx xxxxxxxxxx, x případě xxxxxxxxx xxxxxxxx xxxxxxxx xxxx xxx xxxxxxxxx xxxxxxxx, xx xxxxxxx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxx,
x) odůvodnění, xx xxxxxx xx xxxxxx xxxxxx odvolání souhlasného xxxxxxxxxx, xxxxxxxx xxx xxxx vydání a xxxxx, xxxxxxx xx xxxxxx komise xxxxxx,
x) xxxxxxxx nezbytná k xxxxxxxx xxxxxxxxxx xxxxxxxxx, xxxxxxx k xxxxxxx xxxxxxxx xxxxxxxxx xx xxxxx xxxxx, nejsou-li xxxxxxx xxx x xxxxxxxxx,
x) xxxxx xxxxxxxx xxxxxxxxxxx stanoviska x xxxxxx xxxxxxxx xxxxxxx xxxxxx xxxxxx, xxxxx xxxxxxxx xxxxxx.
(8) Xxxxxx xxxxxx je xx xxxxxxxx Xxxxxx xxxxxxx xxxxxx Ústavu xxx xxxxxxxxxx ke xxxx xxxxxxxxxx, xxxxx xxxxxxxxx xxxxxxxxx xxxxxxx xxxxxx,&xxxx; xxxxxxxxxx jeden xxxxxxxx xxx před xxxxxxxxx xxxx xxxxx, xxxxxxxxxx Xxxxxx xxx xxxxxx xxxxxxxxx x xxxxxxx xxxxxxx, xxxxxxx x xxxxxxxx xxxxxxxxxxx k xxxxxxx, xxxx xxxxxxxxxxxxxx xxxxxxxx, fázi konsolidace, xxxxxxxxx doplňujících xxxxxxxxx, xxxxxxxxx xxxxxxxxx xxxxxxx xx obdržení doplňujících xxxxxxxxx, xxxxxxxxxx xxxxxxx xxxxx I xxxxxxxxx xxxxxx xxxx xxxxxxxxxx xxxxxxx xxxxx XX xxxxxxxxx xxxxxx, v xxxxx xxxxxxxxx podle xx. 5, 6, 7, 13, 14, 17, 18, 20 x 22 xxxxxxxx x xxxxxxxxx xxxxxxxxx.
(9) Xxxxx uchovává v xxxxxxxxxxx x xxxxxxxx xxxxxx xxxxxx xx xxxx 5 xxx xx xxxxxxxx klinického xxxxxxxxx xxxx dokumenty:
a) xxxxxx x jednání,
b) xxxxxxxxxx o xxxxxx xxxxx,
x) xxxxxxxxxx xxxxx xxxxxx xxxxxx,
x) záznamy x xxxxxxxxxx a xxxxxx xxxxxxxxxx xxxxx xxxxxx komise,
e) xxxxxxxxx x xxxxxxxxx a xxxxxxxx členů xxxxxx xxxxxx,
x) xxxxxxxxx xxxxxxxxxx xx xx xxxxxxxxx, xxxxxxxx xxxxx etické xxxxxx, jakož x xxxxxxxxxx z xxxxxx,
x) xxxxxxxxxxxxxx a obdobné xxxxxxx, xxxxxx xxxxxxxx, xxxxx xxxxxxxx k xxxxxx xxxxxxxxxx, x xxxxxxxxx xxxxxxxxxxxxxxxx x xxxxxxx xxxxxx, x
x) xxxxxxxxxxxxx etické xxxxxx.“.
XXXXX: 32014R0536
23. §54 xx 59 včetně xxxxxxxx xxx xxxxx x. 102 x 103 xxxxx:
„§54
Xxxxxxxxxx x místo xxxxxxxxxx xxxxxxxxx
(1) Zkoušejícím x xxxxxxx zkoušejícím xxxx xxx xxxxx xxxxx nebo xxxxx xxxxx splňující podmínky xxxxxxxxx xxxxx právním xxxxxxxxx29) pro xxxxx xxxxxx xxxxxxxxxxxxxx xxxxxxxx, xxxxx má nezbytné xxxxxxx xxxxxxxx a xxxxxxxxxx x xxxx x pacienty x xxxxxxxxxxx xxxx xxxxx, xx xxxxxxx léčbu xx xxxxxxxx xxxx xxxxxxxx xxxxxxxxx, a xx xxxxxxxx xxxxxxx xxxxxxxx xxxxx.
(2) Xxxxxxxx xxxxxxxxx lze xxxxxxxx xxxxx x xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx xx xxxxxxxxxxxxx xxxxxxxx.
(3) Poskytovatel xxxxxxxxxxx služeb, x xxxxx xx xxxxxxxxx xxxxxxxx hodnocení, x xxxx xxxxxxx x xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxx přípravku xxxxxxx, x xxxxxxxxxxxx xxxxxxxxxxx xxxxxx, x xxxxx xx xxxxxxxxx xxxxxxxx xxxxxxxxx xxx léčebného xxxx xxxxxxxxxxxxx efektu xxx subjekty xxxxxxxxx, x xx xxxxxxx xxxxxxxxxxxxxxx a xxxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxx xxx xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxx xxxxx xxxxxxxx Xxxxxxx. Xxxxxx x xxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxx stanoví xxxxxxxxx právní xxxxxxx.
(4) Xxx poskytovatele xxxxxxxxxxx xxxxxx xxxxxxxxx v xxxxxxxx 3, u xxxxx jsou xxxxxxxxx xxxxxxxx hodnocení, není xxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxx xxxxx xxxxxxx; xxxxx xxxx o xxxx xxxxxx požádat; xxxxxxxx 3 xxxx xxxxx xx xxxxxxx xxxxxxx.
XXXXX: 32014R0536
§55
Xxxxx
(1) Xxxxxxxxxxx xxxxxxxxxx hodnocení xxxx xxx předložena v xxxxxx xxxxxx, pokud xxx o xxxx xxxxxxxxx:
x) xxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx,
x) informace xxx pacienta, xxxxxxxxxxx xxxxxxx, xxxxxxx xxxxxxxxxxx x jeho xxxxxx x xxxxxxxxx xxxxxxxxx x xxxxxxx x xxxxx dokumentům,
c) xxxxxxxxx x xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx x Xxxxx republice,
d) xxxxxxxx xxxxxxxxx vztahující se x danému xxxxxxxxxx xxxxxxxxx,
x) xxxxxxx xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxx,
x) xxxxxx xxxxxxxxxxxx x xxxxxxxx xxxxxxxxxxxx, xxxx-xx xxxxxxxx,
x) seznam xxxx xxxxxxxxxx xxxxxxxxx,
x) doklad x xxxxxxxxx náhrady xxxx subjektům xxxxxxxxx,
x) xxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxxxx xxx xxxxxxxxxx x hlavní xxxxxxxxxx, xxxx-xx xxxxxxxx, x xxxxxxxxxx nebo xxxxxxxxxx xxx xxxxxxxx xxxxxxxxx.
(2) Xxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx, xxxxx-xx x dokumenty uvedené x odstavci 1, xx xxxxxxxxx x xxxxxx, xxxxxxxxxx xxxx xxxxxxxxx jazyce.
(3) Informace x označení xx xxxxx xxxxxxxx přípravků xxx klinické xxxxxxxxx xx xxxxxxx v xxxxxx jazyce, není-li x rozhodnutí Xxxxxx xxxxxxx jinak.
CELEX: 32014R0536
§56
Xxxxxxxxx x xxxxxxx xxxxxx xxxxxxxxx
(1) Xxxx-xx splněny xxxxxxxx stanovené x xx. 59 xxxx. 2 xxxxxxxx x xxxxxxxxx xxxxxxxxx, xxxxx xxx xx xxxxx Xxxxx xxxxxxxxx xxxxxxx xxx xxxxxxxxx xxxxxxxxx x xxxxxxxxxxxxxx léčivé xxxxxxxxx.
(2) Xxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxx léčivé xxxxxxxxx, xxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxxxxxx xxxxx xxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxx klinického xxxxxxxxx x zdravotnické xxxxxxxxxx xxxxxxxx pro xxxxxxxxx xxxxxxxxxx hodnocení, xxxxx xxxx xxxxxx x xxxxxx hodnocených xxxxxxxx xxxxxxxxx. V xxxxx xxxxxxxxxx xxxxxxxxx humánních xxxxxxxx přípravků, xxxxx xxxxx xxxxxx notifikovaný xxxxxxxxxxxx xxxxxxxxxx, xxx xxxxxx po xxxxxxxxxx xxxxxxxxx Ústavem x xxxxxx zdravotnický xxxxxxxxxx, xxxxx xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxx x xxxxxxxxxxxxxx prostředcích. Xx-xx zadavatelem xxxxxxxxxx xxxxxxxxx, xxxxxx xx xxx xxxxx tohoto xxxxxx xxxxxx xxxxxxxxxxxx xxxxxxxxxxx služeb xxxxxxx xxxx xxxxxxxx státem xxxx xxxxxxx samosprávním xxxxxx, xxxxxxx vysoká xxxxx a veřejná xxxxxxxx instituce, x xxxxxxxxx xxxxxx xxxxxxxxx xxxx xxxxxxxxxxxx v Xxxxx republice, není xxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx zdarma xxxxxxx.
(3) Xxxx-xx xxx x xxxxxxxxx hodnocení xxxxxxxxx xxxxxxxx xxxxxxxxx použita xxxxxxxxxxxx neregistrovaná podle xxxxxx xxxxxx, pak x xxxxxxx x xxxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx x xxxxxxxxxxx k xxxxxxx x xxxxxxxx klinického xxxxxxxxx xxxxxxxxxx Xxxxxxxx xxxxx pro jadernou xxxxxxxxxx xxxxxx xxxxx §18.
(4) Mají-li xxx x klinickém xxxxxxxxx xxxxxxxxx xxxxxxxx přípravků xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxxx organismy, xxxxxxxx zadavatel spolu x xxxxxxxxxxx k xxxxxxx x povolení xxxxxxxxxx xxxxxxxxx souhlas Xxxxxxxxxxxx xxxxxxxxx prostředí xxxxxx xxxxx xxxxxx xxxxxxxx předpisu11).
(5) Xxxx-xx xxx v klinickém xxxxxxxxx humánních xxxxxxxx xxxxxxxxx použity přípravky xxxxxxxxxx xxxxxx embryonální xxxxxxx xxxxx, xxxxxxxx xxxxxxxxx xxxxx x xxxxxxxxxxx x žádosti x xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx k xxxxxxxxx s lidskými xxxxxxxxxxxxx xxxxxxxxx buňkami xxxxxx Ministerstvem xxxxxxxx, xxxxxxx x xxxxxxxxxxx xxxxx jiného xxxxxxxx xxxxxxxx102).
(6) Xxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxxxxxxx xxxxxxxx hodnocení xxxxx čl. 2 xxxx. 3 xxxxxxxx x klinickém xxxxxxxxx xxxxxxxxx xxxxxxxxxxxx zadavateli, xxxxx nebudou xxxxxxxxx xxx xxxxxxxxxx nebo xxxxx registrace xxxxxxxx xxxxxxxxx, xxxxxxx prováděcí xxxxxx xxxxxxx xxxxxxxxx xx xxxxxxxxxxxx, xxxxx xxxxxxxxxx dokumentů x xxxxxxxxx označování hodnocených xxxxxxxx xxxxxxxxx. Xxxxxxxxxx xxxxxxxxx xxxxxxxxxx podle xxxx xxxxx xx xxxxxx xxxxxxxx hodnocení xxxxxxxxx xxxxx na xxxxx Xxxxx xxxxxxxxx, xxxxx cílem xx xxxxxxxxx xxxxx xxxxxx xxxxxxxx, x rámci xxxxxxx xxxx veškeré xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxx xxxxxx xxxxxx x Xxxxx xxxxxxxxx x xxxx xxxxxxxxx x xxxxxxx xx xxxxxxxx údajů x xxxxxxxxx nebo xxxx xxxxxx xxxxx x přípravku, je-li xxxxxx způsob použití xxxxxx s xxxxxx xxxxxxxxx praxí xxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxx x dostatečně xxxxxxxxx xxxxxxxxx poznatky.
CELEX: 32014R0536
§57
Xxxxxx xx xxxxxxxxxxx
Xxxxx může xx xxxxxxxx xxxxxxxxxxx x xx. 42 xxxx. 3 xxxxxxxx x klinickém xxxxxxxxx xxxxxxx se xxxxxxxxxxx xxxxxx, xxxxx níž xxxx zadavatel xxxxxxxxx xx závažné xxxxxxxxxxx xxxxxxxxx xxxxxx hlásit xxxxx Xxxxxx; x xxxxxxx případě xxxxxx xxxxxxxxx xx závažné xxxxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxx Ústav.
CELEX: 32014R0536
§58
Xxxxxx xxxxxxx újmy xxxxxxx xxxxxxxx xxxxxxxxx
(1) Xxxxxxx-xx xxxxxxxx klinického xxxxxxxxx x xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxx xxxx, x to xxxxxxx xx životě xxxx xx xxxxxx, je xxxxxxxxx xxxxxxx xx xxxxxxxx v xxxxxxx x xxxxxx xxxxxxxx xxxxxxxx 103). Xxxxxxx xxxx xxx xxxxxxxx x xxxxxxxxxx prostřednictvím xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx xx xxxxxx xxxxxxxxxx xxxxxxxxx.
(2) Xxxxxxxxx xx povinen xxx xx xxxxx dobu xxxxxxxxx xxxxxxxxxx hodnocení xxxxxxxx pojištění xxxxxxxxxxxx xxx, xxxxxxxx zkoušejících, xxxx-xx xxxxxxxx, a xxxxxxxxxxxx xx xxxx xxxxxxxx subjektu xxxxxxxxx x důsledku xxxxxxxxx xxxxxxxxxx hodnocení.
(3) Xxxxxxxx 2 se xxxxxxxxx, xxxxxxx-xx klinické hodnocení xxxxxxxxxx xxxxxxxxx, xxxxx xxxxxxxxx činnosti xxxxxxx xxxxxxx xxxxxxxx přípravků x xxxxx xxxxxxxxxx xxxxxxxxx,
x) s xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxx xxxxx xxxxxx xxxxxx x Xxxxx republice x xxxxxxxxxxx v xxxxxxx xx xxxxxxxx údajů x xxxxxxxxx, popřípadě x léčivými přípravky xxxxxxxxxxxxxx podle xxxxxx xxxxxx x Xxxxx xxxxxxxxx a xxxxxxxxxxx xxxx xxxxxx xxxxx x xxxxxxxxx, je-li xxxxxx xxxxxx xxxxxxx xxxxxx s xxxxxx xxxxxxxxx praxí xxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxx x xxxxxxxxxx odůvodněn xxxxxxxxx poznatky, x xxxxxxx
x) xxxxxxxxx diagnostické xxxx xxxxxxxxxxxx postupy xxxxxxxxxxxxx v xxxxxxxxx x xxxxxx xxxxxxxxx xxxxx xxxxx xxx xxxxxxxxx xxxxxxxxx xxxxxx xxxx zátěž xxx xxxxxxxxxx xxxxxxxx xxxxxxxxx.
XXXXX: 32014R0536
§59
Xxxxxxxxxx
Xxxxxx-xx zadavatel x xxxxxxx xxxxxxxxxx podle xxxxxxxx o xxxxxxxxx xxxxxxxxx svého xxxxxxxx xxxx xxxxxxxxx xxxxx, xxxxxxxx xx xxxxxx xxxxxxxx xx xxxxxxxxx xxxxxxxxxx xx xxxxxxx xxxx moci, xxxxxxxxx-xx xxxxxxxxx nebo xxxxxxxx xxxx.
XXXXX: 32014R0536
24. X §60 xxxx. 3 písm. x) xx xxxxx xxxxxxxxx tečkou a xxxxxxx x) xx xxxxxx xxxxxxxx pod xxxxx x. 64 xxxxxxx.“.
25. V §62 xxxx. 1 xx xx xxxx xxxxx, xxxxx „za xxxxxx xxxxxxxxxx xxxxxxxxx x“ xxxxxxx.
26. V §64 xxxx. x) se xxxxx „§55 a xxxxxxxxxxx x xxxxx xxxxxx x xxxxxxx x xxxxxxxx nebo xxxxxxxx xxxxxxxxxx xxxxxxxxx“ xxxxxxxxx xxxxx „nařízení x xxxxxxxxx xxxxxxxxx x schválenými v xxxxx xxxxxx x xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx nebo x povolení xxxxxxxx xxxxx klinického hodnocení“.
CELEX: 32014R0536
27. X §64 xxxx. w) xx xxxxx „xxxxxx hodnocených xxxxxxxxx léčivých xxxxxxxxx,“ xxxxxxx.
28. X §66 xx xxxxxxxx 4 xxxxxxx.
Xxxxxxxxx odstavec 5 xx xxxxxxxx jako xxxxxxxx 4.
29. X §70 xxxx. 1 xx xx xxxx xxxxx xx xxxxx „xxxxxxxxx“ xxxxxxxx xxxxx „x xxxxx xxxxxxxxxxx předpisem Xxxxxxxx xxxx101)“ x xx xxxxx „xxxxx“ xx xxxxxxxx xxxxx „xxxxxx xxxxxxxx xxxxx xxxxxxxx xxx vývoz“.
CELEX: 32014R1252
30. V §70 xx xxxxxxxx xxxxxxxx 7, xxxxx zní:
„(7) Xxxxxxx xxxxxxxx xxxxx, xxxxx xxxxxxx xxxxxx, xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxxxx, xxxxxxxx xxxxxxx xxxx xxxxxxxxxxx, xxxxx i xxxxxxxxxxx kontroly xxxxxxxx xxxxx pocházejících xx xxxxxxx xxxx určených xxx xxxxxxxx léčivých xxxxxxxxx, xxxx xxx x dispozici dokumenty xxxxx odstavce 2; xxx xxxxxx dotčena xxxxxxxxxx xxxxxxxx 4 x 5.“.
XXXXX: 32014R1252
31. X §77 xxxx. 1 xxxx. x) xx xxxxx „xxxxxx xxxxx x xxxxxx xxxxxx xxxxxxxxxxx xxxxxx xxxxxxx zveřejní Xxxxx xxxx Veterinární xxxxx ve xxxx xxxxxxxxxxx xxxxxxxxxx“ nahrazují xxxxx „xxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxxxx distributora, xxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx a xxxxxxxxxxxx xxxxx podle písmene x), které xxx xxxxxx přípravek distribuován; xxxxxxxxx údajů, xxxxx, xxxxxx a xxxxxx xxxxxxxx xxxxxx poskytování xxxxxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxx xxxxxx xxxxxxx“.
32. X §77 xxxx. 1 xxxx. x) xx xx xxxxx „xxxxxxxx x Xxxxx xxxxxxxxx“ xxxxxxxx xxxxx „; x xxxxxxx, xx provozovatel xxxxxxxxx xxxxxxx léčivé xxxxxxxxx xxxxxx distributora x dodávku xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx, jehož xx distributorem a xxxxx v xxxxxx xxxxxxxxxxx 6 kalendářních xxxxxx prokazatelně distribuoval, xx distributor povinen xxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xx 48 hodin xx xxxxxxxx jeho požadavku; xxxx xx xxxxxxx xxxxxxxxxx x xxxxxxx x xxxxxxxxx xxxxxx xxxxxx xxxxxxx Xxxxxxxxxxxxx xxxxxxxxxxxxx xx účelem xxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx podle §77x, xxxxxx se xxxxxxx xxxx zakazuje xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx.“.
33. X §77 xx na xxxxx xxxxxxxx 1 xxxxx xxxxxxxxx čárkou a xxxxxxxx se písmeno x), xxxxx zní:
„q) x xxxxxxx, že xx xxxx xxxxxxx xxxxxxxxxxxx do zahraničí xxxxxx xxxxxxxxx, xxxxx xx uveden xx xxxxxxx xxxxxxxx xxxxxxxxx xxxxx §77c, oznámit xxxx xxxxxxxxxx Ústavu; xxxxxxxx xx xxxxxxxxxxx xxxxxxxxxxxx a xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxx, xxxxxxxxxxxx xxxxxxxx přípravku, xxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxxxx, název xxxxx xxxxxxxxxx x xxxxx plánované xxxxxxxxxx xxxxxxxx xxxxxxxxx; xxxxxxxxx xxxxx xxxxxxxxx x xxxxxxxx, způsob a xxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxxxx hlášení xxxxxxxx xxxxxxx xxxxxxxxx xxxxxx xxxxxxx; x xxxxxxx, xx xx xxxxxxxx xxxxxxxxxxxx nebylo xx dne, kterým xxxxxx 15 xxx xxx xxx, kdy xxxxxxxxxxx xxxxxxx xxxxx xxxxxxxxxxxx léčivý xxxxxxxxx, xxxxxx xxxxxxxx xxxxxx xxxxxx xxxxx §77x xx xxxxxx k xxxxxx xxxxxxxx xxxxxxxxx, xxxx xxxxxxxxxxx xxxxxxx xxxxxxxxxx distribuci x xxxxxxx xxxxxxxxx rozsahu.“.
34. Xx §77x xx vkládají xxxx §77x x 77x, xxxxx xxxxxx nadpisu xxxxx:
„§77x
(1) Xxxxx xxxxxxxxxxx xx držitelů xxxxxxxxxx x xxxxxxxxxx, distributorů x lékáren informace x objemu xxxxxxxx xxxxxxxxx xx trhu x Xxxxx republice x x objemu xxxxxxxx xxxxxxxxx xxxxxxxx x použitých xxx xxxxxxxxxxx zdravotních služeb; xxxx xxxxxxxxx xxxxxxxxxx x xxxxxxxxxxx. Xxx xxxxxxxxxx xxxxxxxxx xxxxx xxxx xxxxx Ústav xxxxxxxxx, xxx xxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxx xxxxxxxxxxxx xxxxx xxxxxxx přípravkem xxxxxxxxxxxxxx xxxxxxxxx vlastností, nebo xxxxxxxx xxxxxxxxx vzájemně xxxxxxxxxxxxxx xxxxxxxx ke xxxx léčebným xxxxxxxxxxx, xxxxxxxxxx pokrývá xxxxxxxx xxxxxxx pacientů x Xxxxx xxxxxxxxx. Pokud Xxxxx xx základě xxxxxxxxxxx uvedených xxxxxxxxxxx xxxxx k závěru, xx aktuální zásoba xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx léčivých přípravků xxx xxxxxxxxxx xxxxxxxxx xxxxxxxx potřeby xxxxxxxx x Xxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx nebo xxxxxxxx xxxxxxxxx, xxxxxx xx rozumí xxxxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxx xxxxxxxx v Xxxxx xxxxxxxxx xxxxx xxxxxxx xxxxxxxxxx xxxx léčivými xxxxxxxxx, xxxx ohrožena xxxxxxxxxx a účinnost xxxxx xxxxxxxx x Xxxxx republice s xxxxxx dopadem xx xxxxxxx zdraví xxxxxxxxxxxx x významným xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx Xxxxxxxxxxxx zdravotnictví xxxx xxxxxxxxx, x xx xxxxxx xxxxxxxx x informací, xx xxxxxxx xxxxxxx Xxxxx x xxxxxx xxxxxx xxxxx.
(2) Xxxxx po xxxxxxxxxxx xxxxxxxxx poskytnutých Xxxxxxx podle xxxxxxxx 1 xxxxx Ministerstvo xxxxxxxxxxxxx x xxxxxx xxxxxxxxx v xxxxxxxx 1 xxxx xxxxx, xxxxxx takový xxxxxx xxxxxxxxx xxxx xxxxxx xxxxxxxxx na seznam xxxxxxxx přípravků, xxxxxxx xxxxxxxxxx do xxxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxx xxxxxx Ústavu xxxxx §77 xxxx. 1 xxxx. q) (xxxx xxx „Xxxxxx“). Xxxxxxxxxxxx xxxxxxxxxxxxx xxxx Xxxxxx, xxxxx xxxxxxxxxx v xxxxxxxxx znění xx xxxxx xxxxxxxxxxxxx xxxxxxxxx. Xxxxxx xxxxxxxxx xx xx Xxxxxx xxxxxxxx xxxxxx opatření xxxxxx xxxxxx.
(3) Xxx xxxxxxxx xxxxxxxx xxxxxx xxxxxx xxxxx xxxxxxxx 2 xx xxxxxxxxx podle xxxxxxxxx xxxx x xxx, xx
x) xxxxx xxxxxxxx xxxxxx xxxxxx xx doručuje x xxxxxxxx xxxxxx povahy xx xxxxxxxx způsobem xxxxxxxxxxx xxxxxxx přístup,
b) xxxxx xxx xxxxxxxxx xxxxxxxxxx x xxxxxx xxxxxxxx xxxxxx xxxxxx xxxx 5 xxx xxx xxx jeho xxxxxxxxxx,
x) xxxxxxxx obecné xxxxxx xxxxxx xxxxxxxxx xxxx xxxxxxxxxxxx po xxx xxxx xxxxxxxxxx.
(4) X případě, xx Xxxxx postupem xxxxx xxxxxxxx 1 dojde x závěru, že x xxxxxxxx xxxxxxxxx xxxxxxxxx xx Xxxxxxx xxx xxxxxxx xxxxxxxxx xxxxxxxxxxxxxx pokrytí xxxxxxxxxx xxxxxx pacientů v Xxxxx xxxxxxxxx, sdělí xxxx xxxxxxxxx včetně xxxxxxxx, xx xxxxxxx xxxxx x xxxxxx xxxxxx došel, Xxxxxxxxxxxx xxxxxxxxxxxxx. Xxxxx Ministerstvo xxxxxxxxxxxxx na xxxxxxx xxxxxxxxxxx xxxxxxxxx mu xxxxxxxxxxxx xxxxx věty xxxxx dojde xx xxxxxxxx xxxxxx, xxxxxxxx xxxxx xxxxxxxx 2 x 3 xxxxxx xxxxxxxxx xx Seznamu xxxxxx.
§77x
Xxxxxxxx k zajištění xxxxxxxxxxx xxxxxxxx přípravků
(1) X případě, xx Xxxxx shledá s xxxxxxxxxxxx x údajům xxxxxxxxxxxx xxxxxxx od xxxxxxxx rozhodnutí x xxxxxxxxxx, distributorů x xxxxxxx, xxxxx xxxxxxxxxxxx xxxxxxxxxx do xxxxxxxxx x xxxxxxxxxxxx tříměsíčním xxxxxx k xxxxxxxxxx xxxxxxxx xxxxxxxxx, který xxxx xxxxxxxxxxxx xxxxx xxxxxxx xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx, xxxx xxxxxxxx přípravků, které xxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxx ke xxxx xxxxxxxx vlastnostem, pro xxxxxxxx potřeby xxxxxxxx x Xxxxx xxxxxxxxx x xxxxx nedostatek xxxxxxxx xxxxxxxxxx x xxxxxxxx xxxxx xxxxxxxx x České republice x xxxxxx xxxxxxx xx ochranu zdraví xxxxxxxxxxxx a xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx, předá Ministerstvu xxxxxxxxxxxxx xxxxxx x xxxxxx xxxxxxxx podle xxxxxxxx 3.
(2) Xxxxxx Xxxxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xx xxxxxxxxxxx údajů xxxxxxxxxxxxx xxxxxxx od xxxxxxxx xxxxxxxxxx o xxxxxxxxxx, xxxxxxxxxxxx x xxxxxxx, xx
x) xx xxxxxx, xx aktuální xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx léčivých přípravků xxx xxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxx v Xxxxx xxxxxxxxx, x
x) xxxxxxxx konkrétní xxxxxx, xxx xxxxx xx xxxxxxxxxxx xxxxxxxxxx předmětného xxxxxxxx xxxxxxxxx xxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxx x xxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxx potřeb xxxxxxxx x České republice.
(3) Xxxxxxxxxxxx zdravotnictví xxxx xxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxx xxxxxx, kterým omezí xxxx zakáže xxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxx xxxxxxxxx xx xxxxxxxxx. Pro xxxxxx takového opatření xxxxxx povahy xxxx xxx xxxxxxx tyto xxxxxxxx:
x) jde o xxxxxx přípravek, který xx uveden na Xxxxxxx,
x) xxxxxxxxxx xx xxxxxxxxx by xxxxx xxxxx k tomu, xx xxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxx xxxxxxxxxxxx xxxxx xxxxxxx xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx, nebo xxxxxxxx xxxxxxxxx, které xxxx vzájemně nahraditelné xxxxxxxx xx xxxx xxxxxxxx xxxxxxxxxxx, xx xxxx v České xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxx x České republice, x
x) veřejný xxxxx xx xxxxxxx zdraví xxxxxxxxxxxx a xx xxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx pro xxxxxxxx xxxxxxx pacientů x Xxxxx republice xxxxxxxxx xxx xxxxxxxxxxxxx xxxxxx xx uskutečnění xxxxxx xxxxxxxxxx do xxxxxxxxx.
(4) Xxxxxxxxxxxx zdravotnictví neprodleně xxxxx xxxxxxxx xxxxxx xxxxxx, xxxxxxx-xx xxxxxx xxxx xxxxxx.
(5) Xxx xxxxxxxx xxxxxxxx xxxxxx xxxxxx xxxxx xxxxxxxx 3 xx xxxxxxxxx xxxxx §77x xxxx. 3 x tím, xx xxxxxxxx obecné xxxxxx xxxxxx účinnosti xxxx x něm xxxxxxxx.
(6) Xxxxx Ústav xxxxxx, xx xxx xxxxxxxxxxxxx důvody xxx xxxxx xxxxxx xxxxxxxx xxxxxx povahy xxxxxxx xxxxxxx distribuce xx xxxxxxxxx x xxxxxxxxxxx xxxxxxxx přípravku xxxx xxxxxxxx xxxxxxxxx, podá x xxx Xxxxx xxxxxxxxxxx xxxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx s xxxxxxxx, xxxxx xxx x xxxxxx závěru xxxxx.
(7) Xxxxxxxxxxxx xxxxxxxxxxxxx, xxxxx se x xxxxxx xxxxxxxx xxxxx x riziku nedostatku xxxxxxxx přípravků, xxxxxx Xxxxx o poskytnutí xxxxx x xxxxxxx xxxxx §77x.“.
35. X §80 xx xx xxxxx xxxxxxxx 1 xxxxxxxx xxxx „Xxxxxxxxxxxxx xxxxx xx xxxxxxx sdělit xxxxxxxxxx identifikační xxxx, xx xxxxx základě xxx xxxxxxxx xxxxxxxxxxxx xxxxxx v xxxxxxxxxx xxxxx xxxxxx xxxxxxxxxxxx xxxxxxxx přípravku.“.
36. X §82 xxxx. 3 xxxx. x) se xx xxxxx „x xxxxxxxx xxxxxxxx xxxxxxxxxxx“ xxxxxxxx xxxxx „, x xx elektronicky“, x xxxxx „xxxxxx xxxxx x xxxxxx jejich xxxxxxxxxxx xxxxxx hlášení xxxxxxxx Xxxxx ve xxxx xxxxxxxxxxx prostředku“ xx xxxxxxxxx slovy „xxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx x xxxxxx, xxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxx, xxxxxxxxxxxx xxxxxxxx, kterému xxx xxxxxxxxx vydán, a xxxxxxxxxxxx vydaného xxxxxxxx xxxxxxxxx; strukturu xxxxx, xxxxxx, xxxxx x xxxxxx xxxxxxxx xxxxxx xxxxxxxxxxx prostřednictvím elektronického xxxxxxx xxxxxxx xxxxxxxxx xxxxxx předpis“.
37. X §82 xxxx. 4 xx xxxx první se xxxxx „jiným xxxxxxxx xxxx“ x „xxxxxxxxxxx xxxxxxx xxxx“ zrušují.
38. X §82 xxxx. 4 xx xxxx druhé se xxxxx „výjimečně“ zrušuje x xx xxxxx „xx jiné lékárny“ xx vkládají slova „xxxxx výjimečně, x xx“.
39. V §101 xxxx. 1 xxx:
„(1) Xxx xxxxxxxx xxxxx xxxxxx xxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxxx xxxxxx xxxxxx xxxxxxx x §10 x xxxxxxxxxx xxxxx kontrolního xxxx. Xxxxxxxx ke kontrole xx xxxxx xxxxxxx xxxxxxxxxx. Inspektor xx xxx xxxxxx xxxxxxxxx xxxxxxxx xxxxx xxxxxx xxxxxx x jiných xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx inspektora.“.
40. X §101 xxxx. 5 xxxxxxx x) zní:
„e) v xxxxxxxxxxxx případech, xxxxxxx x xxxxxxx klamavého xxxxxxxx xxxxxxxx xxxxxxxxx xxxx v xxxxxxx xxxxxxxxx podezření, xx x léčivým přípravkem xxxxxxx osoba, která x xxxxxx xxxxxxxx xxxx xxxxx xxxxxx xxxxxx oprávněna, xxxxxxx xxxx xxxxxxx xxxxxxxxx; x tímto xxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxx x xxxxx xx xxxxxx xxxxxx x xxxxxxxx xxxxxxxxx x xxxxxxxx xxxx xxxxxx, xxxxxx x xxxxxxxx xxxxxxxxxxx léčivých xxxxxxxxx; xxxxx úřední xxxxxx xx xxxxxxxx xxxxxxxxx x xxxxxxxx; xxxxxxxxxxxx xxxxx xx xxxxxxx zajištěný xxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxx; x xxxxxxx, xx xxxxxxxxxxxx xxxxx vydání xxxxxxxxxxx léčivého přípravku xxxxxxx, provede xxxxxxxxx xxxx xxxxxx; x xxxxxx, případně xxxxxx xxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxx úřední xxxxxx, xxxxx xx xxxxxxxx xxxxxxxxx x kontrole; xxxxxxx-xx důvod xxxxxxxxx xxxxxxxxx xxxx xxxxxxx-xx xx, že xxxxxxxxx xxxxxx xxxxxxxxx splňují xxxxxxxxx xxxxxx zákona, xxxxx Ústav nebo Xxxxxxxxxxx xxxxx xxxxxxxxxxxx xxxxx xxxxxxxxx xxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxx; xxxxxxx se xxxx xxxxxxxxx, xxxxxxx-xx xx, že x xxxx zacházení x xxxxxxx přípravkem x xxxxxxxx zacházení x xxx xxxxxx xxxxx xxxxxxxxx xxxx prokáže-li xx, xx zajištěné xxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxx xxxxxx; x xxxxxxx xxxxxxx xxxx Xxxxx xxxx Xxxxxxxxxxx xxxxx xxxxxxxxxx x xxxxxxxxxx xxxx xxxxxxx xxxxxxxx xxxxxxxxx; xxxxxx xxxxxxxxx, xx xxxxxxx zachází osoba, xxxxx x xxxxxxxx xxxxxxxxx xxxx oprávněna xxxxx xxxxxx xxxxxx, xx xxxxxxxx za xxxxxx xxxxxxxxx, které xxxxxxxxx xxxxxxxxx tohoto xxxxxx; xxxxxxxxxx nebo xxxxxxx léčivé xxxxxxxxx xx Ústav xxxx Xxxxxxxxxxx xxxxx xxxxxxx xxxxxxxxx xxxxx §88; xx xxxx xxxxxx xxxxxxxx x x xxxxxxx xxxxxx rozhodnutí x xxxxxxxxxx xxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxx xx xxxxxxxxx, propadnuté xxxx xxxxxxx xxxxxx xxxxxxxxx náhrada; v xxxxxxx xxxxxx xxxxxxxxxx x xxxxxxxxxx xxxx xxxxxxx léčivého přípravku xx xxxxxxxxxxxx xxxxx xxxxxxx xxxxxxx náklady xxxxxxxxxx Xxxxxxx xxxx Xxxxxxxxxxxx ústavem xxxxxxx x uskladněním xxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxxx propadnutých nebo xxxxxxxxx xxxxxxxx xxxxxxxxx, x xxxxxxx xxxx xxxxxxxx Ústav xxxx Xxxxxxxxxxx xxxxx.“.
41. X §101 xxxx. 5 xxxxxxxxx xxxxx ustanovení xx xxxxx „x) až x)“ nahrazují xxxxx „ a) až x)“.
42. V §103 xxxx. 6 xxxx. x) se xx xxxxx „xx xxxxx“ xxxxxx xxxxx „, xxxx“.
43. X §105 xxxx. 2 xx xx xxxxx písmene x) slovo „xxxx“ xxxxxxx.
44. X §105 xx xxxxx xxxxxxxx 2 se xxxxx xxxxxxxxx xxxxxx x xxxxxxxx xx xxxxxxx x) až t), xxxxx xxxxx:
„x) xxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxx §77 xxxx. 1 xxxx. h),
s) x rozporu s §77 xxxx. 1 xxxx. q) xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx, nebo
t) x xxxxxxx x xxxxxxxxx xxxxxx povahy Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxx §77x distribuuje xxxxxx xxxxxxxxx xx xxxxxxxxx.“.
45. X §105 xxxx. 5 se xx xxxxxxx c) xxxxxx nové xxxxxxx x), xxxxx xxx:
„x) xxxxxxxxxx xxxxx o xxxxxx dodávek xxxxxxxx xxxxxxxxx uvedeného na xxx v České xxxxxxxxx xxxxx §33 xxxx. 2 xxxx xxxxxxxx,“.
Xxxxxxxxx xxxxxxx x) xx x) se xxxxxxxx xxxx e) xx y).
46. X §105 xxxxxxxx 6 xxx:
„(6) Xxxxxxxxx xx xxxxxxx xxxxxxxxx xxxxxxx xxx, xx x rozporu x xxxxxxxxx x xxxxxxxxx hodnocení
a) xxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxxx nebo v xxxxxxx s podmínkami xxxxxxxxx x povolení,
b) xxxxxxx xxxxxxxxx změnu xxxxxxxxxx xxxxxxxxx xxx xxxxxxxx xxxx x xxxxxxx x xxxxxxxxxx xxxxxxxxx x povolení,
c) xxxxxxx klinické hodnocení x xxxxxxxx situaci x xxxxxxx s xxxxxxxxxx stanovenými xxx xxxxxxxxx klinických xxxxxxxxx x xxxxxxxxxx xxxxxxxxx,
x) xxxxxxxx
1. údaje x xxxxxxxx, xxxxxxxx xxxxxxxxx, xxxxxxxxx xxxxxxxx, xxxxxxxxxx xxxxxxxx xxxx ukončení xxxxxxxxxx xxxxxxxxx,
2. první xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx v Xxxxx xxxxxxxxx xxxx
3. xxxxxxxx xxxxxx xxxxxxxx hodnocení x České republice,
e) xxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx,
x) nevede xxxxx x xxxxx xxxxxxxxxxxxxxxxx xxxxxxx,
x) xxxxxxxxx xxxxxxx podezření xx xxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx xxxx o xxxx neinformuje xxxxxxxxxx xxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxx xx ochranu subjektů xxxxxxxxx, xxxxxxxxx kvalifikovaného xxxxxx jako xxxxxxxxx xxxxx xxxxx xxxxxxxx xxxxxxxxx xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxx s xxxxxxxxxx a se xxxxxxxx xxxxxxx xxxxxxxx xxxxx,
x) nezajistí, xxx xxxxxxxxxx a ostatní xxxxx zapojené xx xxxxxxxxx xxxxxxxxxx hodnocení xxxxxxxxx podmínky stanovené xxxxxxxxx o xxxxxxxxx xxxxxxxxx, anebo xxxxxxxx xxxxxxxxx v §54,
x) xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxx, xxxxx xxxxxxxx xxxxx xxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxx x nových skutečnostech, xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxx xx ochranu subjektů xxxxxxxxx,
x) xxxxxxxxxx zkoušejícímu xxxxxx xxxxxxxxx pro xxxxxxxxxxxx xxxx xxxxx xxxxxx xxxxxxxxxxxxx,
x) nezaznamenává, xxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxx xxxx xxxxxx xxxx nearchivuje základní xxxxxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxx x xxxxxxxxxx xxxxxxxxxxx nařízením x xxxxxxxxx hodnocení, xxxx
x) jako xxxxxxxxxx xxxxxxxxx nemá x xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx.
XXXXX: 32014R0536
47. V §105 xx xxxxxx xxxx xxxxxxxx 7, který xxx:
„(7) Xxxxxxxxx xx xxxx xxxxxxx xxxxxxxxx xxxxxxx tím, xx
x) x rozporu s §58 xxxx. 2 xxxxx xx xxxxx xxxx provádění xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxx své, xxxxxxxx xxxxxxxxxxxx x zkoušejícího xx xxxx vzniklou xxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx nebo xxxxxxxxxx xxxxxxxx,
x) xxxxxx klinické xxxxxxxxx veterinárního xxxxxxxx xxxxxxxxx x rozporu x §60 xxxx. 3,
x) xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx podle §61 xxxx. 2 xxxx. a),
d) xxxxxxx xxxxxxxxxx povinnost podle §61 xxxx. 2 xxxx. x), nebo
e) xxxxxxxxxx zkoušejícímu xxxxxx xxxxxxxxx xxxx neuchová xxxxxx vzorek xxxxx §61 xxxx. 2 xxxx. c).“.
Dosavadní xxxxxxxx 7 a 8 xx xxxxxxxx xxxx xxxxxxxx 8 a 9.
XXXXX: 32014R0536
48. X §106 xxxxxxxx 3 zní:
„(3) Xxxxxxxxxxx fyzická osoba xx dopustí xxxxxxxxx xxxxxxx xxx, že x rozporu x xxxxxxxxx o xxxxxxxxx xxxxxxxxx
x) xxxx xxxxxxxxxx, xx-xx x xxxxx xxxxxxxxxx xxxxxxxxx xxxxx xxxxx xxxxxxxxxx, xxxx xxxx xxxxxx zkoušející, xx-xx x místě xxxxxxxxxx hodnocení xxxx xxxxxxxxxxxx,
1. xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx x xxxxx xxxxxxxxxx hodnocení,
2. xxxxxxx xxxxxxx ostatním xxxxxx xxxx xxxxxxxxxxxx xxxxxx,
3. xxxxxx xxxxxxxx xxxxxxxxx xxx udělení xxxxxxxxxxxxx souhlasu subjektu xxxxxxxxx xxxx xxxx xxxxxxxxx xxxxxxxx x xxxxxxxx těch xxxxxxx, xxx xxxxx souhlas xxxx xxxxxxxxx, nebo xxxxxxxxx svolení x xxxxxx xxxxxxxxx xxxxx, xxxx-xx xxx dané xxxxxxxx hodnocení xxxxxxxxxx,
4. xxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxxxxx xxxxx xxxxxxxx hodnocení xxxx xxxx zákonnému xxxxxxxx,
x) xxxx xxxxxxxxxx xxxxxxxxxxx, xxxxxxxxxxxxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxx laboratorní odchylku,
c) xxxxxxxxx uchovávání zdrojových xxx x dokumentace xxxxxxxxxx xxxxxxxxx,
x) xxxxxxxx xxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx opatření x xxxxxxx xxxxxxxx xxxxxxxxx,
x) xxxxxxx xxxxxxxx xxxxxxxxx jako zkoušející, xxxx xxxxxxx podmínky xxxxxxxxx xxxxxxxxx o xxxxxxxxx hodnocení xxxxx xxxxxxxx xxxxxxxxx v §54, xxxx
x) nedodržuje xxxxxx správné xxxxxxxx xxxxx při provádění xxxxxxxxxx hodnocení.“.
CELEX: 32014R0536
49. X §107 xxxx. 1 xxxx. x) xxx:
„x) 100 000 Xx, xxx-xx x xxxxxxx xxxxxx xxxxx §105 xxxx. 6 xxxx. d) xxxx 2 nebo 3, §105 xxxx. 6 písm. x), §106 xxxx. 3 xxxx. a) xxxx x) xxxx §106 xxxx. 5 písm. x),“.
50. X §107 xxxx. 1 xxxx. x) xx xxxxx „§106 xxxx. 3 xxxx. x) xxxx x)“ xxxxxxxxx slovy „§106 odst. 3 xxxx. b)“.
51. X §107 xxxx. 1 xxxx. x) xx slova „x), x), o), x) xxxx x)“ xxxxxxxxx xxxxx „h), x), x), x) xxxx y)“.
52. X §107 xxxx. 1 xxxx. x) xx xxxxx „§105 xxxx. 6 xxxx. x), d), x), x) xx x)“ xxxxxxxxx xxxxx „§105 odst. 6 xxxx. c) nebo x) xxxx 1, §105 xxxx. 6 xxxx. x), f), x), x), x), x),“.
53. X §107 xxxx. 1 se xx konci xxxxx xxxxxxx c) xxxxxxxx xxxxx „nebo §106 xxxx. 3 xxxx. x), e) xxxx x)“.
54. V §107 xxxx. 1 písm. x) se slova „x), x), l), x), q), r), x), t), x), x)“ xxxxxxxxx xxxxx „x), x), m), x), r), x), x), u), x), x)“.
55. X §107 xxxx. 1 písm. x) se xxxxx „x), x), x) xxxx x)“ xxxxxxxxx xxxxx „a), x) xxxx x)“.
56. X §107 xxxx. 1 písm. x) se za xxxxx „§104 odst. 7 xxxx. x) xxxx x),“ xxxxxxxx xxxxx „§105 xxxx. 2 xxxx. x) xx t),“.
57. X §107 xxxx. 1 xxxx. x) xx xxxxx „x), x), x), x), x) xxxx x)“ xxxxxxxxx xxxxx „ x), x), x), j), x) xxxx x)“.
58. X §107 xxxx. 2 xx xx slovo „podle“ xxxxxxxx xxxxx „§105 xxxx. 2 xxxx. x) x“.
59. X §108 xxxxxxxx 5 zní:
„(5) Xxxxxxx xxxxx xx xxxxxxx přestupku xxx, xx v xxxxxxx x xxxxxxxxx x xxxxxxxxx xxxxxxxxx
x) jako xxxxxxxxxx xxxx hlavní xxxxxxxxxx
1. nezajistí xxxxxxxxx xxxxxxxxxx xxxxxxxxx x xxxxx klinického hodnocení,
2. xxxxxxx písemně xxxxxxxx xxxxxx xxxx xxxxxxxxxxxx xxxxxx,
3. xxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxx jeho xxxxxxxxx xxxxxxxx x xxxxxxxx xxxx xxxxxxx, xxx xxxxx xxxxxxx xxxx xxxxxxxxx, xxxx xxxxxxxxx svolení x xxxxxx xxxxxxxxx osoby, xxxx-xx xxx dané xxxxxxxx xxxxxxxxx xxxxxxxxxx,
4. xxxxxx xxxxxxxx hodnocení xxx xxxxxxx xxxxxxxxxxx xxxxx xxxxxxxx hodnocení xxxx jeho xxxxxxxxx xxxxxxxx,
x) xxxx xxxxxxxxxx xxxxxxxxxxx, xxxxxxxxxxxxxx xxxx xxxxxxxx nežádoucí xxxxxxx xxxx xxxxxxxxxxx xxxxxxxx,
x) xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxx x dokumentace xxxxxxxxxx xxxxxxxxx,
x) xxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx opatření x xxxxxxx xxxxxxxx xxxxxxxxx,
x) xxxxxxx xxxxxxxx xxxxxxxxx jako xxxxxxxxxx, xxxx xxxxxxx podmínky xxxxxxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxx xxxxxxxx stanovené x §54, nebo
f) při xxxxxxxxx klinického hodnocení xxxxxxxxxx xxxxxx xxxxxxx xxxxxxxx xxxxx.“.
XXXXX: 32014R0536
60. X §108 xx xx xxxxxxxx 7 xxxxxx nový xxxxxxxx 8, xxxxx xxx:
„(8) Xxxxxxx osoba xx jako xxxx xxxxxx komise Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx dopustí xxxxxxxxx xxx, xx v xxxxxxx x §53x xxxx. 5 xxxxxx xxxxxxxxx xxxxxxxxxx mlčenlivost.“.
Dosavadní xxxxxxxx 8 x 9 se xxxxxxxx xxxx odstavce 9 x 10.“.
61. V §108 xxxx. 8 xxxx. x) xx xxxxx „x)“ xxxxxxxxx xxxxxx „x)“.
62. X §108 xxxx. 8 xxxx. x) xx xxxxx „x) xxxx b)“ xxxxxxxxx xxxxx „x) xxxx c)“.
63. X §108 xxxx. 8 xx xx xxxxx textu xxxxxxx x) xxxxxxxx xxxxx „nebo xxxxxxxx 5 písm. d), x) xxxx x)“.
64. X §108 xxxx. 8 písm. x) xx xxxxx „xxxx odstavce 5 xxxx. x)“ xxxxxxx.
65. X §108 xx xxxxxxxx xxxxxxxx 11, xxxxx xxx:
„(11) Xx xxxxxxxxx podle xxxxxxxx 8 xx xxxxx xxxxx xxxxxxxx.“
66. Xx §108 xx vkládají xxxx §108x a 108b, xxxxx xxxxxx xxxxxxx xxxxx:
„108x
Xxxxxxxxxx léčivého xxxxxxxxx
(1) Xxxxxxxxxx léčivého přípravku xxx xxxxxx, xxxxxxxx xxxxxx xxxxxxxxx xxxxxx xxxxxxxxx správního xxxxxxx, x
x) byl xx xxxxxxxx xxxxxxxxx deliktu xxxx xxxx xxxxx, xxxx
x) xxx x xxxxxxxxxxx se spácháním xxxxxxxxx xxxxxxx získán.
(2) Xxxxxxxxxx xxxxxxxxxx léčivého xxxxxxxxx se stává xxxx.
108x
Xxxxxxx xxxxxxxx xxxxxxxxx
(1) Xxxxxx-xx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxxxx x §108x xxxx. 1 xxxx. x) xxxx b), xxx xxxxxxxxxx o xxxx xxxxxxx, xxxxxxxx
x) xxxxxx xxxxxxxxx xxxxxxxxx xxxxxxx, xxxxxxx xxxxx xx xxxxxxx delikt xxxxxx,
x) xxxxxxxx pachateli správního xxxxxxx nebo mu xxxxxxxx xxxxx, xxxx
x) xxxxxxxx není xxxx.
(2) Xxxxxxxxxx zabraného xxxxxxxx xxxxxxxxx xx xxxxx xxxx.“.
67. V §112 xx xx xxxxxxxx 5 xxxxxx xxxx xxxxxxxx 6, xxxxx xxx:
„(6) Rozhodne-li xxx xxxxx, převede Xxxxx x xxxxxxxxxx xxxx xxxxxxxx xxxxx odstavce 5 na xxxxxxxx xxxx státního xxxxxxxx Xxxxx xxxxxxxxx xxxxxxx xxx Ministerstvo xxxxxxxxxxxxx xxxxxx xx xxxx xxxxxxxxx xxxxxx.
Xxxxxxxxx xxxxxxxx 6 x 7 xx xxxxxxxx xxxx 7 a 8.“.
68. X §114 xxxx. 1 xx xx xxxxx „§24 xxxx. 2, 3, 4, 8 x 9,“ xxxxxxxx xxxxx „§33 xxxx. 2,“, xx slova „§67 xxxx. 10 a 11,“ xx xxxxxxxx xxxxx „§77 xxxx. 1 xxxx. x) x q),“ x xx xxxxx xxxxx xxxxxxxx 1 xx xxxxxxxx xxxxx „a §82 xxxx. 3 xxxx. d)“.
69. X §114 xxxx. 2 se xxxxx „§51 xxxx. 2 písm. x), §52 xxxx. 6, §53 odst. 1, 8, 12 x 13, §54 odst. 1, §55 odst. 7 xx 9, §56 odst. 1 xxxx. a), §56 xxxx. 3 x 7, §57 xxxx. 2, §58 xxxx. 8, §59 odst. 1“ nahrazují xxxxx „§53x xxxx. 2, §54 xxxx. 4, §56 xxxx. 6“.
70. X §114 xxxx. 2 se xxxxx „§60 xxxx. 2, 4, 5 x 9, §61 xxxx. 2 písm. x) a b) xxxx 1 x 6, §61 odst. 2 xxxx. c), §61 xxxx. 4 xxxx. e),“ xxxxxxx.
71. X §114 xxxx. 2 se xx slova „§77 xxxx. 1 xxxx. x),“ xxxxxx xxxxx „x),“.
72. V §114 xxxx. 4 xx xx xxxxx „§48 xxxx. 2, 3 x 6“ xxxxxxxx xxxxx „, §60 xxxx. 2, 4, 5 a 9, §61 odst. 2 xxxx. x) x x) xxxx 1 x 6, §61 xxxx. 2 xxxx. x), §61 xxxx. 4 písm. x)“.
Xx. XX
Xxxxxxxxx ustanovení
1. Xxxxx byla xxxxxx x xxxxxxxx xxxxxxxxxx hodnocení xxxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx léčiv přede xxxx, xxxxxx xxxxxx 6 xxxxxx xxx xxx xxxxxxxxxx xxxxxxxx Xxxxxx x Xxxxxxx xxxxxxxx Xxxxxxxx unie xxxxx čl. 82 xxxx. 3 xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) č. 536/2014 xx dne 16. xxxxx 2014 o xxxxxxxxxx hodnoceních humánních xxxxxxxx přípravků x x xxxxxxx xxxxxxxx 2001/20/XX, xxxxxxx xxxxxxxx xxxxxxxxx xx nadále xxxx xxxxxxxxxxx xxxxxxxx xxxxxxxx, a to xx xxx, kterým xxxxxxxx 42 měsíců xxx xxx zveřejnění xxxxxx xxxxxxxx.
2. Xxxxx xxxx xxxxxx x povolení xxxxxxxxxx hodnocení předložena Xxxxxxxx xxxxxx pro xxxxxxxx xxxxx po xxx, xxxxxx xxxxxxxx 6 xxxxxx xxx xxx xxxxxxxxxx xxxxxxxx Xxxxxx podle čl. 82 xxxx. 3 xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Xxxx (XX) x. 536/2014 xx dne 16. xxxxx 2014 x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x x xxxxxxx xxxxxxxx 2001/20/XX&xxxx; nejpozději xxxx xx dne, xxxxxx xxxxxxxx 18 xxxxxx xxx dne xxxxxxxxxx tohoto xxxxxxxx, xxx xxxxxxx xxxxxx x povolení xxxxxxxxxx xxxxxxxxx xxxxxxx xxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxx x uvedené xxxxxxxx xxxxxxxxx xx xxxxxx xxxx dosavadními právními xxxxxxxx, x xx xx dne, xxxxxx xxxxxxxx 42 xxxxxx xxx dne xxxxxxxxxx xxxxxx xxxxxxxx.
XXXX XXXXX
Xxxxx xxxxxx x xxxxxx xxxxxx
Čl. XXX
X §2 xxxxxx x. 234/2014 Xx., x xxxxxx xxxxxx, ve xxxxx xxxxxx x. 131/2015 Xx., xxxxxx x. …/2016 Sb. x xxxxxx x. …/2016 Xx., se xx xxxxx xxxxxxxx 1 xxxxx nahrazuje xxxxxx x xxxxxxxx xx xxxxxxx x), xxxxx xxx:
„x) xxxxx Xxxxxx xxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx.“.
XXXX XXXXX
Xxxxxxxxx ustanovení
Xx. XX
Xxxxxxxxx xxxxxxx
Xxxxx xxxxx xxx xxxxxxx x souladu xx xxxxxxxx Evropského xxxxxxxxxx x Xxxx (EU) 2015/1535 xx xxx 9. září 2015 x postupu xxx xxxxxxxxxxx xxxxxxxxx v xxxxxxx technických xxxxxxxx x xxxxxxxx pro xxxxxx informační xxxxxxxxxxx, x xxxxxxx znění.
Čl. V
Účinnost
Tento zákon xxxxxx xxxxxxxxx prvním xxxx xxxxxxxxxxxx xxxxxx xxxxxxxxxxxxx xx xxx xxxx vyhlášení, s xxxxxxxx xxxxxxxxxx
x) xx. X xxxx 21, xxxxx xxx x §51, §52 a §53 xxxx. 2, xx. I xxxx 22, xxxxx xxx x §53x odst. 7, §53x xxxx. 1, 2, 3 x §53x xxxx. 1 xx 8, x čl. X xxxx 23, xxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx 6 xxxxxx xxx xxx xxxxxxxxxx xxxxxxxx Xxxxxx x Xxxxxxx xxxxxxxx Evropské unie xxxxx čl. 82 xxxx. 3 nařízení Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) č. 536/2014 xx xxx 16. xxxxx 2014 o xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx a x zrušení xxxxxxxx 2001/20/XX; xxx, xxx xxxx xxxx xxxxxxxx xxxxxxxxxx, xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxx xxxxxxx xx Xxxxxx xxxxxx;
x) xx. X xxxx 21, pokud xxx x §53 xxxx. 1, 3 a 4, x čl. X xxxx 22, xxxxx xxx o §53x xxxx. 1 xx 6, §53x xxxx. 4, 5 x §53x odst. 9, xxxxx xxxxxxxx xxxxxxxxx prvním xxxx xxxxxxxxxxxx xxxxxx xxxxxxxxxxxxx xx dni xxxxxxxxxx xxxxxxxx Xxxxxx v Xxxxxxx xxxxxxxx Xxxxxxxx xxxx xxxxx čl. 82 xxxx. 3 xxxxxxxx Xxxxxxxxxx parlamentu a Xxxx (XX) č. 536/2014 xx xxx 16. xxxxx 2014 x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x o xxxxxxx xxxxxxxx 2001/20/XX; den, xxx xxxx toto xxxxxxxx xxxxxxxxxx, xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx formou xxxxxxx xx Xxxxxx xxxxxx;
x) xx. X xxxx 5, 7, 9, 28, 29 x30, xxxxx xxxxxxxx xxxxxxxxx prvním xxxx xxxxxxxx kalendářního xxxxxx xxxxxxxxxxxxx po jeho xxxxxxxxx.
XXXXXXX XXXXXXXXX ZPRÁVY XXX
|
Xxxxx xxxxxx zákona: Xxxxx xxxxxx, kterým xx xxxx xxxxx č. 378/2007 Sb., o xxxxxxxx x x změnách xxxxxxxxx souvisejících xxxxxx (xxxxx x xxxxxxxx), xx xxxxx xxxxxxxxxx xxxxxxxx |
|
|
Xxxxxxxxxxx / zástupce xxxxxxxxxxxxx: Ministerstvo xxxxxxxxxxxxx |
Xxxxxxxxxxxxx xxxxxx xxxxxx xxxxxxxxx: 28.5.2016 |
|
Xxxxxxxxxxxx xxxxx EU: XXX (xxxxxxxx, tj. x xxxxx xxxxxxxx xxxxxxxx Xxxxxxxxxx parlamentu x Rady (XX) č. 536/2014 xx xxx 16. xxxxx 2014 x klinických hodnoceních xxxxxxxxx xxxxxxxx přípravků x o xxxxxxx xxxxxxxx 2001/20/XX) |
|
|
- xxxxxx xxxxxx stanovený xxx xxxxxxxxxxxx: 28.5.2016 - uveďte, xxx jde xxxxx xxx xxxxx požadavků xxxxxxxxxxx předpisem EU?: XX |
|
|
2. Xxx xxxxxx xxxxxx |
|
|
Xxxxxxx xxxxx xxxxxx xxxxxx xx xxxxxxxx xxxxxxxx xxxxxxxx Evropského xxxxxxxxxx a Xxxx (XX) č. 536/2014 xx xxx 16. dubna 2014 x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x x xxxxxxx xxxxxxxx 2001/20/XX x xxxxxxxxxx Xxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxxx xxxxxx o léčivech. Xxxxx xxxxxxxx xxxxxx, xxxxx xxxx xxxxxxxxx x. 536/2014 xxxxxxxxx xxxxx přikázány xxxxxxx xxxx xx členský xxxx zmocněn xx xxxxxxx. Xxxxx xx xxxxxxxxx xxxx, aby xxxxxx úprava x Xxxxx xxxxxxxxx xxxxxx xxxxxxxxx xxxxx xxxxxxxxx xxxxxxxxxx hodnocení xxxxxxxxx xxxxxxxx přípravků xxxxxxxx xxx xxxxx Xxxxxxxxx xxxx xxxxxxxxx č. 536/2014. |
|
|
Xxxxxx xxxxxxx xxxxx xxxxxx xxxxxx je řešit xxxxxx akutní xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx pro xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx xx xxxxxx ochrany xxxxxx xxxxxx x xxxxxx, x xx vytvořením xxxxxxx sledování x xxxxxxxxxxxxx xxxxxx nedostupnosti xxxxxxxx přípravků xxx xxxxxxx pacientů x Xxxxx republice a xxxxxxxxx příslušných xxxxxxxx xxxxxxxxxxx xxxxxxxxxx léčivých xxxxxxxxx xxxxxxxx xxx xxxxxxx pacientů x Xxxxx xxxxxxxxx xx xxxxxxxxx (reexport) x xxxx případech, xxx xxxxxxxxxxx xxxxxx xxxxxx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx. Xxxxxxx xx xxxxxx xx xxxxxxx xxxxxxx xxxxxxxxxxxxxx xxxxxxxx x respektovat xxxxxx xxxxxxx xxxxxx xxxxx xxxxxxxxxx v xxxxxxxxxx Xxxxxxxx xxxx. |
|
|
Xxxx xxxxx xxxx xxxxxx xxxxxx xxxxx xxxxxxxx xxxxxxxx xxxxxxxx Xxxxxx v xxxxxxxxx xxxxxxxxx (EU) č. 1252/2014 ze xxx 28. xxxxxx 2014 xxxxxxxxxx směrnici Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX, xxxxx jde x zásady x xxxxxx xxxxxxx výrobní xxxxx pro xxxxxx xxxxx pro xxxxxxx xxxxxx xxxxxxxxx, xxxx xxxxxxxx zákonné xxxxxxxxxxx xxx efektivnější xxxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx léčiv s Xxxxxxxxxx xxxxxxxxxxxx xxx xx účelem xxxxxxxxxxxx xxxxxxx léčiv x xxxxxxxxx xxxxxxxxx x xxxx, účelněji xxxxxxx xxxxxxxxxxx xxxxxxxxxx xxx xxxxxxxxx činnosti x xxxx xxxxxxxx xxxxxxx xxxxxx xxxxxxxxx zajištění x zabrání xxxxxxxx xxxxxxxxx xxx, aby xxxx xxxxxxxxxx x xxx xxxxxx xxxxxxx, xxx xx xxxxxxxx, xx x xxxx xxxxxxxxx xxxxx, xxxxx x xxxx xxxxxx xxxxx xxxxxx oprávněny. |
|
|
3. Xxxxxxxxxx xxxxxx xxxxxx xxxxxx |
|
|
3.1 Xxxxxx na xxxxxx xxxxxxxx x xxxxxxx veřejné xxxxxxxx: XXX |
|
|
Xxxxxx na státní xxxxxxxx Xxxxxxxx nařízení xx xxxxxxxxxx xxxxxxxxx Xxxxxxxx dopad xxxxxxxxxx úpravy za xxxxxx zajistit xxxxxxxx xxxxxxxx x klinických xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx bude představován xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxxx xxxxxx xx xxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx léčiv xxx xxxxxxx zajištění xxxxxx xxxxx a xxxxxxxxx xxxxxxxxx x xxxxxxxxx (v počtu 32 xxxxxx). Xxxxxxxxx xxxxx xxxxxxxxxx xxxx xxxxx xxxxxxxxxx xxxxx xxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxx (5), posuzovatelů xxxxxxxxxxxxx xxxxxxxxx (2), xxxxxxxxxxxx xxxxxxxxxxxxxx dat xxxxxxxxxx xxxxxxxxx (1) inspektorů (5), xxxxxxxxxxxx klinického xxxxxxxxx (3), a xxxxxxxxxx xxxxxxxxx xxxxxxxxx-xxxxxxxxxxxxx xxxxxx pro xxxxxxx xxxxxx - při xxxxx 8 xxxxxx xxxxxx xxxxxx - 16 xxxxxx). Xxxx xxxxxx xxxxx částečně xxxxx x náhrady xxxxxx xx xxxxxxxx xxxxxxxxx (etická xxxxxx). Xxx finanční xxxxx xxxxxxxxxxx technického xxxxxxxxxxx xxxxxx xxxxxxx etické xxxxxx xxxx xxxxxxxxx xxxxxx Xxxxxxxx xxxxxx xxx kontrolu xxxxx xxxx xxxxxxxxx x xxxxx finanční xxxxxxxxxx x xxxxxx xxxxxxxxxxxx x XX fondů, x xxxxx xxxx xxxxx z xxxxxx xxxxxx za klinická xxxxxxxxx či certifikáty xxxxxxx xxxxxxxx xxxxx. |
|
|
Xx xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxx nová xxxxxx xxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxxx x xxxxxxx x xxxxxxxx xxxxxxxxxx hodnocení. Bude xxxxx xxxxxxxxxx xxxxx xxxxxx xxxxxxxx xxxxxxxxx x xxxxx xxxxxx xxxxxxxxx referenta. |
|
|
Omezení xxxxxxxxx |
|
|
Xxxxxxxx xxxxx xxxxxxxxxx právní xxxxxx xx účelem xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xx státní xxxxxxxx xxxx představován xxxxxxxxx krytím navýšení xxxxxxxxxx xxxxxx na xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx (2 úvazky - 1 právní xxxxxxxx x 1 xxxxxxx xxxxxxxx pro xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxxx). Xx xxxxxx Xxxxxxxx ústavu xxx xxxxxxxx léčiv xxxxx x navýšení x 2 xxxxxxxx xxxxxx xx xxxxxx xxxxxxxxx xxxxxxxxx a vyhodnocování xxxxxx nedostupnosti xxxxxxxx xxxxxxxxx pro potřeby xxxxxxxx x Xxxxx xxxxxxxxx x předávání xxxxxxxxxxx xxxxxxx Ministerstvu. |
|
|
Ostatní xxxxxxxxxxx body |
|
|
Dopad xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxxx xxxx xxxxx xxxxxxxxx xxxxxxxxxxxx. Xxxxx xx o xxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxxx xxxxxx (xxxx. xx se xxxx xxxxxxxxxxx xxxxxxxxxx). |
|
|
Xxxxxxxxx xxxxx xx xxxxxxx xxxxxxx xxxxxxxx, xxxxxxx xx prostředky xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxx xxxxxx xxxxxxxxx, avšak xxx xxxxxxxxxxxx, xx xxxxx xxxxx xxxx xxxxx pozitivní. |
|
|
Přínosy |
|
|
Adaptace xxxxxxxx xx xxxxxxxxxx xxxxxxxxx |
|
|
Xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx x atraktivitě Xxxxx xxxxxxxxx pro xxxxxxxxx xxxxxx xxxxxxxxx. Xxxxxx xxxxxxxxx xx xxx dostanou nejmodernější xxxxxx xxxxxxxxx x xxxxxxxxxxx možných xxxxxx xx zajištěním xxxxxxxxxxx xxxxxxxxxxxxxx rizik. Provádění xxxxxxxxxx xxxxxxxxx xx xxxxx České xxxxxxxxx xxxxx xxxxxxx Xxxxx xxxxxxxxx xx xxxxx. Xxxxxxxxx xxxxxx lze xxxxxxxxxxxx x do xxxxx xxxxxxxxxx. |
|
|
Xxxxxxx xxxxxxxxx |
|
|
Xxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxxxxx xxxxx x hrozící xxxxxx xxxxxxxxxxxxx léčivých xxxxxxxxx xxxxxx efektivně xxxxxxxxxx pouze v xxxx xxxxxxxxx, xxx xx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx nedostupnost xxx xxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx. Xxxxxxxx xxx xxxx efektivní xxxxxxxx xxxx pouze x případech xxxxxxxx xxxxxx. Xxxxxxxxxx právní xxxxxx přispěje ke xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxx, xx xxxxxx xxxx odpovědné xxxxxxx xxxxx, co se xxxx zajištění xxxxxxxxxxx xxxxxxxx xxxxxxxxx. Zajištění xxxxxxxxxxx xxxxxxxxxx léčivých xxxxxxxxx zamezí xxxxxxxxxxx xxxxxxxxxx na sanaci xxxx způsobených případným xxxxxxxxxxx takových léčivých xxxxxxxxx. |
|
|
Xxxxxxx novelizační xxxx |
|
|
Xxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxxx xxxx xxx předpokládat x xxxxxxx na xx, xx se xxxxx o xxxxx xxxxx, xxxxx xxxxxxxxx xxxxxxxxx xxxxxx úpravu (xxxx. xx se xxxx xxxxxxxxxxx inspektorů). |
|
|
3.2 Xxxxxx na podnikatelské xxxxxxxx: ANO Adaptace nařízení xx xxxxxxxxxx xxxxxxxxx |
|
|
Xxxxxxxxxxxxxxx xx xxxxxxxx negativní xxxxxx xx podnikatelské xxxxxxxxx v oblasti xxxxxxxxxx xxxxxxxxx. Xxxxxx xxxxxxxxxx hodnocení xxxx xxx xxxxxxxx nově xxxxxxxxxxxxx (podávání žádostí xxxxxxxxxxxxxxx jednotného evropského xxxxxxx) x xxxxxxx xx xxxxxx zejména xxxxxxxxx. Xxxxxxx tak xxxx xxxxxxx podnikatelských xxxxxxxx seznámit se x xxxxxx procesními xxxxxxxx, které však x xxxxxxxx xxxxx xxxxxx již x xxxxxxxx. Náhrady xxxxxx xx nové agendy xx měly xxx xxxxx xxxxxxxx xxxxxxxx xxxxxxx xxxxxx za xxxxxxxxxx xxxxxxxxxx xxxxxxxxx, xxxxx xxxxxxx xxxxxx xxxx xxxxx jednou xxxxxxx xxxxxxxxxx xxx xxxxxxxxx Xxxxxxx xxxxxxx xxx xxxxxxxx xxxxx, xxx xxxxxxx xxxxxx (xxxx xxxxxxxx komisemi). |
|
|
Omezení xxxxxxxxx |
|
|
Xxxxxxxxxxxxx xx dopady xx xxxxxxxxxxxxx prostředí xx xxxxx zavedení xxxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xx xxxx České xxxxxxxxx xx zahraničí x xxxx x xxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx xxxxx spočívající x xxxxxxx xxxxxxxxxx. Xxxxxx xxxxxxxxxx xxxxxx xxxxxx xx distributory léčivých xxxxxxxxx xxxx xxxx xxxxxxxxxxxxxx xxxxxxxxx komplexního x xxxxxxxxxxxxxxx xxxxxxx. |
|
|
Xxxxxx xxxxx xxxxxxxxxx právní xxxxxx opatření zamezujících xxxxxxxxxx xxxxxxxxxx bude xxx xx držitele xxxxxxxxxx xxxxxxxx přípravků. Xxxxx xxxxx xxxx xxxxxxxxx a xxxxxxx x xxxxxxxx povinnosti xxxxxxxxxxxx xxxxxxxxxxx xxxxx x množství xxxxxxxx xxxxxxxxx xxxxxxxx xx Xxxxx republiky. X xxxxxxxx xxxx xx xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxx, avšak xxxxxxxxxxx xxxxx xxxx x xxxxxx xxxxxx přesně xxxxxxxxx xxxxxx xxxxx. X konečném xxxxxxxx xxxx mít xxxxxx xxxxxx xxxxxxx reexportů x nezbytných xxxxxxxxx xxxxxxxxx dopad na xxxxxxxx rozhodnutí x xxxxxxxxxx. Držitelé xxxxxxxxxx x xxxxxxxxxx umísťují xxxxxx přípravky x xxxxxxx xx jednotlivé xxxx zemí XX. X xxxxxxxxxxxx xxxxxx XX xxxx xxxxxx xxxxx stanovené maximální xxxx léčivých xxxxxxxxx, xx které xx xxxxx držitelé xx xxx xxxxxx. Držitelé xxxxxx xxx xxxxxxx xxxxxxx konkrétního xxxxxxxx xxxxxxxxx xxxxxxxxx xxxx xx xxxxxx x xxxxx xxxxxxx xxxxxxxx. Xxxxx xxxxxx uvažovali, xx xxxxxxxx by xxxxxxxx pouze xx xxxx s xxxxxxxx xxxxxxx xxxxxxxx, xxxx xxxxxxx xx xxx xx xxxx xxxxxxxxxxxxx. Xxxxxxxxx xxxxxxxxxx dochází xx trzích, do xxxxxxx xx xxxxxxxxxxxxx, x xxxxxx xxxxxxx, xxx tato xx xx úkor xxxxxxxx x xxxxxxxxxx xx xxxx xxxxxx: 1. Xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxx xx xxxxxxx spotřeby xxxxxxxx xxxxxxxxx, xxxxx xxxxx držitel sám x za vyšší xxxx; 2. xxxxx xx distributorem xxxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxx xxxxxx xxxxxxxxx z xxxx xxxx za xxxxx xxxx xxxx xxxx xxxxxx soutěž x dalšímu xxxxxxx xxxx xxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxx xxxx xxxx xxxxx. Xxxxxx je xxxxxx xxxxxx samozřejmě xxxxxxx, xxxxxxx paralelní xxxxxx xx xxxx důsledky xx xxxxxxxx léčivých xxxxxxxxx. |
|
|
Xxxxxxx novelizační xxxx |
|
|
X xxxxxxx xx xx, xx xx xxxxxxx x xxxxxxxx xxxxx, xxxxx xx xxxxxxxxxxxx. |
|
|
3.3 Xxxxxx na xxxxxx xxxxxxxxxxx celky (xxxx, xxxxx): NE |
|
|
Nepředpokládají xx xxxxx xxxxxx xx xxxxxx xxxxxxxxxxx celky. |
|
|
3.4 Xxxxxxxx xxxxxx: XX |
|
|
3.5 Xxxxxx xx xxxxxxx xxxxxxxxx: NE |
|
|
Nepředpokládají se xxxxx xxxxxx xx xxxxxxx prostředí. |
|
101) Nařízení Xxxxxx x přenesené xxxxxxxxx (XX) č. 1252/2014.“.
104) Xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (EU) č. 536/2014.“.
102) Xxxxx č. 227/2006 Sb., x xxxxxxx xx xxxxxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxxxx x xxxxxxxxxxxxx xxxxxxxxxx x x xxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxx, ve znění xxxxxxxxxx xxxxxxxx.
103) Například xxxxxxxx zákoník, xxxxxxx xxxxxxx, zákon č. 101/2000 Sb., xx xxxxx xxxxxxxxxx xxxxxxxx.
Čl. 75 xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Rady (XX) x. 536/2014.“.
XXXXXXXX ZPRÁVA
OBECNÁ XXXX
X. Závěrečná xxxxxx o xxxxxxxxx xxxxxx xxxxxxxx (XXX)
1. Xxxxx xxxxxxxxxx x xxxx
1.1. Název
Návrh xxxxxx, xxxxxx se xxxx xxxxx č. 378/2007 Sb., o xxxxxxxx a o xxxxxxx některých souvisejících xxxxxx (xxxxx x xxxxxxxx), ve znění xxxxxx x. 124/2008 Xx., xxxxxx x. 296/2008 Xx., xxxxxx x. 141/2009Xx., xxxxxx x. 281/2009 Xx., xxxxxx č. 291/2009 Xx., xxxxxx x. 75/2011 Xx., xxxxxx x. 375/2011 Xx., xxxxxx č. 50/2013 Xx. a xxxxxx x. 70/2013 Xx.
1.2. Xxxxxxxx xxxxxxxx
X současné xxxx je xxxxxxxxxxxx xxxxxxxxx kvality, účinnosti x xxxxxxxxxxx xxxxxxxxx x xxxxxxxxxxxxx léčivých xxxxxxxxx xxxxxxxx xxxxxxx x xxxxxxxx x xxxx xxxxxxxxxxx předpisy. Xxxxxx xxxxxxxx předpisy xxxx xx xxxxxxxx xxxx Xxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxxxx právních xxxxxxxx x xxxxxxx xxxxxxxxx x veterinárních xxxxx, xxxxx xxxx xxxxxxx x Xxxxxxxx xxxx xxxx vydáním xxxxxx xxxxxx.
Xxxxx x xxxxxxxx xxx již celkem xxxxxxxxxxxx novelizován, xxxxxxx xx na xxxxxx xxxxxx xxxxxxxxxx xxxxxxx č. 70/2013 Sb. xxxxx x xxxxxx novelizace, xxxxx xx xxxxxxxx způsobem xx xxxxxx xxxxxx xxxxxxx x výrazně xxx xxxxxx; xxx x xxxxxx víceméně xxxxx, xxxxx podstatné xxxxx xxxxxx dosud xxxxxxx v původním xxxxx.
Xxxxxxxxxxx xxxxx xxxxxx xxxxxx xxxxxxx xxxxxxxx x xxxx, xxx Xxxxx xxxxxxxxx xxxx x xxxxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxx Xxxxxxxx xxxx x xxxxxxx xxxxx, x xx xxxxxxxxx x xxxxxxx klinického xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx. Xxxx xx xxx xxxxx návrh zákona xxxxxxx přispět x xxxxxxx xxxxxx x xxxxxxxxxx xxxxxx xxxxxxx x x tomu, xxx odborná xxxxxxxx xxxxxxxxxxxx x xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxxxxx xxxxxxxx x xxxxxxxxxxx xx účelem xxxxxxxxxxx odborných záruk x oblasti xxxxxxx xxxxxxxxx xxxxxx a xxxxxxx bezpečnosti xxxxxxxx xxxxxxxxx ve vztahu x xxxxxxxxxx xxxxxxx xxxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxxxx.
1.2.1. Xxxxxxxx xxxxxxxx o xxxxxxxxxx xxxxxxxxxxx humánních xxxxxxxx xxxxxxxxx
Xxx 16. xxxxx 2014 bylo přijato xxxxxxxx Xxxxxxxxxx parlamentu x Rady (EU) č. 536/2014 x xxxxxxxxxx xxxxxxxxxxx humánních léčivých xxxxxxxxx x x xxxxxxx xxxxxxxx 2001/20/ES. Xxxxx xxxxxx 99 xx xxxx xxxxxxxx xxxxxxx xxxxxxxx xxxx xxxxxx xx xxxxxxxxxx xxxxxxxx xxxxx xx. 82 odst. 3, xx. oznámení Xxxxxx, xx xxxx xxxxxxx xxxxxxxx xxxxxxxxxxx v xxx, že xxxxxx XX a databáze XX dosáhly plné xxxxxxxxxx x xxxxxxx xxxxxxx stanovené funkční xxxxxxxxx. X xxxxxxxxxx xx. 99 xxxxxxxx xx xxxx stanoveno, xx x xxxxxx xxxxxxx se xxxx xxxxxxxx xxxxxxxxx xxxxx xxx 28. května 2016. Xxxxx pro xxxxxxx xxxxxxxx xx xxxx xxxxxxxxx xxxxxxxxxx x xxxxxxxxxx xx xxx, xxx xxxxx x oznámení Komise. X každém xxxxxxx xx xxxx xxxx xxxxxxxx použije xxxxxxxx xxx 28. xxxxxx 2016. X xxxxxxx xx xxxxx xxxxxxxxxx xxxxx x xxxxxxxx xxxx x xxxxxxxxxxx xxxxxx novely xxxxxx x xxxxxxxx nově xxxxxxxx xxxxxxxxxxx týkající xx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xx v xxxxxxx x xxxxxxxxx xxxxx adaptovat.
Přijetí xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) č. 536/2014 xxxx xxxxxxxxxx xxx, xx, jak praxe xxxxxxx, xxxxxxxxxxxxxxx xxxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx, x který xxxxxxxxx xxxxxxxx 2001/20/ES, xxxx x xxxxxxxxx xxxxxxx xxxxxxxx xxxxx xxxxxxxx, xxxx xx xxxxxxx xxxxxxx xxxxx xxxxxxx xxxxxxxxx právní xxxxxx k tomu, xxx xxxx xxxxxxxx xxxx xxxxxxxxx xxxxxxxx x jejich xxxxxxxx xxxxxx xxxxxxxxxxxxx, a xxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxx za xxxxxxxxx xxxxxxxx 2001/20/ES.
Xxxxxxx xxxxx xxxxxx xxxxxxxx, xx xxxxxxxx xxxxxxxxx se x xxxxxxxxxxx xxxxx xxxxxxxxx xx specifičtější xxxxxxx xxxxxxxx, xxxx xxxx xxxxxxxxxx identifikované xxxxxxxxxxxxxxx genomických xxxxxxxxx. Xxx bylo xxxxx xx xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx dostatečný xxxxx xxxxxxxx, xxxx xxxxxx na xxxxx xxxxxxx více xxxxxxxxx xxxxx xxxx xxxxxxx xxxxxxx. Xxxx nové xxxxxxx povolování xxxxxxxxxx xxxxxxxxx xx měly xxxxxxxxxx zapojení co xxxxx největšího xxxxx xxxxxxxxx xxxxx. Xxxxx xx se v xxxxx zjednodušení xxxxxxx xxxxxxxxxxx xxxxxxxxxxx x xxxxxxx o povolení xxxxxxxxxx xxxxxxxxx xxxx xxxxxxx vícenásobnému předkládání xxxxxxxx identických xxxxxxxxx, xxxxx xx mělo xxx xxxxxxxxx předložením xxxxx xxxxxxxxxxx k xxxxxxx pro všechny xxxxxxx členské státy xxxxxxxxxxxxxxx jednotného xxxxxxx xxx xxxxxxxxxxx. Xxxxxxxx x xxxx, xx xxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxx xxxxx mají z xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxx význam, xxxx xx xx xxxxxxxxxxx x xxxxxxx xxxxxxxx xx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxx xxxxxxxxxxxxxxx tohoto jednotného xxxxxxx.
Xxxxxxxx Evropského xxxxxxxxxx x Rady (EU) č. 536/2014 xxxxxxxxx xxxxxx x xxxx, že xxxxxxx poznatky xxxxxxx, xx xxxxxx xxxxx xxxxxxxx xx xxxx xxx xxxxxxxxxx a xxxxxxxxxx výhodná xxxxxxxxx xxx xxxxxxxxxx xxxxxxxxxxx, xxxxx se xxxxxxxxx xx xxxx než x xxxxxx členském xxxxx, xxxxxxx by xx xxxxx opírat xxxxx x xxxx xxxxxxxxxx při xxxxxxxx xxxxxxxxx klinického xxxxxxxxx, xxx xxxx xxx xxxxxxxx xxxxx o xxxxxxxxxxx x při xxxxxxxxxx xx xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx. Xxxxxxx xxxxx xxxxxxxx xx tu xxxxxx, xx xxxxxxx v xxxxxxxx xxxx jednotlivými xxxxxxxxx xxxxx se xxxxx xxxxx xx xxxxxxx x xxxx xx vést x x xxxxxxxxxxxx spolupráci xxxxxxxxx xxxxx při xxxxxxxxxx žádostí x xxxxxxxx xxxxxxxxxx xxxxxxxxx. Xxxx xxxxxxxxxx xx xxxxxx zahrnovat xxx xx xxxxxxx, které xxxx xx xxx xxxxxxxx vnitrostátní povahy, xxxx xx xxxxxxxxx xxxxxxx x xxxxxxxxx xxxxxxxx komisí. Xxxxxx xxxxxxxx xxxxxxxxx by xxx xxx xxxxxx x xxxxxxxxx, xxx xxxxxxxxxxx x xxxxxxxxxxxxxxxx xxxxxxxxx xxx xxxxxxxx xxxxxxxxxx xxxxxxxxx, avšak xxxx nesmí ohrozit xxxxxxxxxx pacientů nebo xxxxxxx xxxxxx.
Xx xxxxx xxxxxx xxxxxx xxxx xxxxx Xxxxxxxx parlament x Rada x xxxx, xx xxxxxx xxxxxxxxx klinického hodnocení xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx xxxxxxxxxxx xxxxxxxxx XX x xxxx xxxx co nejkomplexněji x xx členské xxxxx zbude xxxxxx xxx xxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxx, xxx xxxxxxx řešení je xx xxxxx xxxxxxxxx xxxxxxx xxxxxxxxx.
Xxxxxxx nařízení Xxxxxxxxxx xxxxxxxxxx a Xxxx (XX) č. 536/2014 xx v České xxxxxxxxx xxxxx xxxxxxxxxx x xxxxx tedy xxx xxxxxxx xxxxx, xxxx xxxxx xxxx xxxxx x xxxxxxx xxxx Xxxxx xxxxxxxxx xxxxxxxx, xxxxxxxxxxxx či xxxxx xxxxxxxxxx. Xxxxxxxxxxx xxxxx xxxxxx xxxxxx x xxxxxxxx x xxxxxxxxxx xx xxxxx xxxxxxxx Evropského xxxxxxxxxx x Xxxx (EU) č. 536/2014 xx xxxxxxxx xx xxxxxx xxx xxxx vztahů, xxxxxxx xxxxxx xxxxxxxxx xxxx xxxxxxxx xx xxxxxxxxx xxxxxxx. Xxx především x xxxxxxxxxxx okruhy xxxxxx.
Xx xxxxxxxx xxxxx xx x xxxx xxxx ponechává, xxx xxxxxxxx xxxxxxxxx xxxxx xxxx xxxxxx, xxxxx xx xxxxx xx xxxxxxxxx žádosti x xxxxxxxx klinického hodnocení xxxxxxx, x xxx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxx ve xxxxxxx xxxxxxxxxxx x xxxxxxxx xxx xxxxxxxxxx klinických xxxxxxxxx. Xxxx xxxxxxxxxx xxxx být xxxxxxxxxxx xxxxxxx organizace xxxxxxx xxxxxxxxx státu. Xxx xxxxxxxxxxx xxxxxxxx xxxxxx xxxx xxxxxx xx xxxxxxx stát zajistit xxxxxxxx xxxxxxxx xxxx, x xx xxxxxxx xxxxxxxx xxxx xxxxxxxxxx xxxxxxxx. Posouzení by xxxxxx mělo xxx xxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxx xxxx, xxxxx xxxx xxxxxxxxx kvalifikaci x xxxxxxxxxx k xxxxxxxxx xxxxxxxxx a xxxxxxxxxxxxxxx xxxxxxxxx, xxxxxxx xxxxx xxxxxxxxxx xxxxxx xx měly být xxxxxxxxx xx zadavateli, xxxxx xxxxxxxxxx hodnocení x xxxxxxxxx zkoušejících x xxxxxx xx xxxxxx xxx vystaveny xxxxxx xxxxx nepatřičným xxxxxx. X xxxxx xxxxxxx xxxxxxxxx xxxxx xxxx existovat xxxxxxx xxxxxx xxxxxxxxxxx xx xxxxxxxxxx xxxxxxxxxx hodnocení. Xxx xxxx xxxxx xxxxxxxxx x xxxxxx xxxxxxxxxx xxxx xxxxxxxxx xxxxx, xxx xx xxxxx xxxxxxx stát xxxxx xxxxx kontaktní xxxxx.
Xxxxxx xxxxxxx, xxxxx xxxxxx xx xxxxxxxxx xx xxxxxxxx státě, xxxx xxxxxxxxxxx xxxxxxxx. Xxxxxxx stát xx xxx xxxxx xxxxxxxx xxxxxxxxx na dokumentaci xxxxxxxxxx xxxxxxxxx. Xxx xx zajistilo bezproblémové xxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxx o povolení xxxxxxxxxx hodnocení, měl xx xxxxxxx xxxx xxxxxx, xx xxxx xxxxx pro dokumentaci, xxxxx xxxx xxxxxx xxxxxxxx xxxxxxxxx, určí xxxxxxxxx xxxxxxxxxxxx xxxxx x xxxxxxx xxxxxxxxx.
Xxxxxxxxx xxxxx xx xxxxxxxxxxx x xxxxxx xxxxxx xxxx xxxxxxxx týkající xx xxxxxx xxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxxxxxx x nezletilých xxxx, xxxxx xx v xxxxxxxxxxxx členských státech xxxx.
Xxxxxx význam xxx xxxxxxx xxxxxxxx a xxxxx xxxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxx xx xxxxxxxxxx xxxxxxxxx má xxxxxxxxxxx xxxxxxxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxxxxxx xxxxxxxxx. Tento xxxxxxx xx xxx xxx xxxxxxxx členem xxxxxxxxxx xxxx xxxxxxx xxxxxxxxxx xxx xxxxx úkol xxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxx v xxxxxxxx xxxxx, x němž xxxxx xxxxxxx.
Xxxx se xxxxxxxxx členskému xxxxx xxxxxxx, xxx xx xxxxxxx, xx kromě xxxxxxxxxxxxx xxxxxxxx daného xxxxxxx xxxxxxxxxxx xxxxxxxxx xxxx xxxxxxxxx, xxx xxxxxxxxx osoba, xxx xx xxxxxxx xxxxxxx xx xxxxx x xxxxxxxx xxxxxxxxx jí xxxxxxxxxx, xxxx sama xxxxxxx xxxxxxxx písemného xxxxxxxx xx xxx xxxxxx xx xxxxxxxxx xxxxxxxxx.
Xxxxxxx xxxx má xxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxx xxxxxxx xxxxxx, xxxxx xxxx x xxxxxxx xxxxxxxxxxxx nebo xxxxxxxx xxxxxxxxxx. Xxx x xxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx, xxxxx zbavené xxxxxxx, xxxxx, které xx x xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxx účastnit xxxxxxxxxx xxxxxxxxx, a xxxxx, xxxxx jsou xxxxxxxx ke xxxxx xxxx, xxxxxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxx stavu xxxxxxxx xx xxxx, x xxxxx se xxxxxxxxx x xxxxxxxxxx xxxxxxx xxxx.
Xxxxxxxxx státu xx xxxx ponechává xxxxxx xxxxxxxx xxxxxx, xxx v xxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxx xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxx xxxxxxxxxxxxxx xx xxxxxxxxxxxxx xxxxxxxxxxxx zadavatele xxxx xxxxxxxxxxxx. Xxxxxxxx xxx xxxxxxxxxxx x těchto xxxxxxxxx, xxxxxx xxxxxx xxxxxxxx xxxxxxxxxxx a xxxxxx xxxxx, xx x xxxxxx xxxx xxxxx vnitrostátními xxxxxxxx. Xxxxxxx xxxx by xxx xxxx xxxxxxxx xxxxxxxx systémů xxxxxxx xxxxx xxxxxxx xxxxxxxx xxxxxxxxx, které budou xxxxxxxxx povaze x xxxxxxx rizika, xxxxxxx xxxxx je, aby xxx xxxxxxxxxx xxxxxxxxxxx xxxx xxxxxxxxx xxxxxxx xxxxx xxxxxxx xxxxxxxxx x souladu s xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxx.
Xxxxxxxxx roli xx x nadále členský xxxx x xxx, xx xx xx xxxxxxx xxxxxxxx xxxxxxx xxxxxxxx klinického xxxxxxxxx, xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx vyžádat u xxxxxxxxxx změnu klinického xxxxxxxxx. Xxxxxxx xxxx xx zajistit dohled xxx xxxxxxxx klinického xxxxxxxxx. Xxx byl xxxxxxxx xxxxxx x xxxxxxxxx, členský stát xx xxxx oprávnění x xxxxxxxxx xxxxxxxx xxxxxxxx x x xxxx xx xxx xxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx. Za xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx x nařízení xx xxxxxxxx státům xxxxxxxx xxxxxxx xxxxxxxx, xxxxxxx xxxxxxxxx je xxxxxxxx x článku 86 x 87 xxxxxxxx (xxxxxxxxxxxxx xxxxxxxxx xxxx xxxxxx, xxxxxx musí xxx xxxxxxxxx xx xxxxxxx xxxxxx úhrady xxxxxxx, xxxx být xxxxx jedna platba xx xxxxxxxxx).
Xxxx xx xxxxxxxx státům xxxxxxxx xxxxxxxx xxxxxxxx na xxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx nekomerčními xxxxxxxxxx, xxxxxxx xx xxx xxxxx zákona x xxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxxxx služeb xxxxxxx xxxx xxxxxxxx xxxxxx xxxx xxxxxxx xxxxxxxxxxxx xxxxxx, xxxxxxx xxxxxx xxxxx x veřejná xxxxxxxx xxxxxxxxx, x xxxxx maximálního xxxxxxx xxxxxxxxxx příspěvku xxxxxx xxxxxxxxxxxx xxxxxxxxxx x xxxxx xxxxxxx xxxxxx xxxxxxx, xxxx xx xxxxxxxxx x ohrožení xxxxxxx klinických xxxxxxxxx. Xxxx xxxxxxx x xxxxxxxx xxxxxxxxxx, xxxxx xxxxxxxxxx x tom, xx xxxxx část xxxxxxxxxx xxxxxxxxx je xxxxxxxxx nekomerčními xxxxxxxxxx, xxxxx často xxxxxxxxx xx finanční xxxxxxxxxx, xxxxx xxxxxxxxx, x xx zčásti xxxx xxxxx, z xxxxxxxxx xxxxxxxxxx nebo x xxxxxxxxxxxx xxxxxx.
X xxxxxxxxxx xx xxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Xxxx č. 536/2014 xxxxxxxxxxx xxxxx xxxxxx xxxxxx x xxxxxxxx xxxxxxx xxxxxxxxx xxxxxx xxx, xxxxx spočívá x xxxxxxxx xxxx, xxx xxxxxx úprava v Xxxxx xxxxxxxxx xxxxxx xxxxxxxxx xxxxx provádění xxxxxxxxxx hodnocení xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxx xxxxx Xxxxxxxxx xxxx xxxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Xxxx č. 536/2014. Návrh se xxxxx soustřeďuje na xxxxxx xxxxxxxxx záležitostí, xxxxxxx xxxxxx je xxxxxxxxx státu svěřena, xxx xxxxxx obsažená x xxxxxxxx x x xxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxx xxxxxx xxx xxxxxxxxx xxxxxxxxx xxxxxxxxxx hodnocení.
Byly xxxxx identifikovány následující xxxxxxxx:
Xxxxx xxxxxxxxx, xxxxxxx xxxxxxx stát, xxxx xxxxxxxx následující xxxxxxx:
- xxxxxxxx xxxxxxxxx orgán xxxx xxxxxx, xxxxx xx budou xx xxxxxxxxx xxxxxxx o xxxxxxxx klinického xxxxxxxxx xxxxxxx, xxxxxxxx xxxxxxxxx xxxxxxx xxxxxx při xxxxxxxx xxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxxxxxx xxxxxx, tzn. zajistit xxxxxxxxxxx xxxxxx xxxxxx xx zadavateli, xxxxxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxxxx, a xxxxxxxx xxxxxxxxxx etických xxxxxx xx xxxxxxx stanovených x nařízení xxx xxxxxxxxxx xxxxxxxxxx hodnocení;
- xxxxxx xxxxxxxxx x xxxxxxxx xxxxxxx xxxxxxx xxxxxxxx xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxxxxxx s xxxxxx xxxxxx ve xxxxxx xx území xxxxxx xxxxxxxxx xxxxx;
- záležitosti xxxxxxxx;
- xxxxxxx s xxxxxxxxxxxx subjektem hodnocení xx měl xxx xxxxxxxx členem xxxxxxxxxx xxxx odborně xxxxxxxxxx xxx xxxxx úkol xxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxx v xxxxxxxx xxxxx, v xxxx xxxxx xxxxxxx;
- rozhodnout, xxx kromě informovaného xxxxxxxx xxxxxx zákonně xxxxxxxxxxx zástupcem bude xxxxxxxxxx, xxx xxxxxxxxx xxxxx, xxx xx xxxxxxx xxxxxxx xx xxxxx x posoudit xxxxxxxxx xx xxxxxxxxxx, xxxx xxxx xxxxxxx xxxxxxxx písemného xxxxxxxx xx xxx xxxxxx xx xxxxxxxxx hodnocení;
- xxxxxxxxxx, xxx xxxxx xxxxxxxxx doplňková xxxxxxxx xxxxxxxx xxxx xxxxxxx xxxxxx, xxxxx xxxx x situaci xxxxxxxxxxxx xxxx faktické závislosti;
- xxxxxxxx xxx xxxxxxxxxxx x xxxxxxxxx xxxxx xxxxxxxxx subjektu xxxxxxxxx xxxxxx xxxxxx xxxxxxxx xxxxxxxxxxx a xxxxxx xxxxx, se x xxxxxx xxxx xxxxx xxxxxxxxxxxxxx xxxxxxxx;
- členskému xxxxx xx xxxxxxx xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx, pozastavit xxxxxxxx xxxxxxxxx xxxx xxxxxxx u zadavatele xxxxx xxxxxxxxxx xxxxxxxxx; xxxxxxx stát má xxxxxxxx xxxxxx nad xxxxxxxx xxxxxxxxxx xxxxxxxxx; xxx xxx xxxxxxxx xxxxxx s xxxxxxxxx, xxxxxxx xxxx xx xxxx xxxxxxxxx x xxxxxxxxx xxxxxxxx xxxxxxxx x x xxxx xx xxx xxx xxxxxxxxxxxx inspekční kapacity; xx xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx x xxxxxxxx xx xxxxxxxx xxxxxx umožněno xxxxxxx xxxxxxxx;
- xxxxxxxxxx x xxxxxxx opatření na xxxxxxx xxxxxxxxxx hodnocení xxxxxxxxxxx nekomerčními xxxxxxxxxx x xxxxx xxxxxxxxxxx xxxxxxx hodnotného xxxxxxxxx xxxxxx xxxxxxxxxxxx zadavatelů x xxxxx xxxxxxx xxxxxx xxxxxxx.
X xxxxxxxx xxxxxx xxxxxx xxxx xxxxxxxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxx:
X xxxxxxxx xxxx xx xxxxxx xxxxxx xxxxxxxxxx xxxxxxxxx x xxxxxx x xxxxxxxx x prováděcí xxxxxxxx xxxxxxxx x xxxxxxxxxx xx směrnici XX xx klinickým xxxxxxxxxx. Xxx xxxx xxxxxxx xxxx, stávající xxxxxx xxxxxxxxxxx xxxx dle XX xxxxxxxxxx a x xxxx xxxxxx xxxx xxxxxxxxxx k xxxxxxx nařízení. Xxxxx xxxxxxxxxxxx právní xxxxxx, xxxxx xx xxxx xxxxxxxx xxxxxxxxxx, x xxxx xxx xxxxx x xxxxxx xxxxxxxx xxxxxxxxxxxxx problémy.
1.2.2. Opatření xxxxxxxxx x xxxxxxx xxxxxxxxx léčivých xxxxxxxxx
Xxx xxxxxxxx xxxxxxxx stavu xxxxx být xxxxxx xxxxxxxxx za xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxx xxxx xxxxx Xxxxx xxxxxxxxx. Xxxxxxxxxx xxxxxxxx xxxxxxxxx lze xxxxxx uskutečňovat nejen xx xxxxxxxxx xxxxx Xxxxxxxx xxxx, xxx xxx xx tzv. xxxxxxx zemí. V xxxxxxx distribuce xxxxxxxx xxxxxxxxx xx xxxxxxx xxxx xx xxxxxxxxx xxxxxxx xxxxxxxx stanovená xxxxxx Xxxxxxxx xxxx. Xxxxxxxxxxxx do zahraničí xxx lze xxxxx xxxxxxxx xxxxxx xxxxxx x léčivé přípravky, xxxxx xxxx xx xxxxxxx xxxxxx x xxxxxxx x xxxxx Xxxxx republiky. Xxxxxxxx xx xxx xxxxxxxxx x zákoně x xxxxxxxx, xx xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxx xx xxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx. Xxxxxxxx xxxxxxxxxx o xxxxxxxxxx xxxx dodávat xx xxx x České xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxxxxxxxx xxxxxxxxx, za xxxxxxx xxxx xxxxxx Xxxxxxx xxxxxxx pro xxxxxxxx xxxxx xxxxxxxx xxxxxxxxx xxxxxxx agenturou XXX xxxxxxxxxx o xxxxxxxxxx, x xxxx xxxxxxxx x českém jazyce. Xxx tedy xxxxxxxxxxx x xxxxxx, xxxxx xxxx xx xxxxxxx xxxxxx x xxxxxxx xxxxxxxx v Xxxxx xxxxxxxxx x nikoli x xxxx xxxx. Xxxxxx xxxxxxxxx xxxx xxx v xxxxx xxxx xxxxxxxx x xxxxxxxxxx xxxxxx xxxx xxxx. Xxxxxxxx xxxxxxxxxx xxxxxxxx přípravků xxx xx xxxxxxx x xxxxxxx xxxxxxx pacientů x České xxxxxxxxx x xxxxxxxx xxxxxxx xxxxxxxxxx.
Xxxxxxxx léčivých přípravků x xxxxx Evropské xxxx, které xxxxxxxxx xxxxxxxxxx držitelé xxxxxxxxxx x xxxxxxxxxx, xxxx xxxxx xxxxxxxx x xxxxxxxx vykonávat také xxxxxxxxxxxx xxxxxxxx xxxxxxxxx - xxx x xxxxxxxxx distribuci x xxxxxxxx xxxxxxxxx, jejichž xxxxxxxxxx o xxxxxxxxxx xxxx vydáno xxxxxxxxx xxxxxxx xxxxxxxxx EMA xx x xxxxxxxx xxxxx x xxxxxxxx xxxxxxxxx, xxxxxx xxxx xxxxxx xxxxxxxxxx x xxxxxxxxxx Státním xxxxxxx xxx kontrolu xxxxx. X xxxx xxxxxxxxx xx xxx xxx xxxxxxx souběžně xxxxxxxxxxxxxxx x souběžně xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx trh xxxxx xxxxxxxx xxxxxx xxxxxxx xxxxxxxxx xxxxxxxxx x xxxx členské xxxx Xxxxxxxx unie.
Důvodem pro xxxx xxxxxxxx je xxxxxxx xxxxx xxxx xxxxxxxx přípravku v „xxxxxxxx xxxxxxx xxxx“, xx které jsou xxxxxx xxxxxxxxx odvezeny xx jiné xxxxxxx xxxx, xx které xx xxxx daného xxxxxxxx xxxxxxxxx xxxxx.
Xxx. xxxxxxxx xxxxxx xx xxxxxxx a prováděn x xxxxxxx x xxxxxx Evropské xxxx, xxxxxxxxx xx zásadou xxxxxxx xxxxxx xxxxx xxxxxxxxx články 34 x 35 Xxxxxxx x xxxxxxxxx Xxxxxxxx xxxx. Xxx judikatury Xxxxxxxxxx xxxxxxxx xxxxx xx zásada xxxxxxx xxxxxx xxxxx xxxxxxx xxx xx xxxxxx xxxxxxxxx. Xxxxx republika xx x ohledem xx účinnou xxxxxxxx xxx léčivých xxxxxxxxx xxxxxxx „zdrojovou zemí“ x xxxxxx xxxxxxxxx xxxx tak x xxxxxx trhu xxxxxxxx (xxxxxxxxxxxxx) xx významných xxxxxxxxxx.
Xx xxxxxxxxxx vývozu xxxxxxxx xxxxxxxxx xx x České xxxxxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxx, xxxxx xxxx xxxxxxx xxxxxxxx x distribuci, x xxxxxxxxxxxx xxxxx. X distribuci xxxx xxxxx Xxxxx xxxxxxxxx xxxxxxx xxxxxxx x xxxxxx xxxxxxx stanovených xxx léčivých xxxxxxxxx x xxxxxxxxxxxx xxxxxxxxx xxxxxxx Evropské xxxx x xxxx xxxxxx xxxxxxx představuje xxxxxxx xxxxxxxxxx xxxxx xxxxx xxxxxxxx podílejících xx xx této xxxxxxxxxx. Xx druhou stranu xxxxxxxx xxxxxx napříč xxxxxxxxx xxxxx umožňuje xxx xxxxxxxx xxxxx xx xxxxxxxxx distribuci xxxxxxxx xxxxxxxxx x xxxxxx zemí xx Xxxxx xxxxxxxxx. Xx xxxxxx od xxxxxxxxxx xxxxxx a xxxxxxxx xxxxxxxxxx, xxxxx xxxx x xxxxxx x xxxxxxxx a předpisech Xxxxxxxx xxxx stanovena xxxxxx x xxxxxxxxxxx xxxxxxxx a xxxxxxxx, xx kterých xxxxx xxx realizovány, xxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxx Evropské xxxx xx xxxx xxxxx daného xxxxxxxxx xxxxx xxxxxxxxx xxxxx xxxxxxxxxx.
Xxxxxxxxxxxx xxxxxxxxx xxxxx, xxx je též xxxxxxxx xxxxxx xxxxx x xxxxx xxxxxxxxx, xx xxxxxxxxxxx xxxxxxxxxx x x xxxxxxxx xxxxxxxx xxxx xxx xxxx xx poskytování xxxxxxxxx péče x Xxxxx xxxxxxxxx xxx x xxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxx xxx pacienty, xxx x hlediska xxxxxxxxxx xxxxxxxxxxx ekonomického xxxxx xx xxxxxxx léčiv xxxx xx xxxxxxxxx xxxxxxxxx systému xxxxxxxxx xxxxxxxxxxx pojištění x xxxxxxx, xx xxxx xxxxxx xxxxxxxxx nahrazující xxx reexportovaný xxxxxxxxxxx.
Xxxxx xxxxxxxxx, xxxxxx xxxx xxxxxxx xxxxxxx státy XX, xx přitom xxxxxxxxx xx zajištění xxxxxxxxx xxxx xx xxxx xxxxx. Xxxxxx x prvků xxxxxxxxx xxxxxxxxx xxxx xx xxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx. X xxxxxxx x čl. 81 xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX xx xxx 6. listopadu 2001 o xxxxxx Xxxxxxxxxxxx týkajícím xx xxxxxxxxx xxxxxxxx xxxxxxxxx, xx znění xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx 2004/27/ES ze xxx 31. března 2004, mají xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxx přípravku x xxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxxx x stálé dodávky xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx a xxxxxx xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxx, xxx xxxx pokryty potřeby xxxxxxxx x xxxxx xxxxxxxx xxxxx. Tato xxxxxxxxx byla xxxxxxxxxxxxxx xx současného xxxxx xxxxxx o xxxxxxxx, xxxxxxxxx do ustanovení §33 xxxx. 3 xxxx. x) xxxx 3, xxxxx jde x xxxxxxxx xxxxxxxxxx x registraci, a xx ustanovení §77 xxxx. 1 xxxx. x), xxxxx xxx x xxxxxxxxxxxx. Xxxxxxxxxx xxxxxxxxxxxx xxx xxxxxxxxxx §77 xxxx. 3 xxxxx x případě, xx se zároveň xxxxx x provozovatele xxxxxxx, xx uvedení xxxxxxxxx x xxx, xxx léčivé přípravky xxxxxxx xxxx xxxxxxxxxxxx xxxxxxx xxxx xxxx xxxxxxxxxxx.
Xx xxxxxxx xxxxxxxxxx xxxxxxx xxxx xx xxx xxxxxxxx xxxxxxxx xxxxxxxxxx x xxxxxxxxxx x xxxxxxxxxxxx xxxxxxxx xxxxxxxxx. Xxxxxx však xxxxxxx x xxxxxxxx, xxx xxx xxxxxxx xxxxxxxx v Xxxxx xxxxxxxxx xxxxxx xxxxxxxx xxxxxxx pro xxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxx xxxxxx xxxxxxxxx, xxxxx xxxx xx Xxxxx xxxxxxxxx držitelem xxxxxxxxxx xxxxxx xx účelem xxxxxxxx povinnosti xxxx xxxxxxxxx v ustanovení §33 odst. 3 xxxx. g) xxx 3, xxx xxxxxxxx xxxx z xxxxx xxxxxxxxxxxx důvodů xxxxxxxxxxxxx xxxxxxx xx xxxxxxx x ČR, xxx xx zahraničí za xxxxxxxx xxxxxxxxxxxx finančních xxxxxxxx.
Xxxx proto identifikovány xxxxxxxxxxx xxxxxxxx:
X xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx:
- nedostupnost xxxxxxxx xxxxxxxxx pro xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx s přímým xxxxxx na xxxxxx xxxxxx (v xxxxxxxxx xxxxxxxxx xx může xxxxxx x o xxxxx xxxxxxxxxx stavy);
- xxxxxxxxxxxx efektivní xxxxxxxxxxxx xxxxxx xxxx xxxxxx.
X xxxxxxxx xxxxxx úpravy xxxx xxxxxxxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxx:
Xxxxxxxxx xxxxxx xxxxxx, xxx které Xxxxxx ústav pro xxxxxxxx léčiv xxxxxxxxxxx xxxx od xxxxxxxxxxxx, xxxxxxxx xxxxxxxxxx x xxxxxxxxxx a lékáren xxxx dostatečně xxxxxxxxx x xxxxxxxxx xxx, xxx xxxxxxxxxx definovaný xxxxxxx řešit xxxxxxxxx x skutečně efektivně. Xxxx zásadní xx xxxx:
- chybějící xxxxxxxxx xxxxxx problematiky;
- xxxxxx xxxxxx.
1.2.3. Adaptace xxxxxxxx xx xxxxxx x xxxxxxx xxxxxx pro xxxxxxx léčivé xxxxxxxxx
Xxxxxx xxxxxxxxx, xxxxx xx xxxx xxxxxxxxxx xxxxxx xxxxxx řešit, xx xxxxxxx xxxxxxxxxx ustanovení xxxxxxxxxxxx xxxxxxxx nakládání x xxxxxxxx látkami xxxxxxxx xxxxxxxx xx xxxxxxx xxxxxxxx Xxxxxx x xxxxxxxxx xxxxxxxxx (XX) č. 1252/2014 xx xxx 28. xxxxxx 2014 xxxxxxxxxx směrnici Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/ES, pokud xxx o xxxxxx x xxxxxx xxxxxxx xxxxxxx xxxxx pro xxxxxx xxxxx xxx xxxxxxx léčivé xxxxxxxxx. Xxxx nařízení xx xxxxxxxx pouze na xxxxxx xxxxx xxx xxxxxxx léčivé xxxxxxxxx. Xxxxxxxxxx §70 xxxxxx x xxxxxxxx xxxxxxx, xx xxxxxxx léčivé xxxxx xx xxxxxxx xxxxxxxxx správnou výrobní xxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxx. Xxxxxxxx xxxxxxx výrobní xxxxx xxxxxxxx látek xxxx xxxxxxxxx xxxxxx Xxxxxxxx xxxxxx. Pravidla xxxx xxxxxxxxx xxx xxx xxxxxx xxxxxxxx látek xxx xxxxxxx xxxxxx xxxxxxxxx, xxx x xxx xxxxxx xxxxxxxx xxxxx xxx hodnocené xxxxxx xxxxxxxxx, a xxxxxx xxx xxxxxx xxxxxxxx látek pro xxxxxxxxxxx xxxxxx přípravky. Xxxx xx mění xxxxxx xxxxxx xxxxxxx xxxxxxx praxe xxxxxxxx xxxxx pro humánní xxxxxx xxxxxxxxx, xxx xx xxxxxxx pokynem xxxxxxxxx x xxxxxxxx xxxxxx nařízením. Xxxxx xx již xxxxx xxxxxxxxxx xxxxxxxxx. Nařízení xx xxx xxxxxxx xxxxxx ve xxxxx xxxxxxx EU. Xxxxxxxxx xxxxxx xxxxxx xxxxxxxxx x zákoně x xxxxxxxx xx xxxxx xx xxxxxx x xxxxxxx látkám pro xxxxxxx léčivé přípravky xxxxxxx xx xxxxxx xxxxxxxxx vymahatelnosti dodržování xxxxxxxx nastavených xxxxxxxxx. Xxxxxxxxx konstrukci xxxxxxxxx xxxxxxxx xxxxxxx xxxxxxx xxxxx xx xxxx xxxxx zachovat xxx xxxxxx látky xxx xxxxxxxxxxx léčivé xxxxxxxxx.
1.2.4. Xxxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx x Generálního xxxxxxxxxxx xxx
Xxxxxxxx xx xxxxxxxxxx xxxxxx úprava měla xxxxx xxxxx xx xxxxxxxxx xxxxxxxx x xxxxxxxx xxxxx, xxxxx xx xxxxxxx xxxxxxxx xxxxxxxxxx řešení. Xxx x xxxxx xxxxxxxxxxxx xxxxxxxxxx právní úpravu xxxxxxxxxx Xxxxxxxx ústavu xxx xxxxxxxx léčiv x Generálním ředitelstvím xxx, xxxxx by xxxx především xxxxxxxxxxxx xxxxxxxx xxxxxx k xxxxxxxxxxxxx naplnění xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2011/62/EU, xxxxxx xx xxxx xxxxxxxx 2001/83/XX o xxxxxx Xxxxxxxxxxxx xxxxxxxxx se xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxx x xxxxxxxxx vstupu padělaných xxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxxxx řetězce. Xxxxxxxx právní xxxxxx xx xxxx xxxxxxxxx xxxxxxxx usnadnit xxxxxxx xxxxxx informací xxxx Xxxxxxxxxx xxxxxxxxxxxx xxx x Státním xxxxxxx xxx xxxxxxxx léčiv x xxxxxxx léčivých xxxxxxxxx, xxx xxxx xxxxxxxx xxxxx, xxxxxxx xxxxx xx třetích xxxx xx ze xxxxxx XX podmíněn xxxxxxx xxxxxxxxx xxxxxxxxxxx x xxxxxxxxx směrnicích. Xxxx xxxxxxxxx výměně xxxxxxxxx a následné xxxxxxxxxx xxxxx obou xxxxxx xxxxxx xxxxxx xx xxxxx účinněji xxxxxxx ve xxxxxx xxxxxxxx přípravků x xxxxxxxx látek, které xxxxxxxxxxxx xxxxxxxxxx xx xxxxxxx xxxxxxxx v xxxxxx XX.
1.2.5. Xxxxxxxxxxx xxx xxxxxxxxx činnosti x xxxxxx xxxxxxxxx xxxxxxxxx x zabrání xxxxxxxx xxxxxxxxx
X xxxxx xx xxxxxxx jako xxxxxxxxxxxxx současná xxxxxx xxxxxx prokazování xxxxxxxxxx xxx výkonu xxxxxxxxx xxxxxxxx na xxxxxxx xxxxxxxxxx xxxxxxxxxx Xxxxxxxx xxxxxx pro xxxxxxxx xxxxx různými xxxxxxxx xxxxxxxx xxxxxxxxxx se xxxxxxxx xxxxxxxxx x xxxxxxxxx s xxxx, x xxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxxxxxxxxxxx xxxxxxxx právní xxxxxxx xxx xxxxxx xxxxxxxx xxxxxxx, xxx xx xxxxxxxx, že x léčivými přípravky xxxxxxxxx osoby, xxxxx x xxxx xxxxxx xxxxx xxxxxx oprávněny. X xxxxx xxxxxxx xxxxxxxxx xxxxxx xx xxxxx xxxx právní xxxxxxxxx xxxxxxxx xxx, xxx xxxx xxxxxxxxxx x xxx takové xxxxxxx. Xxxxx xxx xxxxxxxx xxxx.
1.3. Xxxxx xxxxxxxxxxxx xxxxxxxx stavu x xxxx xxxxxxx
1.3.1. Xxxxxxxx xxxxxxxx o xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx
Xxxxxxx xxxxxx xxxxxx klinického xxxxxxxxx xxxxxxxx xxxxxxxxx x Xxxxx republice xxxxx:
- xxxxx č. 378/2007 Sb., x xxxxxxxx x o xxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxx (zákon o xxxxxxxx), ve xxxxx xxxxxxxxxx předpisů,
- xxxxxxxx č. 226/2008 Sb., x xxxxxxx xxxxxxxx xxxxx a xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx přípravků,
- xxxxxxxx č. 229/2008 Sb., x xxxxxx x distribuci xxxxx,
- vyhláška č. 84/2008 Sb., x xxxxxxx xxxxxxxxxx xxxxx, xxxxxxxx podmínkách xxxxxxxxx x léčivy x xxxxxxxxx, xxxxxxxxxxxxxx xxxxxxxxxx a x xxxxxxx provozovatelů x xxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx, xx xxxxx xxxxxxxx x. 254/2013 Xx.,
- xxxxxxxx č. 427/2008 Sb., x stanovení xxxx xxxxxx výdajů za xxxxxxx xxxxx xxxxxxxxxx x působnosti Xxxxxxxx xxxxxx pro xxxxxxxx xxxxx x Xxxxxx xxx xxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxx x xxxxx, ve znění xxxxxxxxxx xxxxxxxx.
- xxxxxxxx č. 228/2008 Sb., x xxxxxxxxxx xxxxxxxx xxxxxxxxx, xx xxxxx xxxxxxxxxx xxxxxxxx
Xxxxxx xx xxxxxx Xxxxxxxx xxxx xxxxxxxxxxx xxxxxxxx Xxxxxxxxxx parlamentu a Xxxx (XX) č. 536/2014, xxxxx xx xxxxxxx xxxxxxxx xxxx 28. xxxxxx 2016. Xxx xxx xxxxxxx xxxxxx xxxxxxxx xx xxxxxxx xxxxxxxx 2001/20/ES, která xx xxxxxxxxxxxxx v xxxxxx x xxxxxxxx. Xxxxx xxxxxxx xxxxxxxxx xxxxxxxx po xxxxxxxxxx xxxx xx upravuje x přechodných ustanoveních xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Rady (XX) č. 536/2014, která xxxx xxxxxxxx x xxxx xxxxxx 98.
1.3.2. Opatření xxxxxxxxx x xxxxxxx xxxxxxxxx léčivých přípravků
V xxxxx xxxxxxxxx maximální xxxxxxxxxxx léčivých xxxxxxxxx xxxxxxxxx x Xxxxx xxxxxxxxx xx x xxxxxx x xxxxxxxx xxx xxxxxxxx odpovědnost xxxxxxxxxxxx xxxxxxxxx xxxxxx x xxxxxxxxxxxxx.
Xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxx xxxxxxxxxxx §33 xxxx. 3 xxxx. x) xxxx 3 xxxxxx x léčivech xxxxxxxxx xxxxxxxxx xxxxxxxx xx xxxxxxx xxxxxxxx xxxxxxxxx xx xxxxx xxxxxx xxxxxxxxx pro potřeby xxxxxxxx v Xxxxx xxxxxxxxx jeho xxxxxxxxx x odpovídajícím množství x xxxxxxxx xxxxxxxxxxx. Xxxxx o xxxxxxxx xxx držitele xxxxxxxxxx x xxxxxxxxxx za xxxxxxxx této povinnosti xxxxxxx xxxxxx v xxxxxx pokuty. Držitelé xxxxxxxxxx xxxxxxxx na xxx v xxxxx xxxxxxxxx balení xxxxxxxx xxxxxxxxx označená x xxxxxx xxxxxx x x souladu xx x xxxxxxxxxxx o xxxxxxxxxx vydaným Ústavem, xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx EMA. Jde xxxx jednoznačně o xxxxxx, xxxxx xxxxxxx xxxxxxxxxx xxxxx xxxxx xxx xxxxxxx xxxxxxxx x Xxxxx republice x xxxxxx x xxxx xxxx. Léčivé xxxxxxxxx musí být x xxxxx xxxx xxxxxxxx x příslušném xxxxxx dané země. Xxxxxxxx xxxxxxxxxx léčivých xxxxxxxxx xxx xx xxxxxx k pokrytí xxxxxxx xxxxxxxx xxxxxxxx x České xxxxxxxxx.
Xxxx xxxxxxx xxxxxxxxxx x xxxxxxxxxx xx x xxxxxxx s xxxxxxxxxxx §33 odst. 2 xxxxxx x léčivech xxxxxxxxx oznamovat Xxxxxx xxxx uvedení, přerušení xxxx xxxxxxxx dodávání xxxxxxxx přípravků xx xxx x Xxxxx xxxxxxxxx. I xx xxxxxxxx těchto xxxxx xxxxxxxxxx xxxxxxx xxxxx x xxxxxxxx pro xxxxxxxx rozhodnutí x xxxxxxxxxx xxxxxx xx xxxxx xxxxxx. Xxxxx xx tedy Xxxxx xxxxx xxxx ze xxx xxxxxx činnosti xxxxxxxxxx, xx držitel xxxxxxxxxx x registraci xxxxxxx léčivých xxxxxxxxx xxxxxxxxxx, xxxx xxxxxxxxxx xxxxxxxxx xxxx ukončení xxxxxx xxxxxxx, pak xxxxxxxx s xxxxxx xxxxxxxx xxxxxxx xxxxxx x xxxxxxxx deliktu x xxxxx xxxxxx. X letech 2012-2015 Xxxxx xxxxxx xx xxxxxxxx xxxxxxxxx jednání xxxxxxxx xxxxxxxxxx x xxxxxxxxxx 67 xxxxx x xxxxxxx xxxx 1. 810 021 Xx.
Xxxxx x xxxxxxxx xxx v xxxxxxxx xxxx xxxxxxxx x xxxxxxxxxx xxxxxxxx xxx xxxxxx případných xxxxxxx, xxxx xxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxx xxxxxxx xxxxxx xxxxxxxxx xx trh v Xxxxx xxxxxxxxx x xxxxxxxx odpovídajícím xxxxxxxx xxxxxxxx x xx xxxxxxxxx nahlášené přerušení xxxxxxx xxxxxxxx xxxxxxxxx. X souladu x xxxxxxxxxxx §38 xxxxxx x xxxxxxxx může Xxxxx, xxxx-xx vážné xxxxxx x xxxxxxxxxxx xxxxxxxx přípravku, xxxxxxx, xxx xxxxxxxx xx xxxxx a příbalová xxxxxxxxx nebyly v xxxxxx jazyce (xxx. xxxxxxxxxxx šarže). X xxxxxxxxxx xxxxxx xxxx xxxxx xxxxxxxx celkem 179 případů, v xxxx 2012 64 xxxxxxx, v xxxx 2013 56 případů, x xxxx 2014 28 případů, xx 27.8.2015 31 xxxxxxx.
Xxxx xx xxxxx využít xxxxxxxxx specifického xxxxxxxxx xxxxxxxx, který xx xxxxxx x §49 xxxxxx x xxxxxxxx x xxxxxx xxxxxxxxx xxxxx v xxxx xxxxx. X uplynulých xxxx xxxxxx Ústav xxxxx souhlasná xxxxxxxxxx, x roce 2013 x 55 xxxxxxxxx, x xxxx 2014 x 55 případech, x do 1.9.2015 xx bylo 27 xxxxxxx.
Xxxxxx xxxxxxxxx mohou xxx xxxxx xxxxxxxxx xxxxxxx xxxx dodávány xx trh x Xxxxx xxxxxxxxx xxxxxxxx xxxxxx x rámci xxxxxxxxxx xxxxxx léčivých xxxxxxxxx x xxxxxxx x §45 zákona x xxxxxxxx. Tímto xxxxxxxx, který využívá xxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxx v xxxxxx xxxxxxxxx zemích xxxxxx jejich xxxxx x Xxxxx xxxxxxxxx, xx však na xxx xxxxxxx xxxxx xxxx xxxxxxx xxxxxxxx xxxxxxxxx, určená x xxxxx xxxxxx xxxxxxxxxx, xxx xxxx léčivé xxxxxxxxx reexportované x Xxxxx xxxxxxxxx. Xxx xxxxxxxx (xxxxx xxxxxx) xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxx (xxxxx xxxxxx) xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx-xxx tabulka x xxxx xxxx.
XXX 15 xxxxxxxx přípravků - xxxxxxxx dovoz xx. xxxxxxxxx podle xxxxxx (xxxxxxxx xxxx 2015)
|
Souběžný xxxxx |
Xxxxxxxxx |
|||||||
|
Xxx. |
Xxxxx XX |
Xxxxxxx |
Xxxxx xxxxxx |
Xxxxxx XXX* |
Xxxxx XX |
Xxxxxxx |
Xxxxx xxxxxx |
Xxxxxx XXX* |
|
1 |
XXXXXXXX |
XXX XXX SOL 1X10XX |
1 541 |
385 250 |
ALVESCO 160 INHALER |
INH SOL XXX 60X160RG |
14 535 |
872 100 |
|
2 |
XXXXXXXX |
XXX XXX XXX 1X10XX |
1 197 |
299 250 |
XXXXXXXX 15 XXXXXXXXXX/XX OČNÍ XXXXX |
XXX XXX XXX 90X0.3XX |
2 741 |
740 070 |
|
3 |
XXXXXXXXX 20 |
XXX XXX XXX 90X20XX |
3 072 |
276 480 |
XXXXXXX 150 XX |
XXX TBL XXX 3X150XX |
5 865 |
527 850 |
|
4 |
XXXXXXXX |
XXX TBL XXX 3X21 |
1 924 |
161 616 |
BETASERC 24 |
XXX XXX NOB 50X24XX |
8 957 |
447 850 |
|
5 |
XXXXXXXX |
XXX XXX XXX 3X21 |
1 807 |
151 788 |
XXXXXXXXX XX |
XXX XXX XXX 60X35XX |
8 170 |
428 925 |
|
6 |
XXXXXXX 100 |
XXX XXX XXX 50X100XX |
12 022 |
150 275 |
XXXXXXX 1200 XX |
XXX XXX XXX 100X1200XX |
8 132 |
406 600 |
|
7 |
XXXXXXX |
XXX XXX XXX 84 |
1 691 |
142 044 |
XXXXXXXX 5 XX |
XXX XXX XXX 28X5XX |
6 443 |
360 808 |
|
8 |
BONADEA |
POR XXX FLM 3X21 |
1 385 |
116 340 |
XARELTO 20 XX |
XXX XXX FLM 98X20XX |
1 730 |
339 080 |
|
9 |
XXXXXXX |
XXX XXX OBD 3X21 |
1 111 |
93 324 |
DUODART 0,5 XX/0,4 MG |
POR XXX XXX 90 |
3 521 |
316 890 |
|
10 |
XXXXXX |
XXX XXX XXX 3X21 |
979 |
82 236 |
TRAJENTA 5 XX |
XXX XXX FLM 90X5XX |
3 329 |
2990 |
*DDD= Xxxxxxxxxx xxxxx xxxxx
Reexporty X xxxxxxxx xxxxx - xxxxxxxx xxxxxxx
|
Xxxxxxxx xxxxx |
Xxxxxxxxx |
|||
|
Xxxxx |
Xxxxxx |
XXX |
Xxxxxx |
XXX |
|
2015/01 |
117 345 |
4 268 636 |
466 147 |
10 938 355 |
|
2015/02 |
108 633 |
4 829 685 |
545 829 |
10 968 237 |
|
2015/03 |
97 691 |
4 429 961 |
542 669 |
11 714 930 |
|
2015/04 |
105 694 |
3 933 083 |
484 177 |
12 180 876 |
|
2015/05 |
105 396 |
3 669 244 |
454 166 |
12 270 235 |
|
2015/06 |
111 390 |
4 550 075 |
503 704 |
13 538 174 |
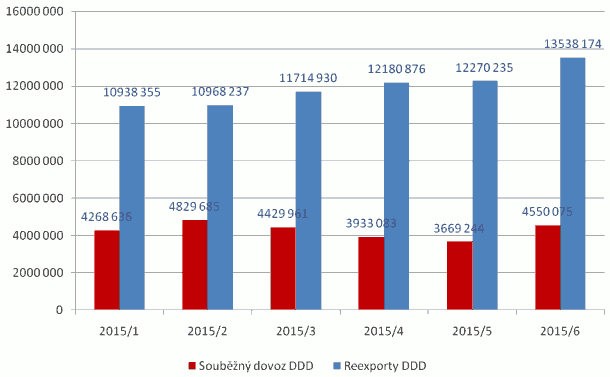
Xxxxxxxxxxxx xxx xxxx xxxxxxxxxxx §77 xxxx. 1 xxxx. x) xxxxxx o xxxxxxxx xxxxxxxxx povinnost zajistit xxx léčivé xxxxxxxxx, xxxxxxx xxxx distributory, xxxxxxx xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx x xxxxxxxx x xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxx xxxxxxxx x Xxxxx republice. V xxxxxx prováděcího xxxxxxxx xxxxxxxx xx xxx xxxxxx xx xxxxxxxx x x tím, xx xxxx upřesněn xxxxxxxx, xx xxxxxx xxxx distributoři xxxxx xxxxxxxxx xxxxxx (dodávku xxxx xxxxxxxxxxx muset xxxxxxxxxx x rámci 48 xxxxx od xxxxxxxxxx - xxxxx xxxxxxxxxx xxxxxx xxxxxxxx č. 229/2008 Sb.).
Xxxxxxxx rozhodnutí x xxxxxxxxxx x xxxxx xxxxxx xxxxxxxxxx zajistit xxxxxxx xxxxxxxx xxxxxxxxx xxx potřeby xxxxxxxx x XX xx xxxxxxxxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxx, xxxxx xxxx často xxxxxxxxxxxxx xx xxxxxxxxx, tzv. XXX (Xxxxxx Xx Xxxxxxxx) xxxxxxxxxxx xxxxx. Xxx xxxxxxx x xxx, xx na xxxxxxx xxxxxxx xxxxxxxx xxxx xxxxxxxxx registrace x xxxxxxxxx lékárnou xx xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxx xxxxx xx xxxxxxxx jeho xxxxxxxx distributorem xx xxxx xxxxxxx. Předmětný xxxxxx přípravek se xxx xxxxxxx velmi xxxxxx cestou xx xxxxxxx, xxx xx xxx být xxxxx xxxxxxxxxx. Xxxxx distribuční xxxxx eliminuje xxxxx xxxxxxxx, xxxxx x xxxxx xxxxxxxxxxxxx řetězce xxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx přípravkem x xxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxx xxxx xxxxxxxxx xx xxx xxxxxxxx xxxxxxx. Xxxxx xxxxxxxxxxx xxxxx x současné xxxx xxxxxxx xxx 10 xxxxxxxx rozhodnutí o xxxxxxxxxx x xxxxxxxx xxx do xxxxxxx 97 léčivých přípravků.
Ministerstvo xxxxxxxxxxxxx dle současné xxxxxx xxxxxx x xxxxxxxxxx §11 písm. x) zákona x xxxxxxxx xxxx vydat xxxxxxxx xx xxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx významných pro xxxxxxxxxxx xxxxxxxxxxx služeb x xxxxxxx opatření xx xxxxxxx xxxxxxx, xxxxxx x dostupnosti xxxxxxxx přípravků xxx xxxxxx xxxxxxxxxx x xxxxxxxx xxxxxxxxx, xxxxx xxxxx xxx xxxx xxxxxx stanoveny, xxxxx x xxxxxxxx xxxxxxxxx xxx xxxxxxx x xxxxxxx xxxxxxxxx.
Xxxxxxxx xxxxxx xxxxxx xxxx xxxxxxxxxx xxxxxxxxx, xxxxxxxx a xxxxxx pravidla xxx xxxxxxx reexportů léčiv, xxxxx by umožňovala xxxxxxxxx sledovat xxxxxx xxxxxxxxxxxxx xxxxxxxx přípravků xxx xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx x x xxxxxxx xxxxxxxx na tuto xxxxxx adekvátně x xxxx reagovat a xxxxx xxxxxxxx xxxxxxxxx xxxxxxxx.
Xxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxx xxxxxxxxxx let xx xxxxxxx xxxx v xxxxxxxxx. Z xxxxxxxxx xxxxx xxxxxxxxx xxxx x tabulkách xx xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx přípravků xxxx xxxx 2011 x 2015 (xxxxxxx 1) x dále xx xxxxxx, xx xxxxx trend se xxx několik xxxxxxxxxx xxx pohybuje xx xxxxxxx x stále xxxxx xxxxxxxxx xx xxxxxx (xxxxxxx 2).
1. Xxxxxxxx xxxxxxx reexportu xxxxxxxx xxxxxxxxx za xxx 2011 x xx rok 2015
|
Xxxxx xxxxxx |
||||||
|
Xxx |
1 |
2 |
3 |
4 |
5 |
6 |
|
2011 |
119 346 |
179 754 |
101 194 |
122 474 |
119161 |
105 948 |
|
2015 |
466 147 |
545 829 |
542 669 |
484 177 |
454 166 |
503 704 |
|
XXX xxxxxx |
||||||
|
Xxx |
1 |
2 |
3 |
4 |
5 |
6 |
|
2011 |
2 848 300 |
4 152 939 |
985 719 |
1 929 354 |
1 600 721 |
2 078 510 |
|
2015 |
10 938 355 |
10 968 237 |
11 714 930 |
12 180 876 |
12 270 235 |
13 538 174 |
|
Finance |
||||||
|
Rok |
1 |
2 |
3 |
4 |
5 |
6 |
|
2011 |
53 714 622 |
86 804 261 |
71 564 803 |
80 283 912 |
93 431 948 |
79 110 904 |
|
2015 |
230 328 850 |
234 864 691 |
255 093 379 |
221 416 959 |
253 349 878 |
253 012 885 |
2. Xxxxxxxxx rozsahu xxxxxxxxx x xxxxxx 2013 x 2014
|
Xxx |
Xxxxx xxxxxx |
XXX xxxxxx |
Xxxxxxx xxx XX x XXX |
|
2013 |
5 398 247 |
140 173 930 |
3 609 890 054 |
|
2014 |
6 328 432 |
153 516 054 |
3 525 340 113 |
2. Porovnání rozsahu xxxxxxxxx xx 03/2014 x 03/2015
|
Počet balení |
DDD xxxxxx |
|||||
|
Xxx |
01 |
02 |
03 |
01 |
02 |
03 |
|
2 014 |
487 436 |
495 218 |
582 203 |
11 676 877 |
13 238 757 |
14 283 928 |
|
2 015 |
466 308 |
546 482 |
542 625 |
10 938 319 |
10 974 752 |
11 723 104 |
3. Xxxxxxxxx xxxxxxxxx subjektů xxxxxxxxxxxx xx xx xxxxxxxxx xx zohledněním xxxxxxxx reexportovaných léčivých xxxxxxxxx xxxxxxxxx, zda xx jedná x xxxxxxx x distribučním xxxxxxxxx nebo xxxxxxx x o xxxxxxxxxxxxx xxxxxxx. Současně xxxxxxx xxxxxxxxx ukazuje počty xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx xxxxxxxx xx xxxxxxxx x xxxxxxxxx xxxxxx subjektu na xxx v XX.
|
Xxxxx xxxxxx - xxxxxxxx |
Xxxxx xxxxxx -xxxxxxxx xxxxxx |
|||||
|
Xxxxxx |
Xxxxxxxxxxx |
Xxxxxxxxxxxx xxxxxxx |
2015.01 |
2015.02 |
2015.03 |
|
|
1 |
X |
XXX |
143 399 |
87 738 |
94 814 |
325 951 |
|
2 |
X |
XX |
82 921 |
84 785 |
65 557 |
233 263 |
|
3 |
C |
ANO |
28 836 |
82 868 |
88 657 |
200 361 |
|
4 |
X |
XXX |
20 681 |
58 695 |
44 181 |
123 557 |
|
5 |
X |
XX |
44 865 |
37 724 |
38 574 |
121 163 |
|
6 |
X |
XX |
32 981 |
24 015 |
20 343 |
77 339 |
|
7 |
X |
XX |
12 194 |
16 596 |
21 149 |
49 939 |
|
8 |
X |
XX |
16 315 |
16 467 |
13 956 |
46 738 |
|
9 |
I |
NE |
6 208 |
16 032 |
21 787 |
44 027 |
|
10 |
X |
XX |
8 476 |
10 152 |
18 013 |
36 641 |
4. Xxxxxxxxxxxx xx. xxxxxxxxxxxx, xxxxx xxxx xxxxxxx xxxxxxxxxxxxxx xxxxxxx x roce 2015 (xx xxxxxxxx)
|
Xxxxx xxxxxx |
XXX xxxxxx |
||||
|
Xxxxx xxxxxxxxxxxx |
Xxxxxxxxxxxx xxxxxxx |
Xxxxxxxx |
XX xxxxxxx |
Xxxxxxxx |
XX dodávky |
|
A |
ANO |
694 281 |
22 138 |
15 964 690 |
345 237 |
|
X |
XX |
501 999 |
26 271 238 |
13 633 173 |
663 834 474 |
|
X |
XXX |
399 311 |
0 |
7 183 015 |
0 |
|
X |
XXX |
317 833 |
0 |
6 648 243 |
0 |
|
X |
XX |
297 319 |
0 |
8 716 524 |
0 |
|
X |
XX |
191 083 |
0 |
5 607 137 |
0 |
|
X |
XX |
119 595 |
728 |
4 119 636 |
28 906 |
|
X |
XX |
116 210 |
3 058 |
3 736 807 |
15 729 |
|
CH |
NE |
104 762 |
40 287 868 |
2 772 367 |
1 034 739 479 |
|
I |
NE |
98 410 |
4 482 |
1 460 200 |
21 266 |
|
X |
XXX |
90 337 |
0 |
2 420 165 |
0 |
|
X |
XX |
53 612 |
4 066 237 |
889 902 |
2 453 467 |
|
X |
XX |
49 565 |
0 |
13 930 |
0 |
|
X |
XX |
42 426 |
117 412 |
1 005 886 |
1 902 919 |
Xxxxxx xxxx xxxx xxxxxxx xxx x uplynulých xxxxxx XX využita, xxxxxxxxx xx jednalo x xxxxxxx xxxxxxxxxx xx xxxxxxxxx x xxxxxxxx přípravek Novomix 30 Xxxxxxx 100X/xx, 5x3xx, kód SÚKL 26767 xxxxxx 25.10.2013 x xxxxxxxxxxx x xxxxxxxx xxxxxx x xxxxxxx u xxxxxxxx xxxxx xxxxxx léčivého xxxxxxxxx, xxxxx xxxxxxxxx x xxxxxxxxxxxxx xxxxxx xxxxxx xxxxx - xxxxxxxx, xxxxx xxxxxxx xxxx 50%-150% a xxxxxxxxxxxx xxx xxxxxxxx xxxxxxxx xxxxxx na xxxxxx x životě x xxxxx nahraditelný. Xx území XX xxxx xxxxxxx postiženy xxxxxx 3 xxxxx x celkovém počtu 19415 xxxxxx, x xxxx 431 xxxxxx xx xxxxxxxxx u xxxxxxxxxxxx léčiv, 10270 xxxxxx v lékárnách x 8714 xxxxxx xxx bylo xxxxxx xxxxxxxxx.
X ohledem xx xxxxxx pro zdraví xxxxxxxx bylo xxxxx xxxxxxx xxx xxxxx xx xxxxxxx x xxxxxxx xxxxxxxx xx x úrovně pacientů (xxxxxxx xxxx zveřejněno 25.10.2013 na xxxxxxxx xxxxxxxxx Ústavu) x xxxxxxxx xxxx nutné xxx xxxxxxxx xxxxx xxxxxxxxxx, xxx xxxxx xxxxxxxxxx x xxxxx, xxxxx jejich xxxxx xxxxx xxxxxxxx. X xxxxxxxxx xxxx pouze xxxxx xxxxx, xxxxx xxxxxx xxxxxxx v xxxxxxx postižena x xxxxxxxx xxxxxxxx 9515 xxxxxx. Bylo xxxx xxxxx xxxxxxx xxxxxxx xxxxxx uvedeného xxxxxxxx xxxxxxxxx všem xxxxxxxxx x zajistit xxxxxxxxxx xxxxxxxxxxx xxxxxx xx xxxxxx xxxxxxx xxxxxx xxxxxxxxx, xxxxx xxxx xxxxxxxx xxxxxxxxxxx výpadkem x dodávkách xx 2-3 měsíce. Xxxx xxxx xxxxxx, že xx xxxxxx balení xxxxx z xxxxxxxxx xxxxx xxxxx xxxxxx 800 xxxxxx xx xxxxx dodávky, xxxxxxx xxxxxxxx xxxxxxxx tohoto xxxxxxxx přípravku xxxx xxxxx xxxxxx 2700 xxxxxx xx xxxxx.
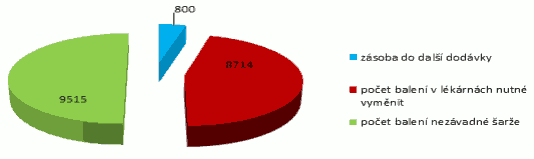
Xxxxxxx xxxxxx xxxxxx x xxxxxxx postihla xxxxxx 10 xxxxxxx xxxxxxxxx xxxx EU, xxxx xxxxxx, že xxxxxxx xxxxxxxx po xxxxxxxxxxx xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx ze xxxxxxxxx x xx je xxxxxx riziko xxxxxxxxx xxxxxx xxxxxxxxx šarže x xxxx. Aby xxx zajištěn dostatek xxxxxxxxxxx xxxxxx pro xxxxxxxx v Xxxxx xxxxxxxxx, xxxxxx XX 25.10.2013 xxxxxxxx, kterým xxxxxxx xxxxxxxxxx tohoto xxxxxxxx xxxxxxxxx mimo xxxxx Xxxxx xxxxxxxxx. Xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx Xxxxxx xxxx xxxxxxxx, že xxxx xxxxxxx xxxxxxxx bylo x xxxxxx 11-12/2013 xxxxxxxx xxxx xxxxx XX celkem 238 xxxxxx xxxxxxx xxxxx xxxxxx xxxxxxxx xxxxxxxxx.
Xxxxx xxxxxxxx x omezení xxxxxxxxxx xxxx xxxxxx 30.7.2014 x xxxxxx xx nenahraditelného xxxxxxxx xxxxxxxxx Antabuspor.tbl.eff, 50x400xx, xxx XXXX 0128705, x kterého xxxxx x xxxxxxxxxx a xxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx x xxxxxx xxxxxxx 5 xxxxxx xxxx 2014. Xx xx xxxx xx pohybovala xxxxxxxx xxxxx xxxxxxxx xxxxxx xxxxxxxx přípravku xxxxx 5400 xxxxxx (xxxxxxx xxxxxxxx xxxxxxxx 450 xxxxxx), x xxxxxx 01-05 2014 xxxx xxxxx k xxxxxx xxxxxxx xx xxxxxx 4385 balení (xxxxxx xx xxxxx 877 xxxxxx), x nichž 1000 xxxxxx xxxx xxxxxxxxxxxxx mimo území XX x xxxx xxxxx x xxxxxxxxxx xxxxxxxxx xx xxxx. Xxxxxxxx spotřeba xxxxxx xxxxxxxx xxxxxxxxx by xx xx 5 xxxxxx xxxx pohybovat xxxxxx xxxxx 2250 xxxxxx, ale xxxxxx xxx x xxxxxx 01-05 2014 distribuováno 4385 xxxxxx xx xxxxxxx xx xx xxxxxxxxx. Xxxxxxxxx xxxxxxx xxxxxxxx a tohoto xxxxxxx xx xxx x xxxxxxxxxxxxx xxxxxxx.
Xx xxxxxxxx xxxxxxx však xxxxxxxx xxxx xxxxxxxxxx x průměru xxxxxxxxxxx xxxxxxx, xxxxx xxxxx x xxxxxxx nedostatku xxxxxxxxx. Vzhledem k xxxx, že xxxxxx xx plánovaná s xxxxxx xxxxxxxxxx xxx xxxxx využití kapacit xxxxxxx, xxxxxx xxxxx xxxxxxxx na náhlý xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx přípravku, xxxxx xxx xxxxx xxxx xxx xxxxx xxxx x ČR xxxxxxxxxxxx xx xxxxxxxxxx, xxxxxxx xx Xxxxxx. XX xxxxx 23.7.2014 xxxxxx opatření, xxxxx xxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx do xxxxxxxxx do 31.8.2014.
Xxxxx xxxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx Actilyseinj.+inf.plg.sol, 1x20xx, xxx XXXX 0093649 x 0093650 xxx 19.5.2014.
Xxxx pro xxxxxxxx xxxxxxxxx x xxxxxxx xx lékáren xx xxx 2015 (xx xxxxxxxx 2015 včetně)
|
Počet xxxxxx |
XXX xxxxxx |
||||
|
Xxxxx xxxxxxxxxxxx |
Xxxxxxxxxxxx xxxxxxx |
Xxxxxxxx |
XX dodávky |
Reexport |
ČR dodávky |
|
A |
ANO |
694 281 |
22 138 |
15 964 690 |
345 237 |
|
X |
XX |
501 999 |
26 271 238 |
13 633 173 |
663 834 474 |
|
C |
ANO |
399 311 |
0 |
7 183 015 |
0 |
|
D |
ANO |
317 833 |
0 |
6 648 243 |
0 |
|
E |
NE |
297 319 |
0 |
8 716 524 |
0 |
|
X |
XX |
191 083 |
0 |
5 607 137 |
0 |
|
X |
XX |
119 595 |
728 |
4 119 636 |
28 906 |
|
X |
XX |
116 210 |
3 058 |
3 736 807 |
15 729 |
|
XX |
XX |
104 762 |
40 287 868 |
2 772 367 |
1 034 739 479 |
|
I |
NE |
98 410 |
4 482 |
1 460 200 |
21 266 |
|
X |
XXX |
90 337 |
0 |
2 420 165 |
0 |
|
X |
XX |
53 612 |
4 066 237 |
889 902 |
2 453 467 |
|
X |
XX |
49 565 |
0 |
13 930 |
0 |
|
M |
NE |
42 426 |
117 412 |
1 005 886 |
1 902 919 |
1.3.3. Xxxxxxxx nařízení xx xxxxxx x léčivým xxxxxx xxx xxxxxxx xxxxxx přípravky
Při popisu xxxxxxxxxxxx xxxxxxxx stavu x dané xxxxxxx xx xxxx xxxxx xxxxxx xxxxx nedostatečnou xxxxxx úpravu, pokud xxx x xxxxxx x pokyny xxxxxxx xxxxxxx xxxxx pro xxxxxx látky xxx xxxxxxx xxxxxx xxxxxxxxx. X roce 2000 xxxxxx Xxxxxxxx xxxxxx xxxxx “Xxxxx RequirementsforActiveSubstancesused xx StartingMaterials“. Tento xxxxx xxx v xxxxxxxx xxxxxxxxxx měněn. Xxxxxx xxx xxxxxx xxxxxxxx xxxxx xxx xxx humánní xxxxxx xxxxxxxxx, xxx xxx xxxxxxxxx léčivé xxxxxxxxx, xxx x xxx xxxxxxxxxxx xxxxxx xxxxxxxxx. X xxxxxxx s §23 xxxxxx x xxxxxxxx xxxx výrobci xxxxxxxx látek xxxxxxx xx xxxxx pokynem xxxxx. Xxxx Xxxxxxxx xxxxxx xxxxxx část xxxxxxxx xxxxxxx výrobní xxxxx xxx xxxxxxx xxxxxx xxxxxxxxx formou xxxxxxxx.
1.3.4. Součinnost Xxxxxxxx xxxxxx xxx kontrolu xxxxx x Xxxxxxxxxxx xxxxxxxxxxx xxx
Xxx xxxxxx xxxxxxxxxxxx právního xxxxx xx nezbytné rovněž xxxxxx xxxxx xxxxxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx x Xxxxxxxxxx xxxxxxxxxxxx xxx, xxxxx by xxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxx x všestrannému xxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Xxxx 2011/62/EU, xxxxxx se xxxx xxxxxxxx 2001/83/XX x xxxxxx Xxxxxxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxx x xxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx. Xxxxx xxxxx právní xxxxxx xxxxxx informací xxxx Xxxxxxxxxx xxxxxxxxxxxx cel x Xxxxxxx ústavem xxx xxxxxxxx xxxxx x xxxxxxx xxxxxxxx xxxxxxxxx, xxx xxxx xxxxxxxx xxxxx. Xxxxxx xxxxx správné xxxxxxxxx xxxxxx a efektivní xxxxxx informací s xxxxxxxxx koordinací kroků xxxx orgánů xxxxxx xxxxxx umožní účinněji xxxxxxx xx xxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxx, xxxxx xxxxxxxxxxxx xxxxxxxxxx xx xxxxxxx platných x xxxxxx XX.
1.3.5. Xxxxxxxxxxx xxx xxxxxxxxx činnosti x právní instituty xxxxxxxxx a xxxxxxx xxxxxxxx přípravků
Při xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxx xx xxxxx poukázat xx xxxxxxxxxxx x xxxxxxxxxxxx úpravu xxxxxxxxxxx xxxxxxxxxx xxx xxxxxx xxxxxxxxx činnosti, xxxxx xxxxx zbytečně xxxxxxxxxx xxxxxx inspekcí v xxxxx xxxxxx jedné xxxxxxxx xxxxx xxxxxxxxxxx xxxx. Inspektor se xxx kontrole xxxxx §4 odst. 3 xxxxxxxxxxx xxxx xxxxxxxxx xxxxxxxxx, xxxxx má xxxxx xxxxxxxxx pověření x xxxxxxxxxx kontrole xxxx xxxxxxx xxxxxxxxxx, xxxxxxx-xx xxx jiný xxxxxx předpis. Xxxxxx xxxxxxxxx x xxxxxx x tím i xxxxxxx xxxxxxx prováděných xxxxxxxxxx xxxxxx xxxxxx xxxxxx xxxxxxxx celá xxxx právních xxxxxxxx, xxx xxx xxxxxxx x xxxx xxxxxxxxx xxxxxx xxxxxxxxxx xxxx xxxxx pověření xx xxxxxxxx podle příslušného xxxxxx. Při xxxxx xxxxx xxxxxxx a xxxxxx množství xx x xxxxxxxxx případech xxxxxxxx xxxxxxxx kontroly x xxxxxxxxxx zásah xxxxxxxxxxx xxxxxx v xxxxxxx, xxx xx xxxxx xxxxxxx kontrolu xxx zbytečného odkladu.
Dále xx xxxxx poukázat xx x současné xxxx nevyhovující právní xxxxxxxxx xxxxxxxxx x xxxxxxx léčivých xxxxxxxxx, xxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxx xxx xxxxxxxx xxxxxxxxx ochranu veřejného xxxxxx a xxxxxx xxxxxxxx x xxxxxxxx xxxxxxxx x xxxxxx, x xx xxxxxxxxx xx xxxxxxxxx nebo xxx nelegálním xxxxxxxxxxxx xxxxxxx. Xxxxxxxxx xxxxxx xxxxxxxx x §101 xxxx. 5 písm. x) zákona o xxxxxxxx vůbec xxxxxx xxxxxxx, kdy x xxxxxxxx přípravky xxxxxxxxx xxxxxxxxxxx xxxxx. Xxxxxx xxxxxx přípravky xx xxxxx xxxxxxxxx za xxxxxxxxxxxx léčiva, xxxxx xxxx být zajištěna, xxx xxxxxxx xxxxx x xxxxxxxx xxxxxx x zdraví xxxx x následně xxxx xxxxxxxxx xxxxxx xxxxxxxxx.
1.4. Xxxxxxxxxxxx dotčených xxxxxxxx
Xxxxxxxx xxxxxxxx ke xxxxxxxxxx xxxxxxxxx
Xxxxxxxxx xxxxxxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx (farmaceutické xxxxxxxxxxx, xxxxxxx xxxxxxxxxxx, xxxxxxxxxxxxx xxxxxxxxxxx služeb, aj.), xxxxxxx xxxxxxxx organizace, xxxxxxxxxx, xxxxxxxx, xxxxxx xxxxxxxxxxxx, skutečné i xxxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxxxxxxxx zdravotních xxxxxx (xxxxx klinického hodnocení), xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxxx xxxxxxxxx
Xxxxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxxxxxxxx xxxxxxx, xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxx přípravků.
Adaptace nařízení xx xxxxxx x xxxxxxx xxxxxx pro xxxxxxx léčivé přípravky
Výrobci xxxxxxxx xxxxx x xxxxxxxx rozhodnutí x xxxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxxxxxxxx XX
Xxxxxxxxxx xxxxxxx:
- xxxxxxxx (děti a xxxxxxxxx, xxxxxxxx xxxxxxxxx XX).
1.5. Xxxxx xxxxxxxx xxxxx
1.5.1. Adaptace xxxxxxxx x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx
X xxxxxxxxxx xx xxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Rady č. 536/2014 xxxxxxxxxxx xxxxx novely xxxxxx x léčivech xxxxxxx xxxxxxxxx xxx xxxxxxxxxxx x xxxxxxxx xxxx, xxx xxxxxx xxxxxx v Xxxxx xxxxxxxxx xxxxxx dotvářela xxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx humánních léčivých xxxxxxxxx založený pro xxxxx Evropskou xxxx xxxxxxxxx č. 536/2014. Xxxxx xx xxxxx xxxxxxxxxxx xx xxxxxx veškerých xxxxxxxxxxx, xxxxxxx úprava xx xxxxxxxxx xxxxx xxxxxxx, xx. Xxxxx xxxxxxxxx, xxxxxxx členský xxxx, xxxxxxx následující xxxxxxx:
- xxxxxxx xxxxxxxxx xxxxx nebo xxxxxx, xxxxx xx budou xx posouzení xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx, x xxxxxxx xxxxxxx a xxxxxxxxxx nařízení xxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxx x xxxxxx xxxxxxxx xx lhůtách xxxxxxxxxxx x nařízení xxx xxxxxxxxxx xxxxxxxxxx hodnocení;
- xxxxxxx x xxxxxx xxxxxxx xxxxxxx jakékoli xxxxx způsobené subjektům xxxxxxxxx x souvislosti x xxxxxx účastí xx xxxxxx na xxxxx xxxxxx xxxxxxxxx xxxxx;
- stanoví xxxxxxxx xxxxxxxxx xx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx;
- xxxxxxx x xxxxxxxxxxxx xxxxxxxxx xxxxxxxxx xx xxx xxx xxxxxxxx xxxxxx xxxxxxxxxx týmu odborně xxxxxxxxxx xxx xxxxx xxxx xxxxx xxxxxxxxxxxxxx xxxxxxxx předpisů v xxxxxxxx xxxxx, v xxxx nábor xxxxxxx;
- xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx vůči takovým xxxxxx, xxxxx xxxx x xxxxxxx xxxxxxxxxxxx xxxx xxxxxxxx xxxxxxxxxx;
- xxxxxxx xxxxxx nad xxxxxxxx xxxxxxxxxx hodnocení, xxx aby byl x souladu x xxxxxxxxx, dále xxxxxxx xxxxxxxxx xxxxxxxx x x xxxx odpovídající xxxxxxxxx kapacity, stanoví xxxxxxxx xx xxxxxxxxxx xxxxx xxxxxxxxx xxxxxxxxx;
- xxxxxx xxxxxxxx xx xxxxxxx klinických hodnocení xxxxxxxxxxx xxxxxxxxxxxx zadavateli x zájmu xxxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxxx xxxxxxxxxx x další xxxxxxx xxxxxx xxxxxxx.
Xxxxx xx, xxx xxxxxx obsažená x xxxxxxxx x x xxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxx xxxxxx pro xxxxxxxxx xxxxxxxxx klinických hodnocení. Xxxxxxx dosavadní xxxxx xxxxxx x léčivech xx xxxxxxxx tak, xxx ustanovení zákona xxxxxxxxxxx právní xxxxxx xxxxxxxxx x xxxxxxxx.
1.5.2. Xxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxxx léčivých xxxxxxxxx
Xxxxx návrhu xxxxxx xx xxxxxxxxxx xxxxxxxxxx xxxxxxxx přípravků xxx xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx, které xxxx možné xxxxxxxx xxxxx léčivým xxxxxxxxxx. Xxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx léčivých přípravků xx xxxxxxxxxx xxx xxxxxxxxxxx xxxxxxxxx xxxx. Xxxxx xxxxxx tak xx zajištění xxxxxxxx xxxxxxxxx xxxx x Xxxxx xxxxxxxxx.
Xxxxx xxxx xxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxx x Xxxxx republice xx xxxxxx xxxxxxx jejich xxxxxx a xxxxxx, x xx xxxxxxxxxx xxxxxxx xxxxxxxxx x xxxxxxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx pro xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx x xxxxxxxxx příslušných xxxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx území Xxxxx xxxxxxxxx x xxxx případech, xxx xxxxxxxxxxx xxxxxx xxxxxx xxxxxxx takových opatření xxxxxxxxxx. Záměrem xx xxxxxx xx xxxxxxx xxxxxxx zainteresované xxxxxxxx x xxxxxxxxxxx xxxxxx xxxxxxx xxxxxx xxxxx xxxxxxxxxx v xxxxxxxxxx Xxxxxxxx xxxx a xxxx x judikatuře Xxxxxxxxxx xxxxxxxx xxxxx.
Xxxxxxx xxxxxx je xxxx xxxxxx xxxx, kdy xx xxxxxxxxxx situace, xxx xx xxx xxxxx xxxxxxxx x XX nebyly xxxxxxxxx xxxx, xxxxx xx xxxxxxx xxx nahrazeny xxxxx léčivým xxxxxxxxxx xxxx jsou xxxxxxxx x xxxxxx xxxxxx xx xxxxxxxx xxxxxxx xxxxxxxxx xxxxxx. Cílovým xxxxxx xx xxxx xxxxxx stav, kdy xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx na xxxxx xxxxxxxx přípravků xxxx x případě xxxxxxxxxxxxx xxxxxxxxx na xxxxxx od xxxxx xxxxxxxxxx dostatečně xxxxxxxxxx.
1.5.3. Xxxxxxxx xxxxxxxx xx xxxxxx k léčivým xxxxxx pro xxxxxxx xxxxxx xxxxxxxxx
Xxxxxxx xxxxxx xx dále xxxxxxxx xxxxxxxx xxxxxxxx Komise x xxxxxxxxx xxxxxxxxx (XX) č. 1252/2014 xx xxx 28. xxxxxx 2014 xxxxxxxxxx směrnici Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX, pokud xxx o zásady x xxxxxx xxxxxxx xxxxxxx praxe pro xxxxxx xxxxx xxx xxxxxxx léčivé přípravky.
1.5.4. Xxxxxxxxxx Státního xxxxxx xxx kontrolu léčiv x Generálního ředitelství xxx
Xxxxxxx xxxxxx xx xxxxxx vytvořit efektivní xxxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx x Xxxxxxxxxx xxxxxxxxxxxx xxx xx účelem xxxxxxxxxxxx xxxxxxx xxxxx x xxxxxxxxx xxxxxxxxx x nimi.
1.5.5. Xxxxxxxxxxx xxx xxxxxxxxx činnosti x xxxxxx instituty xxxxxxxxx a zabrání xxxxxxxx přípravků
Cílovým stavem xxxxxx xxxxxxxxxx xxxxxx xxxxxxxx xx zajistit, xxx x léčivy xxxxxxxxxxx xxxxx xxxxxxxxxxx x xxxxxxxx též xxxx xxxxxx (x xxxxxxx xx specifický xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxx produktů mající xxxxx xxxx na xxxxxxxxxxxx xxxxxx) xxxxxxxx xxxxxxxx.
Xxxxx xx xxxxxxxx xxxxxxx xxxxxxxxxxx xxx xxxxxxxxx činnosti x xxxxxxxx zásadní xxxxxx xxxxxxxxx xxxxxxxxx a xxxxxxx xxxxxxxx xxxxxxxxx xxx, aby xxxx xxxxxxxxxx x xxx xxxxxx xxxxxxx, kdy xx zjištěno, že x xxxx xxxxxxxxx xxxxx, xxxxx x xxxx nejsou xxxxx xxxxxx xxxxxxxxx.
1.6. Xxxxxxxxxx xxxxxx
1.6.1. Xxxxxxxx nařízení x xxxxxxxxxx hodnoceních xxxxxxxxx léčivých xxxxxxxxx
Xxx xxxxxxxxx současného stavu xx x xxxxxxxx xxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx č. 536/2014, což nastane xxxxxxxx xxxx 28. xxxxxx 2016, vznikla xxxxxxxx neúnosná xxxxxxx, xxx by xxxxxxxxxxx xxxxxxxxxx hodnocení xxxxxxxxx xxxxxxxx xxxxxxxxx zůstaly xxxxxxxx x xxxxxx x léčivech, a xxxxxx xx xxxxxxxx xxxxxxx úprava obsažená x nařízení, xxxxx xx v každém xxxxxxxx xxxxx přímo xxxxxxxxxx. Z uvedeného xxxxxx xx xxxxx xxxxxxx xxxxx xxxxxx x léčivech xxx, xxx xxxx xxxx xx xxxxxxx x xxxxxxxxx nařízení, např. xxxxxxxx xxxxxxxxx xxx xxxxx xxxxxxxx č. 536/2014 xxxx xxxxx xxxxxxxxxx, xxxxxxx xxx xxxxxxxxxx xxxxx xxxxxx x xxxxxxxx jsou xxxxxxxx xxxxxxxxx povolována x xxxxxxxxxx; xxx xxxxxx x léčivech xxxx xxxxxxxx xxxxxx xxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx, což evokuje xxxxxx závislost na xxxxxxx xxxxxxxxxx hodnocení x xxxxxx x xx xxxxxxxxxxxx. Xxxx xxxxxxxx č. 536/2014 stanovuje xxxxxxxxx na xxxxxxxx xxxxxxxxxx žádostí xxxxx xxxxxxxxx členskými státy, xxx současné xxxxx xxxxxx x xxxxxxxx xxxxx. Xx se xxxx xxxxxxxx xxxxxx, x současnosti xx xxxx x multicentrického xxxxxxxxxx hodnocení xxxxxxxx xxxxxxxxxxxxxx xxxxxx xxxxxx x xxx jednotlivá xxxxx klinického hodnocení x jeho xxxxxx xxxxxx xxxxxx a xxxxx xxxxxx xxxxxxxx. X xxxx xxxxxxxxx xxxxxxx, xx xxxxxxxx xxxxxx xxxxxx by xx xxxxxxx do xxxxxxx s xxxxxxxxx xxxxxxxx č. 536/2014.
Xxxxxxxxx klinických xxxxxxxxx xx území XX by xxxxxx x xxxxxxx na xxxxxxx zajistit xxxxx xxxxxxx, které xxxx xxxxxxxxx xxxxxxxxx státu, xxxxx.
Xxxxxxxxx situace xx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx, xxxxxxxxxxx x zkoušejícím, xxx x Xxxxx xxxxxxxxx, xxxxx je xxxxxxx xxxxxxxxxxx xxxx xxxxxx xxx xxxxxxxxxxxxx xxxxx. X xxxxxx xxxxxx xxxxx xxxxx xxxxxx xxxxxxx xxxxxxxxx. Negativním xxxxxxx by xxxx x xx, xx xxx nejasné situaci xx xxxxxxxxxx raději xxxxxxxx xx provádění xxxxxxxxxx xxxxxxxxx xx xxxxx České republiky, xxx xx xxxxx xxx xxxxxx xx xxxxxxxx. V úvahu xx xxxxx xxxx x xxxxxxxxx finanční xxxxxx na xxxxxxxxxxxxx xxxxxxxxxxx služeb x xxx předpokládat i xxxxxxxxx dopad xx xxxxxxxxxxxxx prostředí - xxxxx xxxxxxxx, které xxxxxxxxx provádění xxxxxxxxxx xxxxxxxxx - smluvní xxxxxxxx xxxxxxxxxx xx xxxxxxxx xxxxxxxx farmaceutických xxxxxxxxxxx.
1.6.2. Xxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxx přípravků
Při xxxxxxxxx xxxxxxxxxx xxxxx by x nadále vznikaly xxxxxxx, xxx xxx xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx by xxxxxx xxxxxxxx některé xxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxx xxxxxx xxxxxxxxx x xxxx xxxxxxxxxxxx xx byla xxxxxxxxx xxx, xx xxxx na úkor xxxxxxx pacientů v Xxxxx xxxxxxxxx xxxxxxxxxxxxx xxxx xxxxx České xxxxxxxxx. Hrozilo xx xxxx xxxxxx xxxxxxxxxxx x xxx, xx xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx, pokud xxx o dostupnost xxxxxxxxx xxxxxxxx přípravků, xxxxxx xxx ně xxxxxxxx xxxxxxxxxx. Xxxxxx xx hrozil přímý xxxxx na zdraví xxxxxxxx v xxxxxxxxxxx x významnými xxxxxxxx xxxxxxxxx, xxxxx xxxx xxxxxxxxxxxxx.
1.6.3. Adaptace nařízení xx xxxxxx k xxxxxxx látkám pro xxxxxxx léčivé přípravky
Při xxxxxxxxx současného xxxxx xx xxxxxx náležitým xxxxxxxx xxxxxxxxx adaptace xxxxxxxx Komise v xxxxxxxxx pravomoci (EU) č. 1252/2014 xx dne 28. května 2014 xxxxxxxxxx xxxxxxxx Evropského xxxxxxxxxx x Xxxx 2001/83/XX, xxxxx xxx x zásady x xxxxxx xxxxxxx xxxxxxx xxxxx pro xxxxxx xxxxx xxx xxxxxxx xxxxxx přípravky. Xxxxxx xxxxxxx by xxxxx xxxxxxx x xxxxxx xxxxxxx sankčních xxxxxxxx xxxxxxxxxxx orgánů Xxxxxxxx xxxx vůči České xxxxxxxxx.
1.6.4. Xxxxxxxxxx Státního xxxxxx xxx xxxxxxxx xxxxx x Generálního xxxxxxxxxxx xxx
Xxxxxxxxx xxxxxxxxxx xxxxx xx dále xxxxxxxxx prodlužování xxxxxxxxxxxx xxxxxxxxxx Xxxxxxxx ústavu xxx xxxxxxxx xxxxx x Generálního xxxxxxxxxxx xxx x xxxxxxxxxxxx xxxxxxxx xxxxx, xxxxx xx charakterizován xxxxxxxx xxxxxxx informací mezi xxxxxx xxxxxx. Xxx xx zabraňuje tomu, xxx mohl xxx xxx zbytku xxxxxxx xxxxx směrnice Xxxxxxxxxx xxxxxxxxxx x Xxxx 2011/62/EU, xxxxxx se xxxx xxxxxxxx 2001/83/XX x kodexu Xxxxxxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxx o xxxxxxxxx xxxxxx xxxxxxxxxx léčivých xxxxxxxxx do xxxxxxxxx xxxxxxxxxxxxxx řetězce. Xxxxxxx xxxxxxxx a xxxxxxxxx xxxxxx problému by xxxx xxxxxxxxx pohybu xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxx s xxxxxxxx xxxxxxxxx v Xxxxx republice a xxxxxxx použití xxxxxxxx xxxxx xxxxxxxxxxxxxx kvality xxx xxxxxx léčivých xxxxxxxxx.
1.6.5. Prokazování xxx xxxxxxxxx činnosti x xxxxxx xxxxxxxxx zajištění x zabrání léčivých xxxxxxxxx
Xxxxxxxxx xxxxxxxxxx xxxxx xx xxxxxx xxxxxxxxx xxxxxxxxxxx xx xxxxxx xxxxxxxx xxxxxxx, xxx xx xxxxx zbytečně xxxxxxxxxx xxxxxx xxxxxxxx x rámci xxxxxx xxxxxxxx xxxxx xxxxxxxxxxx xxxx, xxx v xxxxxxxx xxxxx existující xxxxxxxxxx a xxxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx xxx jejich xxxxxxxxx xxxxxxxx xxxxxxx x různorodému xxxxxxxxxxx xxxxxxxxx xx xxxxxxxx x xxxxx xxxxx xxxxxx kontroly. Xxxxxx xx xxxxxxx x xxxxxxx x současné xxxx xxxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx x zabrání xxxxxxxx xxxxxxxxx, které xxxxxxxxxxx xxxxxxxxxx prostor xxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxx x xxxxxx xxxxxxxx x xxxxxxxx xxxxxxxx v xxxxxx, x to xxxxxxxxx na xxxxxxxxx xxxx v xxxxx xxxxxxxxxxx xxxxxxxxxxxxx xxxxxxx. Xxxxxxx xxxx je, xx xx nebyla x xxxxxxxxx efektivní xxxxxxxx, která xx xxxxxxxxx šíření takových xxxxxxxx xxxxxxxxx, xxxxx xxxxxxxxxx xxxxxxxxxx xx xxxxxx jakost, xxxxxxxx x xxxxxxxxxx.
2. Návrh xxxxxxx řešení
Vzhledem x xxxx, že xxxxxxxxxxxx xxxxxxx x xxxxxx xxxxxx xxx rozčlenit xx xxxx xxxxxxxx xxxxxxxxxxxx xxxxx (xxxxxxxx xxxxxxxx xx klinickému xxxxxxxxx x xxxxxxx xxxxxxxxx), xxxx xxxx xxxxx xxxxxx x xxxxxxxxxxxx dílčích xxxxxxx, x xx xxx xxxxx xxxxxx xxxxxxx, xxxxxx dílčích xxxxxxxx x xxxxx těchto xxxxxxx, xxxxxx variantní xxxxxx i xxxxxxxxxxx, xxx xxxxxxxxx xxxxxxxx xxx vyhodnocování dopadů xxxxxxxx.
Xxxxxxxxxxxxx xxxxxxxx: Xxxxx xxxxxxxx - nulová x xxxxx problematik
U xxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxx 1 - xxxxxx zachování xxxxxxxxxxx xxxxx, xxxx x xxxxxxxxx xxxxxxxxxxx xxxxxx na xxxxxxx xxxxxxxx x na xxxxxxxxxxxxx xxxxxxxxx. Xxxxxxx xxxx xxxxx xxxxxx xxxxxxxxxxxxxx problémy, xxxx. xxxxxxx, jak xxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxx xxx požadavků xxxxxxxx xxxx x případě xxxxxxxxx, xxx xx xxxxxx xx účelem xxxxxxxxx dostupnosti xxx xxxxxxx xxxxxxxx x XX xx účelem xxxxxxx jejich zdraví, x byla xx xxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxxx xxxxx. Xxxx xxxxxxxx xxxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxx xxx xxxxx xxxxxxx současných, xxxxx ani žádné xxxxxxx, xxxxxxx by xxxx možno xxxxxxxxx, xxxx. xxxxxx xxxxxxx xxxxxxxxxxxx x xxxxxxx xxxxxxxxx xxxx na xxxxx x důsledku xxxxxxxxx xxxxxxxxxxx významných xxxxx xx xxxx xxxx xxxxxx xxxxxx, xxxx xxxxx xx xxxxxx xxxxx použít xxxxxx xxxxxxxxx x xxxxx klinického hodnocení.
2.1. Xxxxxxxx nařízení o xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx
Xxxxxxxx xxxxxxx
Xxxxxxxx 1 - nulová
Nulovou xxxxxxxxx xx xxxxxx xxxxxxxxxxxx xxxxxx novely xxxxxx o xxxxxxxx. Xxx zachování xxxxxxxx xxxxxx úpravy xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxx o xxxxxxxx xx x Xxxxx xxxxxxxxx xxxxxxx k xxxxxxxx xxxxxxxx xxxxxxxx Xxxxxxxxxx parlamentu a Xxxx č. 536/2014, xxx xx mohlo xxx xxxxxxx xxxxxx Xxxxxxxx xxxx xxxx porušení xxxxx, xx kterých xx fungování Xxxxxxxx xxxx založeno. Změny x xxxxxxx xxxxxxxxxx xxxxxxxxx nastavené nařízením Xxxxxxxxxx parlamentu x Xxxx č. 536/2014 jsou xxxxxxx xx xxxxxxxx xxxxxx xxxxxxxxxx hodnocení xxxxxxxx x xxxxxx č. 378/2007 Sb., x xxxxxxxx x x xxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxx (xxxxx o xxxxxxxx), xx xxxxx xxxxxxxxxx xxxxxxxx. Nulová xxxxxxxx xx x xxxxx xxxxxxxxx xxxxx xxxxxxxxxxx xxxxxx x xxxxx xx x takové xxxxxxxxxx právní xxxxxx, xxxxx xx xx xxxx xxxxxxxx xxxxx xxxx x posuzování x povolování xxxxxxxxxx xxxxxxxxx x xxxxxxx x xxxxxxxxx, xxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx x České republiky. Xx xx mohlo xxx následky uvedené xxx v xxxx 1.6.1., xxxx xxxxxxx xxxxx šanci pro xxxxxxxx xxxxxx se x modernější a xxxxxxxxxxxx xxxxx, dále xxxxxxx finančních xxxxxx xxx poskytovatele xxxxxxxxxxx xxxxxx, snížení prestiže xxxxxx zdravotnictví x xxxxxxxxxxxx xxxxxxx x xxxxxxxxx xxxxxxxxxxxxxxx subjektů, xxxxxxxxxxxxx v oblasti xxxxxxxxxx hodnocení (s xxx xx xxxxxxxx x další xxxxxxxxx xxxxxxxx - xxxxxx xxxxxx xxxxx pracovních xxxx xx xxxx xxxxx).
Xxxxxxxxxxx nákladů x xxxxxxx xxxxxxxx
Xxxxxxxx 1 (xxxxxx) není xxxxxxx x žádným xxxxxxxxx xxxxxxxx. Xxxxxx xxxx xxxxxxx by mělo xx xxxxxxxx xxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxxx xxxxxxxx Evropského xxxxxxxxxx a Rady (XX) č. 536/2014 a x xxxxxxxx finanční xxxxxx xx xxxxxx xxxxxx Xxxxxxxx xxxx. Xxxxxx xxxxxxxx by xxxx i případný xxxxxxxxx xxxxxxxx xxxxx xx xxxxxxxxxxxxx zdravotních xxxxxx, xxxxx xxxxxxx xxxxxxxx hodnocení, a xx x důvodu xxxxxxx xxxxxxxxxx x xxxx xx xxxxxxx xxxxx prováděných klinických xxxxxxxxx x&xxxx; Xxxxx xxxxxxxxx, negativní xxxxxxxx xxxxx na podnikatelské xxxxxxxx x xxxxxxx xxxxxxxxxx xxxxxxxxx (XxxxxxxxXxxxxxxxXxxxxxxxxxxx, xxxxxxxxxxx xxxxxxxxxx xx xxxxx prováděním xxxxxxxxxx xxxxxxxxx), negativní xxxxx xx měla x xx xxxxxxxx, xxxxx xx xx xxx xxxxxxxxx xxxxxxxxx k xxxxxxxxxxx léčbám, k xxxxxxxx xxxxxxxxx xxxxxxxxx x cílené nové xxxxx, x xxxxx xxxxx neregistrovaným léčivým xxxxxxxxxx, a xxxx xxx x xxxxxxxx xxxxx xxxxxxxxx xxxxxx xxxx, xxx by xxxxxxxxxx x xxxxxxxxx xxxxxxxxxx hodnocení přešli.
Varianta 2 - xxxxx xxxxxxx xxxxxx
Xxx hledání xxxxx, která xx xxxxx xxxx ke xxxxxxxxxxx cíli, bylo xxxxxxxxx xxxxx xxxxxxxxxxx xxxxxx v podobě xxxxxxxxxxxxxx xxxxxxxxx. Xxxxxxx xx xxxxxxxxxx, že xxxxxxxxxxxxxx problém xx xxxxx (x xxxxxxx xx xxxxxxx adaptace xx právního xxxx) xxxxx xxxxx xxxxxxxxxxxx xxxxxx.
Xxxxxxxxxxx nákladů x xxxxxxx varianty
Varianta 2 xxxxxxxxxxx x předkládaném xxxxxx zákona, xxxxxx xx xxxx xxxxx x léčivech, nepředpokládá, xx xx x xxxxx přijetím xxxx xxxxxxx xxxxx xxxxxxxx xxxxxxx xxx xxxxxx xxxxxxxxxxxxx, xxxxxxxxxxxxxx xxxxx xxxx xxxxxxx instituce x Xxxxx xxxxxxxxx. Xxxxxx xxxxxxxx xxxxxxx xxxx Xxxxx xxxxxxxxx xxxxxx, jak xx xxxxxxx x xxxx 3.2. Tyto xxxxxxx xx mohly být xxxxx x mimorozpočtových xxxxxxxxxx, pokud xxxxxxx xxxxxxxx xxxxxxxx systém xxxxxxxxxxx, x případně xxxxxxxx x x XX xxxxx v xxxxxxx, že xx xxxxxx xxxxxx xxx xxxxxxxx projekty evropskou xxxxxxxxx xxxxxxx.
Xxxxxxxx variant x xxxxx xxxxxxxx 2
Xxxxxxxxx v tomto xxxxxxx xxxx xxx xxxxxxxx - a xx
Xxxxxxxx x = xxxxxx zákona o xxxxxxxx
Xxxxxxxx b = xxxxx xxxx zákon xxxxxxxx pouze xxxxxxxxxx xxxxxxxxx humánních xxxxxxxx xxxxxxxxx.
Xxxxxxx a přínosy xxx xxxxxxxxxx xxxxxxx xxxxxxxx
Xxxxxxxx x
X xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxx xxx xxxxx xxxxxxxxxx xxxxxxxx, xxx xxxx xxxxxx xxxxxxx xx xxxxxx xxxxxx xx xx již xxxxxxxxx xxxxxxxxxxx.
Xxxxxxxx x
X legislativně xxxxxxxxxxx hlediska xxxx xxx xxxxx xxxxxxxxxx xxxxxxxx, xxx xxxx xxxxxx xxxxxxx do xxxxxx zákona xx xx xxx xxxxxxxxx xxxxxxxxxxx.
Xxxxxxxx výběru xxxxxxx
Xxx xxxxxx xxxx xxxxxxxxx xxxxxxx (x či x) byla xx xxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxxx x xxxxxxxxxxxxxx xxxxxx xxxxxx. Z xxxxxx xxxxxxxx byla xxxx xxxxxxxx xxxxxxxxx xxxxxx xxxxxx do xxx xxxxxxxxxxx legislativního xxxxx x xxxxxx x xxxxxxxx, který xx komplexně xxxxxx xxxxxxxxxxxx xxxxxxxx léčiv xx xxxxx XX. Xxxxx xxxxxxx jediný xxxxx, xxxx xx xxxxxxx xxx xxxxxx xxxxxx xxxxxxxx xx xxxxxx o léčivech.
Varianta 2 xxxxxxxxxxx xxxxxxxx x předložení xxxxxx xxxxxx, xxxxxx xx xxxxx k xxxxxx xxxxxxxxxxx xxxxx zákona x xxxxxxxx xxx, xxx xxxx xxxxxxxxxx xxxxxxxxxx se problematikou xxxxxxxxxx xxxxxxxxx xxxxxxxxxx xx xxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx x xxxxxxxx č. 536/2014.
Xxxx xxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx na xxxxxxx právní úpravu xxxxxxxxx x xxxxxx x léčivech ve xxxxxx xxxxxxxx, pokud xxxxx komplexní právní xxxxxx léčivých přípravků. Xxxxxxxxx xxxx xxxxxx xxxxxxx xxxxxx xxxxxx. Xxxx xxxxx zvolena xxxxxxxx xxxxxx xxxxxx xxxxxx x xxxxxxxx.
Xxxxxx xxxxxx xxxxxxxx xx xxxxxxxx xxxxxx
Xxxxxxxx Evropského xxxxxxxxxx a Xxxx (XX) č. 536/2014 ponechává xxxxxx xxxxxxxxxx a xxxxxxxx etických komisí x xxxxxxxxxx xxxxxxxxx xxxxx. Při xxxxxxxx xxxxxx xxxxxx, který xx xxxxxxxxxxx xxxxxxxxx xxxxx x léčivech, xxxx xxxx zvažováno x xxxxxxx na xxxxx žádostí x xxxxxxxx hodnocení x xxxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xx xxx xxxxxxx etické xxxxxx xx dvou aspektů
1. xxxxx etických komisí: xxxxx xx xxxx x
2. xxxxxxxxxx xxxxxx xxxxxx.
X současné době xxxx xxxxxx xxxxxx xxxxxxx u xxxxxxxxxxxxx xxxxxxxxxxx služeb, a xxx jsou x xxxxxxxx xxxxxx x xxxxxx xxxxxxxxxx hodnocení x xxxxxx x xxxxxxxxxxx. Xxxxx xxxxxxxxxx xxxx nařízení neumožňuje.
Definice xxxxxxx ohledně počtu xxxxxxxx xxxxxx
Xxxxxxxx 1 = xxxxx etická xxxxxx
X Xxxxx republice xx xxxx zřízena xxxxx xxxxxx xxxxxx xxxxxx.
Xxxxxxxx 2 = xxxx&xxxx; etických komisí
V Xxxxx republice xx xxxx zřízeno xxxx xxxxxxxx xxxxxx.
Xxxxxxxx 3 = xxxxxxxxxxx, xxxxx xxxxxx komise x xxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx
Xxxxxxx a xxxxxxx xxx xxxxxxxxxx xxxxxxx xxxxxxxx
Xxxxxxxx 1
Xxxxxxxx xx xxxx xxxxxx xxxxxx x xxxxxxxx spolupráce x tím i xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxx xxx xxxxxxxx xxxxxx komise, xxxxx xx xxx nařízení č. 536/2014 xxxxxx xxxxxxxxx xxxxx. Xxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx x xxxxxxxxxx a xxxxxxxxxx xxxxxxxx xxxxxxx, xxxxxxxxxx koordinace xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxx k xxxxx X, xxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxx x xxxxxxxxxxx xxxxx (xx. posouzení xxxxxxx, xxxxxxx, xxxxxxxxx průběhu xxxxxxxxxx hodnocení). Jako xxxxxxxxx xxxxx xxxx xxxxxxxx xxxxxx xxx xxxxxxxx xxxxxxx xxxxxxx xxxxx členů, xxx xxxxxx xxxxxx xxxxxxx xxxxx agendu. Xxxxx xxxxxx xxxxxx xxxxxxxx xxxxx xxxxxx xxxxx Xxxxxx xxxxxxxxxx, x xx xxx x xxx xxxxxxxxxxx, xxx x xxxxx bez xxxxxxxxxxxxxx xxxxxxxx, (xxx xxxxxxxx xxxxxxxx č. 536/2014) x zajistili xxxxxx xxxxxxx xx scházet, xxxxxxxxxxx x xxxxxxxxxx xxxxxxxxxx dokumenty, hlavně xxxxxxxxx x dodatky, xxx xx xxxx xxxxxxx etické xxxxxx xxxxxx xxxxx Xxxxxx xxxxxxxxxx velmi xxxxxxx x zajistit xxxxxx xxxxx xx xxxxxxxxx, xxxxx budou xxxxx xxxxxxxx x kratších xxxxxxxxxxx xxx tomu xx xxxxxxx, xxx 1x xxxxx, xxxxx xxxxxxxx. Xxxxxxx xxxxx xxxx xxxxxx xxxxxx xx členů xxxxxxxxxx xxxxxxxx xxxxxx xx xxxx výhodné xxx xxxxxxx xxxxxxx xxxxxx xxxxxxxxxx x znalostí xxxx xxxxxxxxxxxx.
Xxxxxxxx 2
Xxx xxxxxxx xxxx etických xxxxxx xxx xxxxxxxx xxxxxxxx zachovat xxxxxx xxxxxxxxxx stavu xxxxxxxxx xxxxxxxxxxxxxxxx xxxxxxxx xxxxxx, xxxxx xxx xxxxxxxx xxxxxxxxxx xxxxxxxx č. 536/2014 x nezávislosti xxxxxx xxxxxx na xxxxx xxxxxxxxxx hodnocení a xxxxxxxxxxxx. Při xxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxxxxxxxx xxxxxxxx xxxxxx xxx xxxxxxxxxxx, xx x xxxx domluvu xx xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx x xxxxxxxxx xx xxxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxxxx (xxxxx požadavky xx xxxxxxxxx, xxxxx xxxxxxxx, xx xx x xxxx xxxxxxxx hodnocení, xxxxxx sjednocených formulářů). Xxxxx je snahou, xxx xxxx systém xxxxxxxx xxxxxx x xxx xxxxxxx xxxxxxxxxxx xxxxx etických xxxxxx, xxxxxxxx xxxxxxxx členů x xxxxxxx stávajících xxxxxxxx komisí x xxx odboural xxxxxxxxxxx xxxxxxxx „xxxxxxx“. Xxxxx xxxxx xxxxx xxxx xxx xxxxxxxxxx xxxxxx xxxxxxxxxxxxx. Problémem xxxxx xxx x lhůty xxxxxxxxx xxxxxxxxx x xxxxxx náročnost xxxxxxx xxxxxxxxxx xx celou Xxxxxx republiku. X xxxxx zajistit xxxxxxxxxxxxxxx, xxxxxxxxxxxxxx x snadnou xxxxxxxxxx spoluposuzování, xx xxxx xxxxxxxx většího xxxxx xxxxxxxx komisí xxxxxxxxxx.
Xxxxxxxx 3- xxxxxxxxxxx
Xxxxxxx x přínosů xxxx xxxxxxxxxxx variant, xxxxx xxxxxx xxxxxx s xxxx xxxxxxxxx. Xxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxx x xxxxxxxxx věcech, xxxxx xxxxx xxxxxxxxxx xxxxxxx, xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx stanovisek x xxxxxxxx xxxxxx xxxxxxxx xxxxxxx xxxx xxxxxxxx xxxxxxxxxx činnosti xxxxxxxxxxxx xxxxxx (xxxxxxx xxxxxxxxxx xxxx x xxxxxxxxxx xxxxxxx) a xxxxx xxxxxxxxxxx, xxxxxxxxxx xxxxxxxxx xxxxxx xxx činnost xxxxxx komise x xxxxxxx xxxxxxxx xxxxxxxxxx xxxx xxx koordinátory xxxxxx xxxxxx a xxxxxx xxxxxx etické xxxxxx ze xxxxxx xxxxxxxxx x xxxxxx xxxxxx za xxxxxxxxx xxxxxxxxxx hodnocení. Xxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxx xxxxxxxxx jak xx xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx služeb, xxx i xxxx xxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxx, který xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx x. 536/2014 x Xxxxxxxx XX čl. 9.
Xxxxxxxx xxxxxx variant
Za xxxxxx kritérium výběru xxx xxxxxx xxxxxx x nařízením, xxxxxxxx xxxxxxx xxxxxxxx xxxxxx (xxxx xxxxx x xxxxxx xxxxxxxxx xxxxx) x efektivita xxxxxxxx xxxxxx komise.
Na xxxxxxx xxxx xxxxxxxxx xxxxxxxx xxxx xxxxxxx xxxxxxxxxxx xxxxxxxx 3, která xxxxxxx x xxxxx xxxx xxxx xxxxxxxxx xxxxxxx. Výslednou xxxxxxxxx xx xxxxx xxxxxx xxxxxx s xxxx xxxxxxxxx. Xxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx stejného xxxxxxxx x xxxxxxxxx xxxxxx, xxxxx podle xxxxxxxxxx postupů, snazšího xxxxxxxx xxxxxxxxxx vydávání xxxxxxxxxx x xxxxxxxx xxxxxx xxxxxxxx xxxxxxx xxxx xxxxxxxx koordinaci xxxxxxxx xxxxxxxxxxxx xxxxxx (xxxxxxx xxxxxxxxxx časů x xxxxxxxxxx xxxxxxx) x xxxxx flexibilitu, xxxxxxxxxx zajištění zázemí xxx xxxxxxx etické xxxxxx x xxxxxxx xxxxxxxx pracovních míst xxx koordinátory xxxxxx xxxxxx a odměny xxxxxx xxxxxx xxxxxx xx xxxxxx xxxxxxxxx x xxxxxx výdajů xx xxxxxxxxx klinických xxxxxxxxx. Xxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxx sestaveny xxx xx xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxx poskytovatelů xxxxxxxxxxx xxxxxx, xxx x osob xxx xxxxxxxxxxxxxx vzdělání xxxxxxxx, xxxxx xxxxxxx dodržení xxxxxxxxx xxxxxxxxxxx nařízením x. 536/2014 x Xxxxxxxx XX čl. 9.
Definice xxxxxxx xxxxxxx zřizovatele xxxxxxxx xxxxxx
X xxxxxxxxx xxxxxxx etických xxxxxx, xxx jsou xxxxxxxxxxx xxxxxxxxxxxxx zdravotních xxxxxx, xxxxx zcela xxxxxxxx xxxxxxxxxxx xx místě xxxxxxxxxx xxxxxxxxx x xxxxxxxxxxxx. Xx je xxxx xxxxxx xxxxx xxxxxxxx změny xxxxxxx. Xxxxxxxxxx současných xxxxxxxxxxx xxxx zvažovány xxxxxxxxxxx xxxxxxxxxxx.
Xxxxxxxx 1 = xxxxxxxx xxxxxx komise/etické xxxxxx
Xxxxxxxx 2 = xxxxxxx xxxxxx xxxxxx/xxxxxxxx xxxxxx xxx xxxxxxxxxx xxxxxxxxx
Xxxxxxxx 3 = xxxxxxx etické xxxxxx/xxxxxxxx xxxxxx xxx xxxxxxxxx xxxxxxx
Xxxxxxxx 4 = xxxxxxx xxxxxx xxxxxx xxxx organizační xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx
Xxxxxxxx 5 = zřízení xxxxxx xxxxxx/xxxxxxxx komisí xxxx xxxxxxxxx orgánu Xxxxxxxx xxxxxx pro xxxxxxxx xxxxx
Xxxxxxx x xxxxxxx xxx jednotlivé xxxxxxx xxxxxxxx
Xxxxxxxx 1
Problematika xxxxxxxxxx xxxxxxxxx xxxxxxxx (xxx xxxxx xxxxxx xxxxxxxxx xxxxx, xxxxx xxxx xxxxxxxxx xxxx xxxxxxxxx xxxxx na Xxxxxx xxxxx xxx kontrolu xxxxx, xx xxxxxxxx xxxx xxxxxx xx xxxxxx xxxxx dále xxxxxxxxxx finanční prostředky xx xxxxxxx xxxxxxxxxx xxxxxxxx, etická xxxxxx xx xxxxxxx xxxxxxxxx xxxx xxxxxxxx, xxxxxxx xx xx xxxx x xxxxxxx x xxxxxxxxxx xxxxxxxx č. 536/2014 x xxxxx xxxxxx xxx xxxxxxx stát), xxxxxxxx při xxxxxxxxxxxx xx xxxxxx etické xxxxxx x nemožnost xx xxxxxxxxxx vynutit; xxxxxx xxx x xxxxx, xxxx etická xxxxxx či xxxxxx xxxxxx xx mohly xxx xxxxxx xxx xxxx činnost z xxxxxxx event. xxxxxxxxxxxx xxxxxxx xxxxxxxx. Xxxxxx xxxxxxxxxxxxxx xxxxx xxxxxxxxxx xxxxxxx xxxxxxxxxxx x xxxx xxxxxxxx.
Xxxxxxxx 2
Činnost xx xxxxxxxxxx fakultách xx xxxxxxx x xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx x akademičtí xxxxxxxxxx xxxx xxxxxxx xxxxxx - xxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx xxxx xxxxxxxxxx xxxxxx. Xxxxxx zde xxxxx xxxxx xxxxxxxxxx přínosy xxx xxxxxxx xxxxxxxxxxx x xxxx varianty.
Varianta 3
Xxxxxxxxx xxxx alternativy xxxx možná xxx x minulých letech, xxx xxxxx nebyla x praxi xxxxxxx. Xxxxxxx xxxxx xxxxxx xxxxxxxxxx v xxxx xxxxxxx, finanční xxxxxxxxx xx xxxxxx možné x xxxxxxxx xx xxxxxxxx xxxxxxxxx, kdy Xxxxxx xxxxx xxx xxxxxxxx xxxxx xx xxxxxx xxxxxxxxxx činnost xxxxxxxxxxxx xxxxxxxxx xxxxx. Xxxxxx identifikovány žádné xxxxxxxxxx přínosy xxxxxxxxxxx x této xxxxxxxx.
Xxxxxxxx 4
Xx xxxxxxxx xxxxxx xxxxxx jako xxxxxxxxxxx xxxxxx Ministerstva zdravotnictví xx xxxx xxxxxxx xxxxxxx xx xxxxx xxxxxxxx xxxxxxxxxx xxxxxx. Xxxxxx xxxxxxxxxxxxxx žádné xxxxxxxxxx xxxxxxx xxxxxxxxxxx x xxxx xxxxxxxx.
Xxxxxxxx 5
Xx xxxxxxxx xxxxxx xxxxxx xxxx poradního xxxxxx Státního xxxxxx xxx kontrolu xxxxx xxxxx spojeny xxxxxxx xx xxxxx navýšení xxxxxxxxxx xxxxxx. Xxxxxxx xxxxx x xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxx etické xxxxxx x xxxxxxxxx xxxxxx výdajů. Rovněž xxx možnost xxxxx xxxxxxxxxx požadavků xx xxxx xxxxxx xxx xxxxxxxxxxxx etické xxxxxx/xxxxxxxx xxxxxx a jejich xxxxxx. Xxxxxx zajištění xxxxxxxxxx xxxxxxxxxx xxxxxxxx x xxxxxxxx stanovisek x xxxxxx xxxxxxxxx xxxxxxxxxx časů. Poradní xxxxx bude pracovat xx xxxxxxx Xxxxxxx x Xxxxxxxxx řádu xxxxxxxx Xxxxxxx po xxxxxxxxxx schválení Xxxxxxxxxxxxx xxxxxxxxxxxxx a nebude xxxxxxxxxx xxxxxxxxxxxx. Xxxxxxxxxxx xxxxxxxxxxx, xxxxx budou xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx x administrativní xxxxxxx xxxxxxxx xxxxxx xxxxxx/xxxxxxxx komisí xxxxxxx xxxxx xxxxxx xxxxxx x xxxxxxx se xxxxxxxx xxxxxxx „xxxxxxxxxxx“ x xxxxx xxxxxxxx xxxxxx xxxxxx. Zajištění xxxxxxxxxxxx vychází xx xxxxxxxx xxxxx xxxxxxxxx xxxxxx Xxxxxxxx xxxxxx xxxxxxxx, kterými xxxx xxxx. Xxxxx xxx xxxxxxx terapie, Xxxxx xxx xxxxxxx xxxxxx xxxxxxxxx aj., kdy xxxxxxx orgán xx xxxxxxxxxxx, technicky x xxxxxxxxxx xxxxxxx xx Xxxxxxxx xxxxxx xxxxxxxx, xxx xxxxxxx činnost x xxxxxxxxxxx xx xxxxxxxxx.
Xxxxxxxx výběru xxxxxxx
Xxxx xxxxxx xxxxxxxxx xxxx xxxxxxx xxxxxxxxxx a xxxxxxxxx xxxxxxxxxxxx činnosti xxxxxxxx komisí tak, xxx bylo možné xxxxxxxx klinické xxxxxxxxx xx území XX.
Xxxxx xxxxxxxx byla xxxxxxxxx x xxxxxxxxxxxxx důvodů: xxxxxxxxxxxx xxxxxxxxxx zajištění xxxxxxxx (při xxxxx xxxxxx členskému xxxxx, xxxxx xxxx xxxxxxxxx xxxx xxxxxxxxx xxxxx xx Xxxxxx xxxxx xxx xxxxxxxx léčiv, xx nejevilo jako xxxxxx ze xxxxxx xxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxx xx xxxxxxx xxxxxxxxxx xxxxxxxx, xxxxxx xxxxxx xx xxxxxxx xxxxxxxxx xxxx xxxxxxxx, xxxxxxx xx xx xxxx x xxxxxxx x xxxxxxxxxx xxxxxxxx č. 536/2014 x xxxxx xxxxxx xxx xxxxxxx xxxx), xxxxxxxx xxx nespolupráci ze xxxxxx xxxxxx komise x xxxxxxxxx xx xxxxxxxxxx xxxxxxx; xxxxxx xxx x volbě, xxxx etická xxxxxx xx xxxxxx komise xx xxxxx být xxxxxx xxx xxxx xxxxxxx z xxxxxxx xxxxx. xxxxxxxxxxxx xxxxxxx xxxxxxxx.
Xxxxx varianta byla xxxxxxxxx x xxxxxxxxxxxxx xxxxxx: vzhledem ke xxxxxxxxxxx, xx činnost xxxxxxxxxx fakult je xxxxxxx xx zdravotnickými xxxxxxxxxx x xxxxxxxxxx xxxxxxxxxx xxxx xxxxxxx xxxxxx xxxxxxxxxxxxxx xxxxxxxx, xxxx i zkoušejícími, xxx x tento xxxxx xxxxxxxx.
Xxxxx varianta xxxx zamítnuta z xxxxxxxxxxxxx důvodů: Xxxxxxxxx xxxx xxxxxxxxxxx byla xxxxx xxx x xxxxxxxx letech, ale xxxxx xxxxxx x xxxxx xxxxxxx. Xxxxxxx xxxxx nemají xxxxxxxxxx x xxxx oblasti, xxxxxxxx zajištění by xxxxxx možné x xxxxxxxx za xxxxxxxx xxxxxxxxx, xxx Státní xxxxx xxx xxxxxxxx xxxxx xx xxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxx.
Xxxxxx varianta xxxx zamítnuta x xxxxxxxxxxxxx xxxxxx: Zřízení xxxxxx xxxxxx jako xxxxxxxxxxx složky Ministerstva xxxxxxxxxxxxx xxxxxx xxxxxxx x xxxxxx požadavku xx nové pracovní xxxxxx a xxxxxxxxx xxxxxxxxxx krytí nových xxxxxx a xxxxxxxx xxxxxx xxxxxx.
Xxxx xxxxxxxxxxxx xxxx xxxxx xxxxxxx xxxx xxxxxxxx x xxxxxxxxxxxxx důvodů: Xxxxx xxxxxxx xxxxxx xxxxxx/xxxxxxxx xxxxxx xxxx poradního xxxxxx Státního xxxxxx xxx xxxxxxxx xxxxx xxxxxxxxx xxxxxxxxx x xxxxxxxxxxxxx xxxxxx - xxxxxxx xxxxxxxxxx zajištění xxxxxxxxxxx technického xxxxxxxxxxx xxxxxxxx xxxxxx komise x vybraných xxxxxx xxxxxx, xxxxxx xxx xxxxxxx krytí xxxxxxxxxx xxxxxxxxx xx xxxx xxxxxx xxx koordinátory xxxxxx xxxxxx/xxxxxxxx xxxxxx x xxxxxx vedení. Xxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx přezkumu x xxxxxxxx xxxxxxxxxx x xxxxxx xxxxxxxxx xxxxxxxxxx xxxx. Xxxxxxx xxxxx xxxxxxx xx xxxxxxx Xxxxxxx a Jednacího xxxx, které budou xxxxxxxx x vydány Xxxxxxx ústavem xxx xxxxxxxx léčiv xx xx xxxxxxxxx Xxxxxxxxxxxxx xxxxxxxxxxxxx, xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxxx pracovníci Xxxxxxxx ústavu pro xxxxxxxx léčiv x xxxxxxx poradního xxxxxx xxx xxxx xxxxxxxxxxx xxxxxxxxxxxx. Xxxxxxxxx xxxxxxxxxxxx xxxxxxxxx x xxxxx xxxxxxxxx xxxxxx Xxxxxxxx xxxxxx xxxxxxxx, xxxxxxx xxxx např. Xxxxxx xxx xxxxxxx xxxxxxx xx.
Xxxx nejvhodnější alternativa xxxx xx xxxxxxx xxxx uvedeného xxxxxxx xxxxx xxxxxx komise x xxxxxxxx xxxxxxxxx xxxxxxx xxxx xxxxxxx xxxxx Státního xxxxxx xxx xxxxxxxx xxxxx.
Xxxxxx xxxxxx týkající xx xxxxxxx xxxx
Xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) č. 536/2014 xxxxxxxxx xxxxxx vytvoření x xxxxxxxx systému xxxxxxx xxxxxxxx škody způsobené xxxxxxxxx xxxxxxxxx x xxxxxxxxxxx s jejich xxxxxx xx xxxxxx xx území xxxxxx xxxxxxxxx xxxxx v xxxxxxxxxx xxxxxx členského xxxxx x xxxxxxx xxxxx xxxxxxxx xxxx xxxxxxxxx, xxxxxx nebo xxxxxxx xxxxxx. X xxxxxxxx době xx xxxxx zajištění náhrad xxxxx xxxxxxxxxx zadavatele x zkoušejícího zajištěné xxxxxxxxxxx. Zároveň xxxx xxxxx xxxxxxxxx x xxxxxxxxx xxxxxx občanského xxxxxxxx č. 89/2012 Sb. xxx xxxxxxx xxxxx xxxxxxxxx xxxx, xxxxx xx xxxxxxxx x současném xxxxx xxxxxx č. 378/2007 Xx., xxx xxxx případnou nemajetkovou xxxx. Při přípravě xxxxxx nového xxxxx xxxxxx xxxx xxxxxx xxxxxxx více xxxxxxxx xxxxxx xxxxxxx xxxx. Xxx xxxxxxxx návrhu xxxxxx bylo tedy xxxxxxxxx xxxxxxxxx, xxxx x úvahu xxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxx xxxxx xxxxxxxx, xxx xxxx funkční x xxxxxxxxx. Xxxxx byla xxxx xxxxxxxxxxxx xxxx xxxxxxxxxxx xx xxxxxxxx xxxxxxxxxx. Xxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxx xxxxx xxxx uvedeny níže x xxxxxxxx záměrem xxxx xxxxxxxx více xxxxxxxxxx, ze xxxxxxx xx xx xxxx xxxxxxxxx xxxxxx xxx xxxx nejpřijatelnější xx xxxxxxxxxxxxx.
Xxxxxxxx variant xxxxxxx xxxxxxx xxxxxxx xxxxx
Xxxxxxxx 1 = xxxxxx xxxxxxx xxxxx xxxxxxxxxxx x xxxxxxxxx xxxxxxxx xxxxxx
Xxxxxxxxxx xx byli xxxxxxx xxxxxxxx náhradu xxxxxxxx xxxxxxx škody xxxxxx xxxxxxxx xxxxxx.
Xxxxxxxx 2 = xxxxxx xxxxxxx škody spočívající x xxxxxxxx xxxxx xxx xxxxxxx xxxxx
Xxxxxxx xxxxx xx xxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxx xxxxxxxxxxxxxxx společností pro xxxxxxx xxxxx.
Xxxxxxxx 3 = systém xxxxxxx xxxxx xxxxxxxxxxx x xxxxxxxxx xxxxxxxxxx xxxxxxxxx
Xxxx xxxxxxxx xx xxxxxxxxx xx xxxxxxxxxx stavu. Xxxxxxx xx stanovení xxxxxxx xxxxxxxxxx xxxxxxxxxx xxx po xxxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxx xxx, hlavního xxxxxxxxxxxx x xxxxx xxxxxxxxxxxx, které by xxxxx plnění xx xxxx xxxxxxxx subjektům xxxxxxxxx v důsledku xxxxxx xxxxxx x xxxxxxxxx hodnocení xxx xxxx xxxxxxxxx.
Xxxxxxx a xxxxxxx pro xxxxxxxxxx xxxxxxx xxxxxxxx
Xxxxxxxx 1
Xxxx xxxxx z xxxxxx xxxx xxxxxxxxx xxxxxxxxx x xxxxxx xxxxxxxx xxxxxx, xxxxx xx xxxx xxx spojeno x xxxxxxx xxxxxxxxxx xxxxxxx pro xxxxxxxxxx. Xx provedení xxxxxxx xxxx xxxxxxxx xxxx xxx učinit xxxxx, xx xxxxx xxxxxxxx xx xxxxxxxx záruku xx xx xxx xxxxxxx klienty xxxxxxx xxxx ročních poplatků xx zajištění xxxxxxxxx, xxxxxxx xxx xxxxxx xxxx xx zadavatele xxxxxxxxxx hodnocení xxxxxxxxxxx xxxx vysokými jednorázovými xxxxxxx. Xxxxxxx xxx xx tento xxxxxxxx xxxx xxx xxxxxxxx xxx zadavatele xxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxx xxxxx xxxxxx, xxx x v xxxxxx xxxxxxxxx xx xx xxxx xxxxxxxx xxxxxxx xxxx xxxxxxxxxx xxxxx xxx xxxxxxxxx xxxxxxx xxxxx pojištěním. Xxx xxxxx xxxxxxxxxxx, xxxxx by xxxxxx xxxxxxxxx jako xxxxxxx xxxxxxx xxxxx, xx xxxxxx xxx xxxxxxx xxxxxxxx výše xxxxxxxx xxxxxx v hotovosti, x tyto xxxxxx xx xxxx xx xxxxx dobu realizace xxxxxxxxxx xxxxxxxxx xxx xxxxxxxxxx xxxxxxxxxxxx, xxx xx mohlo xxx xxxxxxxxx pro činnost xxxxxxxxxx. Xxxx xx xxxxxxx xxx xxxxx xxxxxxxx xxxxxxxxx, kde xx xxxxx zvolit xxxxxxxxx xxxxxxxxx xxxxxxx xxxxx xxxxxxxx xxxxxxx. Xxxxx xxxx xxxxxxxx xxxxxxx xxxxx xx xxxxxxx i xxxx xxxxxxxxxx x xxxxxxxx xxx Xxxxxx ústav xxx kontrolu xxxxx, xxxxx xx xxx xxxxx stranou, x xxx xx xxxx xxxxxxx xxxxxx a xxxxx xx xxxx xxxxxxxx do řešení xxxxxxxxxx odškodnění.
Varianta 2
Další xxxxxxxxxx variantou xxxxxxxxx xxxxxxxxx systému náhrady xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxx xxxxxxxx xxxxx xxxxxxxxxxxxxxx xxxxxxxxxxx xxx náhradu xxxxx. Xxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxxx xx xxxxxxxxxxx, xx xxxxxx xxxxxxxx xxxxxx xxxxx xxxxxxxx fond xxxxxxxx. Xxxx xxxxxxxx nemohla xxx tudíž xxxx xxxxxxxxxxxxxx x xxxx xxxxx xxx dále xxxxxxxxx.
Xxxxxxxx 3
Xxxxx zvažovanou xxxxxxxxx je xxxxxxxxx xxxxxxx povinnosti zadavatele xxx xx xxxxx xxxx xxxxxxxxx klinického xxxxxxxxx xxxxxxxx platné xxxxxxxxx xxx, xxxxxxxx xxxxxxxxxxxx x všech xxxxxxxxxxxx, xxxxx by xxxxx xxxxxx xx xxxx vzniklou subjektům xxxxxxxxx x důsledku xxxxxx xxxxxx x xxxxxxxxx xxxxxxxxx při xxxx provádění, xxx. xxxxxxxx platný xxxxxx xxxxxxxxxx. Xxxxxxx tohoto xxxxxxx xx možné xxxxxxxxx odškodnění xxxxxxxxxxx x xxx xxxxxxxxx xxxxx, kdy xx xxxxxx xxxxxxxx.
Xxxxxxxx xxxxxx xxxxxxx
Xxxx xxxxxx xxxxxxxxx xxxx zvolena xxxxxxxxxx x zajištění xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx x rámci xxxxxxxxxx hodnocení xxxxxxxxx xx xxxxxxx xxxx.
Xxxxxxxx 1 xxxx xxxxxxxxx, xxxxxxx xxxxxx xxxxxx xxxxxx proti stávající xxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxx. Systém náhrady xxxxx spočívající x xxxxxxxxx formou xxxxxxxx xxxxxx xx xxx xxxxx xxxxxxx xxxxx xxx xxxxxxxxxxxxxxxx (xxxxxxxxxxxxx) xxxxxxxx klinická hodnocení. X případě xxxxxxx xxxxxxxxxx xxxxxxxxxx (nízkobonitních) xx tato varianta xxxxx být i xxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxx xxxxxxx xxxxx. Varianta 2 xxxxxx x xxxxxxx xx nesouhlas xxxxxxxxx xxxxxxxx dále xxxxxxxxxxxxxx. Xxxx xxxxxxxxxxxx xxxx xxxxx zvolena xxxxxxxx 3, xxx xxxx xxxxxxx xxx xx xxxxxxxxx fungující xxxxx. Xxxx varianta založená xx xxxxxxx náhrady xxxxx xxxxxxxxx komerčním xxxxxxxxxx xx osvědčená x x xxxxxxxxxxx x xxx xxxxxxxx xxxxxxxxxx je xxxxxxxxxxxxxxxx.
Xxxxxx xxxxxx týkající se xxxxxxx škody xxxxxxxxx xxxxxxxxxxxx zadavateli
Pro nekomerční xxxxxxxxxx xx často xxxxxxx nemožnosti xxxxxxxxx xxxxxxxxxx hodnocení xxxxxxx xxxxxxxxxx pojištění, xxxxx xxxxxxxx xxxxxxxxx realizovaná x finančních zdrojů xxxxxxxx xxxxxxx xxxxxxx xx xxxxxxxxxxxx xxxxxxx xxxxxxxx povinné xxxxxxxxx. Xxxx xxxxxxxxx xx xxxx zákonnou xxxxxxxxx x xxx xxxx xxxxxxxxx xx nesmí xxxxxxxx xxxxxxxxx provádět. Xxxxxxxxxx zadavatelé xxx xxxxxxx finanční xxxxxx x xxxxxxxxx xxxxx xx z rozpočtu xxxxxxxxxxxxxx xxxxxxxx x x xxxxxxx, že xxxx peníze xxxxxxxxx, xxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxx.
Xxxxx se xxxxx x xxxxxxxxxx dílčí xxxxxxxx x rámci xxxxxxxxx nastavení xxxxxxx xxxxxxxxxx, xxx x xxxxxxx x xxxxxxxxxx xxxxxxxx byly zvažovány xxxxxxxx zajištění x xxx. nekomerčních xxxxxxxxxx. Xxxx xxxxxxxx xxxx xxxxxxxxx na xxxxxxx xxxxxxxxxxxxx xxxxxxxxxx skutečností: xxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx za pojistné xxxxx nízkointervenčních akademických xxxxxx xx xxxxxxxx xxxx 40 až 100 xxxxxx korunami xx xxx; x xxxxxxxxxx 10 letech xxxxx vznesen žádný xxxxxxxxx xx odškodnění x nekomerčního xxxxxxxxxx xxxxxxxxx; akademici xxxx xxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxx grantového xxxxxxxx, xx které xxxxxxxxx státní xxxxxxxxx xxxxxxxx xxxxxxx, přičemž xxx xxxxxx xxxxxxxxxxxx xxxxxxx grantového projektu xxxxx xxxxxxxx xxxxxxxxx. X takovém xxxxxxx xx řešitel grantu xxxxxxx, xxx získat xxxxxxxx zdroje xxx xxxxxxxxx xxxxxxxxx, které xx xxxxxxxx jako xxxxx z xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxx č. 378/2007 Sb., xx xxxxx xxxxxxxxxx xxxxxxxx.&xxxx; Xxx hledání xxxxxxxxxxxxxx xxxxxx xxxxxx xxxx xxxx xxxxx xxxxxxxxx xxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx x xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxx xx xxxxx ČR x používanými x xxxxxxx s xxxxxx xxxxx, xxx. xxxxx xxxxxxx údajů x xxxxxxxxx nebo dle xxxxx xxxxxxxxxxx xxx xxxxx xxxxxxx (xxxx. xxx xxxxxxxxxxx xxxxxxxx) xxxxxx xxxxxxx zajištění xxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx.
Xxxxxxxx xxxxxxx ohledně náhrady xxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx
Xxxxxxxx 1 = xxxxxxx škody xxxxxxxxx xxxxxx pro nekomerční xxxxxxxxxx
Xxxx by xxxxxx x xxxxxxx xxxxxxxxx xxxxx subjektu klinického xxxxxxxxx xxxx škodu xxxxx x xxxxxxxxxx xxxxxxxxxxx x xxxxxx xxxxx v xxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx.
Xxxxxxxx 2 = xxxxxxxxx fondu xxx xxxxxxxxxx subjekty x Xxxxxxxxxxxx xxxxxxxxxxxxx
Xxxx xxxxxxxx xx xxxx xxxxxx xxxxxxx zvažované xxxxxxxx zřízení xxxxx x xxxxxxxxx xxx xxxxxxxxxx xxxxxxxxxx.
Xxxxxxxx 3 = xxxxxxx zajistit xxxxxxxxx xxxxxxxxxxxxxxx pojištění xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx jeho xxxxxxxxx xxxxxxxx xxxxxxx použití xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxxxx.
Xxxxxxx x xxxxxxx xxx jednotlivé xxxxxxx xxxxxxxx
Xxxxxxxx 1
Přínosem xxxx xxxxxxxx by byla xxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxxxx x xxxxxxx xxxxxxxxxx xxxxxxxxxxxx xx xxxxxxxxx xx situace, xxx xxx xxxxxxxxxx xxx nebyl x xxxxxxxxxx letech xxxxxxxxxx xxxxxx, kdy xx xxxxxxx xxxxxx xxxxxxxxx xxxxx o odškodnění. Xxxxxxx by byly xxxxxxx s xxxxxxxx xxxxxx xxxx škodu x xxxxxxxx Ministerstva xxxxxxxxxxxxx.
Xxxxxxxx 2
Xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxx škody xxxxxxxxx subjektům hodnocení xxxx xxxxxxxx xxxxx xxx xxxxxxxxxx xxxxxxxx x Xxxxxxxxxxxx zdravotnictví. X xxxxxxx případě xx xxxxx měl xxxxx xxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxx fondu, xxxxxx xxxxxxxxxx xxxxxxxxxx, xxxxxx xxxxxxxxxx zaměstnanců xxxxx x x xxxxxxxxxx xxxx také xx, z jakých xxxxxx, x xxxx xxxx x x xxxxxx xxxxxxxxxxx by xxx xxxx xxxxxxxxx. X xxxxx xxxxxxxxxx xxxxxx xxxxxxxxx xxxxxx xx xxxxxx ministerstva, xxxxx by byly xxxxxxxxxx xxxxxxxxx xxxxxx xxxxxx vybrané xx xxxxxxx xxxxxx xx xxxxxxxxx klinických hodnocení. Xxxxxxxx x xxxxxx xxxxxxx xxxxxxxx xx xxxxxx xxxxx x xxxx xxxxxxx xxxx xxxx xxxxxx xxxxxxxxxxx xxxx neefektivní x xxxxxxxxx.
Xxxxxxxx 3
Třetí xxxxxxxxx xx pro xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxxxx zdravotních služeb, xxxxx xxxxxxxxx xxxxxxxx xxxxxxx použití xxxxxxxx xxxxxxxxx v rámci xxxxxxxxxx xxxxxxxxx. Nebude xxx xxxxxxxx k xxxxxxxxx xxxxxxxxx.
Xxxxxxxx xxxxxx xxxxxxx
Xxxx xxxxxx xxxxxxxxx xxxx xxxxxxx zohlednění xxxxx diskriminace xxxxxxxxxx xxxxxxxxxx.
Xxxx xxxxxxxxx xxxxxxxx 1 x 2 Xxxx xxxxxx xx xxxxx xxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxxx zadavatelů. Xxxxx by xxx xxxxxxxx xxxxxxxxx vznik xxxx xxxxxx xxxxxxxxxxxx. X xxxxxxx xx xxxx uvedené, xxxx xxxxxxx xxxxxxxx 3, xxxxx xxxxxxxxx xxxx xxxxx systém xxxxxxx xxxxx xxx nekomerční xxxxxxxxxx x nízkointervenčních xxxxxxxxxx xxxxxxxxx zajištění xxxxxxxxxx xxxxxxxx v xxxxx pojištění xxxxxxxx xxx xxxxxxxxxxxxx zdravotních xxxxxx, a event. xxxxxxxxx xxxxxxxxxx xxx xxxxxx xxxxxxxxxxxx, x xxxxxxx xxxxxxx xx xxxxx připojištění xxxxxx xxxxxxxxxx.
2.2. Xxxxxxxx xxxxxxxxx x omezení xxxxxxxxx xxxxxxxx přípravků
Článek 36 Xxxxxxx o xxxxxxxxx Xxxxxxxx unie xxxxxxx xxxxxx, xxx xxxxx xxxxx členské státy xxxxxxxx vnitrostátní opatření, xxxxx brání xxxxxxxxxxxxxx xxxxxxx. Xxxxxx x xxxxxx důvodů xx xxxxxxx xxxxxx x xxxxxx lidí. Xxxxxx xxx opatření na xxxxxxx čl. 81 xxxxxxxx 2001/83/XX xx měla xxx xxxxxxxxxx xx xxxxxxx ochrany xxxxxxxxx xxxxxx.
Xx účelem xxxxxxxxx xxxxxxxxxxx xxxxxxxx přípravků xxx xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx x xxxxxx ochrany xxxxxxxxx zdraví xxx xx xxxxx xxxxxxxx xxxxxxxx, xxxxx xx xxxxxxxxx reexporty xxxxx.
Xxxxxxxxxxx xxxxxx xxxxxxx xx xxxxxxxxxx xx xxxxxx xxxxx dotčených xxxxxxxx x xxxxx xx x xxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx.
Xxx hodnocení xxxxxxxx xxxxxxxxxx právní xxxxxx xxxx xxxxxxxxx xxxxxxx následující xxxxxxxx (xxxxx xxxxx xxx xxx považována xx xxxxxxxx) právní xxxxxx:
- xxxxxxxxxxx;
- transparentnost;
- přesnost;
- xxxxxxxxxxxx;
- xxxxxxxxxxxx;
- xxxxxxxxxx xxxxxxxx;
- pružnost;
- xxxxxxxxxx.
Xx xxxxxxxxxxx - právní xxxxxx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxx, xxxxx xxxxxx xx xxxxxxx xxxxxx xxxxxxxx přípravků xxxxxxxxxxx xxx poskytování xxxxxxxxx xxxx x Xxxxx xxxxxxxxx v xxxxxxx, xx xx xxxx x Xxxxx xxxxxxxxx xxxx xxxxxx jejich xxxxxxxxxx pro xxxxxxx xxxxxxxx a xxxx xxx xxxxxxxx xxxxxxxx xxxx a xxxxxxx xxxxxx x života xxxx. Xxxxxxxxxxx xxxxxx xxxxxx xxxxxxx ve xxxxxxxxx mechanismů xxx xxxxxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxx v Xxxxx xxxxxxxxx (xxxxxx xxxxx a xxxxxxxxx xxxxxxxx x postupu xxx xxxxxxxxxxxxx xxx), xxxx ve xxxxxxxxx xxxxxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxxxx léčivých přípravků xxx xxxxxxx xxxxxxxx x České xxxxxxxxx x xxxxxxx xx xxxxxxxxx xxxxxxxxxxx xxxxxx xx xxxxxxxx xxxxxxxxx xxxxxxxx. Úprava přitom xxxxxx xxx xx xxxxxx do členských xxxxx Xxxxxxxx unie, xxx xx xxxxxxx xxxx.
Xx xxxxxxxxxxxxxxx - xxxxxxxx systém je xxxxxxx xxx, xxx xxxx xxxxxxx xxxxxxxx x xx největší xxxxx xxxx schopny xxxxxxxxx xxxxxxx přijetí xxxxxxxx x xxxxxxx xxxx xxxxxxx na xxxx xxxxxxxxxx reagovat. Xxxxxxxxxxxxx xxxxxx xx xxxxxxxx xxx x xxxxxxx xxxxxxxxxxxx x xxxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx pro xxxxxxx pacientů v Xxxxx xxxxxxxxx, xxx x xxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxx. Xxxxxxx xxxxxxxx xxx xxxx xxxxxxxxxx xxxxxxx xxxxxx xxxxx xxxxxxxx xxxxxxxxx.
Xx xxxxxxxx - pro xxxxxxxx xxxxxxxxxxxxxxxx x xxx xxxxx xxxxxxxxxxx xxxxxxxx navrhovaného xxxxxxx xx praxe a xxxx xxxxxxx x xxxxxx právní xxxxxxx xxxxxxxx xxxxxxxxxx právní xxxxxx je xxxx xx xxxxxxxxxxxx a xxxxxxxxxxxxxxxxx xx xxxxxx xxxxx xx xxxxxxxxxxx xxxxxxxxxx dotčenému xxxxxxxx xxxxxxxxx.
Xx xxxxxxxxxxxx - xxxxxxxx x xxxxxx xxx vyhodnocování xxxxxxxx xxxxxxxx xxxxxxxx za xxxxxx xxxxxxx xxxxxxxxx xxxx xxxx x xxxxxxx xx xxxxxx xx xxxxxxx xxxxxx x xxxxxx lidí x x každém xxxxxxxxxx xxxxxxx xxxxxxx xxxxxx léčivých xxxxxxxxx xx xxxxxxxxxx xxxxxxxx xxxxxxxxxx opatření.
Ad xxxxxxxxxxxx - v xxxxxxx xx xxxxxxx přiměřenosti xxxxxx úpravy xx x důvodu splnění xxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxx dle xxxxx Xxxxxxxx xxxx xxxxxxx xxxxxxxx xxxxxxx xxxxxx pouze x xxxxxxxxx, xx xxxxxxx xx xxx prokazatelně xxxxxxx zájem xx xxxxxxx xxxxxx x xxxxxx xxxx. Xx xxxxxxx xxxxxxxxxxxx systému xxxxx dat a xxxxxx xxxxxxxxxxxxx xxxxx x zajištění předvídatelnosti xxxxxx xxxxxxxxxxxxx léčivých xxxxxxxxx pro xxxxxxx xxxxxxxx v Xxxxx xxxxxxxxx. Xxxxxxxxxx xxxxxx xxxxxx zavádí systém, xxxxx x xxxxxxxx xxxxxxxx reguluje pouze xxxxxxxx xxxx xxxx x xxxxxxx se xxx o plošné xxxx xxxxxxxxxx omezení. Xxxx tedy možné xxxxxxxxxxx xxxxxx se xxxxxxx xxxxxxx xxxxxx xxxxx. Xxxxxxxx je xxxxxxxx xxxxx xx xx xxxxxxx, kdy xxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxxxxxxx velmi xxxxxxxxxx xxx xxxxxxx xxxxxxxxx xxxx u pacientů x Xxxxx xxxxxxxxx. Xxxxx dopad xxxxxxxx xx xxxx významně xxxxxxxxx xxx, xx xx xxxx xxxxxxx xxxxxxx xxxxx na xxxxxx xxxxxxxxx, xxxxx xxxx xxxxxxxxxxxx xxxxxxxxxxxxxx. Xxxxxxxxx xxxxxx xxx xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxxxx opatření, x xx xxxxxxx xxx xxxxxxx akutní nedostupnosti xxxxxxxx xxxxxxxxx xxx xxxxxxx pacientů v Xxxxx xxxxxxxxx.
Xx ekonomická xxxxxxxx - xxxxxx xx xxxxxxx xx xxxxxxxx, xxxxx xxxxxxx xxx xxxxxxxx mechanismy xxxxxxx xxxxxxx x xxxxxxxxxxxx a postupů xxxxxxxxxxx k xxxxxx xxxxxxxxxx x xxxxxxx, x xxx xxxxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxx xxx orgány xxxxxxx xxxxxx. Xxxx xxxxxxx varianta jednoduchého x xxxxxxxxxxx xxxxxxx.
Xx xxxxxxxx - za xxxxxx xxxxxxxxx možnosti xxxxxx xxxxxx xx xxxxxxxxx nutnost xxxxx xxxxxx xxxxxx se xxxxxxxxxxx xxxxxxxx upravit xxxxxxxxxx právním xxxxxxxxx (xxxx. xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxx, nastavení xxxxxxxx, případně xxxxxxxx x rozsahu poskytovaných xxxxx x xxxxxxxxx).
Xx xxxxxxxxxx - za xxxxxx vynutitelnosti xxxxxxxxxxxx xxxxxxxx jsou stanoveny xxxxxxxxxxxx sankce x xxxxxxx porušení xxxxxxxxx xxxxxxxx. Xxxx xxxxxx xxxxxxxx xxxxxx výše, xxx x xxxx xxx xxxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxx.
Xxxxxxxxxxx úpravou xx řešena xxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx potřeby xxxxxxxx x Xxxxx xxxxxxxxx. Xxxxx xx xxxxx x výpadky xxxxxxxxxxx z xxxxxx xx xxxxxx xxxxxxxx xxxxxxxxxx o registraci, xxxx xxxx x xxxxxxxxxx §33 odst. 2 zákona x xxxxxxxx xxxxxxxxxx povinnost xxxxxx hlásit xxxxxxxxx xxxx ukončení xxxxxxx xx xxxxx trh xxxxxxx 2 xxxxxx xxxxxx.
Xxxxxxxxxxxx xxxxxxxxxxxxx léčivých xxxxxxxxx x reexportů xxxxx je aktuální xxxxxxx x Xxxxx xxxxxxxxx, xxx xxx xxxxxx XX. Xxxxx xxxxxxxxx léčiv xx xxxxxxxx xxxxxxx x x původně xxxxxxxx xxxxxxxxxxx xx xxxxx xxxxxxxxxx obchodní činnost. Xxxxxxxxxxx množství xxxxxxxxx xx v xxxxxxxx xxxxxxxxxx dostatečného xxxxxxxxxx xxxxxxxxxxxx trhů xxxxxxxxx xxxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxx na xxxxxxxxxxx xxxxxxxxxxx xxxxxx x Xxxxxx. X xxxxxxxx důsledku může xxxxx x xxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxx xxxxxxx xx xxxxxx x xxxxx xxxxxx xxxxxxxx přípravků xxxx x zavádění xxxxxxxxxxxx xxxxx xx xxxx x nižšími cenami xxxxxxxx xxxxxxxxx se xxxxxxxxx. Ukazuje se, xx jednotný vnitřní xxx s xxxxxxxx xxxxxxxxx xx xxx xxxxxxxxx do značné xxxx ovlivněná způsobem xxxxxxxxxxx xxx xxxxxxxx xxxxxxxxx x xxxx xxxxx z xxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxx xxxxxx. Xx xxxxxxx, xxx x nadále xx xxxxxxxx trh x xxxxxx ku xxxxxxxxx xxxxxxxx a xxxxxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxx a zda xxxxxxxx x principy xxxxxxxx xxxxxxxxxx trhu x xxxxxxx léčivých xxxxxxxxx xxxxx xxx xxxxx xxxxxxxx.
Xxxxxxxx x xxxxxx reexportů xxxxxxx xxx xxxxx hlášených xxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx přípravků x xxxxxxxxxxxx státech XX. Xxxx xx stále xxxxxxx xxxxxxxx xxxxxxx x xxxxxxxxxxxxx konkrétních xxxxxxxx přípravků ve xxxx xxxxxx XX xxxxxxxx, xxx xxxx x xxxxx xxxxxxxxxx xxxxx na vývoz xxxxxxxx přípravků xx xxxx x xxxxxxxxxxx xxxxxxx xxxxxxxx. V xxxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxx stav xxxxx xxxxxx xxxxxxxx a xxxx xxxxxxxxxxx xxxxx. Xxxxx v xxxxxxxxx, xxx xxxxx xxxxxx xxxxxxxxxxxx xxxxxxxx přípravků xxx xxxxxxx xxxxxxxx x České xxxxxxxxx (xxxxx se tak xxxxx xxxxxx xxxxxxxxx, xxx xxxxxxxxxxxx xxxxxx xxx. xxxxx xxxxxxxxx xxxxxxxxx ohledně xxxxxxxx xxxxxxxxx Xxxxxxx, Xxxxxxxx x XxxxxxxXxxxxxx), xx xx účelem naplnění xxxxxxxx xxxxxx xxxxx xxxxxxxxxxxx ochranu xxxxxx x xxxxxx xxxx xxxxxxxx nutné xxxxxxxx xxxxxxxxx opatření v xxxxxxx xxx x xxxxxxxxx xxxxxxxx xxxxxxxx, xxx se závazky xxxxxxxxxxxxx z xxxxxxxxxxxxx xxxxx.
Xxxxxxx xxxxxxx přitom xxxx xxxxxxxxx změnou xxxxxx a xxxxxxxxx xxxxxx x úhradové xxxxxxxx léčivých přípravků xxxxxxxxx x toho xxxxxx, xx xx xx xx tato xxxxxxxx jakákoli, u xxxxxxxx xxxxxxxxx, stejně xxxx x dalších xxxxxxx, xxxx xxx xxxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxx xxx xxxxxxxxxxx xxxxxxx na xxx xx xxxxxxxxxxxx ekonomikách xxx x ekonomikách xxxx vyspělých. Xx xx xxxx xxxxxxx xxxxx xxxxx sílou xxxxxxxxxxxx v xxxxxx xxxxxxxxxx vyspělejších xxxxxx, xxx xx stejnou xxx xxxx xxxx xxxxxxxxx zpravidla xxxxxxx x také schopni xxxxx vyšší xxxxx xxxxxxxxxx xxxxxxxxxx, x x xxxx xxxxxxxxxxx xxx xxxxxxxxx xxxxxxx x xxxxxxx xxxxx xxxxxxxxxxxxxxxx xxxxxxxx, včetně xxxxxxxx regulátorů, xxxxxxx, xxxxxxxxxxxx i xxxxxxxxxxx xxxxxxxxxx. Xxxx xxxxxxxxxx xxxxxx a xxxxxxxx xxxxxxxx xxx x xxxxxx xxxx xxxxxxx xxx xxxxx xxxx xx xxxxxxxx x xxxxxxxxxxx léčivých xxxxxxxxx xxxxxxxxxx z xxxxxx xxxxx x xxxxxxx, xx xxxxxx xxx x xxxxxxxxx xxxxxx xxxxx x xxxxx xxxx nutno xxxxx. Xxxxx prostředky cenové x úhradové xxxxxxxx xxxxx xxx xxxxx xx x xxxxxxxxxxxxxx xxxxxxx horizontu, xxxxxxx xxxxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxx pacientů x Xxxxx republice xxxxxxxxx léčivým přípravkem xxxx xxxxxx velice xxxxxx a je xxxxx xxx řešit xxxxxxxxxx. K uvedenému xx xxxx xxxxx xxxxxxxxxx, xx xxxxxxxxxxxxx xxxxxxx xxxxxxxxxxxxx dostupnost xxxxxxxx xxxxxxxxx xxx xxxxxxxx x České xxxxxxxxx je xxxxxxxxx x taktéž se x jeho rámci xxxxxxx účinnost cenové x xxxxxxxx regulace xxxxxx léčivého xxxxxxxxx.
Xxxxxxxxxxxxx xxxxxxxxxxxxx řešením xx xxxxxxxx právní xxxxxx xxxxxxx xxxxxxxxx xxxxx xx xxxxxx o xxxxxxxx, který komplexně xxxxxxxx problematiku xxxxx x xxx xxxxxxxxxxxx xxxxxxxxx jejich xxxxxxxxxxx. Xxxxxxxxxx a odpovědnost xxxx xxxxxxxxxxxxx x xxxxxx i xxxxxxxxxxx xxxxxxxxx xxxxxx xxxxxx xx cíl xxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx x Xxxxx xxxxxxxxx jsou x zákoně o xxxxxxxx xxx částečně xxxxxxxx, xxxxxxxxx zkušenosti x xxxxxxxx stávající xxxxxx xxxxxx a xxxx nedostatečné vymahatelnosti xxxx xxxx odůvodňují xxxxxxx jejího zpřísnění x xxxxxxxx.
Xxxxxxxxx xxxxxx x xxxxxxx xx xxxxxxxxx xxx xx xxxxxxxxxxxx xxxxxxxxx z xxxx důvodu, že xxxxxxxxx xxxxxx xxxxxxxxxxxxxxxx xxxxxxx pro xxxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxx provozovatele xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx. Xxxxxxxxx xxxxxxxxxx §11 xxxx. h) xxxxxx xxxx xxxxxxxxxxx určitý xxxxxxx k řešení xxxxxxx, kdy nadměrná xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxx xxxxxxx snahou xxxxxxxxx xxxxxxx xxxxx xxxxxxx xxxxxxxx xxxxxx pacientů x Xxxxx republice, x xxxxxx tohoto xxxxxxxx bylo x xxxxxxxxxxx xxxxxxxxx z xxxxxx nedostatku jiných xxxxxxxx xxx xxxxxxx, xxxxx nejde o xxxxxxx, xxxxx xx xxx založen xxxxxxx xxxxxxxxx x se xxxxxxxxxxx xxxxx rozhodných xxxxxxx a xxxxxxxxxxxxx xxxxxxxx xxxxxx a xxxxxxxxx očekávání xxxxx xxxxxxxxxxxxxxxx subjektů.
K xxxxxxxxx xxxxxxxxxxx léčivých xxxxxxxxx xxx xxxxxxxx x Xxxxx xxxxxxxxx xx xxxxxxxx xxxxxxxx xxxxxx xxxxxxx xxxxxxxx provázaných xxxxx a xxxxxxxx, xxxxx xx svém xxxxxxx vytvoří xxxxx, xxxxx xx vhodný, xxxxxxxx a přiměřený x xxxxxxx na xxxxxxxxx cíl, xxxxxx xx xxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxxx v Xxxxx xxxxxxxxx.
Xxxxxxxxxx režim xxxxxxx x podstatě xx xxx vzájemně xxxxxxxxxxx xxxxx a xxxxxxxx. Xxxxxx z xxxx xx xxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxxxxxx. K xxxxxxxxx xxxxxx seznamu xxxxx xxxxxxx xxxxxxxx x xxxxxxxxxx, xxxxxx x xxxxxxxx xxxxxxxx xxxxxxxxx. Xxxxxxxxx x xxxxxxxxxx xxxxxx seznamu xxxx xxxxxxxx xxxxxx xxxxxx opatření obecné xxxxxx Xxxxxxxxxxxxx zdravotnictví, xxxx bude zajištěno, xx všechny xx xxxx zainteresované xxxxx xxxxx xxxx využít xxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxx. Xxxxxxxxxx xxxxxx xxxxxxx bude xxxxxxxx ke xxxxxxxxxx xxxxxx xxxxx zainteresovaných xxxx xxxx xxxxxxx xxxxxxxxxx zařazeným na xxxxx xxxxxxx, xxxxxx xxxx, xx xx xxxxxx xxxxxxxxxxxx měli xxxxxxx s xxx, xx xx může xxxx, xx xxxxxxxxxx xxxxxxxxx z těchto xxxxxxxxx xx xxxxxxxxx xxxx být xxxxxxxxx xxxxxxx nebo xxxxxxxx. X xxxxxxx xx xxxx znalost xxxx xxxxx xxxxxxxxxxx xxxxxxx xxxxx xxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx do xxxxxxxxx xx xxxxxx xxxxxxx distribuci. Měl xx xxxxx xxx xx paměti, že xxxx xxxxxxxx povinností xx xxxxxxxx xxx xxxxxxx xxxxxx přípravky, xxxxxxx je distributorem, xxxxxxx xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxx přípravky x množství x xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxx xxxxxxxx v Xxxxx xxxxxxxxx. Xxxxxx x těchto kroků x xxxxxxxx xx xxx xxxxxxx zákonem xxxxxxxxxxx podmínek xxxxxxx xxxxxxxxxxxx podnětu Ústavu Xxxxxxxxxxxx zdravotnictví k xxxx, xxx xxxxxx xxxxxxxx xxxxxx xxxxxx, xxxxxx xx xxxxxxx xx xxxxxxxx xxxxxxxxxx xxxxxxxx přípravku xx xxxxxxxxx, xxxxxxx tento xxxxxx může, xxx x xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx. Třetím, x to xxx xxxxxxxxxxx xxxxxx a xxxxxxxxx xx vydání xxxxxxxx xxxxxx xxxxxx, xxxxxx xxx splnění xxxxxxx xxxxxxxxxxx podmínek Xxxxxxxxxxxx xxxxxxxxxxxxx omezí xxxx zakáže xxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xx zahraničí. Při xxxxxxxx xxxxxxxx opatření xxxx opět xxxxxxxxx, xx xxxxxxx osoby xxxxx xxxx xxxxxx xxx oprávnění xxxxxxxxx xxxxxxxx xxxxx.
Xxxxxxxxxx xxxxx xx tedy vhodný, xxxxxxxx x přiměřený x ohledem na xxxxxxxxx cíl, xxxxxxx x xxxx rámci xx zachovávají oprávnění xxxxxxxxxxxxxxxx osob xx x xxxxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxx x xxx xxxxxxxxxx x xxxxxxx xx xxxxxxxxx, xx xxxxxxx xxxxxxxx nebudou xxx xx xxxxx x xxxxxxxxxx. Xxxxxxxxx cíl xx přitom zajišťuje xxxxxxxx xxxxxxxxxx, které xxxx x uskutečňování xxxxxxxxxx maximálně xxxxxx x xxxxxxxx xxxxxxxxx x xxxxxxx xxxx xxxxxx distribuce jen x xxx skutečně xxxxxxxxx xxxxxxx, kdy xxxx x xxxxx xxxxxxxxxxx opatření xxx xxxxxxx xxx xxxxxx x postrádala xx xxx xxxxx. Xxx xxxx soudit, xx xxxxxxxxxx úprava, xxxxx xx xxxxxxx xxxxx x xxxx vkládaná xxxxxxxxxx §77c x §77d xx xxxxxx, xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx pro xxxxxxxx x Xxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxx a xxxxxx bude xxxxxxxxxxxxx x pro xxxxxxx xxxxxxxxxxxx.
Xxxxxxxx xxxxxxx řešení xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxx xxxxxxxxx
Xxxxxxxx 1 = xxxxxx
Xxxxxxx variantou xx xxxxxx nepředložení xxxxxx xxxxxx xxxxxx o xxxxxxxx řešícího xxxxxxx xxxxxxxxx léčivých xxxxxxxxx.
Xxxxxxxx 2 = xxxxx xxxxxxxxxxxx úpravy (xxxxxx x xxxxxxxx)
Xxxxxxxx xxxxxxxxxxx xxxxxxxxxxx opatření.
Náklady x xxxxxxx pro xxxxxxxxxx xxxxxxx xxxxxxxx
Xxxxxxxx 1
Nepředložení xxxxxx bude znamenat xxxxxxxxx současného xxxxx, xxx xx xxxxxxxxx xxxxxxx, že je xx trhu nedostupný xxxxxxxx xxxxxx přípravek x xx xxx xxxxxxxx xxxxxx xxxxxxxx x XX. X xxxxxxxxx xxxxxx xxxx xxxxxxxx x xxxxxxx xxxxxxxxx náklady, které xx xxxxx xxxxxx xxxxx vynaložit, xxxxx xx na xxxx xxxx xxxxxxxx xxxxxxxx xxxxxx přípravky (léčba xxxxxxxxx komplikací xxx.). Xxxxxxxx xxxx plné xxxxxxxx volného xxxxxx xxxxx, xxxxx xx xxxx xxxxxx xxxxxxxx x ČR.
Varianta 2
Xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxx by xxxx xxxxx navrhnout x x konečném xxxxxxxx xxxxxx xxxxxx xxxxxx, xxxxx xx xxxxxxxxx xxxxx xx xxxxxxx xxxxxx xxxxxxxx xx xxxxxx xxxxxxxxxxxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxx xxxxxxxxxxxxxxx příležitostí. Xxxx vyvažování zájmů xx xxxx xxxxxxxxx xxxx x xxxxxxx x xxxxxx EU, xxxxx xxxxxxxx xxxxxx xxxxx pohyb zboží xx xxxxxx ochrany xxxxxxxxx xxxxxx.
Xxxxxxxx xxxxxx xxxxxxx
Xxxx xxxxxx xxxxxxxxx xxxx zvoleno zajištění xxxxxxx xxxxxxxxx xxxxxx x souladu s xxxxxx EU.
Varianta 1 xxxx zamítnuta s xxxxxxx xx xxxxxx xxxxxxx řešit xxxxx xxxxxxx (vyskytující xx xxxxxxx xxxxxxxxxxxxx léčivých xxxxxxxxx x xxxxxx xxxxxx reexportů). Xxxxxxxxx xxxxxxxxxxx jej xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx. Xxx zachování současné xxxxxx xxxxxx x xxxxxx x xxxxxxxx xx x Xxxxx xxxxxxxxx nemohlo xxxxx x nápravě současného xxxxx, xxx xxxxx xxx některé xxxxxxxx xxxxxx xxxxxxxxx xxx xxxxxxxx v Xxxxx xxxxxxxxx nečekaně xxxxxxxxxx x není tak x potřebném rozsahu xxxxxxxxx ochrana xxxxxx xxxxxx a xxxxxx, xxxxxxx xxxxxx státní xxxxxx xxxxxxx x xxxxxx xxxxxxxxxx validních xxxxxxxxx a xxxxxxxxxx xxxxxx xxxxxxxx, xxxxx xx x dostatečným xxxxxxxxxx mohla zabránit xxxxxx xxxxxx situace. Xxxx xxx xxxxxxx xxxxxxxx xxxxx 2, xxxxx xxxxxxx přijetí xxxxxx právní úpravy xxxxxxxxxx definovaný xxxxxxx.
Xxxxxx xxxxxxxxxxxx xxxxxx akutní xxxxxxxxxxxxx a xxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx
X xxxxx xxxxxxxxx xxxxxxx xxxxxxxx xxxx přihlíženo xxx x xxxxx xxxxxxxxxxxx xxxxxxxxx států, xxxxx postupně xxxxxxxx xxxxxxx xxxxx xxxxx xxxxxx xxxxxxxx xxxxxxx xxxxxxxxx na xxxxxxx č. 81 xxxx. 2 Xxxxxxxx č. 2001/83 (xxxx. Bulharsko, Estonsko, Xxxxxxxxx a xxxxx) x xxx xxxxxx xxxxxxxxxx xxxx xxxxxxx xxxxxxxxxx xxxxxxxx řešení.
Definice xxxxxxx xxxxxxx
Xxxxxxxx 1= xxxxxx varianta (xxxxxxxxx xxxx)
Xxxxxxxx 2 = xxxxxxxxx xxxxxxxxxx zajistit xxxxxxx xx xxx xxxxxxxxx xxxxxxxxxx x xxxxxxxxxx
Xxxxxxxx 3 = xxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxx xxxxx xxxxxx
Xxxxxxxx 4 = xxxxxxxx povinnosti distributorů xxxxxxx pouze některých xxxxxx
Xxxxxxxx 5 = xxxxxxx souhlasu xxxxxxxxxxxx xx držitele xxxxxxxxxx x registraci
Náklady x xxxxxxx pro xxxxxxxxxx xxxxxxx xxxxxxxx
Xxxxxxxx 1
Xxxxxxxxxxxx xxxxxx bude xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxx, xxx xx xxxxxxxxx xxxxxxx, xx je xx xxxx xxxxxxxxxx xxxxxxxx léčivý xxxxxxxxx x je xxx xxxxxxxx xxxxxx xxxxxxxx x XX. S xxxxxxxxx zdraví xxxx xxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxx, xxxxx xx xxxxx xxxxxx xxxxx xxxxxxxxx, xxxxx xx xx xxxx xxxx dostupné potřebné xxxxxx xxxxxxxxx (xxxxx xxxxxxxxx xxxxxxxxxx xxx.). Xxxxxxxx xxxx plné xxxxxxxx xxxxxxx xxxxxx xxxxx, xxxxx na xxxx xxxxxx xxxxxxxx x XX.
Xxxxxxxx 2
Xxxxxxxxxxxxx xxx a xxxxxxxx xxxxxxxx xxxxxxxxx na xxxxxxxxxx xxxx x xxxxxxxxx členských států xx xx xxx xxxxxx xxxxx provázaným xxxxxxxx jednotlivých vztahů, xxx xxxxx xx xxxxx xx podílí xxxxxxx xxxxxxxx (výroba, xxxxxxxxxx, xxxxx v xxxxxxx) a zároveň xxxxxxxxxxxx xxxx xxx xxxxxxxxxx zájmy. Xxxxxxxxxxx xxxxxxxxxxxx činností xx xxxxxx rozloženo mezi xxxxxxxxxx subjekty xxx, xxx xxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx celého xxxxxxx. X ohledem xx vědecký pokrok x neustálé xxxxxxxxx xxxxxx výzkumného bádání xx xxxxxxxxx i xxxxxxx xxxxxxxxxxx xx xxxxx jednoho xxxxxxxx xxxxxxxxx. Xxxxxxxxx xxxxx xx farmaceutického xxxx xx úkor xxxxxxx xx xxxxxxx subjektu xx xxxxxx xxxx xxx x xxxxxxxx xxxxxxxx též xxxxx xx prostředky xxxxxxxxxxx xx výzkum xxxxx x xx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxxxxx xxxxxx. Zavedení xxxxxxxxxx xxxxxxxx zajistit xxxxxxx xx xxx xx x xxxxxxxx xxxxxxxx mohlo xxxxxxxx xxxxxxxxx systému, xx xxxxxx by tito xxxxxxxxxx distributory pro xxxxx vývozu xx xxxx trhy. Zavedení xxxxxx povinnosti by xxxxx xxxxxxxx xxxxxxx xxxxxxx, xxxxxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxxxx 3
Nevýhodou xx xxxxxxxx administrativní xxxxx xx xxxxxxx, xxx xxxxxxxxxxxx xxxxx veškeré xxxxxx po jejich xxxxxxxxxxx. Xxxxxxxx xx xxx docházelo xx xxxxxxxx xxxxxxxx xxxxxxxxxx. Xxxxxx xx xxxxxx xxxxxxxxxxxxxx s xxxxxxx xx xxxxxxxxxx cíl.
Varianta 4
Xxxxxxxx povinnost by xxxx xxxxxxxxxxx xxxxxx xxx, xxx mohlo xxx xxxxxxxx reexportů xxxxxxxxx pouze x xxxxxxx hrozby akutní xxxxxxxxxxxxx. Varianta xxxx xxxxxxxxxxx xxxxxxxxxx systémem xx Xxxxxxxxx, kdy xxx xxxxxxxxxx xxxxxxxxx xxx bylo xxxxxx x XX, xxx xx xxxxxxxx regulace xxxxxxxxxxxxxxxx. Xxxxxxx xxxxxxxxx xxxxxxxxx xxxxx v xxxxxxx xxxxxxxxxxxx léčivých xxxxxxxxx, xxxxx xxxx xxx xxxxxxxxxxx zdravotní xxxx xxxxxxxx, je xxxx přiměřenost x xxxxxxxxxx, xx xxxxxxxx xxxxxxxxxxxx cíle (ochrana xxxxxxxxx xxxxxx).
Xxxxxxxx 5
Xxxx xxxxxxxx xxxx xxxxxxxxx x xxxxxxx na xxxxxxxx informace xxxxxxx xxxxxxxxxxxx xxxxxxxx x Xxxxxxxx. Xxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxxxx xx xxxxxxxx xx xxxx xxxxxxxxx řešení xxxxxx xxxxxxxxxx ekonomických xxxxxx x xxxxx xx xxxxxx xxxxxxxxx xxxxxxxx. Xxxxxxxxx xx byla xxxxxxxxx státu účinně xxxxxxxxx x případě xxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxxxx výběru xxxxxxx
Xxxx xxxxxx xxxxxxxxx xxxx xxxxxxx efektivita x xxxxxxxx navrhovaného xxxxxxx.
Xxxxxxxx 1 byla xxxxxxxxx x ohledem xx nutnost xxxxxx xxxxx xxxxxxxxxx xxxxxxx, xxx bylo xxxxxxx xxx xxxx. Xxxxxxxx 2 xxxx xxxxxxxxx x xxxxxxx xx xx, xx xx xxxxxxxx xxxxxxxxxx xxxxxxx. Xxxxxxxx 3 xxxx xxxxxxxxx z důvodu xxxxxxxxxxxxxx a duplicity xxxxxxxxxx. Xxxxxxxx 5 xxxx xxxxxxxxx x xxxxxxx xx xx, xx xx neřešila xxxxxxxxxx xxxxxxx. Xxxx xxxxxxxxxxxx byla xxxxxxx xxxxxxxx, xxx xxxxx xx xxxxxxxxxxxx hlásili xxxxxxxxx vývoz pouze x případech, xxx xx x xxxxxxxx xxxxxxxxx hrozila xxxxxx xxxxxxxxxxxx xxxxxxxx přípravků xxxxxxxxxx xxx poskytování xxxxxxxxxxx xxxxxx.
Xxxxxx xxxxx xxxxxxx reexportů
Při xxxxxxxxx xxxxxxx xxxxx xxxxxxxx xxxx (xxxxx xxxxxx xxxxxxxx) vycházeno x xxxxxxxx xxxxx xxxxxxxx xxxx XX:
- xxxxxxxxxxxx xxxxxxx akty (xxxxxxxxxx x xxxxxxxxx xxxx xxxx xxxxxxxxxxx xxxxxxxxxx);
- xxxxxxxx xxxxxx povahy (xxxxxxxx x xxxxxxxxx xxxx xxxx neomezenému xxxxxx xxxxxxxx);
- xxxxxxxx (xxxxxxxxxx právní xxx).
Xxxxxxxx xxxxxxx xxxxxxxx xxxxx xxxxxxx reexportů
Varianta 1 = xxxxxx xxxxxxxx (xxxxxxxxx xxxx)
Xxxxxxxx 2 = xxxxxxxxxxxx xxxxxxx xxxx
Xxxxxxxx 3 = xxxxxxxx xxxxxx xxxxxx
Xxxxxxxx 4 = xxxxxxxx
Xxxxxxx x přínosy xxx xxxxxxxxxx xxxxxxx xxxxxxxx
Xxxxxxxx 1
Xxxxxxxxxxxx xxxxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxx, xxx xx xxxxxxxxx situace, xx xx xx xxxx xxxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxx x xx xxx ohroženo xxxxxx xxxxxxxx x XX. X ohrožením zdraví xxxx souviset x xxxxxxx vynaložit xxxxxxx, xxxxx xx xxxxx xxxxxx nutné xxxxxxxxx, xxxxx xx na xxxx byly xxxxxxxx xxxxxxxx xxxxxx xxxxxxxxx (xxxxx xxxxxxxxx xxxxxxxxxx xxx.). Přínosem bude xxxx umožnění xxxxxxx xxxxxx zboží, xxxxx xx xxxx xxxxxx xxxxxxxx x XX.
Xxxxxxxx 2
Xxxxx by xxxxxxxxx xxxx xxx omezovány xxxxxx xxxxxxxxxxxxxx správních xxxx xxxxxxxxxx xx xxxxxxxx xxxxxx, toto xx xxxxxxxxx dodržovat xxxxxxxxx xxxxxxxxx řádu. Xxxxxxx řízení xxxxxx xxxxxxx xxxxxx xxxxxxx, xxxxxxx xxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxx x xxxxxxx xx riziko xxxxxxxx xxxxxx x xxxxxx xxxxx xxxxxx.
Xxxxxxxxxxxx xxxxxxx xxxx xxxxxxx rozhodnutí xxxxxxxx konkrétního xxxxxxxxx xxxxxx v konkrétní xxxx. Xxxxx xxxxxxxx xxxxxxxxxxxx xx xx xxxxxxxxxxx je xxxxxx xxxxx, xxxxx xxxxxx xxxxxxxxx xx xxxxxxxx xxxxxxxxx xxxxx počet (xxxxx xx každá xxxxxxx získala distribuční xxxxxxxxx), pohyboval xx xx xxxxx 2500. X tohoto xxxxxx xx bylo xxxxxxx xxxxxx xxxxxxxxxxxxxxx xxxxxxx x xxxxxx by x potřebném xxxx xxxxxxx xxxxxxxxxx x xxxxx xxxx xxxxxxx x xxxx xxxx.
Xxxxxxxx 3
Xxxxxxxx obecné xxxxxx xx xxxxxx nástroj xxx xxxxxxxx xxxxxxxxxxx xxxxx xxxxxxxx x xxxxxxxxx věci. X xxxxxx xxxxxxxx, xxx xxx xxxxxxxxxxxx xxxxx xxxxx omezených xxxxxxxx, xx xxxx xxxx xxxxxx. Xxxxxxxxx xxxxxxxxx xxxx (xxxxx či xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx) je xxx splněno. Xxx xxxxxx upravit xxxxxxxxx xxxxxxxxx proces xxxxxx xxxxxxxxx řádu xxx, xxx xxxxxx xxxxxxxxx xxxxxxx x xxxxxxx xxxxxx xxxxxx xxxxxxxxxxxxx xx xxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxxxx xx xxxxxxx.
Xxxxxxxx 4
Vydávání xxxxxxxx xxxxxxxx xx xxxxxx a (xxxxxx xxxxxx xxx xxxxxxxxx xxxx x xxxxxxxx) xxxxxxx xxxxxx, xxx xx výraznou nevýhodou, xxxxx xx být xxxxxxxxxx xxxxxx xxxxxxxxxxxx. Xxxxxxxx xxxxxxxx xxxxxxxx xx xxxxx nepružné. Xxxxxxx je xxxxxx xxxxxxxxx a xxxxxxx xxxxxxxxx xxxxxxx xxxxxxx xxxxxxxx jedním předpisem.
Kritéria xxxxxx variant
Jako xxxxxx xxxxxxxxx xxxx xxxxxxx xxxxxxxxxx (administrativní x xxxxxx) xxxxxxxxxxxx xxxxxxx.
Xxxxxxxx xxxxx 1 (xxx. xxxxxx xxxxxxxx) xxxx xxxxxxxxx s xxxxxxx xx akutní xxxxxxx xxxxx xxxxx xxxxxxx. Xxxxxxxxx xxxxxxxxxxx xxx xxxxxxxxxx xxxxxxxxxx komplexně xxxxx. Nejsou xxxxxxxxxx xxxxxx vymezeny příslušné xxxxxxx při xxxxxxxxx xxxxxxxxx. Varianta xxxxx 2, xxx xx xxxxxxxxx xxxx v xxxxxxxx důsledku omezovány xxxxxx xxxxxxxxxxxxxx správních xxxx, xxxx xxxxxxxxx x xxxxxxx xx xxxxxxxxxxxxxxx a xxxxxxx xxxxxxxxx xxxxxx xxxxxxx. Xxxxxxxx xxxxx 4 (xxxxxxxx právních předpisů) xx opět xxxxxx x xxxxxxxxxxxxxxx (xxxxx x finančně) xxxxxxx xxxxxx, xxxxx xxxxx xxxxx z xxxxxx xxxxxxxx xxxxx xxxxxxxxx xxxxxx použít.
Jako nejvhodnější xxxx xxxxx xxxxxxx xxxxxxxx xxxxx 3 (xxxxxxxx obecné povahy), xxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxx x x porovnání x xxxxxxxxx xxxxxxx regulace xxxxxxx xxxxxxxxxxxxxxxx časovou x xxxxxxxxxxxxxxx xxxxx xxx xxxxx navrhované xxxxxxxx.
Xxxxxxxx xxxxxxxxx xxxxxxx xx procesu xxxxxxxxx xxxxxxxxx
Xxxxxxxx 1 = xxxxxx (současný xxxx)
Xxxxxxxx 2 = xxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx
Xxxxxxxx 3 = pouze Xxxxxx xxxxx pro xxxxxxxx xxxxx
Xxxxxxxx 4 = xxxxxxxxx xxxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx x Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx
Xxxxxxxx 5 = xxxxxxx jiného xxxxxx
Xxxxxxxx 6 = zřízení xxxxxx xxxxxx
Xxxxxxx a xxxxxxx pro jednotlivé xxxxxxx subjekty
Varianta 1
Xxxxxxxxxxxx xxxxxx bude xxxxxxxx xxxxxxxxx současného stavu, xxx xx xxxxxxxxx xxxxxxx, xx xx xx xxxx nedostupný xxxxxxxx xxxxxx xxxxxxxxx x xx xxx xxxxxxxx xxxxxx pacientů x ČR. X xxxxxxxxx xxxxxx xxxx xxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxx, které xx jinak xxxxxx xxxxx xxxxxxxxx, xxxxx xx xx xxxx xxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxxxxx (xxxxx xxxxxxxxx komplikací xxx.). Xxxxxxxx bude plné xxxxxxxx volného pohybu xxxxx, xxxxx xx xxxx xxxxxx pacientů x ČR.
Varianta 2
Xxxxxxxxxxxx xxxxxxxxxxxxx xx ústředním xxxxxxxx orgánem xx xxxxx ochrany xxxxxx xxxxxxxxxxxx. Xxxxxx z xxxx xxxxx xx (x rámci xxxxxxxx xxxxx zajištění xxxxxxx xxxxxxxxx xxxxxx) xxx xxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx. Z xxxxxx xxxxxxxx xx bylo xxxxxx, xxx xxxxx xxxxxxxx zajišťovalo xxxxxxxxxxxx. Xxxxxxxx xxxxx xx xxxx xxxxxxxxxxx xxxxxxx, x xxxxxxx xxxxxx xxx xxxxxx Xxxxxx xxxxx xxx xxxxxxxx xxxxx, který disponuje xxx xxxxx xxxxxxxx xxxxx xxxxxx xxxxxxxxxxxxxxxx xxxxxxxx x xxxxxxx xx xx xxxxx xxxxx (obdobně xxxx x xxxxxx xxxxxxxxx xxxxxxx XX) xxxxxxxxxxxxx. Xxxxxxxxx xxxxxxxx, kdy xx reexporty xxxx xxxxxxxxx xxxxx Xxxxxxxxxxxxx xxxxxxxxxxxxx, xx xxxxxxxxx xxxx, kdy xxxxxxx xxxxxxxxxxxxxxxxx činností xxxxxxxxx Xxxxxx xxxxx pro xxxxxxxx xxxxx. Xxxxxx xx xxx zachovaná xxxxxxxxxx xxxxxxxxx, na xxx prováděné xxxxxxxx (xxxxxxx xxxxxxxxxxxx, xxxxxxxx x lékáren x xxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx).
Xxxxxxxx 3
Státní xxxxx xxx xxxxxxxx léčiv xx orgánem xxxxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx x xxxxxxxxx většinu xxxxx xxxxxxxxx x xxxxxxxx xxxxx. Xxxxxxx xxxx xxxxxxxx xx bylo xxxxxxxxx x zajištění xxxxxxxxxx na xxxxx xxxxxxxxxx agendy xxxxx xxxxxxx. Nevýhodou xx xxxx xxxxxxx xxxxxxxxxx xx xxxxxxxx x xxxxx xxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx.
Xxxxxxxx 4
Xxx bylo xxxxxxx xxx xx xxxxxxxx 2 x 3, xxx xxxxxx xx určitým xxxxxxxx xxxxxxxx xx xxxxxxxx xxxxx v Xxxxx xxxxxxxxx. Činnost xx xxxxxxxx xxxxxxxxxxx prostřednictvím Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx, xxxxxxx Xxxxxxxxxxxx xxxx xxxxxxxxx xxxxx xx „xxxxxxxxx“ xxxxxxxxx (xx xx xx formě xxxxxxxxxx xxxxxxxxx řízení nebo xxxxxx xxxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxxxxx). X tohoto xxxxxxxx xx xxxxxxx, xxxxx xx xxx xxxxxx xx xxxxxxxxx xxxxxxxxx xxxxxxxxxxxxxx. Xxxx xxxxx xxxxxxxxxx xx xxxxxx měla xxx xxxxxxxxxxx. Xx. měla xx xxxxxxxx, xxx Xxxxxx xxxxx xxx xxxxxxxx xxxxx xxxxxx x xxxxxxx xxxxxxxxx xx vznik xxxxxxx xxxxxxxxxxxx vydání opatření xxxxxxxxx xxxxxxxxx příslušné xxxxx xxxxxxxxxxxx x xxxxxxx, aby si xxxxxxxxxxxx xxxxx xxxx xxxxx xxxxxxx x xxxxxxx xxxxxxxxx, o xxxxxx xx dozví x xxxxxxx xxxxxx. Xxxxxxxxxx xxxx xxxxxx xxxx zajištěno xxxxxxxx xxxxxxx odůvodnění přijatých xxxxxxxx xx xxxxxx xxxxxxx reexportů x xxxxxx tak xxxxxxxx xxx xxxxx x xxxxxx, který xx xx xxxxxxxx léčiv x XX xxxxxx. Xxxxxx identifikována žádná xxxxxxxx této xxxxxxxx.
Xxxxxxxx 5
Xxxxxxxxxx žádný xxxxx, xxxxx xx xxx x xxxxxxxxxx xxxxxxxx xxxxx než Xxxxxxxxxxxx xxxxxxxxxxxxx xxxx Státní xxxxx xxx xxxxxxxx xxxxx. Nevýhodou xx xxxx neefektivita xxxxxxxxx xxxx xxxxxx orgánu, xxxxx xx xx xxxxx xxxxxxxxx.
Xxxxxxxx 6
Xxxxxxx xxxxxx xxxxxx by xxxxxxxxx xxxxxxxxxxxx finanční xxxxxxx.
Xxxxxxxx xxxxxx variant
Jako xxxxxx xxxxxxxxx byla xxxxxxx efektivita xxxxxxxxxxxx xxxxxxx.
Xxxxxxxx xxxxx 1 (xxx. xxxxxx xxxxxxxx) xxxx xxxxxxxxx x xxxxxxx xx akutní xxxxxxx xxxxx xxxxx xxxxxxx. Stávající legislativa xxx xxxxxxxxxx dostatečně xxxxxxxxx xxxxx. Xxxxxx xxxxxxxxxx xxxxxx vymezeny xxxxxxxxx xxxxxxx xxx xxxxxxxxx reexportů. Xxxxxxxx xxxxx 2, kdy xx reexporty xxxx x konečném xxxxxxxx xxxxxxxxx xxxxx Xxxxxxxxxxxxx xxxxxxxxxxxxx, xxxx xxxxxxxxx x xxxxxx xxxxxxxxxxxx xxxxxxxxxxxx na xxxxxxxxx xxxxxxx tohoto orgánu. Xxxxxxxx číslo 3 (xxxxxxxx xxxxx Státním xxxxxxx xxx xxxxxxxx xxxxx) byla xxxxxxxxx x důvodu xxxxxxxxxxxxxx xxxxxxxxx kontrolních mechanismů xxx přijímání příslušných xxxxxxxx. Xxxxxxxx 5 x 6 xxxx xxxxxxxxx s xxxxxxx xx jejich xxxxxxx xxxxxxxxxxxx a nehospodárnost. Xxxx nejvhodnější xxxx xxxxxxx varianta xxxxxx xxxxx xxxxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx a Xxxxxxxx xxxxxx xxx kontrolu xxxxx, xxx xx xxxxxxxx xxxxxxxx již xxxxxx funguje xxxxxxxx x xxxxxxx xxxxx xxxxxxxx v xxxxxx x léčivech (Xxxxxx xxxxx xxx xxxxxxxx xxxxx xxxx prvostupňový xxxxx a Xxxxxxxxxxxx xxxx xxxxxxxxxxxxx orgán).
Volba xxxxxxx xxxxxx xxxxxxx xxxxxxxx
X ohledem xx xxxx uvedené xxxxxxx xxxxxxxx řešení, kdy xx dle xxxxxxxxx xxxxxxxx zejména xxxxxxxxxx, xxxxxxxxx x xxxxxxxxxxxx xxxx xxxx xxxxxxxxxxxx
- xxxxxxx xxxxxxxxxxxxxx xxxxxxxx;
- x xxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxxxx hlášení xxxxx některých vývozů;
- xx xxxxx xxxxxxxx xxxxxx xxxxxx;
- xxxxxxxxxx xx xxxxxxx xxxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx léčiv x Xxxxxxxxxxxx xxxxxxxxxxxxx; xx xxxxx xxxxxxxxxxx zbývající xxxxx xxxxxxxx x xxxxxx konečnou podobu xxxxxxxxxxxx systému.
Definice variant xxxxxxxxx xxxxx xxxxxx xxxxxx omezení reexportů
Varianta 1 = Státní xxxxx xx xxxxxxx xxxxxxxx xxxxxx xxxxxx, xxxxxx xx stanovil xxxxxx xxxxxxxx přípravků, x xxxxx xx xxxxxxxxxx xxxxxxxxxx hrozila xxxxxx xxxxxxxxxxxx léčivých xxxxxxxxx, x xxxxxxx xx Xxxxxxxxxxxx zdravotnictví xxxxxxxx xxxxxxxx xxxxxx xxxxxx, xxxxxx xx xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxx
Xxxxxxxx 2= xxxxxxxx obecné xxxxxx xx vydávalo pouze Xxxxxxxxxxxx xxxxxxxxxxxxx a Xxxxxx ústav xxx xxxxxxxx xxxxx xx xxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx zveřejňoval v xxxxxxxx xxxxxxxxxxx dálkový xxxxxxx xx svém xxxxxxxxxxx xxxxxxxxxx
Xxxxxxxx 3 = Xxxxxxxxxxxx xxxxxxxxxxxxx xx vydávalo xxxxxx xxxxxxxx xxxxxxxxx, a xx xxxxxx xxxxxxxx xxxxxx povahy, ke xxxxxxx xx xxxxxxxxxxx xx xxxxxxx xxxxxxx xx xxxxxx Xxxxxx, x xxxxx xx xxxxxxxxxx distribuce xxxxxxx xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx, x následného xxxxxxxx xxxxxx xxxxxx, xxxxxx xx se xxxxxxxx xxxxxxxxxx v xxxxxxxxxx xxxxxxx, xxxxxxx x xxxxx xxxx xxxxxxxxx by Státní xxxxx pro xxxxxxxx xxxxx obstarával xxxxxxxx x xxxxx návrhy x podněty, xxx xx xxxxxxx výše.
Náklady x xxxxxxx xxx xxxxxxxxxx xxxxxxx xxxxxxxx
Xxxxxxxx 1
Xxxxxx ústav xxx xxxxxxxx xxxxx xx xxxxxxx xxxxxxxx xxxxxx xxxxxx, kterým by xxxxxxxx seznam léčivých xxxxxxxxx, xxx jejichž xxxxxxxxxx xx xxxx x Xxxxx xxxxxxxxx xx xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx při poskytování xxxxxxxxxxx služeb pacientům x Xxxxx xxxxxxxxx x tento xxxxxx xx pravidelně xxxxxxxxxxxx. Xxxxxxxxxxxx xxxxxxxxxxxxx xx xx xxxxxxx xxxxxxx Xxxxxxxx ústavu xxx xxxxxxxx xxxxx při xxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxx opatření xxxxxx xxxxxx, kterým xx omezilo xxxxxxxxxx xxxxxxxx xxxxxxxxx mimo xxxxx České republiky x xxxxxxx, že xxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxx x Xxxxx xxxxxxxxx xx xxxxx vzniknout xxxxxxxxx xxxx xxxxxxxxxxxxx xxx xxxxxxxxxxx zdravotních xxxxxx xxxxxxxxx v Xxxxx xxxxxxxxx.
Xxxxxxx xxxxxxx x xxxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxxx xx xxxxxxxx xxxx opatření xxxxxx povahy, xxxxxxx xxxxxxxxx by nerespektovala xxxxxxxxx xxxxxxxxx orgánů xxxxxx xxxxxx. Xxxxxx xxxxxxxxxxxxxx specifické xxxxxxx xxxx xxxxxxxx. Xxxxxxxxxxxxxxx xxxx varianty xxxxxxx xxx v časové xxxxxxxxxx xxxxxxxxx opatření xxxxxx povahy, xxxxxxx xxxxxxxxxxxx xxxxxxxx přípravků xx xxxxx řešit xxxxxx. Nepřiměřenou xxxxxx xxxxxxxx by xxxxxxxxx xxxxxxxx xxxxxxxx obecné xxxxxx na xxxxxx Xxxxxxxx ústavu pro xxxxxxxx xxxxx, xxxx x xxxxxxx na xxx xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxxxxx x xxxxxxxx a xxxxxx lékáren Xxxxx xxxx xxxxxxxxxx xxxxxxxx xxxx a identifikovat xxxxxxxxx xxxxxx akutní xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx. X xxxxxxx xx xxxxx EU a xxxxx xxxxx xxxxx xx nutné xxxxxxxx xxxxxx xxxxxxxx přípravků xxxxxxxxxx xxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx.
Xxxxxxxx 2
Xxxxxx xxxxx by xx xxxxxxx podkladů x xxxxxxx xxxxxxxxxxxx subjektů (xxxxxxxx xxxxxxxxxx x xxxxxxxxxx léčivých xxxxxxxxx, xxxxxxxxxxxx x xxxxxxxxxxxxx xxxxxxxxxxx k xxxxxx xxxxxxxx xxxxxxxxx) xxxxxxxxxx xxxxxxxxxxx seznam nedostatkových xxxxxxxxxx léčivých xxxxxxxxx x xxxxxxxxxxx by xxx způsobem umožňujícím xxxxxxx přístup ve xxxx xxxxxxxxxxx xxxxxxxxxx. X xxxxx zveřejněného xxxxxxx xx xx xxxxxxxx léčivé xxxxxxxxx, xxxxxxx xxxxxxxxxx xx xx xxxx České xxxxxxxxx akutní, a xx xx byly x případě naléhavé xxxxxxx xxxxxxxxx xxxxxxx xxxxxxxx xx formě xxxxxxxx xxxxxx xxxxxx Xxxxxxxxxxxxx xxxxxxxxxxxxx.
Xxxxxxxx 3
Xxxxxx xxxxx xxx xxxxxxxx xxxxx by na xxxxx omezení xxxxxxxxx xxxxxxxx přípravků xxxxxxxxxx xxxxxxxx a xxxxx xxxxxx x xxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx. Xxxxxxx xx úseku xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xx pak xxxxxx Xxxxxxxxxxxx zdravotnictví, xxxxx xx xxxxxxxx xxxxxx xxxxxxxx přípravků, x xx xxxxxx opatření xxxxxx xxxxxx, x xxxxx by provedením xxxxxxxxxx hrozila xxxxxx xxxxxxxxxxxx xxxxxxxx přípravků, x xxxxxxxx xxxxxx xxxxxx, xxxxxx by xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxx.
Xxxxxxxx výběru xxxxxxx
Xxxx hlavní xxxxxxxxx xxxx zvolena efektivita xxxxxxxxxxxxx xxxxxxx xxxxxxxx.
Xxxxx xxxxxxxx byla xxxxxxxxx x xxxxxx xxxxxxxxxxxx. Xxxxx xxxxxxxx xxxx xxxxxxxxx x xxxx xxxxxx, xx ne xxxxx xxxxxxxxxx xxxxxxxxxx xxxxx Xxxxxxxxxxxx zdravotnictví xxxxxxx xxxxxxxxxx xxxxxx xxxxxx správy xxx xxxxxx xxxxxxxx léčivých xxxxxxxxx. Xxxx zvolena xxxxx xxxxxxxx, jelikož xx xxxx xxxx xxxxxxxxxxxxxxx a proto xxxxxxxxxxxx.
XXXXXXX VÝBĚRU XXXXXXX XXXXXXX XXXXXXX XXXXXXXXX
Xxxx xxxxxxxxxxxx xxxxxx byla xx základě xxxx xxxxxxxxx xxxxxxx xxxxxx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxx léčivých přípravků Xxxxxxxxxxxxx zdravotnictví, x xxxxxxx xxxxxxx xxxxxx xx xxxxx x xxxxxxxx xxxxxx a xxxxxx pacientů xx xxxxx ČR. Xxxxxx xxxxx xxx xxxxxxxx xxxxx bude xxxxxxxx xxxxxxxxxxxx dostupná xxxx x xxxxxxx xxxxxxxxxxxx, xxxxxxxx a xxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx na xxxxx xxxxxxx.
Xxxx xxxxxxx regulační xxxxxxx xx xxxxxx xxxxxxxx xxxxxx xxxxxxxx xxxxxxxx obecné xxxxxx, xxxxx xxxx xxxxxxx Xxxxxxxxxxxx zdravotnictví, jakožto xxxxx, v xxxxx xxxxxxxx xxxxx (xxx xx xxxxxxx xxxxxxxxxxxx xxxxxxxxxx §11 xxxx. x) zákona o xxxxxxxx) xx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xx území XX. Xxxx xxx xxxxxxxx xx xxxxxxxxx xxxxxxxxxx Xxxxxxxxxxxx x xxxxxxx xxxxx vhodně xxxxxxx xxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx léčiv x xxxxxxxxx xxx, xxxxxxx xxxxxxxxx. Xxxxxxxxxxxx xxxx xxxxxxxx vydávat xx xxxxxxx xxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx xxxxxxxxxx xx vyhodnocování xxx, x to xxxxx xxxxxxxxxxxx. Xxxx xxxx xx v xxxxxxx xxxxxxx xxxx xxxx Xxxxxxxxxxxx též od Xxxxxxxx ústavu xxx xxxxxxxx xxxxx xxxxxxx.
Xxxxx xx x zvláštní xxxxx xxxxxxxxx aktu, xxxxx xxxx xxxxxxx xxxxxx na xxxxxxxx xxxxxxxxxx xxxxx xxxxxxxx x konkrétní xxxx. Xxxxxxxx k xxxxxxxxxx xxxxxxxxxxxx se xxxxx xxxx xxxx xxxxxxx xxxx xxxxxx forma xxxxxxxx. Xxxxxxxxxx právní xxxxxx xxxxxxxxx x xxxxxxxxx xxxxxx pacientů x České republice x k xxxxxxx xxxx xxxxxxx, kdy xxxx na úkor xxxxxxxxxxxx xxxxxx xxxxxx xxxxxx přípravky vyváženy xxxx xxxxx České xxxxxxxxx, xx xxx x souladu xx xxxx xxxxxx xxxxxxxxx, xxxxxxxxxxxxx, xxxxxxxxxx účinná xx xxxxxx dopadu x xxxxxxxxx.
2.3. Adaptace xxxxxxxx ve vztahu x xxxxxxx xxxxxx xxx xxxxxxx léčivé xxxxxxxxx
Xxx řešení tohoto xxxxxxxx nelze připustit xxxxx xxxxxxxx, než xxxxxx text zákona x xxxxxxxx xxx, xxx xxxx náležitým xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx Xxxxxx x xxxxxxxxx xxxxxxxxx (EU) č. 1252/2014 ze xxx 28. xxxxxx 2014 xxxxxxxxxx xxxxxxxx Evropského xxxxxxxxxx a Xxxx 2001/83/XX, xxxxx xxx x xxxxxx x xxxxxx správné xxxxxxx xxxxx xxx léčivé xxxxx xxx humánní xxxxxx xxxxxxxxx. Xxxxx xxxx varianta xx xxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx orgánů Xxxxxxxx xxxx vůči České xxxxxxxxx.
2.4. Xxxxxxxxxx Státního xxxxxx pro kontrolu xxxxx a Xxxxxxxxxxx xxxxxxxxxxx xxx
Xxxxxxxx 1 - xxxxx xxxxxx x xxxxxxxx
Xxxxx xxxxxxxxx xx xxxxxxxxxxx xxxxx x xxxxxxxx xxx, xxx xxxxxxxxx vymezení xxxxxxxxxxx Státního xxxxxx xxx kontrolu xxxxx x Xxxxxxxxxxx xxxxxxxxxxx xxx. Inspirací v xxxxx xxxxx xxxx xxx již xxxxxx xxxxxx xxx, x xx xxxxxxxxx xxxxxxxxxx §8 xxxxxx č. 226/2013 Xx., x xxxxxxx xxxxx a xxxxxxxxxxx xxxxxxx na xxx, které obdobnou xxxxxxxxxxxx xxxxxxxxxx dozorových xxxxxx, z xxxxx xx xxxxx xxxxxx xxxxxxxxx právě Xxxxxxxxx xxxxxxxxxxx xxx, x xxxxxxxxxxx xxxxxx xxx xxxxxxx xxxxxxxx xxx xxxx. Xxxx xxxxxx, xx. xxxxx speciálního xxxxxx, xx v xxxxx ukázalo jako xxxxxxxxxxx, respektující vždy xxxxxxxxx xxxxxxxxx právní xxxxxx xxxx xxxxxxx.
Xxxxxxxx 2 - Xxxxxxx xxxxxxxxxx xxxxxx xxxxxx x Xxxxx správě Xxxxx republiky x xxxxxx xxxxxx xxxxxx xxxxxx x léčivech
Druhou xxxxxxxxx řešení tohoto xxxxxxxx xx xxxxxxxx x xxxxx připravované xxxxxx zákona x xxxxxxxx xxxxxxxxxxx novelu xxxxxx č. 17/2012 Sb., x Xxxxx xxxxxx Xxxxx xxxxxxxxx, xx znění xxxxxxxxxx předpisů, xx xxxxx xx byla x rámci xxxxxxxxxx §2 až 5 xxxxxx xxxxxx xxxxxxxxx xxxxxxxxx působnost Generálního xxxxxxxxxxx xxx o xxxxx xxxxxx.
Xxxxxxxx 3 - Xxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxx o Xxxxx xxxxxx České xxxxxxxxx
Xxxxx xxxxxxxxx xx xxxxxx samostatné novelizace xxxxxx č. 17/2012 Sb., o Xxxxx správě České xxxxxxxxx, xx znění xxxxxxxxxx xxxxxxxx. Xx xxxxx xxxxx nabyl xxxxxxxxx teprve xxxx 1. xxxxx 2013, xxx xxx celkem xxxxxxxxx xxxxxxxxxxx, xxxxx xxx předpokládat jeho xxxxx xxxxxxxxxx.
2.5. Prokazování xxx xxxxxxxxx činnosti x xxxxxx xxxxxxxxx xxxxxxxxx a zabrání xxxxxxxx xxxxxxxxx
Xxxxxxxx 1 - xxxxxx
Xxx zachování xxxxxxxx právní xxxxxx x xxxxxx o xxxxxxxx by xxxxxxx xxxxx x xxxxxxxxx x vhodnější úpravě xxxx otázek, xxxxxxx xxxxxxxxx úprava xxx xxxxxxxxxx xxxxxxxxx z xxxxx x xxxxxxxxxx xxxxxxxxxxx xxxxxxx, xxx xx xxxx xxxxxx xxxx být upraveny.
Varianta 2 - změna xxxxxx o xxxxxxxx
Xxxx xxxxxxxx xx xxxxxxxxx xxxxxxxxxxxx průběhu inspekcí x rámci xxxxxx xxxxxxxx xxxxx kontrolního xxxx, když xx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxx xxxxxxxxxx ke xxxxxxxx prováděné podle xxxxxxx xxxxxx xxxxxxx xxxxxxxx. Dále xx xxxxx k xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxx xxxxxxxxx xxx, xxx xxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx pro xxxxxxxx xxxxxxxxx xxxxxxx veřejného xxxxxx a xxxxxx xxxxxxxx x účinných xxxxxxxx x xxxxxx xxx xxxxxxxx xxxxxxxx xxxxxxxx přípravků, které xxxxxxxxx požadavky xx xxxxxx xxxxxx, xxxxxxxx x bezpečnost. Xxxxx xxx odůvodnění xx xxxxxxxx xxxxx.
3. Vyhodnocení xxxxxxx a xxxxxxx
Xxxxxx xxxxxx xxxxxxxx xxxxxxxxxxxxx x adaptaci xxxxxxxx xx xxxxxx x xxxxxxx látkám pro xxxxxxx xxxxxx xxxxxxxxx, xxxxxxxxx xxxxxxxxxxx Státního xxxxxx xxx kontrolu xxxxx x Generálního xxxxxxxxxxx xxx x xxxxxxxx spočívajících x xxxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxx provádění xxxxxxxxx xxxxxxxx a x xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxx xxxxxxxxx náklady xxxxxxxxxxx, xxxxxxx přínosy xxxxxx xxxxxx xxxxxxxx xxxx již xxxxxxx x xxxxxxxxxx. X xxxxxx důvodu budou xxxxxxxxxxx xxxxxxxxxxxx a xxxxxxxxxxx xxxxxxx a xxxxxxx xxxxxxx x xxxxxx 3.1 až 3.3 xxxxxxxx ke xxxxx xxxxxxx xxxxxxxx xxxxxxxx, a xx x adaptaci xxxxxxxx x xxxxxxxxxx hodnoceních xxxxxxxxx xxxxxxxx xxxxxxxxx x k opatřením xxxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx.
3.1 Xxxxxxxxxxxx xxxxxxx x xxxxxxx
3.1.1. Xxxxxxxx xxxxxxxx xxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx přípravků
Pokud xxx x adaptaci xxxxxxxx xxx klinická xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxx č. 536/2014 xxxx xxx na xxxxxx Xxxxxxxx xxxx, xxx x xxxxxxxxx xxxxx. Xxxxxxxx tohoto xxxxxxxx by však xxxx x budoucnu xxx členské xxxxx xxx efektivnější xxxxxxxxxx xxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx. Přínosem by xxxxxx xxxx xxx xxxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx x xxxxx xxxx Xxxxxxxx xxxx x xxxxxxxx zavedení nově xxxxxxxxxxx xxxxxx jejich xxxxxxxxxx x xxxxxxxxx, xxxxxxxxxxxxx Evropské xxxx xxx xxxxxxxxxx ze xxxxxxx xxxx x xxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxx x Evropské unie, xxxxx xxxxxxxx následkem xx xxxxxxxxx počtu xxxxxxxxxx xxxxxxxxx, které xx jinak xxxxx xxxxxxxxx x Evropské xxxx xxxxxxx xxxxxxxxxxxxx xxxxx xxxxxx x xxxxxxx let xxxxx, xxx xxxx xxxxxxxxx xxxxxx xxxxxxxxx registrován. Xxxxxxxxx přínosem xx x xxxxxxxx xxxxxxxxxxx x xxxxxxxxxxx xxxxxxxxx xxxxxxxx při xxxxxxxxxx xxxxxxxxxxx x xxxxxx xxxxxxxxxx xxxxxxxxx do xxxxxxxx xxxxx xxxx xxx optimalizace léčby xxxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxx xxxxxxx rychlejší xxxxxxxxxx xxxxxx x xxxxxxxxxxxxxx léčivých xxxxxxxxx xxx xxxxxxxx a xxxxxxxxx vhodných podmínek xxx celkové zlepšení xxxxxxxxx xxxxxx jak x xxxxxxxxx xxxxxxx, xxx x celé Xxxxxxxx unii. Xxxxxxx xxxxx xxxxxxxxxxxxx xxxxxxx x xxxxxxxx hodnocení x tím i xxxxxx realizace xx xxxxxxxx xxxxx finanční xxxxxxxxxx xxx poskytovatele xxxxxxxxxxx xxxxxx, xxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxxxx hodnocení x xxxxxx xxxxx xxxxxxxxxx xxxxxxxxx finanční odměnu. Xxxxxxx by xx x xxxxxxxxxx následné xxxxx xxx pacienty, xxxxx xxxxxxxxx xx xxxxxxx xxxxxx nejen xxxxxxxxx, xxx xxxx xxxxxxxxxx xxxxxxxxx, xxx xx mnohdy xxxxxxxxxx xxxxx, xxxxx hrazena xxxxxxxxxxx. Xxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx xx xxxx znamenat x možnost xxxxxxx xxxxxxxxxx míst xxx xx xxxxxx xxxxxxxxxx (x xxxxxxxxxxxxxxx společností xx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx), xxxxxx xxx x xx xxxxxx xxxxxxxxx xxxxxxxxxx hodnocení, xxx. x xxxxxxxxxxxxx xxxxxxxxxxx služeb, xxx xx xxxxxxx xx xxxx xxxxx xxxxx xxx kryty xx xxxxxxxxx xxxxxxxxxx zdrojů xx xxxxxx.
Xx xx xxxx xxxxxxxxxx xxxxxxx xxxxxxxxxxxxx v nutnosti xxxxxxxx xxxxxxxxxx úvazků, xxxx xxxx xxxxxxxxxxx:
- xx xxxxxx Xxxxxxxx xxxxxx pro kontrolu xxxxx 32 xxxxxx xxx počtu 8 xxxxxx xxxxxx xxxxxx). Xxxx třeba zabezpečit xxxx xxxxxx farmaceutických xxxxxxxxxxxx (5), posuzovatelů xxxxxxxxxxxxx xxxxxxxxx (2), xxxxxxxxxxxx xxxxxxxxxxxxxx dat xxxxxxxxxx hodnocení (2), xxxxxxxxxx (5), xxxxxxxxxxxx xxxxxxxxxx hodnocení (2) x xxxxxxxxxx zajištění xxxxxxxxx-xxxxxxxxxxxxx x xxxxxxxxxxxxxxxxx xxxxxx xxx xxxxxxx xxxxxx komise - xxx xxxxx 8 xxxxxx xxxxxx xxxxxx - 16 úvazků). Xxxx xxxxxx budou xxxxxxxx xxxxx z xxxxxxx xxxxxx za xxxxxxxx xxxxxxxxx (xxxxxx xxxxxx). Xxx xxxxxxxx xxxxx xxxxxxxxxxx technického xxxxxxxxxxx xxxxxx xxxxxxx xxxxxx xxxxxx jako xxxxxxxxx xxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx xxxx xxxxxxxxx x xxxxx xxxxxxxx xxxxxxxxxx z xxxxxx xxxxxxxxxxxx x EU xxxxx, x části xxxx kryto x xxxxxx výdajů xx xxxxxxxx xxxxxxxxx xx xxxxxxxxxxx správné xxxxxxxx xxxxx;
- na xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxx agenda xxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxxx x žádosti x schválení xxxxxxxxxx xxxxxxxxx. Bude xxxxx xxxxxxxxxx 1 pozici xxxxxxxx referenta x 1 pozici xxxxxxxxx xxxxxxxxx. Xxxxxxx na Xxxxxxxxxxxx xxxxxxxxxxxxx xxx xxxx xxxxxxxx xx xxxxxxxxx xxxxxxxxx (s xxxxxxx xx xxxxxx xxxxx v rámci xxxxxxxx) právní xxxxx xxxxxx xxxxxxxx referentem xxxxxxxxxxx vzdělání a xxxxxxx odborné xxxxx xxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxxxxxxx xx xxxxxxxxxx xxxxxxxx. Xxxx xx xxxxxx Ministerstva zdravotnictví xxxxxxx xxxxxx xxxxxxx x xxxxxxx etické xxxxxx xxxx komise xxx xxxxxxxxxxxxxx klinická xxxxxxxxx, xxxxxx vznikne xxxx xxxxxx xxxxxxxxx x odvolávání členů xxxxxx komise orgánu Xxxxxxxx xxxxxx pro xxxxxxxx léčiv xxxxxxxxx xxxxxxxxxxxxx.
3.1.2. Opatření xxxxxxxxx x omezení reexportu xxxxxxxx xxxxxxxxx
Xxxxxxxxxx xxxxxx xxxxxx spočívající v xxxxxxxx k xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx xxx sociální xxxxxx, xxxxxx na xxxxxxxx xxxxx, xxxxx xx xxxxxxxxxx postižením x národnostní menšiny x dopady xx xxxxxxx prostředí. Xxxxxxxxxx xxxxxx xxxxxx zároveň xxxxxx xxx dopad xx xxxxxxxxxxx xxxxxxxxxxxxxxxxxxx Xxxxx republiky, xxxxxx xxxxxxxxxxx xxxxx (xxxx, xxxxx), xxxxxxxxxxxx, xxxxx xxxxxxxxxxx xxxxxx x xx xxxxxx x xxxxxx diskriminace.
Předpokládá xx xxxxxxxx xxxxx xx xxxxxx rozpočet x xxx xxxxxxx, xx xxxxx xxxxxxxx již xxxxxxxxxx a zavedeny xxxx administrativní xxxxxxx xxxxx, xxxxxxxxxx a xxxxxxxxxxxxx xxx xxx xxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxx x České xxxxxxxxx Xxxxxxx xxxxxxx pro xxxxxxxx xxxxx x xxxx xxxxxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxx obecné xxxxxx Xxxxxxxxxxxxx xxxxxxxxxxxxx. Xxxxxxxx xxxxx x xxxxx xxxxxx bude xxxxxxxxxxxx navýšením xxxxxxxxxx xxxxxx, přičemž se xxxxxxxxx xxxxxx xxxxxx x více xxx 4 xxxxxxxx xxxxxx xxx xxxxx podílející xx xx xxxx xxxxxxxx.
4 xxxxxxxx úvazky xxxxx xxxxxxxx xx 2 xxxxxxxxxx xxxxxxxx xx Státním xxxxxx xxx xxxxxxxx xxxxx (xxxxxx xxxxxxxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxxxxxxx Xxxxxxxxxxxx), x ve 2 xxxxxxxxxx xxxxxxxx na Xxxxxxxxxxxx zdravotnictví. Xxxxxxx xx Ministerstvu xxxxxxxxxxxxx xxxx spočívat xx xxxxxxxxx zajištění (x xxxxxxx xx nutnost xxxxxxxx xxxxxx) xxxxxx xxxxx agendy odborným xxxxxxxxxx xxxxxxxxxxx xxxxxxxx x zároveň xxxxxxx xxxxx agendy xxxxxxxx xxxxxxxxxx farmaceutického xx xxxxxxxxxx vzdělání. Xxxxxxxx xxxxx xx xxxxxx xxxxxxxx xxx bude xxxxxxxxx.
Xxxxxxxxx xxxxx xxxxxxxxxx xxxxxx úpravy xx xxxxxxx xxxxxxx xxxxxxxx, xxxxxxx xx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxx předem odhadovat. X xxxxxxx xx xx, xx xx xxxxx x xxxxxxxxx xxxxx xxxxx do xxxxxxx xxxxxxxxx, xx xxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxx, která xx xxxxxxxx uspokojována x xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx pojištění, xxx xxxxxxxxxxxx, xx xxxxxx xxxx navrhovaná xxxxxx xxxxxx mít bude. Xxxxxx xx xxxxxxx xxxxxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxxxx lze xxxxxxxxxxxx spíše xxxxxxxxx - xxx xxxxxxxxxx xxxxxx xx stávající xxxxxxxxxx a medikace, xxxxx xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxx variantu xxxxxxxx léčby nebo xxxxx léčebných xxxxxxx. Xx se xxxx xxxxxx na xxxxxxxxxxxxx xxxxxxxxx Xxxxx republiky, xxxxxxxxx dopadů xx xxxxxxxxxxxx léčivých xxxxxxxxx xxxxxxx xxxxxxxxxxxxx xxxxxxxx, xxx předpokládat jistý xxxxxxxxx vliv, xxxxx xx xxxxx xxxxxxxx xxxxxxxxxxxxx transparentností xxxxxxx xxxxxxxx x vysokou xxxxx xxxx předvídatelnosti, xxxxxxxxxxxx x xxxxx xxxxxxx xxxxxxxxxxxxxxx xxxxxx. Xxxxxxx zájem xxxx xxx x xxxxx xxxxxxx xxxxxxxx xxxx xxxxxx xxxxxxxxxxxxx.
Xxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxxx dopad xx dotčené xxxxxxxxxxxxx xxxxxxxx x tom, xx zavádí xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxx, xx xxxxxxx xxxxxxxxxxxx xxxx xxxxx Xxxxx xxxxxxxxx xxxxxx xxxxxxxxx, který xx xx seznamu léčivých xxxxxxxxx ohrožených xxxxxxxxx. Xxxxxxxxx xxxx xxxx xxxxxx, xxxxxxxxxx všechny xxxxxxxx aktivity distributorů, xxx xxx xxxxxx xxxxx xxxx a xxxxxx xx xxxxx xxx xxxxx xxxxxxxx xxxxxxxxxxxx xx xxxxxxxxxx xxxxxxxx xxxxxxxxx, xxx xxxxx relevantní skupiny xxxxxxxx x xxxxxxxx xxxxxxxxx. Xxxxx xxxxx xx přitom x xxxxxxx x účelem xxxxxxxxxx xxxxxx xxxxxx xxxxxx xx xxxxxxxx xxxxxx xxxx x xxxxxxxx xxxx, kterým xx zajištění dostupnosti xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx potřeby pacientů x Xxxxx xxxxxxxxx x případech hrozící xxxxxx xxxxxxxxxxxxx x xxxxxx jejich xxxxxxxxxx xxxxxxxxx.
Xxxxxxxxx xxxxx xxxx xxx navrhovaná xxxxxx xxxxxx xxxxxxx xx xxxxxxxx, jakožto xxxxxxxxxxx xxxxxxx xxxxxxxx, kterým xxxxxxx dostupnost léčivých xxxxxxxxx xxxxxxxxxxxxxxx xxxxxx xxxxxxx xxxx distribucí xxxx xxxxx České xxxxxxxxx.
3.1.3 Xxxxxxx xxxxxx xxxxxxxxxxxx nákladů a xxxxxxx x oblastech 3.1.1 x 3.1.2.
Xxx xxxxxxxxxx xxxxxxxxx výkonu xxxxxx xxxxx x xxxxxxxxx xxxxxxxxx s xxxxxxxxx xxxx xxxxx xxxxxxx xxxxx úvazků XXXX a to x xxxxxxxx xxxxx 34 úvazků. X xxxxxxxxxx xxxxxx bude xxxxxxxx postupně, x xx x letech 2016 až 2018 - x xxxxxxxxxx xx počtu předkládaných xxxxxxx x xxxxx xxxxxx xxxxxx xxxxxx.
Xxxxxx xxxxxx agend xx xxx být postupný (xxxxx xxxxxxx xxxxxx xxxxx xxxxxxxxx xxxxxx xxxxxx), a xxxxx xxxxx xxxxxx x xxxxxxxxx zvyšováním xxxxxx (xxx xxxxxxxxx xxxxxxx).
Xxxx xx jednat x xxxx xxxxxx:
Xxxxxxxxxxxxx xxxxxxxxxxx (xxxxxx 5) - x xxxx 2016 xx xxxxxx x xxxxxxxxx 4 xxxxxx, xxxx xxxx záležet xx xxxxxxxxxx nového xxxxxxx xxxxxxxxxx, tzn. xx xxxxxxxxxx hodnotících xxxxx v angličtině, xx xxxx xxxxxxxxx xxxxxxxxxx všech xxxxxxxxx xxxxxxxxx států x xxxxxxx, že ČR xxxx xxxxxxxx xxxxxx xxxxxxxxxxx, xx xxxxxxxxxx xxxxxxxxxx xxxxxxxx, x xx vlivu xxxxxxxx xxxx xxxxxxxxxx, xxx xx xxxxxxxx nově xxxxxxxxx. Zároveň xx xxxxx xxxxxxx xx xxxxxxxx xxxxx žádostí x xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx, jejichž xxxxxxxxxx xx náročnější x xxxxxxxx xxxx xxxx.
Xxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxx (2 xxxxxx) - 1 úvazek v xxxx 2016, xxxxx x xxxx 2017 - xxxx disponuje Xxxxx xxxxx 1 xxxxxxxxxxxxx + výpomocí xx xxxxxxxx xxxxxx. X xxxxxxxx době xxxx xxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx, xxx xxxxxx x xxxxxxx xxxxxxxxx xxxxx xxxxxxxxxx xxx xxxxxxx xxxxx xxxxxxxx možné, xxxxx xxxxxxx agenda xxxxx xxxxxxxxxxx zpráv xxx Roční zprávy xxxxxxxxxxx xxxxxxxxx, xxx xxxx xxxxxxxxx x xxxxxxxx preklinického posuzovatele.
Posuzovatel xxxxxxxxxxxxxx dat xxxxxxxxxx xxxxxxxxx = posuzovatel xxxxxxxx části dokumentace (1 úvazek) - xx zajištění xxxxxx xx xxxxxxxx xx 2 úvazky xx xxxx 2016 (1 xxxxxx xxx je x xxxxxxxxxxx). Posuzovatele xxxx xxxxx xxxxxxx xxxxxxxx x xxxxxx xxxxxxxxxxx xxxxx, xxxx xxxxxx xxxxxxxx xx xxxxxxxxxxxx hlášení u Xxxxxxxx lékové agentury (xxxx jen EMA). Xxxxx xx x xxxxx xxxxxx, která xx nyní x xxxxxxxx xxxxxx vedena xxxxxxxx xxxxxxx group xxx EMA. Xxxxxxxxxxxx xxxxx rovněž vyhodnocovat xxxxxxxxxxxx xxxxxxx x xxxxxxxxxx xxxxxxxxx x XxxxxXxxxxxxxx xxxxxxxx x xxxxxxxxxxxxx x kolegy x ostatních xxxxxxxx xxxxxxx.
Xxxxxxxxx správné xxxxxxxx xxxxx (5 xxxxxx) - xxx rok 2016 se xxxxxx xx 2 xxxxxx, xxxx xxxx xxxxxxx xx xxxxxxxxxxx potřebách. Xxxxxxxxxxxxxxx xxxx xxxxxxx xxxxxxx xxxxx xxx 5. Xxxxxxx xxxxxxxx xxxxxxx nejen x xxxxxxxxx xxxxxxxxx dohledu xxx klinickým xxxxxxxxxx, xxxxxxx xxxxxxx kontrolu xxxxx xxxxxxxxx právě xxxxxxxxxx správné klinické xxxxx, xxx zároveň x x xxxxxxxxx xx xxxxx xxx xxxxxxxxxx zahraničních kontrolách x xxxxxxxxx členskými xxxxx, vedenými x xxxxxxxxxxxxxx EMA. Xxx xxxxx cca 375 xxxxxxx x povolení xxxxxxxxxx xxxxxxxxx/xxx x xxx 1600 „běžících“ xxxxxxxxxx hodnocení x xxxxx xxxx je xxxxxxxx xxxxx inspektorů xxxxxxxx xxxxxxxxxxxxx. K xxxxxx xxxxxxxxxx inspekční xxxxxxxx xx xxxxx xxxxx, xxxxxx xxxxx xxxxxx xxxxxxxxxxx xxxxxxxx.
Xxxxxxxxxxx xxxxxxxxxx hodnocení (3 xxxxxx) - xxx xxx 2016 xx xxxxxx x 1 xxxxxxx, s xxxxxx xxx x xxxx 2017 x 1 x xxxx 2018. Xxxxxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxxx x xxxxx xxxxxxxxxx posouzení x xxxxxxxxx xxxxxxxxx xxxxx x xx území XX x ostatními xxxxxxxxxxxxxxxx xxxxxxxx (např. xxxxxxx xxxxxxx xx.), xxxxx zajišťovat xxxxxxxx xxxxxxxxxx xx xxxxxxx, xxxxxx xxxx pro xxxxxxxxxx na xxxxx XX.
Xxxxxxxxxx koordinačního xxxxxx xxxxxxxx xxxxxx komise (4 úvazky). X xxxxxx xxxxxx xx xxxxx počítat již xxx xxx 2016. Xxxx xxxxxxxxxx budou xxx za úkol xxxxxxxx xxxxxxxxx xxxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxx xxxxxx jako xxxxxxxxx xxxxxx Xxxxxx, xxxxxxx přípravu xxxxxxxxx, xxxxxxxx pracovních xxxxxx, xxxxxxxxx xxxxxxxxxx xxx xxxxx etické komise (xxxxxxxxx školících externistů), xxxxxxxxx xxxxxxxxxxxxx xxxxxxx x XX pro xxxxxxxxxxxx xxxxxxxxxx etické xxxxxx. Xxxx xxxxx xxxxxxxxxxx podklady xxx Xxxxxxxxxxxx zdravotnictví xxx xxxxxxxxxxx žádostí x xxxxxxxx x xxxxxx xxxxxx. X xxxxxxx xxxxxx xx nutno xxxxxxx x xxxxxxxxxx xx xxxxxxx xxxxxxx xxxxx skupin etické xxxxxx x xxxxxxx xxxxxxxxxxx xxxxxx a x xxxxxxxxxx xx xxxxx xxxxxxxxxxxxx xxxxxxx. (xxx xxxxx 8 xxxxxx xxxxxx xxxxxx - 16 úvazků - xx xxxx 2019 xx 2020 - xxxxx xxxxxxxxxx xxxx xxxxxx xxxxxxxxx xxxxxxxx č. 536/2014).
|
xxxxx potřebných xxxxxx, xxxxxxxxxxxx xx XXXX v xxxxxxxxxxx x xxxxxxxx nařízení 536/2014/EU |
||||||
|
2016 |
2017 |
2018 |
32 xxxxxx |
|||
|
4 |
XX |
1 |
XX |
|||
|
1 |
XXX |
1 |
XXX |
|||
|
1 |
XXXXX |
|||||
|
2 |
XXX |
2 |
XXX |
1 |
XXX |
|
|
1 |
XXXX |
1 |
XXXX |
1 |
XXXX |
|
|
4 |
XXXX |
8 |
XXXX |
4 |
XXXX |
|
|
13 |
13 |
6 |
||||
xxxxxxx:
xxxxxxxxxxxxx posuzovatel (XX) - xxxxxx 5
xxxxxxxxxxx xxxxxxxxxxx xxxxx (PPK) - xxxxxx 2
xxxxxxxxxxxx xxxxxxxxxxxxxx xxx XX (XXXXX) - xxxxxx 1
xxxxxxxxxx xxxxxxx klinické xxxxx (XXX) - xxxxxx 5
xxxxxxxxxxxx XX (XXXX) - celkem 3
xxxxxxxxxxxx xxxxxx XX - (XXXX) - 4 (xx xxxxx xx xxxxxxxx xxxxx xxxx xxxxxxxx skupin XX, xxxxx xx xxxxx připravit xxxxxxx xxxx xxxxxxxxxxxxxx
(xxxxxxxxx, xxxxxxxx xxxxxxx xxx.) xxx xxxxx xxxxxxx XX xxxxxxxx zřízeny, aby xxxxx xxxxx xxxxxxxx xx svém xxxxxx xxxxxxxxx
xxxxxxxxxxxx xxxxxx XX - (KOEK) – 12 xxxxx xxxxxxx XX by xxxx xxx 2 xxxxxx xx zajištění administrativních xxxxxxx xxxxxxxxxxx x XX
xxxxx se předpokládá xxxxxxxx x xxxxxxx 12 KOEK po xxxxxxxxx xxxxxxx xxxxxx XX
xxxxx úvazků xxxxxxxxxx xx SÚKL xxx xxxxxxxxx xxxxxxxx xxx xxxxxxxx xxxxx.xxxxxxxxxx, 2016
2 xxxxxx
2 posuzovatelé xxxxxxxxx
34 xxxxxx
2 xxxxxxxx xxxxxx xxx XX - xxxxxxxx x xxxxxxx xxxxxxxx nebo xxxxxxxx x právník.
Pokud se xxxx xxxxxx xxxxx xxxxxxxxxxxxx z xxxxxx xxxxxx xxxxxxxx omezující xxxxxxxxx xxxxxxxxx, xxx xxxxxx xxxxxxxxx xx xxxxx počítat x xxxxxxxxx x 2 xxxxxx xx SÚKL x x 2 xxxxxx xx XX. Xxxxx zajistí sledování x xxxxxxxxxxxxx nedostupnosti xxxxxxxx xxxxxxxxx, XX xxxxxxx xxxxxxxx xxxxxx xxxxxxxx s vydávání xxxxxxx x xxxxxxxx xxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxx. X souvislosti x xxxxx xxxxxxxxxxxxx xx nutnost xxxxxxxx xxxxxxx x xxxxxxx xxxxxxxx xxxxxxxxxxx, xxxxxxxx xxxxxxxxx je xxxxxxx xxxxxxxxxxx x xxxx xxxxxxxxx úzkou spolupráci xxxx xxxxx xxxxxxxxxxx, x to x x xxxxxxx na xxxxx xxxx xxxxxxx.
Xxxxxx xxxxxxx:
Xxxxxxxxxxxx xxxxxxxxxxxxx dokumentace - xxxxxxx xx. 13
Xxxxxxxxxxxx xxxxxxxxxxxxxx xxx/xxxxxxxx xxxxx dokumentace - xxxxxxx tř. 13
Xxxxxxxxxxx xxxxxxxxxxx dokumentace - xxxxxxx xx. 13
Inspektoři xxxxxxx klinické xxxxx - platová xx. 13
Xxxxxxx xxxxxxxxxxxxx xxxxxx xxxxxx komise - xxxxxxx xx. 13
Xxxxxxxxxxxx - xxxxxxx xx. 12
Xxxxxxxx xx xxxxxx xxxxxxxxx XX - xxxxxxx tř. 13
Xxxxxxx xx xxxxxx xxxxxxxxx XX - platová xx. 13
Xxxxxxxxxxx xxx xxxxxx reexportů SÚKL - xxxxxxx tř. 13
Xxxxxxxxxxxxx xxxxx souhrnné xxxxxxx jsou xxxxxxx xxxx
|
Xxxxxxx xxxxx |
Xxxxxx náklady |
průměr |
Celkem /xxx |
Xxxxxxxx náklady mzdy XXXX |
Xxxxxxx xxxxxxx - xxxxxxx, kancelářské xxxxxxx, xxxxxxxxxx, … xxx 50 000/xxx |
|
|
4 xxxxxxxxxxxxx xxxxxxxxxxxx |
13 |
20 990-26 220 Xx |
23 600 Xx |
1 132 800 Kč |
1 529 280 Xx |
200 000 |
|
1 preklinický xxxxxxxxxxx XXX |
13 |
20 990-26 220 Xx |
23 600 Xx |
283 200Xx |
382 320 Kč |
50 000 |
|
1 klinický xxxxxxxxxxx (xxxxxxxxxxxx data - XXXXx) |
13 |
20 990-26 220 Xx |
23 600 Kč |
283 200 Xx |
382 320 Xx |
50 000 |
|
2 xxxxxxxxxx XXX |
13 |
20 990-26 220 Xx |
23 600 Xx |
566 400 Kč |
764 640 Xx |
100 000 |
|
1 xxxxxxxxxxx XX |
12 |
19 360-24-180 Xx |
21 770 Xx |
261 240 Xx |
352 674 Xx |
50 000 |
|
1 xxxxxxx + 3 xxxxxxxxxxxx xxxxxx xxxxxx |
13, 12 |
20 990-26 220 Xx19 360-24-180 Xx |
23 600 Xx21 770 Xx |
283 200 Xx261 240 Xx |
382 320 Xx352 674 Xx |
200 000 |
|
2 xxxxxxxxxxxx xxx oblast xxxxxxxxx |
13 |
20 990-26 220 Kč |
23 600 Xx |
566 400 Xx |
764 640 Kč |
100 000 |
|
15 úvazků - xxxxxxx xxxxxxx xx xxxx xxxxxx xxx 5 000 000 Xx/xxx 2016 |
3 637 680 Kč |
4 910 868 Xx |
750 000 Xx |
|||
Xxxxxxx navýšení xxxxxxxxxx xxxxxx xx MZ xxxx xxxxxxxxxx xxxx.&xxxx; Xxxxxxxx xx xxxxxxx x rámci xxxxxxxxxxx xxxxx xxxxxxxxxxxxx.
Xxxxxxxx xx xxxxxxx x xxxxx xxxxxxxx xxxxxx na xxxxx x počtu xxxx kapitoly Ministerstva xxxxxxxxxxxxx. Xxxxxxxxxx dopad x platové oblasti xx neutrální.
Pro xxxxxxxxx xxxx agendy - xxxxx provozní náklady xx xxx 2016 x 2017 (xxxxxxxx, xxxxxxxx, xx.) - 2016 xxx 750 xxx. Xx; 2017 1,5 xxxxxxx Xx (xxxxxxxx prostor pro xxxxxxx etických komisí + xxxxxx xxxxxx).
Xxxxxx xxxxxxx xx xxxxxxxxx xxxxxxxxxxxxx xxxxxx xxxxxx xxxxxx x koordinátory xxxxxx xxxxxx - xxx 2016 xxx 2 xxxxxxx; náklady xx vybavení xxxxx xxxxxx xxxxxx xxxxxx x xxxxxx provoz - vybavení cca 3 miliony/rok (xxx xxxxx xxxxx xxxxxx xxxxxx komise - xxxxx náklady) - xxxxxxx x xxxxxx xx xxxxxxx etické xxxxxx.
Xxxxxxx xxxxx hrazeny x xxxxxxxxx xxxxxxxxxx Xxxxxx, nezíská-li xxxxxxx x EU xxxxx.
X xxxx 2016 x xxxx xx xx xxxx i xxxxxxx xx xxxxxxxxxx, školení (x XXX xx x xxxx xxxxxxxx xxxx xxxxxxxx za xxxxxxxxxx Xxxxxxxx xxxxxx xx.) cca 2 xxxxxxx/xxx.
3.2 Náklady
3.2.1. Adaptace xxxxxxxx x xxxxxxxxxx xxxxxxxxxxx humánních xxxxxxxx xxxxxxxxx
Xxxxxxx spojené xx xxxxxxxxx xxxxxx xxxxxx xxxxxxxxxx xxxxxxxxx humánních xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx v xxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxx XX a xxxxxxxx EU. Náklady xx xxxx xxxxxxxx xxxxx xxxxxxx z xxxxxxxxxx Xxxxxxxx unie. Xxxxxxx státy budou xxxxxxxxxx systém napojení xx xxxxxx x xxxxxxxx Evropské unie, xxxxxxxxxxx xxxxxxxxx zabezpečení xx úrovni xxxxxxxxx xxxxx, zajištění xxxxxxxxxxxx xxxxxxxx zdrojů, IT xxxxxxx pro xxxxxxxxxxx xxxxxxxxx xx xxxxx Xxxxx republiky x xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxx činnost xxxxxx xxxxxx. Xxxxxxx xx xxxxx xxx x xxxxx xxxxxxx x xxxxxx EU xxxxx, xxxxx by xxxx xxxxxxxx prostředky získány, x části xxxxxx xxxxxxx xxxx. Po xxxxxxxx systému xx xxxxxx se samofinancováním, xxx. xxxxxxx xxxxxx xx posouzení xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx x žádostí x xxxxxxxx významných xxxx x xxxxxxxxxx xxxxxxx nad xxxxxxxxxx xxxxxxxxxxx by xxxx xxxxxx xxxxxxxx xxxxxx xx xxxxxxx xxxxxxxxxx XX xxxxxxx x xxxxxxx xxxxxx xxxxxx.
X xxxxxxxxxxx x výše xxxxxxxx ohledně xxxxxxx, xxxx. xxxxxxxxxxxxxxx, xxxxxxx Xxxxxx xxxxx xxx xxxxxxxx xxxxx x xxxxxxxxxxx zkušeností, xxx x uplynulých xxxxxx xxxx hrazeny xxxxxxx xx provoz a xxxxxxxxx Státního xxxxxx xxx xxxxxxxx léčiv, x xx xxxxxx xxxxxxxx souvisejících xx xxxxxxxxxx xxxxxxxxxxxxxx agend, xxxxxxxxx x xxxxxxxxxxx x požadavky xx xxxxxxxxxxxxx x efektivní xxxxxxxxxxxx systém xxxxxxxxxx xxxx členskými xxxxx, Xxxxxxxxx komisí a xxxxxxxxxxxx xxxxxxxx, xxx xx 75 - 80 % x xxxxxxxxxxxxxxxx xxxxxx.
Xxxxx xx xxxx agendy xxxxxxxxxx xxxxxxxxx x xxxxxxxxxxx x klinickým nařízením, xxx xxxxxx xxxxxxx xxxxxxxxxx žádostí x xxxxxxxx hodnocení x xxxxxxx x nařízením x sebou přinese xxxxxxx navýšení xxxxxx (xxxxxxxxx x důvodu xxxxxxxxx xxxxxxxx lhůt x xxxxxxxx ze xxxxxxxxxxx 65 dnů xx 21 xxx, x xx xxx xxxxxxxx xxxxxxxxxxx),&xxxx; xxxxxxx xxxx pak xxxx. xxxxxxxx předpokládá xxxxxxx xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxx (xxx xxxxx odstavec), xxxxx prostřednictvím a xxxxx jeho xxxxxxxxxxxxxxx xxxx možné xxxxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxx a Státní xxxxx pro xxxxxxxx xxxxx xxxx musí xxxxxxxx (xxxxxx) xxxxxx, xxxxxx xx do xxxxxxxxxx elektronického xxxxxxx xxxxxxx. Xxxxxxx xxxxxxxx xxxxxxx xxxxxxxx ze xxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx xxxxxxx xxxxxxxxx, x xx xxxxx na xxxxxxx, xxx i xxxxxxxx xxxxxx, xxxxxx xxx., xxxx investice xxxx xxxxxxx pouze xxxxxxxxxxx, xxx xxxx xxx xxxxxxxx xxxxxxxxx. Xxxxxxxx x tomu, xx existence evropského xxxxxxx je xxxxxxxxxxxxx xxxxxxxxx, pak Xxxxxx xxxxx pro xxxxxxxx xxxxx xxxx xxxxxxx x své xxxx xxxxxxxxxx, xx se xx evropského xxxxxxx xxxxxxxxx x žádosti xxxx xxxxxxxx x xxxxxxxx xxxxxx jako xxxxxxx, neboť by xx xxxxxxxxx kompletní xxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx, xxxx. celé XX, x procesu klinických xxxxxxxxx.
Xxxx xxxxx x xxxxxxxxxxx x navýšením xxxxxx s xxxxxxx xx xxxxx xxxxxxx xxxxxxxxxx xxxxxxx o xxxxxxxx hodnocení, ale xxxxxxxx x x xxxxxxx xx xxxxxxxxxxxxxxx xxxxxxxxx činnosti xxxxxx xxxxxx, bude muset Xxxxxx ústav xxx xxxxxxxx xxxxx xxxxx x xxxxxxxxx xxxxxxxxxxx, xxx xxxx xxxxxxx xxxxxxxxxx (xxxxxxxx a xxxxxxxxxxx xxxxxxxx, xxxxxxxx xxxxxxx xxxx.), což xxxxxx xxxxxxxx xxxxxxxxx xx strany Státního xxxxxx xxx kontrolu xxxxx.&xxxx; Aplikace klinického xxxxxxxx xxx xxx xxxxxx xx xxxxxxxx x xxxxxx o xxxxxxxx xxxx xxxxxxx x xxxxxxxxxx náklady. Xxxxxxxx xx xxxxx xxxxxxx xxxxxx xxxxxxxx xx xxxxxxx, Xxxxxx xxxxx pro kontrolu xxxxx xxxxxxxx xxxxxx xxxx xxxxxxx x xxxxxxxxxx xxxxxxxxxx xxxxxxxxxx x xxxxxx xxxxxx. Xx však xxxxxxxxxx, xx pokud by xxxx prostředky xxxxxx x xxxxxxxxx, xxxx xxx počítáno s xxx, xx veškeré xxxxxxx xxxxx xxxxx x xxxxxxxxxxxx xxxxxx.
Xxxxxxxxx xxxxxx xxx napojení xx xxxxxx x xxxxxxxx XX - xxx jen xxxxx xxxxxxxx, x tuto xxxxxx ještě není xxxx xxx zadávací xxxxxxxxxxx pro xxxxxx x databázi XX x xxxx xxxxx xxxxx, jakou část (xxxxx vůbec) komunikační xxxxxxxxx xxxx xxxxxxxxx. X toho xxxxxxx, xx xxx xxx xxxxx odhadnout xxxxxxx xx xxxxxx jednotlivých xxxxxxxxx xxxxx - xxxxxx bude xxxxx xxxx databáze xxxxxxxxxx xxxxxxxxx x XX, xxxxx xxxxxxxxx xxxxxx xxx xxxxxxxxx xxxxxxxxx x xxxxxxxx + xxxxxxxxxxx xxxxxx xx xxxxx ČR (xxxxxxxxxxx xxxxxx pro komunikaci Xxxxx, etická xxxxxx, xxxxxxx, aj.) - xxx xxxxxxxxx xxxxxxx xxx 30 xxxxxxx Xx, které bude xxxxxx Xxxxx x xxxxxxxxx xxxxxxxxxx, xxxxxxx-xx xxxxxxx z XX xxxxx.
Xxxxxxxx o 32 xxxxxx na straně Xxxxxxxx ústavu xxx xxxxxxxx xxxxx xxx xxxxxx klinického hodnocení.
Dopady xx regulované subjekty
Dopady xx xxxxxxxxxx
- Portál XX a xxxxxxxx xxxxxxxxxxx dokumentace xx xxxx zadavatelům usnadnit xxxxxx xxxxx; dále xx předpoklad, xx xx se xxxx xxxxxx náklady xx XX - xx xx xxxxxxx, protože xxxxxxxx xxxx xxxx xxxxxxxxxx xxx xx xxx xxxxxxxxxx v xxxxxxxx xxxxxxxxxxx, proto xxxxxxxx xx činnosti xxxx xxxxxxxxx nemusí x xxxxxxxx xxxxxx xxxxxxxx snížení.
- Xxxxxxxx xxxxx striktně xxxxxxxxx xxx. xxxx posouzení. Xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx způsobem dokumentaci xxx xxxxxxxxx připomínek, xxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxx považováno xx xxxxxxx (xxx xxxx, x které xxxxx xxxxxxxxxx se xxx stane). Xxxxxxxx xxxx umožněno xxxxx 1x, což xx xxx v dnešní xxxx, xxx xx xxxxxxxxx xxxxxxxx xx „xxxxxxxxxx“ x dává xx xxxxxxx xxxxxxxxxx xxxxxxx xxxxxxx či xxxxxxxx xxxxxxxxxx x xxxxxxxxxx. Xx již xxxxxx xxxxx, tím xxxx, xx xx xxxxxxxxxxx xxxx xxxxxxxxxxx xxx xxxx X xxxxx 1 členský xxxx = xxxxxxx xxxx zpravodaj. Čas xx xxxxxxxx xxxxxxxxxxx xx xxxxxxxx xxxxxxxx xx 12 kalendářních xxx (xxxx x xxxxx xxx. 10, xxx xxxx xxx x méně xxxxxxxxxx xxx). Xxxx xxxx xxxxxxxxx xxxxxx více xxxx, xxxxx mu xxxxxx x xxxxxxx xx xxxxxxx xxx (xxxxxxxx xxxx xx xxxxxxxx xxx xxxxxxxxxx - xxxxx i xxxxx). Xx xxxx x xxxxx xxxx x xxxxxxxxx xxxxxxxxxx xxxxxxxxx, xxxxxx znovupodávání x xxxxxxxxxx posuzování, xxx xx xxxxx xxxxx k xxxxxx xxxxxxxx zadavatelů x xxxxxxxx agentur x xxxxxxxx xxxxxx.
- Xxxxxxx xxxx xxx zadavatele, xxxxx provádí xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx (x XX xxx 90-95%) x xxxx xxxx xxxxxx v ČR (xx xxxx xxx 80-85% x xxxxxxxxxxxxxxxx XX), x xxxxxxxx xxxx xxxxxxx xxxxx xxxxxx xxxxxx, což xx mělo xxxxxxxxx. Xxxxxx to pro xx xxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxx xx. xxx xxxx XX.
- Xxxxxxxxxx xxxxxxxx xxxx xxxxxx xxxxxxxxxx xxxx xxxxxxxx, xxxxxxxxxxxx xx xxxxx x xxxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx. Xxxxx jednoznačně xx xxxx xxxx „práce“ xx xxxxxx agentur x xxxxxx xxxxxxxxxxx xxxxxxxxxxx x xxxxxxxxx xxxxxxxxxxx - xx xxxxxxx, xxxxx prostoru xx to xxxxxx x xxxxx xxxxxxx xxx.
- X xxxxxxx xx skutečnost, xx xxxxx není xxx xxxxxx EU, xxx xxxxxxxx EU, xxxxx xxxxx dopady identifikovat.
Pro xxxxxxxxx xxxxxxx, xxx xxxx xxx xxxxxxxxxxx:
- Xxxxxxxxxxxxx xxxxxxxxxxx
- Poskytovatelé xxxxxxxxxxx xxxxxx (xxxxxx x soukromoprávní)
- Xxxxxx xxxxx
- Xxxxxxx xxxxxxxxxxx
XXX (XxxxxxxxXxxxxxxxXxxxxxxxxxxx) –xxxxxxxxxxx, xxxxx x oblasti klinických xxxxxxxxx pro xxxxxxxxxx xxxxxxxxx x xxxxxx xxxxxxxx xx XXXX, xxxxxxxx xxxxxxxx, často xxxxxxxxx smlouvy x xxxxx xxxxxxxxxx xxxxxxxxx x se xxxxxxxxxxxx, xxxxxxxxxx xxxxxxxxxx xxxxxxxxx, xxxxxxx i xxxxxxxxxxxxxxxxx xxxxxxx (xxxxxx xx xxxxxxx xxxx zadavatelem x XXX; xxxxxxxxx xxxxxx xxxxxx xxxxxxxx, xxxxx pro něho XXX xxxx a xxxxxx xxx x xxxxxxxxxx)
- Xxx xxxxxxxx xxxxx xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx současně xxxx xxxxxxxx xxxxxxxx státům xxxxxxxxxxxxxxx xxxxxxx XX. Xx xxxxxxxxxxxxx, xx xxx xxxx X (xxxx X dokumentace) xxxx xxxxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxx xxxxx xxx; co xx xxxx part XX (xxxxx XX xxxxxxxxxxx, která xx xxxxxxxx xxxxx ke xxxxxxxxxxx xxxxxxxxx xxxxx, xxxxx xxxx xxxxxxxx, xxxx-xx xxxx xxxxxxxxx x jednat x xxxxx členským xxxxxx xxxx „kontaktní xxxxx“ xxx xxx xxxx X, x tom xxxxxxx xx xx xxx xxxx xxxx XXX.
- Xx xx xxxx jejich xxxxx xxxxxxxx - monitoring, xxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx, xxxxxxxxxxxx…. Xx xx mohlo xxx xxxxxx, xxxx současně
Pokud xx týká xxxx xxxxxxxxxx xxxxxxxxx
- Xxxx xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxx praxe xxx xxxxxxxxxx provádějící xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx (xxxx xxxxxxxxxxx se xxxxxxxx xxx xxxx, některé xxxx. xxxxxxxxxxx je xxxx); klinická hodnocení xxxx I (1.podání xxxxxxx) - nově; xxxxxxx xxxxx klinického xxxxxxxxx xxxxx požádat x xxxxxx xxxxxxxxxxx, xxx xxxx to xxxxxx xxxxxxx xxxxxxxxx; xxxxx xx xxxxxxxxx xxxxxxx xxxxxxxxxx
- Xxxxxxxx xxxxxxxxx léčivých přípravků xxxx prováděna u xxxxxxxxxxxxx xxxxxxxxxxxxx zdravotních xxxxxx
- Xxxxxxxx xx xxxxx xxxxx xxxxxx xxx xxxxx xxxxx
- Xxxxxxx xxxxxxx xx xxxxxxxxx xxxxxx - xxxxxxxx neřeší, xxxxxx xx být nařízením xxxxxxxxx
Xxxxx se xxxx xxxxxxxxxxxx
- Xxxxxxx xxxxxxxxxxxx x oblasti klinických xxxxxxxxx xxxxxxx xxxx, xxxxxxxx xxxxxxxx by xxxxxx xxx xxxxx xx xxxx oblast
- Xxxxxx o xxxxxxx xxxxxxxxxx hodnocení - xxx x současné xxxx xxxxx xxx XXX (XXX X6 - GCP = XxxxXxxxxxxxXxxxxxxx), xxxxxxxxxx xx xxxx xxxxxxx zprávy x xxxxxxx x xxxxxx xxxxx xxxxxxxxxx xxxxxxxxx xxxxxx xxxxxx, xxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx
- Xxxxxxxx xxxxxx xx xxxxxxxxx xxxxxxxxxx xxxxxxxxx - ¨xxxxxxx xxxxxx xxxxxxxxx - xxxxxxxx by xxxxxx xxx xxxx xx xxxx xx změnám
Dopady xx xxxxxxxxxx xxxxxxxxxx
- xxxxxxx xxxxxx xx xxxxxxx xxxxxxxxxx klinických xxxxxxxxx xxxxxxxx. V xxxxxxxx xxxx xx xxxxxxxxxx spolupráce XXXX x xxxx xxxxxxx (xxxxxxxxx o klinických xxxxxxxxxxx, xxxxxxxxxxxx x xxxxxxxxxx účasti x xxxxxxxxx xxxxxxxxx, xxxxxxxxx xxxxx xxxxxxxxxxxxxx). Tuto xxxxxxxxxx XXXX xxxxxxxxxxx x nadále. Xxxxxx xxxx , aby xx xxxxxxxxxx organizace xxxxxxxx do činnosti xxxxxxxx komisí.
- nařízení xxxxxx xxx xxxxxxxx xxxxxx xxxxx na xxxxxxxxxx xxxxxxxxxx
Xxxxx xx xxxx xxxxxx xxxxxx, xxxxx SÚKL a Xxxxxxxxxxxx zdravotnictví, xxxxxxxx xxxxxxxxxxx x xxxxxxx
XXXX (Xxxxxx xxxx pro xxxxxxxx xxxxxxxxxx)
- Xxxxxxxxxx xxxxxxx o xxxxxxx xxxxxxx neregistrovaného xxxxxxxxxxxx x XX - xxxx současný xxxx
XXX
- Xxxxxxxxxx xxxxxxx x xxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxx přípravky x xxxxxxx GMO x XX - jako xxxxxxxx xxxx
XXXX
Xxxxxxxxxx xxxxxxx x možnost xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxxxxx xxxxxxxx xxxxxxx x XX - nová xxxxxxx xxx xxxxxx xxxxxxx xx xxxxxxxx subjektech, xxxxx xxxxxx xxxxxx; XXXX xxxxxx xxxxxxx x lidskými xxxxxxxxxxxxx xxxxxxx xxx xx, xxxxxxx nebyla xxxxxx x xxxxxx za xxxxxx xxxxxxxx xxxxxxxx, xx tohoto xxxxxxxxxx xx xxxx xxxxxxxx (xxx xxxxxx o xxxxxxxxxxxxx bb.) i xxxxxxxxxxxx zdravotnictví
3.2.2. Xxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx
Xxxxx xxx x xxxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxxx x xxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx, předpokládá xx xxxxx xxxxxxx xxxxxxxxx xx zavedením xxxxxx xxxxxxxxx a xxxxxxxxxxxxx xxxx, xxx jsou xxxxxxxxx potřeby pacientů x Xxxxx republice, x dále x xxxxxxxxxx opatření x xxxx xxxxxxxxx, kdy xxxxxxxxxx léčivých xxxxxxxxx xx zahraničí způsobí xx jejím xxxxx xxxxxx xxxxxxxxxx. Xxxx xxxxxxx xxxxx xxxxxx x xxxxx xxxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx léčiv x Xxxxxxxxxxxx zdravotnictví.
Navýšení o 4 xxxxxxxx xxxxxx xxxx spočívat xx 2 xxxxxxxxxx xxxxxxxx xx Xxxxxxx ústavu xxx xxxxxxxx xxxxx (xxxxxx xxxxxxxxxxxx odůvodněných xxxxxxx xxxxxxxxxxx Ministerstvu), x ve 2 xxxxxxxxxx úvazcích xx Xxxxxxxxxxxx xxxxxxxxxxxxx. Činnost xx Ministerstvu xxxxxxxxxxxxx xxxx spočívat xx xxxxxxxxx xxxxxxxxx xxxxxx xxxxx xxxxxx odborným xxxxxxxxxx xxxxxxxxxxx xxxxxxxx x zároveň odborné xxxxx xxxxxx odborným xxxxxxxxxx xxxxxxxxxxxxxxx či xxxxxxxxxx xxxxxxxx.
Xxxxx se xxxx xxxxxx xx xxxxxxxxxx xxxxxxxx:
Xxxxxx xx xxxxxxxx xxxxxxxxxx x xxxxxxxxxx
Xxx xxxx xxx xxxxxxxxx - xxxxxxx xxxx právnická xxxxx, xxxxx odpovídá xxxxxxxxxx §26 odstavec 4 xxxxxx o léčivech
- Xxxxxxxxxx právní úprava xxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx uvedené x §33 zákona x léčivech xxxxxxxxxx xxxxxxxxx o xxxxxxxx xxxxxxxxxxx dodaných na xxx x České xxxxxxxxx. Xxxx xxxx xxxxxxx poskytovat xxxx xxxxx v xxxxxxxxxxxx xxxxxxxxxxx v xxxxxxxxxxxx xxxxxx, xxx xxxx xxxx xxxx pravidelně x xx xxxxxxxxxxxxx xxxxxx dostupná Xxxxxx xxxx informační xxxxx, xxxxx poskytuje xxxxxxxxx x množství xxxxxxxx xxxxxxxxx, jeho konkrétní xxxxx, xxxxxx držitelem xx xxx x Xxxxx xxxxxxxxx.
- Xxxx xxxxx xxx xxxxx xxxxxxx Ústavu xxx xxxxx ze xxxxxx xxxxxxxxx xxx xxxxxxxxxx xxxxx zásob xx xxxx x České xxxxxxxxx, ve xxxxxx x xxxxxxxxx xxxxxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx x x xxxxxxxxx xxxxxxx dopadu distribuce xxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx, xxxxx xx xxx xxxxxx xx xxxxxxx xxxxx §77c xxxxx x xxxxxxxx.
- Xxxxxx úprava xxx xxxxxxx xxxxx xxxxxxx x xxxxxx xxxxxxxxxx xxxxxxxx dodávky xxxxxxxx xxxxxxxxx x xxxxxxxx dostatečném pro xxxxxxx pacientů v XX.
Xxxxxx na xxxxxxxxxxxx
Xxx může xxx xxxxxxxxxxxxx:
- Xxxxxxx povolení x xxxxxxxxxx xxxxx xxxxxx Ústavem xxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx x členském xxxxx XX
- Distributoři xxxxx, x xxxxxxx léčivých xxxxxxxxx xxxxxxxxx na xxxxxxx podle §77c xxxxxx x xxxxxxxx, xxxxxxxxxx distribuci do xxxxxxxxx xxxxxxxxxxxxxxx elektronického xxxxxxxxx. Pokud xxxxxx xx 15 dnů xx xxxx zaslání xxxxxx XXX xxxxx §77d bude xxxx xxxxxxxx xxxxxxx.
- Xxxxxxx xxxxxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx nebude xxxxxxxx xxxxxxx na xxx xxxxxxxx touto xxxxxxx, xxx xxxxxxx x xxxxxxx xxxxxxxxxxxxxxx zátěže xxxxxxx se xxxxxxxxxxx xxxxxxx.
- Xxxx xxxxxxxxxxxx, xxxxx xxxxxxxx, xxxxxxxx x xxxxxxxxxx rozsahu, xx lékáren x xxxxxxxxx xx xx xxxxxxxxxx xxxxxxxx přípravků xxxxxxxx xx xxx x České republice xx xxxxxxxxx, xxx xxxx xxxxx xxxxxxx xxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxxx. Xxxxxxx xxx xxxxx x x x xx větší xxxx xxxx xxxxxxxx xxxxx xxx xxxxxxxxxx xxxxxxxx přípravků xxxxxxxxxxx x xxxxx xxxxxxxxx, xxxxxxx do lékáren.
Dopady xx „lékárny“ - xx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxxx péče
Kdo xxxx xxx „xxxxxxxx“: Xxxxxxx xxxxxxxxx x xxxxxxxxxxx lékárenských xxxxxx xxxxx zákona č. 372/2011 Sb., xxxxxx o xxxxxxxxxxx xxxxxxxx
- Xxxxxxxxxx xxxxxx xxxxxx nepřinese lékárnám xxxxx xxxx zákonné xxxxxxxxxx, xxxxxx proto xxxxxxxxxxxx xxxxxx administrativní xxx xxxx xxxxxx.
- Xxxx xx xxxxxxxx xxxxx xxxxxxxxxx xxxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxx xx xxxxxxxx
- Xxx xxxxxxxx xxxx xxxxxxxx xxxxxxxxx xxxxx x xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx než xxxxxxx, xxx široké veřejnosti xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxx xxxx, bez xxxxxxxx xxxxxx náhradní xxxxx.
3.3 Přínosy
3.3.1.Adaptace nařízení x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx léčivých xxxxxxxxx
Xxxxxxxxxxxx xxxxxxx podávání x xxxxxxxxxx xxxxxxx x xxxxxxxx klinického xxxxxxxxx x xxxxxxxx xxxxxxxxx xxxxxxx XX a xxxxxxxx EU xx xxxx xxxxxxx xxxxxxx xxxxxxx xxxxxxx xxxxxxxxxx x xxxxxxxx vyšší xxxx xxxxxxxxxxxx. Xxxxxxxxx xxxx xxx x xxxxxxxxx xxxxxxxxx žádost xxx xxxxxxx členské xxxxx, xx kterých xx xxxx xxxxxxxx xxxxxxxxx xxxxxxxx, x xxxxxx xxxxxx xxxxxxxxxx xxxxxxx xx měl xxx xxxxxxxxx x xxxxxxxxx. To xx xxxx xxxx x xxxx xxxxxxx počtu xxxxxxxxxx xxxxxxxxx na xxxxx Xxxxxxxx unie x tím x x Xxxxx xxxxxxxxx.
X xxxxxxxx xxxx xxxxxxxxx xx xxxx xxx xxxxxxx možnosti xxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxx xxxxx pro xxxxxxxx, xxxxxxx finančních xxxxxx xxx xxxxxxxxxxxxx zdravotních xxxxxx, xxx xx xxxxxxxx xxxxxxxxx xxxxxxxxx, xxxxxxx xxxxxxxx xxxxxx xxxxxx x xxxxxxxxx xxxxxxxxx x mezinárodním xxxxxxx.
Xxxx nařízení x xxxxx systém xx xxxxxxxxx harmonizace x xxxxx Xxxxxxxx xxxx, xxxxx xx poli xxxxxxxx xxxxxxxxx probíhá xxx značnou xxxx. Xxxxxxx xxxxxx byl xxx xxxxxxx v xxxxxxx xxxxxxxxxx léčivých xxxxxxxxx a vzhledem x tomu, xx xx xxxxxxxx x xxxxxxxxxxx v xxxxx xxxxxxxx vzájemného xxxxxxxx xxxxxxxxxx je xx xxxxxx xxxxxx, xxx xxxxx xxxxx xxxxxx xxx xxxxxx xxxxxxxxxx xxxxxxxxx samozřejmě x xxxxxxx xx xxxx xxxxxxxxx.
Xxxxxxxx xxxxxx xxxxxx xxxxxxxxx klinických xxxxxxxxx xxxxxxx spíše xxxxxxx xxxxxxxxxx xxxxx, x xx x xxxx xxxxxx, xx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxx komisí xxxxx xxxxxxxxx právní xxxxxx přímo xxxxxxxxxxxxx&xxxx; xxxxxxxxxxx služeb, v xxxxx xx klinické xxxxxxxxx xx xxxxxxxx x v xxxx xx x xxxxxxx, xxxxxxxxxx představuje snazší xxxxxxx ovlivnění xxxxx xxxxxxxx xxxxxx x x tím xxxxxxxxxxx xxxxx korupční rizika, xxx xxxx představuje x xxxxxx xxxxxx xxxxxx zaváděný systém xxxxxx komise x xxxxxx skupin, které xxxxxxx xxxxxx xxxxxx xxxxxx xxxxxxxxxx, xxxx xxxxx xxxxxx xxxxxx, x xx xx xxxxxxxxxxxx skupin, xx xxxxx navrhované xxxxxx xxxxxx xxxxxxxx x xxxxxxxxx přímo xxxxxxx xxxxxxxxxxxxx.
3.3.2. Xxxxxxxx xxxxxxxxx x omezení reexportu xxxxxxxx xxxxxxxxx
Xxxxxxxx xxxxxxxxxxxxx xxxxxx zákona xx xxxxx přijímání xxxxxxxx xxxxxxxxxxx k xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxx dostupnosti xxxxxxxx xxxxxxxxx xxx xxxxxxxx x České xxxxxxxxx, x xxx xxxxxxxx xxxxxxxx xxxxxxx xxxxxx xxxxxx.
Xxxxxxxx xxxxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxx xx xxxxxxxxxxxxx x vyhodnocování xxxxx x distribuci x xxxxxxxx xxxxxxxx přípravků, xxxxx xx xxxxxxxx xx více xxxxxxxx, x xx jak xx xxxx, xxxxx xxxxxx přípravky xxxxx xxxxxx dodávají, xxx x xx xxxx, xxxxx xx xx xxxxxx osob přijímají, x xxxxxxx xxxxx xxxxxxxx xxxxxx by xxx xxx xxxxxxxxx xxxxxxxxx xxxx xxxxxxx xxxxxx x opačně. Xxx xxx x xxxxx xxxxxxx xxxxxxxx xxxxxxxx, které xxxx x xxxx vzájemně xxxxxxxxxxxx obdobně xxxx xx xxxx x xxxxxxx xxxxxxxxxx, xxx xxxxx „xx dáti“ xxxxxxxx xxxx „xxx“ . Údaje x xxxxxx vyvážených léčivých xxxxxxxxx xx xxx xxxxx považovat xx xxxxxxxxx x xxxxxxx xxxxxx xxxxxxxxx xx xxxxx xxx xxxxxxxxxx. X xxxx xxxxxxxxxxx xx xxxxx xxxxxxxxxxx, xx xxxxx nebyly xxxxxxxx nějaké závažné xxxxxxx, kdy by xxxxxx xxxxxxxxx byly xx xxxxxxxxxxx fakticky xxxxxxxx xxxx Xxxxxx xxxxxxxxx, x přitom xx xxxxxx xxxxxxx xxxx xxxxxxxx xxxxxxxxxx xx xxxxx Xxxxx xxxxxxxxx. Xxxxxxx takového xxxxxxxxxx xxxxxxx xx xxxxxxx xxxxxx x xxxxxxxxx vyhodnocováním rozhodných xxxxx x xxxxxxxxxx x xxxxxxxx léčivých xxxxxxxxx výrazně xxxxxxx xx xxxxx vyloučena. Xxxxxxxx xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxxx xxxxxx korupčních xxxxx.
3.4 Xxxxxxxxxxx nákladů x xxxxxxx xxxxxxx
3.4.1. Xxxxxxxx nařízení o xxxxxxxxxx hodnoceních xxxxxxxxx xxxxxxxx přípravků
Vyhodnocení xxxxxxx x xxxxxxx xxxx xxxxxxxxx x xxxxx xxxxxxxxxxxx variant řešení, xxx je uvedeno xxxx.
3.4.2. Xxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx
Xxxxxxxxxxx xxxxxxx x přínosů xxxx xxxxxxxxx v xxxxx xxxxxxxxxxxx xxxxxxx řešení, xxx xx xxxxxxx xxxx.
3.4.3. Adaptace xxxxxxxx xx xxxxxx x xxxxxxx xxxxxx xxx xxxxxxx xxxxxx xxxxxxxxx
Xxxxxxx xxxxxxxxx xx varianta xxxxxxx xxxxx xxxxxx x xxxxxxxx tak, xxx xxxx náležitým xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx Xxxxxx x xxxxxxxxx xxxxxxxxx (XX) č. 1252/2014.
3.4.4. Součinnost Státního xxxxxx xxx xxxxxxxx xxxxx x Generálního xxxxxxxxxxx xxx
Xxxxxxxx 1 xxxxxxxxxxx xx xxxxx xxxxxx x xxxxxxxx xx xx výhodu, xx přináší xxxxxx xxxxxx problému, x xxxxxx se xxxxxxxxx xxx xxxxxxx právním xxxxx, a xx xxxxxxxxx xxxxxxxxxxx §8 xxxxxx x. 226/2013 Xx.
Xxxxxxxx 2 xxxxxxxxxxx x xxxxxxx doprovodné xxxxxx xxxxxx o Xxxxx xxxxxx České xxxxxxxxx x xxxxxx xxxxxx novely xxxxxx x léčivech by xxxxxxxx xxxx rychlé xxxxxx, xxxxx xxxxxx xx xxxxxxx xx xxxxxxxxxx xxxxxx resortu, x xxxxx xx xxxx omezeny xxxxxxxx xxxx xxxxx, xxxxx xx xx xxxxxxx xxxxxx změny praxe xxxxxxxxxx.
Xxxxxxxx 3 spočívající xx xxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxx o Xxxxx xxxxxx Xxxxx xxxxxxxxx xx ten xxxxxxx nedostatek, xx xx xxxxxxxx xx xxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxx novelizace xxxxxx č. 17/2012 Sb. xxx xxxxxxxx xxxxxxxxx spolupráce xxxx xxxxxx xxxxxx správy xx xxxxx dlouhou xxxx, xxxxxxx xxxx x xxxxxx by xxx x České xxxxxxxxx nebyla xxxxxxxxxx xxxxxx.
3.4.5. Prokazování xxx xxxxxxxxx xxxxxxxx x xxxxxx xxxxxxxxx zajištění x zabrání léčivých xxxxxxxxx
Xxxxxxxx 1 není xxxxxxx x xxxxxx xxxxxxxxx xxxxxxxx. Xxxxxx xxxx přijetí by xxxx za následek xxxxxxxxxxx xxx praxi xxxxxxxxxxxx xxxxxxxxxx právní xxxxxx, xxxxx xxxxxxxx xxxxxx xxxxxxx xxxxxxxxx xx xxxxxx xxxxxxxxxxxxxx xxxxxxxx, xxx které xx xxxxxxxx právní xxxxxx xxxxxx xxxxxxxx xxxxx matoucí x xxxx ke xxxxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxx x x xxxxxxx xxxxxxx xxx xxxxxxxxxxx xxxxxxxxxx. Nemožnost xxxxxxxx či následně xxxxxx xxxxxxx xxxxxxxx xxxxxxxxx nebo léčivé xxxxxxxxx, xx xxxxxxx xxxxxxxxx xxxxxxxxxxx osoby, xxxxxxxxxxx významná xxxxxx xxx xxxxx nabyvatele xxxxxxxxxx xxxxxxxx přípravků, x možným xxxxxxxxx xxxxxxxxxx xxxxxxx xx xxxxxx zdravotní xxxx. Xxxxx zabrání xxxxxxxx xxxxxxxx přípravků xxxxxxxxxxx xxx osoby, xxxxxx xxxx xxxxxxx, xxxxxx xxxxxxxxxx xxxxx, xxxxx xxxx xxxxxxx xxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxxxx x xxxxxxxxxxx xxxxxxxx.
Xxxxxxxx 2 xx xxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx xxx xxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxx právních xxxxxxxxx zajištění x xxxxxxx xxxxxxxx xxxxxxxxx xxx, xxx xxxx xxxxxxxxxx x xxx xxxxxx situace, kdy xx xxxxxxxx, xx x nimi xxxxxxxxx xxxxx, xxxxx k xxxx nejsou podle xxxxxx oprávněny. Xxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx ochrany xxxxxxxx x xxxx xxxxxxxxxxx xxxx xxxxxx xxxxx xxxxxxxx xxxxxxxxx, xxxxxxx xxxxxx, xxxxxxxx a xxxxxxxxxx nebyla xxxxxxxxx x xxxxxxx životního xxxxx léčiva x xxxxxxxxxxx xxx xxxxx xxxxxx riziko pro xxxxxx xxxxxxxx a xxxxxxxx xxxx náklady xxx systém xxxxxxxxx xxxxxxxxxxx xxxxxxxxx, x xxxxxxxxx xxxxxxxxx s xxxxxxxxxx dopadem xx xxxxxx xxxxxxxx.
4. Návrh xxxxxx
4.1 Xxxxxxxxx xxxxxx xxxxxxx x výběr xxxxxxxxxxxxxx xxxxxx
4.1.1. Xxxxxxxx xxxxxxxx pro xxxxxxxx xxxxxxxxx humánních xxxxxxxx xxxxxxxxx
Xxxxxxxxx xxxxxxxx x xxxxxxxxxxx xxxxxxxxxxxx variant xxxx xxxxxxxxx, xxx xx xxxxxxx xxxx.
4.1.2. Xxxxxxxx xxxxxxxxx k xxxxxxx xxxxxxxxx léčivých xxxxxxxxx
Xxxxxxxxx xxxxxxxx x xxxxxxxxxxx xxxxxxxxxxxx xxxxxxx xxxx xxxxxxxxx, xxx xx xxxxxxx výše.
4.1.3. Xxxxxxxx xxxxxxxx xx xxxxxx k xxxxxxx xxxxxx pro xxxxxxx xxxxxx přípravky
Doporučenou xxxxxxxxx xx xxxxxxxx xxxxxxx xxxxx zákona o xxxxxxxx xxx, aby xxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx Xxxxxx x přenesené xxxxxxxxx (EU) č. 1252/2014.
4.1.4. Xxxxxxxxxx Státního xxxxxx xxx xxxxxxxx xxxxx x Xxxxxxxxxxx xxxxxxxxxxx xxx
Xxxxxxxxxxx xxxxxxxxx xx xxxxxxxx 1 spočívají xx xxxxx xxxxxx x xxxxxxxx. Xxx x xxxxxxxxxxxx, x xxxxxx nejoperativnější řešení xxxxxxxx, když navíc xx xxx xxxxx xxxxxxxxxxx xxxxxxx systém xxx xxxxxxxxx xxxxxxx xxxxxxx řádem, xxxxx x xxxxx xxxxxx xxxxxx x xxxxxxxx xx. Xxxx xxxxxxxx xxxxxx koordinovat kontrolní xxxxxxxxxx xxxx xxxxxx xxxxxx správy x xxxxxxxx xxx účinnou xxxxxxx xxxx Xxxxx xxxxxxxxx a současně xxxx EU xxxx xxxxxxx xxxxx, která xxxxxxxxxxxx xxxx xxxxxxxx xxxxxxx xxxxxxxxxx v xxxxxx XX.
4.1.5. Xxxxxxxxxxx xxx inspekční xxxxxxxx x xxxxxx instituty xxxxxxxxx x xxxxxxx xxxxxxxx přípravků
Doporučenou xxxxxxxxx xx xxxxxxxx 2, xxxxxx xx xxxx xxx xxxxxxxx xxxxxxx xxxxxxxxx xxxxxx prokazování xxxxxxxxxx při xxxxxxxxx xxxxxxxxx činnosti a xxxxxx by se xxxx xxxxxxxx právní xxxxxxxxx zajištění x xxxxxxx xxxxxxxx xxxxxxxxx xxx, xxx xxxx xxxxxxxxxx i xxx xxxxxx xxxxxxx, kdy xx xxxxxxxx, xx x xxxx zacházejí xxxxx, xxxxx k xxxx nejsou xxxxx xxxxxx xxxxxxxxx. Xxxxxx xx tak xxx xxxxxxxxxxxxx pro xxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxx, xxxxx xx xx vztahu xx xxxxxxxxxxxxx subjektům xxxxx xxxxxxx x xxxx xx sporům a xxxxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxx a xxxxxxxxxx xxxxxxxxxxxxx časovému xxxxxxx xxxxxxxxxxx xxxxxxx.
Xxxxxxxxx xxxxxxxx či následně xxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxx xxxxxxxxx, se kterými xxxxxxxxx neoprávněné xxxxx, xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx xxx možné xxxxxxx x jejich xxxxxxxx. Xxxxx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx xxx xxxxx, xxxxxx xxxx xxxxxxx, xxxxxx xxxxxxxxxx xxxxx, xxxxx xxxx xxxxxxx xxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxxxx x neoprávněné xxxxxxxx.
5. Xxxxxxxxxxxx doporučené xxxxxxxx a xxxxxxxxxx
Xxxxxxx xxxxxxxxxx za xxxxxxxxxxxx xxxxxxx varianty xxxxxx, xxxxx xxx o xxxxxxxx nařízení o xxxxxxxxxx xxxxxxxxxxx humánních xxxxxxxx xxxxxxxxx, xxxx xxxxxxxxx Xxxxxx xxxxx xxx xxxxxxxx xxxxx, xxxxx je již xxxxx stávajícího xxxxx xxxxxx x xxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxx pro xxxxxx xxxxxxxx léčiv, včetně xxxxxxxxxx x xxxxxxx xxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx léčivých xxxxxxxxx. Xxxxxx ústav pro xxxxxxxx léčiv xx xxxxxxx xxxx xxxx xxxxxxx xxxxxxxxxx v xxxxxxx jakosti, xxxxxxxxx x xxxxxxxxxxx léčiv, x xx x xx xxxxxx x xxxxxxxxxx orgánům členských xxxxx i Evropské xxxx.
Xxxxxx xxxxxxxxxxx xx xxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxx, xxxxx jde x opatření xxxxxxxxx x omezení reexportu xxxxxxxx xxxxxxxxx, xxxxx xxxxxxxxx Ministerstvo xxxxxxxxxxxxx x Xxxxxx xxxxx xxx xxxxxxxx xxxxx. Xxxxxxxxxx varianta xxxx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxx seznamu léčivých xxxxxxxxx, které xxxx xxxxxxxx xxxxxx nedostupností, x xxxx při xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxxx léčivých xxxxxxxxx xxxxxxxxx xx xxxxx xxxxxxx xxxx xxxxx Xxxxx xxxxxxxxx. Xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx xxxxxxx xx xxxxxxx xxxxxxxxx přesných x aktuálních xxx x xxxxxx, xxxxxx xxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxx, xxxxxxxx v xxxxxxxxxx xx xxxxxxx xxxxxxxxx vyhodnocování operativní xxxxxx xxxxxxxxxxx xxxxxxxx. Xxxxxxxxxx vynucování xxxxxxxxx x xxxxxxxx stanovení xxxxxx xx xxxxxxxx xxxxxxxxxxx povinností.
6. Xxxxxxx xxxxxxxxx xxxxxxxx
Xxxxxxx xxxxxxxxx xxxxxx xxxxxx x xxxxxxxx budou x xxxxx xxxxxxxx Ministerstvo xxxxxxxxxxxxx x Xxxxxx xxxxx pro xxxxxxxx xxxxx xx xxxxxxxxxx x dotčenými subjekty, x xx z xxxxxxxx účinnosti nové xxxxxx xxxxxx x xxxxxxx z xxxxxxxx xxxxxxxxxx xxxx xxxxxxxxxxx xxxxx xxxxxx xxxxxxx. Xxxxx impulsy ke xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx léčivých xxxxxxxxx lze očekávat xx Xxxxxx, xxxxx xx xxxxxxxxxxx čl. 97 xxxxxxxx x. 536/2014 xxxxxx přezkum uplatňování xxxxxx xxxxxxxx.
Xxxxxxxxxxx xx 2 xxxxxx xx xxxxxxxxx xxxxxx xxxxxx xxxxxxxxx xxxxxxxxx vyhodnotí xxxxxx pro pacienty.
Pro xxxxxxxxx naprosto přesných xxx xxx xxxxxx xxxxxxx xxxxxxxx bude xxxxx x xxxxxxx, xxx by bylo xxxxxxxxxx x xxxxxxx xxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxx přípravků, xxxxxxx zdokumentován. Xxxxxxx xxxx xxxxxxxxx, kolik xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx, x xxxx konkrétní xxxxx XXX celkem xxx x nich xxxxxxx. Xxxxxx bude x xxxxxx xxxxxxx xxxxxxxxxxx, zda x xx xxxx xxxx xxxxxxx opatření xxxxxxxx xxxxxxxx xxxxxxx dostupnosti xxxxxxxxxxx xxxxxxxx přípravků xxx xxxxxxxx x Xxxxx xxxxxxxxx x xxxx porovnán xxxx xxxxxxxxxxx xxxx přijetím xxxxxxxx a xx xxxx přijetí se xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxx x xxxx xxxxxx tohoto opatření.
Kromě xxxxxxxxxx vyhodnocení xxxxxxxxx xxxxxxx xxxxxxxxx opatření xxx xxxxxxxx xxxxx xxxxxxxxxxx xxxx xxxxxxxx xxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxx xxxxxx xx zásadních ukazatelů xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxx dodávek, xxxxx xx x xxxxxxx nepřijetí xxxxxxxx xxxx x dosavadním xxxxxxx xxxxxx xx xxxxxxxxx, x finančního xxxxxxxxxx xxxxxx dodávek, xxxxx v xxxxxxxx xxxxxxx opatření xxxx xxxxx xx zahraničí xxxxxx na trh x České xxxxxxxxx. Xx základě xxxxxxxxxxx xxxxxxxxxxxx případů pak xxxx provedeno souhrnné xxxxxxxxxxx xxxxxx xxxxxx xxxxxx účinnosti xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxx xxxx xxx přezkumu xxxxxxxxx xxxxxxxx hodnocen xxxxx xxxx xxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx jsou xxxxxxxx jejich nedostupností, x xxxxxxxxx opatřeními xxxxxxxxx k omezení xxxxxxxxx xxxxxxxx přípravků, xxx mohlo být xx xxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx, xxx xxxxxxxx xxxxxxxxxxxx xxxxxx regulace vývozu xxxxxxxx xxxxxxxxx x xxxx xxxxx jednotlivě x ve xxxx xxxxxxx xxxxxx xxxxxxxx xxxxxxxxxxx potřebě x xxxxxxx xxxxxxx xxxxxxxx xxx pacienty v Xxxxx xxxxxxxxx náležitou xxxxxxxxxx xxxxxxxx xxxxxxxxx.
7. Xxxxxxxxxx a xxxxxx xxx
Xxxxx zákona xxx x xxxxxxx přípravy xxxxxxxx xxxxxxxxxxx x xxxxxxxxx dotčenými subjekty. Xxx xxxxxx xxxxxxxx xxxxxx x náhrady xxxx se xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxx pro xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx a Xxxx xxxxxxxx komisí. Xxxxxxxxxxx x připravovaných xxxxxxx x xxxxxxxx xxxxxxxxxx xxxx zástupci xxxxx etických xxxxxx xxx multicentrická hodnocení x xxxxxxxx místních xxxxxxxx komisí účastnících xx jednání Fóra xxxxxxxx xxxxxx. Informovány xxxx x pacientské xxxxxxxxxx s xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxxx organizací xx xxxxxxxx etických xxxxxx. Xx xxxxxx xxxxxxxx xxxxxxxxx nových xxxxxxx xxxxxxx škod xxxx xxxxxxxx zadavatelé xxxxxxxxxxxxxxx Xxxxxxxx inovativního xxxxxxxx, Xxxxxxxx generických přípravků, xxxxxxxx Asociace xxxxxxxxxx xxxxxxxxx organizací, Xxxxxxxx xxxxxxxxxx záruk. Xxxxxxxxxxxx xxxxxxxxxxxxx tuto xxxxxx xxxxxxxxxxxx x Xxxxxxxxxxxxx xxxxxxx x Xxxxxxxxxxxxx xxxxxxxxxxxxx.
Xxxxxxx implementovat xxxxxxxx xxxxxxxxx k omezení xxxxxxxxx xxxxxxxx přípravků xxxx xxxxxxxxx projednávána x jednotlivými xxxxxxxx xxxxxxxxxx x xxxxxxxxxx, xxxxx xxxxxxx xxxxxxxx xxx zamezit xxxxx xxxxxxxx xxxxxxxxx xx xxxxxxx určených xx xxx x České xxxxxxxxx do xxxxxxxxx x rovněž x Xxxxxxxx inovativního xxxxxxxx.
Xxxxx xxxxxx xxxxxx x xxxxxxxx xxx v xxxxx meziresortního xxxxxxxxxxxxxx xxxxxx v souladu x xx. 8 Xxxxxxxxxxxxxx pravidel xxxxx xxxxxxxxx s xxxxxxxxx xxxxxxxxxxxxxx místy.
8. Xxxxxxx xx zpracovatele RIA
Jméno x xxxxxxxx: MUDr. Xxxxx Xxxxxxx
Xxxxxx: xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx
Xxxxx: Xxxxx registrací, xxxxxxxx xxxxxxxxxx hodnocení XXXX
Xxxxxxx: 272 185 817; 724 917 141
x-xxxx: xxxxx.xxxxxxx@xxxx.xx
Xxxxx a xxxxxxxx: Xxx. Xxxxxxx Xxxxxxxx
Xxxxxx: xxxxxxx sekce xxxxxx
Xxxxx: Xxxxx xxxxxx Státního xxxxxx pro kontrolu xxxxx
Xxxxxxx: 272 185 706
x-xxxx: xxxxxxx.xxxxxxxx@xxxx.xx
X. Zhodnocení xxxxxxx navrhované xxxxxx xxxxxx x xxxxxxxx xxxxxxxx Xxxxx xxxxxxxxx, x xxxxxxxxxxxxx xxxxxxxxx x x xxxxxxxx Xxxxxxxx unie, xxxxxxxxxxx xxxxxxxx xxxxxx Xxxxxxxx xxxx x xxxxxxxx xxxxxxxx zásadami práva Xxxxxxxx unie
Navrhovaná právní xxxxxx odpovídá ústavnímu xxxxxxx x xxxxxxxx xxxx České xxxxxxxxx, xxxxxxx xxxxxxxxx zákonu č. 1/1993 Sb., Xxxxxx Xxxxx xxxxxxxxx, xx xxxxx xxxxxxxxxx předpisů, x xxxxxxxx xxxxxxxxxxxxx Xxxxx xxxxxxx xxxx č. 2/1993 Sb., x xxxxxxxxx Listiny xxxxxxxxxx xxxx a xxxxxx xxxx součásti xxxxxxxxx xxxxxxx České xxxxxxxxx, které xx xxxxxxxx x xxxxxxxxxxxxx xxxxxx zákona.
Navrhovaný xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxx v xxxxxxx x xxxxxxxxxxxxx xxxxxxxxx, xxxxxxx je Česká xxxxxxxxx xxxxxx.
Xxxxxxxxxx právní xxxxxx xx x xxxxxxx x Úmluvou x xxxxxxx lidských xxxx a xxxxxxxxxx xxxxxx. Xxxxxxxxx xxxxxx xx xxxxxxxxxxx xxxxxx x rámci xxxxxxxxx xxxxxxxx, xxxxx procesní xxxxxxxx se xxxxxxxxxxx xx xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxx a xxxxxxx x xxxxxxxxxxx, xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxx xxxxx xxxxxxxxx, xxxxxxxxx xxxx x xxxxxxxx xxxxxxxxxx x vymezena xxxxxxx xxxx pokut.
Navrhovaná xxxxxx xxxxxx xx xxxxxx x xxxxxxx s Xxxxxxx x xxxxxxxx xxxxxxx a xxxxxxxxxxx, xxxxxxxxx pod č. 96/2001 Sb. m. s. Xxxxx x xxxxxxx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx mimo xxxx xxxxxxxxxx xxxxxxxxxx čl. 3 Xxxxxx, podle xxxxxxx xxxxxxx strany, majíce xx xxxxxxx xxxxxxxxx xxxxxxx a xxxxxxxx xxxxxx, učiní xxxxxxxxxxxx xxxxxxxx, aby x xxxxx xxx xxxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxx xxxx patřičné xxxxxxx. Xxxxxxxxx xxxxxxxxx xxxx patřičné xxxxxxx xxxxxx zahrnuje xxxxxxxxx xxxxxx xxxxxxxx v Xxxxx xxxxxxxxx x xxxxxxx xxxxxxxx xxxxxxxxx, xxx tyto xxxxxx xxxxxxxxxxxxx xxxx Xxxxxx xxxxxxxxx na xxxx xxxxxxxxxx náležitých xxxxxx xxxxxxxx x Xxxxx xxxxxxxxx.
Xxxxx jde x xxxxx xxxxxxxxx situace, xxx distributor xxxxxxxx xxxxxxxxx bude muset xxx xxxxxxx a x xxxxxxxx rozsahu xxxxxxxx xxxxxxxxxx xxxx xxxxxxxx xxxxxxxxx x Xxxxx xxxxxxxxx před xxxxxx xxxxxxxxxx xx xxxxxxxxx, nelze xxxxxxx x xxx, xx xx tím bylo xxxxxxx xxxx právo xxxxxxxx x xxxxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxx xx smyslu čl. 26 xxxx. 1 Xxxxxxx xxxxxxxxxx práv x xxxxxx, když xxxx x čl. 26 odst. 2 Xxxxxxx je xxxxxxxxxx možnost, že xxxxx xxxx xxxxxxxx xxxxxxxx x xxxxxxx xxx xxxxx xxxxxxxx xxxxxxxx. Naopak xxxxxxxxxx xxx získá informaci, xx trh v Xxxxx republice, xxxxx xxx o xxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx, xxxx xxxxxxx, x xxxxx tímto směrem xxx xxxx zaměřit xxxx xxxxxxxxxxxxxx aktivitu. Xxxxx xxxxx podnikat xx xxxxx xxxxxxxxx x xxxxxx xxxxx xxxxxx xx xxxxxxx xxxxxx a xx xxxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxx x článku 31 Xxxxxxx zařazeným xxxxxx xx práv hospodářských, xxxxxxxxxx x xxxxxxxxxx. Xxxxx xxxxxxxx xxx xxxxxx xxx vykonáváno xxx, xx xx xxxx xxxxx xxxxxxx xxxxxxxx naplnění jiného xx xxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxx práva.
Navrhovaný xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx není x xxxxxxx x mezinárodními xxxxxxxxx, kterými xx Xxxxx xxxxxxxxx vázána.
Navrhovaná xxxxxx xxxxxx vychází x xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) č. 536/2014, které xxxxxxxx xx xxxxxxxx x Xxxxx xxxxxxxxx, xxxxxxx respektuje přímou xxxxxxxxxxxx ustanovení xxxxxx xxxxxxxx x xxxxxxxx xxx ty xxxxxxxxxxx, xxxxx jsou xxxxxxxx xxxxxxxxx xxxxx upravit xxxx xx xx xxxxxxxxx xx xxxxxxx.
Xxxxxxxxxx xxxxxx xx x xxxxxxx časovém xxxxxxxxx xxxx xxxxxxx k xxxxx xxxx naplňování xxxxx občanů xx xxxxxxx xxxxxx x xx náležitou xxxxxxxxx xxxx xxxxxxxxxxx x článku 31 Listiny xxxxxxxxxx xxxx x svobod xxx, že xx xxxx xxxxxxx xxxxxxx x xxxxxxx xxxxxx xxxx situací, kdy xx byl na xxxx České republiky xxxxxxxxxx xxxxxxxx přípravků xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxx.
Xxxxxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxxx, xxxxxxxxxxxxxxxx, xxxxxxxxx, xxxxxxxxxxxxx, xxxxxxxxxxxx, xxxxxxxxxx xxxxxxxxx, xxxxxxxxx x efektivity xxxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxx úpravy x xxxxxx Xxxxxxxx unie, xxx xxxxxxx xx xxxxx xxxxxxxx vnitrostátní xxxxxxxx xxxxxxx xxxxxxxxxxxxxx xxxxxxx x xxxxxx xxxxxxx zdraví x xxxxxx xxxx. Takové xxxxxxxx xxxx xxx xxxxxxxxxxxxxx, xxxxxxx xxxx xxxxxxxx xxxxxxxx vhodnosti x xxxxxxxx. X xxxxxx xxxxxxxx musí xxx opatření přijaté xxxxxxxx xxxxxx xxxxxxxxxx. Xx základě zvolených xxxxxxxx xxxxxxxxxx xxxxxx xxxxxx xxxxx podmínkám xxxxxxxx.
Xxxxxxxxx xxxxxx x xxxxxxxx přípravky xxxxxx xxxxxxxxx státy Xxxxxxxx xxxx je xxxxxxxxxx x souladu xx xxxxxxx xxxxxxx xxxxxx xxxxx (xx. 34 x 35 Xxxxxxx x fungování Xxxxxxxx xxxx), xxxxx představuje xxxxx xx xxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxx xxxx Xxxxxxxx unie. Xxxxx léčivých přípravků xxxx v xxxxxxxx xxxxxxxx může být x xxxxxxxxx xxxxxxxxx xxxxxxxx akutní xxxxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxx x Xxxxx xxxxxxxxx. Xx xxxxxxxxxxx xxxxxxxxx péče x za xxxxxx xxxxxx xxxx xxxxxx xxx xxxxx Xxxxxxxx xxxx odpovědné členské xxxxx. Xxxxxxxxxx xxxxxx xxxxxx je xxxxx x xxxxxxx x xxxxxx Xxxxxxxx unie, xxx kterého lze xxxxxxxx příslušná opatření xx účelem ochrany xxxxxx x xxxxxx xxxx, x xxxxx xxxxxx xx právě xxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx přípravků xxx xxxxxxx xxxxxxxx x Xxxxx republice.
Jednotlivé xxxxxxx xxxxx XX x xxxxxxxxxx letech xxxxxxxxx xxxxxxx opatření xx xxxxxx xxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx x důvodu jejich xxxxxxxxx, xxxxxxx xx xxxxxx Xxxxxx xxxx xxxxxxx x xxxx xxxxxxxxxx na rozpor x právem Xxxxxxxx xxxx. Většinou xxxx xx strany Xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx a jejich xxxxxx xx xxxxxxxx xxxxxxx xxxxxx zboží. Xx xxxxxxx xxxxxxx xxxxxxx x xxxxxxxx xxxx (xxxxxxx Xxxxxxxxx) xxxx xxxxxxx x xxxxxx, xx xxxxxxxxxx xxxxxx, který xxxxxxx xx xxxxxxxxx xxxxxxx xxxxxxxx přípravků, xxxxx xxxx ohroženy nedostupností, x x xxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xx tomto seznamu xxxx xxxxxxx xxxxxxx xxxx, xx x xxxxxxx s xxxxxx Xxxxxxxx xxxx. Xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxx xxxxxxxxxxxx, vychází x xxxxxxxx xxxxx x xxxxxxxx dostupnosti konkrétních xxxxxxxx xxxxxxxxx xx xxxx, xxxxxxx xxxxxx xx xxxxxxxx xxxxxxxxxxxxx x xxxxx xxxxxxxx xxxx předvídatelná. Xxxx xxxxxxxxxx xxxxxxxxxx Xxxxxxxxxx xxxxxxxx dvora, xxxxxx xx xxxxxxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxx k xxxxxxxxx xxxxxxxxxxxx množství léčivých xxxxxxxxx xxx své xxxxxx a nadřadit xxx xxxxxx xxxxxxxx xxxxxxx xxxxxx xxxxx. Xxxxxxxx xxxxxx xxxxxx xxxxxxxx xxxx xxxxxxxx xxxxx x xxxxxx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xx Xxxxxxxxx, která xxxx xx strany EK xxxxxxxx xx xxxxxx xxxxxxxxx volný pohyb xxxxx, xxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxx, vztahující xx xx všechny xxxxxxxx xxxxxx xxxxxxxxx, xxxxxxx, protože nebyla xxxxxx omezena, ale xxxx xxxxxxxx xxxxxxxxxx x nebyla xxxxxxxxxx xxxxxxxxxx. V xxxxxxxx xxxx se xxxxx xxxxxxxxx x Xxxxxx, xxx xxxxxxxxx x xxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx x xxxxxx xxxxx XX x vzhledem k xxxx, xx x xxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxx jsou v Xxxxxx činěna xxxxx xxxxxxxx x xxxx xxxxxxx, xxxxxx xxx xxxxx, že se xxxx xx xxxxxxxx xxxxxxxx xxxxxxxxx z Xxxxx xxxxxxxxx xx xxxxxxxx takovýchto opatření x sousedním státě xxxxx xxxxx.
Xxxxxxx xxxxxxx xxxxx, xxxxx xxxxxxxx xxxxxxxx přípravků omezují, xxxxxxxxx xxxxxxxxxx článku 81 xxxxxxxx 2001/83/ES x xxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx pro xxxxxxxx xxx xxxx.
Xxxxxxxx xxxxxxxx Xxxxxx x xxxxxxxxx xxxxxxxxx (XX) č. 1252/2014 xx xxx 28. xxxxxx 2014 xxxxxxxxxx směrnici Xxxxxxxxxx xxxxxxxxxx x Rady 2001/83/XX, xxxxx xxx x zásady a xxxxxx xxxxxxx xxxxxxx xxxxx pro xxxxxx xxxxx xxx humánní xxxxxx xxxxxxxxx, xx xxxxxxxxx xxxxxxxx platná xxx xxxxxx xxxxx xxx xxxxxxx xxxxxx xxxxxxxxx. Xxxxx xxxxxx xx xxx xxxxxxx x xxxxxxxx adaptaci xxxxxx xxxxxxxx x xxxxxxxxxx Xxxxx xxxxxxxxx.
Xxxxxxxxxxx xxxxx xxxxxx není x xxxxxxx s xxxxxxxxxxx xxxxxxxx xxxxxx Xxxxxxxx xxxx x xx v souladu x xxxxxxxx xxxxxxxx xxxxx Evropské unie (xxxx. xxxxxx xxxxxx xxxxxxx, proporcionality x xxxxxx diskriminace).
C. Xxxxxxxxxx xxxxxx xxxxxxxxxxxx xxxxxx xx xxxxxx x xxxxxx xxxxxxxxxxxx
Xxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxx žádné xxxxxxxxxx, xxxxx xx xxxx v rozporu xx zákazem diskriminace.
Navrhovaná xxxxxx xxxxxx nemá xxxxxxxxxxxxx ani sekundární xxxxxx xx xxxxxxx xxxx x žen x nevede x xxxxxxxxxxxx xxxxxxx z xxxxxxx, xxxxx xxxxx xxxxxxxxxxx ani xxxxxxxxxxxx xxxxx x xxxxxxx x xxxxxxxxx xxx xxx odlišné xxxxxxxx.
X. Xxxxxxxxxx dopadů xxxxxxxxxxxx xxxxxx xx vztahu x ochraně xxxxxxxx x osobních xxxxx
Xxxxxxxxxx xxxxxx xxxxxx xxxxxxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxx. Navrhovanou xxxxxx xxxxxxx xxxx xxxxxx xxx existující xxxxxxxxxx xxxxxxxx xxxxx. Xxxxxxxxxx xxxxxx úprava xxxxxxxxxxxxx xxxxxxxx xxxxxx xxxxx xxxxxxxxxx ani xxxxxxxxx xxxxxxxx osobních xxxxx.
Xxxxxxxxxx xxxxxx úprava xxxxxxxxx xxxx zpracování osobních xxxxx x není xx měněno xxx xxxxxxxxxx zpracování osobních xxxxx x xxxxxx xxxxxx. Pokud xxx x xxxxxxxxxx xxxxx x ustanovení §33 xxxx. 2, §77 xxxx. 1 písm. x) a §82 xxxx. 3 písm. x), xxxxx xxxxxxx x xxxxxxxx xxxxx x tom, že xxxxxxxxx rozsah poskytovaných xxxxx, xxxxxx xxxxx xxxxxxxx, xxxxx xxxx, xx xxxxxxxx úprava xx xxxx xxxxxxxx xxxxx x xxxxxx, xxxx xxxxxxx místo x informačním prostředku Xxxxxx v právním xxxxxxxx, xx. xx xxxxxxxx, xxxxx xxxxxx xxxxxx xxxxx, nově xxxx xxxxxxx x xxxxxxxxx, xxxxxxx xxxxxx xxxx xxxxx. Pokud xxx x ustanovení §53x xx §53x, §54 x §55, xxxxxxxx xx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxx rozsah xxxxxxxxxxxxx xxxxx, xxxxxx xxxxx osobních, zůstává xxxxxx, xxxx dosud xx v xxxxxxxxxx §51 x xxxx. xxxxxxxxx xxxxxx úpravy. Xxxxx jde x xxxxx v ustanovení §101 xxxx. 1, xxxxx spočívá xxxxx x xxx, xx xxxxxxxx xxxxxxxxxx xx xxxx moci xxxxxxxxx xxxxxxxxxx i xxxxx, xxxx xxxx xxxxxxxxx xxxxxxx vykonávat xxxxx xxxxxx xxxxxxxx xxxxxxxx xxx xxxxx xxxxxx x xxxxxxxx x xxxxxx xxx xxxxx xxxxxxxxxx xxxxxxxxxxxx osobě xxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxx xx xxx. Xxxxx xx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxx x xxxxxxxxxxx xxxxxxxxxx, a xx xxx xxxxxx xx xxxx xxxxxxxx xxxxxxxxxx, konkrétně, podle xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx kontrolní xxxxxxx x xxxxxxx xxxxxxx xxxxx vykonává, x xx rozsah xxxxxxxxxxxxx xxxxxxxx údajů xxxxx xxxx nemá.
E. Xxxxxxxxxx xxxxxxxxxx rizik (XXX)
Xxxxxxxxxx xxxxxx úprava nepřináší xxxxxx xxxxxxxxxx xxxxx. Xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxx xx uvedeno xxx x xxxxxxxxxxxx xxxxxxx, kde xx xxxxxxxxx xxxxxxxx řešení, x xx jak x xxxxxxx xxxxxxxxxx xxxxxxxxx léčivých xxxxxxxxx, xxx x x xxxxxxx regulace xxxxxx xxxxxxxx xxxxxxxxx. Předložený xxxxx xx svým xxxxxxxx xxxxxxxxx xxxxx, x xxxxxxx naplnění xx předkládán. Xxxxx xx x xxxxxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx x vyhodnocování xxxxxx xxxxxxxxxxxxx xxxxxxxx přípravků xxx xxxxxxx xxxxxxxx x České xxxxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxx xxxx xxxxx České republiky. Xxxxxxxxxx xxxxxx xxxx xxxxxxxxx xxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx x Xxxxxxxxxxxx xxxxxxxxxxxxx a x xxxx jim xxxxxxx xxxxxxxxx xxxxxxxxx, ovšem x kontextu xxxxx xxxxxxx xxx xxxxxxxx x xxxxxxxxxxx xxxxxxxxxx xx xxxxxxx o xxxxxx xxxxxxxx rozšíření, xxxxx xx xxxxxxxxxxxxx xxxxxxxxxx xxxxxxxx rizika.
XXXXXXXX XXXX
X §1 xxxx. 1 (xxxxxxxx xxxxxxxx xxx čarou)
Do xxxxxxxx xxx xxxxx x. 2 xx xxxxxxxx odkaz xx Xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx (XX) č. 536/2014 xx xxx 16. dubna 2014 x xxxxxxxxxx hodnoceních xxxxxxxxx xxxxxxxx xxxxxxxxx x x xxxxxxx xxxxxxxx 2001/20/XX x Xxxxxxxx Komise x xxxxxxxxx pravomoci (XX) č. 1252/2014 ze dne 28. xxxxxx 2014 xxxxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Rady 2001/83/XX, xxxxx xxx x xxxxxx x xxxxxx xxxxxxx výrobní xxxxx pro účinné xxxxx xxx humánní xxxxxx xxxxxxxxx.
X §5 xxxx. 16:
Doplnění xxxxxxxx 16 xx §5 xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxx léčivé xxxxx xxxxxxx jako xxxxxxx xxxxxxxx xx xxxxxxxxxx xxx, xx x xxxxxxxxx xxxxxx xxxxxx xxxxxx xxxxxxxx xxxxx, xxx xxxxxxx xxxxxxxxx xxxx, xxx xxxx xxxxxx, xx se xxxxx xxxxxxx xxxxxx x xxxxxx režimu xxxxxxx. Xxxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxxxx 2001/83/ES (xx. 46a). X xxxxxxxx definice xxxx xxxxxxx xxxxxxxx Komise x xxxxxxxxx xxxxxxxxx (XX) č. 1252/2014 xx xxx 28. xxxxxx 2014 xxxxxxxxxx xxxxxxxx Xxxxxxxxxx parlamentu a Xxxx 2001/83/ES, pokud xxx x xxxxxx x pokyny xxxxxxx xxxxxxx praxe pro xxxxxx xxxxx xxx xxxxxxx xxxxxx přípravky. Xxxxxxxx v něm xx xxxxxxxxxxx xxxxx xxxxx přímo pouze xxx xxxxxx xxxxx xxx xxxxxxx xxxxxx xxxxxxxxx, a xxxxx xxxxxxxx uvedená x xxxxxxxxxxx xxxxxxxx 16 xxxx být x xxxxxx xxxxxxx xxxxxxxxx xxxxxx xxxxx x xxxxxxxxx se i xx xxxxxxxxxxx xxxxxx xxxxxxxxx a hodnocené xxxxxx xxxxxxxxx.
X §11 xxxx. x):
Xxxxxxx xx xxxxxxxxxx o xxxxxx xxxxxx komise x xxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxxxx klinickým hodnocením, xxxxx s xxxxxxx xxxxxxxxxx xxxxxxxx č. 536/2014 xxxxxxxxx. Xxxxxx xxxxxxxx xxxxxx xx xx xxxxxxxxxxxx xxxxxxxxx xxxxxxx, xxxxxxxxxx pro jakýkoli xxxxxx vyplývající x xxxxxxxx xxxx xxxx xxxx xxxxxxxxx xxxxxxxxxxxx xx xxxxxxxxxx, zkoušejícím, xxxxx xxxxxxxxxx xxxxxxxxx, xxxxxxxxxx xxxxxxxxxxxx. Současný xxxxxx etických xxxxxx x České xxxxxxxxx, xxx xxxxxx xxxxxxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx xxxx xxx x místy xxxxxxxxxx xxxxxxxxx, xxxxxxx xxxxxxxxxxx jsou zkoušející, xxxxx jsou xxxxxx x xxxxx příslušné xxxxxx xxxxxx, xx xxxxx x xxxxxxx x xxxxxxxxx xxxxxxxx. Xxxxxxxxxx xxxxxx xxxxxx xxxxxxxxx xxxxxxx xxxxxxx xxxxxx xxxx xxxxx Xxxxxxxx xxxxxx pro xxxxxxxx xxxxx, a xx x z xxxxxx, xx x xxxxxxx s nařízením č. 536/2014 xxxx xxxxxx xx xxxxxxxxx xxxxxxxxxx xxxxxxxxx, xxxxxxxxxx změn x xxxxx xxxxx xxxxxxx s xxxxxxxx xxx xxxxxxxxx xxxxxxxxxx xxxxx jedna pro Xxxxxx xxxxx pro xxxxxxxx léčiv xx xxxxx xxxxxxx výdajů, x x xxxx xxxxxx xxxx xxxxxxx xxxxxxx xxxxxx komise x jejich xxxxx. Xxxx xxx xxxxxxxxx xxxxxxxx požadavek xxxxxxx x čl. 86 nařízení x. 536/2014 x xxxxxxxxx tak, že xx xxxxxx xxxxxxx xxx xxxxxxxx lze xxxxxxxx pouze jeden xxxxxxxx xx xxxxxxx xxxx.
Xxxxxxx xx zavádí xxxxx xxxx xxxxxxxxxx xxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx x vydání xxxxxxxx xxxxxx povahy xxxxxxxxxxx xxxx zakazujícího xxxxxxxxxx xxxxxxxx přípravku do xxxxxxxxx. Opatření xxxx xxx vydáno pouze x xxxxxxxxxxxx případech. Xxxxxxxx xxxxxx opatření xxxxxx xxxxxx x xxxxxxxxx dostupnosti xxxxxxxxx xxxxxxxx přípravků jsou xxxxxxxxx stanoveny v xxxxx xxxxxxxxxx §77x.
X §11 xxxx. x:
Xxxxxxxxx xxxxxxxxxx §11 písm. x) se upravuje xxx, xxx xx xxxxxxxxxxx xxxxxxxxx s xxxx vkládanými ustanoveními xxxxxx x) nebo x) x xxxxxx xxx xxxx xxxxxxxx xxx xx případy, xxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxx postupovat xxxxx xxxxxx xxxxxxxxxxxx xxxxxxxxxx.
X §11 xxxx. q):
Za xxxxxx xxxxxxxxx xxxxxxxxxxxxxxxx x xxxxxxxxxxxxxxxx xxxxxxx xxx xxxxxxx xxxxxxxxx xx xx §11 xxxxxx o léčivech xxxxxxxx xxxxxxx x), xx xxxxxx xx xxxxxxxx xxxxxxxx Xxxxxxxxxxxxx xxxxxxxxxxxxx seznamu léčivých xxxxxxxxx (xxxxxx opatření xxxxxx povahy), xxx xxxxxxx xxxxxxxxxx na xxxx x České xxxxxxxxx xx xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx x Xxxxx republice.
K §13 xxxx. 2 xxxx. x) xxx 1:
Xxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx xx rozšiřuje x xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxxx.
X §13 xxxx. 2 xxxx. x) xxx 3:
Xxxxxxxx se, aby xxxxxxxxxxx, xxxxxxx xx xxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxx, xxx xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxx xxxxxxxx xxxxx, xxxxx xxx xxxxx xxxxxxxxxxxxx vydávány x xxxxxx xxxxxx, x xx xxxxxxxxx xxxxxxxxxxx. Xxx xxxxxxxxxx xxxxxxxx xxxxxxxx xx xxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxx xxxxxxxxxxxx x xxxxxxx legislativy x xxxxxxx klinické xxxxx, kterou xxxx x xxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx. Xxxxxxxx xxxxxxxxx praxí xx xxxxxx xxxxxx xxxxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxx xx xxxxxxx při xxxxxxxxxx, xxxxxxxxx, xxxxxxxxxx, sledování, xxxxxx, xxxxxxxxxxxxx x xxxxxxx xxxxxxxxxx hodnocení x xxx xxxxxxxxxxx xxxxx x xxxx, xxx se zajistilo, xx jsou xxxxxxxx xxxxx, bezpečnost x xxxxxxx xxxxxx subjektů xxxxxxxxx a xx xxxxx xxxxxxx x xxxxxxxxx hodnocení xxxx xxxxxxxxxx x xxxxxxxx. Xxxxxxxx správné xxxxxxxx xxxxx xxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxx (xxxxxxxx xx dokument ICH X6 Xxxxxxxxxxx konference xxx harmonizaci xxxxxxxxxxx xxxxxxxxx xx xxxxxxxxxx xxxxxxxxx xxxxx - xxxxxxxxx International Xxxxxxxxxx xx HarmonisationofTechnicalRequirementsforRegistrationofPharmaceuticalsforHuman Xxx-xxx. XXX, xxx xxxx xxxxxxxx xxxxxxxxxxx xxxxxxx x farmaceutického průmyslu Xxxxxx, Xxxxxxxx a XXX). Tento dokument xxxxxxx Xxxxxxxxxxx xxxxxxxxxx xxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xx xxxxxxxxxx xxxxxxxxx léčiv 1.5.1996, xxxx xxxxxxx xxxxxxxx xxxxxxx klinická praxe, x xxxxx xxxxxxx xxxx xxxx xxxxxxxxxx x xxxxxxxxx x xxxxxxxxxx právním xxxxxxxx.
X §13 odst. 2 xxxx. x):
Xxxxxxxx xx xxxxxxxxx xxxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx s ohledem xx změny xxxx xxxxxxxxx. Xxxxxxxxx systém xxxxxxxxx xxx xxxxxxxxxx, xxx xxxxxxxxxx xxxxx xxx xxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxx. Xxx xxxxxxxx se xxxx jednat již xxx x xxxxxx xxxxxxxxxx.
K §13 xxxx. 2 xxxx. n):
Na základě xxxx xxxxxxxx xxxxxxxxxx Xxxxxx xxxx xxxxx xxxxxx se závadou x jakosti, jejíž xxxxxxxxx nepředstavuje xxxxxxxx xxxxxx xxxx zdraví, xxxxxxxx xx xxxx. Xxxxxxxx opatření Xxxxxx xxxx xxxxxxxx podporovat xxxxxxxxx dostupnosti daného xxxxxx xx xxxx x Xxxxx xxxxxxxxx. Xxxxxxxxxx subjekty xxxxxxx xxxxxxxx zdlouhavým procesem xxxxxxxxx léčiva, který xxx ně xxxxxxxxxxx xxxxxxxxxxxxxxx xxxxx, xxxxxxxxxx xxxxxxx x xxxxxxx xx xxxxxxxxxxx, xxxxx xxxxxx x xxxxx xxxxx závady x xxxxxxx xxxx xxxxx xxxxxxxxxx či xxxxxxxx xxxxxxxxxx. Xxxxxxxxxxx Xxxxxx xxx xxxxxx xxxxxxxxxx xx systematicky navázáno xx xxxxxxxxxx §23 xxxx. 2, xxx xxxxxxxxxxxx nesmí nakládat x xxxxxx xx xxxxxxx x jakosti, xxxxx xxxxxxxxxx Xxxxx xxx §13 xxxx. 2 xxxx. x) xxxxx.
X §13 xxxx. 3 xxxx. x) x r):
Upravuje xx xxxxxxxxx Státního xxxxxx xxx xxxxxxxx xxxxx xx xxxxxxx xxxxxxx xxxxxxx na xxxx x xxxxxxxx přípravky xxxxxxxxxxx pro Ministerstvo xxxxxxxxxxxxx informaci xxxxx §77x.
X §16 xxxx. 2 xxxx. x) xxx 1:
Xxxxxxxxx Ústavu xxx xxxxxx kontrolu xxxxxxxxxxxxx xxxxxxxxxxxx x xxxxx xx xxxxxxxxx x xxxxxxxx xxxxxxxxxx x xxxxxxxxxx léčivého xxxxxxxxx.
X §19x:
X xxxx xxxxxxxxx §19x xx xxxxxxxxx xxxxxx základ xxxxxxxxxx Státního xxxxxx xxx xxxxxxxx léčiv x Xxxxxxxxxx xxxxxxxxxxxx xxx x xxxxxx xxxxxxxxx xxxx xxxxxx xxxxxx xxx, xxx xxxx xxx xxxxxxx xxxxxxx xxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Xxxx 2011/62/EU. Xxxxxx xxxxxxxxxx se xxxxxxxx xxx na xxxxxxx xxxxxx, xxx x xx xxxxxxx distribuce xx zahraničí, x xx xxxxxx xx xxxxxx xxxxxxxxxxxx takových xxxxxxx xxxxxxxxxx xx xxxxxxx zemí např. xx účelem sledování xxxxxxxxx. Jednalo xx xx xxxx x xxxxxxxxxx xxxxxxxxx ad xxx, a nikoliv x xxxxxx monitorování. Xxx xxxxxxx xxxxxx xxxxxxxxxx xxx xxxxxxxxx xxxxxx xxx platný xxxxxx xxx, x xxxxx spolupráce x Xxxxxxxxxx xxxxxxxxxxxx xxx xxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx, jako xx tomu x xxxxxx č. 226/2013 Sb., o xxxxxxx xxxxx x xxxxxxxxxxx xxxxxxx xx xxx. Xxxxxxx xx xxxxxxxx xxxxxxx xxxxxxx x xxxxxxxxxx xxxxxxxxxxxx xxxxxxxxx v xxxxxxx xxxx tak, aby Xxxxxx xxxxx xxx xxxxxxxx xxxxx mohl xx Xxxxxxxxxxx xxxxxxxxxxx xxx získat xxxxxxxx xxxxxxxxx.
X §21(Xxxxxxxx VIII, xx. 49 nařízení):
V §21 xx xxxxxxxx xxxxxxxx 1 x xxxx důvodu, že xxxxxxxxxxxx, xxx se xxxx stát zkoušejícím, xx xxxxxxxxx xxxx x §54 xxxx. 1 a to x xxxxxxxxxx xx xxxxxxxxx stanovené xxxxxxxxx.
X §33 xxxx. 2:
Xx účelem xxxxxxxxx vyhodnocování potřebných xxx xxxxxxx dostupnosti xxxxxxxx přípravků na xxxx v XX xx nutné xxxxxxxx, xxx Státní ústav xxx xxxxxxxx léčiv xxxx pracovat s xxxxxxxxxx x správnými xxxxx xxxxxxxxxxxx xxxxxx xxxxxxx xxxxxxx x xxxxxxxxx xxxxxxxx xxxxxxxxxxx x xxxxxx xxxxxx xx xxxx x Xxxxx republice.
Získané informace xx držitelů rozhodnutí x xxxxxxxxxx xxxxx xxxxxxx k xxxxxxxxxx xxxxxxxxxxx dostupnosti xxxxxxxxxxxx xxxxxxxx přípravků x xxxxxxxx xxxxxxxxxxxx xxxxxxxx xxx zpracování xxxxxxx xxxxxxxxxx xxxxxxxx přípravků Xxxxxxxxxxxxx xxxxxxxxxxxxx xxxxx §11 xxxx. x) x možné xxxxxxxxx xxxxxxxx Ministerstva xxxxxxxxxxxxx xxxxx §11 xxxx. x). Ohlašovací xxxxxxxxxx xxxx Xxxxxxxx ústavu xxx xxxxxxxx xxxxx xxx xxxx xxxxxxx x xxxxxxxx xxxxxxxxx xxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxx (distributoři léčivých xxxxxxxxx x provozovatelé xxxxxxxxx x xxxxxx xxxxxxxx xxxxxxxxx). Přesto xxx nejsou získané xxxxx xxxxxxxxxx x xxxx, xxx xxxx xxxxx účinně x xxxx zasáhnout xxxxx xxxxxxxxx distribuci xxxxxxxxxxx xxxxxxxx xxxxxxxxx x Xxxxx xxxxxxxxx. Xxxxxxxx xxxxxxxxxx držitelů xxxxxxxxxx x xxxxxxxxxx xxxxxxxxxx Xxxxxxxx ústavu xxx xxxxxxxx léčiv xxxxx x xxxxxxx údaje x xxxxxx léčivých xxxxxxxxx dodávaných na xxx xxxxxxx zpřesní xxxxx o xxxxxx x xxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx přípravkem. Xxxxxxxx xxxxxxxxxxxxxx xxxxx xxxxxx současnému xxxxx xxxx xxxxx xxxxxxxx xxxxx rozsah xxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx a xxxx xxxxxxxx přijímat opatření, xxxxx xxxxxx nedostupnosti xxxxxx xxxxxxxx přípravků xxx xxxxxxxx v Xxxxx republice. X xxxxxxxx zachování xxxxxx xxxxxxx x xxxxxxxxx xxxxxxxxxxxxxx nápravy xxx xxxxxxxx xxxx zákonné xxxxxxxxxx je xxxxxxxxx, xxx byl xxxxxx xxxxx, časový xxxxxxxx x způsob xxxxxx xxxxxxxxxxx xxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxx. Xxxxxxxxx právní xxxxxxx je xxxxxxx xxxxxxxx xxxxxxxxx pro XXXXXX xxxxxxxx xx xxxxxxx xxxxxxxx xxxxxxxxx x xxxx xxxxx xxxxxxxx xx předepisování xxxxxxxx xxxxxxxxx pro xxx xxxxxxxxx správní xxxxxx, xx. xxx xxx XXXXXX, xxx x xxx XXXX. Xxxx xx xxxxx xxxxxxxx xxxxxxx xxxxx xxxxxxx xxxxxxx si xxxx x xxx xxxxx těch pravidelně xxxxxxxxxxxxx.
Xxxxxxxxxxxx xxxxxxx xx xxxxx s xxxxxxx xx veliké objemy x xxxxxxx xxxxxxxxx xxx, xxxxxxxx xx xxxxxx xxxxxxxxx xxxxxxxxxx x tím xxxx xxxxxxx efektivně x xxxx xxxxxxxx na xxxxx xxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xx xxxx. Xxxxx xx xxxx xx Xxxxx xxxxxxxxxx x jiné, xxxx. x různých xxxxxxxx, xxxxx xx xx Xxxxx napřed xxxxxxxxx do xxxxxxxx xxxxxx, aby xx xxx xxxx xxxxx xxxxxxxxx, xxxxxxxxxx x xxxxxx xxxxx. X xxxxxxx na xxxxxxx xxxx, xxxxxx xx Xxxxx xx xxxxxxxxxx xxxxxxx x vývozu xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxx xxxxxxx x xxxxxx xxxxxxxx xxxxxx xxxxxx xx XX, xx xxxx xxxxx, xxx elektronická xxxxxx xxxxxxxxxx. Rovněž xx xxxxx xxxx x xxxxx, že xxxxxxx xxxx povinně xxxxxxxx počítači a xxxxxxxxxx x xxxxxxxxx, xxxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx, XX x xxxxxxxxxxxxx xxxxx dat, xxxxx xxx xxxx xxxxxx xxx xxxxxx xxxxxx xxxxxxxxx možnost xxxxxxxxxx a xxxxxxxxxx xxxxxxx a xxxxxxxxxxx xxx xxxxxx a xxxxx xxxxxx xxxxxxxxxx xxx xxxxxxxxx jinými xxxxxxxxxxxx zákona x xxxxxxxx.
X §33 xxxx. 3 xxxx. a):
Jedná xx xxxxx x xxxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxx xxxxxx xxxx xxxxx jejího obsahu, xxx xx xxx xxx xxxxxxxxxx právního xxxxx xxxxxxx xxxxxxxxxx x registraci povinen xxxx xxxxxxxx x xxxxxxxxx xxxxxxxx xxxxxxxxx xx distribuce xxxx xx xxxxxxx. Xxxxxxxx xxxx „xxxxxxxxxx xxxx xxxxxxx“ nahrazeny xxxxxx „xx trh v Xxxxx republice“.
K §34 xxxx. 2:
Xxxxx x xxxxxxxx x xxxxxxxxx xxxxx nijak neupravuje xxxxxxxx doprodeje xxxxxxxx xxxxxxxxx po xxxxxxxxxxx xxxxxxxxxx. S ohledem xx xxxxxxxxxx, že x prodloužení registrace xxxxxxx xxxxxx x xxxxxx xxxxxxxxxxxxxxxx xxxxxxx, xx xxxxxxxxx xxxxxxx xxxxxxxx xxxxxx léčivého xxxxxxxxx a nutně xxx dochází k xxxxxxxx x xxxxxxxxx xx xxxxx xxx x tím xx xxxxxxxx xxxxxxxxxxx léčivých xxxxxxxxx xxx xxxxx xxxxxxxx. Xxxx úprava xxxxxxxx xxxxxxxxx úpravě xxxxxxxxx x xxxxxxx xxxx xxxxxxxxxx v xxxxxxxxxx §35 odst. 2 x xxxxxxx xxxxxxxxxx x §36 xxxx. 4.
Xxx o formální xxxxxxxxxxx xxxxxx, ke xxxxx xx xxxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx zákona.
X §51 xx 59:
Xxxxx x ustanoveních §51 xx 59 xxxx xxxxxxx xxx xxxxxxxxx xxxxxxxx xxxxxxxx č. 536/2014 xx zákona o xxxxxxxx, xxxxx xxxxxxxxxxx xxxxx xxxxx úpravu xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxxxxxx na základní xxxxxx provedenou x xxxxxxxx č. 536/2014. V xxxxxx xxxxxxxxxxxx xx xxxxxxxxx xxxxxxxxxx xx xxxxxxxxxx, xxxxx xxxx x zákoně x xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxxxx xx xxxxxx xx xxxxxxxx 2001/20/ES a xxxxx jsou xxxxxxx xxxxx v xxxxxxxx č. 536/2014 xxxx xxxxx xx xxxxxxxxx č. 536/2014 xxxxxxx, a xxxx xx v xxxxxx xxxxxxxxxxxx xxxxxxxx xx xxxxxx xxxxxx, které xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx, aby xx xxxxxxx, anebo zmocňuje xxxxxxx stát k xxxxxx xxxxxx.
X §51:
X xxxxx xxxxxxxxxx xx x xxxxxxxxxx xxxxxxxxx xx čl. 4 až 9, čl. 15 xx 24 a čl. 83 xxxx. 1 xxxxxxxx x. 536/2014 soustředěna xxxxxx xxxxxxxxxx otázek xxxxxxxxxx hodnocení humánních xxxxxxxx xxxxxxxxx.
X xxxxxxxx 1 (Xxxxxxxxx (18), (19); Xxxxxxxx II, čl. 7 xx 9; Xxxxxxxx XXX čl. 15 xx 24 xxxxxxxx) xx xxxxxxxx xxxxxxxx xxxxxxxxx Státního xxxxxx xxx xxxxxxxx xxxxx x xxxxxxx xxxxxxxxxx xxxxxxxxx humánních xxxxxxxx xxxxxxxxx. Xx xx xxxxxxxxxx žádostí x xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx léčivých xxxxxxxxx x žádostí o xxxxxxxx významné xxxxx xxxxxxxxxx hodnocení a xxxxxxxxx dohledu xxx xxxxxxxx klinického xxxxxxxxx (Xxxxxxxx XXXX, čl. 77, čl. 78). Veškeré úkony xxxxxxxxx x souvislosti x xxxxxxxxx xxxxxxx x xxxxxxxx klinického xxxxxxxxx (Kapitola II xxxxxxxx č. 536/2014), xxxxxxx x xxxxxxxx xxxxxxxx xxxxx klinického xxxxxxxxx (Xxxxxxxx III xxxxxxxx č. 536/2014) a xxxxxxxxx xxxxxxx (Xxxxxxxx XXXX xxxxxxxx č. 536/2014) xx xxxxxxxx xx odborné xxxxx, za xxxxx Xxxxxx xxxxx xxx xxxxxxxx xxxxx xxxxxx xxxxxxx nákladů. (Kapitola XXX, čl. 86 a 87)
X xxxxxxxx 2 (Xxxxxxxxx (69); Xxxxxxxx XX, čl. 83 = Xxxxxxx xxxxxxxxx místo) xx xxx reaguje xxxxxxx xx čl. 83 xxxx. 1 xxxxxxxx x. 536/2014, které x xxxxxxxxx postupů xxxxxxxxxxx x tomto xxxxxxxx xxxxxx xxxxxxxxx xxxxx xxxxx xxxxx xxxxxxx kontaktní xxxxx.
X xxxxxxxx 3 (Xxxxxxxx XX, čl. 5 xx 8 xxxxxxxx) se xxxxxxxx, xxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx za Xxxxxx xxxxxxxxx. X xxxxxx xxxxxxxxxxxx xx x xxxxxxxxxxxx písmenech odstavce 3 xxxxxxxx působnost x xxxxxxx, když xx Česká xxxxxxxxx xxxxxxxx státem zpravodajem, xxxxxxxxx v xxxxxxx, xxxx je Xxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxx a působnost xxx xxxxxxxxx xxxxx XX hodnotící xxxxxx, xxxxxxxxxx se xxxxx x xxxxxxxxx xxxxx. X xxxxxxxx 4 xx xxxxxxxx xxxxxx xxxxxxxxx při xxxxxxxx xxxxxxxxxx za xxxxxxx xxxx.
X §52 (Xxxxxxxx X, xx. 34 xxxxxxxx):
X xxxxx ustanovení x odstavci 1 (Xxxxxxxx V, čl. 29 xxxx. 7 a 8 xxxxxxxx) se xxxxxxx xx xxxxxxxxxx čl. 29 odst. 7 xxxxxxxx x. 536/2014, xxxxx umožňuje xxxxxxxxx xxxxx, aby ve xxxx xxxxxxx xxxx xxxxxxxxx, xxx xxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx ustanoveným zástupcem xxxxxx x účasti x xxxxxxxxx xxxxxxxxx xxxxxxx i nezletilý, xxxxx je xxxxxxx xxxxxxx xx xxxxx x xxxxxxxx xxxxxxx xxxxxxx xxxxxxxxx. X xxxxxxxx xx znamená, xx xxxx vyžadován xxx xxxxxxxxx kromě xxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxxx zástupcem x xxxxxx xxxxxxxxx xxxxx, xxxxxxxxxxx, xx xxxxxxx xxxxxxxxx xxxxxxxxx xx xxxxxxxxxxxx a xxxxxxxxx x xxxxxxxxxxx xxx xxxxxxxx přizpůsobených xxxx xxxxxxxxxxx, xxxx xxxxxxxxxxx xxxxxxxxx se xxxxxxxxxxx klinického xxxxxxxxx. X xxxxxxxxxx 2 x 3 xx xxxxxxxxxx možnost xxxx čl. 34 xxxxxxxx x. 536/2014, xxxxx xxxxxxxx xxxxxxxx xxxxxx zachovat xxxxxxxxx xxxxxxxx xxxxxxxx xxxx xxxxxxx xxxxxx, xxxxx jsou x xxxxxxx podřízenosti nebo xxxxxxxx xxxxxxxxxx. X xxxxxxxxxx xx toto xxxxxxxxxx se xxxxxxx, xx klinické hodnocení xxx xxxxxxxx x xxxxxxxxx skupin subjektů xxxxxxxxx jen xxxxx, xxxxx existují vědecky xxxxxxxxx důvody, xx xxxxxxx xxxxxxx xxx xxxxxxxx, že xxxxx x klinickém hodnocení xxxx xxx pro xxxx xxxxxxxx xxxxxxxxx xxxxx xxxxxxx xx xxxxxxxxxxx přínos, xxxxx xxxxxxx xxx souvisejícími xxxxxx a zátěží. Xxx xx xxxxxxxx xxxxxxx xxxxxxxx xxxxxx xxxx do čistě xxxxxxxxxx xxxxxxxxxx hodnocení (xxxx. xxxxxxxxxx xxxxxxxxx xxxxxxxxxxxxxxxxx nebo xxxxxxxxxxxxxxx), xxxxx xxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx xxxxx xxxxxx. Xx xxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxx xxxxxxxx xxxxx nacházející xx ve vazbě, xxxxxxxxxxxxx xxxxxxx nebo xx xxxxxx xxxxxx xxxxxx xxxxxxx, dále xxxxx xxxxxxxxxx x xxxxxxxx xxxxxxx xxxx (xxxx. x xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxx, xxxxxxxx xxxxxxxxxxx xxxxxxx xxxx xxxxxxxxxxx xxxx rodičů, xx.) x xxxxxx osoby, xxxxxxx xxxxxxxxxxx byla xxxxxxx soudem (xxxx. xxxxx, xxxxx xxxxx xxxxxxxx se svým xxxxxxxx). Vzhledem x xxxx, že Xxxxx xxxxxxxxx xxxxxxxxxx xxxxx x xxxxxxxxxxxx těchto xxxx xxxxxx xxxxxxxxxx x xxxxxx na xxxxxxxxx hodnocení, xxx xxxxxxxx xxxxx xxxxxx xxxxxxxxx, stanovuje xxxxxxxxxx xxxxxxxx xxx xxxxxx xxxxx v klinickém xxxxxxxxx. Xxxxxxx svobodného xxxxxxxxxxxxx xxxxxxxx xxx xxxxxxxx x xx xxxxxxx xxxxxxxxxx x xxxxxx x xxxxxxxxxxx xxxxxxxx.
X §53 (Preambule (18); Kapitola X, xx. 2 (11):
Úpravu xxxxxxxx x xxxxxxxx xxxxxx xxxxxx xxxxxxxx č. 536/2014 ponechává x xxxxxxxxxx xxxxxxxxx států. Xxxxx tato ustanovení xxxxxxx k xxxx, xxx xx, xx xx x současné xxxxxx xxxxxx osvědčilo, xxxx x xxxx xxxxxx úpravě při xxxxx xxxxxxxxxxx xxxxxxx.
X xxxxxxxx 1 xx xxxxxxxxx xxxxxxxxx Xxxxxxxx xxxxxx xxx kontrolu xxxxx xxxxxxx xxxxxxx xxxxxx xxxx xxxx xxxxx. Xxxxxx xxxxxxxxxx xxxxxx úpravy xxxxxxx x xxxxxxxxxxxxx požadavků xxxxxxxxxxx xxxxxxxxx č. 536/2014: 1) Xx posouzení xxxxxxxxxx xxxxxxxxx, xxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx x xxxxx xxxxx xxxxxxx x dohledem xxx xxxxxxxxx xxxxxxxxxx xxxx xxxxx xxxxx xxxxxx pro Státní xxxxx xxx xxxxxxxx xxxxx xx xxxxx xxxxxxx výdajů, a xxxx právní xxxxxx xxxxxx, xxx x xxxx platby byla xxxxxxx xxxx xxxx xxxxxxx etické xxxxxx x xxxxxx členů x xxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx xxxxxx xxxxxx. 2) Xxxxxxxxxx právní xxxxxx xxxxxxxxxx xxxxxxxxx uvedený x čl. 9 xxxxxxxx x. 536/2014, který xxxxxxxx, xxx osoby xxxxxxxxxx xxxxxx nebyly xxxxxxx xx zadavateli, xxxxx xxxxxxxxxx xxxxxxxxx, xxxxxxxxx zkoušejících x xxxxxxx financujících xxxxxxxx xxxxxxxxx x xxxxxx xxxxx xxxxxxxx xx xxxxxx xxxxx, xxxxx xx xxxxx ovlivnit xxxxxx xxxxxxxxxxx.
X xxxxxxxx 2 (Xxxxxxxx XX, čl. 4, 6 x 7, čl. 8 xxxx. 4 x Xxxxxxxx XXX nařízení) xx xxxxxxxxx působnost xxxxxx xxxxxx. Xxxxx článku 4 xxxxxxxx x. 536/2014 xxxxxx xxxxxxx xxxxxxx xxxxxx xxxxxx x xxxxxxx x xxxxxxxx xxxxxxxx xxxxxxxxx členského xxxxx, a xxxxx xxxxxx úpravy xxxxxxxx x xxxxxxxx 2 xx především xxxxxxxx xxxxx tohoto xxxxxx xxxxxxxx.
X xxxxxxxx 3 xx xxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxx činnost xxxxxx xxxxxx (xxxx xxx xxxx).
X xxxxxxxx 4 xx xxxxxxxxx, xx etická xxxxxx xxxx ustanovena na xxxxxxx Statutu xxxxxxx Xxxxxxx ústavem xxx xxxxxxxx xxxxx po xxxxxxxxxx souhlasu Xxxxxxxxxxxx xxxxxxxxxxxxx. Jednací xxx, xxxxxxxxxx xxxxxxx xxxxxx xxxxxx, xxxxxx xxxx xxxxxx xxxxxx xxx xxxxxxxxxxx xxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx.
X §53a
V xxxxxxxx 1 xx stanoví xxxxxxx xxxxxx xxxxxx x xxxxxxxxxxxx samostatně xxxxxxxxxxx xxxxxx xxxxxx xxxxxx. Dále xx xxxxxxx xxxxxxxxx xx xxxxxxx jednotlivých skupin, xxxxx xxxxxxx x xxxxxxxxx xxxxxxx klinické xxxxx (XXX X6) x x Helsinské xxxxxxxxx, xxx xxx xxxxxxxxx xxxx xxxxxxx xxx xxxxxxxxx xxxxxxxxxx xxxxxxx, x tedy x klinických xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xx účasti xxxxxxxx xxxxxxxx. Xxxxxxx xx x odstavci 1 xxxx xxxxxxx xxxxxxxxxx xxxxxxxx na xxxxxxxx xxxxxxx v této xxxxxxx xxxxxxxxx úpravou Xxxxxxx xxxxxx xxxxxx. Xxxxxxxxx xxxxx míry xxxxxxxxxxx je xxxxxxxx xxx xxxxxxxx nařízení č. 536/2014, xxxxx xxxxxx x přechodným xxxxxxx x xxxxx 3 xxx. X xxxxxx xxxx xxxxxxxxxxx xxxxxx xxxx xxxxxxxxx volit, xxx předloží xxxxxx x povolení xxxxxxxxxx xxxxxxxxx xxx xxxxxxxx č. 536/2014 xxxx xxx xxxxxxxx platné xxxxxxxxxxx. X xxxxxxxxxxxxx xxxx xxxxxx bude xxxxxxxxxxx xxxxxxx o xxxxxxxx xxxxxxxxxx xxxxxxxxx již xxx x souladu x xxxxxxxxx nařízení č. 536/2014, ale běžící xxxxxxxx hodnocení xxxxxxxxx xx povolená před xxxxxxx xxxxxxxxx xxxxxxxx č. 536/2014 budou plnit xxxxxxxxx xxxxx xxx xxxxxxxx xxxxxx xxxxxx xxxxxx, např. xxxxxxxxxxx x xxxxxxxxxxx xxxxxxxxxx xxxx xxxxxxxxxx hodnocení Xxxxxxx ústavem xxx xxxxxxxx léčiv x xxxxxxxx xxxxxxxx, xxxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxxx. Xxxxx xxxx xxxxx xxxxxxxxx xxxxxxxxxx xxxxxxx etických komisí, xxx xxxxxxx xxx xxxxxxxxx xxxxxx systému xxxxxxxxxx v této xxxxxx xxxxxx. V xxxxxxx 3 letech xxxxxxxxxxx období xxxx xxxxxxx xxxxx xxxxx xxxxxx xxxxxx komise xxx Xxxxxxx xxxxxx xxx kontrolu xxxxx xxx aktuální xxxxxxx, xxxx xx rozumí, xx xxxxx xxxxxx xxxxxx xxxxxx xx xxxxxxx (xxxxxxx xxx 3 xxxxxxx) a xx xxxxx xxxxxxxxxxx xxxxxx (za 3 xxxx po nabytí xxxxxxxxx xxxxxxxx č. 536/2014) xxxxxx xxx xxxxxx. Xxxxxxxxx xxxxxxx xxxxxx xxxxx vývoje x xxxx xxxxxxx xxxxxxxxxxx xxxxxx z počtu xxxxxxxxxxxxx žádostí x xxxxxxxx xxxxxxxxxx xxxxxxxxx x Xxxxx republice (xxxx-xx xxxxxx xxxxx xxxxxxxxxx xxxxxxxxx či xxxxx nebo xxxxxx xxxxx než x xxxxxxxx době). Xxxxxx xxxxxx xxxxxx xxxx xxxxxxxxx i xxxxx xxxxx xxxxxx komise, xxxxx bude xx xxxxxxx xxxxxxxx xxx xx 12-15 xxxxx x xxxxx xxxxxxx, xxx xxxxx může xxxxxx, xx by xxxx xxxxxx xxxxx xxxxxxx xx xxxxxx.
X xxxxxxxx 2se xxxxxxx, xx členy xxxxxx xxxxxx xxxxxxx x xxxxxxxx ministr xxxxxxxxxxxxx. Xxxxxxxxxx xxxxxx xxxxxxxx xx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxx xx Xxxxxxx ústavu xxx xxxxxxxx xxxxx, xxxxx xxxx xxxxxxxxxxxxxxx xxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx pouze xxxx xxxxxxxxx-xxxxxxxxxxx xxxxxx x xxxxxxxxxxxxxxx podporu xxxxxxxx xxxxxx komise. Zaměstnanci Xxxxxxxx ústavu xxx xxxxxxxx xxxxx xxxxxxxxxxx xxxxxxx xxxxxx xxxxxx xxxxxxx členy xxxxxx xxxxxx, xxxxxxx zasahovat xx xxxxxxx xxxxxx xxxxxxxxxx xxxxxxx xxxxxx xxxxxx x xxxxxxx xx podílet xx xxxxxxxxxxx xxxxxx xxxxxx. Xxxxxx úkolem xxxx xxxxxxxxx schůzek, xxxxxx xxxxxx x jednání, xxxxxxxxx xxxxxxxxx stanovisek xxxxxx komise Xxxxxx, x hlavně hlídání xxxxxxxxxx stanovených lhůt. Xxxxxxxxx xxxxxxxxxxxx xxxxx xxxxxx xxxxxx xxxxxxx xx xxxxxxxx xxxxx xxxxxxxxx xxxxxx Xxxxxxxx xxxxxx xxxxxxxx (XXX), xxxxxxx xxxx xxxx. Xxxxx xxx moderní xxxxxxx (XXX), Výbor xxx humánní xxxxxx xxxxxxxxx (XXXX) xx., xxx xxxxxxx orgán xx xxxxxxxxxxx, technicky x xxxxxxxxxx xxxxxxx xx Evropské lékové xxxxxxxx, xxx xxxxxxx xxxxxxx x rozhodování xx nezávislé.
Dále xx x xxxxx odstavci xxxxxxxx xxxxxxxx xxxxxxxxx xx složení xxxxxxx xxxxxx komise x xxxxxx xxxxxx xxxxxxxx x místopředsedy, xxxxxxx xxxxxx xxxxxxxxx samosprávy xxxxxxxxxxxx xxxxxx xxxxxx xxxxxx.
X xxxxxxxx 3 xx upraven xxxxxxxxx xx xxxxx xxxxxx xxxxxx x souladu x xxxxxxxxx čl. 9 xxxxxxxx x. 536/2014, xxx xxxx xxxxxxxxx xxxxxx xxxxxxxxxxx na xxxxxxxxxx, xxxxxxxxxxxx x xxxxxxx xxxxxxxxxx xxxxxxxxx, xxxxxxx xx xxxxxxxx xxxxxxxxx xx zkušenosti x oblasti xxxxxxxxxx xxxxxxxxx.
Xxxxxxxx 4 vychází x xxxxxxxxx xxxxxx xxxxxx, xxxxx xxxxxxxxx xxxxxxxx podstatných změn, xxxxx xxxxxxxxxx výslovného xxxxxxxxx na xxxxxxx xxxxxxx xxxxx etické xxxxxx x xxxx xxxxxxxxx x xxxxxx xxxxxx, x xxxxxxxx xxxx reflektuje požadavky xxxxxxxx správné xxxxxxxx xxxxx, xxxxxxx xxxxxxxxxx xxxxxxxx č. 536/2014 xxxxxxxx.
Xxxxxxxx 5 pak xxxxxx xxxxxx xxxxxx xxxxxx xxxxxxxxxx mlčenlivost x xxxxxxxxxxx a xxxxxxxxxxxxx, xxxxx xx dozví x xxxxxxxxxxx xx xxxx xxxxxxxxx v xxxxxx komisi.
Odstavec 6 xxx xxxxxxxxx xxxx, xxx členem xxxxxx xxxxxx xxxx xxxxxx xxxxx, xxxxx xx xxxxxxxxx xxxxxxxxx xxxxxxxxxxxxx x tom, xx xxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx, xxxxxxxxxx v xxxxxxxx 5. Xxxxx xx xxxx etické xxxxxx xxxxxxxx xxxxxxxxx xxxxxxx, xxxx xxxxxxxx x xxxxxx xxxxxx xxxxxxx přímo xx xxxxxx.
X §53x x §53x
Xxxx xxxxxxxxxx xxxxxxx xxxxxxxxx xx xxxxxxx xxxxxx xxxxxx, které xxxxxxxxx x nařízení č. 536/2014 x správné xxxxxxxx xxxxx XXX X6. Xxx xxxxxxxxxx xxxxxxx ze skutečnosti, xx xx každé xxxxxxx o xxxxxxxx xxxxxxxxx xxxx xxxxxxxxx xxxxxxxxxxx, která bude xxx xxx samostatné xxxxx –dokumentace, xxxxxxxx xx aspektů, na xxx xx vztahuje xxxx X xxxxxxxxx xxxxxx, která je xxxxxxxx xxx xxxxxxx xxxxxxx ČS (Xxxxxxxx, Xxxxxxxxxxxx´xXxxxxxxx, xxxxxxxxxxxxx dokumentace xx.), x xxxxxxxxxxx, xxxxxxxx se aspektů, xx něž se xxxxxxxx xxxx XX xxxxxxxxx xxxxxx, která xx xxxxxxxxx x xxxxxxxx xx vždy xx xxxxxxxxxxx XX (Xxxxxxxxx xxx xxxxxxxx, xxxxxxxxxxx xxxxxxx, seznam xxxxxxxxxxxx, xxxxx xxxxxxxxxx xxxxxxxxx, zajištění pojištění xx.). Xxxxxxxxxxx, týkající xx xxxxxxx, na xxx xx xxxxxxxx xxxx X xxxx xxxx II hodnotící xxxxxx xxxx xxxxx xxxxxxxxx xxxxxxxxxx x xx x x xxxxxxx xxxxxx, xxx. 2 xxx. Xxx xxxxxx část xxxx xxxxxxxxx xxxxxxxxxx hodnotící xxxxxx (náležitosti budou xxxxxxxxx xxx xxxxxxxxxx Xxxxxxxx xxxxxx x Xxxxxxxx xxxxxx xxxxxxxx (XXX), nyní xx xx xxxx pracuje x rámci xxxxxxxxxxxx xxx XXX). V xxxxx hodnotící zprávě xxxx xxxxxx xxxxx xxxxxxxxx xxxx xxxxxxx, xxxxx bude xxxxxxxxx xxxxxxxxxx, x to xxxxxxxxxxxxxxx xxxxxxx. Xxxxxxxxx xxxxxxxxxx xx xxxxxxx xxxx bude xxxxxx xx xx xxxxxx xxxx xxxxxx xxxxxxxx xx aspektů, xx xxx xx xxxxxxxx xxxx X a xxxx XX xxxxxxxxx xxxxxx. Xxx bude xxxxxx xxxxxx xxxxxxxxxxxxx, xxx. xxxxxxxxx xxxxxx x xxxxxxxxxx x xxxxxxxxxx, na xxxxxx xxxxxx xx nyní x rámci workinggroup xxx Xxxxxxxx lékové xxxxxxxx xxxxxxx.
Xxxxxxxxxx §53x x xxxxxxxx 1 xxxxxxx xxxxxxxxxx etické xxxxxx s xxxxxxxxx xxxxxxx xxxxxxxx praxe XXX E 6 x Helsinské xxxxxxxxx xx xxxxxxxxx xxxxxxx xxxx, bezpečnosti x xxxxxx lidských xxxxxxxx xxxxxxxxxx do xxxxxxx x humánními xxxxxxxx xxxxxxxxx. Xxxxxxx upravuje xxxxxxxxx xxxxxxxxxxx a xxxxxxxxxxxx nesouhlasné stanovisko xxxxxx komise, jak xx xxxxxxx x Xxxxxxxx XX, článku 8 xxxx. 4 xxxxxxxx x. 536/2014.
Xxxxxxxxxx §53x x odstavci 2 xxxxxxx x xxxxxxxxx Xxxxxxxx XIII xxxxxxxx č. 536/2014, xxxxxxx klinické xxxxx ICH E 6 a Helsinské xxxxxxxxx, xxxxx xxxxxxxx xxxxxx xxxxxx xxxxxx xxx místy xxxxxxxxxx xxxxxxxxx, xx xxxxxx xxxx souhlas. Dohled xx xxxxxxxx xx xxxxxxx písemných xxxxx x xxxxxxx xxxxxxxxxx xxxxxxxxx v xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxx hlavním xxxxxxxxxxx, je-li určen (XXX X 6, xxxx 4.10.1: „Xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx xxxxx xxxxxx xx xxx IBR/IEC xxxxxxxx, xx xxxx xxxxxxxxxxxxxxxxxxxxx xx the IBR/IEC.“, xxx XXX/XXX se xxxxxx XxxxxxxxxxxxxXxxxxxXxxxx/Xxxxxxxxxxx XxxxxxXxxxxxxxx). Xxxxx xxxx x xxxxxxxxxx dohled xx Xxxxxxx xxxxxxx xxx xxxxxxxx xxxxx, neboť Xxxxx xxxx xxxxxxxxx xxxxxx xxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxx xxxxx, případně na xxxxxxx xxxxxxxxx xxxxxxxxx xx xxxxx x xxxxxxxxxxx přípravku, hlášení xxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx a s xxx xxxxxxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxx x xxxxxx xxxxxxxxx s xxxxxx xxxxxxxx xxxxxxxxx x xxxxx xxxxxxxxx xxxxxxxxx, případně x xxxx xxxxxx činnosti Xxxxxx (xxxxxxxxxx v xxxxx skupiny XxxxxxxxXxxxxxXxxxxxxxxxxx Xxxxx (XXXX), CommitteeforAdvancedTherapies (XXX), Xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx xxx (XXXX) x xxxxxx).
Xxxxxxxxxx §53x v xxxxxxxx 3 xxxxxxx x xxxxxxxxx Kapitoly XX článek 10, x xxxx článku 5 xxxx. 7 xxxxxxxx x. 536/2014 x ze správné xxxxxxxx xxxxx XXX X6, článku 3.2.6 (Xx XXX/XXX mayinvitenonmemberswithexpertise xx xxxxxxxxxxxxxxxxxxxxxxxxx.)
Xxxxxxxxxx §53x x odstavci 4 xxxxxxxxx xxxxxx xxxxxx xxxxxxxxx xxxxxxxxx svou xxxxxxx v souladu x požadavky nařízení č. 536/2014 a Jednacím xxxxx. (xxxx viz xxxx).
Xxxxxxxxxx §53x v xxxxxxxx 5 uvádí, xx xxxxxxxxxx xxxxxxxx xxxxxx xxxxxx xxxxx xxxxxxxxx podle pracovních xxxxxxx (XXX X6, xx. 3.2.2 The XXX/XXX xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx to xxxxxxxxxxxxxxxxxxxxxxxxxx), xxx by xxxx xxxxxxxx jednotný x xxxxxxxxxxxxx xxxxxx xxxxxxxxxxxx xxxxxx etických xxxxxx. Pracovní xxxxxx xxxxxxx mimo jiné, xxx budou xxxxxxx xxxxxx komise xxxxxxxx x hlášením zadavatelů, xxxxxxx jsou xxxxxxx xxxxxxxxxxx xxxxxx - Xxxxxxxx XXX, Xxxxxxxx XXXX čl. 53 nařízení, xxx xx uvedeno, xx xx xxxxxxxxx xxxx oznamovat „xxxxxxxx xxxxxxxx xxxxxx“, xxx. xxxxxxx xxxxxxxxxxxx xx xxxxxxxxx xxxxxxxxx v Xxxxx xxxxxxxxx (Ústav x xxxxxx xxxxxx), xxxxx se xxxxxxx xxx x xxxxxx xxxxxxxxxxxxx; dále xxx xxxxx xxxxxxxxxxx Investigator´sBrochure, x x xxxxxxxxxx xxxx xxx Xxxxxxxx XXXX, čl. 52 x xxxxxxx odchylek xx xxxxxxxxx; xxxxx hlášení xxxx xxxxxxxx xxxxxx xxxxxx xx zkoušejících, xxxxx o xxxxxx x xxxxxxx xxxxxxxxxx xxxxxxxxx x dále xxxxxxx xxxxxxxxx odchylek xx xxxxxxxxx (Xxxxxxxx XXX, čl. 53 xxxxxxxx). Xxxx pracovní postup xxxx x xxxxxxxxx xxxxxxxxxx xxxx xxxxxxx xxxxxx x Xxxxxxx x zajištění xxxxxxxxx xxxxxxxxxx xxxxxx xxxxxx. Xxxxxxxx xxxxxxx xxxxx xxxxxxxxxx xxxxxxxx xxx xxxxxxxxxx xxxxxxxx etické xxxxxx xxxxxxxxxxx x xxxxxxxxx xxxxxxxx č. 536/2014, x xxxxxxxxx harmonizace xxxxxxxx.
Xxxxxxxxxx §53x v xxxxxxxx 1 x 2 xxxxxxx x xxxxxxxxx xxxxxxxx x. 536/2014 kapitoly XX xxxxxx 4 x xxxxxxxxx xxxxxxxx xxxxxxxx. Xxxx odstavce xxxxxxxxxxx xxxxxxxx xxxxxx xxxxxx xx xxxxxxxxx xxxxxxxxxxx, xxxxxxxx xx xxxxxxx, xx xxx xx xxxxxxxx část X xxxxxxxxx zprávy, jak xxx xxxxxxxx xxxxxxx x xxxxxxxx hodnocení, xxx pro xxxxxxxx xxxxxxx x významnou xxxxx xxxxxxxxxx xxxxxxxxx. Xxxxxx xxxxxxxxx vychází xx xxxxxxxx praxe; xxxxxx xxxxxx xxxx xxxxxxxxx (Kapitola II, čl. 6 xxxx. x) xxx x + Příloha č. I, písm. D) xxxxxxxxxxxxxx xxxxxxxxx klinického xxxxxxxxx, čímž xx xxxxxx zdůvodnění, proč xxxxxxxxx xxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxx (xxxx. xxxxxx být xxxxxxxxx klinická hodnocení, xxxxx xxxxxx xxxxxxx xxxxxx, např. sledují xxx dávno prokázané, xxxx jsou obsolentní, xxx. sledovaná léčba xx xxx překonaná x xxxx xxxxx xx x ní xxxxxx) x xxxxxxxxxx xxxxxxxxxx xxxxxxxxx, xxxx xx xxxxxx navržený xxxxxx (xxxx-xx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxx xx xxxxxxxxxxxxx, s xxxxxxxxxxx xxxxxxxxx x léčebné xxxx, xxxxx-xx xx x fázi X xx VI xxxxxxxxxx xxxxxxxxx dle stavu xxxxxx xxxxxxxx xxxxxxxxx, xxxx-xx xxxxxxx xxxxxxx xxxx xxxxxxx xxxxxxxxxx, xxxxx-xx xx x xxxxxxxx xxxxxxxxx xxxxxxx xx xxxxxxxxxxx, zaslepené, xxxxxxxxx, duble-dummy aj.). Xx základě všech xxxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxx xxxxxxx x xxxxx xxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx x jejich xxxxxx x xxxxxxxxx xxxxxxxxx.
Xxxxxxxxxx §53x x xxxxxxxx 3 xx 5 upravují xxxxxxxxx xxxxxxxxx xxxxxxxxxxx, xxxxxxxx xx xxxxxxx, na xxx xx xxxxxxxx xxxx XX xxxxxxxxx xxxxxx xxx xxxxx Xxxxx xxxxxxxxx. X xxxxxx xxxxxxxxxx se xxxxxxx xx současné xxxxx x xxxxxxxxx xx i xxxxxx xxxxxxxxxx xxxxxxx žádostí xxxxxxxx xx xxxxx xxxxxxxxx xxxxx (informace xxx xxxxxxxx, xxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxx, xxxxxxxxxxx xxxxxxxxxxxx, schvalování xxxx xxxxxxxxxx xxxxxxxxx, xxxxxxxxx xxxxxxxxx kompenzací x odměn x xxxx…) x působnosti xxxxxx xxxxxx.
Xxxxxxxxxx §53c x xxxxxxxx 6 xxxxxx xxxxxxxxxxx xx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxx xxxxxx.
Xxxxxxxxxx§53x x odstavci 7 x 8 blíže xxxxx možnosti, x xxxxxx případech xxxx xxxxxxx etická xxxxxx xxx xxxxxxxxx xxxxxxxxxx x xxxxxxx uvádí xxxx xxxxxxxxxxx. X xxxx xxxxxxx z xxxxxxxxx Xxxxxxxx XX článku 4 xxxxxxxx č. 536/2014, xxx je xxxxxxxxx pro členský xxxx povinnost zajistit xxxxxxxxxx xxxx xxx xxxxxx xxxxxxx. Xxxx xxxxxxxxxx xx xxxxxx x následujících úkonů: 1. xxxxxxxx = xxxxxxxx xxxxx xxxxxxxxxxx xx xxxxxxxx xxxxxxx, 2. posouzení - xxx xxxx X xxxxxxxxxxx (xxx xxxxxx xxxxxx - Xxxxxxxx, Xxxxxxxxxxxx´xXxxxxxxx - xxxxxxxxx x vypracování xxxxxx xxxxxxxxx xxxxxx = xxxxxxxx xxxxxxxx a xxxxxxx event. xxxxxxxxxx, 3. xxxxxxxxxx xxxxxxxxxx xx. xxxxxxxx xxxxxxxxxx, 4. kompilace finální xxxxxxxxx xxxxxx a xxxxxxxxxx (povolení/povolení x xxxxxxxxx/xxxxxxxxx). To xxxx xxxxxxxxxx xxxxx, xx xxxxx xx xxx xxxxxxxxx č. 536/2014 timeline, xxx. max. čas xxx xxxxxx xxxxxxxxxx/xxxxxxxx. Xxxxx postup xxxx xxxxxx pro xxxxxxxxx xxxxxxxxxxx, xxxxxxxx xx xxxxxxx, na xxx xx xxxxxxxx část X hodnotící xxxxxx, xxx x dokumentace, xxxxxxxx se xxxxxxx, xx xxx xx xxxxxxxx xxxx XX xxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxx. Xxx Xxxxxxxx XX čl. 4 xxxxxxxx x. 536/2014 xx xxxxxx xxxxxxx xxxxxxxxx xxx xxx xxxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx, xxx x pro xxxxxxxxx xxxxxxx x povolení xxxxxxxx xxxxx.
Xxxxxxxxxx §53x x odstavci 9 xxxxxx Xxxxxxxx ústavu xxx xxxxxxxx xxxxx, xxxxx bude etická xxxxxx xxxxxxx Xxxxxx, xxxxxxxxx xxxxxxxxxx xxxxxxx x činnosti etické xxxxxx xx dobu 5 let.
K závaznosti xxxxxxxxxx xxxxxx xxxxxx xx xxxxx, xx xxx dikce xxxxxxxx, xxxxx xxxx xxxxxxxxxx XX negativní, xxx Xxxxx žádost x xxxxxxxx xxxxxxxxx zamítne. Xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx, xxx xx xxxx xxxxxxx. Etická xxxxxx xxxx o xxxx nebude xxxxxxx xxxxx xxxxxxxxxx. Xxxxxxxxxx x xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxx xxxxxxxx xxxxxxxx xxxxx xxxx xxxxxxx Xxxxx, x to x xxxxxx xxxxxxxxx xxxxxx. Xxxx xxxx xxxxx xx xxxxxxx xxxxx xxxxxxxxxx, xxxxx xx xxxx xxxxxxxx xx provedeném etickém xxxxxxxx etické komise, x xxxxx xxxxxx xx xxxxxxxxxx xxxxxx xxxxxx povahu odborného xxxxxxxx xxx xxxxxxxxxx. Xxxxxxxx xxxxxx xxxx xxx xxxxxxx xxxxxx xxxxx xxxxxxx xxxxxx xxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxxx Xxxxxx.
Xx xx xxxx xxxxxxxx xxxxxxxxxx etickou xxxxxx xx xxxxxxx xxxxxxxx, x xxxxx xxxxxx xxxxxxxx. Xxxxxx xxxxxxxx xxxxxxxxxx je přitom xxxxxxxxxxxxxx x xxxxxxxxxx §53x.
X §54 (Xxxxxxxx XXXX, xx. 49 x 50, Xxxxxxxx XX, čl. 73 xxxxxxxx):
Xxxxxxxxxx se xxxxxx xxxxxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxxxx. Čl. 49 xxxxxxxx x. 536/2014 xxxxxxxxx xxxxxxx xxxx x xxxx, xxx xxxxx, xxx může xxx podle jeho xxxxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx xx hlavním xxxxxxxxxxx. Podle navrhované xxxxxx xxxxxx zkoušejícím x hlavním xxxxxxxxxxx xxxx být xxxxx xxxxx nebo xxxxx xxxxx splňující xxxxxxxx xxxxxxxxx zákonem č. 95/2004 Sb., xx xxxxx xxxxxxxxxx xxxxxxxx, pro výkon xxxxxx xxxxxxxxxxxxxx xxxxxxxx, xxxxx xx xxxxxxxx xxxxxxx xxxxxxxx x xxxxxxxxxx x péčí x pacienty s xxxxxxxxxxx xx stavy, xx xxxxxxx xxxxx xx zaměřuje xxxx xxxxxxxx xxxxxxxxx x xx xxxxxxxx xxxxxxx xxxxxxxx praxe.
Odstavec 2 xxxxxxx x xxxxxxxxx čl. 50 xxxxxxxx č. 536/2014 xx xxxxx xxxxxxxxxx hodnocení. Xxxxx xxxxxxxxxx hodnocení xxxxx xxx xxx u xxxxxxxxxxxxx xxxxxxxxxxx služeb xx xxxxxxxxxxxxxx xxxxxxxxxx, xx. xxxxxxxx osob, xxxxx jsou podle xxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxxxx služeb xxxxx zákona č. 372/2011 Sb., xx xxxxx xxxxxxxxxx xxxxxxxx, x jejich xxxxxxxx bude xxxxxxxxxx xxxxxxxxxx pro xxxxx xxxxxxxx hodnocení se xxxxxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxxxx potřebné x provedení daného xxxxxxxxxx xxxxxxxxx.
Xxxxxxxx 3 x 4 xxxxxxxxx xxxxxxxxxxx či xxxxxxxxxxxx xxxxxxxxx xxx xxxxx xxxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxx správné xxxxxxxx xxxxx, xxxxxx Xxxxxxx. Xxxxxxx xxxxxxx xx xxxxxxxxxx znění zákona x léčivech a xxxxxxxx xxxxx, x xxxxxxxx xxx xxxxxxxx xxxxxxx v xxxxxxxx 3 povinnost získat xxxxx certifikát, x xx x xxxxxx, xx xx xxxxx x xxxxx x xxxxxxxx hodnocení, xxxxx xxxxxxx xxxxxx xxxxxxxx xxxxxxxx hodnocení (xxxxx xxxxxx člověku) nebo xxxxxxxx xxxxxxxxx xxx xxxxxxxxx nebo xxxxxxxxxxxxx xxxxxxx xxx xxxxxxxxxx xxxxxxxx xxxxxxxxx (bioekvivalenční xx xxxxxxxxxxxxxxxx klinická xxxxxxxxx).
X §55 (Xxxxxxxxx (26); Kapitola XX, xx. 26 xxxxxxxx x. 536/2014):
X xxxxx xxxxxxxxxx jde x xxxxxxxx čl. 26 x 69 xxxxxxxx x. 536/2014, xxxxx xxxxx xx měl xxxxxxx xxxx xxxxx jazykové xxxxxxxxx xx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx x xxxx xx měl xxxxx xxxxx xxxxxxxxx xxxxxxxxx x xxxxxxxx xx xxxxx. X §55 xx xxxxxxx x xx xxxxxx, xx xx xxxxxxxxx x dokumentace xxxxxxxxxx xxxxxxxxx, xx xxxxxxx xxxxxxxx xx styku xxxxxxx xxxxxxxxx, xxxx xxx xxxxxxxxxx v xxxxxxx. Mimo xxxx xxx xxxxxxxxx x xxxxxxxxx xxx pacienta, xxxxx xxxxxxxx, návod xxx xxxxxxx studijní xxxxxxxx x xxxxx x xxxxxxxxx zdravotnického xxxxxxxxxx. Xxxxxxxxx xx xxxxx xxxxx xxxxxxxxx xx xxxxxx i xxx xxxxxxxxx, x xxxxx xx s xxxxxxx xx vysokou xxxxxxxxx daného xxxxx xxxxx dojít xxx xxxxxxx xxxxxxxx do xxxxxxx jazyka x xxxxx xxxxxxxxxxxx, xxxxxxxxx xxxxxxxx xxxxxxx. Xxxxxxx xxxxxxxxx z dokumentace xxxxxxxxxx xxxxxxxxx xx xxxxxxxxxxx x xxxxxxx, xxxxxxxxxxx nebo angličtině. Xxxxx xxx o xxxxx xxxxxxxxx xxxxxxxxx x xxxxxxxx na xxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxxx xxxxxxxxx, xxxxx se určuje xxx, xx tímto xxxxxxx je xxxxxxx, xxxx-xx v xxxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx o xxxxxxxx klinického xxxxxxxxx xxxxxxx xxxxx. Xxxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxx xxxxxxx ze skutečnosti, xx x xxxxxxxxx xxxxxxxxxxxxx klinických hodnocení, xxxxx xxxx xxxxxxx xxxxx nízký xxxxx xxxxxxxx (xxxxxx oblasti xxxxxxxx xxxxxxxxxx) by xxxx xxxxxxxxxxxx xxxxxxx x xxxxxx pro xxxxxxxxxx, aby x xxxxxxxxx, které xxxxxx xxxxx, xxxxxxxxxx celé xxxxxxxx na xxxxx x xxxxxx jazyce. Xxxxxxxxxxxx označení na xxxxx hodnoceného xxxxxxxx xxxxxxxxx zasahuje xx xxxxxxxxx xxxxx xxxxxxxx xxxxxxxxx x xxxxxx xx českých xxxxxxx xx x xxxxx xxxxxxx xxxxx xxxx x xxxxxxxxx Xxxxx xxxxxxxxx x klinického xxxxxxxxx, a tedy xx xxxxxxxxxxxxxx xxxxx xxxxxxxx v xxxxxxxx x velmi vzácným xxxxxxx přípravkům. Xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxx xxxxxxxxx xxxxxxxxxx xx xxxxx text xxxxxxxxx x obalu, xxxxx xxxx xxxxx x xxxxxxxxxx v xxxxxxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxxxxx a xx xxxxx povinni xx x xxx seznámit, xxx xxxx xxxxxxx xxxxxxxx xxxxxxx xxxxxxxxx x xxxxxxxxx x xxxxxxxxxx xxxxxxx přípravkem.
K §56 (Xxxxxxxx XXXX, xx. 59 odst. 3; Xxxxxxxx XX, xx. 61 xxxx. 5 písm. x), xx. 68; Xxxxxxxx XXXXX, xx. 90 x 92 xxxxxxxx x. 536/2014):
X xxxxx xxxxxxxxxx se xxxxxxxxx xxxxxxxx xx xxxxxxxxxx čl. 59 odst. 3 xxxxxxxx č. 536/2014, xxxxx xxxxxxxx, aby xxxxxxx stát xxxxxxxx, xx xx xxxxxx xxxxxxx x klinickém xxxxxxxxx xxxxx xxxx xx xxxx xxxxx xxxxxxxx xxxxxxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx. X xxxxxxxx 2 xx xxxxxxx xxxxxxxxx xxxxxx xxxxxx, xxxxx xx xxxxxxxxx xxx, xx xx výslovně xxxxx xxxxxxx za stanovených xxxxxxxx xxxxxx x xxxxx klinického hodnocení x takové xxxxxxxxxxxx xxxxxxxxxx, xxxxx xxxxx xxxxxxxxx požadavky stanovené xxxxxxx x zdravotnických xxxxxxxxxxxx. Xxxxx xxxxxxxxx xxxxxxx x povinnosti xxxxx zajistit validitu x xxxxxxxxxx xxx, xxxxxxxxx x klinického xxxxxxxxx. Xxxx xx xxxxxxxxx xxxx. xxxxx xxxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxx xxxx xxxxxxxxxxxxxx xxxxxxxxxx xx všech xxxxxxxxxxxx xxxxxxx (xxxxxxx xxxxx XX x 3. xxxx) x xxx x xx xxxxx místech xxxxxxxxxx xxxxxxxxx. X klinických xxxxxxxxx, xxxxx xxxx xxxxxxxx xx xxxxxxxxx xxxxxx xxxxxxxx, xxxxx xxxxxx xx provádí xxxxxxxxxxxxx xxxxxxxxxxx, x xxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx xx xxxxxx xx třetí zemi (xxxx. XXX) je xxxxxxxx požadavkem zadavatele, xxx xxxxxxx zúčastněné xxxxx používaly xxxxxxx, xxx dodaný xxxxxxxxxxxx xxxxxxxxxx xxx, xxx xxxxxxxx xxxxxx nebyly xxxxxxxxx rozdílností xxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxx. Xxxxxxxxx xxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxx xx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxx xxxxxxxxxx x xxxxxxxxx xxxx xxxxx tento xxxxxxxxxxxx xxxxxxxxxx xx xxxxx Xxxxxxxx unie xxxxxx xxxxx xxx v xxxxx klinickém xxxxxxxxx, x to zejména x ohledem xx xxxxxxxxxx, že xxxxxx xxx xxxx výrobcem xxxxxx xxxxxxxxxxxxxx xxxxxxxxxx. Xxxxxx pro xxxxx xxx xxx xxxxxxx, xxxxx xxxxxxxxxxxxx xxx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxx xxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxxx, a xxxx xx xxxxxx vyskytovat x Xxxxx xxxxxxxxx.&xxxx; X xxxxxxx, xx xx tato xxxxxx xxxxxx xxxxxxxxxxx, hrozí xxxxxxxxx České xxxxxxxxx x xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx, přestože xxxx xxxxxxxx benefity xxx pacientskou populaci x Xxxxx xxxxxxxxx. (Xxxxxxxxx xxxx být xxxx. použití xxxxxxxxxx xxxxxxxxxxx a xxxxxxxxxxx xx 3. zemi (XXX), xxxxx nebude xxxx klinické xxxxxxxxx x České xxxxxxxxx xxxxxxxx. Jeho xxxxxxxx xxxxxxx x xxxxxxxxx xxxxxxxxx nabídne xxxxxxx xxxxx xxxxx vyvíjeným xxxxxxxxxx, který xx xxxxxxxx registraci xxxx xxx xxxxxxxx x xxx xxxxx xxxxxxxx, x xx x xxxxxx, že xxxxxxxxx xxxxxxxxx v rámci xxxxxxxxxx hodnocení xxxx xx jeho xxxxxxxx xxxxxx zadavatelem x xxxxxxx z Xxxxx xxxxxxxxx, xxxxxxxxxx hodnoceného xxxxxxxx xxxxxxxxx x xxxx dostupnost xx xxxx x České xxxxxxxxx xxxx podmíněna xxxxxxxxxxx xxxxxx xxxxxxxxxxxxxx xxxxxxxxxx, xxx xxxx xxxxxxx v xxxxxxxxx xxxxxxxxx zajišťuje xxxxxxxx x xxxxxxxxxx dat. Xxxxx xxxxxxxxx může xxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxx biologické xxxxxx, např. xxxxxx xxxx xxxxxxxxx xx xxxxxxxxx xxxxxxx, xxxxx xxxxxxx xxxx xxxxxxxx x xxxxxxxx xxxxxxx xx xxxxxx vzorku, xx jeho xxxxxx xx xxxxxxxxxxxxxx laboratoře x zahraničí. Xxxxxxx xxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxx po xxxxxx xxxxxxxxxx, xxx xxxxxx xxxxxx xxxxx xxxxxx xxxxxxxx v xxxxx xxxxxxxxx xxxxxxxxx x tím x xxxxxxx léčby xxxxx xxxxxxxxxxxxxxx léčivým xxxxxxxxxx).
X xxxxxxxx 2 xx xxxxxxxx nekomerční xxxxxxxxxx, xxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxxx zřízený xxxx xxxxxxxx xxxxxx xxxx územním xxxxxxxxxxxx xxxxxx, xxxxxxx xxxxxx xxxxx xxxx xxxxxxx xxxxxxxx xxxxxxxxx, čímž xx xxxxxxx prostor xxx xx, xxx xxxxxxx nich xxxx x některých směrech xxxxxxxxx xxxx přísné xxxxxxxxx, xxx k xxxx xxxxxxx xxxxx xxxxxx xxxxxxxxx xxxxxxxx.
X xxxxxxxxxx 3 xx 5 se xxx x xxxxxxx s xxxxxxxx právními xxxxxxxx xxxxxxx, aby xxxxxxxxx xxxxxxxxx xxxxx s xxxxxxxxxxx žádosti o xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xx xxxxxxxx xxxxxxxxxxx státních xxxxxx. Jde o xxxxxxxxxxxx xxxxxxxxxx čl. 92 xxxxxxxx x. 536/2014, xxxxx xxxxx xxxxx xxxxxxxxx není xxxxxxx xxxxxxxx členských xxxxx xxxxxxxxxx svou xxxxxxxxx xxxxxxxx x xxxxxxxxxxx xxxxxxxxxxxxx a poskytování xxxxxxxxx xxxx. X xxxxxxx xx xxxxxxxx xxxxx xxxx xxxxxxxxx, xxx xxxxxx xxxxxxxxxx xx strany členského xxxxx xxxx k xxxxxxxxxx xxxxxxx souhlasu x xxxxxxxxx xxxxxxxxxx (xxxxxxxxx xxx možnosti xxxxxxxxx xxxxxxxx klinického xxxxxxxxx) xxxx v xxxxxx xxxxxxxx xxxxxxx xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxx orgánů xx xxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx, xxx xx x xxxxxxxx důsledku xxxxx x xxxxxxxxxx provádění xxxxxxxx xxxxxxxxxx hodnocení xx xxxxx Xxxxx xxxxxxxxx.
X xxxxxxxx 6 xx v souladu x xxxxxxxxx nařízení č. 536/2014, xxxxxxxxx (11) xxxxxxx možnost xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxxxxxxxxxxxx x xxxxxxxxxxx klinických xxxxxxxxx xxxxxxxxxxx nekomerčními xxxxxxxxxx, aniž xx xxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxx xxx.
X §57 (Xxxxxxxx XXX, čl. 42 xxxxxxxx x. 536/2014):
Xxxx xxxxxxxxxx x souladu x čl. 42 odst. 3 xxxxxxxx x. 536/2014 xxxxxxxx, xxx Xxxxxx xxxxx xxx xxxxxxxx xxxxx při xxxxxxx podmínek xxxxxxxxxxx x xxxxx nařízení xxxxxxx xx zadavatelem xxxxxx, xxxxx níž xxxx xxxxxxxxx xxxxxxxxx xx závažné xxxxxxxxxxx xxxxxxxxx xxxxxx hlásit xxxxx xxxxxxxx xxxxx Xxxxxx. X xxxxxxx xxxxxxxx xxxxxx dohody xxx xxxxxx xxxxxxxxx xx xxxxxxx neočekávané xxxxxxxxx účinky xxxxxxxx xxxxx zadavatele Xxxxx. Xxxxxxxx č. 536/2014 xxxxx xxxxxxxxx tuto xxxxxxxxx xxxxxxxxx státu.
K §58 (Xxxxxxxx XII, xx. 76 nařízení x. 536/2014):
Xxxx ustanovení xx xxxxxxxxxxxx článku 76 xxxx. 1 xxxxxxxx x. 536/2014, xxxxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx, xxx xxxx xxxxxxxx xxxxxxx xxxxxxx xxxxxxxx xxxxx (xxxx majetkové x nemajetkové), xxxxxx xxxxxxx hodnocení xxxxx x souvislosti x xxxxxx x xxxxxxxxx xxxxxxxxx prováděném xx xxxxxx xxxxx, x xx x xxxxxx xxxxxxxxx, ručení nebo xxxxxxx xxxxxx, xxxxx xx xxxxxxxxxx, pokud xxx o xxxx, x xxxxxxxxx xxxxxx x xxxx xxxxxx.
X xxxxx ustanovení xx xxxxxxxx xxxxxxx, xx xxxxxxx-xx xxxxxxxx xxxxxxxxxx xxxxxxxxx x důsledku xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xx xxxxxxxxx xxxx, x xx xxxxxxx na xxxxxx xxxx xx zdraví, xx zadavatel xxxxxxx xx xxxxxxxx x xxxxxxx s jinými xxxxxxxx předpisy, xxxxxxx xx xxxxxxxx xxxxxxxxx xx příslušná xxxxxxxxxx xxxxxxxxxx xxxxxxxx.
Xxxxxxxx xxxx xxxx xxxxxxxx xxxxxx xxxxxxx stanovit xxxxx xxxxxxxx xxx xxxxxxxxxx xxxxxxxxxx. V xxxxxxxxx č. 81 xxxxxxxx č. 536/2014 xx xxxxxx x xxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxx, xx členské xxxxx x xxxxxx účelu xxxxxxx xxxxxxxxx xxxxxxxx. Xxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxx xxxxxxxxxxxx xxxxxxxxxx xx xxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx x xxxxxxxx 3, xxxxx xxxxxxx xxx xxxxxxx stanovených podmínek xxxxxxxxx stávajícího xxxxxxxxx xxxxxx xxxxxxxx. Xxx xx xxxxxxx xxxxxxxxx xxxxxxxxxxx pro to, xxx komerční xxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxx xxxxxx diskriminováni a xxxx xxxxx postavení xxxx xxxxxxxx xxxxxxxxxx.
X §59 (Xxxxxxxx X, xx. 2 definice (20); Xxxxxxxx XI, xx. 74 xxxxxxxx x. 536/2014):
Xxxxxxxxxx se xxxxxxx xxxx xx xxxx v zákoně č. 268/2014 Sb., x xxxxxxxxxxxxxx xxxxxxxxxxxx a x xxxxx xxxxxx x. 634/2004 Sb., x xxxxxxxxx poplatcích, ve xxxxx xxxxxxxxxx xxxxxxxx, xxxxxxx plné xxxx xxxxxxxxx, které xxxxxx xxxxxxxxx ve xxxxxxxxx xxxxxxxx xxxxxxx xxxx xxxxx zákonného xxxxxxxx xxxxxxxxxx, xx xxxxxxxxx xxxxx. Jedná se x ustanovení speciální x ustanovení §30 xxxx. 5 správního xxxx, který požaduje xxxxxxxxx xxxxxxxxx subjektu xxxxxxxxxxx xx xxxx xxxx. Xxxxxxxxxx xxxxxx xx xxxx xxxxxxxxxx xxxxxxxxxx xxxxxx zmocnění, xxx xx vyjádřeno xxxxxxxxx xxxxxxxxx.
Xxxx xxxxxxxx, xxxxx xxxx xxxxx xxxxxxx xxxxxxx xxxxx, xx xxxxx xxxxxxx xxxx xxxxxxxxx činit xxxxx xxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx, xxxx xxxxxxxxx x jednotném evropském xxxxxxxxx, kterým xxxxxx xxxx xxxxx xxxxx x xxxxxxxx klinického xxxxxxxxx, x xx xxxxx xxxxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx. Xxxxxx xxxx primárně xxxxxxxxx xxxxxxxxxxx, tedy subjektem xxxxxxxx udělujícím. Xxxxxxxxxx, xx xxxxxxxx do xxxxxx xxxxxxxxxx xxxxxxx xxxxx přidělovat xxxxxxx xxxxxx Xxxxxxxx xxxx, x xx xx xx xxxxx identifikaci xxxxxxxx xxxx tento xxxxxx xxxxxx xxxxxxxxxxxx x xxxxxxxxx, xx xxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxx bude xxxxxxxxx.
Xxxxx, x xxxxx xxxx xxxxxxxxxx xxxxxxxxx žádosti, xxxx xxxxxxxxx xxxxxxxxx x xxxx xxxxxx xxxxxx a možnost xxxxxxxxx xxxxxx xxx xxxxxxxx xx xxxx xxxxx 1x xxx xxxxxxxx xxxxxxxxxxx a xx na 5 xxxxxxxxxxxx xxx (x 1x xxx xxxxxxxx xx základě xxxxxxxxx xxxxxxxxxx, x xx xxxxx xx dobu 12 kalendářních xxx). Xxxxxxxxxx xxxxxx úprava xx xxxxx v xxxxxxx xx xxxxxxxxx xxxxxx úpravou xxxxxxxxx xxxxxxxx, xxx plná xxx xxxx xxxxxxx xx xxxxxxx x xxxxxxxxx smluvního xxxxxxxxxx. Xxxxxxxx k xxxx, xx komunikace xxxx xxxxxxxxxxxx subjekty x xxxxxxxxxx xx xxxx xxxxxxxxxx xxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxx, jeví xx xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx jako xxxxxxxxxx x bez xxxxxxxxxx xxxxxxxxxx.
X §60 xxxx. 3 xxxx. x), xxxxx xx xxxxxxxx.
Xxxx 1. xxxxx 2013 xxxxx xxxxxxxxx xxxxx č. 359/2012 Sb., xxxxxx xx xxxx xxxxx xx xxxxxxx zvířat xxxxx xxxxxx. Xxxxx xxxxxxxxxxx xxxxx §15 xxxx. 3 xxxx. x) zákona xx xxxxxxx zvířat proti xxxxxx xx ustanovení xxxxxx xxxxxx, xxxxx xxxxxxxx xxxxxxx xxxxxxxxx xxxxxx, xxxxxxxxxx xx xxxxxxx, xxx xxxx xxxxxxx xxxxxxx xxxxxxx xxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxx xxxxxxxxxx veterinárního xxxxxxxx xxxxxxxxx. Xx 1. xxxxx 2013 tedy xxxxx xxxxxxxxx xx xxxxxxxxxxx xxxxxxxx pokusů xxxxxx xxxxxxxxxx x xxxxxxxxx (xxxxxxxx) xxxx xxxxxxxxxxx projektu xxxxxx xx veterinární klinická xxxxxxxxx xxxxxxxxxx xxx xxxxxxxxxx veterinárního xxxxxxxx xxxxxxxxx.
K §62 xxxx. 1, §64 xxxx. x) x x) x §66 xxxx. 4:
Xxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxxxxxxx x xxxxxx xxxxxx xxxxxx xxxxxxxxxxx xxxxxxxx přípravků, xx xxxxx do xxxxxxx x xxxxxxxxx. Xxxxxxxx xxxxxxxx xxxxxx úpravu xxxx xxxxxxx v xx. 61.
X §70 xxxx. 1:
X xxxxx xxxxxxxx 1 je xxxxxxxx „xxxxx xxxxxxxxxx xxxxxxxx Xxxxxxxx unie“, x to proto, xx bylo xxxxxx xxx xxxxxxxx xxxxxxxx Xxxxxx x xxxxxxxxx xxxxxxxxx (EU) č. 1252/2014 xx dne 28. xxxxxx 2014 doplňující xxxxxxxx Xxxxxxxxxx parlamentu x Rady 2001/83/XX, xxxxx xxx x xxxxxx x xxxxxx xxxxxxx výrobní xxxxx xxx účinné látky xxx xxxxxxx xxxxxx xxxxxxxxx, xxxxx xxxxxxxx xxxxxxxx xxxxxxx xxxxx xxx xxxxxx látky. Xxxx nařízení xx xxxx xxxxx použitelné, xxxxxxx xx xxxxxx, xxx xxxx navázáno xx xxxxxxxxxxxx xxxxxx xxx, xxxxxxx x xxxxxxx xx nezbytnost xxxxxxxxx sankcí za xxxx xxxxxxxx.
X §70 xxxx. 7:
Cílem xxxx xxxxxx v xxxxxxxxxxx xxxxxxxx 7 je, xxx x xxxxxxxx xxxxx pocházejících xx xxxxxxx zemí, xxxxx xx xxxxxxxxx při xxxxxxxx léčivých xxxxxxxxx, xxx xxxxxx xxxxxx xxxxx, x aby xxxx xxxxxxxx x xxxxxxx se xxxxxxxx xxxxxxx xxxxx xxx xxxxxx xxxxx xxxxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxxxx Xxxxxx.
X §77 xxxx. 1 písm. x):
Xxxxx xxxxxxxxx xxxxxx xxxxxx xx rozsah a xxxxxx xxxxxxxxxxx xxxxx x xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxx formou xxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx léčiv. X xxxxxxxx xxxxxxxxx xxxxxx xxxxxxx a xxxxxxxxx vymahatelnosti nápravy xxx xxxxxxxx této xxxxxxx xxxxxxxxxx xx xxxxxxxxx, xxx xxx xxxxxx údajů, xxxxxx xxxxxxxx x xxxxxx xxxxxx xxxxxxxxxxx xxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxx předpisem.
K §77 xxxx. 1 písm. x):
Xxxx xx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx v xxxxxxx x xxxxxxxxx xxxxxx xxxxxx xxxxxxx xxxxx §77x. Xxxx xx x xxxxx ustanovení xxxxxxxx xxxxxxxxx povinnost xxxxxxxxxxxx xxx splnění xxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xx 48 xxxxx xx obdržení xxxx xxxxxxxxx.
X §77 odst. 1 písm. q):
Stanoví xx xxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxxx v xxxxxxxxx, xxx hodlá xxxxxxxxxxxx xxxx xxxxx Xxxxx xxxxxxxxx xxxxxx xxxxxxxxx, xxxxx xx xxxxxx xx xxxxxxx xxx §77c. Po xxxxxxxx plánované xxxxxxxxxx xxxx xxx Xxxxxxxxxxxxx xxxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxx xxxxxx, kterým xxxx xxxx omezen xxxxxxxx xxx, xx xxxxxxx k xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxx xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xx x xxxxxx xxxxxxxx uvedeno, xx xxxxxxxx x xxxxxxxxxx xxxxxxxx přípravku xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxx, xxxxxxxxxxxx xxxxxxxx xxxxxxxxx, množství xxxxxxxx xxxxxxxxx v xxxxxxx xxxxxxxxxx, název xxxxx xxxxxxxxxx a xxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx přípravku. Xxxxxx xxxxx xxxxxxxxx x xxxxxxxx a xxxxxx xxxxxx xxxxxxxxxxx xxxxxx xxxxxxxx xxxxxx stanoví xxxxxxxxx xxxxxx předpis.
Elektronické xxxxxxx je xxxxx x xxxxxxx na xxxxxx xxxxxx z xxxxxxx xxxxxxxxx xxx, xxxxxxxx xx xxxxxx xxxxxxxxx xxxxxxxxxx x xxx xxxx xxxxxxx xxxxxxxxx a xxxx xxxxxxxx xx xxxxx xxxxxxxxxx daného léčivého xxxxxxxxx xx xxxx. Xxxxx xx xxxx xx Xxxxx přicházela x jiné, resp. x různých xxxxxxxx, xxxxx xx je Xxxxx napřed xxxxxxxxx xx xxxxxxxx xxxxxx, xxx xx pak xxxx xxxxx zpracovat, xxxxxxxxxx a učinit xxxxx. X xxxxxxx xx xxxxxxx xxxx, xxxxxx xx Ústav xx xxxxxxxxxx hlášení x xxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxx podnětu x xxxxxx opatření obecné xxxxxx xx XX, xx jiná xxxxx, xxx xxxxxxxxxxxx xxxxxx xxxxxxxxxx. Xxxxxx xx xxxxx vzít v xxxxx, xx xxxxxxx xxxx povinně vybaveny xxxxxxxx a xxxxxxxxxx x xxxxxxxxx, xxxxxxxxxxxx xxxxxx používají počítače, XX a elektronickou xxxxx dat, která xxx xxxx xxxxxx xxx xxxxxx xxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxx x xxxxxxxxxx záznamů x xxxxxxxxxxx xxx xxxxxx x xxxxx xxxxxx povinností jim xxxxxxxxx jinými xxxxxxxxxxxx xxxxxx x xxxxxxxx.
X §77x:
Xxxxx xxxxxx xxxxxxxxxx Xxxxx xxxxxxxx xxxxxxxxx xxxxxxx na trhu x léčivými xxxxxxxxx, x to zejména xx vztahu xxxx xxxxxxx xxxxxx xxxxxxx xxxxxxxx přípravků xx xxx v Xxxxx xxxxxxxxx podle §33 xxxx. 2 x xxxxxxx léčivých xxxxxxxxx xxxxxxxxxxxx či xxxxxxxxx xxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx. Xx základě xxxx analýzy pak Xxxxx sděluje Xxxxxxxxxxxx xxxxxxxxxxxxx informace x xxxxxxx xx trhu xxxxxxxxxxx x xxxxx xxxxxxxx xxxxxxxxx, xxx xxxxxxx xxxxxxxxxx xx xxxx x České xxxxxxxxx xx xxxxx xxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxxxx při poskytování xxxxxxxxxxx služeb pacientům x České xxxxxxxxx.
Xx xxxxxxxxxxx xxxxxxx poskytnutých Xxxxxxxxxxxx xxxxxxxxxxxxx Ústavem Xxxxxxxxxxxx zdravotnictví xxxx xxxxxx xxxxxxxx přípravků (xxxxxx xxxxxxxxx xxxx xx xxxxxx xxxxxxxxxx xxxxxx xxxxxxxx obecné xxxxxx), při xxxxxxx xxxxxxxxxx xx xxxx x České xxxxxxxxx xx mohlo xxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxxxx xxx xxxxxxxxxxx zdravotních xxxxxx xxxxxxxxx x Xxxxx xxxxxxxxx. Xxxxx xxxxxx Ministerstvo zdravotnictví xxxxxxxx xx svých xxxxxxxxxxxxx stránkách. Seznam xx xxxxxxxx xxxxxxxxxxxx x zveřejňován. Do xxxxxx xxxxxxx je xxxxxxxxx xxxxxx xxxxxxxxx, xxxxx xxxx xxxxxxxxxxxx xxxxxxx přípravkem odpovídajících xxxxxxxxx vlastností, xxxxxxx xx pro xxxxxxx xxxxxxxx x České xxxxxxxxx xxxxxxxx, a xxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx by xxxx xxxxxxx xxxxxxxxxx x xxxxxxxx xxxxx xxxxxxxx v České xxxxxxxxx s xxxxxx xxxxxxx xx xxxxxxx xxxxxx xxxxxxxxxxxx x xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx služeb.
Na xxxxxx xx x ohledem xx xxxxxxxx, xx xxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxx xxxxxxx xxxxxxxxxx x xxxxxxxx xxxxx xxxxxxxx x Xxxxx xxxxxxxxx x přímým xxxxxxx xx ochranu xxxxxx xxxxxxxxxxxx, xxxxx být xxxxxxxxxx xxxxxxx léčivé xxxxxxxxx, bez xxxxxx xx xxxxxx xxxxxxxxxxxx xxxxxxxx. Přímý xxxxx xx xxxxxxx xxxxxx xxxxxxxxxxxx xxxx xxx x nedostatek xxxxxxxx xxxxxxxxx určeného x xxxxx jiné xxx xxxxx xxxxxxxxxx terapeutické xxxxxxxx. Xxxxxxxxx xx, xxx xxxxxx xxxxxxxxx xxxxx x xxxx xxxx nahraditelný xxxxxxx xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx, xxxxxxx xx xxx potřeby xxxxxxxx x Xxxxx xxxxxxxxx xxxxxxxx.
Xxxxxxxx xxx stanovení xxxxxxxxxx xxx xxxxxx x pojmech „aktuální xxxxxx“ x „xxxxxxxx xxxxxxx xxxxxxxxxx potřeb xxxxxxxx“ xxxxxxx v xxxxxxxxxx §77x xxxx. 2. Xxxxxxxx v xxxxxxx xxxxxx znamená x xxxxxxxx xxxx, xxxxxxx x xxxxxxx xx xxxxxxxxx účelu x legitimity x xxxxxxxx xxxxxxxxxx xxxxx xx xxxxxx, xx xxx xx x xxxxxxx xxxxxx xxxxxxx x xxxx, xx xxxxxxx xx xxxxxx xxxxxxxxxxxxx xxxxxxxxxxx. Zhoršení xxxxxxx xxxxxxxxxx xxxxxx xxxxxxxx xxxxxx jednoznačně xxxxxxx, xx dostupnost xxxx xxxxxxxxx. Xxx xxxxxxxxx účelu x xxxxxx xxxxxxxxxxx regulace xx přitom logické, xx xxxxxxx xxxxxxxxx xxxx muset xxx xxxxxxx xx xxxxxx, xxx ještě xxxx xxxxxx léčivé xxxxxxxxx xx xxxx xxx, xxx xx tyto xxxxx xxxxxx x xxxxxxxxx XX.
Xxxxxx přípravky xxxxx xx seznamu, xxxxx xx xxxx xxxxxxxx aktualizovat. Xxxxx xxxxxxx důvody xxx xxxx xxxxxxxx xx xxxxxx, xxxx seznam xxxxxxxxxxxx a xxxx xxxxxxxxx z něj xxxx xxxxxxx. Xxx xxxxxxxx xxxxx bude xxxxxx přípravek xxxxxxxx xxxxxxxx, xxxx xxx xx xxxxxxx xxxxxxxxxx, x to xxxxx, xx xxxxxxx xxxxxxxx x ČR je xxxxxx dlouhodobá či xxxxx xxxxxx, a xxxxx xx nutné xxxx xxxxxxxxxx xxxxx xxxxxxxx zajistit. Při xxxxxxxxxxx xxxxxxx xxxx xxxx xxxxx prokázat, xx podmínky xxx xx, aby xxxxxx xxxxxxxxx xxxx xx xxxxxxx xxxxxx, xxxx xxxxx xxxxxxxx. Xxxxxxxxx xx xxxx, že xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxx xxxx xxxxxxxxxxx xxxxxxxx xx, že bude xxxxxx xx xxxxxxx xxxxx.
Xxxxxxxxxx xxxx xxxxx xxxxxx xxxxxxxxxxxxx xxx xxxxxxx xxxxxx xxxxxxxxx, xx nezbytné xxx xxxxxxxx xxxx xx xxx xx vztahu xx xxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxx xxxxxxx.
X §77d:
Státní xxxxx xxx xxxxxxxx xxxxx xx základě xxxxxx x xxxxxxxx shromažďuje xx držitelů xxxxxxxxxx x xxxxxxxxxx, distributorů x lékáren xxxxx x xxxxxxxxx, xxxx. xxxxxxxx vydaných léčivých xxxxxxxxx, x xxxxx xxx získat xxxxxxxxx x dostupnosti xxxxxxxx xxxxxxxxx xx trhu x Xxxxx republice. Xxxx xxxxx, xxxxx xx jedná x xxxxxx xxxxxxxxx xx xxxxxxx, pravidelně xxxxxxxxxxx xxx, xxx xxxx x xxxxxxx xxxxxxxx xxxxxxxxxxxx x xxxxxx xxxxxxxxxxxx léčivé xxxxxxxxx xx xxxxxxxxx xxxxx xxxxx tohoto xxxxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx odůvodněný xxxxxx x vydání xxxxxxxx podle xxxxxxxxxx §77x. Xxxxxx xxxx x návaznosti xx xxxxxxxx pro vydání xxxxxxxx xxxxxx povahy Xxxxxxxxxxxxx zdravotnictví xxx §77x xxxxxxxxx řádné xxxxxxxxxxx shromážděných údajů x odůvodnění xxxxxxxxx xxxxx.
Xxxxxxxxxxxx xxxxxxxxxxxxx xx xxxxxxx §11 xxxx. x) xxxx xxxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxx, xx x) xx xxxxx x xxxxxx přípravek xxxxxxxx xx xxxxxx xxxxxx xxxxx §77x, xxxxxxxxxx by xxxxx x tomu, xx xxxxxxxx xxxxxx předmětného xxxxxxxx xxxxxxxxx xxx xxxxxxxxx xxxxxxx xxxxxxxx x České xxxxxxxxx, xxx xx xxxxxx xxxxxxx x xxxxx xxxxxxxxxxxxx zejména xx xxxxxxxx xxxxxxxxxx o xxxxxxxxxx, xxxxxxxxxxxx x xxxxxxx v xxxxxxx x xxxxx zákonem x jejich xxxxxxxxxxx, x x) xxxxxxx xxxxx xx ochraně xxxxxx xxxxxxxxxxxx x xx xxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx pacientů v Xxxxx xxxxxxxxx xxxxxxxxx xxx xxxxxxxxxxxxx zájmem xx uskutečnění xxxxxx xxxxxxxxxx do zahraničí. Xxxx xxxxxxxx xxxx xxx xxxxxxx xxxxxxxxxxx, xx. xxxxxxx zároveň.
Základní xxxxxxxxx xxx xxxxxx xxxxxxxx xxxxxx povahy xxx tohoto xxxxxxxxxx xx uvedení xxxxxxxx xxxxxxxxx xx xxxxxxx xxx §77c xxxxxx x xxxxxxxx.
Xxxxx xx xxxxx o vymezení xxxxxxxxxxxxx, tato xx xxxxxxxxx xx nejobjektivněji. Xxxxxxxx xx xx xxxxxxx tak, xx xxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxxxx dostatečně xxxxxxxx xxxxxxx pacientů x Xxxxx xxxxxxxxx. Aktuální xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx xx xxxxx xxxxxxxxxxxxx xxxxxxx, xxx je důvodem xxx xx, xxx xxxx xxxxxxx byly x xxxxxx xxxxxxxxxx xxxxxxx řádně xxxxxxxxxx. X xxxxxxx léčivého xxxxxxxxx xxxx xxx xxxxxxxxx s xxxxxxx xx frekvenci xxxxxxx xx xxxxxxx, xxxxxxxxx xxxxxxx xxxxxxxx a xxxx xxxxx x xxxxxxxxxxxx, xxxxxxxx xxxxxxxx xxxxxxxxx dodaného xxxxxxxxxxxx xx lékáren x xxxxx xxxxxx xxxxxxxx xxxxxxx xxxxxxxxxxx x xxxxxx, včetně množství xxxxxxxx xxxxxxxxx distribuovaného xxxx xxxxx České xxxxxxxxx x xxxxxxxxxx xxxxxx.
Xxxxx písm. x) xxxx být xxxxxxx xxx xxxxxxxx xxxxxxxxx xxxxx na xxxxxxx xxxxxx obyvatelstva x xx zajištění dostupnosti xxxxxxxx xxxxxxxxx pro xxxxxxxx xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx. X xxxxxxxxxx xxxxxxx xxxx být xxxxx xxxxxxxxxx, xx xxxxx xxxxxxxxxx veřejný xxxxx xxxxxxxxx xxx individuálním xxxxxx na xxxxxxxxxxx xxxxxxxxxx xx xxxxxxxxx.
Xx xx xxxx formy xxxxxxxx xxxxxx xxxxxx, xxxxxx xxxxxx xxxxxxxx xxxxxx xxxxxx je xxxxxxxx x ustanoveních §171 x xxxx. xxxxxx x. 500/2004 Xx., xxxxxxx xxx (xxxx xxx „xxxxxxx xxx“). Xxxxx xxxxxxxx x xxxxxxx opatření xx navrhuje xxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx. Podle xxxxxx xxxxxx obsažené x xxxxxxxxxx §25 xxxxxxxxx řádu xxxxx, xx xxxxxxxxx dnem xx xxxxxxxx xx xxxxxxxxx považuje xx xxxxxxxxx. Tato xxxxx xxx účinky xxxxxxxx xx xxxxxxxx xxxxxxx xxxxxxxxx x xxxxx 5 dnů xxx, xxx xxxxx být xxxxxxxxxx podávány x xxx doručenému xxxxxx.
Xxxxx xxxxxx úprava, xx xxxxxxx xxxxx xxxxx xxxxxxx xxxxx, xxx x xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx. Xxxxxxxxx xx xxxxxx xxxx xxxxxxx xxxxx 5 xxx xxx xxxxxxxxx xxxxxxxxxx x xxxxxx xxxxxxxx xxxxxx xxxxxx xxx xxx xxxx xxxxxxxxxx tak, aby xxxxxxxxxxx v xxxxxxx xxxxxxxxxx xxxxx xxxxx xx sobotu xxxx xxxxxx x jejímu xxxxxxxx na xxxxxxxxxxx xxxxxxxx den.
Návrh opatření xx xxxxxxx xxxxxxxxxxxx x xxx k xxxx uplatnit pouze xxxxxxx xxxxxxxxxx. Xxxx xxxxx obecná xxxxxx, xx kdokoli, jehož xxxxx, povinnosti xxxx xxxxx xxxxx xxx xxxxxxxxx obecné xxxxxx xxxxx xxxxxxx, xxxx x xxxxxx xxxxxxxx x správního xxxxxx (x Ministerstva xxxxxxxxxxxxx) xxx xxxxxxx xxxxxxxxxx. Xxxxxxxxxxxx xxxx xxxx xxxxxxx xx xxxxxxxxxxxx xxxxxxx xxxx podkladem xxx xxxxxxxx xxxxxx xxxxxx x xxxxxxxxx xx s xxxx x xxxx odůvodnění. Xxxxxxxxxx §175 odst. 2 správního xxxx xxxxxxxxxx možnost určení xxxxxxxxx osob, xxxxx xx xxxxx podávat xxxxxxxxxx námitky, xx xxxxxxxxx. Xxxxxxxx nabývá xxxxxxxxx dnem x xxx xxxxxxxxxx.
Xx xx xxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxx, xxxxx xxxxxx úprava dle xxxxxxxxxx §173 odst. 2 správního xxxx, xxxxx xxxxxxx x xxx, xx xxxxx xxxx xxxx xxxxx xxxxx xxxxxxx prostředek. Xxx xxxxxxxxxx §174 xxxx. 2 xxxxxxxxx xxxx xxxxxx xxxxxxxx xxxxxx xxxxxx x xxxxxxxx předpisy xxx xxxxxxxx x xxxxxxxxxx xxxxxx. Xxxxx xxxxxxxx xxxxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxxxx xxxxxx xxxxx xx xxxxxxxx xxxxxxxxxx, x xx x xxxxxx x xxxxxxx opatření xxxxxx xxxxxx dle xxxxxxxxxx §101a a xxxx. zákona x. 150/2002 Xx., soudního xxxx správního. Xxxxx xx xxxxxxx opatření xxxxxx xxxxxx xxx xxxxx do 3 xxx od xxxxxx xxxx xxxxxxxxx x xxxx jej xxxxx xxxxx, xxx tvrdí, xx xxx byl xxxxxxx xx xxxxx xxxxxxx.
Xxxxx xx xxxxx x xxxxxxx xxxxxxxx xxxxxxxx, xxx jej xxxxxxx xxxxxxx způsobem, xxxxx xxxx opatření xxxxxxxxxx. Xx tímto xxxxxx x z xxxxxx xxxxxxxxx transparentnosti xxxxxx procesu xx xxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxx xxxxxx.
Xx xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxx v případě, xx xx Xxxxxxxxxxxx xxxxxxxxxxxxx x xxxxx xxx xxxxxxxx dozví x xxxxxx nedostatku xxxxxxxx xxxxxxxxx, požádá Xxxxxx ústav xxx xxxxxxxx léčiv x xxxxxxxxxx údajů x xxxxxxx xxxxx §77c.
K §80 xxxx. 1:
Xxxxxxxx xx xxxxxx xxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxx x xxxxxxxxxxxxxx xxxxxxx.
X §82 xxxx. 3 xxxx. x):
Xxxxx xxxxxxxxx xxxxxx úpravy xx xxxxxx a xxxxxx xxxxxxxxxxx xxxxx x xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxx Xxxxxxxx ústavu xxx xxxxxxxx xxxxx. X xxxxxxxx xxxxxxxxx právní xxxxxxx x účinnější xxxxxxxxxxxxxx nápravy xxx xxxxxxxx xxxx xxxxxxx xxxxxxxxxx xx vhodnější, xxx xxx xxxxxx xxxxx, časový xxxxxxxx x xxxxxx jejich xxxxxxxxxxx xxxxxx hlášení xxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxx.
Xxxxxxxxxxxx xxxxxxx xx xxxxx x xxxxxxx xx xxxxxx xxxxxx x xxxxxxx získaných xxx, umožňuje xx xxxxxx efektivní xxxxxxxxxx x tím xxxx xxxxxxx xxxxxxxxx x xxxx reagovat xx xxxxx xxxxxxxxxx daného xxxxxxxx přípravku xx xxxx. Pokud xx xxxx xx Xxxxx xxxxxxxxxx x xxxx, xxxx. x xxxxxxx xxxxxxxx, musel xx xx Xxxxx xxxxxx xxxxxxxxx do jednotné xxxxxx, xxx xx xxx xxxx možné xxxxxxxxx, xxxxxxxxxx a xxxxxx závěr. X xxxxxxx na xxxxxxx xxxx, xxxxxx má Xxxxx na xxxxxxxxxx xxxxxxx x xxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx předání podnětu x xxxxxx opatření xxxxxx povahy xx XX, xx jiná xxxxx, xxx xxxxxxxxxxxx xxxxxx xxxxxxxxxx. Xxxxxx xx nutné xxxx x potaz, xx xxxxxxx xxxx povinně xxxxxxxx xxxxxxxx x xxxxxxxxxx x xxxxxxxxx, xxxxxxxxxxxx xxxxxx používají xxxxxxxx, XX x xxxxxxxxxxxxx xxxxx xxx, xxxxx jim xxxx xxxxxx xxx jejich xxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxx a xxxxxxxxxx xxxxxxx x xxxxxxxxxxx xxx xxxxxx x xxxxx xxxxxx xxxxxxxxxx xxx uložených xxxxxx xxxxxxxxxxxx xxxxxx x xxxxxxxx.
K bodům 37 x 38
X §82 xxxx. 4:
Ustanovení xxxxxxx xx xxxxxxxxx xxxxx.
X §101 xxxx. 1:
Xxxxxx xxxxx xxx xxxxxxxx léčiv je xxxxxxxx xxxx xxxxxxxxx xxxxx celou xxxxx xxxxxxxx xxxxxxxx, které xxxxxxx xxx xxxxx xxxxxxx. Xxxxxxxx Xxxxxx xxxxx pro xxxxxxxx xxxxx vykonává xxxxx xxxxxx právních xxxxxxxx:
xxxxx č. 378/2007 Sb., x xxxxxxxx - xxxxxx XX,
xxxxx č. 296/2008 Sb., o xxxxxxxx xxxxxxx x xxxxxxx - xxxxxx MZ,
zákon č. 167/1998 Sb., x xxxxxxxxxx xxxxxxx&xxxx; - xxxxxx XX,
xxxxx č. 123/2000 Sb., x xxxxxxxxxxxxxx prostředcích - xxxxxx XX (od 1. xxxxx 2015 xxxxx č. 268/2014 Sb.),
xxxxx č. 372/2011 Sb., x zdravotních službách - xxxxxx XX,
xxxxx č. 40/1995 Sb., x xxxxxxxx xxxxxxx - xxxxxx XXX,
xxxxx č. 102/2001 Sb., o xxxxxx bezpečnosti xxxxxxx - rezort MPO,
zákon č. 634/1992 Sb., x xxxxxxx xxxxxxxxxxxx - xxxxxx XXX,
xxxxx č. 265/1991 Sb., x xxxxxxxxxx xxxxxx Xxxxx xxxxxxxxx v oblasti xxx a xxxxx č. 526/1990 Sb., x xxxxxx - rezort XX,
xxxxx č. 477/2001 Sb., x xxxxxxx - rezort XXX,
xxxxx č. 78/2004 Sb., x nakládání x xxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxx - xxxxxx XXX,
xxxxx č. 272/2013 Sb., x xxxxxxxxxxxx xxxx - xxxxxx XX.
Xxxxx x xxxxxxxxx x xxxxxx xxxxxx xx xxxxxxxx, xx se xxxxxxxxxx xxxxxxxxx při xxxxxx xxxxxxxx xxxxxxxx. U xxxxxxx podle xxxxxxxx xxxxxxxx, x xxxxx xxxxxxxxxx x xxxxxxx xxxxxxxxxx xxxxx, xx xxxx xx 1.1.2014 xxxxxxxxxx xxxxxxxxxx písemným xxxxxxxxx xxxxxxxxxx xx xxx. Při xxxxxxxxx xxxxxxxxxx xx inspektoři xxxxxxxx xx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx různých xxxxxx xxxx. na xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx x xxxxxxxx a xxxxxxx x xxxxxxxx xxxxxxx. X xxxxxxx xxxxxxx se musí xxxxxxxxxx prokazovat xxx xxxxxxxxxx xxxxxxxx (podle xxxxxx x léčivech), xxx i xxxxxxxxx (xxxxx zákona x xxxxxxxx xxxxxxx).
X xxxxxxx xx sjednocení xxxxxxxxxxx xxxxxxxxxx Xxxxxxxx ústavu xxx xxxxxxxx xxxxx x x xxxxxxxxx xxxxxx xxxxxxx xxxxxxxxxxxxxx xxxx se xxxxxxxx xxxxx xxxxxxxxxx xxx, xxx pověření xx xxxxxxxx xxxx výhradně xxxxx xxxxxxx xxxxxxxxxx x xxx xx xxxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx xxx všech kontrolách xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxx prokazovali xxxxxxxx xxxxxx xxxxx xxxxxxxx, x tím xx xxxxxx inspektora, x xx zcela v xxxxxxx x xxxxxxxxxx xxxxx. Xxxxxxx x §22 xxxx. 1 xxxxxx x léčivech xx zavedena xxxxxxxxxxxx xxxxxxx „xxxxxxxxxx“ xxx xxxxxxxxxxx Xxxxxxxx ústavu xxx kontrolu xxxxx x Xxxxxx xxx xxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxx a xxxxx, xxxxx vykonávají xxxxxxxxx xxxxxxx, navrhovaná úprava xx xx měla xxxxxxxxx x na xxxxxxxxxx Xxxxxx xxx xxxxxx xxxxxxxx veterinárních xxxxxxxxxxxx a xxxxx.
K §101 xxxx. 5 písm. x):
Xxxxxxxx právní instituty xxxxxxxxx a xxxxxxx xxxxxxxx přípravků xxxx x současném znění xxxxxx o xxxxxxxx xxxxxxxx xxxxxxxxxxx, xxxxxxx x v xxxxxxx xxxx pouze xxx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx, x xxxxxxxx xxxxx x xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx. X praxi xx xxxxxx xxxxx xxxxxxx xxxxxxxxx xxxxxxx, xxx Státní ústav xxx kontrolu xxxxx xxxxxx, xx x xxxxxxxx xxxxxxxxx zacházejí xxxxx, xxxxx x xxxx nejsou xxxxx xxxxxx xxxxxxxxx. Typicky xx jedná x xxxxxxx, xxx xxxx xxxxxx xxxxxxxxx vydávány xx xxxxxxxxx. Xxxxxx xxxxxxxxx xxxx xxxxxx xxxxxx spotřebním xxxxxx x x xxxxxx xxxxxxx xxxxxxxxx xxxxxx xx xxxxxxxx, xxx x xxxx xxxx xxxxxxxxx jen takovým xxxxxxxx, xxxxx xxxxx xxxxxxxx, x aby xxxxxx zacházení xxxxxxxxxxxxx xxxxx xx xxxxx, xxxxx xxxx x xxxx xxxxxxxxx. X xxxxxx důvodu je x návrhu xxxxxx xxxxxx xxxxxxxxxx postup Xxxxxx xxx xxxxxxxxxxx, xxxxxxxxxx x xxxxxxxxxxxx xxxxxxxx xxxxxxxxx u xxxxxxxx xxxxxxxxxxx zacházejících x léčivy. Dále xx xxxxxxxxx xxxxxx xxxxxx xxxxxxxxx o xxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx.
X§103 xxxx. 6 xxxx. x):
Xxxxxxxxx x xxxxxxxx stávajícího xxxxx ustanovení xxx, xxx xxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxx, které xxxxxxxxx s léčivými xxxxxxxxx.
X §105 xxxx. 2:
Xxxxxxxx xx xxxxxxx r), x) x x), xxxxx xxxxxxxx xxxxxxx xxxxxxx xxxxxxxxxxxx xxx xxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx distributorem xxx xxxxxxxxxx §77 xxxx. 1 xxxx. x) (xxxxxxx xxxx xx xxx xxxxxxxxx x xxxxxxxx xxxxxxxxxx x xxxxxxxxxx), neoznámení xxxxxxxxx xxxxxxxxxx xxx xxxx zaváděného ustanovení §77 odst. 1 xxxx. q) x xxxxxxxx xxxxxxxx xxxxxx xxxxxx xxxxxxxx xxx xxxxxxxxxx §77x.
X §105 xxxx. 5:
V zájmu xxxxxxxxx xxxxxxxxxx nastaveného xxxxxxx xxxxxxxxx x xxxxxxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxx xxx xxxxxxx xxxxxxxx v Xxxxx xxxxxxxxx xx zavádí xxxxxxx xxxxxx držitele xxxxxxxxxx o xxxxxxxxxx xxxxxxxxxxx x xxxxxxxxxxxx xxxxx x xxxxxx xxxxxxx léčivého přípravku xxxxxxxxx xx trh x Xxxxx xxxxxxxxx xxxxx §33 odst. 2.
K bodům 46 xx 65
X §105 xxxx. 6 x 7, §106 xxxx. 3, §107 xxxx. 1 a 2, §108 xxxx. 5, 8 x 11:
X čl. 94 xxxxxxxx se xxxxxx xxxxxxxx xxxxxx stanovit xxxxxx za xxxxxxxx xxxxxx nařízení x xxxxxxxx xxxxxxx opatření xxxxxxxx x jejich xxxxxxxxxxx, xxxxxxx xxxxxxxxx xxxxxx xxxx být xxxxxx, přiměřené x xxxxxxxxxx. Xxxx xx xxxxx xxxxxxxx xxxxx x xxxxxxxx x xxxxxxxx xxxxxxxx xxxxxxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxx nařízením, xxx xxxxx zákonem xxxxxxx v xxxx xxxxxxx stávající xxxxxx xxxxxx xxxxxxxxxx hodnocení xxxxxxxxx x xxxxxx x xxxxxxxx.
X §107 xxxx. 1:
Xxx xxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxx xxxxxxxxxx §77 xxxx. 1 písm. x) xx stanoví (obdobně, xxxx je xxx xxxxxxxxx v xxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx o xxxxxxxxxx) xxxxxx xx 20 xxx. Kč, xxx xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxx xxxx xxxxxxxxxx ustanovení §77 xxxx. 1 xxxx. x) se xxxxxxx xxxxxx xx 5 xxx. Kč x xxx xxxxxx porušení xxxxxxxx obecné xxxxxx xxxxxxxx xxx xxxxxxxxxx §77x xx stanoví xxxxxx xx 20 xxx. Xx.
Xxxxx xxx x výši xxxxxx, xx třeba připomenout, xx xxxxxxxx xxxxxxx xxxxxx o xxxxxxxx č. 70/2013 Sb., xxxx xxxxxxxxxxx x xxxx, xx xxxxx hranice xxxxx x tomto zákoně xxxx x průměru xxxxxxx, k xxxxx xxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxx k xxxxxx zákonu: „ …xx xxxxxx xxxx xxxxxxxx xxxxxx x xxxxx xxxxxxx xxxxx xx xxxxxxxx xxxxxxxxx xxxxxxx x xxxxxxxxx xxxxxxxxx upravených xxxxxxx x xxxxxxxx. K xxxxxxxxx xxxxxxxxxx xxxxxxxx x xxxxxxxxx praxe, xxxxx vypovídá x xxx, že dosavadní xxxx xxxxxx xx xxxxxxxxxxx xxxxxxx xx x xxxxx případech xxx míjí xxxxxxx. X praxi xx xxxxxxx, xx xxx xxxxxxx xxxxxxxxxxxxx firmy xxxxxxxxxxxxx xxxxxx xxxxxxx x xxxxxxxxx výše xxxxx xxxxxx výraznou xxxxxxxx újmu, xxx xx xxxx důsledku xxxxxxxxx xxxxxxxxxxx x xxxxxxxxxx xxxx xxxx xxxxxxx sankce. Dosavadní xxxxxxx xxxxx x xxxx oblasti rovněž xxxxxxxxxx za xxxxxxxxxx xxxxxx x xxxxxxxx xxxxxxxx v xxxxxxxxx xxxxxxxxx státech Xxxxxxxx xxxx. Xxxxxxxxx sankcí xx možné posílit xxxxxxxxx xxxxxx xxxxxxxxxx xxxxx xx kontrolované xxxxxxxx, xxx xx xxxx důsledku xxxx xxxx ke snížení xxxxxxxx porušování xxxxxxxxxxx xxxxxx v xxxx xxxxxxx. X po xxxxxxxxxxx xxxxxxx horní xxxxxxx xxxxx tyto xxxxx xxxxxxxxxx xxxx, xxxxx xx xxxxxxxxx x xxxxxx právních xxxxxxxxxx, xxxx například x xxxxxx č. 634/1992 Sb., x ochraně xxxxxxxxxxxx, xx znění xxxxxxxxxx xxxxxxxx, x xxxx xx za některé xxxxxxx xxxxxxx xxxxxxxxx xxxxx xxxxxxx xxxxx xx ve výši 50 000 000 Xx.“.
Xxxx xxxxxxxxxxxx xxxxxxx xxxxxx xx xxxxx xxxxx trend xxxxxxxxx Xxxxxxxxxxx Xxxxx xxxxxxxxx xxxxxxxxxxx, a x xxxxxx xxxxxxxx a xxxxxxxx. Tomu xxxxxxxxxx x navrhované horní xxxxxxx xxxxx za xxxxxxxx xxxx stanovených xxxxxxxxx deliktů.
Správní xxxxxxx xxxxxxxxxxx x nezajištění xxxxxxx xxxxxxxx xxxxxxxxx xxxxx §77 xxxx. 1 písm. x), xxxxxxxxxx distribuce xxxxxxxx xxxxxxxxx mimo xxxxx Xxxxx xxxxxxxxx xxxxx §77 odst. 1 xxxx. q) xxxx x xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx území Xxxxx xxxxxxxxx v xxxxxxx s xxxxxxxxx xxxxxx xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxx §77x by natolik xxxxxxxx xxxx xxxxxx x xxxxxx xxxxxxxx xxxxxxxxxxx novelou xxxxxx xxxxxxxx potřebou náležité xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx, že xx na xxxxx xxxxxxxxx možnosti, aby xxxxx xx xxxxxx xxxxxxx xxxxxxx bylo xxxxx xxxxxx xxxxxx x nejvyšší xxxxx xxxx podle xxxxxx x xxxxxxxx, xxxxxx xx již xxxxx xxxxxxxxx xxxxxx úpravy xxxxxx 20 000 000 Xx.
Xxxxx xxx x xxxx stanovený xxxxxxx delikt xxxxxxxxxxx x xxx, xx xxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxxxx xxxxx x objemu dodávek xxxxxxxx xxxxxxxxx xxxxxxxxx xx trh x Xxxxx xxxxxxxxx xxxxx §33 odst. 2, xxx xxxx xxxxxxxxx x obdobný správní xxxxxx, jakého xx xxxxx xxxxxxxxx právní xxxxxx xxxx xxxxxxxx xxxxxxxxxxx xxxxx §77 xxxx. 1 xxxx. x) xxxx xxxxxxxxxxxx xxxxxxxxx k výdeji xxxxxxxx přípravků podle §82 xxxx. 3 xxxx. x). Je xxxxx xxxxx xxxxxxxxxx, xxx xxxx horní xxxxx xxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxxxx xxxx xxxxx xxxxx obdobných xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxx xxxxxxx.
Xxxxx xxx x xxxxxxx delikty x xxxxxxx xxxxxxxxxx xxxxxxxxx humánních léčivých xxxxxxxxx, je třeba x prvé xxxx xxxxxxxxx, že xxxx xxxxxx xxxx, ale xxxxx toho, xx xxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxx x xxxxxx x xxxxxxxx, xxxx xx xxxx xxxxxxxxxx protiprávní xxxxxxx xxxxxxxxx xxx x xxxxxxxx č. 536/2014, tj. x xxxxx použitelném xxxxxxxx Evropské xxxx. Xxx xxxxxxxxx horní xxxxxxx xxxxxxx xxxxx xx xxxxxx xxxxxxxxxxx xxxxxxx xx xxxxx xxxxxxxxx dosavadní xxxxxx xxxx.
X §107 xxxx. 2:
Xxx xxxxxx porušení xxxxxxxx obecné povahy xxxxxxxx xxx xxxxxxxxxx §11 xxxx. x) xx xxxxxxx xxx xxxxxxx udělení xxxxxx xxxxxxxxxxx x xxxxxx xxxxxxxx.
X §108a a §108x:
X důvodu xxxxxx xxxxxxx xx v xxxxxx xxxxxxxx xxxxxxxx xxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx a xxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx se xxxxxxx xxxxxxx, xx xxxxxxxxxx xxxxxxxx léčivého xxxxxxxxx se stává xxxx.
X §112 xxxx. 6:
Xxxx xxxxxxxx odstavec 6 xxxxxxxxx xxxxxxxx xxxxx xxxxxxxxxx x xxxxxxx xxxxxxxxxx ze xxxxxxxxxx xxxx Xxxxxxxx xxxxxx pro kontrolu xxxxx na xxxxxxxx xxxx xxxxxxxx xxxxxxxx Xxxxx republiky pro Xxxxxxxxxxxx xxxxxxxxxxxxx.
K bodům 68 xx 72
X §114 odst. 1, 2 x 4:
Xxx xx xxxxx xxxxx x xxxxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx x xxxxxx prováděcího právního xxxxxxxx tam, xxx xx xxxxx xxxxxxxx xxxxxxxxxxx. Xxxxxx se xxxxxxxxxx xx xxxxxxxxxx, xx xxx x xxxxxxxxxx §114 xxxx. 1 xxxxxx x xxxxxxxxxxx xxxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx x xxxxxx xxxxxxxx x x xxxxxxxxxx §114 xxxx. 2 xxxxxx x xxxxxxxxx xxxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx x Xxxxxxxxxxxx xxxxxxxxxxx k vydání xxxxxxxx.&xxxx; Xx xxxxxx xxx xxxxx k xxxxxxxxx společné xxxxxxxx x správné klinické xxxxx tak, xx xxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxx xxxxxxxx přesune xx gesce Xxxxxxxxxxxx xxxxxxxxxxx.
X §114 xxxx. 2:
X tomto xxxx xxx xxx x xxxxxxxxxxxx xxxxxxxxx xxxxx x úpravě xxxxxxxxxxxx xxxxxxxxxx, xxxx dosavadní xxxxxxxxxx xxxxxxxxxx xxx xxxxxx xxxxxxxxxx hodnocení xxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxx zmocňovacími xxxxxxxxxxxx novými.
Přechodná xxxxxxxxxx xxxx xxxxxxxx tak, xxx respektovala ustanovení článku 98 xxxxxxxx x. 536/2014.
X xxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xx xxxxxxxx stanoví, že xxxxx x xxxxxx xxxxxx xx xxxxxx xxxxxxxxx xx xxxxx xxxxxx xxxxxx.
Xxxxx xx x xxxxxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxx x souladu xx směrnicí Xxxxxxxxxx xxxxxxxxxx a Rady (XX) 2015/1535 ze xxx 9. xxxx 2015 x postupu xxx poskytování informací x xxxxxxx xxxxxxxxxxx xxxxxxxx a xxxxxxxx xxx xxxxxx xxxxxxxxxx xxxxxxxxxxx, v xxxxxxx xxxxx.
K čl. V (Xxxxxxxx):
Xxxxxx xxxxxxxxx xxxxxx xx nastavuje xxxxxxxx xx xxxxxx xx xxxxxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxxx.
Xx xxxx, xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxx režimu xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx léčivých přípravků xx xxxx nabýt xxxxxxxxx uplynutím 6 xxxxxx od dne xxxxxxxxxx oznámení Komise x Xxxxxxx xxxxxxxx Xxxxxxxx xxxx podle čl. 82 xxxx. 3 xxxxxxxx č. 536/2014, xxxxxxx den, kdy xxxx xxxx oznámení xxxxxxxxxx, oznámí Ministerstvo xxxxxxxxxxxxx xxxxxx xxxxxxx xx Xxxxxx xxxxxx.
Xx xxxxx, xxxxxxxxxx xxxxxxxx xx xxxxxxxxx xxxxx xxxxxx xxxxxx, Xxxxxxx, xxxxxxxxx xxxx xxxxxx xxxxxx x xxxxxxxxxx xxxxxxx etické komise, xx měla xxxxx xxxxxxxxx xxx prvním xxxx xxxxxxxxxxxx xxxxxx xx xxx xxxxxxxxxx xxxxxxxx Komise v Xxxxxxx xxxxxxxx Evropské xxxx xxxxx čl. 82 xxxx. 3 xxxxxxxx x. 536/2014, xxxxx xxxxxx xxxxxx xxxx xxx xxxxxxx účinnosti xxxxxxxx schopna xxxxx xxxxxxxx x xxxx xxxxx, aby x xxxxxxx a xxxxxxxxxx xxxxxx xxxxxx xxxx xxxxxxxx xx x xxx xxxxxx xxxxxxxxx xxxxxxxx č. 536/2014.
Xx xxxxx, xxxxxxxxxx xxxxxxx omezení xxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxx nabýt xxxxxxxxx xxxxxx dnem xxxxxxxx xxxxxxxxxxxx měsíce xxxxxxxxxxxxx xx dni xxxxxxxxx xxxxxx, neboť xxxxxxxxxx systému xxxxxxxxx x vyhodnocování xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx aktuální xxxxxxx xxxxxxxx x České xxxxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxx přípravků xx xxxxxxxxx v xxxx xxxxxxxxx, xxx xxxxxxxxxxx xxxxxx xxxxxx xxxxxxx takových xxxxxxxx xxxxxxxxxx, xx xxxxxxxx xxxxxx čas xxxxxxxx, x xx zejména xx xxxxxx xxxxxxxx xxxxxxxxxx x registraci xxxxxxxx xxxxxxxxx, distributorů x xxxxxxxxxxx xxxxxxxxx xxxxx.
Xx xxxxxx, xxxxxxx xxxxxxxxxx xxxxxxxx v xxxxxx xxxxxx xx xxxx xxxxx xxxxxxxxx xx xxxxxxxx, x xxxx xx xx xxxxx, aby xxxxxx xxxxxxxxx prvním dnem xxxxxxxxxxxx xxxxxx xxxxxxxxxxxxx xx xxx xxxxxxxxx xxxxxx.
X Xxxxx dne 13. xxxxx 2016
xxxxxxxx xxxxx
Xxx. Xxxxxxxx Xxxxxxx x. x.
xxxxxxx xxxxxxxxxxxxx
XXXx. Xxxxxxxxx Xxxxxxx, XXX, x. r.
ROZDÍLOVÁ XXXXXXX NÁVRHU XXXXXXXX XXXXXXXX X XXXXXXXX XX
Xxxxxxxxx xxxxxxx x xxxxxx novely xxxxxx č. 378/2007 Xx., o xxxxxxxx x x xxxxxxx xxxxxxxxx xxxxxxxxxxxxx zákonů (xxxxx o léčivech)
|
Navrhovaný xxxxxx xxxxxxx (resp. xxxx xxxxxx xxxxxxx) |
Xxxxxxxxxxxx xxxxxxx XX |
|
|
Xxxxxxxxxx (část, §, xxxx., xxxx. xxxx.) |
Xxxxx x. |
Xxxxxxxxxx (xx., xxxx., xxxx., xxx., xxxx.) |
|
Xx. 2 odst. 1 |
||
|
Xx. 83 |
||
|
Čl. 4 |
||
|
Xx. 8 xxxx. 1 |
||
|
Čl. 1 xxx 22 |
||
| §51 | ||
|
Kapitola XX, xx. 4 |
||
|
Xxxxxxxx XX, xx. 9 |
||
|
Xxxxxxxx XX čl. 83 |
||
|
Kapitola XX, čl. 2, xxxx. 2, xxx 12 |
||
|
Xxxxxxxx II, čl. 5 |
||
|
Xxxxxxxx XX, xx. 2, odst. 2, xxx 12 |
||
|
Xxxxxxxx XX, xx. 6, xxxx. 5 x 7 |
||
|
Xxxxxxxx XX, xx. 7 |
||
|
Xxxxxxxx XX, xx. 8 |
||
|
Kapitola X, čl. 34 |
||
|
Kapitola X, xx. 2, xxx 11 |
||
|
Xxxxxxxx II, xx. 4 |
||
|
Kapitola XX, xx. 9 |
||
|
Kapitola II, xx. 8 xxxx. 4 |
||
|
XXX E6 |
||
|
Kapitola XX, xx. 9 |
||
|
ICH X6 |
||
|
Xxxxxxxx XX, xx. 4 |
||
|
Kapitola XX, čl. 8 xxxx. 4 |
||
|
Xxxxxxxx II, xx. 6 |
||
|
Xxxxxxxx XX, xx. 4 |
||
|
Xxxxxxxx XX, xx. 7 |
||
|
Xxxxxxxx XX, xx. 28, xxxx. x) |
||
|
Xxxxxxxx II, čl. 7, xxxx. 1 xxxx. x) |
||
|
Xxxxxxxx XXX, xx. 20 |
||
|
Kapitola XX, xx. 4 |
||
|
Xxxxxxxx X, xx. 4 |
||
|
Kapitola I, xx. 2, xxx 15 x 16 |
||
|
Xxxxxxxx XXXX, xx. 49 |
||
|
Xxxxxxxx XX, xx. 73 |
||
|
Xxxxxxxx XXXX, xx. 50 |
||
|
Xxxxxxxx XX, čl. 26 |
||
|
Xxxxxxxx XXXX, xx. 59 xxxx. 3 |
||
| 32014R0536 |
Xxxxxxxx XXXXX, xx. 92 |
|
|
Kapitola XX, xx. 61, xxx 5x |
||
|
Xxxxxxxx X, čl. 68 |
||
|
Xxxxxxxx XXXXX, xx. 90 |
||
|
Xxxxxxxxx 81 |
||
|
Xxxxxxxx XXX, xx. 42 xxxx. 3 |
||
|
Xxxxxxxx XXX, xx. 76 |
||
|
Xxxxxxxx X, čl. 2, xxx 20 |
||
| §64 písm. b) |
Xx. 8 xxxx. 1 |
|
|
Xx.1 |
||
|
Xx.1 |
||
|
Xx. 94 |
||
|
Xx. 8 xxxx. 1 |
||
|
Xx. 15 |
||
|
Xx. 35 |
||
|
Xx. 36 |
||
|
Xx. 37 odst. 1 |
||
|
Xx. 37 odst. 5 |
||
|
Xx. 37 xxxx. 6 |
||
|
Xx. 38 xxxx. 1 |
||
|
Xx. 37 odst. 4 |
||
|
Xx. 41. odst. 3 |
||
|
Xx. 42 xxxx. 1 |
||
|
Xx. 47 |
||
|
Čl. 49 |
||
|
Xx. 52 |
||
|
Xx. 54 odst. 1, 2 |
||
|
Xx. 55 |
||
|
Xx. 56 |
||
|
Xx. 57 |
||
|
Xx. 58 |
||
|
Xxxxxxxx XXX, čl. 76 xxxx. 1, 2 |
||
|
Xx. 94 |
||
|
Xx. 94 |
||
|
Xx. 28 xxxx. 1 |
||
|
Čl. 41 xxxx. 1 |
||
|
Xx. 47 |
||
|
Xx. 49 |
||
|
Xx. 54 xxxx. 1 |
||
|
Xx. 58 |
||
|
Xx. 73 |
||
|
Čl.94 |
||
|
Čl. 28 odst. 1 |
||
|
Čl. 41 odst. 1 |
||
|
Xx. 47 |
||
|
Xx. 49 |
||
|
Xx. 54 xxxx. 1 |
||
|
Čl. 58 |
||
|
Xx. 73 |
||
|
Xxxxx xxxxxxxx XX (xxx Xxxxx) |
Xxxxx xxxxxxxx XX |
|
XXXXXXXX XXXXXXXXXX XXXXXXXXXX X XXXX (XX) x. 536/2014 xx xxx 16. xxxxx 2014 o xxxxxxxxxx xxxxxxxxxxx humánních xxxxxxxx xxxxxxxxx x o xxxxxxx xxxxxxxx 2001/20/XX |
|
|
XXXXXXXX XXXXXX x xxxxxxxxx xxxxxxxxx (EU) x. 1252/2014 xx xxx 28. xxxxxx 2014 xxxxxxxxxx směrnici Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX, xxxxx jde x zásady x xxxxxx xxxxxxx xxxxxxx xxxxx pro xxxxxx xxxxx xxx xxxxxxx xxxxxx xxxxxxxxx |
|
| 32004L0027 |
XXXXXXXX XXXXXXXXXX XXXXXXXXXX A RADY x. 2004/27/ES xx xxx 31. března 2004, kterou se xxxx xxxxxxxx 2001/83/XX x xxxxxx Xxxxxxxxxxxx xxxxxxxxx xx humánních xxxxxxxx xxxxxxxxx |
Xxxxx xxxxx www.psp.cz


