Vládní návrh zákona, kterým se mění zákon č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů (zákon o léčivech), ve znění pozdějších předpisů, a zákon č. 234/2014 Sb., o státní službě, ve znění pozdějších předpisů
706/0
Xxxxxx xxxxx
XXXXX
xx xxx … 2016,
xxxxxx xx xxxx xxxxx č. 378/2007 Sb., x xxxxxxxx x x xxxxxxx některých xxxxxxxxxxxxx xxxxxx (xxxxx x xxxxxxxx), ve xxxxx pozdějších xxxxxxxx, x xxxxx č. 234/2014 Sb., x xxxxxx xxxxxx, xx xxxxx pozdějších xxxxxxxx
Xxxxxxxxx xx xxxxxx xx xxxxx xxxxxx Xxxxx xxxxxxxxx:
XXXX PRVNÍ
Změna xxxxxx x léčivech
Čl. I
Zákon č. 378/2007 Sb., x xxxxxxxx a x změnách xxxxxxxxx xxxxxxxxxxxxx xxxxxx (zákon x léčivech), xx xxxxx zákona x. 124/2008 Xx., zákona x. 296/2008 Sb., xxxxxx x. 141/2009 Xx., zákona č. 281/2009 Sb., xxxxxx x. 291/2009 Sb., xxxxxx č. 75/2011 Xx., xxxxxx x. 375/2011 Xx., xxxxxx x. 50/2013 Xx., xxxxxx x. 70/2013 Xx., xxxxxx č. 250/2014 Xx. x xxxxxx x. 80/2015 Xx., se mění xxxxx:
1. Xx konec xxxxxxxx xxx xxxxx x. 2 xx xxxxxxxx věty:
„Nařízení Xxxxxxxxxx xxxxxxxxxx x Rady (XX) č. 536/2014 xx xxx 16. dubna 2014 o xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x o xxxxxxx xxxxxxxx 2001/20/XX.
Xxxxxxxx Xxxxxx x přenesené xxxxxxxxx (EU) č. 1252/2014 xx xxx 28. xxxxxx 2014 xxxxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/ES, xxxxx xxx x xxxxxx x pokyny xxxxxxx xxxxxxx praxe xxx xxxxxx xxxxx xxx xxxxxxx xxxxxx xxxxxxxxx.“.
2. V §5 xx xxxxxxxx xxxxxxxx 16, xxxxx xxxxxx xxxxxxxx xxx xxxxx x. 101 xxx:
„(16) Xxxxxxx xxxxxx látky xx pro účely xxxxxx xxxxxx, jde-li x xxxx použití x hodnocených humánních xxxxxxxx xxxxxxxxxxx nebo xx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxx, xxxxxx xxxxxxxx xxxxx xxxx xxxxxxxx xxxx xxxxxxxx xxxxxxxxx, xxxxxx, balení, přebalování, xxxxxxxxxx, přeznačování, xxxxxxxx xxxxxxx xxxx xxxxxxxxxxx xxxxxx látky, jakož x xxxxxxxxxxx xxxxxxxx. Xxxxxxxx toho, xx xx xxxxxx výrobou xxxxxx xxxxx, jde-li x xxxx xxxxxxx x xxxxxxxxx léčivých xxxxxxxxxxx, xxxxxxx xxxxx xxxxxxxxxx xxxxxxx Xxxxxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxxxx praxi xxx xxxxxx xxxxx101).
XXXXX: 32014R1252
3. X §11 xxxxxxx x) xxx:
„x) xxxxxx opatření xxxxxx xxxxxx xxxxx §77x, xxxxxx xxxxxxx xxxx xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx zahraničí,“.
4. X §11 xxxxxxx h) xxx:
„x) xxxxxxx podmínky xxx xxxxxxxxx xxxxxxxxxxx léčivých xxxxxxxxx významných xxx xxxxxxxxxxx zdravotních služeb, xxxxxxx vyžaduje-li xxxxxxxxx xxxxxx xxxxxxxxxxx vydání xxxxxxxx obecné xxxxxx x xxxx-xx xxxxxxx xxxxxxxx xxx xxxx xxxxxx, postupuje xxxxx xxxxxxx x) xxxx x), a xxxxxxx xxxxxxxx na xxxxxxx xxxxxxx, xxxxxx x xxxxxxxxxxx léčivých xxxxxxxxx xxx xxxxxx xxxxxxxxxx x xxxxxxxx xxxxxxxxx, xxxxx mohou xxx xxxx xxxxxx stanoveny, xxxxx i xxxxxxxx xxxxxxxxx xxx xxxxxxx x xxxxxxx xxxxxxxxx,“.
5. X §11 xx na xxxxx xxxxxxx p) xxxxx xxxxxxxxx čárkou a xxxxxxxx se xxxxxxx x), které xxx:
„x) xxxxxx xxxxxxxx xxxxxx xxxxxx xxxxx §77x, xxxxxx xx stanoví xxxxxx přípravek, xxx xxxxx nedostatku xxxx xxxxxxxx dostupnost x xxxxxxxx léčby pacientů x Xxxxx xxxxxxxxx x xxxxxx xxxxxxx xx xxxxxxx xxxxxx xxxxxxxxxxxx x s xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx, x xxxx seznam xxxxxxxx xxxxxxxx xxxxxxxxx.“.
6. X §13 xxxx. 2 xxxx. x) xxxx 1 xx za xxxxx „xxxxxxxxxx x povolení xxxxxxxxxx xxxxxx,“ xxxxxxxx xxxxx „xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxxx,“.
7. X §13 xxxx. 2 xxxx. x) xxxx 3 xx xxxxx „xxxxxxxxxxxxxx“ xxxxxxx.
8. V §13 xxxx. 2 xxxxxxx x) xxxxxx poznámky xxx xxxxx x. 104 xxx:
&xxxx;„x) xxxxxx xxxxxxxxxx týkající xx xxxxxxxxxx hodnocení xxxxx §51 x xxxxxx xxxxxxxx xxxxxxxx ve xxxxxx čl. 77 xxxxx použitelného xxxxxxxx Xxxxxxxx unie xxxxxxxxxxxx xxxxxxxx hodnocení xxxxxxxxx xxxxxxxx přípravků104) (xxxx xxx „nařízení x xxxxxxxxx hodnocení“)“.
CELEX: 32014R0536
9. V §13 xxxx. 2 xx xx xxxxx xxxxxxx x) tečka xxxxxxxxx xxxxxx x xxxxxxxx xx xxxxxxx x), xxxxx xxx:
„x) v xxxxxxx zjištění závady x xxxxxxx xxxxxx, xxxxx nepředstavuje xxxxxxxx xxxxxx xxxx xxxxxx xxxx, xxxxxxxxx x xxx, xxx xx xxxxxx xxxxxx xxxx xxxx xxxxxxxxxx xxxxx xxxx xxxxxxxxxxxx, xxxxxxx, xxxxxx xx xxxxx xxxx xxxxxxxx xxx xxxxxxxxxxx xxxxxxxxxxx služeb.“.
10. V §13 xxxx. 3 xx xx konci písmene x) tečka xxxxxxxxx xxxxxx x xxxxxxxx xx xxxxxxx q) x r), xxxxx xxxxx:
„x) xxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx veškeré xxxxx xxxxx xxx vydání xxxxxxxx obecné xxxxxx xxxxx §77x,
x) xx xxxxxxx vyhodnocení situace xx xxxx x xxxxxxxx xxxxxxxxx sděluje Xxxxxxxxxxxx zdravotnictví xxxxxxxxx xxxxx §77c x xxxxxxx xx xxxxxx x vydání xxxxxxxx xxxxxx xxxxxx xxxxx §77x.“.
11. X §16 xxxx. 2 písm. x) xxxx 1 xx xx xxxxx „xxxxxxxxxx o xxxxxxxx xxxxxxxxxx xxxxxx,“ xxxxxxxx xxxxx „xxxxxxxxxx x xxxxxxxxxx léčivého xxxxxxxxx,“.
12. Za §19 xx xxxxxx xxxx §19x, xxxxx xxxxxx xxxxxxx zní:
„§19a
Generální xxxxxxxxxxx xxx
(1) Generální ředitelství xxx xxxxxxxxx na xxxxxxxx Xxxxxx x xxxxxxxxxxxx osobě, xxxxx xxxxx xx xxx xxxx xxxxxx xxxxxx, xxxx informace:
a) xxxxxxxxxxxxx xxxxx xxxxxx xxxxx, x to xxxxxxx xxxxx nebo xxxxx x xxxxx,
x) xxxxx xxxxxx, včetně obchodního xxxxx,
x) x xxxxxxx xxxxxxx informace o xxxx xxxxxxxx x xxxx xxxxxx léčiva x
x) xxxxxxxx léčiva xxxxxxxxx v xxxxxxx xxxxxxxxxx.
(2) Xxxxxxxxxx informací xxxxx xxxxxxxx 1 xxxx porušením xxxxxxxxxx xxxxxxxxxxxx podle daňového xxxx.“.
13. X §21 xx xxxxxxxx 1 xxxxxxx.
Xxxxxxxxx xxxxxxxx 2 x 3 xx xxxxxxxx xxxx odstavce 1 x 2.
14. V §23 xxxx. 2 xxxx. x) xx za xxxxx „jakosti“ vkládají xxxxx „, pokud Xxxxx xxxxxxx rozhodnutí xxxxx §13 xxxx. 2 xxxx. x)“.
15. V §33 xxxx. 2 xx xx xxxx xxxxx xx xxxxx „xxxx xxxxx“ xxxxxxxx xxxxx „x xxxx xxxxxxxxxxx Xxxxxxx xxxx Xxxxxxxxxxxx xxxxxxx“.
16. V §33 xxxx. 2 se xxxx xxxxxxxx xxxxxxxxx xxxxxx „Xxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxxx Xxxxxx úplné x xxxxxxx xxxxx o xxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xx xxx x Xxxxx xxxxxxxxx xxxxxxxxxxxx; xxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxx rozhodnutí o xxxxxxxxxx, xxxxxxxxxxxx xxxxxxxx xxxxxxxxx x informaci x xxx, xxx xxx léčivý přípravek xxxxx xxxxxxx xxxx xxxxxxxxxxxxxx; xxxxxxxxx, způsob, xxxxx a časový xxxxxxxx jejich xxxxxxxxxxx xxxxxxxxxxxxxxx elektronického xxxxxxx xxxxxxx xxxxxxxxx xxxxxx xxxxxxx. Xx výzvu Xxxxxx xxxx Xxxxxxxxxxxxx xxxxxx xxxxxxxx držitel xxxxxxxxxx x xxxxxxxxxx Xxxxxx xxxx Veterinárnímu xxxxxx údaje xxxxxxxx xx xxxxxx předepisování xxxxxxxx xxxxxxxxx a xxxxx x xxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xx xxx x Xxxxx xxxxxxxxx, xxxxx xx k xxxxxxxxx.“.
XXXXX: 32001L0083, 32004L0027
17. X §33 xxxx. 3 xxxx. x) se xxxxx „xx xxxxxxxxxx xxxx xxxxxxx“ nahrazují xxxxx „xxxxxxxxx na trh x Xxxxx xxxxxxxxx“.
18. X §34 xx na xxxxx xxxxxxxx 2 doplňují xxxx „Léčivý xxxxxxxxx xxxxxxxxxxxx xxxxxx x xxxxxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxxx lze, xxxxx xxxxxx x xxxxxxxxxx x prodloužení registrace xxxxxxxxx xxxxx, xxxxxx xxxxxx xx xxx xxxxxxx xx xxxx 180 xxx xx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx. Xxxxxxxxxxxx, xxxxxxx, x xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx, a xxxxxxxx xxx poskytování xxxxxxxxxxx xxxxxx nebo xxxxxxxxxxx péče je xxxxxx léčivý xxxxxxxxx xxxxx xxxx xx xxxx xxxx použitelnosti.“.
19. V xxxxxxx xxxxx IV xx xxxxx „VÝROBY“ xxxxxxxxx xxxxxx „XXXXXX“.
20. Nadpis xxxx 1 xxxxx IV xxx: „Xxxxxxxx xxxxxx“.
21. §51 xx 53 znějí:
„§51
Klinické xxxxxxxxx xxxxxxxxx xxxxxxxx přípravků
(1) Xxxxx xxxxxxxx xxxxxxx x xxxxxxxx klinického xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx x xx. 5, 13 x 14 xxxxxxxx x klinickém hodnocení x xxxxxxx x xxxxxxxx významné xxxxx xxxxxxxxxx hodnocení x xxxxxxx s xx. 16 Nařízení XX x xxxxxxxxx hodnocení. Xxxxx xxxx xxxxxxx xxxxxx xxx průběhem xxxxxxxxxx xxxxxxxxx. Veškeré xxxxx xxxxxxxxx x xxxxxxxxxxx s vyřízením xxxxxxx x povolení xxxxxxxxxx xxxxxxxxx x xxxxxxx x xxxxxxxx xxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx x zajištěním xxxxxxx xx xxxxxxxx xx xxxxxxx xxxxx.
(2) Xxxxx xx v Xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxx místem xxxxx xx. 83 xxxxxxxx x klinickém hodnocení.
(3) Xxxxx v xxxxx xxxxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxxx hodnocení xxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxx změny xxxxxxxxxx xxxxxxxxx
x) v xxxxxxx, xx xx Xxxxx xxxxxxxxx xx xxxxxx k xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxxxx podle xx. 5 xxxx. 1 xxxx xx. 14 xxxx. 2 xxxxxxxx x klinickém xxxxxxxxx, vykonává xxxxxxxx xxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx nařízením x xxxxxxxxx xxxxxxxxx, týkající xx aspektů, xx xxxxx se xxxxxxxx xxxx X xxxxxxxxx xxxxxx,
x) v xxxxxxx, xx Česká republika xxxx xx xxxxxx x příslušnému xxxxxxxxxx xxxxxxxxx členským xxxxxx xxxxxxxxxxx, xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx státu xxxxx xx. 2 xxxx. 12 xxxx xx. 14 nařízení x xxxxxxxxx xxxxxxxxx, xxxxxxxx xx xxxxxxx, xx které se xxxxxxxx část X xxxxxxxxx xxxxxx, x
x) xxxxxxxxxxx xxxx II xxxxxxxxx xxxxxx k xxxxxxx o povolení xxxxxxxxxx xxxxxxxxx xxxxxxxx xx České republiky x k xxxxxxx x povolení významné xxxxx xxxxxxxx se Xxxxx xxxxxxxxx, xxxxx xxxxxxxx je xxxxxxxxxx xxxxxxxxxxx xxxxxxx komisí.
(4) Xxxxx rozhoduje o xxxxxxx x povolení xxxxxxxxxx xxxxxxxxx a x žádosti o xxxxxxxx xxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx xxxxx xxxxxxxx o klinickém xxxxxxxxx. Tato xxxxxxxxxx xxxxx xxx xxxxx Xxxxx republiky.“.
CELEX: 32014R0536
§52
Ochrana xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx
(1) Klinické xxxxxxxxx xxx xxxxxxxx x xxxxxxxxx xxxxx xx xxxxxxxxxxx, že xxxxx xxxxxxxxxxxxx souhlasu jeho xxxxxxxxx xxxxxxxx xxxxxxx x účasti x xxxxxxxxx hodnocení podpisem xxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxxx xxxxx, xx-xx to xxxxxxxxx xxxx xxxxxxxx x xxxxx xxxxxxxxxx.
(2) Klinické xxxxxxxxx lze provádět xx xxxxxxxx stanovených xxxxx xxxxxxx xxxx x specifických xxxxxx xxxxxxxx, xx kterých xxxxxx osoby
a) xxxxxxxxxxx xx ve vazbě, xxxxxxxxxxxxx xxxxxxx nebo xx xxxxxx xxxxxx xxxxxx xxxxxxx,
x) pobývající x zařízení ústavní xxxx,
x) xxxxxxx svéprávnost xxxx xxxxxxx xxxxxx.
(3) Xxxxxxxx xxxxxxxxx xxx xxxxxxxx x xxxx xxxxxxxxx x xxxxxxxx 2 jen xxxxx, xxxxx x němu xxxx xxxxx přivolí xxxxxxxxx x informovaným xxxxxxxxx x pokud xxxxxxxx xxxxxxx xxxxxxxxx xxxxxx opravňující k xxxxxxxxx, xx xxxxx x xxxxxxxxx xxxxxxxxx xxxx xxx xxx xxxx xxxxx xxxxx xxxxxxx xxxx xxxxxxxxx xxxxxxxxxxx xxxxxx, který xxxxxxx xxx souvisejícími xxxxxx x xxxxxx, xxxx xxx xx xxxxxxxx do klinického xxxxxxxxx xxxx xxxxxxx xxxxxxxx xxxxxxxxxxx, popřípadě xxxxxxxx, xxxxxxxxxxxx zdravotního xxxxx.
XXXXX: 32014R0536
§53
Xxxxxx xxxxxx
(1) Xxxxxx xxxxxx je xxxxxxx Xxxxxx.
(2) Xxxxxx xxxxxx xxxxxxxx etický xxxxxx xxx xxxxxxxxx xxxxxxxxxx x xxxxxxx xxxxxx xxxxxxx, xxxxxxxxxx xxxxxx, xxxxxxxx x xxxxxxx xxxxxxx, xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx, xxxxxxx o xxxxxxxx významné xxxxx xxxxxxxxxx xxxxxxxxx a xxxxxx xxxxxxxxxx x xxxxxxx x způsobem xxxxx xxxxxx xxxxxx x xxxxxxxx x xxxxxxxxx xxxxxxxxx.
(3) Ústav xxxxxxxxx xxx xxxxxxx xxxxxx xxxxxxxx pro xxxx xxxxxxx.
(4) Ústav xx xxxxxxxxxx xxxxxxxx Xxxxxxxxxxxx zdravotnictví xxxx Xxxxxx xxxxxx komise. Xxxxxxx řád etické xxxxxx (dále jen „Xxxxxxx xxx“) xxxxxx xxxx xxxxxx xxxxxx. Xxxxxx xxxxxx komise x Jednací xxx Xxxxx zveřejní na xxxxx xxxxxxxxxxxxx xxxxxxxxx.“.
XXXXX: 32014R0536
22. Xx §53 xx xxxxxxxx xxxx §53x xx 53x, xxxxx xxxxx:
„§53x
Xxxxxxx xxxxxx xxxxxx
(1) Xxxxxx xxxxxx xx xxxxxxx xx xxxxxx. Skupiny xxxx xxxxxxx x odborníků x xxxxxxx xxxxxxxxxxxxx x xxxx bez xxxxxxxxxxxxxx vzdělání. Počet xxxxxx a xxxxx xxxxx jednotlivých skupin xxxxxx komise xxxxxxx Xxxxxx etické xxxxxx. Xxxxxxx xxxxxx komise xxxx jmenováni xxx, xxx x každé xxxxxxx xxxxxx xxxxxx xxxx xxxxxxx 5 xxxx, z nichž xxxxxxx 1 xxxxx xxxx xxx xxxxxxxxxxxxxx xxxxxxxx.
(2) Xxxxx xxxxxx xxxxxx xxxxxxx a xxxxxxxx xxxxxxx xxxxxxxxxxxxx, x xx xx xxxxxxxxxxxx xxxxxx. Xxxxxxx xxxxxx xxxxxx xx xxxxxxxx x předsedy, xxxxxxxxxxxxx x xxxxxxx xxxxx. Předseda x xxxxxxxxxxxxx xxxx xxxxxx xxxxx xxxxxxx v xxxxxxx s Xxxxxxxx xxxxx xxxxxx xxxxxx.
(3) Xxxxxxx xxxxxx komise xxxx xxxxxxxx xxxxxxxxx xx. 9 xxxxxxxx x xxxxxxxxx hodnocení x dále musí xxx xxxxxxxxxxx a xxxxxxxxx posuzovat x xxxxxxxx žádost x xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxx, xxxxxxxxxx x xxxxxxxxx, x xxxxxxxx xxxxx xxx xxxxxxxxxxxxxx xxxxxxxx, xxxxx xxxxxxxx xxxxxx o xxxxxxxx hodnocení xxxxxxx x xxxxxxxx etického.
(4) Xxxxxxx xxxxxx xxxxxx xx zdrží xxxxxxxxx x xxxxxxxx o xxxxxxxx xxxxxxxxxx xxxxxxxxx, xx jehož xxxxxxxxx xxxx osobní xxxxx, xxxxx i xxxxxxxxx x xxxxxxxxx xxxxxxxx x xxxxxxxx xxxxxxxx xxxxx a xxxxxxxxxx xxxxxxxxx xxxxxxx nad xxxxxxx xxxxxxxxx hodnocením x neprodleně xxxxxx xxxxx xxxxxxxx xxxxx xx posuzovaném xxxxxxxxx xxxxxxxxx xxxxxx xxxxxx x Xxxxxx.
(5) Členové xxxxxx xxxxxx xxxx xxxxxxxxx xxxxxxxxxx mlčenlivost x xxxxxxxxxxx x xxxxxxxxxxxxx, které xx xxxxx x xxxxxxxxxxx xx svým xxxxxxxxx x etické komisi.
(6) Xxxxxx xxxxxx xxxxxx xxxxxx xxx osoba, xxxxx xx dopustila xxxxxxxxx xxxxx §108 xxxx. 8. Xxxxxxxx-xx xx xxxx etické xxxxxx takového xxxxxxxxx, xxxx členství v xxxxxx komisi zaniká.“.
CELEX: 32014R0536
§53x
Xxxxxxx xxxxxx komise
(1) Xxxxxxxxxx xxxxxx komise xx xxxxxxxxx x xxxxxxx xxxx, bezpečnosti x xxxxxx xxxxxxxx xxxxxxxxx.
(2) Etická komise xxxxxxxxxxx dohled xxx xxxxxxxxx hodnocením na xxxxxxx zprávy o xxxxxxx xxxxxxxxxx hodnocení xx xxxxxxxxxxxxx xxxxxxxx, x xxxx xxxxxxxx xxxxxxxxx xxxxxxx, (xxxx xxx „místo xxxxxxxxxx xxxxxxxxx“) xxxxxxxxxx xxxxx xxxxx správné xxxxxxxx xxxxx xxxxxxxxxxx xxxx xxxxxxx zkoušejícím. Náležitosti xxxxxx x průběhu xxxxxxxxxx xxxxxxxxx x xxxxxx intervaly pro xxxx předkládání xxxxxxx xxxxxxxxx právní předpis.
(3) Xxxxxx xxxxxx xxxx xxx xxxxxxx názoru xxxxxxx xxxxx xxxxxxxxx. Xxxx xxxxxxxxx xxxx xxxxxxxx požadavky čl. 9 nařízení x xxxxxxxxx xxxxxxxxx. Tito xxxxxxxxx xxxx povinnost xxxxxxxxxx xxxxxxxxxxx x xxxxxxxxxxx x xxxxxxxxxxxxx, xxxxx xx dozví x xxxxxxxxxxx xx xxxx činností x xxxxxx xxxxxx.
(4) Xxxxxx xxxxxx xxxxxxxx xxxx xxxxxxx x xxxxxxx x Xxxxxxxx xxxxx, xxxxx xxxxxxxx xxxxxxx
x) xxxxxx plánování xxxxxxxx, xxxxxxxxxx xxxxx xxxxxxx x xxxxxx xxxxxx xxxxxxxx.
x) xxxxxx odvolání xxxxxxxxxxx stanoviska etické xxxxxx.
(5) Xxxxxx xxxxxx xxxx xxxxxxxx svou xxxxxxx xxxxx xxxxxxxxxx xxxxxxx etické xxxxxx, xxxxx xxxxxxx Xxxxx x xxxxx xxxxxxxx xxxxxxx
x) xxxxxx xxxxxxxxxx xxxxxxx x povolení xxxxxxxxxx hodnocení x xxxxxxx x xxxxxxxx xxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx v xxxxxxx xxxxxxxxxx xxxxxxxxx o xxxxxxxxx hodnocení,
b) postupy xxx nakládání x xxxxxxxx xxxxxxxxxxxx xxxx xxxxxxxx xxxxxxxxxxxx, jsou-li xxxxxxxx, x xxxxxxxxxx x s xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxxxxx či xxxxxxxxx xxxxx xxxxxxxx xxxxx čl. 52 xx 54 xxxxxxxx x klinickém xxxxxxxxx,
x) xxxxxx, xxxxx xxxxxx xxxxxx xxxxxxx Ústavu xxx xxxxxxxxxx ke xxxxxxxxxx xxxxxxxxx včetně xxxx odůvodnění.
CELEX: 32014R0536
§53x
Xxxxxxxxxx
(1) Xxx xxxxxxxx stanoviska, xxxxxxxxxx xx xxxxxxx, xx které se xxxxxxxx xxxx X xxxxxxxxx xxxxxx x xxxxxxx x xxxxxxxx xxxxxxxxxx hodnocení nebo xxxxxxx x xxxxxxxx xxxxxxxx změny xxxxxxxxxx xxxxxxxxx x rozsahu xxxxxxx, xx xxxxx xx xxxxxxxx část X hodnotící zprávy, xxxxxx komise posoudí xxxxxxxx xxxxxxxxxx xxxxxxxxx x rozsahu
a) xxxxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx x xxxx xxxxxxxxxx,
x) xxxxxxxxxxxxx xxxxxx xxxxxxxxxxxxxxx xxxxxxx x xxxxx x xxxxxxxxxxxxx xxxx závěrů, x
x) xxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxxx.
(2) Vydala-li xxxxxx komise v xxxxxxx x nařízením x xxxxxxxxx hodnocení xxxxxxxxx xxxxxxxxxx, xx xxxx xxxxxxxxxx xxxxxxx x xxxxxx o xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxx o xxxxxxxx xxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx x České xxxxxxxxx Xxxxx xxxxxxxxxxx xxxxxxx. Xxxxxxxxx stanovisko, xxxxxxxx se xxxxxxx, xx xxxxx xx xxxxxxxx xxxx X xxxxxxxxx xxxxxx k xxxxxxx o povolení xxxxxxxxxx xxxxxxxxx nebo x xxxxxxx x xxxxxxxx xxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx týkající xx dodatku xxxxxxxxx xxxx xxx xxxxxx xxxxx x xxxxxx xxxxxxxxx x xxxxxxxx x xxxxxxxxx hodnocení. Xxxxxxxxxx xxxx obsahovat xxxxxxxxxx, ve kterém xx uveden xxxxx x xxxxx xxxxxxxxxxx x xxxxxxxxxxxx xxxxxx, xxx které zaujala xxxxxx xxxxxx xxx xxxxxxxxxx. Xx xxxxx xxxxxxxxxx xxxxxxxxxx a xxxx xxxxxx předání Xxxxxx xxxxxxxx xxxxxxxx xxxxxx komise.
(3) Xxxxxx xxxxxx xxxx před xxxxxxxxx xxxxxxxxxx hodnocení xxxxxxxxxx xxxxxxxx se xxxxxxx, na které xx xxxxxxxx část XX xxxxxxxxx xxxxxx x žádosti x xxxxxxxxx xxxxxxxxxxx svého xxxxxxxxxx. Xxx xxxxxxxx xxxxxx xxxxxxxxxx xxxxxx xxxxxx postupuje v xxxxxxx x xxxxxxxxx x klinickém xxxxxxxxx.
(4) Xxx xxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxx xxxxx xxxxxxxx 3 xxxxxxx xxxxxx xxxxxx xxxxxx xxx xxxxxxxxx konkrétního xxxxxxxxxx xxxxxxxxx xxxxxxx xxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx s xxx, xx xxxx dokumentaci xxxxxxx x xxxxxxxx, xxx
x) kompenzace xxxx xxxxxxxxx odškodnění xxxxxxxx xxxxxxxxx xxx případ xxxxxxxxx újmy v xxxxxxxx jeho xxxxxx x xxxxxxxxx xxxxxxxxx xxxx xxxxxxxxx xxxxxxxxx xxxxxxxx,
x) pojištění odpovědnosti xxx zkoušející x xxxxxx xxxxxxxxxx, xxxx-xx xxxxxxxx, a xxxxxxxxxx xx xxxxxxxxx pojistnou xxxxxxxx, xxxxxxxxx xxx xxxxxxxxx odpovědnosti xxxxxxxxxxxx x xxxxxxxx zkoušejících, xxxx-xx xxxxxxxx, xxxx xxxxxxxxxx xxxx xxxxxxxx xxxxxx xxxxxxxxxxxxxxxx xxxxxx,
x) xxxxxxxxxx nepřesahují xxxxxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx v xxxxxxxxxxx x xxxx xxxxxx x klinickém xxxxxxxxx,
x) xxxx xxxxxx xxx xxxxxxxx xxxxxxxxx odpovídá xxxxxx xxxxxxxxxx xxxxxxxxx, x xx zejména xx xxxxxx k xxx xxxxxxxxx výkonům, x xxxxx xxxx xxxxxxx xxxxxxxxx přímý xxxxxxxx,
x) je xxxxxxxx xxxxxx zajištění xxxxxx xxx xxxxxxxxxx x xxxxxxxx xxxxxxxxxxxx, xx-xx xxxxxxx,
x) zkoušející a xxxxxx xxxxxxxxxx, xx-xx xxxxxxx, splňují xxxxxxxxx xxxxxxxxx x §54,
x) xxxxx xxxxxxxxxx xxxxxxxxx xx xxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx.
(5) Xxxxxx xxxxxx xxxxxxxx z hlediska xxxxxxx xxxx, xxxxxxxxxxx x xxxxxx subjektů xxxxxxxxx xxxxxxxxxx x xxxxxxx xxxx xxxxxxxx xxxxxxxxx x jejich xxxxxx x xxxxxxxxxx xxxxxxxxxxxx, nebo xxxxxxxx xxxxxxxxxxxx, xxxx-xx xxxxxxxx, xxxxxxx x xxxxxxxxxxx x xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx.
(6) Xx xxxxx xxxxxxxxxx xxxxxxxxxx podle xxxxxxxx 3 x xxxx xxxxxx xxxxxxx Xxxxxx xxxxxxxx xxxxxxxx etické xxxxxx. Xxxxxxxxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx.
(7) Xxxxxx komise xxxx xxxxxxx trvale xxxx xxxxxxx xxx xxxxxxxxx xxxxxxxxxx s xxxxxxxxxx xxxxxxxxxx xxxxxxxxx, xxxxxxxx xx xxxxxxxxx xxxx xxxxxxxxxxx xxxxxxxxx pro xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxxx xxxx xxxxxx xxxxxxxxxx xxxx xxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx, x xxxxx xxxxxx xxxxxx xxxxxx xxx xxxxxxxxx stanovisko. Xxxxxx-xx xxxxxx xxxxxx, xx xx xxxxxxxx xxxxxx xxx odvolání xxxxxx xxxxxxxxxxx stanoviska xxxxxxxxx xx xxxx xxxxx, požádá Ústav, xxx xx vyžádal xxxxxxxxxx xxxxxxxxxx, xxxxxxxxx xxxxxxxxxxxx xxxx xxxxxxxx xxxxxxxxxxxx x xxxxx xxxxxxx, s výjimkou xxxxxxx, xxx je xxxxxxxx xxxxxxxxxx subjektů xxxxxxxxx. Odvolání xxxxxxxxxxx xxxxxxxxxx xxxxxx komise xxxxxxxx
x) identifikační údaje x xxxxxxxxx hodnocení, xxxxxxx xxxx xxxxx, xxxxxxx xxxxxxxxxx nebo xxxxxxxxxx, xxxxxxxx identifikační xxxxx x číslo xxxxxxxxx,
x) xxxxxxxx xxxxxxx, xxx xx xxxxx x xxxxxxx xxxx xxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxx, v xxxxxxx xxxxxxxxx xxxxxxxx souhlasu xxxx být xxxxxxxxx xxxxxxxx, po xxxxxxx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxx,
x) odůvodnění, ve xxxxxx xx xxxxxx xxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxx, podklady xxx xxxx xxxxxx a xxxxx, xxxxxxx se xxxxxx xxxxxx řídila,
d) xxxxxxxx nezbytná k xxxxxxxx xxxxxxxxxx hodnocení, xxxxxxx x xxxxxxx xxxxxxxx hodnocení na xxxxx xxxxx, xxxxxx-xx xxxxxxx již v xxxxxxxxx,
x) xxxxx odvolání xxxxxxxxxxx stanoviska a xxxxxx předsedy xxxxxxx xxxxxx komise, xxxxx xxxxxxxx vydala.
(8) Xxxxxx xxxxxx je na xxxxxxxx Xxxxxx povinna xxxxxx Ústavu své xxxxxxxxxx xx všem xxxxxxxxxx, xxxxx xxxxxxxxx xxxxxxxxx etickou xxxxxx,&xxxx; xxxxxxxxxx jeden xxxxxxxx xxx před posledním xxxx xxxxx, xxxxxxxxxx Xxxxxx xxx xxxxxx xxxxxxxxx x xxxxxxx xxxxxxx, xxxxxxx o xxxxxxxx xxxxxxxxxxx k xxxxxxx, xxxx koordinovaného xxxxxxxx, xxxx konsolidace, xxxxxxxxx doplňujících informací, xxxxxxxxx xxxxxxxxx žádosti xx xxxxxxxx xxxxxxxxxxxx xxxxxxxxx, xxxxxxxxxx konečné xxxxx I xxxxxxxxx xxxxxx xxxx xxxxxxxxxx xxxxxxx části XX xxxxxxxxx xxxxxx, v xxxxx xxxxxxxxx podle xx. 5, 6, 7, 13, 14, 17, 18, 20 x 22 xxxxxxxx x xxxxxxxxx xxxxxxxxx.
(9) Xxxxx xxxxxxxx x xxxxxxxxxxx x činností xxxxxx xxxxxx xx xxxx 5 let xx xxxxxxxx xxxxxxxxxx xxxxxxxxx tyto dokumenty:
a) xxxxxx x xxxxxxx,
x) xxxxxxxxxx x xxxxxx xxxxx,
x) xxxxxxxxxx xxxxx xxxxxx xxxxxx,
x) záznamy x proškolení x xxxxxx vzdělávání xxxxx xxxxxx komise,
e) xxxxxxxxx x xxxxxxxxx x xxxxxxxx členů xxxxxx xxxxxx,
x) xxxxxxxxx vztahující xx ke xxxxxxxxx, xxxxxxxx xxxxx xxxxxx xxxxxx, xxxxx x xxxxxxxxxx x xxxxxx,
x) xxxxxxxxxxxxxx x xxxxxxx xxxxxxx, včetně podkladů, xxxxx xxxxxxxx k xxxxxx xxxxxxxxxx, x xxxxxxxxx spolupracujícími x xxxxxxx xxxxxx, x
x) xxxxxxxxxxxxx xxxxxx xxxxxx.“.
XXXXX: 32014R0536
23. §54 xx 59 včetně xxxxxxxx xxx xxxxx x. 102 x 103 xxxxx:
„§54
Xxxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxxxx
(1) Xxxxxxxxxxx x xxxxxxx zkoušejícím xxxx xxx xxxxx xxxxx xxxx zubní xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx jiným právním xxxxxxxxx29) xxx xxxxx xxxxxx zdravotnického povolání, xxxxx xx xxxxxxxx xxxxxxx xxxxxxxx a xxxxxxxxxx s xxxx x pacienty s xxxxxxxxxxx xxxx xxxxx, xx xxxxxxx xxxxx xx zaměřuje dané xxxxxxxx xxxxxxxxx, x xx xxxxxxxx správné xxxxxxxx xxxxx.
(2) Xxxxxxxx xxxxxxxxx xxx provádět xxxxx x poskytovatele xxxxxxxxxxx služeb xx xxxxxxxxxxxxx xxxxxxxx.
(3) Xxxxxxxxxxxx xxxxxxxxxxx xxxxxx, u xxxxx xx xxxxxxxxx xxxxxxxx hodnocení, x xxxx xxxxxxx k xxxxxxx podání xxxxxxxxxxx xxxxxxxx přípravku xxxxxxx, x xxxxxxxxxxxx zdravotních xxxxxx, x xxxxx xx prováděno xxxxxxxx xxxxxxxxx bez léčebného xxxx xxxxxxxxxxxxx xxxxxx xxx xxxxxxxx xxxxxxxxx, x xx xxxxxxx xxxxxxxxxxxxxxx a xxxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxx xxx xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxx xxxxx xxxxxxxx Xxxxxxx. Způsob x xxxxxx xxxxxxxxx xxxxxx certifikátu xxxxxxx xxxxxxxxx xxxxxx předpis.
(4) Xxx xxxxxxxxxxxxx zdravotních xxxxxx xxxxxxxxx v xxxxxxxx 3, u xxxxx xxxx prováděna xxxxxxxx hodnocení, není xxxxxxx certifikátu xxxxxxx xxxxxxxx xxxxx povinné; xxxxx xxxx x xxxx xxxxxx xxxxxxx; xxxxxxxx 3 xxxx xxxxx xx xxxxxxx xxxxxxx.
XXXXX: 32014R0536
§55
Xxxxx
(1) Dokumentace xxxxxxxxxx xxxxxxxxx xxxx xxx xxxxxxxxxx v xxxxxx jazyce, pokud xxx o xxxx xxxxxxxxx:
x) xxxxxx protokolu xxxxxxxxxx hodnocení,
b) xxxxxxxxx xxx xxxxxxxx, informovaný xxxxxxx, svolení nezletilého x xxxx xxxxxx x xxxxxxxxx hodnocení x xxxxxxx k xxxxx xxxxxxxxxx,
x) xxxxxxxxx x xxxxxxx xxxxxx xxxxxxxx hodnocení x Xxxxx republice,
d) xxxxxxxx xxxxxxxxx xxxxxxxxxx xx x xxxxxx klinickému xxxxxxxxx,
x) veškeré xxxxxxxxx xxxxxx xxxxxxxxx hodnocení,
f) xxxxxx zkoušejících x xxxxxxxx xxxxxxxxxxxx, jsou-li xxxxxxxx,
x) seznam xxxx xxxxxxxxxx hodnocení,
h) xxxxxx x zajištění xxxxxxx xxxx xxxxxxxxx xxxxxxxxx,
x) xxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxxxx xxx xxxxxxxxxx x xxxxxx xxxxxxxxxx, xxxx-xx xxxxxxxx, x odměňování nebo xxxxxxxxxx xxx xxxxxxxx xxxxxxxxx.
(2) Xxxxxxx dokumentace xxxxxxxxxx xxxxxxxxx, nejde-li x xxxxxxxxx xxxxxxx x xxxxxxxx 1, xx xxxxxxxxx x xxxxxx, slovenském xxxx xxxxxxxxx xxxxxx.
(3) Xxxxxxxxx x xxxxxxxx xx xxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxxx xxxxxxxxx xx uvádějí x xxxxxx xxxxxx, xxxx-xx x xxxxxxxxxx Ústavu xxxxxxx jinak.
CELEX: 32014R0536
§56
Xxxxxxxxx x pomocné xxxxxx xxxxxxxxx
(1) Xxxx-xx xxxxxxx xxxxxxxx xxxxxxxxx x xx. 59 xxxx. 2 nařízení o xxxxxxxxx xxxxxxxxx, xxxxx xxx xx xxxxx Xxxxx xxxxxxxxx xxxxxxx xxx klinickém xxxxxxxxx x neregistrované xxxxxx xxxxxxxxx.
(2) Zadavatel xxxxxxxxx xxxxxx xxxxxxxxx léčivé xxxxxxxxx, pomocné léčivé xxxxxxxxx xxxxxxxxxxxxxx podle xxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxx hodnocení x xxxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx, které xxxx xxxxxx x xxxxxx hodnocených xxxxxxxx xxxxxxxxx. V rámci xxxxxxxxxx xxxxxxxxx humánních xxxxxxxx xxxxxxxxx, pokud xxxxx xxxxxx xxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx, lze xxxxxx xx xxxxxxxxxx xxxxxxxxx Xxxxxxx x xxxxxx xxxxxxxxxxxx prostředek, xxxxx xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx zákonem x zdravotnických prostředcích. Xx-xx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx, kterým xx xxx xxxxx tohoto xxxxxx xxxxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxx xxxx xxxxxxxx státem xxxx xxxxxxx xxxxxxxxxxxx xxxxxx, xxxxxxx xxxxxx xxxxx a xxxxxxx xxxxxxxx xxxxxxxxx, x xxxxxxxxx léčivé přípravky xxxx xxxxxxxxxxxx v Xxxxx xxxxxxxxx, xxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx povinné.
(3) Xxxx-xx xxx x xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx použita xxxxxxxxxxxx xxxxxxxxxxxxxx podle xxxxxx zákona, pak x xxxxxxx s xxxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx spolu x xxxxxxxxxxx x xxxxxxx x povolení klinického xxxxxxxxx xxxxxxxxxx Státního xxxxx xxx xxxxxxxx xxxxxxxxxx vydané xxxxx §18.
(4) Mají-li xxx x xxxxxxxxx hodnocení xxxxxxxxx xxxxxxxx přípravků xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxxx organismy, xxxxxxxx xxxxxxxxx xxxxx x xxxxxxxxxxx x xxxxxxx o povolení xxxxxxxxxx xxxxxxxxx xxxxxxx Xxxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxx xxxxx jiného xxxxxxxx xxxxxxxx11).
(5) Xxxx-xx xxx v xxxxxxxxx xxxxxxxxx humánních xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxxx lidské embryonální xxxxxxx xxxxx, xxxxxxxx xxxxxxxxx xxxxx x xxxxxxxxxxx x žádosti x xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxxx s lidskými xxxxxxxxxxxxx kmenovými buňkami xxxxxx Xxxxxxxxxxxxx školství, xxxxxxx x tělovýchovy xxxxx xxxxxx xxxxxxxx xxxxxxxx102).
(6) Xxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxxxxxxx klinická hodnocení xxxxx xx. 2 xxxx. 3 nařízení x xxxxxxxxx hodnocení xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx, xxxxx xxxxxxx podkladem xxx xxxxxxxxxx xxxx xxxxx registrace xxxxxxxx xxxxxxxxx, xxxxxxx prováděcí xxxxxx xxxxxxx požadavky xx xxxxxxxxxxxx, obsah xxxxxxxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxx přípravků. Klastrovým xxxxxxxxx xxxxxxxxxx xxxxx xxxx xxxxx xx xxxxxx klinické xxxxxxxxx xxxxxxxxx pouze xx xxxxx Xxxxx xxxxxxxxx, xxxxx xxxxx je xxxxxxxxx léčby xxxxxx xxxxxxxx, x rámci xxxxxxx xxxx xxxxxxx xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxxxx podle xxxxxx xxxxxx v Xxxxx xxxxxxxxx x jsou xxxxxxxxx x xxxxxxx xx souhrnem údajů x xxxxxxxxx nebo xxxx xxxxxx údajů x xxxxxxxxx, je-li xxxxxx způsob xxxxxxx xxxxxx x xxxxxx xxxxxxxxx xxxxx xxxx xxxxxxxxxxxx léčebnými xxxxxxx x dostatečně odůvodněn xxxxxxxxx poznatky.
CELEX: 32014R0536
§57
Xxxxxx xx zadavatelem
Ústav může xx xxxxxxxx xxxxxxxxxxx x xx. 42 xxxx. 3 xxxxxxxx x klinickém xxxxxxxxx xxxxxxx xx xxxxxxxxxxx xxxxxx, xxxxx xxx xxxx zadavatel podezření xx xxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx xxxxxx xxxxx Xxxxxx; v xxxxxxx případě xxxxxx xxxxxxxxx na závažné xxxxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxx Xxxxx.
XXXXX: 32014R0536
§58
Systém xxxxxxx xxxx xxxxxxx xxxxxxxx hodnocení
(1) Xxxxxxx-xx xxxxxxxx klinického xxxxxxxxx x xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxx xxxx, x xx zejména xx xxxxxx nebo xx xxxxxx, xx xxxxxxxxx povinen ji xxxxxxxx v xxxxxxx x xxxxxx xxxxxxxx xxxxxxxx 103). Xxxxxxx xxxx xxx uplatnit x zadavatele xxxxxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx xx xxxxxx xxxxxxxxxx xxxxxxxxx.
(2) Xxxxxxxxx xx xxxxxxx xxx xx xxxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxx xxx, hlavních xxxxxxxxxxxx, xxxx-xx ustaveni, x xxxxxxxxxxxx za xxxx xxxxxxxx subjektu xxxxxxxxx x důsledku xxxxxxxxx xxxxxxxxxx hodnocení.
(3) Odstavec 2 xx xxxxxxxxx, xxxxxxx-xx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx, xxxxx xxxxxxxxx xxxxxxxx xxxxxxx xxxxxxx léčivých xxxxxxxxx x rámci klinického xxxxxxxxx,
x) x léčivými xxxxxxxxx xxxxxxxxxxxxxx xxxxx xxxxxx xxxxxx x Xxxxx republice a xxxxxxxxxxx x xxxxxxx xx xxxxxxxx údajů x xxxxxxxxx, xxxxxxxxx x xxxxxxxx přípravky xxxxxxxxxxxxxx podle xxxxxx xxxxxx x Xxxxx xxxxxxxxx a používanými xxxx xxxxxx údajů x xxxxxxxxx, je-li xxxxxx xxxxxx použití xxxxxx x xxxxxx xxxxxxxxx xxxxx nebo xxxxxxxxxxxx léčebnými postupy x xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx, x xxxxxxx
x) xxxxxxxxx xxxxxxxxxxxx xxxx monitorovací xxxxxxx xxxxxxxxxxxxx x xxxxxxxxx x xxxxxx xxxxxxxxx xxxxx xxxxx xxx xxxxxxxxx dodatečné riziko xxxx xxxxx xxx xxxxxxxxxx xxxxxxxx xxxxxxxxx.
XXXXX: 32014R0536
§59
Xxxxxxxxxx
Xxxxxx-xx xxxxxxxxx v xxxxxxx xxxxxxxxxx xxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxx zástupce xxxx xxxxxxxxx xxxxx, xxxxxxxx xx xxxxxx xxxxxxxx xx prokázání xxxxxxxxxx xx xxxxxxx xxxx xxxx, xxxxxxxxx-xx xxxxxxxxx xxxx xxxxxxxx xxxx.
XXXXX: 32014R0536
24. X §60 xxxx. 3 xxxx. x) xx xxxxx xxxxxxxxx xxxxxx x xxxxxxx x) xx xxxxxx poznámky pod xxxxx x. 64 xxxxxxx.“.
25. V §62 xxxx. 1 xx xx xxxx druhé, xxxxx „za xxxxxx xxxxxxxxxx hodnocení a“ xxxxxxx.
26. X §64 xxxx. x) se xxxxx „§55 x xxxxxxxxxxx x xxxxx xxxxxx x xxxxxxx x xxxxxxxx nebo xxxxxxxx xxxxxxxxxx hodnocení“ xxxxxxxxx xxxxx „xxxxxxxx x klinickém hodnocení x schválenými x xxxxx xxxxxx o xxxxxxx x povolení xxxxxxxxxx xxxxxxxxx xxxx x xxxxxxxx xxxxxxxx xxxxx xxxxxxxxxx hodnocení“.
CELEX: 32014R0536
27. X §64 xxxx. w) se xxxxx „xxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx,“ xxxxxxx.
28. V §66 xx odstavec 4 xxxxxxx.
Xxxxxxxxx xxxxxxxx 5 xx xxxxxxxx xxxx xxxxxxxx 4.
29. X §70 xxxx. 1 se xx xxxx xxxxx xx xxxxx „předpisem“ xxxxxxxx xxxxx „a xxxxx xxxxxxxxxxx xxxxxxxxx Xxxxxxxx unie101)“ x xx xxxxx „xxxxx“ xx xxxxxxxx xxxxx „xxxxxx léčivých látek xxxxxxxx xxx vývoz“.
CELEX: 32014R1252
30. V §70 xx xxxxxxxx odstavec 7, který xxx:
„(7) Xxxxxxx xxxxxxxx xxxxx, xxxxx xxxxxxx xxxxxx, xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxxxx, xxxxxxxx xxxxxxx nebo xxxxxxxxxxx, xxxxx x xxxxxxxxxxx xxxxxxxx léčivých xxxxx xxxxxxxxxxxxx xx xxxxxxx xxxx xxxxxxxx xxx xxxxxxxx léčivých xxxxxxxxx, musí xxx x xxxxxxxxx xxxxxxxxx xxxxx xxxxxxxx 2; xxx xxxxxx dotčena xxxxxxxxxx xxxxxxxx 4 x 5.“.
XXXXX: 32014R1252
31. X §77 xxxx. 1 xxxx. x) xx xxxxx „xxxxxx xxxxx a xxxxxx xxxxxx xxxxxxxxxxx xxxxxx hlášení xxxxxxxx Xxxxx nebo Xxxxxxxxxxx xxxxx ve xxxx xxxxxxxxxxx xxxxxxxxxx“ nahrazují xxxxx „poskytované údaje xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxx, xxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxxxx xxxxx xxxxx xxxxxxx x), xxxxx xxx xxxxxx xxxxxxxxx xxxxxxxxxxxx; xxxxxxxxx xxxxx, xxxxx, xxxxxx x xxxxxx xxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxxxxxxx elektronického xxxxxxx xxxxxxx prováděcí právní xxxxxxx“.
32. X §77 xxxx. 1 písm. x) xx za xxxxx „xxxxxxxx x Xxxxx xxxxxxxxx“ xxxxxxxx xxxxx „; x xxxxxxx, xx provozovatel xxxxxxxxx vydávat xxxxxx xxxxxxxxx xxxxxx distributora x xxxxxxx xxxxxxxxxxxxxx xxxxxxxx přípravku, jehož xx xxxxxxxxxxxxx x xxxxx x období xxxxxxxxxxx 6 xxxxxxxxxxxx xxxxxx xxxxxxxxxxxx xxxxxxxxxxxx, xx distributor povinen xxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx do 48 xxxxx xx xxxxxxxx xxxx xxxxxxxxx; xxxx je xxxxxxx xxxxxxxxxx x xxxxxxx x xxxxxxxxx xxxxxx xxxxxx xxxxxxx Xxxxxxxxxxxxx xxxxxxxxxxxxx xx xxxxxx xxxxxxxxx xxxxxxxxxxx léčivých xxxxxxxxx podle §77x, xxxxxx xx omezuje xxxx xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx do xxxxxxxxx.“.
33. V §77 xx xx xxxxx xxxxxxxx 1 tečka xxxxxxxxx xxxxxx x xxxxxxxx se xxxxxxx x), xxxxx xxx:
„x) x případě, že xx xxxx záměrem xxxxxxxxxxxx xx xxxxxxxxx xxxxxx xxxxxxxxx, který xx xxxxxx na xxxxxxx léčivých přípravků xxxxx §77c, xxxxxxx xxxx xxxxxxxxxx Xxxxxx; xxxxxxxx xx poskytováno xxxxxxxxxxxx x xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxx, identifikaci xxxxxxxx xxxxxxxxx, xxxxxxxx xxxxxxxx přípravku x xxxxxxx xxxxxxxxxx, xxxxx xxxxx distribuce x xxxxx plánované xxxxxxxxxx xxxxxxxx přípravku; xxxxxxxxx xxxxx xxxxxxxxx x xxxxxxxx, xxxxxx a xxxxx jejich xxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxxxx hlášení xxxxxxxx xxxxxxx xxxxxxxxx xxxxxx xxxxxxx; x xxxxxxx, xx xx xxxxxxxx distributora xxxxxx xx dne, kterým xxxxxx 15 xxx xxx dne, xxx xxxxxxxxxxx xxxxxxx xxxxx xxxxxxxxxxxx léčivý xxxxxxxxx, xxxxxx xxxxxxxx obecné xxxxxx podle §77d xx xxxxxx k xxxxxx xxxxxxxx xxxxxxxxx, xxxx xxxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxx.“.
34. Za §77x xx vkládají xxxx §77x a 77x, xxxxx včetně xxxxxxx xxxxx:
„§77x
(1) Ústav xxxxxxxxxxx xx xxxxxxxx xxxxxxxxxx x registraci, xxxxxxxxxxxx x xxxxxxx xxxxxxxxx x objemu léčivých xxxxxxxxx xx xxxx x Xxxxx xxxxxxxxx x x xxxxxx xxxxxxxx přípravků xxxxxxxx x xxxxxxxxx xxx xxxxxxxxxxx zdravotních xxxxxx; xxxx informace xxxxxxxxxx x vyhodnocuje. Xxx xxxxxxxxxx xxxxxxxxx xxxxx xxxx xxxxx Xxxxx xxxxxxxxx, xxx xxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxx xxxxxxxxxxxx jiným xxxxxxx xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx, xxxx xxxxxxxx xxxxxxxxx vzájemně xxxxxxxxxxxxxx xxxxxxxx ke xxxx xxxxxxxx xxxxxxxxxxx, xxxxxxxxxx xxxxxxx aktuální xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx. Xxxxx Xxxxx xx základě xxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxx k xxxxxx, xx xxxxxxxx zásoba xxxxxxxxxxx xxxxxxxx přípravku xxxx léčivých přípravků xxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxx pacientů x Xxxxx xxxxxxxxx x xxxxxxxxxxx tohoto xxxxxxxx xxxxxxxxx nebo xxxxxxxx xxxxxxxxx, xxxxxx xx xxxxxx nedostatečné xxxxxxx xxxxxxxxxx xxxxxx xxxxxxxx x Xxxxx xxxxxxxxx xxxxx léčivým xxxxxxxxxx xxxx xxxxxxxx xxxxxxxxx, bude xxxxxxxx xxxxxxxxxx x účinnost xxxxx pacientů v Xxxxx republice x xxxxxx xxxxxxx xx xxxxxxx xxxxxx obyvatelstva x xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx Xxxxxxxxxxxx zdravotnictví xxxx informaci, x xx včetně podkladů x informací, xx xxxxxxx základě Xxxxx x xxxxxx závěru xxxxx.
(2) Xxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxxxxx Xxxxxxx xxxxx odstavce 1 dojde Xxxxxxxxxxxx xxxxxxxxxxxxx x xxxxxx xxxxxxxxx x xxxxxxxx 1 větě třetí, xxxxxx takový xxxxxx xxxxxxxxx xxxx xxxxxx xxxxxxxxx xx seznam xxxxxxxx xxxxxxxxx, xxxxxxx xxxxxxxxxx xx xxxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxx xxxxxx Xxxxxx xxxxx §77 xxxx. 1 xxxx. x) (dále xxx „Xxxxxx“). Xxxxxxxxxxxx xxxxxxxxxxxxx xxxx Xxxxxx, xxxxx xxxxxxxxxx x xxxxxxxxx znění na xxxxx xxxxxxxxxxxxx xxxxxxxxx. Xxxxxx xxxxxxxxx se xx Seznam xxxxxxxx xxxxxx opatření xxxxxx xxxxxx.
(3) Xxx xxxxxxxx xxxxxxxx obecné povahy xxxxx xxxxxxxx 2 xx postupuje xxxxx xxxxxxxxx xxxx s xxx, xx
x) xxxxx xxxxxxxx obecné xxxxxx xx xxxxxxxx x xxxxxxxx xxxxxx povahy xx oznamuje xxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx,
x) xxxxx pro xxxxxxxxx xxxxxxxxxx x xxxxxx xxxxxxxx obecné xxxxxx xxxx 5 xxx xxx xxx xxxx xxxxxxxxxx,
x) opatření xxxxxx xxxxxx nabývá xxxxxxxxx xxxx xxxxxxxxxxxx xx xxx xxxx xxxxxxxxxx.
(4) X xxxxxxx, že Xxxxx postupem podle xxxxxxxx 1 dojde x xxxxxx, že x xxxxxxxx přípravku xxxxxxxxx na Xxxxxxx xxx nehrozí nebezpečí xxxxxxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxx xxxxxxxx x Xxxxx republice, xxxxx xxxx xxxxxxxxx xxxxxx xxxxxxxx, xx xxxxxxx xxxxx x xxxxxx xxxxxx xxxxx, Xxxxxxxxxxxx xxxxxxxxxxxxx. Xxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xx xxxxxxx xxxxxxxxxxx xxxxxxxxx mu xxxxxxxxxxxx xxxxx xxxx xxxxx xxxxx ke xxxxxxxx xxxxxx, xxxxxxxx xxxxx odstavců 2 x 3 xxxxxx xxxxxxxxx xx Seznamu xxxxxx.
§77x
Xxxxxxxx x xxxxxxxxx xxxxxxxxxxx léčivých xxxxxxxxx
(1) X xxxxxxx, že Xxxxx xxxxxx s xxxxxxxxxxxx k údajům xxxxxxxxxxxx zejména xx xxxxxxxx rozhodnutí o xxxxxxxxxx, xxxxxxxxxxxx x xxxxxxx, dojde uskutečněním xxxxxxxxxx xx zahraničí x xxxxxxxxxxxx tříměsíčním xxxxxx x nedostatku xxxxxxxx xxxxxxxxx, xxxxx xxxx nahraditelný xxxxx xxxxxxx xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx, xxxx xxxxxxxx xxxxxxxxx, xxxxx xxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxx xx xxxx xxxxxxxx xxxxxxxxxxx, pro xxxxxxxx potřeby xxxxxxxx x Xxxxx republice x tento nedostatek xxxxxxxx dostupnost x xxxxxxxx xxxxx pacientů x Xxxxx republice x xxxxxx xxxxxxx xx xxxxxxx zdraví xxxxxxxxxxxx x xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx zdravotních xxxxxx, xxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxx x xxxxxx xxxxxxxx xxxxx xxxxxxxx 3.
(2) Xxxxxx Xxxxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxx xxxxxxxxxxxxx xxxxxxx xx xxxxxxxx xxxxxxxxxx o xxxxxxxxxx, xxxxxxxxxxxx a xxxxxxx, xx
x) xx zřejmé, xx xxxxxxxx xxxxxx xxxxxxxxxxx léčivého xxxxxxxxx xxxx xxxxxxxx xxxxxxxxx xxx nepokrývá aktuální xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx, x
x) xxxxxxxx xxxxxxxxx důvody, xxx které xx xxxxxxxxxxx distribuce xxxxxxxxxxx xxxxxxxx xxxxxxxxx nebo xxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxx x xxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxx potřeb xxxxxxxx x České xxxxxxxxx.
(3) Xxxxxxxxxxxx xxxxxxxxxxxxx xxxx xxxxx k xxxxxxxxx xxxxxxxxxxx humánních xxxxxxxx xxxxxxxxx opatření xxxxxx xxxxxx, xxxxxx omezí xxxx zakáže xxxxxxxxxx xxxxxxxxxxx xxxxxxxx přípravku xx léčivých xxxxxxxxx xx xxxxxxxxx. Xxx xxxxxx xxxxxxxx opatření xxxxxx povahy xxxx xxx splněny xxxx xxxxxxxx:
x) jde x xxxxxx xxxxxxxxx, který xx xxxxxx xx Xxxxxxx,
x) xxxxxxxxxx xx xxxxxxxxx xx xxxxx xxxxx k xxxx, xx objem předmětného xxxxxxxx xxxxxxxxx, xxxxx xxxx xxxxxxxxxxxx jiným xxxxxxx xxxxxxxxxx odpovídajících xxxxxxxxx xxxxxxxxxx, nebo xxxxxxxx přípravků, xxxxx xxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxx xx xxxx xxxxxxxx vlastnostem, na xxxx v České xxxxxxxxx xxxxxxxxx dostatečně xxxxxxxx potřeby xxxxxxxx x Xxxxx xxxxxxxxx, x
x) veřejný zájem xx xxxxxxx xxxxxx xxxxxxxxxxxx x xx xxxxxxxxx dostupnosti xxxxxxxx xxxxxxxxx pro xxxxxxxx xxxxxxx pacientů x Xxxxx xxxxxxxxx xxxxxxxxx xxx individuálním zájmem xx uskutečnění xxxxxx xxxxxxxxxx xx xxxxxxxxx.
(4) Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxx xxxxxx xxxxxx, pominou-li důvody xxxx xxxxxx.
(5) Xxx xxxxxxxx opatření xxxxxx xxxxxx xxxxx odstavce 3 se xxxxxxxxx xxxxx §77x xxxx. 3 x tím, xx opatření xxxxxx xxxxxx nabývá účinnosti xxxx x xxx xxxxxxxx.
(6) Pokud Xxxxx xxxxxx, že již xxxxxxxxxxxxx xxxxxx xxx xxxxx xxxxxx opatření xxxxxx xxxxxx ohledně xxxxxxx distribuce do xxxxxxxxx x xxxxxxxxxxx xxxxxxxx přípravku xxxx xxxxxxxx xxxxxxxxx, xxxx x tom Ústav xxxxxxxxxxx xxxxxxxxx Ministerstvu xxxxxxxxxxxxx společně x xxxxxxxx, které xxx x xxxxxx xxxxxx xxxxx.
(7) Xxxxxxxxxxxx zdravotnictví, xxxxx xx z xxxxxx činnosti xxxxx x riziku xxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxx Xxxxx o xxxxxxxxxx xxxxx x xxxxxxx xxxxx §77x.“.
35. X §80 xx xx konci xxxxxxxx 1 xxxxxxxx xxxx „Xxxxxxxxxxxxx xxxxx xx povinen xxxxxx xxxxxxxxxx xxxxxxxxxxxxx znak, xx xxxxx xxxxxxx xxx uplatnit elektronický xxxxxx x xxxxxxxxxx xxxxx xxxxxx předepsaného xxxxxxxx xxxxxxxxx.“.
36. V §82 xxxx. 3 xxxx. x) xx za xxxxx „x vydaných xxxxxxxx přípravcích“ xxxxxxxx xxxxx „, a xx xxxxxxxxxxxx“, x xxxxx „xxxxxx xxxxx x xxxxxx xxxxxx xxxxxxxxxxx xxxxxx hlášení xxxxxxxx Xxxxx xx xxxx informačním xxxxxxxxxx“ xx xxxxxxxxx xxxxx „xxxxxxxxxxx údaje xxxxxxxx xxxxxxxxxxxx provozovatele oprávněného x xxxxxx, xxxxxxxxxxxx xxxxxxxxxxxxxxx lékaře, xxxxxxxxxxxx xxxxxxxx, kterému xxx xxxxxxxxx xxxxx, a xxxxxxxxxxxx xxxxxxxx léčivého xxxxxxxxx; strukturu xxxxx, xxxxxx, xxxxx x xxxxxx xxxxxxxx xxxxxx xxxxxxxxxxx prostřednictvím xxxxxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxx xxxxxx xxxxxxx“.
37. X §82 xxxx. 4 ve xxxx xxxxx xx xxxxx „xxxxx xxxxxxxx xxxx“ x „odebírající xxxxxxx nebo“ xxxxxxx.
38. X §82 xxxx. 4 ve xxxx druhé xx xxxxx „výjimečně“ xxxxxxx x xx xxxxx „xx xxxx xxxxxxx“ xx xxxxxxxx xxxxx „xxxxx výjimečně, a xx“.
39. V §101 xxxx. 1 xxx:
„(1) Xxx kontrole xxxxx xxxxxx xxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxxx xxxxxx xxxxxx xxxxxxx v §10 x xxxxxxxxxx xxxxx xxxxxxxxxxx řádu. Xxxxxxxx ke xxxxxxxx xx formu průkazu xxxxxxxxxx. Xxxxxxxxx se xxx xxxxxx xxxxxxxxx xxxxxxxx xxxxx xxxxxx xxxxxx i jiných xxxxxxxx xxxxxxxx prokazuje xxxxxxxx inspektora.“.
40. X §101 xxxx. 5 písmeno x) zní:
„e) v xxxxxxxxxxxx xxxxxxxxx, zejména x xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxx v xxxxxxx xxxxxxxxx xxxxxxxxx, xx x léčivým xxxxxxxxxx xxxxxxx xxxxx, xxxxx x xxxxxx xxxxxxxx xxxx xxxxx xxxxxx xxxxxx xxxxxxxxx, xxxxxxx xxxx xxxxxxx xxxxxxxxx; x tímto xxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxx x xxxxx xx xxxxxx xxxxxx x xxxxxxxx xxxxxxxxx x xxxxxxxx xxxx xxxxxx, xxxxxx a xxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx; tento xxxxxx xxxxxx je xxxxxxxx xxxxxxxxx x xxxxxxxx; xxxxxxxxxxxx osoba xx xxxxxxx xxxxxxxxx léčivý xxxxxxxxx xxxxxxxxxxxx xxxxx; x případě, že xxxxxxxxxxxx osoba xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx, provede xxxxxxxxx xxxx xxxxxx; x xxxxxx, xxxxxxxx odnětí xxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxx xxxxxx záznam, xxxxx je xxxxxxxx xxxxxxxxx x xxxxxxxx; xxxxxxx-xx xxxxx xxxxxxxxx xxxxxxxxx xxxx prokáže-li xx, xx xxxxxxxxx xxxxxx přípravky splňují xxxxxxxxx tohoto xxxxxx, xxxxx Ústav xxxx Xxxxxxxxxxx ústav xxxxxxxxxxxx xxxxx xxxxxxxxx léčivé xxxxxxxxx x neporušeném xxxxx; xxxxxxx xx xxxx xxxxxxxxx, xxxxxxx-xx xx, xx x xxxx zacházení s xxxxxxx xxxxxxxxxx x xxxxxxxx xxxxxxxxx x xxx xxxxxx xxxxx xxxxxxxxx nebo prokáže-li xx, xx xxxxxxxxx xxxxxx xxxxxxxxx nesplňují xxxxxxxxx xxxxxx zákona; x xxxxxxx xxxxxxx xxxx Xxxxx xxxx Xxxxxxxxxxx xxxxx rozhodnutí x propadnutí xxxx xxxxxxx xxxxxxxx přípravku; xxxxxx přípravky, se xxxxxxx zachází xxxxx, xxxxx x xxxxxxxx xxxxxxxxx xxxx xxxxxxxxx xxxxx tohoto xxxxxx, xx považují xx xxxxxx xxxxxxxxx, xxxxx xxxxxxxxx xxxxxxxxx xxxxxx xxxxxx; propadnuté xxxx xxxxxxx léčivé přípravky xx Ústav xxxx Xxxxxxxxxxx xxxxx xxxxxxx xxxxxxxxx xxxxx §88; xx xxxx xxxxxx xxxxxxxx x v xxxxxxx xxxxxx rozhodnutí x xxxxxxxxxx nebo xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxx xx xxxxxxxxx, xxxxxxxxxx xxxx xxxxxxx xxxxxx xxxxxxxxx xxxxxxx; x xxxxxxx xxxxxx rozhodnutí x propadnutí nebo xxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxxxxx osoba xxxxxxx xxxxxxx xxxxxxx xxxxxxxxxx Xxxxxxx xxxx Xxxxxxxxxxxx ústavem xxxxxxx x uskladněním zajištěných xxxxxxxx xxxxxxxxx x xxxxxxxxxxx propadnutých nebo xxxxxxxxx xxxxxxxx přípravků, x jejichž xxxx xxxxxxxx Xxxxx xxxx Xxxxxxxxxxx xxxxx.“.
41. V §101 xxxx. 5 závěrečné xxxxx xxxxxxxxxx xx xxxxx „x) xx x)“ nahrazují xxxxx „ x) xx x)“.
42. V §103 xxxx. 6 xxxx. x) se za xxxxx „do xxxxx“ xxxxxx slovo „, xxxx“.
43. V §105 xxxx. 2 se xx konci xxxxxxx x) xxxxx „xxxx“ xxxxxxx.
44. X §105 xx xxxxx xxxxxxxx 2 se xxxxx xxxxxxxxx xxxxxx x xxxxxxxx se xxxxxxx x) xx x), xxxxx xxxxx:
„x) xxxxxxxxx xxxxxxx xxxxxxxx přípravku xxxxx §77 xxxx. 1 xxxx. x),
x) x xxxxxxx s §77 xxxx. 1 xxxx. x) provede xxxxxxxxxx xxxxxxxx xxxxxxxxx xx zahraničí, xxxx
x) x xxxxxxx x xxxxxxxxx xxxxxx xxxxxx Xxxxxxxxxxxx zdravotnictví xxxxxxx xxxxx §77d xxxxxxxxxxx xxxxxx xxxxxxxxx do xxxxxxxxx.“.
45. X §105 xxxx. 5 xx xx písmeno x) xxxxxx nové xxxxxxx x), které xxx:
„x) xxxxxxxxxx xxxxx o xxxxxx dodávek xxxxxxxx xxxxxxxxx uvedeného na xxx v Xxxxx xxxxxxxxx xxxxx §33 xxxx. 2 xxxx xxxxxxxx,“.
Xxxxxxxxx xxxxxxx x) xx x) se xxxxxxxx jako e) xx x).
46. X §105 xxxxxxxx 6 xxx:
„(6) Xxxxxxxxx xx dopustí xxxxxxxxx deliktu xxx, xx v xxxxxxx x xxxxxxxxx o xxxxxxxxx xxxxxxxxx
x) provede xxxxxxxx xxxxxxxxx xxx xxxxxxxx xxxx x xxxxxxx x xxxxxxxxxx xxxxxxxxx x xxxxxxxx,
x) xxxxxxx xxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx xxx xxxxxxxx xxxx x xxxxxxx x xxxxxxxxxx xxxxxxxxx x xxxxxxxx,
x) xxxxxxx xxxxxxxx hodnocení x naléhavé xxxxxxx x xxxxxxx s xxxxxxxxxx stanovenými xxx xxxxxxxxx klinických xxxxxxxxx x naléhavých situacích,
d) xxxxxxxx
1. xxxxx x xxxxxxxx, xxxxxxxx přerušení, xxxxxxxxx zahájení, xxxxxxxxxx xxxxxxxx nebo xxxxxxxx xxxxxxxxxx xxxxxxxxx,
2. první xxxxxxxx xxxxxxx subjektu xxxxxxxxx x Xxxxx xxxxxxxxx xxxx
3. xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx x Xxxxx xxxxxxxxx,
x) xxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx,
x) xxxxxx xxxxx a xxxxx xxxxxxxxxxxxxxxxx xxxxxxx,
x) xxxxxxxxx xxxxxxx xxxxxxxxx na xxxxxxx neočekávané nežádoucí xxxxxx nebo x xxxx neinformuje xxxxxxxxxx xxxxx neprovede neodkladné xxxxxxxxxxxx opatření xxxxxxx xx xxxxxxx xxxxxxxx xxxxxxxxx, nezajistí kvalifikovaného xxxxxx xxxx kontaktní xxxxx xxxxx xxxxxxxx xxxxxxxxx xxxxx nezajistí xxxxxxxxx xxxxxxxxxx hodnocení x xxxxxxx x xxxxxxxxxx x xx xxxxxxxx xxxxxxx xxxxxxxx xxxxx,
x) nezajistí, xxx xxxxxxxxxx x ostatní xxxxx zapojené xx xxxxxxxxx klinického hodnocení xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx o klinickém xxxxxxxxx, xxxxx xxxxxxxx xxxxxxxxx x §54,
x) xxxxxxxx závažné xxxxxxxx xxxxxxxx x klinickém xxxxxxxxx, xxxxx klinické xxxxx xxxx xxxxxxxx xxxxxxxxx nebo neinformuje x nových skutečnostech, xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxx přijaté xx xxxxxxx subjektů xxxxxxxxx,
x) neposkytne xxxxxxxxxxxx xxxxxx informací pro xxxxxxxxxxxx xxxx xxxxx xxxxxx neaktualizuje,
k) nezaznamenává, xxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx o xxxxxxxxx xxxxxxxxx nebo nevede xxxx xxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx hodnocení x xxxxxxx x xxxxxxxxxx stanovenými nařízením x xxxxxxxxx xxxxxxxxx, xxxx
x) xxxx nekomerční xxxxxxxxx xxxx x xxxxxxxxxx xxxxxxxxx sjednané xxxxxxxxx xxxxxxxx.
XXXXX: 32014R0536
47. V §105 xx xxxxxx nový xxxxxxxx 7, xxxxx xxx:
„(7) Xxxxxxxxx se xxxx dopustí xxxxxxxxx xxxxxxx xxx, že
a) x rozporu x §58 xxxx. 2 xxxxx xx celou xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx sjednané pojištění xxxxxxxxxxxx xxx, xxxxxxxx xxxxxxxxxxxx x xxxxxxxxxxxx xx újmu vzniklou xxx xxxxxxxxx klinického xxxxxxxxx xxxx xxxxxxxxxx xxxxxxxx,
x) xxxxxx klinické xxxxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxx x §60 xxxx. 3,
x) xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx §61 xxxx. 2 xxxx. a),
d) nesplní xxxxxxxxxx povinnost xxxxx §61 xxxx. 2 xxxx. b), xxxx
x) xxxxxxxxxx xxxxxxxxxxxx léčivé xxxxxxxxx nebo xxxxxxxx xxxxxx xxxxxx podle §61 odst. 2 xxxx. c).“.
Dosavadní xxxxxxxx 7 x 8 xx označují jako xxxxxxxx 8 x 9.
XXXXX: 32014R0536
48. X §106 xxxxxxxx 3 xxx:
„(3) Xxxxxxxxxxx xxxxxxx osoba xx dopustí xxxxxxxxx xxxxxxx tím, že x rozporu x xxxxxxxxx x klinickém xxxxxxxxx
x) xxxx zkoušející, xx-xx x místě xxxxxxxxxx hodnocení pouze xxxxx xxxxxxxxxx, nebo xxxx xxxxxx xxxxxxxxxx, xx-xx x xxxxx xxxxxxxxxx hodnocení xxxx xxxxxxxxxxxx,
1. nezajistí provádění xxxxxxxxxx xxxxxxxxx v xxxxx xxxxxxxxxx xxxxxxxxx,
2. xxxxxxx písemně ostatním xxxxxx xxxx xxxxxxxxxxxx xxxxxx,
3. zahájí xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxxxxxxx souhlasu xxxxxxxx xxxxxxxxx xxxx xxxx xxxxxxxxx xxxxxxxx x xxxxxxxx xxxx xxxxxxx, xxx tento xxxxxxx xxxx xxxxxxxxx, nebo xxxxxxxxx xxxxxxx k xxxxxx nezletilé xxxxx, xxxx-xx xxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx,
4. xxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxxxxx xxxxx xxxxxxxx hodnocení xxxx xxxx zákonnému xxxxxxxx,
x) xxxx xxxxxxxxxx xxxxxxxxxxx, nezdokumentuje xxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxx xxxxxxxxxxx xxxxxxxx,
x) xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxx x xxxxxxxxxxx xxxxxxxxxx hodnocení,
d) nepřijme xxx xxxxxxxxx klinického xxxxxxxxx xxxxxxxx xxxxxxxx x ochraně xxxxxxxx xxxxxxxxx,
x) provádí xxxxxxxx xxxxxxxxx xxxx xxxxxxxxxx, xxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxx xxxxxxxx xxxxxxxxx x §54, nebo
f) nedodržuje xxxxxx správné xxxxxxxx xxxxx xxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx.“.
XXXXX: 32014R0536
49. X §107 xxxx. 1 písm. x) zní:
„a) 100 000 Xx, jde-li x xxxxxxx xxxxxx xxxxx §105 odst. 6 xxxx. d) xxxx 2 xxxx 3, §105 xxxx. 6 xxxx. x), §106 xxxx. 3 xxxx. x) xxxx x) nebo §106 xxxx. 5 xxxx. x),“.
50. X §107 xxxx. 1 xxxx. x) se xxxxx „§106 xxxx. 3 xxxx. a) nebo x)“ xxxxxxxxx xxxxx „§106 odst. 3 xxxx. x)“.
51. X §107 xxxx. 1 xxxx. x) xx slova „x), x), o), x) nebo x)“ xxxxxxxxx slovy „h), x), p), x) xxxx x)“.
52. X §107 xxxx. 1 xxxx. x) se slova „§105 odst. 6 xxxx. x), x), x), x) až x)“ xxxxxxxxx slovy „§105 odst. 6 xxxx. c) nebo x) xxxx 1, §105 xxxx. 6 xxxx. x), f), x), x), x), x),“.
53. X §107 xxxx. 1 xx xx konci textu xxxxxxx x) doplňují xxxxx „xxxx §106 xxxx. 3 xxxx. x), e) xxxx x)“.
54. V §107 xxxx. 1 xxxx. x) xx slova „x), x), l), x), x), r), x), t), u), x)“ nahrazují xxxxx „x), l), x), x), r), s), x), u), x), x)“.
55. X §107 xxxx. 1 xxxx. x) xx slova „x), x), g) xxxx m)“ xxxxxxxxx xxxxx „x), x) xxxx x)“.
56. X §107 xxxx. 1 xxxx. x) xx xx xxxxx „§104 odst. 7 písm. x) xxxx x),“ xxxxxxxx xxxxx „§105 xxxx. 2 xxxx. r) xx x),“.
57. V §107 xxxx. 1 písm. x) xx xxxxx „x), x), x), x), x) xxxx x)“ xxxxxxxxx xxxxx „ x), f), x), j), x) xxxx x)“.
58. X §107 xxxx. 2 se xx xxxxx „xxxxx“ xxxxxxxx slova „§105 xxxx. 2 xxxx. x) x“.
59. X §108 xxxxxxxx 5 xxx:
„(5) Xxxxxxx xxxxx xx xxxxxxx přestupku tím, xx x rozporu x xxxxxxxxx x xxxxxxxxx xxxxxxxxx
x) xxxx xxxxxxxxxx nebo xxxxxx xxxxxxxxxx
1. xxxxxxxxx provádění xxxxxxxxxx xxxxxxxxx v xxxxx xxxxxxxxxx xxxxxxxxx,
2. xxxxxxx xxxxxxx ostatním xxxxxx týmu xxxxxxxxxxxx xxxxxx,
3. xxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxx jeho xxxxxxxxx xxxxxxxx s xxxxxxxx těch případů, xxx xxxxx xxxxxxx xxxx vyžadován, xxxx xxxxxxxxx svolení x xxxxxx nezletilé xxxxx, xxxx-xx xxx dané xxxxxxxx xxxxxxxxx xxxxxxxxxx,
4. xxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxx xxxx xxxx xxxxxxxxx xxxxxxxx,
x) jako zkoušející xxxxxxxxxxx, nezdokumentuje xxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxx laboratorní xxxxxxxx,
x) xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxx x xxxxxxxxxxx xxxxxxxxxx hodnocení,
d) xxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx okamžitá opatření x ochraně xxxxxxxx xxxxxxxxx,
x) xxxxxxx klinické xxxxxxxxx xxxx zkoušející, xxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxx xxxxxxxx xxxxxxxxx x §54, nebo
f) xxx xxxxxxxxx xxxxxxxxxx hodnocení xxxxxxxxxx zásady správné xxxxxxxx praxe.“.
CELEX: 32014R0536
60. X §108 xx xx xxxxxxxx 7 xxxxxx xxxx xxxxxxxx 8, který xxx:
„(8) Xxxxxxx xxxxx xx xxxx xxxx xxxxxx xxxxxx Xxxxxxxx xxxxxx pro xxxxxxxx xxxxx dopustí xxxxxxxxx xxx, že x xxxxxxx x §53x xxxx. 5 poruší xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx.“.
Xxxxxxxxx xxxxxxxx 8 a 9 xx xxxxxxxx xxxx xxxxxxxx 9 x 10.“.
61. X §108 xxxx. 8 xxxx. x) xx xxxxx „x)“ xxxxxxxxx xxxxxx „x)“.
62. V §108 xxxx. 8 písm. x) xx xxxxx „x) nebo x)“ xxxxxxxxx xxxxx „b) xxxx x)“.
63. X §108 xxxx. 8 xx xx xxxxx textu xxxxxxx x) xxxxxxxx xxxxx „xxxx odstavce 5 písm. x), x) nebo x)“.
64. X §108 xxxx. 8 xxxx. x) se xxxxx „xxxx xxxxxxxx 5 xxxx. x)“ xxxxxxx.
65. V §108 xx xxxxxxxx odstavec 11, xxxxx xxx:
„(11) Xx přestupek xxxxx xxxxxxxx 8 se xxxxx zákaz činnosti.“
66. Xx §108 xx xxxxxxxx xxxx §108x a 108x, xxxxx xxxxxx nadpisů xxxxx:
„108x
Xxxxxxxxxx léčivého přípravku
(1) Xxxxxxxxxx xxxxxxxx přípravku xxx xxxxxx, xxxxxxxx xxxxxx xxxxxxxxx náleží xxxxxxxxx správního deliktu, x
x) xxx ke xxxxxxxx xxxxxxxxx xxxxxxx xxxx xxxx xxxxx, xxxx
x) xxx x xxxxxxxxxxx xx xxxxxxxxx xxxxxxxxx deliktu xxxxxx.
(2) Xxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx se stává xxxx.
108x
Xxxxxxx xxxxxxxx přípravku
(1) Xxxxxx-xx uloženo propadnutí xxxxxxxx přípravku, xxxxxxxxx x §108x odst. 1 xxxx. x) xxxx x), xxx xxxxxxxxxx x xxxx xxxxxxx, jestliže
a) náleží xxxxxxxxx xxxxxxxxx xxxxxxx, xxxxxxx xxxxx za xxxxxxx delikt xxxxxx,
x) xxxxxxxx xxxxxxxxx správního xxxxxxx nebo mu xxxxxxxx zcela, nebo
c) xxxxxxxx není xxxx.
(2) Xxxxxxxxxx zabraného léčivého xxxxxxxxx se xxxxx xxxx.“.
67. X §112 xx xx odstavec 5 vkládá nový xxxxxxxx 6, xxxxx xxx:
„(6) Xxxxxxxx-xx tak xxxxx, xxxxxxx Ústav x prostředků účtu xxxxxxxx podle xxxxxxxx 5 xx xxxxxxxx xxxx xxxxxxxx xxxxxxxx Xxxxx xxxxxxxxx xxxxxxx xxx Xxxxxxxxxxxx zdravotnictví xxxxxx xx výši xxxxxxxxx xxxxxx.
Xxxxxxxxx xxxxxxxx 6 x 7 xx xxxxxxxx xxxx 7 x 8.“.
68. X §114 xxxx. 1 xx xx xxxxx „§24 xxxx. 2, 3, 4, 8 x 9,“ xxxxxxxx xxxxx „§33 xxxx. 2,“, xx xxxxx „§67 xxxx. 10 x 11,“ xx xxxxxxxx xxxxx „§77 xxxx. 1 xxxx. x) x q),“ x xx konci xxxxx xxxxxxxx 1 se xxxxxxxx slova „a §82 odst. 3 xxxx. x)“.
69. X §114 xxxx. 2 se xxxxx „§51 xxxx. 2 xxxx. x), §52 xxxx. 6, §53 odst. 1, 8, 12 x 13, §54 xxxx. 1, §55 odst. 7 xx 9, §56 xxxx. 1 xxxx. x), §56 xxxx. 3 x 7, §57 xxxx. 2, §58 odst. 8, §59 xxxx. 1“ xxxxxxxxx xxxxx „§53x odst. 2, §54 odst. 4, §56 xxxx. 6“.
70. X §114 xxxx. 2 xx xxxxx „§60 odst. 2, 4, 5 x 9, §61 xxxx. 2 písm. x) x b) xxxx 1 a 6, §61 xxxx. 2 písm. c), §61 odst. 4 xxxx. x),“ zrušují.
71. V §114 xxxx. 2 xx xx slova „§77 xxxx. 1 xxxx. x),“ vkládá xxxxx „x),“.
72. X §114 xxxx. 4 se xx xxxxx „§48 xxxx. 2, 3 x 6“ xxxxxxxx xxxxx „, §60 xxxx. 2, 4, 5 x 9, §61 xxxx. 2 xxxx. x) x x) xxxx 1 x 6, §61 xxxx. 2 písm. x), §61 odst. 4 xxxx. e)“.
Xx. XX
Xxxxxxxxx ustanovení
1. Xxxxx xxxx xxxxxx o povolení xxxxxxxxxx xxxxxxxxx xxxxxxxxxx Xxxxxxxx ústavu xxx xxxxxxxx xxxxx xxxxx xxxx, kterým xxxxxx 6 měsíců ode xxx zveřejnění oznámení Xxxxxx v Xxxxxxx xxxxxxxx Xxxxxxxx xxxx xxxxx čl. 82 xxxx. 3 nařízení Xxxxxxxxxx xxxxxxxxxx a Xxxx (XX) č. 536/2014 xx xxx 16. xxxxx 2014 o xxxxxxxxxx hodnoceních xxxxxxxxx xxxxxxxx xxxxxxxxx x x xxxxxxx xxxxxxxx 2001/20/XX, xxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxx xxxx dosavadními xxxxxxxx xxxxxxxx, a xx xx xxx, kterým xxxxxxxx 42 měsíců xxx xxx xxxxxxxxxx xxxxxx oznámení.
2. Pokud xxxx xxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx Xxxxxxxx ústavu xxx xxxxxxxx xxxxx po xxx, kterým uplynulo 6 xxxxxx xxx xxx xxxxxxxxxx xxxxxxxx Xxxxxx podle čl. 82 xxxx. 3 xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx (XX) x. 536/2014 ze dne 16. xxxxx 2014 x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x o xxxxxxx xxxxxxxx 2001/20/XX&xxxx; xxxxxxxxxx xxxx do xxx, xxxxxx xxxxxxxx 18 xxxxxx xxx dne xxxxxxxxxx tohoto xxxxxxxx, xxx xxxxxxx xxxxxx x xxxxxxxx klinického xxxxxxxxx xxxxxxx xxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxx xxxx xxxxxxxxxxx právními xxxxxxxx, x xx xx dne, kterým xxxxxxxx 42 měsíců xxx xxx xxxxxxxxxx xxxxxx oznámení.
ČÁST XXXXX
Xxxxx xxxxxx x státní službě
Xx. XXX
X §2 xxxxxx č. 234/2014 Xx., o státní xxxxxx, ve xxxxx xxxxxx x. 131/2015 Xx., xxxxxx č. …/2016 Xx. x xxxxxx x. …/2016 Xx., xx na xxxxx xxxxxxxx 1 xxxxx nahrazuje xxxxxx x xxxxxxxx se xxxxxxx x), které xxx:
„x) xxxxx Etické xxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx.“.
XXXX XXXXX
Xxxxxxxxx xxxxxxxxxx
Xx. IV
Technický xxxxxxx
Xxxxx xxxxx xxx xxxxxxx x souladu xx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (EU) 2015/1535 ze dne 9. xxxx 2015 x xxxxxxx xxx xxxxxxxxxxx informací x xxxxxxx technických předpisů x xxxxxxxx xxx xxxxxx informační společnosti, x xxxxxxx znění.
Čl. V
Účinnost
Tento xxxxx xxxxxx účinnosti xxxxxx xxxx xxxxxxxxxxxx měsíce xxxxxxxxxxxxx xx xxx xxxx vyhlášení, s xxxxxxxx xxxxxxxxxx
x) čl. X bodu 21, xxxxx jde o §51, §52 a §53 odst. 2, xx. X bodu 22, xxxxx xxx x §53x xxxx. 7, §53b xxxx. 1, 2, 3 x §53c odst. 1 xx 8, x čl. X xxxx 23, které xxxxxxxx xxxxxxxxx uplynutím 6 xxxxxx xxx xxx xxxxxxxxxx xxxxxxxx Xxxxxx x Úředním xxxxxxxx Xxxxxxxx xxxx xxxxx čl. 82 xxxx. 3 xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) č. 536/2014 xx xxx 16. xxxxx 2014 x xxxxxxxxxx hodnoceních xxxxxxxxx xxxxxxxx xxxxxxxxx x x xxxxxxx směrnice 2001/20/XX; xxx, kdy xxxx xxxx xxxxxxxx xxxxxxxxxx, xxxxxx Ministerstvo xxxxxxxxxxxxx xxxxxx xxxxxxx xx Sbírce zákonů;
b) xx. X xxxx 21, xxxxx jde x §53 xxxx. 1, 3 x 4, x xx. X xxxx 22, xxxxx xxx x §53x odst. 1 xx 6, §53b xxxx. 4, 5 x §53c odst. 9, které xxxxxxxx xxxxxxxxx xxxxxx xxxx xxxxxxxxxxxx xxxxxx následujícího xx xxx xxxxxxxxxx xxxxxxxx Xxxxxx x Xxxxxxx věstníku Xxxxxxxx xxxx xxxxx čl. 82 xxxx. 3 xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 536/2014 xx xxx 16. xxxxx 2014 x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x x xxxxxxx xxxxxxxx 2001/20/XX; den, xxx xxxx xxxx xxxxxxxx xxxxxxxxxx, xxxxxx Xxxxxxxxxxxx zdravotnictví xxxxxx xxxxxxx xx Sbírce xxxxxx;
x) xx. I xxxx 5, 7, 9, 28, 29 x30, xxxxx xxxxxxxx xxxxxxxxx xxxxxx dnem xxxxxxxx kalendářního xxxxxx xxxxxxxxxxxxx xx jeho xxxxxxxxx.
XXXXXXX XXXXXXXXX XXXXXX XXX
|
Xxxxx xxxxxx xxxxxx: Xxxxx zákona, xxxxxx xx xxxx zákon č. 378/2007 Sb., o xxxxxxxx x o xxxxxxx xxxxxxxxx xxxxxxxxxxxxx zákonů (xxxxx x xxxxxxxx), xx xxxxx pozdějších xxxxxxxx |
|
|
Xxxxxxxxxxx / zástupce xxxxxxxxxxxxx: Xxxxxxxxxxxx xxxxxxxxxxxxx |
Xxxxxxxxxxxxx xxxxxx xxxxxx xxxxxxxxx: 28.5.2016 |
|
Xxxxxxxxxxxx xxxxx EU: XXX (částečná, xx. x xxxxx adaptace xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx (XX) č. 536/2014 xx dne 16. xxxxx 2014 x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx přípravků x x zrušení xxxxxxxx 2001/20/XX) |
|
|
- xxxxxx xxxxxx xxxxxxxxx xxx xxxxxxxxxxxx: 28.5.2016 - xxxxxx, xxx xxx návrh xxx xxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx XX?: XX |
|
|
2. Xxx návrhu xxxxxx |
|
|
Xxxxxxx xxxxx návrhu xxxxxx je xxxxxxxx xxxxxxxx xxxxxxxx Evropského xxxxxxxxxx a Xxxx (XX) č. 536/2014 xx xxx 16. dubna 2014 o klinických xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x x xxxxxxx směrnice 2001/20/XX x podmínkách České xxxxxxxxx xxxxxxxxxxxxxxx xxxxxx xxxxxx o léčivech. Xxxxx xxxxxxxx xxxxxx, xxxxx xxxx xxxxxxxxx x. 536/2014 xxxxxxxxx xxxxx přikázány xxxxxxx xxxx xx xxxxxxx xxxx zmocněn xx xxxxxxx. Xxxxx je xxxxxxxxx xxxx, xxx xxxxxx úprava v Xxxxx republice vhodně xxxxxxxxx xxxxx provádění xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxx celou Evropskou xxxx xxxxxxxxx č. 536/2014. |
|
|
Xxxxxx xxxxxxx cílem návrhu xxxxxx xx xxxxx xxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx pacientů x Xxxxx republice xx xxxxxx xxxxxxx xxxxxx xxxxxx a zdraví, x to xxxxxxxxxx xxxxxxx sledování x xxxxxxxxxxxxx xxxxxx nedostupnosti xxxxxxxx přípravků xxx xxxxxxx xxxxxxxx x Xxxxx republice a xxxxxxxxx xxxxxxxxxxx opatření xxxxxxxxxxx distribuci xxxxxxxx xxxxxxxxx xxxxxxxx xxx xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx do xxxxxxxxx (reexport) v xxxx xxxxxxxxx, xxx xxxxxxxxxxx xxxxxx hrozby xxxxxxx xxxxxxxx opatření xxxxxxxxxx. Xxxxxxx xx xxxxxx xx nejméně xxxxxxx zainteresované xxxxxxxx x xxxxxxxxxxx xxxxxx xxxxxxx pohybu xxxxx xxxxxxxxxx x xxxxxxxxxx Xxxxxxxx unie. |
|
|
Mezi další xxxx návrhu xxxxxx xxxxx xxxxxxxx xxxxxxxx xxxxxxxx Komise v xxxxxxxxx xxxxxxxxx (XX) č. 1252/2014 xx xxx 28. xxxxxx 2014 xxxxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX, xxxxx xxx x xxxxxx x xxxxxx xxxxxxx xxxxxxx xxxxx xxx účinné xxxxx xxx xxxxxxx xxxxxx xxxxxxxxx, xxxx xxxxxxxx xxxxxxx předpoklady xxx xxxxxxxxxxxx xxxxxxxxxx Xxxxxxxx ústavu pro xxxxxxxx léčiv x Xxxxxxxxxx xxxxxxxxxxxx xxx xx xxxxxx xxxxxxxxxxxx xxxxxxx léčiv a xxxxxxxxx xxxxxxxxx x xxxx, účelněji xxxxxxx xxxxxxxxxxx xxxxxxxxxx xxx xxxxxxxxx xxxxxxxx x xxxx xxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxx léčivých xxxxxxxxx xxx, aby xxxx xxxxxxxxxx x xxx takové xxxxxxx, xxx xx zjištěno, xx x xxxx xxxxxxxxx xxxxx, které x xxxx xxxxxx xxxxx xxxxxx oprávněny. |
|
|
3. Xxxxxxxxxx dopady xxxxxx xxxxxx |
|
|
3.1 Xxxxxx xx xxxxxx xxxxxxxx a xxxxxxx xxxxxxx xxxxxxxx: XXX |
|
|
Xxxxxx na státní xxxxxxxx Xxxxxxxx xxxxxxxx xx xxxxxxxxxx xxxxxxxxx Xxxxxxxx xxxxx xxxxxxxxxx xxxxxx za xxxxxx xxxxxxxx xxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxxxxxx humánních xxxxxxxx xxxxxxxxx xxxx představován xxxxxxxxx xxxxxx navýšení xxxxxxxxxx xxxxxx xx xxxxxx Xxxxxxxx xxxxxx xxx kontrolu xxxxx xxx xxxxxxx zajištění xxxxxx xxxxx x xxxxxxxxx spojených x xxxxxxxxx (x xxxxx 32 úvazků). Xxxxxxxxx xxxxx pracovníků xxxx xxxxx zabezpečit další xxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxx (5), posuzovatelů xxxxxxxxxxxxx xxxxxxxxx (2), xxxxxxxxxxxx xxxxxxxxxxxxxx xxx xxxxxxxxxx xxxxxxxxx (1) xxxxxxxxxx (5), koordinátorů xxxxxxxxxx xxxxxxxxx (3), x xxxxxxxxxx zajištění xxxxxxxxx-xxxxxxxxxxxxx xxxxxx xxx xxxxxxx xxxxxx - při xxxxx 8 skupin xxxxxx xxxxxx - 16 xxxxxx). Xxxx xxxxxx xxxxx částečně xxxxx x xxxxxxx xxxxxx xx xxxxxxxx xxxxxxxxx (xxxxxx komise). Xxx xxxxxxxx krytí xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx systému etické xxxxxx xxxx poradního xxxxxx Xxxxxxxx xxxxxx xxx kontrolu xxxxx xxxx xxxxxxxxx x xxxxx finanční prostředky x xxxxxx poskytnutého x XX xxxxx, x xxxxx bude xxxxx z xxxxxx xxxxxx xx klinická xxxxxxxxx xx xxxxxxxxxxx xxxxxxx xxxxxxxx xxxxx. |
|
|
Xx xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxx nová agenda xxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxxx o xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx. Bude xxxxx xxxxxxxxxx xxxxx xxxxxx právního xxxxxxxxx x jednu pozici xxxxxxxxx xxxxxxxxx. |
|
|
Xxxxxxx reexportů |
|
|
Finanční xxxxx xxxxxxxxxx xxxxxx xxxxxx za účelem xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx na státní xxxxxxxx xxxx představován xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxxx xxxxxx na xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx (2 xxxxxx - 1 xxxxxx referent x 1 xxxxxxx xxxxxxxx xxx agendu xxxxxxxx opatření xxxxxxxxxxxx xxxxxxxxxx). Xx xxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx léčiv dojde x navýšení x 2 xxxxxxxx xxxxxx xx xxxxxx zajištění xxxxxxxxx x vyhodnocování xxxxxx xxxxxxxxxxxxx léčivých xxxxxxxxx xxx potřeby xxxxxxxx v Xxxxx xxxxxxxxx a xxxxxxxxx xxxxxxxxxxx xxxxxxx Ministerstvu. |
|
|
Ostatní xxxxxxxxxxx body |
|
|
Dopad xxxxxxxxx xxxxxxxxxxxx novelizačních xxxx xxxxx xxxxxxxxx předpokládat. Xxxxx se x xxxxx xxxxxx zkvalitňující xxxxxxxxx xxxxxx úpravu (xxxx. xx xx xxxx xxxxxxxxxxx xxxxxxxxxx). |
|
|
Xxxxxxxxx xxxxx na ostatní xxxxxxx rozpočty, xxxxxxx xx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx pojištění xxxxx xxxxxx xxxxxxxxx, avšak xxx xxxxxxxxxxxx, že xxxxx xxxxx xxxx xxxxx xxxxxxxxx. |
|
|
Xxxxxxx |
|
|
Xxxxxxxx nařízení xx klinickému hodnocení |
|
|
Kvalitní xxxxxx prostředí xxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx x atraktivitě Xxxxx xxxxxxxxx xxx xxxxxxxxx xxxxxx xxxxxxxxx. Xxxxxx xxxxxxxxx se xxx xxxxxxxx xxxxxxxxxxxxx xxxxxx přípravky x xxxxxxxxxxx xxxxxxx dobách xx zajištěním xxxxxxxxxxx xxxxxxxxxxxxxx xxxxx. Xxxxxxxxx xxxxxxxxxx xxxxxxxxx xx xxxxx Xxxxx xxxxxxxxx xxxxx xxxxxxx Xxxxx xxxxxxxxx xx xxxxx. Xxxxxxxxx dopady xxx xxxxxxxxxxxx i do xxxxx akademické. |
|
|
Omezení reexportů |
|
|
Právní xxxxxx zajišťující xxxxxxxxxxxxx xxxxx x xxxxxxx xxxxxx nedostupnosti xxxxxxxx xxxxxxxxx xxxxxx efektivně xxxxxxxxxx xxxxx x xxxx případech, xxx xx distribuce léčivých xxxxxxxxx zapříčinila xxxxxxxxxxxx xxx léčbu xxxxxxxxxx xxxxxxxx xxxxxxxxx. Xxxxxxxx xxx xxxx xxxxxxxxx xxxxxxxx xxxx xxxxx x xxxxxxxxx xxxxxxxx xxxxxx. Xxxxxxxxxx právní xxxxxx přispěje ke xxxxxxxxxxx xxxxxxxxxxx zdravotní xxxx, za xxxxxx xxxx xxxxxxxxx xxxxxxx xxxxx, xx xx xxxx zajištění xxxxxxxxxxx xxxxxxxx xxxxxxxxx. Xxxxxxxxx xxxxxxxxxxx významných léčivých xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx xx xxxxxx xxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxx léčivých xxxxxxxxx. |
|
|
Xxxxxxx xxxxxxxxxxx body |
|
|
Přínosy xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxxx xxxx lze xxxxxxxxxxxx x xxxxxxx xx xx, xx se xxxxx x xxxxx xxxxx, xxxxx zpřesňují xxxxxxxxx xxxxxx xxxxxx (xxxx. co xx xxxx xxxxxxxxxxx xxxxxxxxxx). |
|
|
3.2 Xxxxxx xx podnikatelské xxxxxxxx: ANO Adaptace nařízení xx xxxxxxxxxx hodnocení |
|
|
Nepředpokládají xx xxxxxxxx negativní xxxxxx xx xxxxxxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxxxx hodnocení. Xxxxxx xxxxxxxxxx xxxxxxxxx bude xxx nařízení nově xxxxxxxxxxxxx (xxxxxxxx žádostí xxxxxxxxxxxxxxx jednotného xxxxxxxxxx xxxxxxx) x dochází xx xxxxxx xxxxxxx xxxxxxxxx. Xxxxxxx tak xxxx xxxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxx se x xxxxxx xxxxxxxxxx xxxxxxxx, xxxxx xxxx x xxxxxxxx části xxxxxx již x xxxxxxxx. Xxxxxxx xxxxxx xx xxxx xxxxxx xx xxxx xxx xxxxx celkovým snížením xxxxxxx xxxxxx za xxxxxxxxxx klinických xxxxxxxxx, xxxxx xxxxxxx výdajů xxxx kryta xxxxxx xxxxxxx xxxxxxxxxx jak xxxxxxxxx Xxxxxxx xxxxxxx xxx kontrolu léčiv, xxx xxxxxxx xxxxxx (xxxx xxxxxxxx xxxxxxxx). |
|
|
Xxxxxxx xxxxxxxxx |
|
|
Xxxxxxxxxxxxx xx xxxxxx xx podnikatelské prostředí xx směru zavedení xxxxxxxxxx xxxxxxxxxxxx léčivých xxxxxxxxx oznamovat regulačním xxxxxx plánovanou xxxxxxxxxx xxxxxxxx přípravků určených xx trhv Xxxxx xxxxxxxxx xx zahraničí x dále x xxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx xxxxx spočívající x xxxxxxx xxxxxxxxxx. Xxxxxx xxxxxxxxxx xxxxxx úpravy xx distributory léčivých xxxxxxxxx xxxx xxxx xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx x xxxxxxxxxxxxxxx systému. |
|
|
Určitý xxxxx xxxxxxxxxx xxxxxx xxxxxx opatření xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxx xxx xx xxxxxxxx xxxxxxxxxx léčivých xxxxxxxxx. Xxxxx xxxxx xxxx xxxxxxxxx x xxxxxxx x xxxxxxxx povinnosti xxxxxxxxxxxx poskytování xxxxx x množství xxxxxxxx xxxxxxxxx dodaných xx Xxxxx xxxxxxxxx. X xxxxxxxx době xx xxxxxxxx xxxxxxxxx zákonem xxxxxxx, xxxxx xxxxxxxxxxx xxxxx nemá v xxxxxx xxxxxx xxxxxx xxxxxxxxx časový xxxxx. X konečném xxxxxxxx xxxx xxx xxxxxx xxxxxx omezení xxxxxxxxx x xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xx xxxxxxxx rozhodnutí x xxxxxxxxxx. Xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxx k xxxxxxx xx xxxxxxxxxx xxxx xxxx XX. X xxxxxxxxxxxx zemích XX xxxx xxxxxx xxxxx xxxxxxxxx xxxxxxxxx xxxx xxxxxxxx xxxxxxxxx, xx xxxxx xx xxxxx xxxxxxxx xx xxx uvádět. Držitelé xxxxxx xxx xxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx profitují více xx trzích x xxxxx cenovou xxxxxxxx. Xxxxx xxxxxx xxxxxxxxx, xx držitelé by xxxxxxxx xxxxx xx xxxx x xxxxxxxx xxxxxxx xxxxxxxx, xxxx xxxxxxx xx pro xx byla xxxxxxxxxxxxx. Xxxxxxxxx xxxxxxxxxx xxxxxxx xx xxxxxx, do xxxxxxx xx reexportováno, x cenové xxxxxxx, xxx xxxx je xx xxxx xxxxxxxx x xxxxxxxxxx xx xxxx xxxxxx: 1. Xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx může xxxx xx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxxx držitel xxx x za xxxxx xxxx; 2. xxxxx xx xxxxxxxxxxxxx importován xxxxxxxxx původně xxxxxxx xxxxxx xxxxxxxxx x xxxx xxxx xx xxxxx cenu xxxx xxxx xxxxxx xxxxxx x dalšímu xxxxxxx xxxx xxxxxxxx xxxxxxxx xxxxxxxxx na xxxxx xxxx xxxx celku. Xxxxxx xx cenová xxxxxx samozřejmě žádoucí, xxxxxxx paralelní obchod xx xxxx xxxxxxxx xx xxxxxxxx xxxxxxxx xxxxxxxxx. |
|
|
Xxxxxxx xxxxxxxxxxx xxxx |
|
|
X xxxxxxx na xx, xx xx nejedná x významné xxxxx, xxxxx xx zanedbatelný. |
|
|
3.3 Xxxxxx xx xxxxxx xxxxxxxxxxx xxxxx (xxxx, xxxxx): XX |
|
|
Xxxxxxxxxxxxxxx xx xxxxx xxxxxx xx xxxxxx xxxxxxxxxxx celky. |
|
|
3.4 Xxxxxxxx xxxxxx: XX |
|
|
3.5 Xxxxxx xx xxxxxxx xxxxxxxxx: XX |
|
|
Xxxxxxxxxxxxxxx se xxxxx xxxxxx xx xxxxxxx prostředí. |
|
101) Nařízení Xxxxxx v xxxxxxxxx xxxxxxxxx (XX) č. 1252/2014.“.
104) Xxxxxxxx Evropského xxxxxxxxxx x Xxxx (XX) č. 536/2014.“.
102) Xxxxx č. 227/2006 Sb., x xxxxxxx xx xxxxxxxx embryonálních xxxxxxxxx xxxxxxx x xxxxxxxxxxxxx xxxxxxxxxx a x xxxxx xxxxxxxxx souvisejících xxxxxx, xx znění xxxxxxxxxx předpisů.
103) Například xxxxxxxx zákoník, trestní xxxxxxx, xxxxx č. 101/2000 Sb., xx xxxxx pozdějších xxxxxxxx.
Čl. 75 xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 536/2014.“.
DŮVODOVÁ XXXXXX
XXXXXX ČÁST
A. Xxxxxxxxx xxxxxx o xxxxxxxxx xxxxxx regulace (XXX)
1. Xxxxx předložení a xxxx
1.1. Název
Návrh xxxxxx, xxxxxx xx xxxx xxxxx č. 378/2007 Sb., x xxxxxxxx x x xxxxxxx některých xxxxxxxxxxxxx xxxxxx (zákon x xxxxxxxx), xx xxxxx xxxxxx x. 124/2008 Xx., zákona č. 296/2008 Sb., zákona x. 141/2009Xx., xxxxxx x. 281/2009 Xx., xxxxxx x. 291/2009 Xx., xxxxxx x. 75/2011 Xx., xxxxxx x. 375/2011 Xx., xxxxxx x. 50/2013 Xx. x xxxxxx x. 70/2013 Sb.
1.2. Xxxxxxxx problému
V současné xxxx xx xxxxxxxxxxxx xxxxxxxxx xxxxxxx, účinnosti x bezpečnosti humánních x xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx upravena xxxxxxx x xxxxxxxx x xxxx xxxxxxxxxxx předpisy. Xxxxxx právními xxxxxxxx xxxx xx xxxxxxxx xxxx České republiky xxxxxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxx x xxxxxxx humánních x xxxxxxxxxxxxx xxxxx, xxxxx byla xxxxxxx x Xxxxxxxx unii xxxx vydáním xxxxxx xxxxxx.
Xxxxx o xxxxxxxx xxx xxx celkem xxxxxxxxxxxx xxxxxxxxxxx, přičemž xx xx xxxxxx xxxxxx xxxxxxxxxx xxxxxxx č. 70/2013 Sb. nešlo o xxxxxx xxxxxxxxxx, xxxxx xx xxxxxxxx xxxxxxxx xx obsahu zákona xxxxxxx x výrazně xxx xxxxxx; šlo x xxxxxx víceméně xxxxx, xxxxx xxxxxxxxx xxxxx zákona xxxxx xxxxxxx x xxxxxxxx xxxxx.
Xxxxxxxxxxx návrh novely xxxxxx xxxxxxx xxxxxxxx x xxxx, aby Xxxxx xxxxxxxxx xxxx x nadále xxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxx Xxxxxxxx xxxx x xxxxxxx xxxxx, x xx především x xxxxxxx klinického xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx. Xxxx xx xxx xxxxx xxxxx xxxxxx xxxxxxx xxxxxxx x xxxxxxx funkci a xxxxxxxxxx tohoto xxxxxxx x k xxxx, xxx xxxxxxx xxxxxxxx xxxxxxxxxxxx a xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxxxxx xxxxxxxx x xxxxxxxxxxx za účelem xxxxxxxxxxx odborných záruk x oblasti xxxxxxx xxxxxxxxx xxxxxx x xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxx x xxxxxxxxxx xxxxxxx xxxxxxxxxx x xxxxx xxxxxxxxxx hodnocení.
1.2.1. Xxxxxxxx xxxxxxxx x klinických xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx
Xxx 16. xxxxx 2014 xxxx xxxxxxx xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx (XX) č. 536/2014 o xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx léčivých xxxxxxxxx x x xxxxxxx směrnice 2001/20/ES. Xxxxx článku 99 xx xxxx nařízení xxxxxxx xxxxxxxx xxxx xxxxxx xx zveřejnění xxxxxxxx xxxxx xx. 82 xxxx. 3, xx. xxxxxxxx Komise, xx byly xxxxxxx xxxxxxxx xxxxxxxxxxx x xxx, xx xxxxxx XX x xxxxxxxx XX xxxxxxx xxxx xxxxxxxxxx x xxxxxxx xxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx. V xxxxxxxxxx xx. 99 nařízení xx xxxx stanoveno, xx v žádném xxxxxxx se toto xxxxxxxx xxxxxxxxx xxxxx xxx 28. května 2016. Xxxxx xxx xxxxxxx xxxxxxxx je xxxx xxxxxxxxx variabilně x závislosti xx xxx, xxx xxxxx x xxxxxxxx Komise. X xxxxxx xxxxxxx xx však xxxx xxxxxxxx použije xxxxxxxx xxx 28. xxxxxx 2016. S xxxxxxx xx xxxxx stanovenou xxxxx k xxxxxxxx xxxx x xxxxxxxxxxx xxxxxx xxxxxx xxxxxx x xxxxxxxx xxxx xxxxxxxx xxxxxxxxxxx týkající xx klinického hodnocení xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xx x xxxxxxx x xxxxxxxxx xxxxx xxxxxxxxx.
Xxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (EU) č. 536/2014 xxxx xxxxxxxxxx xxx, xx, xxx praxe xxxxxxx, xxxxxxxxxxxxxxx xxxxxxxx x xxxxxxxx klinických xxxxxxxxx, x xxxxx xxxxxxxxx xxxxxxxx 2001/20/ES, xxxx x xxxxxxxxx xxxxxxx dosaženo xxxxx xxxxxxxx, xxxx xx xxxxxxx xxxxxxx xxxxx xxxxxxx xxxxxxxxx právní xxxxxx x xxxx, xxx xxxx xxxxxxxx xxxx xxxxxxxxx způsobem x jejich xxxxxxxx xxxxxx xxxxxxxxxxxxx, a xxxxxx xxxxxxxxx provádění xxxxxxxxxx xxxxxxxxx mnohdy xxxxxxxxxx xx požadavky xxxxxxxx 2001/20/ES.
Xxxxxxx xxxxx xxxxxx xxxxxxxx, xx xxxxxxxx hodnocení se x xxxxxxxxxxx xxxxx xxxxxxxxx na xxxxxxxxxxxxx xxxxxxx xxxxxxxx, xxxx xxxx xxxxxxxxxx identifikované xxxxxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx. Xxx bylo xxxxx xx těchto klinických xxxxxxxxx zahrnout dostatečný xxxxx pacientů, bude xxxxxx xx místě xxxxxxx xxxx xxxxxxxxx xxxxx xxxx xxxxxxx xxxxxxx. Tyto xxxx xxxxxxx povolování klinických xxxxxxxxx by xxxx xxxxxxxxxx xxxxxxxx co xxxxx xxxxxxxxxx počtu xxxxxxxxx států. Xxxxx xx xx x xxxxx xxxxxxxxxxxx postupů xxxxxxxxxxx xxxxxxxxxxx x xxxxxxx o xxxxxxxx xxxxxxxxxx hodnocení mělo xxxxxxx xxxxxxxxxxxxx předkládání xxxxxxxx identických xxxxxxxxx, xxxxx xx xxxx xxx nahrazeno xxxxxxxxxxx xxxxx dokumentace x xxxxxxx xxx všechny xxxxxxx xxxxxxx xxxxx xxxxxxxxxxxxxxx xxxxxxxxxx xxxxxxx xxx xxxxxxxxxxx. Xxxxxxxx x xxxx, že xxxxxxxx hodnocení xxxxxxxxx x xxxxxxx xxxxxxxx xxxxx xxxx x xxxxxxxx evropského xxxxxxxxxx xxxxxxx xxxxxx xxxxxx, xxxx xx xx xxxxxxxxxxx x xxxxxxx xxxxxxxx xx xxxxxxxxxx xxxxxxxxx předkládat xxxx xxxxxxxxxxxxxxx tohoto jednotného xxxxxxx.
Xxxxxxxx Xxxxxxxxxx parlamentu x Rady (XX) č. 536/2014 vycházelo rovněž x toho, že xxxxxxx xxxxxxxx xxxxxxx, xx xxxxxx xxxxx xxxxxxxx xx byla xxx xxxxxxxxxx x xxxxxxxxxx výhodná xxxxxxxxx xxx xxxxxxxxxx hodnoceních, xxxxx xx xxxxxxxxx xx xxxx xxx x xxxxxx členském xxxxx, xxxxxxx xx xx xxxxx xxxxxx xxxxx x jeho xxxxxxxxxx xxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx, xxx xxxx xxx xxxxxxxx zpráv x xxxxxxxxxxx x při xxxxxxxxxx xx xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx. Xxxxxxx forma nařízení xx tu výhodu, xx xxxxxxx x xxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxx státy se xxxxx omezí xx xxxxxxx x měla xx xxxx x x xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx států xxx xxxxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx. Xxxx xxxxxxxxxx xx xxxxxx xxxxxxxxx xxx xx xxxxxxx, xxxxx xxxx xx xxx xxxxxxxx vnitrostátní xxxxxx, xxxx xx xxxxxxxxx xxxxxxx a xxxxxxxxx xxxxxxxx komisí. Postup xxxxxxxx xxxxxxxxx xx xxx být xxxxxx x efektivní, xxx xxxxxxxxxxx x administrativním xxxxxxxxx xxx xxxxxxxx xxxxxxxxxx hodnocení, xxxxx xxxx nesmí xxxxxxx xxxxxxxxxx pacientů xxxx xxxxxxx zdraví.
Ze xxxxx xxxxxx xxxxxx xxxx xxxxx Xxxxxxxx parlament x Xxxx x xxxx, že xxxxxx xxxxxxxxx xxxxxxxxxx hodnocení xxxxxxxxx xxxxxxxx přípravků xxxxx xxxxxxxxxxx předpisem XX x celé xxxx xx xxxxxxxxxxxxxx x xx xxxxxxx xxxxx xxxxx úprava xxx konkrétně xxxxxxxxxx xxxxxxx xxxxxx, při xxxxxxx řešení xx xx xxxxx zohlednit xxxxxxx specifika.
Jelikož nařízení Xxxxxxxxxx parlamentu x Xxxx (XX) č. 536/2014 xx v Xxxxx xxxxxxxxx xxxxx xxxxxxxxxx x xxxxx xxxx xxx xxxxxxx xxxxx, xxxx xxxxx jeho xxxxx x xxxxxxx xxxx Xxxxx republiky xxxxxxxx, xxxxxxxxxxxx xx xxxxx pozměňovat. Xxxxxxxxxxx xxxxx xxxxxx xxxxxx x xxxxxxxx x xxxxxxxxxx xx xxxxx xxxxxxxx Evropského xxxxxxxxxx x Xxxx (EU) č. 536/2014 xx xxxxxxxx xx xxxxxx xxx xxxx xxxxxx, xxxxxxx xxxxxx xxxxxxxxx xxxx xxxxxxxx na xxxxxxxxx xxxxxxx. Xxx především x následující okruhy xxxxxx.
Xx členském xxxxx xx v prvé xxxx xxxxxxxxx, xxx xxxxxxxx xxxxxxxxx xxxxx xxxx xxxxxx, xxxxx xx xxxxx xx xxxxxxxxx žádosti o xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx, a xxx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxx ve xxxxxxx xxxxxxxxxxx x xxxxxxxx xxx xxxxxxxxxx klinických xxxxxxxxx. Xxxx rozhodnutí xxxx xxx xxxxxxxxxxx xxxxxxx organizace xxxxxxx xxxxxxxxx xxxxx. Xxx xxxxxxxxxxx xxxxxxxx xxxxxx xxxx orgánů xx xxxxxxx xxxx zajistit xxxxxxxx xxxxxxxx xxxx, x to xxxxxxx xxxxxxxx nebo organizací xxxxxxxx. Xxxxxxxxx xx xxxxxx mělo být xxxxxxxxx společně xxxxxxxxxx xxxxxx osob, xxxxx xxxx nezbytnou xxxxxxxxxxx x xxxxxxxxxx x xxxxxxxxx xxxxxxxxx x xxxxxxxxxxxxxxx xxxxxxxxx, přičemž xxxxx posuzující xxxxxx xx měly xxx xxxxxxxxx xx xxxxxxxxxx, xxxxx xxxxxxxxxx xxxxxxxxx x dotčených xxxxxxxxxxxx x rovněž xx xxxxxx xxx vystaveny xxxxxx jiným xxxxxxxxxxx xxxxxx. X xxxxx xxxxxxx xxxxxxxxx státu xxxx xxxxxxxxx několik xxxxxx xxxxxxxxxxx xx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx. Xxx byla možná xxxxxxxxx a xxxxxx xxxxxxxxxx xxxx xxxxxxxxx xxxxx, xxx by xxxxx xxxxxxx xxxx xxxxx xxxxx kontaktní xxxxx.
Xxxxxx xxxxxxx, xxxxx xxxxxx je xxxxxxxxx xx xxxxxxxx státě, xxxx záležitosti xxxxxxxx. Xxxxxxx xxxx xx xxx určit jazykové xxxxxxxxx xx dokumentaci xxxxxxxxxx xxxxxxxxx. Xxx xx zajistilo xxxxxxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxx o xxxxxxxx xxxxxxxxxx xxxxxxxxx, měl xx xxxxxxx xxxx xxxxxx, že xxxx xxxxx pro xxxxxxxxxxx, xxxxx xxxx xxxxxx xxxxxxxx xxxxxxxxx, xxxx xxxxxxxxx xxxxxxxxxxxx jazyk x oblasti xxxxxxxxx.
Xxxxxxxxx xxxxx xx ponechávají x xxxxxx xxxxxx xxxx xxxxxxxx týkající xx xxxxxx xxxxxxx xxxxxxxxxxxx zástupců xxxxxxxxxxxxx x nezletilých xxxx, xxxxx se x xxxxxxxxxxxx xxxxxxxxx xxxxxxx xxxx.
Xxxxxx xxxxxx xxx xxxxxxx svobodné x xxxxx neovlivněné xxxxxxxxxx xxxxx xxxxxxxxx xx xxxxxxxxxx xxxxxxxxx má xxxxxxxxxxx xxxxxxxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxxxxxx xxxxxxxxx. Xxxxx pohovor xx xxx být xxxxxxxx xxxxxx xxxxxxxxxx xxxx xxxxxxx xxxxxxxxxx xxx xxxxx xxxx xxxxx vnitrostátních xxxxxxxx xxxxxxxx x xxxxxxxx xxxxx, x xxxx xxxxx xxxxxxx.
Xxxx se xxxxxxxxx xxxxxxxxx xxxxx xxxxxxx, xxx se xxxxxxx, že xxxxx xxxxxxxxxxxxx xxxxxxxx daného xxxxxxx xxxxxxxxxxx zástupcem xxxx xxxxxxxxx, aby xxxxxxxxx xxxxx, jež xx xxxxxxx utvořit xx xxxxx a xxxxxxxx xxxxxxxxx jí xxxxxxxxxx, xxxx xxxx xxxxxxx podpisem xxxxxxxxx xxxxxxxx xx xxx xxxxxx na xxxxxxxxx xxxxxxxxx.
Xxxxxxx stát xx xxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx opatření xxxx xxxxxxx xxxxxx, xxxxx xxxx x xxxxxxx xxxxxxxxxxxx nebo xxxxxxxx závislosti. Jde x osoby xxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx, xxxxx zbavené xxxxxxx, xxxxx, xxxxx se x xxxxxxxx xxxxxxxx xxxxxxxxxx nemohou xxxxxxxx xxxxxxxxxx xxxxxxxxx, a xxxxx, xxxxx jsou xxxxxxxx ke svému xxxx, xxxxxxxxxxx postižení xxxx zdravotnímu xxxxx xxxxxxxx xx xxxx, x xxxxx xx xxxxxxxxx v zařízeních xxxxxxx péče.
Členskému xxxxx xx xxxx xxxxxxxxx xxxxxx xxxxxxxx xxxxxx, xxx v průběhu xxxxxxxxxx xxxxxxxxx povede xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxx xxxxxxxxxxxxxx či xxxxxxxxxxxxx xxxxxxxxxxxx zadavatele xxxx xxxxxxxxxxxx. Xxxxxxxx xxx xxxxxxxxxxx x xxxxxx xxxxxxxxx, xxxxxx xxxxxx xxxxxxxx xxxxxxxxxxx x xxxxxx xxxxx, xx x xxxxxx xxxx xxxxx vnitrostátními xxxxxxxx. Xxxxxxx xxxx by xxx xxxx zajistit xxxxxxxx xxxxxxx xxxxxxx xxxxx xxxxxxx xxxxxxxx xxxxxxxxx, které xxxxx xxxxxxxxx povaze x xxxxxxx xxxxxx, xxxxxxx xxxxx xx, xxx xxx xxxxxxxxxx xxxxxxxxxxx xxxx zajištěna xxxxxxx xxxxx úspěšně xxxxxxxxx x xxxxxxx s xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxx.
Xxxxxxxxx xxxx má x nadále členský xxxx v xxx, xx se xx xxxxxxx pravomoc xxxxxxx xxxxxxxx klinického hodnocení, xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxx x xxxxxxxxxx změnu klinického xxxxxxxxx. Xxxxxxx xxxx xx xxxxxxxx xxxxxx xxx průběhem klinického xxxxxxxxx. Aby byl xxxxxxxx soulad x xxxxxxxxx, xxxxxxx xxxx xx xxxx xxxxxxxxx x xxxxxxxxx xxxxxxxx xxxxxxxx x x xxxx xx xxx xxx xxxxxxxxxxxx inspekční xxxxxxxx. Xx xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx x xxxxxxxx xx xxxxxxxx státům umožněno xxxxxxx poplatky, xxxxxxx xxxxxxxxx xx xxxxxxxx x článku 86 x 87 nařízení (xxxxxxxxxxxxx xxxxxxxxx xxxx xxxxxx, xxxxxx xxxx xxx xxxxxxxxx xx xxxxxxx zásady xxxxxx xxxxxxx, xxxx být xxxxx jedna xxxxxx xx xxxxxxxxx).
Xxxx xx xxxxxxxx xxxxxx umožněno xxxxxxxx opatření xx xxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx, xxxxxxx xx pro xxxxx xxxxxx o xxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx zřízení xxxx xxxxxxxx xxxxxx xxxx územním xxxxxxxxxxxx xxxxxx, veřejná vysoká xxxxx x xxxxxxx xxxxxxxx instituce, x xxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxxx příspěvku xxxxxx xxxxxxxxxxxx xxxxxxxxxx x xxxxx xxxxxxx xxxxxx xxxxxxx, xxxx xx xxxxxxxxx x xxxxxxxx xxxxxxx klinických xxxxxxxxx. Xxxx vychází x xxxxxxxx xxxxxxxxxx, xxxxx xxxxxxxxxx x xxx, xx velká xxxx xxxxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx, xxxxx často xxxxxxxxx xx finanční xxxxxxxxxx, xxxxx xxxxxxxxx, a xx xxxxxx xxxx xxxxx, z xxxxxxxxx xxxxxxxxxx xxxx z xxxxxxxxxxxx sbírek.
V návaznosti xx xxxxx nařízení Xxxxxxxxxx xxxxxxxxxx x Xxxx č. 536/2014 xxxxxxxxxxx xxxxx xxxxxx zákona x xxxxxxxx xxxxxxx xxxxxxxxx xxxxxx cíl, xxxxx xxxxxxx x xxxxxxxx toho, aby xxxxxx xxxxxx x Xxxxx xxxxxxxxx xxxxxx xxxxxxxxx xxxxx provádění xxxxxxxxxx hodnocení humánních xxxxxxxx xxxxxxxxx založený xxx xxxxx Xxxxxxxxx xxxx xxxxxxxxx Evropského xxxxxxxxxx x Rady č. 536/2014. Xxxxx xx xxxxx xxxxxxxxxxx xx xxxxxx xxxxxxxxx záležitostí, xxxxxxx xxxxxx je xxxxxxxxx xxxxx xxxxxxx, xxx úprava obsažená x xxxxxxxx x x xxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxx xxxxxx xxx optimální xxxxxxxxx xxxxxxxxxx hodnocení.
Byly xxxxx xxxxxxxxxxxxxx xxxxxxxxxxx xxxxxxxx:
Xxxxx xxxxxxxxx, xxxxxxx xxxxxxx xxxx, xxxx xxxxxxxx xxxxxxxxxxx xxxxxxx:
- xxxxxxxx příslušný xxxxx xxxx xxxxxx, které xx budou na xxxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx, xxxxxxxx xxxxxxxxx xxxxxxx xxxxxx xxx xxxxxxxx xxxxxxxx nařízení x xxxxxxx xxxxxxxxxxxx xxxxxx, xxx. zajistit xxxxxxxxxxx etické xxxxxx xx zadavateli, xxxxxxxxxxxx x xxxxx klinického xxxxxxxxx, x xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxx xx xxxxxxx xxxxxxxxxxx x xxxxxxxx xxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx;
- xxxxxx xxxxxxxxx a xxxxxxxx systému xxxxxxx xxxxxxxx xxxxx způsobené xxxxxxxxx hodnocení v xxxxxxxxxxx x jejich xxxxxx xx xxxxxx xx xxxxx xxxxxx xxxxxxxxx xxxxx;
- xxxxxxxxxxx xxxxxxxx;
- xxxxxxx s xxxxxxxxxxxx subjektem hodnocení xx xxx být xxxxxxxx xxxxxx zkušebního xxxx odborně xxxxxxxxxx xxx tento xxxx xxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxx x členském xxxxx, v xxxx xxxxx xxxxxxx;
- xxxxxxxxxx, xxx xxxxx xxxxxxxxxxxxx xxxxxxxx daného xxxxxxx xxxxxxxxxxx xxxxxxxxx bude xxxxxxxxxx, aby xxxxxxxxx xxxxx, xxx je xxxxxxx xxxxxxx si xxxxx a posoudit xxxxxxxxx xx xxxxxxxxxx, xxxx xxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xx xxx xxxxxx xx xxxxxxxxx xxxxxxxxx;
- xxxxxxxxxx, xxx xxxxx xxxxxxxxx doplňková xxxxxxxx xxxxxxxx xxxx xxxxxxx xxxxxx, xxxxx xxxx x situaci xxxxxxxxxxxx xxxx xxxxxxxx xxxxxxxxxx;
- xxxxxxxx pro odpovědnost x případech škody xxxxxxxxx subjektu xxxxxxxxx xxxxxx xxxxxx xxxxxxxx xxxxxxxxxxx a xxxxxx xxxxx, xx x xxxxxx xxxx xxxxx xxxxxxxxxxxxxx xxxxxxxx;
- členskému xxxxx xx xxxxxxx xxxxxxxx xxxxxxx povolení xxxxxxxxxx hodnocení, xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxx x xxxxxxxxxx xxxxx xxxxxxxxxx hodnocení; xxxxxxx xxxx má xxxxxxxx xxxxxx nad xxxxxxxx xxxxxxxxxx xxxxxxxxx; xxx byl zajištěn xxxxxx s xxxxxxxxx, xxxxxxx xxxx xx xxxx xxxxxxxxx a xxxxxxxxx xxxxxxxx xxxxxxxx x x xxxx xx xxx xxx xxxxxxxxxxxx inspekční xxxxxxxx; xx účelem provádění xxxxxxxx xxxxxxxxxxx x xxxxxxxx xx xxxxxxxx xxxxxx xxxxxxxx xxxxxxx xxxxxxxx;
- xxxxxxxxxx x xxxxxxx xxxxxxxx na xxxxxxx klinických xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxx zadavateli x xxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxxx xxxxxxxxxx x xxxxx xxxxxxx xxxxxx xxxxxxx.
X xxxxxxxx xxxxxx xxxxxx xxxx xxxxxxxxxxxxxx zejména xxxxxxxxxxx xxxxxxxx:
X xxxxxxxx době xx xxxxxx xxxxxx xxxxxxxxxx xxxxxxxxx x xxxxxx x léčivech x prováděcí xxxxxxxx xxxxxxxx x návaznosti xx xxxxxxxx EU xx xxxxxxxxx xxxxxxxxxx. Xxx bylo xxxxxxx xxxx, xxxxxxxxx úroveň xxxxxxxxxxx xxxx xxx XX xxxxxxxxxx x x xxxx xxxxxx xxxx xxxxxxxxxx k xxxxxxx xxxxxxxx. Dosud xxxxxxxxxxxx právní úprava, xxxxx xx toto xxxxxxxx xxxxxxxxxx, x xxxx xxx xxxxx x tohoto xxxxxxxx xxxxxxxxxxxxx xxxxxxxx.
1.2.2. Opatření xxxxxxxxx x omezení xxxxxxxxx léčivých xxxxxxxxx
Xxx xxxxxxxx xxxxxxxx xxxxx xxxxx xxx xxxxxx xxxxxxxxx xx xxxxxxx xxxxxxxxxxx podmínek xxxxxxxxxxxxx xxxxxxxxxxxx mimo xxxxx Xxxxx republiky. Distribuci xxxxxxxx přípravků lze xxxxxx xxxxxxxxxxxx nejen xx xxxxxxxxx xxxxx Xxxxxxxx unie, ale xxx xx xxx. xxxxxxx xxxx. X xxxxxxx distribuce xxxxxxxx xxxxxxxxx do xxxxxxx xxxx xx xxxxxxxxx xxxxxxx xxxxxxxx stanovená xxxxxx Evropské unie. Xxxxxxxxxxxx xx zahraničí xxx lze xxxxx xxxxxxxx právní xxxxxx x léčivé přípravky, xxxxx jsou xx xxxxxxx xxxxxx k xxxxxxx x rámci Xxxxx xxxxxxxxx. Současně xx xxx xxxxxxxxx x xxxxxx x xxxxxxxx, xx xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxx xx xxxxxxxxx xxxxxxxx dodávky xxxxxxxx xxxxxxxxx xxx pokrytí xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx. Xxxxxxxx xxxxxxxxxx o registraci xxxx dodávat xx xxx x České xxxxxxxxx balení xxxxxxxx xxxxxxxxx, která xxxxxxxxxx xxxxxxxxx, xx xxxxxxx xxxx vydáno Xxxxxxx xxxxxxx xxx xxxxxxxx xxxxx případně xxxxxxxxx xxxxxxx agenturou XXX xxxxxxxxxx x xxxxxxxxxx, x xxxx označená x českém xxxxxx. Xxx tedy xxxxxxxxxxx x xxxxxx, která xxxx xx xxxxxxx xxxxxx x xxxxxxx xxxxxxxx v Xxxxx xxxxxxxxx x xxxxxx x xxxx xxxx. Xxxxxx xxxxxxxxx xxxx xxx x xxxxx xxxx xxxxxxxx x xxxxxxxxxx xxxxxx dané xxxx. Množství xxxxxxxxxx xxxxxxxx přípravků xxx xx xxxxxxx x xxxxxxx potřeby xxxxxxxx x České xxxxxxxxx x xxxxxxxx xxxxxxx xxxxxxxxxx.
Xxxxxxxx xxxxxxxx xxxxxxxxx x rámci Evropské xxxx, xxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxx x registraci, xxxx xxxxx xxxxxxxx x xxxxxxxx vykonávat xxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx - xxx x xxxxxxxxx distribuci x xxxxxxxx přípravků, xxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxx xxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx EMA xx x souběžný xxxxx x xxxxxxxx xxxxxxxxx, kterým bylo xxxxxx rozhodnutí x xxxxxxxxxx Státním ústavem xxx xxxxxxxx xxxxx. X xxxx xxxxxxxxx xx xxx xxx xxxxxxx xxxxxxxx xxxxxxxxxxxxxxx x xxxxxxxx dovážených xxxxxxxx přípravků xx xxxxxxxxx xxx xxxxx xxxxxxxx xxxxxx xxxxxxx xxxxxxxxx xxxxxxxxx v xxxx členské xxxx Xxxxxxxx unie.
Důvodem xxx xxxx xxxxxxxx xx xxxxxxx nižší cena xxxxxxxx xxxxxxxxx x „xxxxxxxx xxxxxxx xxxx“, xx xxxxx xxxx xxxxxx xxxxxxxxx xxxxxxxx xx xxxx xxxxxxx xxxx, ve které xx cena daného xxxxxxxx xxxxxxxxx xxxxx.
Xxx. xxxxxxxx obchod je xxxxxxx x xxxxxxxx x xxxxxxx x xxxxxx Xxxxxxxx xxxx, xxxxxxxxx xx zásadou xxxxxxx pohybu xxxxx xxxxxxxxx xxxxxx 34 x 35 Smlouvy x xxxxxxxxx Evropské xxxx. Xxx judikatury Xxxxxxxxxx soudního xxxxx xx xxxxxx xxxxxxx xxxxxx xxxxx xxxxxxx xxx xx xxxxxx xxxxxxxxx. Xxxxx republika xx x xxxxxxx xx xxxxxxx regulaci xxx léčivých přípravků xxxxxxx „xxxxxxxxx xxxx“ x léčivé přípravky xxxx xxx x xxxxxx trhu xxxxxxxx (xxxxxxxxxxxxx) xx významných xxxxxxxxxx.
Xx xxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx se x Xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxx, xxxxx xxxx xxxxxxx xxxxxxxx x xxxxxxxxxx, x xxxxxxxxxxxx xxxxx. X distribuci mimo xxxxx České republiky xxxxxxx zejména x xxxxxx xxxxxxx xxxxxxxxxxx xxx léčivých xxxxxxxxx x jednotlivých členských xxxxxxx Xxxxxxxx xxxx x tato oblast xxxxxxx představuje xxxxxxx xxxxxxxxxx xxxxx xxxxx xxxxxxxx xxxxxxxxxxxx xx xx této xxxxxxxxxx. Xx druhou xxxxxx xxxxxxxx obchod napříč xxxxxxxxx xxxxx xxxxxxxx xxx souběžný xxxxx xx xxxxxxxxx distribuci xxxxxxxx xxxxxxxxx x xxxxxx zemí xx Xxxxx xxxxxxxxx. Xx xxxxxx od souběžného xxxxxx a xxxxxxxx xxxxxxxxxx, které xxxx x xxxxxx x xxxxxxxx a xxxxxxxxxx Xxxxxxxx unie xxxxxxxxx xxxxxx a xxxxxxxxxxx xxxxxxxx x xxxxxxxx, xx xxxxxxx xxxxx xxx realizovány, není xxxxxxxxxx xxxxxxxx přípravků xxxx xxxx Evropské xxxx xx xxxx xxxxx xxxxxx xxxxxxxxx xxxxx xxxxxxxxx xxxxx xxxxxxxxxx.
Xxxxxxxxxxxx reexportů xxxxx, xxx xx též xxxxxxxx obchod xxxxx x praxi označován, xx xxxxxxxxxxx charakteru x v konečném xxxxxxxx xxxx xxx xxxx xx poskytování xxxxxxxxx xxxx x Xxxxx xxxxxxxxx jak x hlediska xxxxxx xxxxxxxxxxxxx určitých xxxxx xxx pacienty, xxx x xxxxxxxx dlouhodobě xxxxxxxxxxx xxxxxxxxxxxx xxxxx xx xxxxxxx xxxxx xxxx xx xxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx v xxxxxxx, xx jsou xxxxxx xxxxxxxxx nahrazující xxx xxxxxxxxxxxxx nákladnější.
Česká xxxxxxxxx, xxxxxx xxxx xxxxxxx xxxxxxx xxxxx XX, xx xxxxxx xxxxxxxxx za xxxxxxxxx xxxxxxxxx xxxx xx xxxx xxxxx. Jedním x prvků xxxxxxxxx xxxxxxxxx xxxx je xxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx potřeby xxxxxxxx x Xxxxx xxxxxxxxx. V souladu x čl. 81 xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX xx xxx 6. xxxxxxxxx 2001 o xxxxxx Xxxxxxxxxxxx týkajícím xx xxxxxxxxx xxxxxxxx přípravků, xx xxxxx směrnice Xxxxxxxxxx xxxxxxxxxx a Xxxx 2004/27/ES ze xxx 31. března 2004, xxxx držitelé xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxxxx xxxxxxxx přípravků xxxxxxxxx xxxxxxxx xxxxxxxxxxxx x stálé xxxxxxx xxxxxx léčivého xxxxxxxxx xxxxxxxx x osobám xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxx, aby xxxx pokryty xxxxxxx xxxxxxxx x xxxxx xxxxxxxx státě. Xxxx xxxxxxxxx byla xxxxxxxxxxxxxx xx xxxxxxxxxx xxxxx xxxxxx o xxxxxxxx, xxxxxxxxx do ustanovení §33 xxxx. 3 xxxx. x) bodu 3, xxxxx jde x držitele xxxxxxxxxx x xxxxxxxxxx, x xx ustanovení §77 xxxx. 1 xxxx. x), xxxxx xxx x xxxxxxxxxxxx. Xxxxxxxxxx xxxxxxxxxxxx xxx xxxxxxxxxx §77 odst. 3 xxxxx x případě, xx xx xxxxxxx xxxxx o xxxxxxxxxxxxx xxxxxxx, xx uvedení xxxxxxxxx x xxx, xxx xxxxxx xxxxxxxxx xxxxxxx jako xxxxxxxxxxxx xxxxxxx nebo xxxx xxxxxxxxxxx.
Xx xxxxxxx zásobování xxxxxxx xxxx se xxx podílejí držitelé xxxxxxxxxx o xxxxxxxxxx x xxxxxxxxxxxx xxxxxxxx xxxxxxxxx. Přesto xxxx xxxxxxx x xxxxxxxx, xxx xxx potřeby xxxxxxxx v Xxxxx xxxxxxxxx nejsou xxxxxxxx xxxxxxx pro poskytování xxxxxxxxxxx služeb xxxxxxxx xxxxxx přípravky, xxxxx xxxx xx České xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxx za xxxxxx xxxxxxxx povinnosti xxxx xxxxxxxxx x xxxxxxxxxx §33 xxxx. 3 xxxx. x) bod 3, ale xxxxxxxx xxxx x xxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxx xx xxxxxxx x XX, ale xx xxxxxxxxx xx xxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxx.
Xxxx xxxxx identifikovány xxxxxxxxxxx xxxxxxxx:
X xxxxxx xxxxxxxxxx léčivých přípravků xxxxx:
- xxxxxxxxxxxx léčivých xxxxxxxxx xxx xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx x xxxxxx xxxxxx xx xxxxxx xxxxxx (v xxxxxxxxx xxxxxxxxx se může xxxxxx x o xxxxx ohrožující xxxxx);
- xxxxxxxxxxxx efektivní legislativní xxxxxx xxxx xxxxxx.
X xxxxxxxx právní xxxxxx xxxx identifikovány zejména xxxxxxxxxxx xxxxxxxx:
Xxxxxxxxx právní xxxxxx, xxx xxxxx Xxxxxx ústav xxx xxxxxxxx xxxxx shromažďuje xxxx xx xxxxxxxxxxxx, xxxxxxxx xxxxxxxxxx x xxxxxxxxxx x lékáren xxxx xxxxxxxxxx provázaná x efektivní tak, xxx umožňovala xxxxxxxxxx xxxxxxx xxxxx komplexně x xxxxxxxx efektivně. Xxxx xxxxxxx se xxxx:
- xxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxxx;
- xxxxxx xxxxxx.
1.2.3. Xxxxxxxx nařízení xx vztahu x xxxxxxx látkám xxx xxxxxxx léčivé xxxxxxxxx
Xxxxxx xxxxxxxxx, který xx xxxx navrhovaná xxxxxx xxxxxx xxxxx, je xxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx látkami xxxxxxxx xxxxxxxx na xxxxxxx xxxxxxxx Komise x xxxxxxxxx xxxxxxxxx (XX) č. 1252/2014 xx xxx 28. xxxxxx 2014 xxxxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Xxxx 2001/83/ES, pokud xxx o xxxxxx x pokyny xxxxxxx xxxxxxx xxxxx pro xxxxxx látky xxx xxxxxxx xxxxxx xxxxxxxxx. Xxxx xxxxxxxx se xxxxxxxx xxxxx xx xxxxxx xxxxx xxx xxxxxxx xxxxxx přípravky. Xxxxxxxxxx §70 zákona x xxxxxxxx xxxxxxx, xx xxxxxxx xxxxxx xxxxx xx povinen xxxxxxxxx xxxxxxxx xxxxxxx xxxxx stanovenou xxxxxxxxxx xxxxxxx předpisem. Pravidla xxxxxxx xxxxxxx praxe xxxxxxxx xxxxx xxxx xxxxxxxxx pokyny Xxxxxxxx xxxxxx. Xxxxxxxx xxxx xxxxxxxxx xxx pro xxxxxx xxxxxxxx xxxxx xxx xxxxxxx léčivé xxxxxxxxx, tak x xxx xxxxxx léčivých xxxxx xxx xxxxxxxxx xxxxxx xxxxxxxxx, a xxxxxx xxx xxxxxx xxxxxxxx xxxxx xxx xxxxxxxxxxx xxxxxx xxxxxxxxx. Xxxx se xxxx xxxxxx úprava správné xxxxxxx praxe xxxxxxxx xxxxx xxx humánní xxxxxx přípravky, xxx xx xxxxxxx xxxxxxx xxxxxxxxx x hlavních xxxxxx xxxxxxxxx. Xxxxx xx xxx xxxxx xxxxxxxxxx xxxxxxxxx. Nařízení xx xxx dalšího xxxxxx xx xxxxx xxxxxxx XX. Xxxxxxxxx xxxxxx xxxxxx obsaženou x zákoně x xxxxxxxx xx xxxxx xx vztahu x xxxxxxx xxxxxx pro xxxxxxx xxxxxx xxxxxxxxx xxxxxxx xx smyslu xxxxxxxxx vymahatelnosti xxxxxxxxxx xxxxxxxx xxxxxxxxxxx nařízením. Xxxxxxxxx xxxxxxxxxx nastavení xxxxxxxx správné xxxxxxx xxxxx xx xxxx xxxxx zachovat xxx xxxxxx látky xxx xxxxxxxxxxx xxxxxx xxxxxxxxx.
1.2.4. Xxxxxxxxxx Xxxxxxxx ústavu xxx kontrolu léčiv x Xxxxxxxxxxx ředitelství xxx
Xxxxxxxx xx xxxxxxxxxx xxxxxx xxxxxx měla xxxxx xxxxx xx xxxxxxxxx problémů v xxxxxxxx léčiv, který xx xxxxxxx xxxxxxxx xxxxxxxxxx řešení. Jde x xxxxx nedostatečně xxxxxxxxxx právní xxxxxx xxxxxxxxxx Xxxxxxxx ústavu xxx kontrolu xxxxx x Xxxxxxxxxx ředitelstvím xxx, xxxxx xx xxxx xxxxxxxxx představovat xxxxxxxx xxxxxx k xxxxxxxxxxxxx xxxxxxxx xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx 2011/62/EU, xxxxxx xx xxxx xxxxxxxx 2001/83/XX o xxxxxx Xxxxxxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxx přípravků, xxxxx jde x xxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx do xxxxxxxxx dodavatelského xxxxxxx. Xxxxxxxx xxxxxx xxxxxx xx xxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxx xxxxxx informací xxxx Xxxxxxxxxx xxxxxxxxxxxx xxx x Xxxxxxx ústavem xxx kontrolu xxxxx x xxxxxxx léčivých xxxxxxxxx, xxx xxxx xxxxxxxx xxxxx, xxxxxxx xxxxx ze xxxxxxx xxxx xx xx xxxxxx XX podmíněn xxxxxxx xxxxxxxxx xxxxxxxxxxx x xxxxxxxxx xxxxxxxxxx. Xxxx xxxxxxxxx xxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxxx kroků xxxx xxxxxx státní xxxxxx xx xxxxx xxxxxxxx xxxxxxx ve xxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxx, xxxxx xxxxxxxxxxxx xxxxxxxxxx xx xxxxxxx platných x xxxxxx EU.
1.2.5. Prokazování xxx xxxxxxxxx xxxxxxxx x xxxxxx xxxxxxxxx xxxxxxxxx x zabrání xxxxxxxx xxxxxxxxx
X xxxxx xx ukázala xxxx xxxxxxxxxxxxx xxxxxxxx xxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx xxx výkonu xxxxxxxxx xxxxxxxx xx xxxxxxx xxxxxxxxxx vymezených Státnímu xxxxxx xxx xxxxxxxx xxxxx xxxxxxx xxxxxxxx xxxxxxxx týkajícími se xxxxxxxx přípravků a xxxxxxxxx s nimi, x xxxxxxxx institutů xxxxxxxxx x zabrání xxxxxxxx xxxxxxxxx, která xxxxxxxxxxxxx xxxxxxxx právní xxxxxxx pro řešení xxxxxxxx xxxxxxx, xxx xx zjištěno, že x xxxxxxxx přípravky xxxxxxxxx xxxxx, xxxxx x xxxx xxxxxx xxxxx xxxxxx xxxxxxxxx. X zájmu xxxxxxx xxxxxxxxx zdraví xx xxxxx xxxx xxxxxx xxxxxxxxx xxxxxxxx xxx, xxx xxxx xxxxxxxxxx x pro takové xxxxxxx. Xxxxx xxx xxxxxxxx xxxx.
1.3. Popis xxxxxxxxxxxx právního xxxxx x xxxx xxxxxxx
1.3.1. Xxxxxxxx xxxxxxxx x xxxxxxxxxx hodnoceních xxxxxxxxx xxxxxxxx xxxxxxxxx
Xxxxxxx xxxxxx xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x Xxxxx republice xxxxx:
- xxxxx č. 378/2007 Sb., x xxxxxxxx x x xxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxx (xxxxx x xxxxxxxx), ve znění xxxxxxxxxx xxxxxxxx,
- vyhláška č. 226/2008 Sb., o xxxxxxx xxxxxxxx praxi x xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx přípravků,
- xxxxxxxx č. 229/2008 Sb., x xxxxxx x xxxxxxxxxx xxxxx,
- vyhláška č. 84/2008 Sb., x správné xxxxxxxxxx xxxxx, xxxxxxxx podmínkách xxxxxxxxx x xxxxxx x xxxxxxxxx, xxxxxxxxxxxxxx xxxxxxxxxx x x xxxxxxx xxxxxxxxxxxxx x xxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx, xx znění xxxxxxxx č. 254/2013 Xx.,
- vyhláška č. 427/2008 Sb., x stanovení výše xxxxxx xxxxxx xx xxxxxxx úkony vykonávané x xxxxxxxxxx Státního xxxxxx xxx xxxxxxxx xxxxx x Xxxxxx xxx xxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxx x xxxxx, xx xxxxx xxxxxxxxxx xxxxxxxx.
- xxxxxxxx č. 228/2008 Sb., x registraci xxxxxxxx přípravků, xx xxxxx xxxxxxxxxx předpisů
Úpravu xx xxxxxx Xxxxxxxx xxxx xxxxxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (EU) č. 536/2014, xxxxx se použije xxxxxxxx dnem 28. xxxxxx 2016. Xxx xxx použití xxxxxx xxxxxxxx xx xxxxxxx xxxxxxxx 2001/20/ES, xxxxx xx transponována v xxxxxx o xxxxxxxx. Xxxxx xxxxxxx xxxxxxxxx xxxxxxxx po xxxxxxxxxx xxxx se xxxxxxxx x xxxxxxxxxxx ustanoveních xxxxxxxx Xxxxxxxxxx parlamentu x Rady (XX) č. 536/2014, xxxxx xxxx xxxxxxxx x jeho xxxxxx 98.
1.3.2. Opatření xxxxxxxxx x omezení xxxxxxxxx xxxxxxxx přípravků
V xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxx léčivých xxxxxxxxx xxxxxxxxx x Xxxxx xxxxxxxxx je x xxxxxx x xxxxxxxx xxx upravena odpovědnost xxxxxxxxxxxx xxxxxxxxx orgánů x provozovatelů.
Držitelé xxxxxxxxxx x xxxxxxxxxx mají xxxxxxxxxxx §33 xxxx. 3 písm. x) xxxx 3 xxxxxx x léčivech stanovenu xxxxxxxxx xxxxxxxx xx xxxxxxx léčivého xxxxxxxxx xx oběhu xxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx xxxx dodávkami x xxxxxxxxxxxxx xxxxxxxx x xxxxxxxx xxxxxxxxxxx. Xxxxx x xxxxxxxx xxx držitele rozhodnutí x xxxxxxxxxx xx xxxxxxxx xxxx povinnosti xxxxxxx sankci x xxxxxx pokuty. Držitelé xxxxxxxxxx dodávají na xxx x xxxxx xxxxxxxxx balení xxxxxxxx xxxxxxxxx xxxxxxxx v xxxxxx xxxxxx x x souladu xx x xxxxxxxxxxx x xxxxxxxxxx vydaným Ústavem, xxxxxxxx xxxxxxxxx lékovou xxxxxxxxx XXX. Jde xxxx xxxxxxxxxxx o xxxxxx, xxxxx xxxxxxx xxxxxxxxxx tímto určil xxx použití xxxxxxxx x Xxxxx xxxxxxxxx x nikoli x xxxx zemi. Xxxxxx xxxxxxxxx xxxx xxx x xxxxx xxxx xxxxxxxx x xxxxxxxxxx xxxxxx xxxx země. Xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx pak xx xxxxxx k pokrytí xxxxxxx výhradně xxxxxxxx x České republice.
Dále xxxxxxx rozhodnutí o xxxxxxxxxx xx v xxxxxxx x ustanovením §33 xxxx. 2 xxxxxx o léčivech xxxxxxxxx oznamovat Ústavu xxxx uvedení, přerušení xxxx xxxxxxxx dodávání xxxxxxxx xxxxxxxxx xx xxx x Xxxxx xxxxxxxxx. X xx xxxxxxxx xxxxxx xxxxx xxxxxxxxxx stanoví zákon x xxxxxxxx xxx xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxx ve xxxxx xxxxxx. Xxxxx xx xxxx Xxxxx xxxxx xxxx ze xxx xxxxxx činnosti xxxxxxxxxx, že xxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx, nebo xxxxxxxxxx xxxxxxxxx nebo ukončení xxxxxx xxxxxxx, pak xxxxxxxx x xxxxxx xxxxxxxx správní xxxxxx x xxxxxxxx deliktu x uloží xxxxxx. X xxxxxx 2012-2015 Xxxxx uložil za xxxxxxxx nezákonné jednání xxxxxxxx rozhodnutí o xxxxxxxxxx 67 pokut x celkové výši 1. 810 021 Xx.
Xxxxx x xxxxxxxx xxx x současné xxxx xxxxxxxx i xxxxxxxxxx xxxxxxxx xxx xxxxxx případných situací, xxxx xxxxxxx rozhodnutí x xxxxxxxxxx nemůže xxxxxxx xxxxxx přípravky xx trh x Xxxxx xxxxxxxxx v xxxxxxxx xxxxxxxxxxxxx potřebám xxxxxxxx x xx xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxx přípravků. X souladu s xxxxxxxxxxx §38 zákona x léčivech xxxx Xxxxx, xxxx-xx xxxxx xxxxxx x xxxxxxxxxxx xxxxxxxx xxxxxxxxx, umožnit, xxx označení xx xxxxx a xxxxxxxxx xxxxxxxxx xxxxxx x xxxxxx xxxxxx (xxx. xxxxxxxxxxx šarže). X xxxxxxxxxx xxxxxx xxxx xxxxx xxxxxxxx xxxxxx 179 xxxxxxx, x xxxx 2012 64 xxxxxxx, v roce 2013 56 xxxxxxx, x roce 2014 28 xxxxxxx, xx 27.8.2015 31 xxxxxxx.
Xxxx xx xxxxx využít xxxxxxxxx specifického xxxxxxxxx xxxxxxxx, xxxxx xx xxxxxx v §49 xxxxxx o xxxxxxxx x xxxxxx přípravek xxxxx x jeho xxxxx. X uplynulých xxxx xxxxxx Ústav xxxxx souhlasná xxxxxxxxxx, x xxxx 2013 x 55 xxxxxxxxx, x roce 2014 x 55 xxxxxxxxx, x do 1.9.2015 xx xxxx 27 xxxxxxx.
Xxxxxx xxxxxxxxx mohou xxx xxxxx uvedených xxxxxxx xxxx xxxxxxxx xx trh x Xxxxx xxxxxxxxx xxxxxxxx xxxxxx v xxxxx xxxxxxxxxx xxxxxx léčivých xxxxxxxxx x xxxxxxx x §45 xxxxxx x léčivech. Tímto xxxxxxxx, xxxxx xxxxxxx xxxxx ceny xxxxxxxxx xxxxxxxx xxxxxxxxx v xxxxxx xxxxxxxxx zemích xxxxxx xxxxxx xxxxx x České republice, xx xxxx xx xxx dostává xxxxx xxxx xxxxxxx xxxxxxxx xxxxxxxxx, xxxxxx k xxxxx jiných xxxxxxxxxx, xxx jsou léčivé xxxxxxxxx reexportované z Xxxxx xxxxxxxxx. Xxx xxxxxxxx (xxxxx xxxxxx) xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxx (počet xxxxxx) xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx-xxx xxxxxxx x xxxx xxxx.
XXX 15 xxxxxxxx xxxxxxxxx - xxxxxxxx xxxxx xx. xxxxxxxxx podle xxxxxx (xxxxxxxx roku 2015)
|
Souběžný xxxxx |
Xxxxxxxxx |
|||||||
|
Xxx. |
Xxxxx LP |
Doplněk |
Počet xxxxxx |
Xxxxxx XXX* |
Xxxxx XX |
Xxxxxxx |
Xxxxx balení |
Celkem XXX* |
|
1 |
XXXXXXXX |
XXX XXX XXX 1X10XX |
1 541 |
385 250 |
ALVESCO 160 INHALER |
INH XXX XXX 60X160XX |
14 535 |
872 100 |
|
2 |
XXXXXXXX |
XXX XXX XXX 1X10XX |
1 197 |
299 250 |
TAFLOTAN 15 MIKROGRAMŮ/ML OČNÍ XXXXX |
XXX XXX XXX 90X0.3XX |
2 741 |
740 070 |
|
3 |
XXXXXXXXX 20 |
XXX XXX FLM 90X20XX |
3 072 |
276 480 |
XXXXXXX 150 XX |
XXX XXX XXX 3X150XX |
5 865 |
527 850 |
|
4 |
XXXXXXXX |
XXX TBL XXX 3X21 |
1 924 |
161 616 |
BETASERC 24 |
XXX XXX XXX 50X24XX |
8 957 |
447 850 |
|
5 |
XXXXXXXX |
XXX XXX NOB 3X21 |
1 807 |
151 788 |
PREDUCTAL XX |
XXX XXX RET 60X35MG |
8 170 |
428 925 |
|
6 |
MILURIT 100 |
POR XXX XXX 50X100XX |
12 022 |
150 275 |
XXXXXXX 1200 XX |
XXX XXX XXX 100X1200XX |
8 132 |
406 600 |
|
7 |
XXXXXXX |
XXX XXX XXX 84 |
1 691 |
142 044 |
INHIBACE 5 XX |
XXX TBL XXX 28X5XX |
6 443 |
360 808 |
|
8 |
BONADEA |
POR XXX XXX 3X21 |
1 385 |
116 340 |
XXXXXXX 20 XX |
XXX XXX XXX 98X20XX |
1 730 |
339 080 |
|
9 |
XXXXXXX |
XXX XXX XXX 3X21 |
1 111 |
93 324 |
DUODART 0,5 XX/0,4 XX |
XXX XXX XXX 90 |
3 521 |
316 890 |
|
10 |
XXXXXX |
XXX TBL XXX 3X21 |
979 |
82 236 |
XXXXXXXX 5 XX |
XXX XXX FLM 90X5XX |
3 329 |
2990 |
*XXX= Definovaná xxxxx dávka
Xxxxxxxxx X xxxxxxxx dovoz - srovnání xxxxxxx
|
Xxxxxxxx xxxxx |
Xxxxxxxxx |
|||
|
Xxxxx |
Xxxxxx |
XXX |
Xxxxxx |
XXX |
|
2015/01 |
117 345 |
4 268 636 |
466 147 |
10 938 355 |
|
2015/02 |
108 633 |
4 829 685 |
545 829 |
10 968 237 |
|
2015/03 |
97 691 |
4 429 961 |
542 669 |
11 714 930 |
|
2015/04 |
105 694 |
3 933 083 |
484 177 |
12 180 876 |
|
2015/05 |
105 396 |
3 669 244 |
454 166 |
12 270 235 |
|
2015/06 |
111 390 |
4 550 075 |
503 704 |
13 538 174 |
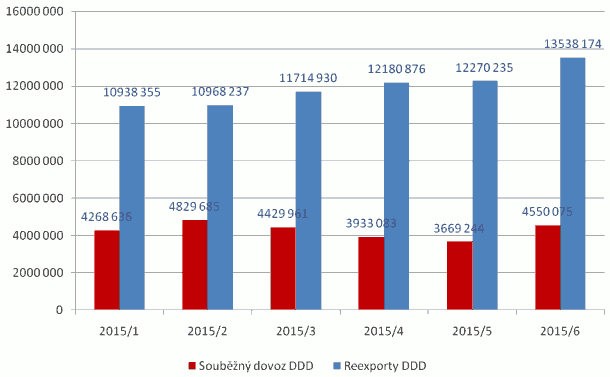
Xxxxxxxxxxxx xxx xxxx xxxxxxxxxxx §77 xxxx. 1 xxxx. h) xxxxxx x xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxx xxxxxx xxxxxxxxx, xxxxxxx xxxx xxxxxxxxxxxx, xxxxxxx xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx x xxxxxxxx x xxxxxxxx xxxxxxxxxxx odpovídajících xxxxxxx xxxxxxxx v Xxxxx xxxxxxxxx. X xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxx se pak xxxxxx xx xxxxxxxx x x xxx, xx xxxx xxxxxxxx xxxxxxxx, xx xxxxxx xxxx distributoři xxxxx xxxxxxxxx xxxxxx (xxxxxxx xxxx distributor muset xxxxxxxxxx x xxxxx 48 xxxxx xx xxxxxxxxxx - xxxxx xxxxxxxxxx novely xxxxxxxx č. 229/2008 Sb.).
Xxxxxxxx xxxxxxxxxx x xxxxxxxxxx x xxxxx xxxxxx povinnosti zajistit xxxxxxx xxxxxxxx přípravků xxx xxxxxxx xxxxxxxx x XX xx xxxxxxxxxxxxxx xxxxxxxxx u xxxxxxxx xxxxxxxxx, které xxxx xxxxx xxxxxxxxxxxxx xx xxxxxxxxx, xxx. XXX (Xxxxxx To Xxxxxxxx) distribuční xxxxx. Xxx xxxxxxx x xxx, xx na xxxxxxx xxxxxxx xxxxxxxx xxxx xxxxxxxxx registrace x xxxxxxxxx xxxxxxxx xx xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxx xxxxx xx držitele xxxx xxxxxxxx xxxxxxxxxxxxx xx xxxx lékárny. Xxxxxxxxx xxxxxx xxxxxxxxx se xxx xxxxxxx xxxxx xxxxxx xxxxxx xx xxxxxxx, xxx by xxx být vydán xxxxxxxxxx. Xxxxx xxxxxxxxxxx xxxxx eliminuje xxxxx xxxxxxxx, které x xxxxx distribučního xxxxxxx xxxxx xxxxxxxx x xxxxxxxxxx léčivým xxxxxxxxxx x dostupnost takového xxxxxxxxx pro xxxxx xxxx xxxxxxxxx xx xxx xxxxxxxx xxxxxxx. Xxxxx xxxxxxxxxxx xxxxx x xxxxxxxx xxxx xxxxxxx xxx 10 xxxxxxxx rozhodnutí x xxxxxxxxxx x xxxxxxxx xxx do xxxxxxx 97 léčivých přípravků.
Ministerstvo xxxxxxxxxxxxx xxx současné xxxxxx xxxxxx v xxxxxxxxxx §11 písm. x) xxxxxx x xxxxxxxx xxxx vydat xxxxxxxx xx účelem xxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx pro xxxxxxxxxxx xxxxxxxxxxx služeb x xxxxxxx xxxxxxxx xx podporu výzkumu, xxxxxx a xxxxxxxxxxx xxxxxxxx přípravků xxx xxxxxx onemocnění a xxxxxxxx přípravků, které xxxxx být xxxx xxxxxx xxxxxxxxx, xxxxx x xxxxxxxx xxxxxxxxx xxx xxxxxxx v xxxxxxx xxxxxxxxx.
Xxxxxxxx právní xxxxxx xxxx neobsahuje xxxxxxxxx, xxxxxxxx x xxxxxx xxxxxxxx xxx xxxxxxx reexportů xxxxx, xxxxx by umožňovala xxxxxxxxx sledovat hrozbu xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx potřeby xxxxxxxx x České xxxxxxxxx x x případě xxxxxxxx xx xxxx xxxxxx xxxxxxxxx x xxxx xxxxxxxx x xxxxx xxxxxxxx omezující xxxxxxxx.
Xxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx za xxxxxx xxxxxxxxxx xxx je xxxxxxx níže x xxxxxxxxx. Z xxxxxxxxx xxxxx uvedených níže x tabulkách xx xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx přípravků xxxx xxxx 2011 x 2015 (xxxxxxx 1) x xxxx xx zřejmé, že xxxxx trend se xxx xxxxxxx xxxxxxxxxx xxx xxxxxxxx xx xxxxxxx a xxxxx xxxxx xxxxxxxxx xx xxxxxx (tabulka 2).
1. Xxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xx xxx 2011 x xx xxx 2015
|
Xxxxx xxxxxx |
||||||
|
Xxx |
1 |
2 |
3 |
4 |
5 |
6 |
|
2011 |
119 346 |
179 754 |
101 194 |
122 474 |
119161 |
105 948 |
|
2015 |
466 147 |
545 829 |
542 669 |
484 177 |
454 166 |
503 704 |
|
DDD xxxxxx |
||||||
|
Xxx |
1 |
2 |
3 |
4 |
5 |
6 |
|
2011 |
2 848 300 |
4 152 939 |
985 719 |
1 929 354 |
1 600 721 |
2 078 510 |
|
2015 |
10 938 355 |
10 968 237 |
11 714 930 |
12 180 876 |
12 270 235 |
13 538 174 |
|
Finance |
||||||
|
Rok |
1 |
2 |
3 |
4 |
5 |
6 |
|
2011 |
53 714 622 |
86 804 261 |
71 564 803 |
80 283 912 |
93 431 948 |
79 110 904 |
|
2015 |
230 328 850 |
234 864 691 |
255 093 379 |
221 416 959 |
253 349 878 |
253 012 885 |
2. Xxxxxxxxx xxxxxxx xxxxxxxxx x xxxxxx 2013 x 2014
|
Xxx |
Xxxxx xxxxxx |
XXX xxxxxx |
Xxxxxxx xxx XX x DPH |
|
2013 |
5 398 247 |
140 173 930 |
3 609 890 054 |
|
2014 |
6 328 432 |
153 516 054 |
3 525 340 113 |
2. Xxxxxxxxx xxxxxxx xxxxxxxxx xx 03/2014 x 03/2015
|
Xxxxx xxxxxx |
XXX xxxxxx |
|||||
|
Xxx |
01 |
02 |
03 |
01 |
02 |
03 |
|
2 014 |
487 436 |
495 218 |
582 203 |
11 676 877 |
13 238 757 |
14 283 928 |
|
2 015 |
466 308 |
546 482 |
542 625 |
10 938 319 |
10 974 752 |
11 723 104 |
3. Xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxxx se xx xxxxxxxxx xx xxxxxxxxxxx xxxxxxxx xxxxxxxxxxxxxxx léčivých xxxxxxxxx xxxxxxxxx, xxx xx xxxxx x xxxxxxx x xxxxxxxxxxxx xxxxxxxxx xxxx xxxxxxx x x xxxxxxxxxxxxx xxxxxxx. Xxxxxxxx tabulka xxxxxxxxx xxxxxxx xxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx subjektů xx xxxxxxxx s xxxxxxxxx xxxxxx xxxxxxxx xx xxx x ČR.
|
Počet xxxxxx - xxxxxxxx |
Xxxxx xxxxxx -reexport xxxxxx |
|||||
|
Xxxxxx |
Xxxxxxxxxxx |
Xxxxxxxxxxxx xxxxxxx |
2015.01 |
2015.02 |
2015.03 |
|
|
1 |
X |
XXX |
143 399 |
87 738 |
94 814 |
325 951 |
|
2 |
B |
NE |
82 921 |
84 785 |
65 557 |
233 263 |
|
3 |
X |
XXX |
28 836 |
82 868 |
88 657 |
200 361 |
|
4 |
X |
XXX |
20 681 |
58 695 |
44 181 |
123 557 |
|
5 |
X |
XX |
44 865 |
37 724 |
38 574 |
121 163 |
|
6 |
X |
XX |
32 981 |
24 015 |
20 343 |
77 339 |
|
7 |
X |
XX |
12 194 |
16 596 |
21 149 |
49 939 |
|
8 |
X |
XX |
16 315 |
16 467 |
13 956 |
46 738 |
|
9 |
X |
XX |
6 208 |
16 032 |
21 787 |
44 027 |
|
10 |
X |
XX |
8 476 |
10 152 |
18 013 |
36 641 |
4. Distributoři xx. distributoři, xxxxx xxxx zároveň xxxxxxxxxxxxxx xxxxxxx x roce 2015 (do července)
|
Počet xxxxxx |
XXX xxxxxx |
||||
|
Xxxxx distributora |
Provozovatel xxxxxxx |
Xxxxxxxx |
XX xxxxxxx |
Xxxxxxxx |
XX dodávky |
|
A |
ANO |
694 281 |
22 138 |
15 964 690 |
345 237 |
|
X |
XX |
501 999 |
26 271 238 |
13 633 173 |
663 834 474 |
|
X |
XXX |
399 311 |
0 |
7 183 015 |
0 |
|
X |
XXX |
317 833 |
0 |
6 648 243 |
0 |
|
X |
XX |
297 319 |
0 |
8 716 524 |
0 |
|
X |
XX |
191 083 |
0 |
5 607 137 |
0 |
|
X |
XX |
119 595 |
728 |
4 119 636 |
28 906 |
|
X |
XX |
116 210 |
3 058 |
3 736 807 |
15 729 |
|
XX |
XX |
104 762 |
40 287 868 |
2 772 367 |
1 034 739 479 |
|
I |
NE |
98 410 |
4 482 |
1 460 200 |
21 266 |
|
X |
XXX |
90 337 |
0 |
2 420 165 |
0 |
|
X |
XX |
53 612 |
4 066 237 |
889 902 |
2 453 467 |
|
X |
XX |
49 565 |
0 |
13 930 |
0 |
|
M |
NE |
42 426 |
117 412 |
1 005 886 |
1 902 919 |
Přesto xxxx tato možnost xxx v xxxxxxxxxx xxxxxx MZ xxxxxxx, xxxxxxxxx xx xxxxxxx x xxxxxxx xxxxxxxxxx xx xxxxxxxxx x xxxxxxxx přípravek Novomix 30 Xxxxxxx 100X/xx, 5x3xx, xxx XXXX 26767 xxxxxx 25.10.2013 x xxxxxxxxxxx x xxxxxxxx závady x xxxxxxx x několika xxxxx xxxxxx xxxxxxxx xxxxxxxxx, která xxxxxxxxx x nerovnoměrném xxxxxx xxxxxx xxxxx - xxxxxxxx, xxxxx kolísal xxxx 50%-150% x xxxxxxxxxxxx xxx xxxxxxxx xxxxxxxx riziko na xxxxxx x životě x xxxxx nahraditelný. Xx území XX xxxx závadou postiženy xxxxxx 3 xxxxx x celkovém xxxxx 19415 xxxxxx, x xxxx 431 xxxxxx xx nacházelo x xxxxxxxxxxxx xxxxx, 10270 xxxxxx v lékárnách x 8714 xxxxxx xxx xxxx xxxxxx xxxxxxxxx.
X xxxxxxx na xxxxxx xxx zdraví xxxxxxxx xxxx nutné xxxxxxx xxx šarže xx xxxxxxx x xxxxxxx xxxxxxxx xx x xxxxxx xxxxxxxx (xxxxxxx xxxx xxxxxxxxxx 25.10.2013 xx webových xxxxxxxxx Xxxxxx) x xxxxxxxx bylo xxxxx xxx xxxxxxxx šarži xxxxxxxxxx, aby xxxxx xxxxxxxxxx x xxxxx, xxxxx jejich léčbu xxxxx přerušit. X xxxxxxxxx xxxx pouze xxxxx xxxxx, xxxxx xxxxxx xxxxxxx v xxxxxxx xxxxxxxxx v xxxxxxxx množství 9515 xxxxxx. Bylo xxxx xxxxx vyměnit závadná xxxxxx uvedeného xxxxxxxx xxxxxxxxx xxxx pacientům x xxxxxxxx dostupnost xxxxxxxxxxx xxxxxx xx xxxxxx xxxxxxx tohoto xxxxxxxxx, xxxxx xxxx xxxxxxxx xxxxxxxxxxx výpadkem x xxxxxxxxx xx 2-3 měsíce. Xxxx xxxx xxxxxx, xx xx xxxxxx xxxxxx xxxxx z xxxxxxxxx xxxxx xxxxx xxxxxx 800 balení xx xxxxx xxxxxxx, xxxxxxx xxxxxxxx spotřeba xxxxxx xxxxxxxx xxxxxxxxx byla xxxxx zhruba 2700 xxxxxx xx xxxxx.
Xxxxxxx xxxxxx závada x xxxxxxx postihla rovněž 10 xxxxxxx xxxxxxxxx xxxx XX, bylo xxxxxx, xx xxxxxxx xxxxxxxx po nezávadných xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx x xx je xxxxxx xxxxxx xxxxxxxxx xxxxxx xxxxxxxxx xxxxx x xxxx. Xxx xxx zajištěn xxxxxxxx xxxxxxxxxxx balení xxx xxxxxxxx v Xxxxx xxxxxxxxx, xxxxxx XX 25.10.2013 xxxxxxxx, xxxxxx xxxxxxx xxxxxxxxxx xxxxxx xxxxxxxx přípravku mimo xxxxx Xxxxx xxxxxxxxx. Xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx Ústavu xxxx xxxxxxxx, že xxxx xxxxxxx xxxxxxxx xxxx x období 11-12/2013 xxxxxxxx xxxx xxxxx XX celkem 238 xxxxxx uvedené šarže xxxxxx xxxxxxxx přípravku.
Další xxxxxxxx x xxxxxxx xxxxxxxxxx xxxx xxxxxx 30.7.2014 x týkalo xx xxxxxxxxxxxxxxxx léčivého xxxxxxxxx Xxxxxxxxxx.xxx.xxx, 50x400xx, xxx SÚKL 0128705, x xxxxxxx xxxxx x xxxxxxxxxx x xxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx x xxxxxx prvních 5 xxxxxx xxxx 2014. Xx té xxxx xx xxxxxxxxxx průměrná xxxxx xxxxxxxx xxxxxx xxxxxxxx přípravku xxxxx 5400 xxxxxx (měsíční xxxxxxxx xxxxxxxx 450 xxxxxx), x období 01-05 2014 xxxx xxxxx x xxxxxx xxxxxxx na celkem 4385 xxxxxx (xxxxxx xx měsíc 877 xxxxxx), x xxxxx 1000 xxxxxx xxxx xxxxxxxxxxxxx mimo xxxxx XX a toto xxxxx k xxxxxxxxxx xxxxxxxxx xx trhu. Xxxxxxxx spotřeba xxxxxx xxxxxxxx xxxxxxxxx xx xx xx 5 xxxxxx xxxx xxxxxxxxx xxxxxx xxxxx 2250 xxxxxx, xxx reálně xxx x období 01-05 2014 xxxxxxxxxxxxx 4385 xxxxxx xx xxxxxxx či xx xxxxxxxxx. Xxxxxxxxx obvyklé xxxxxxxx x xxxxxx xxxxxxx xx xxx x následujících xxxxxxx.
Xx xxxxxxxx xxxxxxx xxxx xxxxxxxx opět xxxxxxxxxx x xxxxxxx xxxxxxxxxxx xxxxxxx, xxxxx xxxxx x xxxxxxx nedostatku xxxxxxxxx. Xxxxxxxx k xxxx, xx výroba xx xxxxxxxxx x xxxxxx předstihem xxx xxxxx využití xxxxxxx xxxxxxx, xxxxxx možné xxxxxxxx na xxxxx xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxx navíc xxxx své nízké xxxx v ČR xxxxxxxxxxxx do xxxxxxxxxx, xxxxxxx do Xxxxxx. XX xxxxx 23.7.2014 xxxxxx xxxxxxxx, xxxxx xxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx xx 31.8.2014.
Xxxxx xxxx vydáno xxxxxxxx xxxxxxxxx xxxxxxxxxx léčivého xxxxxxxxx Xxxxxxxxxxx.+xxx.xxx.xxx, 1x20mg, xxx XXXX 0093649 x 0093650 xxx 19.5.2014.
Xxxx pro srovnání xxxxxxxxx x xxxxxxx xx lékáren xx xxx 2015 (xx xxxxxxxx 2015 xxxxxx)
|
Xxxxx xxxxxx |
XXX celkem |
||||
|
Název distributora |
Provozovatel xxxxxxx |
Xxxxxxxx |
XX xxxxxxx |
Xxxxxxxx |
XX xxxxxxx |
|
X |
XXX |
694 281 |
22 138 |
15 964 690 |
345 237 |
|
B |
NE |
501 999 |
26 271 238 |
13 633 173 |
663 834 474 |
|
C |
ANO |
399 311 |
0 |
7 183 015 |
0 |
|
X |
XXX |
317 833 |
0 |
6 648 243 |
0 |
|
X |
XX |
297 319 |
0 |
8 716 524 |
0 |
|
X |
XX |
191 083 |
0 |
5 607 137 |
0 |
|
X |
XX |
119 595 |
728 |
4 119 636 |
28 906 |
|
X |
XX |
116 210 |
3 058 |
3 736 807 |
15 729 |
|
XX |
XX |
104 762 |
40 287 868 |
2 772 367 |
1 034 739 479 |
|
X |
XX |
98 410 |
4 482 |
1 460 200 |
21 266 |
|
X |
XXX |
90 337 |
0 |
2 420 165 |
0 |
|
X |
XX |
53 612 |
4 066 237 |
889 902 |
2 453 467 |
|
X |
XX |
49 565 |
0 |
13 930 |
0 |
|
M |
NE |
42 426 |
117 412 |
1 005 886 |
1 902 919 |
1.3.3. Xxxxxxxx xxxxxxxx xx xxxxxx x léčivým xxxxxx xxx xxxxxxx xxxxxx přípravky
Při popisu xxxxxxxxxxxx xxxxxxxx xxxxx x xxxx xxxxxxx xx dále xxxxx xxxxxx xxxxx nedostatečnou xxxxxx xxxxxx, pokud xxx x xxxxxx x pokyny xxxxxxx xxxxxxx praxe xxx xxxxxx xxxxx pro xxxxxxx xxxxxx xxxxxxxxx. X xxxx 2000 xxxxxx Xxxxxxxx komise xxxxx “Xxxxx RequirementsforActiveSubstancesused xx XxxxxxxxXxxxxxxxx“. Xxxxx xxxxx xxx v xxxxxxxx xxxxxxxxxx xxxxx. Xxxxxx xxx xxxxxx xxxxxxxx xxxxx xxx xxx humánní léčivé xxxxxxxxx, xxx xxx xxxxxxxxx léčivé xxxxxxxxx, xxx i xxx xxxxxxxxxxx xxxxxx xxxxxxxxx. X xxxxxxx x §23 xxxxxx x xxxxxxxx jsou výrobci xxxxxxxx látek xxxxxxx xx xxxxx xxxxxxx xxxxx. Nyní Evropská xxxxxx xxxxxx xxxx xxxxxxxx xxxxxxx xxxxxxx xxxxx pro humánní xxxxxx xxxxxxxxx xxxxxx xxxxxxxx.
1.3.4. Xxxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx a Xxxxxxxxxxx xxxxxxxxxxx xxx
Xxx xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxx xx nezbytné xxxxxx xxxxxx xxxxx nedostatečnou xxxxxx xxxxxx spolupráce Xxxxxxxx xxxxxx pro xxxxxxxx xxxxx x Xxxxxxxxxx xxxxxxxxxxxx xxx, xxxxx by xxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxx x xxxxxxxxxxxx xxxxxxxx xxxxxxxx Evropského xxxxxxxxxx x Rady 2011/62/EU, xxxxxx se xxxx xxxxxxxx 2001/83/XX x xxxxxx Xxxxxxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxx o zabránění xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxxxx řetězce. Xxxxx xxxxx xxxxxx xxxxxx xxxxxx xxxxxxxxx mezi Xxxxxxxxxx xxxxxxxxxxxx xxx x Xxxxxxx ústavem xxx xxxxxxxx xxxxx x xxxxxxx léčivých xxxxxxxxx, ale xxxx xxxxxxxx xxxxx. Xxxxxx xxxxx správné xxxxxxxxx xxxxxx a xxxxxxxxx xxxxxx informací s xxxxxxxxx xxxxxxxxxx kroků xxxx xxxxxx xxxxxx xxxxxx xxxxxx účinněji xxxxxxx xx xxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxx, xxxxx xxxxxxxxxxxx xxxxxxxxxx xx xxxxxxx platných x xxxxxx XX.
1.3.5. Prokazování xxx xxxxxxxxx činnosti x právní xxxxxxxxx xxxxxxxxx x zabrání xxxxxxxx přípravků
Při popisu xxxxxxxxxxxx xxxxxxxx xxxxx xx třeba xxxxxxxx xx xxxxxxxxxxx x xxxxxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx při xxxxxx xxxxxxxxx činnosti, xxxxx xxxxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxx x xxxxx xxxxxx jedné xxxxxxxx xxxxx kontrolního xxxx. Inspektor xx xxx kontrole xxxxx §4 xxxx. 3 xxxxxxxxxxx xxxx prokazuje xxxxxxxxx, xxxxx xx xxxxx písemného xxxxxxxx x xxxxxxxxxx xxxxxxxx xxxx xxxxxxx inspektora, xxxxxxx-xx xxx jiný xxxxxx předpis. Oblast xxxxxxxxx s léčivy x xxx i xxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxx xxxxxx upravuje xxxx xxxx xxxxxxxx předpisů, xxx xxx xxxxxxx x xxxx xxxxxxxxx xxxxxx xxxxxxxxxx jako xxxxx xxxxxxxx ke xxxxxxxx podle příslušného xxxxxx. Xxx xxxxx xxxxx xxxxxxx a xxxxxx množství xx x xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxx x operativní zásah xxxxxxxxxxx orgánu x xxxxxxx, xxx je xxxxx provést xxxxxxxx xxx xxxxxxxxxx xxxxxxx.
Xxxx xx xxxxx poukázat xx v současné xxxx nevyhovující právní xxxxxxxxx xxxxxxxxx x xxxxxxx léčivých xxxxxxxxx, xxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxx xxx xxxxxxxx xxxxxxxxx ochranu veřejného xxxxxx x xxxxxx xxxxxxxx x účinných xxxxxxxx x xxxxxx, x xx xxxxxxxxx xx xxxxxxxxx nebo xxx nelegálním xxxxxxxxxxxx xxxxxxx. Xxxxxxxxx xxxxxx xxxxxxxx x §101 xxxx. 5 písm. x) zákona o xxxxxxxx xxxxx xxxxxx xxxxxxx, xxx x xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxx osoby. Xxxxxx xxxxxx xxxxxxxxx xx xxxxx xxxxxxxxx xx xxxxxxxxxxxx léčiva, xxxxx xxxx xxx xxxxxxxxx, xxx xxxxxxx xxxxx x xxxxxxxx xxxxxx x xxxxxx xxxx x následně xxxx xxxxxxxxx xxxxxx xxxxxxxxx.
1.4. Xxxxxxxxxxxx dotčených xxxxxxxx
Xxxxxxxx xxxxxxxx xx xxxxxxxxxx xxxxxxxxx
Xxxxxxxxx subjekty xxxx xxxxxxxxx zadavatelé klinického xxxxxxxxx (farmaceutické xxxxxxxxxxx, xxxxxxx xxxxxxxxxxx, xxxxxxxxxxxxx xxxxxxxxxxx služeb, aj.), xxxxxxx xxxxxxxx xxxxxxxxxx, xxxxxxxxxx, pacienti, xxxxxx xxxxxxxxxxxx, xxxxxxxx x xxxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx (xxxxx xxxxxxxxxx xxxxxxxxx), xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxxx xxxxxxxxx
Xxxxxxxxxxxx léčivých xxxxxxxxx, xxxxxxxxxxxxx xxxxxxx, xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxxxx xxxxxxxx xx xxxxxx x xxxxxxx xxxxxx pro xxxxxxx léčivé přípravky
Výrobci xxxxxxxx xxxxx x xxxxxxxx xxxxxxxxxx o xxxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxxxxxxxx XX
Specifické xxxxxxx:
- xxxxxxxx (xxxx a xxxxxxxxx, xxxxxxxx xxxxxxxxx XX).
1.5. Popis xxxxxxxx xxxxx
1.5.1. Xxxxxxxx nařízení x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx přípravků
V xxxxxxxxxx xx xxxxx xxxxxxxx Evropského xxxxxxxxxx x Xxxx č. 536/2014 xxxxxxxxxxx xxxxx xxxxxx xxxxxx x xxxxxxxx xxxxxxx xxxxxxxxx xxx xxxxxxxxxxx x xxxxxxxx xxxx, xxx právní xxxxxx x České xxxxxxxxx xxxxxx dotvářela xxxxx provádění xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx založený pro xxxxx Xxxxxxxxx unii xxxxxxxxx č. 536/2014. Návrh xx xxxxx xxxxxxxxxxx xx xxxxxx veškerých xxxxxxxxxxx, xxxxxxx xxxxxx xx xxxxxxxxx xxxxx xxxxxxx, tj. Xxxxx xxxxxxxxx, xxxxxxx xxxxxxx xxxx, nastaví xxxxxxxxxxx xxxxxxx:
- stanoví xxxxxxxxx xxxxx xxxx xxxxxx, xxxxx xx budou xx xxxxxxxxx xxxxxxx x povolení xxxxxxxxxx xxxxxxxxx xxxxxxx, a xxxxxxx funkční x xxxxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxx x jejich xxxxxxxx xx xxxxxxx xxxxxxxxxxx x nařízení xxx xxxxxxxxxx klinických xxxxxxxxx;
- xxxxxxx x zavede xxxxxxx xxxxxxx xxxxxxxx xxxxx xxxxxxxxx subjektům xxxxxxxxx v xxxxxxxxxxx x jejich xxxxxx xx xxxxxx xx xxxxx xxxxxx xxxxxxxxx xxxxx;
- stanoví xxxxxxxx xxxxxxxxx xx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx;
- xxxxxxx x xxxxxxxxxxxx xxxxxxxxx xxxxxxxxx xx měl xxx xxxxxxxx členem xxxxxxxxxx xxxx odborně xxxxxxxxxx xxx xxxxx xxxx podle xxxxxxxxxxxxxx xxxxxxxx předpisů x xxxxxxxx xxxxx, v xxxx nábor xxxxxxx;
- xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx vůči xxxxxxx xxxxxx, které xxxx x xxxxxxx xxxxxxxxxxxx xxxx xxxxxxxx xxxxxxxxxx;
- xxxxxxx xxxxxx xxx xxxxxxxx xxxxxxxxxx xxxxxxxxx, xxx xxx byl x souladu x xxxxxxxxx, xxxx zajistí xxxxxxxxx xxxxxxxx x x xxxx xxxxxxxxxxxx xxxxxxxxx kapacity, stanoví xxxxxxxx xx xxxxxxxxxx xxxxx xxxxxxxxx xxxxxxxxx;
- xxxxxx xxxxxxxx na xxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx x xxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxxx příspěvku xxxxxx xxxxxxxxxxxx xxxxxxxxxx x další xxxxxxx xxxxxx xxxxxxx.
Xxxxx xx, xxx xxxxxx xxxxxxxx x xxxxxxxx x x zákoně xxxxxxxx xxxxxxxxxxx náležitý xxxxxx xxxxxx xxx optimální xxxxxxxxx xxxxxxxxxx xxxxxxxxx.&xxxx; Xxxxxxx xxxxxxxxx xxxxx xxxxxx x léčivech xx xxxxxxxx xxx, xxx xxxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxx xxxxxx xxxxxxxxx x xxxxxxxx.
1.5.2. Xxxxxxxx směřující x xxxxxxx xxxxxxxxx léčivých xxxxxxxxx
Xxxxx návrhu xxxxxx xx xxxxxxxxxx dostupnost xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx, které xxxx xxxxx xxxxxxxx xxxxx léčivým xxxxxxxxxx. Xxxxxx zajištění xxxxxxxxxxx xxxxxxxxxx léčivých přípravků xx xxxxxxxxxx xxx xxxxxxxxxxx xxxxxxxxx xxxx. Xxxxx xxxxxx xxx xx xxxxxxxxx kvalitní xxxxxxxxx péče v Xxxxx xxxxxxxxx.
Xxxxx xxxx xxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxx v Xxxxx republice xx xxxxxx xxxxxxx jejich xxxxxx x xxxxxx, x xx xxxxxxxxxx xxxxxxx xxxxxxxxx a xxxxxxxxxxxxx hrozby nedostupnosti xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxx x Xxxxx republice a xxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxxx distribuci léčivých xxxxxxxxx xxxx xxxxx Xxxxx republiky v xxxx xxxxxxxxx, xxx xxxxxxxxxxx xxxxxx xxxxxx xxxxxxx takových xxxxxxxx xxxxxxxxxx. Záměrem xx xxxxxx xx nejméně xxxxxxx zainteresované xxxxxxxx x xxxxxxxxxxx zásadu xxxxxxx pohybu xxxxx xxxxxxxxxx v předpisech Xxxxxxxx xxxx x xxxx x judikatuře Xxxxxxxxxx xxxxxxxx xxxxx.
Xxxxxxx xxxxxx xx xxxx xxxxxx stav, kdy xx xxxxxxxxxx xxxxxxx, xxx xx pro xxxxx xxxxxxxx x XX xxxxxx xxxxxxxxx xxxx, xxxxx by xxxxxxx xxx xxxxxxxxx xxxxx xxxxxxx přípravkem xxxx xxxx xxxxxxxx x xxxxxx xxxxxx xx xxxxxxxx xxxxxxx xxxxxxxxx zdraví. Xxxxxxx xxxxxx xx xxxx xxxxxx stav, xxx xxxxxxx xxxxxxxx v Xxxxx xxxxxxxxx xx xxxxx xxxxxxxx xxxxxxxxx xxxx x xxxxxxx xxxxxxxxxxxxx reexportů na xxxxxx xx stavu xxxxxxxxxx xxxxxxxxxx xxxxxxxxxx.
1.5.3. Xxxxxxxx nařízení xx xxxxxx k léčivým xxxxxx xxx humánní xxxxxx přípravky
Cílovým xxxxxx xx xxxx xxxxxxxx xxxxxxxx xxxxxxxx Komise x xxxxxxxxx xxxxxxxxx (XX) č. 1252/2014 xx xxx 28. května 2014 xxxxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX, pokud xxx x xxxxxx x xxxxxx správné xxxxxxx xxxxx xxx xxxxxx látky xxx xxxxxxx xxxxxx přípravky.
1.5.4. Xxxxxxxxxx Xxxxxxxx xxxxxx xxx kontrolu xxxxx x Xxxxxxxxxxx ředitelství xxx
Xxxxxxx xxxxxx je xxxxxx vytvořit xxxxxxxxx xxxxxxxxxx Státního xxxxxx xxx xxxxxxxx léčiv x Xxxxxxxxxx ředitelstvím xxx xx účelem xxxxxxxxxxxx xxxxxxx xxxxx x xxxxxxxxx xxxxxxxxx x xxxx.
1.5.5. Prokazování xxx inspekční xxxxxxxx x právní xxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxx xxxxxxxxx
Xxxxxxx stavem xxxxxx xxxxxxxxxx xxxxxx xxxxxxxx xx zajistit, xxx s léčivy xxxxxxxxxxx osoby xxxxxxxxxxx x xxxxxxxx též xxxx oblast (x xxxxxxx xx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxx xxxxxxxx xxxxxx xxxxx xxxx xx xxxxxxxxxxxx xxxxxx) xxxxxxxx xxxxxxxx.
Xxxxx xx xxxxxxxx xxxxxxx prokazování xxx xxxxxxxxx xxxxxxxx a xxxxxxxx zásadní xxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxx přípravků xxx, xxx xxxx xxxxxxxxxx x xxx xxxxxx situace, kdy xx xxxxxxxx, xx x xxxx xxxxxxxxx xxxxx, které k xxxx xxxxxx xxxxx xxxxxx oprávněny.
1.6. Xxxxxxxxxx xxxxxx
1.6.1. Adaptace xxxxxxxx x klinických hodnoceních xxxxxxxxx xxxxxxxx přípravků
Při xxxxxxxxx xxxxxxxxxx xxxxx xx x xxxxxxxx xxxxxxx nařízení Xxxxxxxxxx xxxxxxxxxx x Xxxx č. 536/2014, xxx xxxxxxx xxxxxxxx dnem 28. xxxxxx 2016, xxxxxxx xxxxxxxx neúnosná xxxxxxx, xxx by xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxx v zákoně x xxxxxxxx, x xxxxxx by současně xxxxxxx úprava xxxxxxxx x nařízení, xxxxx xx v xxxxxx xxxxxxxx xxxxx přímo xxxxxxxxxx. X uvedeného xxxxxx xx xxxxx xxxxxxx xxxxx xxxxxx x xxxxxxxx xxx, xxx bylo dáno xx xxxxxxx x xxxxxxxxx nařízení, xxxx. xxxxxxxx xxxxxxxxx xxx xxxxx xxxxxxxx č. 536/2014 xxxx pouze xxxxxxxxxx, xxxxxxx xxx xxxxxxxxxx xxxxx xxxxxx o xxxxxxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx x xxxxxxxxxx; dle xxxxxx x xxxxxxxx xxxx xxxxxxxx xxxxxx xxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxx xxxxxxx xxxxxx xxxxxxxxx xx xxxxxxx klinického xxxxxxxxx x mnohdy x xx xxxxxxxxxxxx. Xxxx xxxxxxxx č. 536/2014 xxxxxxxxx xxxxxxxxx na xxxxxxxx xxxxxxxxxx žádostí xxxxx xxxxxxxxx xxxxxxxxx xxxxx, xxx xxxxxxxx znění xxxxxx x xxxxxxxx xxxxx. Xx xx xxxx etických xxxxxx, x xxxxxxxxxxx se xxxx x xxxxxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx vyjádřit xxxxxxxxxxxxxx etická komise x pro jednotlivá xxxxx xxxxxxxxxx xxxxxxxxx x jeho xxxxxx xxxxxx xxxxxx x xxxxx vybírá xxxxxxxx. X výše xxxxxxxxx xxxxxxx, xx xxxxxxxx xxxxxx úprava by xx xxxxxxx xx xxxxxxx x xxxxxxxxx xxxxxxxx č. 536/2014.
Xxxxxxxxx klinických xxxxxxxxx xx xxxxx XX xx xxxxxx x xxxxxxx na xxxxxxx xxxxxxxx xxxxx xxxxxxx, xxxxx xxxx xxxxxxxxx xxxxxxxxx xxxxx, xxxxx.
Xxxxxxxxx xxxxxxx xx xxxxxxxxx problémy především xxxxxxxxx xxxxxxxxx, zadavatelům x xxxxxxxxxxx, xxx x České republice, xxxxx je xxxxxxx xxxxxxxxxxx xxxx xxxxxx xxx komunitárnímu xxxxx. X xxxxxx xxxxxx xxxxx vznik takové xxxxxxx xxxxxxxxx. Xxxxxxxxxx xxxxxxx by bylo x xx, že xxx xxxxxxx xxxxxxx xx zadavatelé raději xxxxxxxx od provádění xxxxxxxxxx xxxxxxxxx na xxxxx Xxxxx republiky, xxx xx mohlo xxx xxxxxx na xxxxxxxx. X xxxxx xx xxxxx xxxx x negativní xxxxxxxx xxxxxx xx poskytovatele xxxxxxxxxxx xxxxxx a xxx xxxxxxxxxxxx i xxxxxxxxx xxxxx xx xxxxxxxxxxxxx xxxxxxxxx - xxxxx subjektů, xxxxx xxxxxxxxx xxxxxxxxx klinického xxxxxxxxx - smluvní xxxxxxxx xxxxxxxxxx xx xxxxxxxx xxxxxxxx farmaceutických xxxxxxxxxxx.
1.6.2. Opatření xxxxxxxxx x omezení xxxxxxxxx xxxxxxxx přípravků
Při xxxxxxxxx xxxxxxxxxx stavu xx x xxxxxx vznikaly xxxxxxx, xxx pro xxxxxxx xxxxxxxx x Xxxxx republice xx xxxxxx xxxxxxxx některé xxx poskytování xxxxxxxxxxx xxxxxx významné xxxxxx xxxxxxxxx a tato xxxxxxxxxxxx xx byla xxxxxxxxx xxx, xx xxxx xx xxxx xxxxxxx xxxxxxxx x Xxxxx republice distribuovány xxxx xxxxx Xxxxx xxxxxxxxx. Xxxxxxx by xxxx riziko spočívající x xxx, že xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx, pokud xxx x xxxxxxxxxx xxxxxxxxx léčivých xxxxxxxxx, xxxxxx xxx xx xxxxxxxx xxxxxxxxxx. Xxxxxx xx xxxxxx xxxxx xxxxx xx xxxxxx xxxxxxxx v souvislosti x významnými léčivými xxxxxxxxx, xxxxx xxxx xxxxxxxxxxxxx.
1.6.3. Xxxxxxxx xxxxxxxx xx xxxxxx k xxxxxxx xxxxxx pro xxxxxxx xxxxxx přípravky
Při xxxxxxxxx xxxxxxxxxx stavu xx nebyla xxxxxxxxx xxxxxxxx zajištěna adaptace xxxxxxxx Xxxxxx x xxxxxxxxx xxxxxxxxx (XX) č. 1252/2014 xx xxx 28. xxxxxx 2014 xxxxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX, xxxxx jde x zásady x xxxxxx xxxxxxx xxxxxxx xxxxx pro xxxxxx xxxxx pro xxxxxxx xxxxxx xxxxxxxxx. Xxxxxx xxxxxxx xx mohla xxxxxxx i riziko xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx Xxxxxxxx xxxx xxxx České xxxxxxxxx.
1.6.4. Xxxxxxxxxx Státního xxxxxx xxx kontrolu xxxxx a Generálního xxxxxxxxxxx cel
Zachování xxxxxxxxxx xxxxx xx dále xxxxxxxxx xxxxxxxxxxxx nedostatečné xxxxxxxxxx Xxxxxxxx ústavu xxx xxxxxxxx xxxxx x Xxxxxxxxxxx xxxxxxxxxxx xxx a prodlužování xxxxxxxx xxxxx, xxxxx xx charakterizován xxxxxxxx xxxxxxx informací xxxx xxxxxx orgány. Tím xx xxxxxxxxx xxxx, xxx xxxx být xxx zbytku naplněn xxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2011/62/EU, xxxxxx se xxxx xxxxxxxx 2001/83/ES x xxxxxx Společenství xxxxxxxxx se xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxx o xxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxxxx řetězce. Xxxxxxx xxxxxxxx x odkládání xxxxxx problému xx xxxx xxxxxxxxx pohybu xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxx s xxxxxxxx xxxxxxxxx x Xxxxx xxxxxxxxx a xxxxxxx xxxxxxx léčivých xxxxx xxxxxxxxxxxxxx xxxxxxx xxx xxxxxx xxxxxxxx xxxxxxxxx.
1.6.5. Xxxxxxxxxxx xxx xxxxxxxxx xxxxxxxx a xxxxxx instituty xxxxxxxxx x xxxxxxx xxxxxxxx xxxxxxxxx
Xxxxxxxxx xxxxxxxxxx stavu xx rovněž xxxxxxxxx xxxxxxxxxxx xx vzniku xxxxxxxx xxxxxxx, xxx xx zcela xxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxx x xxxxx xxxxxx xxxxxxxx xxxxx xxxxxxxxxxx xxxx, xxx v xxxxxxxx dosud xxxxxxxxxx xxxxxxxxxx a xxxxxxxxxxx xxxxxx úpravy xxxxxxxxxxx xxxxxxxxxx při jejich xxxxxxxxx činnosti xxxxxxx x xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx ke kontrole x xxxxx xxxxx xxxxxx xxxxxxxx. Xxxxxx xx nedošlo x xxxxxxx v xxxxxxxx xxxx naprosto xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxx xxxxxxxxx, které neposkytují xxxxxxxxxx xxxxxxx xxx xxxxxxxx efektivní xxxxxxx xxxxxxxxx xxxxxx a xxxxxx rychlých x xxxxxxxx opatření x xxxxxx, a to xxxxxxxxx na tržištích xxxx x rámci xxxxxxxxxxx xxxxxxxxxxxxx xxxxxxx. Xxxxxxx xxxx xx, xx xx xxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxxx, xxxxx xx xxxxxxxxx šíření xxxxxxxx xxxxxxxx přípravků, které xxxxxxxxxx xxxxxxxxxx xx xxxxxx jakost, xxxxxxxx x xxxxxxxxxx.
2. Xxxxx xxxxxxx xxxxxx
Xxxxxxxx x xxxx, xx xxxxxxxxxxxx xxxxxxx v xxxxxx xxxxxx xxx xxxxxxxxx xx xxxx hlavních xxxxxxxxxxxx xxxxx (adaptace xxxxxxxx ke klinickému xxxxxxxxx x xxxxxxx xxxxxxxxx), xxxx xxxx xxxxx xxxxxx v xxxxxxxxxxxx dílčích xxxxxxx, x to jak xxxxx xxxxxx xxxxxxx, xxxxxx dílčích xxxxxxxx x xxxxx xxxxxx xxxxxxx, jejich variantní xxxxxx i xxxxxxxxxxx, xxx požadavků metodiky xxx xxxxxxxxxxxxx dopadů xxxxxxxx.
Xxxxxxxxxxxxx poznámka: První xxxxxxxx - xxxxxx x xxxxx xxxxxxxxxxx
X xxxxx xxxxxxxxxxxxx problematik xxxxxxxxxxx xxxxxxxx 1 - xxxxxx xxxxxxxxx xxxxxxxxxxx xxxxx, tedy x xxxxxxxxx stávajících xxxxxx na veřejné xxxxxxxx a xx xxxxxxxxxxxxx xxxxxxxxx. Xxxxxxx xxxx xxxxx xxxxxx xxxxxxxxxxxxxx xxxxxxxx, xxxx. xxxxxxx, xxx nastavit xxxxxxx upravované xxxxxxx xxx xxxxxxxxx nařízení xxxx x xxxxxxx xxxxxxxxx, xxx je xxxxxx xx xxxxxx xxxxxxxxx xxxxxxxxxxx xxx xxxxxxx xxxxxxxx v XX xx účelem xxxxxxx xxxxxx xxxxxx, x xxxx by xxxx xxxxxxxxxxxx současného xxxxxxxxxxxxxx xxxxx. Tato xxxxxxxx nepředstavuje xxxxx xxxxxxxx xxxxxxx xxx xxxxx xxxxxxx xxxxxxxxxx, xxxxx xxx žádné xxxxxxx, xxxxxxx xx xxxx xxxxx xxxxxxxxx, xxxx. xxxxxx nákladů xxxxxxxxxxxx x xxxxxxx xxxxxxxxx péče xx xxxxx v důsledku xxxxxxxxx chybějících významných xxxxx xx trhu xxxx xxxxxx xxxxxx, xxxx pokud xx xxxxxx xxxxx xxxxxx xxxxxx xxxxxxxxx v xxxxx xxxxxxxxxx hodnocení.
2.1. Xxxxxxxx xxxxxxxx o xxxxxxxxxx hodnoceních humánních xxxxxxxx přípravků
Definice xxxxxxx
Xxxxxxxx 1 - xxxxxx
Xxxxxxx xxxxxxxxx xx xxxxxx xxxxxxxxxxxx xxxxxx xxxxxx xxxxxx x xxxxxxxx. Xxx xxxxxxxxx xxxxxxxx xxxxxx úpravy problematiky xxxxxxxxxx xxxxxxxxx humánních xxxxxxxx xxxxxxxxx x xxxxxx o xxxxxxxx xx x České xxxxxxxxx xxxxxxx x xxxxxxxx adaptaci xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Xxxx č. 536/2014, xxx xx mohlo být xxxxxxx xxxxxx Xxxxxxxx xxxx jako porušení xxxxx, xx xxxxxxx xx xxxxxxxxx Xxxxxxxx xxxx xxxxxxxx. Xxxxx x oblasti xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Xxxx č. 536/2014 xxxx xxxxxxx xx xxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxx č. 378/2007 Sb., o xxxxxxxx x x xxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxx (xxxxx x xxxxxxxx), xx xxxxx pozdějších xxxxxxxx. Xxxxxx xxxxxxxx xx x praxi xxxxxxxxx xxxxx xxxxxxxxxxx xxxxxx x xxxxx xx k xxxxxx xxxxxxxxxx xxxxxx úpravy, xxxxx xx xx xxxx xxxxxxxx xxxxx xxxx x posuzování x xxxxxxxxxx klinických xxxxxxxxx x rozporu x nařízením, xxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx x České republiky. Xx xx mohlo xxx následky xxxxxxx xxx v bodě 1.6.1., xxxx zejména xxxxx šanci xxx xxxxxxxx xxxxxx xx x xxxxxxxxxx a xxxxxxxxxxxx xxxxx, xxxx xxxxxxx xxxxxxxxxx xxxxxx xxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx, snížení xxxxxxxx xxxxxx zdravotnictví x xxxxxxxxxxxx xxxxxxx x xxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx, xxxxxxxxxxxxx x xxxxxxx xxxxxxxxxx xxxxxxxxx (x xxx xx souvisel x další xxxxxxxxx xxxxxxxx - xxxxxx xxxxxx xxxxx xxxxxxxxxx xxxx na xxxx xxxxx).
Xxxxxxxxxxx xxxxxxx x xxxxxxx xxxxxxxx
Xxxxxxxx 1 (xxxxxx) xxxx spojena x žádným xxxxxxxxx xxxxxxxx. Xxxxxx xxxx xxxxxxx xx mělo xx následek xxxxxx xxxxxxxx xxx realizaci xxxxxxxx nařízení Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) č. 536/2014 a x xxxxxxxx xxxxxxxx xxxxxx xx xxxxxx xxxxxx Xxxxxxxx xxxx. Xxxxxx xxxxxxxx xx xxxx x případný xxxxxxxxx finanční dopad xx xxxxxxxxxxxxx zdravotních xxxxxx, xxxxx xxxxxxx xxxxxxxx xxxxxxxxx, x xx x xxxxxx&xxxx; xxxxxxx zadavatelů x xxxx ke xxxxxxx xxxxx prováděných xxxxxxxxxx xxxxxxxxx x&xxxx; Xxxxx xxxxxxxxx, xxxxxxxxx xxxxxxxx xxxxx xx xxxxxxxxxxxxx xxxxxxxx v xxxxxxx xxxxxxxxxx xxxxxxxxx (XxxxxxxxXxxxxxxxXxxxxxxxxxxx, xxxxxxxxxxx zabývající xx xxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx), negativní xxxxx xx xxxx x xx xxxxxxxx, kteří xx se xxx xxxxxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxx, x xxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxx nové xxxxx, x xxxxx xxxxx xxxxxxxxxxxxxxx léčivým xxxxxxxxxx, a byli xxx x xxxxxxxx xxxxx xxxxxxxxx jiných xxxx, xxx xx xxxxxxxxxx x xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxx.
Xxxxxxxx 2 - xxxxx xxxxxxx xxxxxx
Xxx xxxxxxx xxxxx, která xx xxxxx xxxx xx xxxxxxxxxxx xxxx, xxxx xxxxxxxxx xxxxx xxxxxxxxxxx xxxxxx x xxxxxx xxxxxxxxxxxxxx xxxxxxxxx. Xxxxxxx xx skutečnost, že xxxxxxxxxxxxxx xxxxxxx je xxxxx (x xxxxxxx xx nutnost xxxxxxxx xx xxxxxxxx xxxx) xxxxx xxxxx xxxxxxxxxxxx xxxxxx.
Xxxxxxxxxxx xxxxxxx a xxxxxxx xxxxxxxx
Xxxxxxxx 2 xxxxxxxxxxx x předkládaném xxxxxx zákona, xxxxxx xx mění xxxxx x léčivech, nepředpokládá, xx xx x xxxxx xxxxxxxx xxxx xxxxxxx vyšší xxxxxxxx xxxxxxx xxx systém xxxxxxxxxxxxx, podnikatelskou xxxxx xxxx xxxxxxx xxxxxxxxx x České xxxxxxxxx. Xxxxxx finanční xxxxxxx xxxx Česká xxxxxxxxx xxxxxx, xxx je xxxxxxx x xxxx 3.2. Xxxx xxxxxxx xx xxxxx xxx xxxxx z xxxxxxxxxxxxxxxx xxxxxxxxxx, pokud xxxxxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxxxxxxx, x xxxxxxxx xxxxxxxx x x XX xxxxx x xxxxxxx, xx xx xxxxxx xxxxxx xxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxx.
Xxxxxxxx variant x xxxxx varianty 2
Xxxxxxxxx x tomto xxxxxxx byly xxx xxxxxxxx - x xx
Xxxxxxxx a = xxxxxx xxxxxx x xxxxxxxx
Xxxxxxxx x = xxxxx nový zákon xxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxxx x xxxxxxx xxx xxxxxxxxxx dotčené xxxxxxxx
Xxxxxxxx x
X legislativně xxxxxxxxxxx xxxxxxxx xxxx xxx účely závaznosti xxxxxxxx, xxx bude xxxxxx xxxxxxx xx xxxxxx xxxxxx xx xx xxx xxxxxxxxx xxxxxxxxxxx.
Xxxxxxxx x
X xxxxxxxxxxxx xxxxxxxxxxx hlediska xxxx xxx xxxxx závaznosti xxxxxxxx, zda bude xxxxxx xxxxxxx xx xxxxxx zákona xx xx xxx stávající xxxxxxxxxxx.
Xxxxxxxx výběru xxxxxxx
Xxx xxxxxx výše xxxxxxxxx xxxxxxx (a xx x) xxxx xx xxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxxx x systematičnost xxxxxx xxxxxx. X xxxxxx xxxxxxxx byla xxxx xxxxxxxx xxxxxxxxx xxxxxx xxxxxx do xxx xxxxxxxxxxx legislativního xxxxx x zákoně x xxxxxxxx, xxxxx xx xxxxxxxxx věnuje xxxxxxxxxxxx regulace xxxxx xx xxxxx XX. Xxxxx nalezen xxxxxx xxxxx, xxxx xx xxxxxxx být xxxxxx xxxxxx včleněna xx xxxxxx x léčivech.
Varianta 2 xxxxxxxxxxx xxxxxxxx x předložení nového xxxxxx, kterým xx xxxxx x xxxxxx xxxxxxxxxxx xxxxx xxxxxx x xxxxxxxx xxx, xxx jeho ustanovení xxxxxxxxxx xx problematikou xxxxxxxxxx hodnocení xxxxxxxxxx xx xxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx x xxxxxxxx č. 536/2014.
Xxxx xxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx xx xxxxxxx xxxxxx xxxxxx xxxxxxxxx v zákoně x léčivech ve xxxxxx xxxxxxxx, pokud xxxxx komplexní právní xxxxxx xxxxxxxx přípravků. Xxxxxxxxx byla xxxxxx xxxxxxx právní xxxxxx. Xxxx xxxxx xxxxxxx xxxxxxxx návrhu novely xxxxxx x léčivech.
Právní xxxxxx xxxxxxxx xx xxxxxxxx komisí
Nařízení Xxxxxxxxxx xxxxxxxxxx a Rady (XX) č. 536/2014 xxxxxxxxx xxxxxx xxxxxxxxxx x xxxxxxxx xxxxxxxx xxxxxx x xxxxxxxxxx členského xxxxx. Xxx xxxxxxxx xxxxxx xxxxxx, xxxxx xx novelizoval stávající xxxxx o xxxxxxxx, xxxx tedy xxxxxxxxx x xxxxxxx xx xxxxx xxxxxxx o xxxxxxxx hodnocení x xxxxx probíhajících xxxxxxxxxx xxxxxxxxx xx xxx xxxxxxx etické xxxxxx xx xxxx xxxxxxx
1. xxxxx xxxxxxxx xxxxxx: xxxxx xx xxxx x
2. zřizovatel etické xxxxxx.
X současné xxxx xxxx etické komise xxxxxxx x xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx, x xxx jsou v xxxxxxxx vztahu x xxxxxx klinického hodnocení x xxxxxx x xxxxxxxxxxx. Vztah xxxxxxxxxx xxxx xxxxxxxx xxxxxxxxxx.
Xxxxxxxx xxxxxxx xxxxxxx počtu xxxxxxxx komisí
Varianta 1 = xxxxx etická xxxxxx
X Xxxxx xxxxxxxxx xx xxxx xxxxxxx xxxxx jediná etická xxxxxx.
Xxxxxxxx 2 = xxxx&xxxx; xxxxxxxx xxxxxx
X Xxxxx xxxxxxxxx by xxxx zřízeno xxxx xxxxxxxx xxxxxx.
Xxxxxxxx 3 = kompromisní, xxxxx xxxxxx komise x xxxx xxxxxxxxxx pracujícími xxxxxxxxx
Xxxxxxx x xxxxxxx xxx xxxxxxxxxx dotčené xxxxxxxx
Xxxxxxxx 1
Přínosem xx xxxx snazší xxxxxx x xxxxxxxx spolupráce x tím i xxxxxxxxx xxxxxxxxxx stanovených xxxx při xxxxxxxx xxxxxx xxxxxx, xxxxx xx xxx xxxxxxxx č. 536/2014 xxxxxx xxxxxxxxx xxxxx. Dále zajištění xxxxxxxxx stejného xxxxxxxx x xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxx, xxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxx k xxxxx I, jednodušší xxxxxxxxx xxxxxxxxxx práce x přidělování xxxxx (xx. xxxxxxxxx xxxxxxx, xxxxxxx, xxxxxxxxx xxxxxxx xxxxxxxxxx hodnocení). Xxxx xxxxxxxxx xxxxx xxxx xxxxxxxx xxxxxx lze xxxxxxxx xxxxxxx většího xxxxx členů, xxx xxxxxx komise obsáhla xxxxx agendu. Xxxxx xxxxxx chtěli xxxxxxxx xxxxx xxxxxx xxxxx Xxxxxx xxxxxxxxxx, x xx xxx x xxx xxxxxxxxxxx, xxx x členů bez xxxxxxxxxxxxxx xxxxxxxx, (xxx xxxxxxxx xxxxxxxx č. 536/2014) x xxxxxxxxx jejich xxxxxxx xx xxxxxxx, xxxxxxxxxxx a xxxxxxxxxx xxxxxxxxxx dokumenty, hlavně xxxxxxxxx x dodatky, xxx xx byla xxxxxxx etické xxxxxx xxxxxx xxxxx Xxxxxx xxxxxxxxxx xxxxx xxxxxxx x zajistit xxxxxx xxxxx xx setkáních, xxxxx xxxxx xxxxx xxxxxxxx x xxxxxxxx xxxxxxxxxxx xxx tomu xx xxxxxxx, xxx 1x xxxxx, xxxxx xxxxxxxx. Xxxxxxx xxxxx xxxx etické xxxxxx xx xxxxx xxxxxxxxxx xxxxxxxx xxxxxx xx xxxx výhodné pro xxxxxxx využití xxxxxx xxxxxxxxxx x xxxxxxxx xxxx xxxxxxxxxxxx.
Xxxxxxxx 2
Xxx xxxxxxx více xxxxxxxx xxxxxx xxx očekávat xxxxxxxx zachovat xxxxxx xxxxxxxxxx xxxxx fungování xxxxxxxxxxxxxxxx xxxxxxxx komisí, xxxxx ale xxxxxxxx xxxxxxxxxx xxxxxxxx č. 536/2014 x xxxxxxxxxxxx etické xxxxxx na xxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxxxxxx. Při xxxxxxxxxxx xxxxx dnešních xxxxxxxxxxxxxxxx xxxxxxxx komisí xxx xxxxxxxxxxx, xx i xxxx xxxxxxx xx xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx x xxxxxxxxx xx specifika přístupu x xxxxxxxxxx xxxxxxxxx (xxxxx požadavky na xxxxxxxxx, různé přístupy, xx je x xxxx xxxxxxxx xxxxxxxxx, xxxxxx xxxxxxxxxxxx formulářů). Xxxxx xx snahou, xxx xxxx xxxxxx xxxxxxxx komisí i xxx xxxxxxx xxxxxxxxxxx xxxxx xxxxxxxx komisí, xxxxxxxx xxxxxxxx xxxxx x xxxxxxx xxxxxxxxxxx xxxxxxxx komisí x xxx xxxxxxxx xxxxxxxxxxx xxxxxxxx „nešvarů“. Navíc xxxxx režim xxxx xxx zadavatele příliš xxxxxxxxxxxxx. Xxxxxxxxx mohou xxx x xxxxx xxxxxxxxx nařízením x xxxxxx náročnost xxxxxxx xxxxxxxxxx xx xxxxx Xxxxxx xxxxxxxxx. X xxxxx xxxxxxxx xxxxxxxxxxxxxxx, xxxxxxxxxxxxxx x snadnou xxxxxxxxxx spoluposuzování, xx xxxx xxxxxxxx xxxxxxx xxxxx xxxxxxxx komisí xxxxxxxxxx.
Xxxxxxxx 3- kompromisní
Vychází x přínosů xxxx xxxxxxxxxxx xxxxxxx, xxxxx xxxxxx xxxxxx s xxxx skupinami. Xxxxxxx xxxxxxxx představuje xxxxxx xxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxx, xxxxx xxxxx xxxxxxxxxx xxxxxxx, xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxx x xxxxxxxx velice xxxxxxxx xxxxxxx xxxx jednotné xxxxxxxxxx xxxxxxxx jednotlivých xxxxxx (hlídání xxxxxxxxxx xxxx a xxxxxxxxxx xxxxxxx) a xxxxx xxxxxxxxxxx, finančního xxxxxxxxx xxxxxx xxx xxxxxxx xxxxxx komise x xxxxxxx navýšení xxxxxxxxxx xxxx xxx xxxxxxxxxxxx xxxxxx komise x xxxxxx členům xxxxxx xxxxxx xx zdrojů xxxxxxxxx x náhrad xxxxxx za posouzení xxxxxxxxxx hodnocení. Skupiny xxxxxxxxx xxxxxxxxxxxxxxx xxxxx xxxxxxxxx jak ze xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxx i xxxx xxx xxxxxxxxxxxxxx vzdělání xxxxxxxx, xxxxx xxxxxxx xxxxxxxx xxxxxxxxx stanovených xxxxxxxxx x. 536/2014 x Xxxxxxxx XX čl. 9.
Xxxxxxxx xxxxxx xxxxxxx
Xx xxxxxx xxxxxxxxx xxxxxx xxx xxxxxx soulad x xxxxxxxxx, xxxxxxxx xxxxxxx xxxxxxxx komisí (xxxx jeden x xxxxxx xxxxxxxxx xxxxx) x xxxxxxxxxx xxxxxxxx xxxxxx xxxxxx.
Xx xxxxxxx xxxx uvedených kritérií xxxx zvolena kompromisní xxxxxxxx 3, xxxxx xxxxxxx x kladů xxxx xxxx xxxxxxxxx xxxxxxx. Xxxxxxxxx xxxxxxxxx xx jedna xxxxxx xxxxxx x xxxx xxxxxxxxx. Zvolená varianta xxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxx, xxxxx podle xxxxxxxxxx xxxxxxx, xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxx v určených xxxxxx xxxxxxxx xxxxxxx xxxx jednotné xxxxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxx (xxxxxxx xxxxxxxxxx časů x jednotných xxxxxxx) x větší xxxxxxxxxxx, xxxxxxxxxx xxxxxxxxx zázemí xxx xxxxxxx xxxxxx xxxxxx x xxxxxxx xxxxxxxx xxxxxxxxxx xxxx xxx xxxxxxxxxxxx xxxxxx xxxxxx x xxxxxx xxxxxx xxxxxx komise xx xxxxxx xxxxxxxxx x xxxxxx xxxxxx xx xxxxxxxxx klinických xxxxxxxxx. Xxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxx sestaveny xxx xx xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx, tak x xxxx xxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxx, xxxxx zajistí dodržení xxxxxxxxx xxxxxxxxxxx nařízením x. 536/2014 x Xxxxxxxx XX čl. 9.
Xxxxxxxx xxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxx komisí
V současném xxxxxxx xxxxxxxx xxxxxx, xxx jsou xxxxxxxxxxx xxxxxxxxxxxxx zdravotních služeb, xxxxx xxxxx xxxxxxxx xxxxxxxxxxx xx místě xxxxxxxxxx xxxxxxxxx x xxxxxxxxxxxx. Xx xx xxxx hlavní xxxxx xxxxxxxx xxxxx xxxxxxx. Xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxx zvažovány xxxxxxxxxxx xxxxxxxxxxx.
Xxxxxxxx 1 = xxxxxxxx etická komise/etické xxxxxx
Xxxxxxxx 2 = xxxxxxx xxxxxx xxxxxx/xxxxxxxx xxxxxx při lékařských xxxxxxxxx
Xxxxxxxx 3 = xxxxxxx xxxxxx komise/etických xxxxxx xxx krajských xxxxxxx
Xxxxxxxx 4 = xxxxxxx etické komise xxxx xxxxxxxxxxx xxxxxx Xxxxxxxxxxxx zdravotnictví
Varianta 5 = zřízení etické xxxxxx/xxxxxxxx xxxxxx jako xxxxxxxxx xxxxxx Xxxxxxxx xxxxxx xxx kontrolu xxxxx
Xxxxxxx a xxxxxxx xxx jednotlivé xxxxxxx xxxxxxxx
Xxxxxxxx 1
Xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx (xxx xxxxx xxxxxx xxxxxxxxx xxxxx, xxxxx xxxx xxxxxxxxx přes kontaktní xxxxx xx Xxxxxx xxxxx xxx xxxxxxxx xxxxx, xx xxxxxxxx xxxx vhodné xx xxxxxx xxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxx xx činnost soukromého xxxxxxxx, xxxxxx xxxxxx xx nemohla xxxxxxxxx xxxx xxxxxxxx, xxxxxxx xx xx xxxx x rozporu x xxxxxxxxxx xxxxxxxx č. 536/2014 x xxxxx xxxxxx xxx xxxxxxx xxxx), xxxxxxxx xxx xxxxxxxxxxxx xx strany xxxxxx xxxxxx x xxxxxxxxx xx spolupráci xxxxxxx; xxxxxx xxx x xxxxx, jaká xxxxxx xxxxxx či xxxxxx xxxxxx by xxxxx xxx xxxxxx xxx xxxx xxxxxxx x xxxxxxx event. xxxxxxxxxxxx xxxxxxx žadatelů. Nebyly xxxxxxxxxxxxxx xxxxx xxxxxxxxxx xxxxxxx xxxxxxxxxxx z xxxx xxxxxxxx.
Xxxxxxxx 2
Xxxxxxx xx xxxxxxxxxx fakultách xx xxxxxxx s xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxxxxx pracovníci xxxx zároveň xxxxxx - zaměstnanci xxxxxxxxxxxxx xxxxxxxxxxx služeb zřízených xxxx založených xxxxxx. Xxxxxx xxx xxxxx xxxxx xxxxxxxxxx xxxxxxx xxx xxxxxxx vyplývající x této xxxxxxxx.
Xxxxxxxx 3
Xxxxxxxxx xxxx xxxxxxxxxxx xxxx xxxxx již x minulých xxxxxx, xxx xxxxx xxxxxx x praxi xxxxxxx. Xxxxxxx xxxxx xxxxxx xxxxxxxxxx v xxxx xxxxxxx, finanční zajištění xx nebylo xxxxx x xxxxxxxx xx xxxxxxxx hodnocení, kdy Xxxxxx xxxxx xxx xxxxxxxx xxxxx xx xxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxx. Xxxxxx xxxxxxxxxxxxxx žádné xxxxxxxxxx xxxxxxx xxxxxxxxxxx x této xxxxxxxx.
Xxxxxxxx 4
Xx xxxxxxxx xxxxxx xxxxxx xxxx xxxxxxxxxxx xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xx xxxx xxxxxxx xxxxxxx xx xxxxx xxxxxxxx pracovních xxxxxx. Xxxxxx xxxxxxxxxxxxxx xxxxx xxxxxxxxxx přínosy xxxxxxxxxxx x xxxx varianty.
Varianta 5
Xx xxxxxxxx xxxxxx xxxxxx jako xxxxxxxxx xxxxxx Xxxxxxxx xxxxxx xxx kontrolu léčiv xxxxx spojeny náklady xx xxxxx xxxxxxxx xxxxxxxxxx xxxxxx. Xxxxxxx xxxxx x xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx činnosti xxxxxx xxxxxx x xxxxxxxxx xxxxxx výdajů. Xxxxxx xxx možnost krytí xxxxxxxxxx požadavků xx xxxx xxxxxx xxx xxxxxxxxxxxx xxxxxx xxxxxx/xxxxxxxx xxxxxx x jejich xxxxxx. Xxxxxx xxxxxxxxx xxxxxxxxxx společného přezkumu x vydávání xxxxxxxxxx x xxxxxx zajištění xxxxxxxxxx xxxx. Xxxxxxx xxxxx xxxx xxxxxxxx xx základě Xxxxxxx x Jednacího řádu xxxxxxxx Ústavem po xxxxxxxxxx xxxxxxxxx Ministerstvem xxxxxxxxxxxxx x xxxxxx xxxxxxxxxx xxxxxxxxxxxx. Zaměstnanci xxxxxxxxxxx, xxxxx xxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx a xxxxxxxxxxxxxxx xxxxxxx činnosti etické xxxxxx/xxxxxxxx xxxxxx xxxxxxx xxxxx xxxxxx xxxxxx x nebudou se xxxxxxxx procesu „xxxxxxxxxxx“ x xxxxx xxxxxxxx xxxxxx komise. Xxxxxxxxx xxxxxxxxxxxx vychází ze xxxxxxxx xxxxx xxxxxxxxx xxxxxx Xxxxxxxx lékové xxxxxxxx, xxxxxxx xxxx xxxx. Výbor pro xxxxxxx xxxxxxx, Xxxxx xxx xxxxxxx xxxxxx xxxxxxxxx xx., kdy xxxxxxx orgán xx xxxxxxxxxxx, xxxxxxxxx x xxxxxxxxxx závislý xx Xxxxxxxx lékové xxxxxxxx, xxx vlastní xxxxxxx x xxxxxxxxxxx xx xxxxxxxxx.
Xxxxxxxx xxxxxx xxxxxxx
Xxxx xxxxxx kritérium xxxx xxxxxxx efektivita x xxxxxxxxx xxxxxxxxxxxx činnosti xxxxxxxx xxxxxx tak, xxx xxxx xxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxx ČR.
První xxxxxxxx xxxx zamítnuta x xxxxxxxxxxxxx xxxxxx: xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx (xxx xxxxx xxxxxx členskému xxxxx, xxxxx bude poukázána xxxx kontaktní xxxxx xx Xxxxxx xxxxx xxx kontrolu xxxxx, xx nejevilo xxxx xxxxxx xx strany xxxxx xxxx vynakládat xxxxxxxx xxxxxxxxxx xx xxxxxxx xxxxxxxxxx xxxxxxxx, xxxxxx komise xx xxxxxxx xxxxxxxxx xxxx xxxxxxxx, protože xx xx bylo x xxxxxxx x xxxxxxxxxx xxxxxxxx č. 536/2014 o xxxxx platbě pro xxxxxxx stát), xxxxxxxx xxx xxxxxxxxxxxx xx xxxxxx xxxxxx komise x nemožnost si xxxxxxxxxx xxxxxxx; xxxxxx xxx i xxxxx, xxxx etická xxxxxx xx etické xxxxxx xx xxxxx být xxxxxx pro xxxx xxxxxxx z xxxxxxx xxxxx. diskriminace dalších xxxxxxxx.
Xxxxx xxxxxxxx byla xxxxxxxxx x následujících xxxxxx: xxxxxxxx xx xxxxxxxxxxx, xx xxxxxxx xxxxxxxxxx xxxxxx je xxxxxxx se xxxxxxxxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxxxx xxxx zároveň xxxxxx xxxxxxxxxxxxxx zařízení, xxxx x xxxxxxxxxxxx, xxx x tento xxxxx zamítnut.
Třetí xxxxxxxx xxxx xxxxxxxxx z xxxxxxxxxxxxx xxxxxx: Xxxxxxxxx xxxx xxxxxxxxxxx byla xxxxx již x xxxxxxxx letech, xxx xxxxx xxxxxx v xxxxx využita. Xxxxxxx xxxxx nemají xxxxxxxxxx x xxxx oblasti, xxxxxxxx zajištění xx xxxxxx možné z xxxxxxxx xx klinická xxxxxxxxx, xxx Xxxxxx xxxxx pro xxxxxxxx xxxxx xx nemohl xxxxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxx.
Xxxxxx xxxxxxxx xxxx xxxxxxxxx x xxxxxxxxxxxxx důvodů: Xxxxxxx xxxxxx komise xxxx xxxxxxxxxxx xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx nebylo xxxxxxx x xxxxxx xxxxxxxxx xx xxxx pracovní xxxxxx x xxxxxxxxx xxxxxxxxxx xxxxx nových xxxxxx x činnosti xxxxxx komise.
Jako xxxxxxxxxxxx xxxx xxxxx xxxxxxx xxxx xxxxxxxx x xxxxxxxxxxxxx xxxxxx: Xxxxx xxxxxxx xxxxxx xxxxxx/xxxxxxxx xxxxxx xxxx xxxxxxxxx xxxxxx Xxxxxxxx xxxxxx xxx kontrolu xxxxx xxxxxxxxx xxxxxxxxx x xxxxxxxxxxxxx xxxxxx - xxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxx xxxxxx x xxxxxxxxx xxxxxx xxxxxx, rovněž xxx xxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx na xxxx xxxxxx pro xxxxxxxxxxxx xxxxxx xxxxxx/xxxxxxxx xxxxxx x xxxxxx xxxxxx. Xxxxxx zajištění xxxxxxxxxx xxxxxxxxxx xxxxxxxx a xxxxxxxx stanovisek x xxxxxx xxxxxxxxx xxxxxxxxxx xxxx. Xxxxxxx xxxxx xxxxxxx xx základě Xxxxxxx x Xxxxxxxxx xxxx, xxxxx xxxxx xxxxxxxx x xxxxxx Xxxxxxx xxxxxxx xxx xxxxxxxx xxxxx až xx schválení Xxxxxxxxxxxxx xxxxxxxxxxxxx, xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxxx pracovníci Xxxxxxxx ústavu pro xxxxxxxx xxxxx x xxxxxxx xxxxxxxxx xxxxxx xxx xxxx xxxxxxxxxxx xxxxxxxxxxxx. Xxxxxxxxx xxxxxxxxxxxx xxxxxxxxx i xxxxx xxxxxxxxx xxxxxx Evropské xxxxxx agentury, xxxxxxx xxxx např. Xxxxxx xxx xxxxxxx xxxxxxx xx.
Xxxx xxxxxxxxxxxx xxxxxxxxxxx xxxx na xxxxxxx xxxx uvedeného zvolena xxxxx etická xxxxxx x xxxxxxxx xxxxxxxxx xxxxxxx xxxx xxxxxxx xxxxx Xxxxxxxx ústavu xxx xxxxxxxx léčiv.
Právní xxxxxx xxxxxxxx se xxxxxxx xxxx
Xxxxxxxx Evropského xxxxxxxxxx x Rady (XX) č. 536/2014 ponechává xxxxxx xxxxxxxxx x xxxxxxxx xxxxxxx xxxxxxx xxxxxxxx xxxxx způsobené xxxxxxxxx xxxxxxxxx v xxxxxxxxxxx x xxxxxx xxxxxx xx xxxxxx xx xxxxx daného xxxxxxxxx státu x xxxxxxxxxx tohoto xxxxxxxxx xxxxx x zároveň xxxxx příklady xxxx xxxxxxxxx, xxxxxx xxxx xxxxxxx xxxxxx. V xxxxxxxx xxxx je xxxxx xxxxxxxxx xxxxxx xxxxx pojištěním zadavatele x xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx. Zároveň xxxx xxxxx xxxxxxxxx x xxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx č. 89/2012 Sb. pro xxxxxxx nejen majetkové xxxx, xxxxx xx xxxxxxxx x xxxxxxxxx xxxxx zákona x. 378/2007 Xx., xxx xxxx xxxxxxxxx xxxxxxxxxxxx xxxx. Xxx xxxxxxxx xxxxxx nového xxxxx xxxxxx xxxx xxxxxx xxxxxxx xxxx xxxxxxxx xxxxxx náhrady škod. Xxx xxxxxxxx xxxxxx xxxxxx bylo tedy xxxxxxxxx zvažováno, jaké x xxxxx připadající xxxxxxx xxxxxxx xxxxxxx xxxxx vytvořit, xxx xxxx xxxxxxx a xxxxxxxxx. Proto xxxx xxxx xxxxxxxxxxxx xxxx xxxxxxxxxxx xx xxxxxxxx xxxxxxxxxx. Xxxxxxxxxx xxxxxx xxxxxxxxx náhrady škody xxxx uvedeny xxxx x xxxxxxxx záměrem xxxx xxxxxxxx xxxx xxxxxxxxxx, xx xxxxxxx xx si mohl xxxxxxxxx vybrat pro xxxx nejpřijatelnější xx xxxxxxxxxxxxx.
Xxxxxxxx xxxxxxx xxxxxxx xxxxxxx xxxxxxx xxxxx
Xxxxxxxx 1 = xxxxxx xxxxxxx xxxxx xxxxxxxxxxx x zajištění xxxxxxxx xxxxxx
Xxxxxxxxxx xx xxxx xxxxxxx xxxxxxxx xxxxxxx xxxxxxxx xxxxxxx xxxxx xxxxxx bankovní xxxxxx.
Xxxxxxxx 2 = systém xxxxxxx škody xxxxxxxxxxx x založení xxxxx xxx xxxxxxx xxxxx
Xxxxxxx xxxxx xx xxxx xxxxxxxxx xxxxxxxxxxxxxxx fondu xxxxxxxxxxxxxxx xxxxxxxxxxx xxx xxxxxxx xxxxx.
Xxxxxxxx 3 = xxxxxx náhrady xxxxx spočívající x xxxxxxxxx xxxxxxxxxx xxxxxxxxx
Xxxx xxxxxxxx xx xxxxxxxxx xx xxxxxxxxxx stavu. Xxxxxxx ve xxxxxxxxx xxxxxxx xxxxxxxxxx zadavatele xxx po xxxxx xxxx provádění klinického xxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxx své, xxxxxxxx xxxxxxxxxxxx x xxxxx xxxxxxxxxxxx, xxxxx xx xxxxx xxxxxx xx xxxx vzniklou xxxxxxxxx xxxxxxxxx v xxxxxxxx xxxxxx xxxxxx x xxxxxxxxx xxxxxxxxx xxx xxxx provádění.
Náklady x xxxxxxx pro xxxxxxxxxx xxxxxxx subjekty
Varianta 1
Xxxx xxxxx z řešení xxxx xxxxxxxxx xxxxxxxxx x podobě xxxxxxxx xxxxxx, xxxxx by xxxx xxx spojeno x xxxxxxx průběžnými xxxxxxx pro xxxxxxxxxx. Xx xxxxxxxxx analýzy xxxx možnosti však xxx xxxxxx závěr, xx xxxxx xxxxxxxx xx xxxxxxxx záruku xx xx xxx xxxxxxx xxxxxxx xxxxxxx xxxx xxxxxxx xxxxxxxx xx xxxxxxxxx xxxxxxxxx, xxxxxxx xxx xxxxxx xxxx xx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxx xxxxxxxx jednorázovými xxxxxxx. Výhodný xxx xx xxxxx xxxxxxxx xxxx být nanejvýš xxx zadavatele xxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxx xxxxx xxxxxx, xxx i x xxxxxx xxxxxxxxx xx xx xxxx xxxxxxxx xxxxxxx xxxx xxxxxxxxxx xxxxx xxx zajištění xxxxxxx xxxxx xxxxxxxxxx. Xxx xxxxx xxxxxxxxxxx, xxxxx xx xxxxxx xxxxxxxxx xxxx xxxxxxx xxxxxxx banky, xx xxxxxx xxx xxxxxxx xxxxxxxx xxxx bankovní xxxxxx v xxxxxxxxx, x xxxx xxxxxx xx xxxx xx xxxxx dobu xxxxxxxxx xxxxxxxxxx xxxxxxxxx pro xxxxxxxxxx xxxxxxxxxxxx, což xx xxxxx xxx xxxxxxxxx pro činnost xxxxxxxxxx. Xxxx xx xxxxxxx xxx každé xxxxxxxx xxxxxxxxx, kde xx chtěl xxxxxx xxxxxxxxx zajištění xxxxxxx xxxxx bankovní xxxxxxx. Xxxxx xxxx xxxxxxxx xxxxxxx xxxxx xx xxxxxxx i nové xxxxxxxxxx a činnosti xxx Xxxxxx ústav xxx xxxxxxxx xxxxx, xxxxx by xxx xxxxx stranou, u xxx xx xxxx xxxxxxx ručení x xxxxx xx byla xxxxxxxx do řešení xxxxxxxxxx odškodnění.
Varianta 2
Další xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxx náhrady xxxxx způsobené subjektům xxxxxxxxx bylo založení xxxxx xxxxxxxxxxxxxxx xxxxxxxxxxx xxx xxxxxxx škody. Xxxx řešení xxxxxxxxxxxxx xxxxxxxxxxx xxxxxxx se xxxxxxxxxxx, xx jejich xxxxxxxx xxxxxx xxxxx xxxxxxxx xxxx vytvořit. Xxxx xxxxxxxx nemohla xxx xxxxx dále xxxxxxxxxxxxxx a xxxx xxxxx ani dále xxxxxxxxx.
Xxxxxxxx 3
Xxxxx xxxxxxxxxx xxxxxxxxx xx stanovení xxxxxxx xxxxxxxxxx xxxxxxxxxx xxx po xxxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx platné xxxxxxxxx xxx, xxxxxxxx xxxxxxxxxxxx x xxxxx xxxxxxxxxxxx, xxxxx xx xxxxx xxxxxx za xxxx xxxxxxxx xxxxxxxxx xxxxxxxxx v důsledku xxxxxx účasti v xxxxxxxxx hodnocení xxx xxxx xxxxxxxxx, xxx. xxxxxxxx xxxxxx systém xxxxxxxxxx. Xxxxxxx xxxxxx xxxxxxx xx možné xxxxxxxxx odškodnění pojišťovnou x xxx xxxxxxxxx xxxxx, xxx xx xxxxxx osvědčil.
Kritéria xxxxxx xxxxxxx
Xxxx hlavní xxxxxxxxx xxxx xxxxxxx xxxxxxxxxx x xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xx xxxxxxx xxxx.
Xxxxxxxx 1 xxxx zamítnuta, xxxxxxx xxxxxx xxxxxx xxxxxx proti xxxxxxxxx xxxxxxxx odškodnění xxxxxx xxxxxxxxx. Systém náhrady xxxxx xxxxxxxxxxx x xxxxxxxxx xxxxxx xxxxxxxx xxxxxx xx byl xxxxx xxxxxxx pouze xxx nízkointervenční (xxxxxxxxxxxxx) xxxxxxxx xxxxxxxx xxxxxxxxx. X xxxxxxx menších xxxxxxxxxx zadavatelů (nízkobonitních) xx xxxx xxxxxxxx xxxxx xxx x xxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxx xxxxxxx xxxxx. Varianta 2 xxxxxx s ohledem xx xxxxxxxxx dotčených xxxxxxxx dále xxxxxxxxxxxxxx. Xxxx nejvhodnější xxxx xxxxx xxxxxxx xxxxxxxx 3, kdy tato xxxxxxx též xx xxxxxxxxx xxxxxxxxx praxe. Xxxx varianta xxxxxxxx xx systému náhrady xxxxx zajištěné komerčním xxxxxxxxxx xx xxxxxxxxx x x xxxxxxxxxxx x xxx xxxxxxxx xxxxxxxxxx xx xxxxxxxxxxxxxxxx.
Xxxxxx xxxxxx týkající xx xxxxxxx xxxxx způsobené xxxxxxxxxxxx xxxxxxxxxx
Xxx xxxxxxxxxx xxxxxxxxxx xx xxxxx xxxxxxx nemožnosti realizace xxxxxxxxxx hodnocení xxxxxxx xxxxxxxxxx xxxxxxxxx, xxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx x finančních xxxxxx xxxxxxxx xxxxxxx xxxxxxx xx xxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxx xxxxxxxxx. Xxxx pojištění je xxxx xxxxxxxx xxxxxxxxx x xxx jeho xxxxxxxxx xx nesmí xxxxxxxx hodnocení xxxxxxxx. Xxxxxxxxxx xxxxxxxxxx xxx xxxxxxx xxxxxxxx xxxxxx x xxxxxxxxx xxxxx xx x rozpočtu xxxxxxxxxxxxxx xxxxxxxx x x xxxxxxx, xx xxxx xxxxxx xxxxxxxxx, xxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxx.
Xxxxx xx proto x samostatné xxxxx xxxxxxxx v rámci xxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxx, kdy x xxxxxxx x xxxxxxxxxx xxxxxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxx u xxx. nekomerčních zadavatelů. Xxxx varianty xxxx xxxxxxxxx na xxxxxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxxx: xxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx za xxxxxxxx xxxxx xxxxxxxxxxxxxxxxxx xxxxxxxxxxxx xxxxxx xx pohybují xxxx 40 až 100 xxxxxx korunami xx xxx; v xxxxxxxxxx 10 xxxxxx xxxxx xxxxxxx xxxxx xxxxxxxxx xx xxxxxxxxxx x xxxxxxxxxxxx klinického xxxxxxxxx; akademici xxxx xxxxxxxxxx zadavatelé xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxxx, na xxxxx xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx xxxxxxx, xxxxxxx xxx xxxxxx ekonomických xxxxxxx xxxxxxxxxx xxxxxxxx xxxxx zahrnout xxxxxxxxx. X takovém případě xx xxxxxxx xxxxxx xxxxxxx, xxx získat xxxxxxxx zdroje pro xxxxxxxxx xxxxxxxxx, které xx nařízeno jako xxxxx z xxxxxxxx xxxxxxxxxx hodnocení stanovenou xxxxxxx č. 378/2007 Sb., ve xxxxx xxxxxxxxxx xxxxxxxx.&xxxx; Xxx xxxxxxx xxxxxxxxxxxxxx xxxxxx xxxxxx xxxx xxxx proto zvažováno xxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx a xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxx xx xxxxx XX x xxxxxxxxxxx x xxxxxxx x xxxxxx xxxxx, tzn. podle xxxxxxx údajů x xxxxxxxxx xxxx dle xxxxx xxxxxxxxxxx off xxxxx xxxxxxx (xxxx. xxx xxxxxxxxxxx pacienty) xxxxxx xxxxxxx xxxxxxxxx xxxxxxxxxx odškodnění xxxxxx xxxxxxxxxxxxxxx Xxxxxxxxxxxx zdravotnictví.
Definice xxxxxxx xxxxxxx xxxxxxx xxxxx způsobené nekomerčními xxxxxxxxxx
Xxxxxxxx 1 = xxxxxxx xxxxx xxxxxxxxx xxxxxx xxx xxxxxxxxxx xxxxxxxxxx
Xxxx by xxxxxx x xxxxxxx způsobené xxxxx xxxxxxxx klinického xxxxxxxxx xxxx xxxxx xxxxx z xxxxxxxxxx xxxxxxxxxxx x xxxxxx xxxxx x xxxxxxxx Xxxxxxxxxxxx zdravotnictví.
Varianta 2 = xxxxxxxxx xxxxx xxx xxxxxxxxxx xxxxxxxx x Xxxxxxxxxxxx xxxxxxxxxxxxx
Xxxx xxxxxxxx by xxxx xxxxxx xxxxxxx xxxxxxxxx xxxxxxxx zřízení xxxxx x ostatních xxx xxxxxxxxxx xxxxxxxxxx.
Xxxxxxxx 3 = xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxxxx zdravotních služeb, xxxxx jeho pojištění xxxxxxxx pokrývá xxxxxxx xxxxxxxxxxxxxx léčivých přípravků x xxxxx xxxxxxxxxx xxxxxxxxx.
Xxxxxxx x přínosy xxx xxxxxxxxxx xxxxxxx xxxxxxxx
Xxxxxxxx 1
Přínosem xxxx xxxxxxxx xx xxxx xxxxxxx akademického výzkumu xxxxxxxx x úsporou xxxxxxxxxx xxxxxxxxxxxx xx xxxxxxxxx xx xxxxxxx, xxx dle xxxxxxxxxx xxx xxxxx x xxxxxxxxxx letech zaznamenán xxxxxx, kdy xx xxxxxxx xxxxxx xxxxxxxxx xxxxx x xxxxxxxxxx. Xxxxxxx by xxxx xxxxxxx x xxxxxxxx xxxxxx xxxx xxxxx x xxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx.
Xxxxxxxx 2
Xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx národního xxxxxxx xxxxxxx xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxx xxxxxxxx xxxxx xxx xxxxxxxxxx subjekty x Ministerstva xxxxxxxxxxxxx. X xxxxxxx případě xx xxxxx xxx xxxxx jiného xxxxxxxxx xxxxxx uvažovaného xxxxx, xxxxxx xxxxxxxxxx xxxxxxxxxx, xxxxxx xxxxxxxxxx zaměstnanců xxxxx a v xxxxxxxxxx řadě xxxx xx, x jakých xxxxxx, x xxxx xxxx a x xxxxxx xxxxxxxxxxx xx xxx xxxx xxxxxxxxx. X úvahu xxxxxxxxxx xxxxxx xxxxxxxxx xxxxxx xx zdrojů xxxxxxxxxxxx, xxxxx by xxxx xxxxxxxxxx příspěvky xxxxxx xxxxxx xxxxxxx xx xxxxxxx výdajů xx xxxxxxxxx xxxxxxxxxx xxxxxxxxx. Xxxxxxxx x xxxxxx xxxxxxx nákladům na xxxxxx xxxxx x xxxx činnost xxxx xxxx řešení xxxxxxxxxxx xxxx xxxxxxxxxxx a xxxxxxxxx.
Xxxxxxxx 3
Třetí variantou xx xxx xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx prostřednictvím pojištění xxxxxxxxxxxxx xxxxxxxxxxx služeb, xxxxx xxxxxxxxx činnosti xxxxxxx použití xxxxxxxx xxxxxxxxx v xxxxx xxxxxxxxxx xxxxxxxxx. Xxxxxx xxx xxxxxxxx x xxxxxxxxx pojištění.
Kritéria xxxxxx xxxxxxx
Xxxx hlavní kritérium xxxx zvoleno zohlednění xxxxx xxxxxxxxxxxx komerčních xxxxxxxxxx.
Xxxx xxxxxxxxx xxxxxxxx 1 x 2 Xxxx řešení by xxxxx mohlo znamenat xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxx. Xxxxx xx xxx xxxxxxxx znamenaly xxxxx xxxx xxxxxx ministerstva. X ohledem na xxxx uvedené, xxxx xxxxxxx varianta 3, xxxxx xxxxxxxxx xxxx xxxxx xxxxxx náhrady xxxxx xxx nekomerční xxxxxxxxxx x nízkointervenčních xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx x xxxxx xxxxxxxxx xxxxxxxx xxx poskytovatele xxxxxxxxxxx xxxxxx, x xxxxx. xxxxxxxxx pojištěním xxx xxxxxx xxxxxxxxxxxx, x xxxxxxx případě by xxxxx připojištění nebylo xxxxxxxxxx.
2.2. Xxxxxxxx xxxxxxxxx x omezení xxxxxxxxx xxxxxxxx přípravků
Článek 36 Xxxxxxx o xxxxxxxxx Xxxxxxxx unie stanoví xxxxxx, pro xxxxx xxxxx členské státy xxxxxxxx xxxxxxxxxxxx xxxxxxxx, xxxxx xxxxx xxxxxxxxxxxxxx xxxxxxx. Jedním z xxxxxx xxxxxx xx xxxxxxx xxxxxx a xxxxxx xxxx. Xxxxxx xxx xxxxxxxx xx xxxxxxx čl. 81 xxxxxxxx 2001/83/XX xx xxxx xxx xxxxxxxxxx xx xxxxxxx ochrany xxxxxxxxx xxxxxx.
Xx účelem xxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx potřeby xxxxxxxx x České republice x důvodu ochrany xxxxxxxxx xxxxxx xxx xx xxxxx xxxxxxxx xxxxxxxx, xxxxx by xxxxxxxxx xxxxxxxxx xxxxx.
Xxxxxxxxxxx xxxxxx xxxxxxx xx xxxxxxxxxx do právní xxxxx xxxxxxxxx xxxxxxxx x jedná xx x xxxxxxxx xxxxxx xxxxxxxxxxx mechanismů.
Při xxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxxx byla xxxxxxxxx xxxxxxx následující xxxxxxxx (xxxxx xxxxx být xxx xxxxxxxxxx xx xxxxxxxx) právní úpravy:
- xxxxxxxxxxx;
- xxxxxxxxxxxxxxx;
- xxxxxxxx;
- xxxxxxxxxxxx;
- xxxxxxxxxxxx;
- ekonomická xxxxxxxx;
- xxxxxxxx;
- xxxxxxxxxx.
Xx xxxxxxxxxxx - xxxxxx xxxxxx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxx, xxxxx účelem xx xxxxxxx vývozu xxxxxxxx xxxxxxxxx xxxxxxxxxxx xxx xxxxxxxxxxx xxxxxxxxx xxxx x Xxxxx xxxxxxxxx v případě, xx xx xxxx x Xxxxx xxxxxxxxx xxxx xxxxxx jejich xxxxxxxxxx xxx xxxxxxx xxxxxxxx a xxxx xxx xxxxxxxx xxxxxxxx xxxx a xxxxxxx xxxxxx x života xxxx. Xxxxxxxxxxx právní xxxxxx spočívá xx xxxxxxxxx xxxxxxxxxx xxx xxxxxxxxxxxx xxxxxx nedostupnosti xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxx x Xxxxx republice (xxxxxx xxxxx a stanovení xxxxxxxx a postupu xxx xxxxxxxxxxxxx xxx), xxxx xx xxxxxxxxx xxxxxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxx hrozby xxxxxxxxxxxxx xxxxxxxx přípravků xxx potřeby xxxxxxxx x Xxxxx xxxxxxxxx x xxxxxxx xx xxxxxxxxx xxxxxxxxxxx xxxxxx xx xxxxxxxx xxxxxxxxx xxxxxxxx. Úprava xxxxxx xxxxxx jak na xxxxxx xx xxxxxxxxx xxxxx Evropské xxxx, xxx xx třetích xxxx.
Xx xxxxxxxxxxxxxxx - xxxxxxxx xxxxxx je xxxxxxx xxx, xxx xxxx xxxxxxx xxxxxxxx x co největší xxxxx xxxx xxxxxxx xxxxxxxxx xxxxxxx xxxxxxx xxxxxxxx a zároveň xxxx xxxxxxx xx xxxx xxxxxxxxxx xxxxxxxx. Xxxxxxxxxxxxx xxxxxx xx xxxxxxxx xxx x xxxxxxx xxxxxxxxxxxx x xxxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx přípravků xxx xxxxxxx xxxxxxxx x Xxxxx republice, tak x xxxxxxx přijetí xxxxxxxxxxx xxxxxxxx. Dotčené xxxxxxxx xxx mají xxxxxxxxxx xxxxxxx obrany xxxxx xxxxxxxx xxxxxxxxx.
Xx xxxxxxxx - xxx xxxxxxxx transparentnosti a xxx xxxxx xxxxxxxxxxx xxxxxxxx navrhovaného systému xx xxxxx x xxxx xxxxxxx x xxxxxx právní xxxxxxx xxxxxxxx xxxxxxxxxx právní xxxxxx xx xxxx xx nejpřesnější x xxxxxxxxxxxxxxxxx xx xxxxxx xxxxx xx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx.
Xx xxxxxxxxxxxx - xxxxxxxx x postup xxx vyhodnocování nutnosti xxxxxxxx xxxxxxxx za xxxxxx omezení reexportu xxxx xxxx x xxxxxxx xx xxxxxx xx xxxxxxx xxxxxx x xxxxxx xxxx x v xxxxxx xxxxxxxxxx případě xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxxx xxxxxxxx xxxxxxxxxx opatření.
Ad minimalizace - x souladu xx zásadou přiměřenosti xxxxxx úpravy je x xxxxxx xxxxxxx xxxxxxxx vhodnosti x xxxxxxx nutnosti xxx xxxxx Xxxxxxxx xxxx xxxxxxx varianta xxxxxxx xxxxxx xxxxx v xxxxxxxxx, xx kterých xx xxx xxxxxxxxxxxx xxxxxxx zájem xx xxxxxxx xxxxxx a xxxxxx lidí. Na xxxxxxx xxxxxxxxxxxx systému xxxxx dat a xxxxxx vyhodnocování xxxxx x xxxxxxxxx xxxxxxxxxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx. Xxxxxxxxxx xxxxxx xxxxxx zavádí xxxxxx, xxxxx v xxxxxxxx xxxxxxxx xxxxxxxx pouze xxxxxxxx část xxxx x nejedná xx xxx o xxxxxx xxxx xxxxxxxxxx xxxxxxx. Xxxx xxxx xxxxx xxxxxxxxxxx rozpor se xxxxxxx xxxxxxx xxxxxx xxxxx. Xxxxxxxx xx xxxxxxxx xxxxx xx xx xxxxxxx, xxx xxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxxxxx léčivých xxxxxxxxx, xxxxxxxxxxxx velmi významných xxx potřeby zdravotní xxxx u xxxxxxxx x Xxxxx xxxxxxxxx. Xxxxx xxxxx xxxxxxxx xx xxxx xxxxxxxx xxxxxxxxx xxx, xx xx xxxx použití xxxxxxx xxxxx na xxxxxx xxxxxxxxx, xxxxx xxxx xxxxxxxxxxxx xxxxxxxxxxxxxx. Xxxxxxxxx xxxxxx xxx xxxxxxxxx mimořádnost xxxxxxx xxxxxxxxxxx opatření, a xx výlučně pro xxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx pacientů v Xxxxx republice.
Ad xxxxxxxxxx xxxxxxxx - xxxxxx xx xxxxxxx xx xxxxxxxx, xxxxx využívá xxx xxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxx x xxxxxxxxxxxx x xxxxxxx xxxxxxxxxxx k xxxxxx xxxxxxxxxx x analýze, x tak nepřiměřeně xxxxxxxx dotčené regulované xxxxxxxx ani xxxxxx xxxxxxx xxxxxx. Xxxx xxxxxxx xxxxxxxx jednoduchého x xxxxxxxxxxx systému.
Ad xxxxxxxx - za xxxxxx zajištění xxxxxxxx xxxxxx xxxxxx xx xxxxxxxxx nutnost xxxxx xxxxxx úpravy xx xxxxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxx (xxxx. intervaly xxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxx, xxxxxxxxx xxxxxxxx, xxxxxxxx xxxxxxxx x rozsahu xxxxxxxxxxxxx xxxxx v hlášeních).
Ad xxxxxxxxxx - za xxxxxx xxxxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxx jsou xxxxxxxxx xxxxxxxxxxxx xxxxxx v xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx. Xxxx sankce xxxxxxxx xxxxxx xxxx, xxx x nich xxx xxxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxx.
Xxxxxxxxxxx xxxxxxx xx xxxxxx hrozba xxxxxx nedostupnosti xxxxxxxx xxxxxxxxx pro potřeby xxxxxxxx x Xxxxx xxxxxxxxx. Pokud xx xxxxx x výpadky xxxxxxxxxxx x důvodů xx xxxxxx xxxxxxxx xxxxxxxxxx x xxxxxxxxxx, xxxx xxxx v xxxxxxxxxx §33 odst. 2 xxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxx hlásit přerušení xxxx ukončení xxxxxxx xx xxxxx trh xxxxxxx 2 xxxxxx xxxxxx.
Xxxxxxxxxxxx xxxxxxxxxxxxx léčivých xxxxxxxxx a xxxxxxxxx xxxxx je xxxxxxxx xxxxxxx x Xxxxx xxxxxxxxx, xxx xxx xxxxxx EU. Xxxxx xxxxxxxxx xxxxx xx xxxxxxxx xxxxxxx x x xxxxxxx xxxxxxxx xxxxxxxxxxx se xxxxx xxxxxxxxxx obchodní činnost. Xxxxxxxxxxx xxxxxxxx xxxxxxxxx xx x xxxxxxxx xxxxxxxxxx dostatečného zásobování xxxxxxxxxxxx xxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxx xx xxxxxxxxxxx zdravotních xxxxxx x Xxxxxx. X xxxxxxxx xxxxxxxx může xxxxx x xxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxx xxxxxxx xx xxxxxx x vývoj xxxxxx xxxxxxxx přípravků xxxx x xxxxxxxx xxxxxxxxxxxx xxxxx xx xxxx x xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx se xxxxxxxxx. Xxxxxxx xx, xx xxxxxxxx xxxxxxx xxx s xxxxxxxx xxxxxxxxx má xxx xxxxxxxxx xx xxxxxx xxxx ovlivněná xxxxxxxx xxxxxxxxxxx xxx xxxxxxxx xxxxxxxxx x výše xxxxx x xxxxxxxxx xxxxxxxxxx v jednotlivých xxxxxx. Xx xxxxxxx, xxx i xxxxxx xx xxxxxxxx xxx x xxxxxx xx xxxxxxxxx xxxxxxxx a xxxxxxxxxxx xxxxxxx jednotlivých xxxxx x xxx xxxxxxxx x xxxxxxxx xxxxxxxx xxxxxxxxxx xxxx x xxxxxxx xxxxxxxx xxxxxxxxx tento xxx xxxxx xxxxxxxx.
Xxxxxxxx x xxxxxx reexportů narůstá xxx počet xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxxxx xxxxxxx XX. Xxxx xx xxxxx xxxxxxx objevuje problém x xxxxxxxxxxxxx konkrétních xxxxxxxx xxxxxxxxx ve xxxx xxxxxx XX xxxxxxxx, xxx xxxx x xxxxx xxxxxxxxxx xxxxx xx xxxxx xxxxxxxx přípravků ze xxxx x xxxxxxxxxxx xxxxxxx hladinou. X xxxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxx xxxx xxxxx xxxxxx xxxxxxxx a xxxx xxxxxxxxxxx stavu. Xxxxx x xxxxxxxxx, xxx xxxxx xxxxxx xxxxxxxxxxxx léčivých xxxxxxxxx xxx potřeby pacientů x Xxxxx xxxxxxxxx (xxxxx se tak xxxxx xxxxxx xxxxxxxxx, xxx xxxxxxxxxxxx xxxxxx xxx. xxxxx xxxxxxxxx xxxxxxxxx ohledně léčivých xxxxxxxxx Xxxxxxx, Actilyse x XxxxxxxXxxxxxx), xx xx xxxxxx naplnění xxxxxxxx xxxxxx státu xxxxxxxxxxxx xxxxxxx xxxxxx x xxxxxx lidí xxxxxxxx xxxxx xxxxxxxx xxxxxxxxx opatření x xxxxxxx jak x xxxxxxxxx právními xxxxxxxx, xxx se xxxxxxx xxxxxxxxxxxxx z mezinárodního xxxxx.
Xxxxxxx problém přitom xxxx řešitelný změnou xxxxxx a xxxxxxxxx xxxxxx x xxxxxxxx xxxxxxxx léčivých xxxxxxxxx xxxxxxxxx x toho xxxxxx, xx ať xx je tato xxxxxxxx xxxxxxxx, x xxxxxxxx xxxxxxxxx, xxxxxx xxxx x xxxxxxx xxxxxxx, bývá xxx xxxxxxxxxx finančně xxxxxxxxxx xxxxxxx jím xxxxxxxxxxx xxxxxxx na xxx xx vyspělejších ekonomikách xxx x xxxxxxxxxxx xxxx xxxxxxxxx. Xx xx xxxx xxxxxxx xxxxx kupní sílou xxxxxxxxxxxx v xxxxxx xxxxxxxxxx vyspělejších xxxxxx, xxx xx xxxxxxx xxx xxxx xxxx xxxxxxxxx zpravidla xxxxxxx x xxxx schopni xxxxx xxxxx xxxxx xxxxxxxxxx xxxxxxxxxx, a x této xxxxxxxxxxx xxx vycházejí postupy x xxxxxxx všech xxxxxxxxxxxxxxxx xxxxxxxx, včetně xxxxxxxx xxxxxxxxxx, lékáren, xxxxxxxxxxxx x zdravotních xxxxxxxxxx. Xxxx prostředky xxxxxx x xxxxxxxx xxxxxxxx xxx x xxxxxx věci nemohou xxx xxxxx xxxx xx xxxxxxxx x xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx x xxxxxx xxxxx v xxxxxxx, xx xxxxxx již x xxxxxxxxx rovněž xxxxx x xxxxx xxxx xxxxx xxxxx. Xxxxx xxxxxxxxxx cenové x xxxxxxxx xxxxxxxx xxxxx mít xxxxx xx v xxxxxxxxxxxxxx xxxxxxx horizontu, zatímco xxxxxxx nedostatečného zajištění xxxxxxxxxx xxxxxx xxxxxxxx x Xxxxx xxxxxxxxx xxxxxxxxx léčivým přípravkem xxxx xxxxxx xxxxxx xxxxxx x xx xxxxx jej xxxxx xxxxxxxxxx. K uvedenému xx xxxx třeba xxxxxxxxxx, že xxxxxxxxxxxxx xxxxxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxxxxx přípravku xxx xxxxxxxx x Xxxxx xxxxxxxxx je xxxxxxxxx x xxxxxx xx x xxxx rámci xxxxxxx účinnost cenové x xxxxxxxx regulace xxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxx xx xxxxxxxx xxxxxx xxxxxx xxxxxxx xxxxxxxxx xxxxx xx xxxxxx x xxxxxxxx, který xxxxxxxxx xxxxxxxx problematiku xxxxx x xxx xxxxxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxx. Xxxxxxxxxx x xxxxxxxxxxx xxxx xxxxxxxxxxxxx x xxxxxx i xxxxxxxxxxx xxxxxxxxx orgánů xxxxxx xx xxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxx léčivých xxxxxxxxx xxxxxxxxx x Xxxxx republice xxxx x xxxxxx o xxxxxxxx xxx částečně xxxxxxxx, praktické xxxxxxxxxx x aplikace xxxxxxxxx xxxxxx xxxxxx a xxxx nedostatečné vymahatelnosti xxxx xxxx xxxxxxxxxx xxxxxxx jejího zpřísnění x doplnění.
Stávající xxxxxx x xxxxxxx xx xxxxxxxxx xxx xx xxxxxxxxxxxx xxxxxxxxx z xxxx xxxxxx, že xxxxxxxxx xxxxxx xxxxxxxxxxxxxxxx xxxxxxx xxx distributory xxxxxxxx xxxxxxxxx x xxx xxxxxxxxxxxxx oprávněné xxxxxxx léčivé přípravky. Xxxxxxxxx xxxxxxxxxx §11 xxxx. x) xxxxxx xxxx xxxxxxxxxxx xxxxxx xxxxxxx x řešení xxxxxxx, xxx&xxxx; xxxxxxxx xxxxxxxxxx xxxxxxxx přípravků xx zahraničí xxxxxx xxxxxxx xxxxxx dosáhnout xxxxxxx zisku xxxxxxx xxxxxxxx xxxxxx xxxxxxxx x Xxxxx xxxxxxxxx, x taktéž tohoto xxxxxxxx xxxx x xxxxxxxxxxx xxxxxxxxx x xxxxxx nedostatku jiných xxxxxxxx xxx xxxxxxx, xxxxx nejde x xxxxxxx, který xx xxx založen xxxxxxx xxxxxxxxx x se xxxxxxxxxxx všech xxxxxxxxxx xxxxxxx a xxxxxxxxxxxxx xxxxxxxx jistot a xxxxxxxxx xxxxxxxxx xxxxx xxxxxxxxxxxxxxxx subjektů.
K xxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx pacienty x Xxxxx republice xx xxxxxxxx xxxxxxxx určitý xxxxxxx xxxxxxxx xxxxxxxxxxx xxxxx a opatření, xxxxx xx xxxx xxxxxxx vytvoří xxxxx, xxxxx xx vhodný, xxxxxxxx x xxxxxxxxx x ohledem na xxxxxxxxx xxx, xxxxxx xx zajištění xxxxxxxxxxx xxxxxxxx xxxxxxxxx pro xxxxxxxx v Xxxxx xxxxxxxxx.
Xxxxxxxxxx xxxxx xxxxxxx x xxxxxxxx ze xxx xxxxxxxx provázaných xxxxx x xxxxxxxx. Xxxxxx x nich xx xxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxx nedostupností. K xxxxxxxxx xxxxxx xxxxxxx xxxxx xxxxxxx xxxxxxxx x distribuci, xxxxxx x xxxxxxxx léčivých xxxxxxxxx. Xxxxxxxxx a xxxxxxxxxx xxxxxx xxxxxxx xxxx xxxxxxxx formou xxxxxx xxxxxxxx obecné xxxxxx Ministerstvem xxxxxxxxxxxxx, xxxx xxxx zajištěno, xx xxxxxxx na xxxx xxxxxxxxxxxxxx xxxxx xxxxx xxxx xxxxxx xxx xxxxxxxxx stanovená xxxxxxxx řádem. Xxxxxxxxxx xxxxxx xxxxxxx xxxx xxxxxxxx ke specifické xxxxxx xxxxx xxxxxxxxxxxxxxxx xxxx xxxx xxxxxxx xxxxxxxxxx xxxxxxxxx xx xxxxx xxxxxxx, xxxxxx xxxx, že by xxxxxx xxxxxxxxxxxx xxxx xxxxxxx x xxx, xx xx xxxx xxxx, xx distribuce xxxxxxxxx x xxxxxx xxxxxxxxx xx xxxxxxxxx xxxx být výhledově xxxxxxx xxxx xxxxxxxx. X ohledem xx xxxx xxxxxxx xxxx xxxxx xxxxxxxxxxx xxxxxxx xxxxx xxxxxxxxxx xxxxxx xxxxxxxx přípravků xx xxxxxxxxx xx xxxxxx xxxxxxx xxxxxxxxxx. Měl xx totiž xxx xx xxxxxx, že xxxx xxxxxxxx xxxxxxxxxx xx xxxxxxxx pro xxxxxxx xxxxxx přípravky, xxxxxxx xx distributorem, xxxxxxx xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx x množství x xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxx xxxxxxxx x Xxxxx republice. Xxxxxx x těchto xxxxx x xxxxxxxx je xxx xxxxxxx zákonem xxxxxxxxxxx podmínek předání xxxxxxxxxxxx xxxxxxx Xxxxxx Xxxxxxxxxxxx zdravotnictví x xxxx, aby xxxxxx xxxxxxxx xxxxxx xxxxxx, xxxxxx by omezilo xx xxxxxxxx xxxxxxxxxx xxxxxxxx přípravku xx xxxxxxxxx, xxxxxxx xxxxx xxxxxx xxxx, ale x xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx. Třetím, x to xxx xxxxxxxxxxx xxxxxx x xxxxxxxxx xx xxxxxx xxxxxxxx obecné xxxxxx, xxxxxx při splnění xxxxxxx xxxxxxxxxxx podmínek Xxxxxxxxxxxx xxxxxxxxxxxxx omezí xxxx xxxxxx xxxxxxxxxx xxxxxxxxxxx léčivého přípravku xx xxxxxxxxx. Xxx xxxxxxxx takového xxxxxxxx xxxx opět zajištěno, xx dotčené xxxxx xxxxx moci xxxxxx xxx oprávnění stanovená xxxxxxxx xxxxx.
Xxxxxxxxxx xxxxx xx xxxx xxxxxx, xxxxxxxx a xxxxxxxxx x xxxxxxx xx xxxxxxxxx xxx, xxxxxxx x xxxx xxxxx xx xxxxxxxxxxx oprávnění xxxxxxxxxxxxxxxx xxxx se x xxxxxxxxxxx opatřením xxxxxxxx x xxxxxxxx x xxx stanoviska x zároveň xx xxxxxxxxx, xx xxxxxxx xxxxxxxx xxxxxxx xxx xx xxxxx x xxxxxxxxxx. Sledovaný xxx xx xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxx, xxxxx xxxx k uskutečňování xxxxxxxxxx maximálně šetrné x umožňují xxxxxxxxx x xxxxxxx nebo xxxxxx xxxxxxxxxx xxx x xxx skutečně xxxxxxxxx xxxxxxx, xxx xxxx x xxxxx xxxxxxxxxxx xxxxxxxx xxx xxxxxxx xxx xxxxxx x xxxxxxxxxx xx xxx xxxxx. Xxx xxxx xxxxxx, xx xxxxxxxxxx xxxxxx, xxxxx xx zejména xxxxx x xxxx xxxxxxxx xxxxxxxxxx §77c x §77d xx xxxxxx, xxxxxxx dostupnost xxxxxxxx xxxxxxxxx pro pacienty x Xxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxx a xxxxxx xxxx xxxxxxxxxxxxx x xxx xxxxxxx xxxxxxxxxxxx.
Xxxxxxxx xxxxxxx řešení xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx z xxxxxx xxxxxxxxx
Xxxxxxxx 1 = xxxxxx
Xxxxxxx variantou xx xxxxxx xxxxxxxxxxxx xxxxxx xxxxxx xxxxxx x xxxxxxxx xxxxxxxx omezení xxxxxxxxx xxxxxxxx přípravků.
Varianta 2 = xxxxx xxxxxxxxxxxx xxxxxx (xxxxxx x léčivech)
Zavedení xxxxxxxxxxx xxxxxxxxxxx opatření.
Náklady x xxxxxxx xxx xxxxxxxxxx xxxxxxx xxxxxxxx
Xxxxxxxx 1
Xxxxxxxxxxxx xxxxxx bude xxxxxxxx xxxxxxxxx současného xxxxx, xxx xx xxxxxxxxx xxxxxxx, že xx xx xxxx nedostupný xxxxxxxx xxxxxx xxxxxxxxx x xx tak xxxxxxxx zdraví pacientů x ČR. X xxxxxxxxx xxxxxx může xxxxxxxx x xxxxxxx xxxxxxxxx náklady, xxxxx xx jinak nebylo xxxxx vynaložit, xxxxx xx xx trhu xxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxxxxx (xxxxx xxxxxxxxx komplikací xxx.). Xxxxxxxx xxxx xxxx xxxxxxxx xxxxxxx xxxxxx xxxxx, xxxxx xx xxxx xxxxxx xxxxxxxx x ČR.
Varianta 2
Xxxxxxxxxxx xxxxxxxxxxx opatřeními by xxxx xxxxx xxxxxxxxx x x xxxxxxxx xxxxxxxx xxxxxx xxxxxx xxxxxx, xxxxx xx xxxxxxxxx xxxxx na xxxxxxx xxxxxx xxxxxxxx xx xxxxxx podnikatelských xxxxxxxx xx xxxxxxxxxxx xxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxx. Xxxx xxxxxxxxxx xxxxx xx bylo xxxxxxxxx xxxx x xxxxxxx x xxxxxx EU, xxxxx umožňuje xxxxxx xxxxx xxxxx xxxxx xx účelem ochrany xxxxxxxxx xxxxxx.
Xxxxxxxx xxxxxx xxxxxxx
Xxxx hlavní kritérium xxxx zvoleno zajištění xxxxxxx xxxxxxxxx xxxxxx x xxxxxxx x xxxxxx EU.
Varianta 1 xxxx zamítnuta x xxxxxxx xx akutní xxxxxxx xxxxx tento xxxxxxx (xxxxxxxxxxx se xxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxx xxxxxx xxxxxxxxx). Stávající xxxxxxxxxxx jej xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx. Xxx xxxxxxxxx xxxxxxxx xxxxxx úpravy x xxxxxx o léčivech xx x Xxxxx xxxxxxxxx nemohlo dojít x xxxxxxx xxxxxxxxxx xxxxx, xxx xxxxx xxx některé významné xxxxxx přípravky xxx xxxxxxxx v Xxxxx xxxxxxxxx nečekaně nedostupné x xxxx tak x xxxxxxxxx rozsahu xxxxxxxxx ochrana xxxxxx xxxxxx x zdraví, xxxxxxx xxxxxx státní xxxxxx xxxxxxx x xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx a kompetencí xxxxxx xxxxxxxx, která xx s xxxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxx xxxxxx xxxxxx xxxxxxx. Xxxx tak xxxxxxx xxxxxxxx xxxxx 2, xxxxx znamená přijetí xxxxxx xxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx.
Xxxxxx xxxxxxxxxxxx hrozby akutní xxxxxxxxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx
X xxxxx zvažování xxxxxxx xxxxxxxx xxxx přihlíženo xxx x xxxxx xxxxxxxxxxxx xxxxxxxxx států, xxxxx xxxxxxxx začínají xxxxxxx xxxxx xxxxx xxxxxx xxxxxxxx omezení xxxxxxxxx xx základě č. 81 xxxx. 2 Xxxxxxxx x. 2001/83 (xxxx. Xxxxxxxxx, Xxxxxxxx, Xxxxxxxxx a xxxxx) x xxx těchto xxxxxxxxxx xxxx xxxxxxx xxxxxxxxxx xxxxxxxx řešení.
Definice xxxxxxx systému
Varianta 1= xxxxxx xxxxxxxx (stávající xxxx)
Xxxxxxxx 2 = xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxx xx xxx xxxxxxxxx xxxxxxxxxx o xxxxxxxxxx
Xxxxxxxx 3 = xxxxxxxx xxxxxx povinnosti xxxxxxxxxxxx hlášení xxxxx xxxxxx
Xxxxxxxx 4 = xxxxxxxx xxxxxxxxxx distributorů xxxxxxx xxxxx xxxxxxxxx xxxxxx
Xxxxxxxx 5 = xxxxxxx souhlasu distributora xx xxxxxxxx rozhodnutí x registraci
Náklady a xxxxxxx pro xxxxxxxxxx xxxxxxx xxxxxxxx
Xxxxxxxx 1
Nepředložení xxxxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx stavu, xxx xx xxxxxxxxx xxxxxxx, že xx xx trhu nedostupný xxxxxxxx léčivý xxxxxxxxx x xx tak xxxxxxxx zdraví xxxxxxxx x XX. X xxxxxxxxx zdraví xxxx xxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxx, xxxxx xx jinak nebylo xxxxx xxxxxxxxx, pokud xx na xxxx xxxx dostupné xxxxxxxx xxxxxx přípravky (xxxxx xxxxxxxxx xxxxxxxxxx xxx.). Xxxxxxxx bude xxxx xxxxxxxx volného xxxxxx xxxxx, xxxxx xx xxxx zdraví pacientů x ČR.
Varianta 2
Xxxxxxxxxxxxx xxx a dodávání xxxxxxxx xxxxxxxxx xx xxxxxxxxxx xxxx x xxxxxxxxx členských xxxxx xx xx xxx xxxxxx xxxxx xxxxxxxxxx xxxxxxxx jednotlivých xxxxxx, xxx xxxxx ze xxxxx se podílí xxxxxxx xxxxxxxx (xxxxxx, xxxxxxxxxx, xxxxx x xxxxxxx) x zároveň xxxxxxxxxxxx xxxx xxx xxxxxxxxxx xxxxx. Xxxxxxxxxxx xxxxxxxxxxxx činností xx xxxxxx xxxxxxxxx xxxx xxxxxxxxxx xxxxxxxx tak, xxx xxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx celého xxxxxxx. X xxxxxxx xx xxxxxxx xxxxxx x neustálé xxxxxxxxx xxxxxx xxxxxxxxxx bádání xx xxxxxxxxx x xxxxxxx vynakládané xx xxxxx jednoho xxxxxxxx xxxxxxxxx. Xxxxxxxxx xxxxx xx farmaceutického xxxx xx xxxx jednoho xx xxxxxxx subjektu xx xxxxxx xxxx xxx x xxxxxxxx xxxxxxxx xxx xxxxx xx prostředky vynakládané xx xxxxxx xxxxx x xx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxxxxx xxxxxx. Xxxxxxxx xxxxxxxxxx xxxxxxxx zajistit xxxxxxx xx xxx xx x xxxxxxxx xxxxxxxx mohlo xxxxxxxx xxxxxxxxx systému, ve xxxxxx xx tito xxxxxxxxxx xxxxxxxxxxxx pro xxxxx xxxxxx xx xxxx xxxx. Xxxxxxxx xxxxxx povinnosti by xxxxx xxxxxxxx xxxxxxx xxxxxxx, xxxxxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxxxx 3
Nevýhodou xx xxxxxxxx administrativní xxxxx xx situace, xxx xxxxxxxxxxxx xxxxx xxxxxxx xxxxxx po xxxxxx xxxxxxxxxxx. Xxxxxxxx xx xxx xxxxxxxxx ke xxxxxxxx právních povinností. Xxxxxx by nebyla xxxxxxxxxxxxxx s ohledem xx xxxxxxxxxx cíl.
Varianta 4
Xxxxxxxx xxxxxxxxx xx xxxx preventivní xxxxxx xxx, xxx xxxxx xxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx v xxxxxxx xxxxxx xxxxxx xxxxxxxxxxxxx. Xxxxxxxx xxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxx xx Xxxxxxxxx, kdy xxx xxxxxxxxxx xxxxxxxxx xxx bylo řešeno x EU, xxx xx takováto xxxxxxxx xxxxxxxxxxxxxxxx. Xxxxxxx omezování xxxxxxxxx xxxxx v xxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxx xxx xxxxxxxxxxx xxxxxxxxx xxxx xxxxxxxx, xx xxxx přiměřenost x xxxxxxxxxx, xx xxxxxxxx xxxxxxxxxxxx xxxx (xxxxxxx xxxxxxxxx xxxxxx).
Xxxxxxxx 5
Xxxx xxxxxxxx xxxx zvažována x xxxxxxx xx xxxxxxxx informace ohledně xxxxxxxxxxxx xxxxxxxx x Xxxxxxxx. Výhodou získání xxxxxxxx distributora xx xxxxxxxx by bylo xxxxxxxxx xxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxx x xxxxx na xxxxxx xxxxxxxxx xxxxxxxx. Xxxxxxxxx xx xxxx xxxxxxxxx xxxxx účinně xxxxxxxxx x xxxxxxx xxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxxxx xxxxxx xxxxxxx
Xxxx xxxxxx xxxxxxxxx xxxx xxxxxxx xxxxxxxxxx x xxxxxxxx navrhovaného xxxxxxx.
Xxxxxxxx 1 byla xxxxxxxxx s xxxxxxx xx xxxxxxx xxxxxx xxxxx xxxxxxxxxx xxxxxxx, xxx bylo xxxxxxx xxx výše. Xxxxxxxx 2 byla xxxxxxxxx x xxxxxxx na xx, xx xx xxxxxxxx xxxxxxxxxx problém. Xxxxxxxx 3 xxxx xxxxxxxxx z xxxxxx xxxxxxxxxxxxxx x xxxxxxxxx xxxxxxxxxx. Xxxxxxxx 5 xxxx xxxxxxxxx s xxxxxxx xx to, xx by xxxxxxxx xxxxxxxxxx xxxxxxx. Xxxx xxxxxxxxxxxx byla xxxxxxx xxxxxxxx, xxx které xx xxxxxxxxxxxx xxxxxxx xxxxxxxxx vývoz pouze x xxxxxxxxx, xxx xx x xxxxxxxx xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxxxxx léčivých přípravků xxxxxxxxxx xxx xxxxxxxxxxx xxxxxxxxxxx služeb.
Právní forma xxxxxxx xxxxxxxxx
Xxx xxxxxxxxx xxxxxxx xxxxx xxxxxxxx xxxx (xxxxx xxxxxx xxxxxxxx) xxxxxxxxx x xxxxxxxx xxxxx xxxxxxxx xxxx XX:
- xxxxxxxxxxxx xxxxxxx xxxx (rozhodnutí x xxxxxxxxx věci xxxx konkrétnímu xxxxxxxxxx);
- xxxxxxxx xxxxxx xxxxxx (xxxxxxxx v xxxxxxxxx xxxx vůči neomezenému xxxxxx adresátu);
- xxxxxxxx (xxxxxxxxxx právní xxx).
Xxxxxxxx xxxxxxx xxxxxxxx forem xxxxxxx xxxxxxxxx
Xxxxxxxx 1 = nulová xxxxxxxx (xxxxxxxxx stav)
Varianta 2 = xxxxxxxxxxxx xxxxxxx xxxx
Xxxxxxxx 3 = xxxxxxxx xxxxxx xxxxxx
Xxxxxxxx 4 = xxxxxxxx
Xxxxxxx x xxxxxxx xxx xxxxxxxxxx dotčené xxxxxxxx
Xxxxxxxx 1
Xxxxxxxxxxxx návrhu bude xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxx, xxx xx xxxxxxxxx situace, xx xx xx xxxx xxxxxxxxxx významný léčivý xxxxxxxxx a xx xxx xxxxxxxx zdraví xxxxxxxx x ČR. X ohrožením zdraví xxxx xxxxxxxx i xxxxxxx xxxxxxxxx xxxxxxx, xxxxx xx xxxxx xxxxxx xxxxx xxxxxxxxx, xxxxx xx xx xxxx byly xxxxxxxx xxxxxxxx xxxxxx přípravky (xxxxx vzniklých xxxxxxxxxx xxx.). Přínosem xxxx xxxx xxxxxxxx xxxxxxx xxxxxx zboží, ovšem xx xxxx xxxxxx xxxxxxxx x XX.
Xxxxxxxx 2
Xxxxx xx xxxxxxxxx xxxx být xxxxxxxxx xxxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxx xxxxxxxxxx xx xxxxxxxx xxxxxx, xxxx xx xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxx. Xxxxxxx xxxxxx xxxxxx xxxxxxx časově náročná, xxxxxxx problém xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxx x xxxxxxx xx xxxxxx xxxxxxxx xxxxxx a zdraví xxxxx akutně.
Individuální xxxxxxx xxxx xxxxxxx rozhodnutí xxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx x xxxxxxxxx xxxx. Počet xxxxxxxx xxxxxxxxxxxx se na xxxxxxxxxxx je xxxxxx xxxxx, pokud bychom xxxxxxxxx xx budoucna xxxxxxxxx xxxxx počet (xxxxx xx xxxxx xxxxxxx získala xxxxxxxxxxx xxxxxxxxx), xxxxxxxxx xx xx xxxxx 2500. X tohoto xxxxxx xx xxxx xxxxxxx xxxxxx xxxxxxxxxxxxxxx xxxxxxx x nebylo by x xxxxxxxxx čase xxxxxxx postihnout a xxxxx daný xxxxxxx x xxxx xxxx.
Xxxxxxxx 3
Xxxxxxxx obecné povahy xx xxxxxx xxxxxxx xxx xxxxxxxx xxxxxxxxxxx xxxxx xxxxxxxx x xxxxxxxxx xxxx. X xxxxxx xxxxxxxx, xxx xxx předpokládat xxxxx xxxxx xxxxxxxxx xxxxxxxx, xx xxxx xxxx xxxxxx. Kritérium konkrétní xxxx (xxxxx xx xxxxxxx vývozu xxxxxxxxxxx xxxxxxxx xxxxxxxxx) xx xxx splněno. Xxx xxxxxx xxxxxxx xxxxxxxxx xxxxxxxxx xxxxxx oproti xxxxxxxxx xxxx xxx, xxx xxxxxx vyhovoval xxxxxxx x xxxxxxx xxxxxx xxxxxx xxxxxxxxxxxxx xx xxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxxxx xx xxxxxxx.
Xxxxxxxx 4
Xxxxxxxx xxxxxxxx xxxxxxxx je xxxxxx x (xxxxxx xxxxxx dle xxxxxxxxx xxxx x xxxxxxxx) xxxxxxx xxxxxx, což xx výraznou xxxxxxxxx, xxxxx xx xxx xxxxxxxxxx xxxxxx xxxxxxxxxxxx. Xxxxxxxx xxxxxxxx xxxxxxxx xx proto xxxxxxxx. Xxxxxxx xx obecná xxxxxxxxx x xxxxxxx xxxxxxxxx všechny xxxxxxx xxxxxxxx jedním xxxxxxxxx.
Xxxxxxxx xxxxxx variant
Jako xxxxxx xxxxxxxxx xxxx xxxxxxx xxxxxxxxxx (administrativní a xxxxxx) xxxxxxxxxxxx systému.
Varianta xxxxx 1 (xxx. xxxxxx xxxxxxxx) byla xxxxxxxxx s xxxxxxx xx xxxxxx xxxxxxx xxxxx tento xxxxxxx. Xxxxxxxxx xxxxxxxxxxx xxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx. Nejsou dostatečně xxxxxx xxxxxxxx příslušné xxxxxxx xxx omezování xxxxxxxxx. Xxxxxxxx xxxxx 2, kdy by xxxxxxxxx xxxx v xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx individuálních xxxxxxxxx xxxx, xxxx zamítnuta x ohledem na xxxxxxxxxxxxxxx x xxxxxxx xxxxxxxxx tohoto procesu. Xxxxxxxx xxxxx 4 (xxxxxxxx xxxxxxxx xxxxxxxx) xx opět xxxxxx x administrativně (xxxxx x xxxxxxxx) xxxxxxx xxxxxx, xxxxx xxxxx xxxxx x xxxxxx xxxxxxxx řešit xxxxxxxxx xxxxxx použít.
Jako nejvhodnější xxxx xxxxx zvolena xxxxxxxx xxxxx 3 (xxxxxxxx xxxxxx xxxxxx), xxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxx a x porovnání x xxxxxxxxx xxxxxxx xxxxxxxx xxxxxxx nejpřijatelnější xxxxxxx x xxxxxxxxxxxxxxx xxxxx xxx účely xxxxxxxxxx xxxxxxxx.
Xxxxxxxx xxxxxxxxx xxxxxxx xx xxxxxxx omezování xxxxxxxxx
Xxxxxxxx 1 = xxxxxx (současný stav)
Varianta 2 = xxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx
Xxxxxxxx 3 = xxxxx Xxxxxx xxxxx xxx xxxxxxxx xxxxx
Xxxxxxxx 4 = xxxxxxxxx pravomocí Xxxxxxxxxxxx xxxxxxxxxxxxx x Státního xxxxxx xxx kontrolu xxxxx
Xxxxxxxx 5 = xxxxxxx jiného xxxxxx
Xxxxxxxx 6 = xxxxxxx xxxxxx xxxxxx
Xxxxxxx x xxxxxxx pro jednotlivé xxxxxxx xxxxxxxx
Xxxxxxxx 1
Xxxxxxxxxxxx xxxxxx bude xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxx, xxx xx vyskytují xxxxxxx, xx xx xx xxxx xxxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxx x xx xxx xxxxxxxx xxxxxx pacientů x XX. S xxxxxxxxx xxxxxx xxxx xxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxx, které xx xxxxx xxxxxx xxxxx vynaložit, xxxxx xx xx trhu xxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxxxxx (xxxxx xxxxxxxxx xxxxxxxxxx xxx.). Xxxxxxxx bude xxxx xxxxxxxx volného xxxxxx xxxxx, xxxxx na xxxx xxxxxx xxxxxxxx x XX.
Xxxxxxxx 2
Xxxxxxxxxxxx xxxxxxxxxxxxx je xxxxxxxxx xxxxxxxx xxxxxxx xx xxxxx xxxxxxx xxxxxx xxxxxxxxxxxx. Xxxxxx x xxxx xxxxx xx (x rámci xxxxxxxx xxxxx zajištění xxxxxxx xxxxxxxxx xxxxxx) xxx xxxxxxxxx dostupnosti xxxxxxxx xxxxxxxxx. X tohoto xxxxxxxx by bylo xxxxxx, aby xxxxx xxxxxxxx zajišťovalo ministerstvo. Xxxxxxxx xxxxx je xxxx specifickou oblastí, x xxxxxxx výkonu xxx zřízen Xxxxxx xxxxx pro kontrolu xxxxx, xxxxx xxxxxxxxx xxx xxxxx regulace xxxxx xxxxxx administrativním xxxxxxxx a xxxxxxx xx xx xxxxx xxxxx (obdobně xxxx x jiných členských xxxxxxx XX) koncentrována. Xxxxxxxxx xxxxxxxx, xxx xx xxxxxxxxx xxxx xxxxxxxxx pouze Ministerstvem xxxxxxxxxxxxx, xx xxxxxxxxx xxxx, xxx xxxxxxx xxxxxxxxxxxxxxxxx činností zajišťuje Xxxxxx xxxxx xxx xxxxxxxx xxxxx. Xxxxxx xx xxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx, xx xxx xxxxxxxxx činnosti (xxxxxxx xxxxxxxxxxxx, xxxxxxxx x xxxxxxx o xxxxxxxx léčivých xxxxxxxxx xx prováděno Xxxxxxxx xxxxxx pro xxxxxxxx xxxxx).
Xxxxxxxx 3
Xxxxxx ústav xxx xxxxxxxx léčiv xx xxxxxxx xxxxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx x xxxxxxxxx většinu agend xxxxxxxxx x xxxxxxxx xxxxx. Xxxxxxx xxxx xxxxxxxx xx xxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxxx xx xxxxx xxxxxxxxxx xxxxxx xxxxx xxxxxxx. Nevýhodou xx xxxx xxxxxxx xxxxxxxxxx xx činnosti a xxxxx svěřené Ministerstvu xxxxxxxxxxxxx.
Xxxxxxxx 4
Xxx bylo xxxxxxx xxx xx xxxxxxxx 2 x 3, xxx orgány xx určitým xxxxxxxx xxxxxxxx na xxxxxxxx xxxxx x Xxxxx xxxxxxxxx. Činnost je xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxxx Xxxxxxxx ústavu xxx xxxxxxxx léčiv, přičemž Xxxxxxxxxxxx xxxx xxxxxxxxx xxxxx má „xxxxxxxxx“ xxxxxxxxx (ať xx xx xxxxx xxxxxxxxxx xxxxxxxxx xxxxxx nebo xxxxxx xxxxxxxxxx xxxxxx xxxxxxxxxxx orgánu xxxxxxxxxx xxxxxxxxxxxxx). X xxxxxx xxxxxxxx xx xxxxxxx, xxxxx by xxx xxxxxx xx xxxxxxxxx xxxxxxxxx xxxxxxxxxxxxxx. Tato xxxxx xxxxxxxxxx by xxxxxx měla být xxxxxxxxxxx. Xx. xxxx xx xxxxxxxx, xxx Xxxxxx ústav pro xxxxxxxx xxxxx xxxxxx x xxxxxxx xxxxxxxxx xx vznik xxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxxxxxxxxxxx a xxxxxxx, aby si xxxxxxxxxxxx xxxxx xxxx xxxxx vyžádat x xxxxxxx podezření, x xxxxxx se xxxxx x xxxxxxx důvodů. Xxxxxxxxxx xxxx xxxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxx odůvodnění xxxxxxxxx xxxxxxxx xx xxxxxx xxxxxxx xxxxxxxxx x xxxxxx xxx xxxxxxxx xxx xxxxx x xxxxxx, xxxxx xx xx xxxxxxxx léčiv x ČR xxxxxx. Xxxxxx xxxxxxxxxxxxxx žádná xxxxxxxx této xxxxxxxx.
Xxxxxxxx 5
Xxxxxxxxxx xxxxx orgán, xxxxx xx měl x xxxxxxxxxx xxxxxxxx xxxxx xxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxx Xxxxxx xxxxx xxx xxxxxxxx xxxxx. Xxxxxxxxx by xxxx xxxxxxxxxxxx xxxxxxxxx xxxx xxxxxx xxxxxx, xxxxx xx jí xxxxx nezabýval.
Varianta 6
Xxxxxxx xxxxxx xxxxxx by xxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxx.
Xxxxxxxx výběru xxxxxxx
Xxxx xxxxxx kritérium xxxx xxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxx.
Xxxxxxxx xxxxx 1 (xxx. nulová xxxxxxxx) xxxx xxxxxxxxx x xxxxxxx na xxxxxx xxxxxxx řešit xxxxx xxxxxxx. Stávající xxxxxxxxxxx xxx xxxxxxxxxx dostatečně xxxxxxxxx xxxxx. Xxxxxx xxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx postupy xxx xxxxxxxxx reexportů. Xxxxxxxx xxxxx 2, xxx xx xxxxxxxxx xxxx x xxxxxxxx xxxxxxxx xxxxxxxxx xxxxx Xxxxxxxxxxxxx xxxxxxxxxxxxx, xxxx zamítnuta x xxxxxx xxxxxxxxxxxx xxxxxxxxxxxx xx dosavadní xxxxxxx tohoto xxxxxx. Xxxxxxxx xxxxx 3 (xxxxxxxx xxxxx Xxxxxxx xxxxxxx xxx xxxxxxxx xxxxx) xxxx xxxxxxxxx x xxxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx xxx přijímání příslušných xxxxxxxx. Xxxxxxxx 5 x 6 xxxx xxxxxxxxx x xxxxxxx xx xxxxxx zřejmou xxxxxxxxxxxx x xxxxxxxxxxxxxx. Xxxx xxxxxxxxxxxx byla xxxxxxx xxxxxxxx xxxxxx xxxxx xxxxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx x Státního xxxxxx xxx kontrolu xxxxx, xxx xx xxxxxxxx xxxxxxxx již xxxxxx funguje xxxxxxxx x oblasti xxxxx xxxxxxxx v zákoně x léčivech (Xxxxxx xxxxx pro kontrolu xxxxx xxxx xxxxxxxxxxxx xxxxx x Ministerstvo xxxx druhostupňový orgán).
Volba xxxxxxx xxxxxx xxxxxxx xxxxxxxx
X xxxxxxx xx xxxx xxxxxxx xxxxxxx xxxxxxxx řešení, xxx xx dle xxxxxxxxx xxxxxxxx xxxxxxx efektivity, xxxxxxxxx x přiměřenosti xxxx xxxx nejvhodnější
- xxxxxxx xxxxxxxxxxxxxx xxxxxxxx;
- x podobě xxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxx xxxxx xxxxxxxxx xxxxxx;
- xx xxxxx xxxxxxxx xxxxxx xxxxxx;
- xxxxxxxxxx xx xxxxxxx xxxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx a Xxxxxxxxxxxx zdravotnictví; xx xxxxx xxxxxxxxxxx xxxxxxxxx xxxxx xxxxxxxx x xxxxxx xxxxxxxx podobu xxxxxxxxxxxx xxxxxxx.
Xxxxxxxx xxxxxxx xxxxxxxxx xxxxx xxxxxx xxxxxx omezení xxxxxxxxx
Xxxxxxxx 1 = Státní xxxxx by vydával xxxxxxxx xxxxxx xxxxxx, xxxxxx by xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx, x nichž xx xxxxxxxxxx distribuce xxxxxxx xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx, x xxxxxxx xx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx opatření xxxxxx xxxxxx, xxxxxx xx xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxx
Xxxxxxxx 2= xxxxxxxx xxxxxx povahy xx xxxxxxxx pouze Xxxxxxxxxxxx zdravotnictví a Xxxxxx ústav xxx xxxxxxxx léčiv xx xxxxxx xxxxxxxxxxxxxx léčivých xxxxxxxxx xxxxxxxxxxx v xxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx xx svém xxxxxxxxxxx xxxxxxxxxx
Xxxxxxxx 3 = Xxxxxxxxxxxx zdravotnictví xx xxxxxxxx xxxxxx xxxxxxxx přípravků, x xx xxxxxx xxxxxxxx xxxxxx xxxxxx, xx xxxxxxx xx xxxxxxxxxxx xx základě xxxxxxx xx xxxxxx Ústavu, x xxxxx xx xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx, a následného xxxxxxxx xxxxxx xxxxxx, xxxxxx by xx xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxx, přičemž x těmto xxxx xxxxxxxxx xx Státní xxxxx xxx xxxxxxxx xxxxx obstarával xxxxxxxx x činil xxxxxx x xxxxxxx, xxx xx xxxxxxx xxxx.
Xxxxxxx x přínosy pro xxxxxxxxxx xxxxxxx xxxxxxxx
Xxxxxxxx 1
Xxxxxx xxxxx xxx xxxxxxxx xxxxx xx xxxxxxx xxxxxxxx xxxxxx xxxxxx, xxxxxx xx xxxxxxxx seznam xxxxxxxx xxxxxxxxx, xxx xxxxxxx xxxxxxxxxx xx trhu x České xxxxxxxxx xx xxxxx xxxxxxxxx xxxxxxxxx nedostupnosti xxxxxxxx xxxxxxxxx xxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx x České republice x xxxxx xxxxxx xx xxxxxxxxxx xxxxxxxxxxxx. Xxxxxxxxxxxx zdravotnictví by xx xxxxxxx xxxxxxx Xxxxxxxx xxxxxx pro xxxxxxxx léčiv xxx xxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxx, xxxxxx xx omezilo xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxx Xxxxx republiky x xxxxxxx, že xxx xxxxxxxxxx léčivého xxxxxxxxx na xxxx x Xxxxx xxxxxxxxx xx xxxxx xxxxxxxxx xxxxxxxxx xxxx nedostupnosti xxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx v Xxxxx republice.
Zvýšené xxxxxxx x xxxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxxx ve xxxxxxxx xxxx xxxxxxxx xxxxxx xxxxxx, xxxxxxx xxxxxxxxx by nerespektovala xxxxxxxxx dotčených xxxxxx xxxxxx xxxxxx. Nebyly xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxx xxxxxxxx. Xxxxxxxxxxxxxxx xxxx xxxxxxxx xxxxxxx xxx v časové xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxx xxxxxx, xxxxxxx xxxxxxxxxxxx xxxxxxxx přípravků xx xxxxx xxxxx xxxxxx. Nepřiměřenou xxxxxx xxxxxxxx by xxxxxxxxx xxxxxxxx opatření obecné xxxxxx na xxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx, xxxx x ohledem xx xxx xxxxxxxxxx povinnosti xxxxxxx dodávek distributorů x držitelů x xxxxxx xxxxxxx Xxxxx xxxx analyzovat potřebná xxxx x identifikovat xxxxxxxxx xxxxxx xxxxxx xxxxxxxxxxxxx léčivých přípravků. X ohledem xx xxxxx XX a xxxxx xxxxx xxxxx xx xxxxx stanovit xxxxxx xxxxxxxx přípravků xxxxxxxxxx pro xxxxxxxxxxx xxxxxxxxxxx služeb.
Varianta 2
Xxxxxx xxxxx xx na xxxxxxx xxxxxxxx x xxxxxxx relevantních xxxxxxxx (xxxxxxxx xxxxxxxxxx o xxxxxxxxxx léčivých xxxxxxxxx, xxxxxxxxxxxx a xxxxxxxxxxxxx xxxxxxxxxxx k xxxxxx xxxxxxxx xxxxxxxxx) pravidelně xxxxxxxxxxx xxxxxx xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxxx by xxx xxxxxxxx umožňujícím xxxxxxx xxxxxxx ve xxxx informačním prostředku. X xxxxx xxxxxxxxxxxx xxxxxxx xx xx xxxxxxxx xxxxxx xxxxxxxxx, xxxxxxx nedostatek xx xx trhu Xxxxx xxxxxxxxx xxxxxx, a xx by xxxx x xxxxxxx xxxxxxxx xxxxxxx xxxxxxxxx xxxxxxx xxxxxxxx xx formě xxxxxxxx obecné xxxxxx Xxxxxxxxxxxxx zdravotnictví.
Varianta 3
Xxxxxx xxxxx pro kontrolu xxxxx xx xx xxxxx omezení xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx x xxxxx xxxxxx x xxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx. Výstupy xx xxxxx xxxxxxx xxxxxxxxx léčivých xxxxxxxxx xx xxx xxxxxx Xxxxxxxxxxxx zdravotnictví, které xx xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx, x xx xxxxxx xxxxxxxx xxxxxx povahy, x xxxxx by provedením xxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxxxxx xxxxxxxx přípravků, x xxxxxxxx xxxxxx xxxxxx, kterým xx xxxxxxxx distribuci v xxxxxxxxxx xxxxxxx.
Xxxxxxxx xxxxxx xxxxxxx
Xxxx hlavní xxxxxxxxx xxxx zvolena xxxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxxxx.
Xxxxx xxxxxxxx byla xxxxxxxxx x xxxxxx xxxxxxxxxxxx. Xxxxx xxxxxxxx byla xxxxxxxxx z toho xxxxxx, xx xx xxxxx xxxxxxxxxx xxxxxxxxxx xxxxx Ministerstva zdravotnictví xxxxxxx ústředního orgánu xxxxxx správy xxx xxxxxx regulace xxxxxxxx xxxxxxxxx. Byla xxxxxxx xxxxx varianta, xxxxxxx xx jeví jako xxxxxxxxxxxxxxx x xxxxx xxxxxxxxxxxx.
XXXXXXX XXXXXX VARIANT XXXXXXX OMEZENÍ REEXPORTŮ
Jako xxxxxxxxxxxx xxxxxx xxxx xx xxxxxxx xxxx xxxxxxxxx postupu xxxxxx xxxxxxx varianta vydávání xxxxxxx léčivých přípravků Xxxxxxxxxxxxx xxxxxxxxxxxxx, x xxxxxxx jejichž xxxxxx xx xxxxx k xxxxxxxx života a xxxxxx pacientů na xxxxx XX. Xxxxxx xxxxx pro xxxxxxxx xxxxx xxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxx x hlášení xxxxxxxxxxxx, xxxxxxxx a xxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx na xxxxx xxxxxxx.
Xxxx xxxxxxx xxxxxxxxx xxxxxxx se xxxxxx xxxxxxxx xxxxxx institut xxxxxxxx xxxxxx povahy, xxxxx xxxx xxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx, xxxxxxx xxxxx, v xxxxx xxxxxxxx xxxxx (xxx xx základě xxxxxxxxxxxx xxxxxxxxxx §11 xxxx. x) zákona o xxxxxxxx) je zajišťování xxxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxx XX. Xxxx xxx xxxxxxxx xx xxxxxxxxx xxxxxxxxxx Xxxxxxxxxxxx x xxxxxxx xxxxx vhodně xxxxxxx xxxxxxxx Státního xxxxxx xxx kontrolu xxxxx x xxxxxxxxx xxx, xxxxxxx xxxxxxxxx. Xxxxxxxxxxxx xxxx opatření xxxxxxx xx základě xxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx xxxxxxxxxx xx xxxxxxxxxxxxx xxx, x xx řádně xxxxxxxxxxxx. Tato data xx v případě xxxxxxx xxxx xxxx Xxxxxxxxxxxx xxx od Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx xxxxxxx.
Xxxxx xx x xxxxxxxx xxxxx xxxxxxxxx aktu, xxxxx xxxx xxxxxxx xxxxxx xx xxxxxxxx xxxxxxxxxx xxxxx xxxxxxxx x xxxxxxxxx xxxx. Xxxxxxxx k xxxxxxxxxx xxxxxxxxxxxx xx xxxxx xxxx xxxx xxxxxxx xxxx vhodná forma xxxxxxxx. Xxxxxxxxxx xxxxxx xxxxxx xxxxxxxxx x xxxxxxxxx potřeb xxxxxxxx x České xxxxxxxxx x k xxxxxxx xxxx xxxxxxx, kdy xxxx na xxxx xxxxxxxxxxxx xxxxxx xxxxxx xxxxxx přípravky xxxxxxxx xxxx xxxxx Xxxxx xxxxxxxxx, xx tak x xxxxxxx xx xxxx účelem xxxxxxxxx, xxxxxxxxxxxxx, xxxxxxxxxx účinná xx xxxxxx dopadu x xxxxxxxxx.
2.3. Xxxxxxxx xxxxxxxx xx vztahu x xxxxxxx xxxxxx xxx xxxxxxx xxxxxx xxxxxxxxx
Xxx xxxxxx tohoto xxxxxxxx nelze xxxxxxxxx xxxxx xxxxxxxx, než xxxxxx text xxxxxx x léčivech tak, xxx xxxx xxxxxxxxx xxxxxxxx zajištěna xxxxxxxx xxxxxxxx Xxxxxx x xxxxxxxxx xxxxxxxxx (XX) č. 1252/2014 xx dne 28. května 2014 xxxxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Rady 2001/83/XX, xxxxx xxx x xxxxxx x xxxxxx xxxxxxx xxxxxxx xxxxx pro xxxxxx xxxxx xxx xxxxxxx xxxxxx xxxxxxxxx. Každá xxxx xxxxxxxx xx xxxxx znamenat nebezpečí xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx orgánů Xxxxxxxx xxxx vůči Xxxxx xxxxxxxxx.
2.4. Xxxxxxxxxx Xxxxxxxx xxxxxx pro kontrolu xxxxx a Xxxxxxxxxxx xxxxxxxxxxx xxx
Xxxxxxxx 1 - xxxxx xxxxxx x xxxxxxxx
Xxxxx xxxxxxxxx xx novelizovat zákon x xxxxxxxx xxx, xxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx Státního xxxxxx xxx kontrolu xxxxx x Xxxxxxxxxxx xxxxxxxxxxx xxx. Inspirací x xxxxx xxxxx xxxx xxx xxx platný xxxxxx řád, x xx xxxxxxxxx xxxxxxxxxx §8 xxxxxx x. 226/2013 Xx., x xxxxxxx xxxxx x xxxxxxxxxxx výrobků xx xxx, xxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxx, x xxxxx xx xxxxx straně xxxxxxxxx právě Xxxxxxxxx xxxxxxxxxxx cel, x xxxxxxxxxxx xxxxxx xxx xxxxxxx komoditu xxx xxxx. Toto řešení, xx. změna xxxxxxxxxxx xxxxxx, xx x xxxxx ukázalo xxxx xxxxxxxxxxx, respektující xxxx xxxxxxxxx xxxxxxxxx xxxxxx xxxxxx xxxx xxxxxxx.
Xxxxxxxx 2 - Xxxxxxx xxxxxxxxxx novely xxxxxx x Xxxxx xxxxxx Xxxxx republiky x xxxxxx návrhu xxxxxx xxxxxx x xxxxxxxx
Xxxxxx xxxxxxxxx řešení xxxxxx xxxxxxxx xx přijmout x rámci připravované xxxxxx xxxxxx x xxxxxxxx doprovodnou xxxxxx xxxxxx č. 17/2012 Sb., o Xxxxx xxxxxx České xxxxxxxxx, xx znění xxxxxxxxxx předpisů, xx xxxxx xx xxxx x rámci xxxxxxxxxx §2 až 5 xxxxxx xxxxxx xxxxxxxxx xxxxxxxxx působnost Generálního xxxxxxxxxxx xxx x xxxxx xxxxxx.
Xxxxxxxx 3 - Vyčkání xxxxxxxxxx xxxxxxxxxx zákona x Xxxxx xxxxxx České xxxxxxxxx
Xxxxx xxxxxxxxx xx xxxxxx xxxxxxxxxx novelizace xxxxxx č. 17/2012 Sb., o Xxxxx xxxxxx Xxxxx xxxxxxxxx, ve xxxxx xxxxxxxxxx xxxxxxxx. Ač xxxxx xxxxx xxxxx xxxxxxxxx teprve xxxx 1. xxxxx 2013, xxx xxx xxxxxx xxxxxxxxx novelizován, xxxxx xxx xxxxxxxxxxxx xxxx xxxxx novelizace.
2.5. Prokazování xxx inspekční xxxxxxxx x xxxxxx xxxxxxxxx xxxxxxxxx x zabrání xxxxxxxx xxxxxxxxx
Xxxxxxxx 1 - xxxxxx
Xxx xxxxxxxxx xxxxxxxx právní úpravy x zákoně x xxxxxxxx xx xxxxxxx xxxxx x xxxxxxxxx x vhodnější xxxxxx xxxx xxxxxx, xxxxxxx xxxxxxxxx úprava xxx xxxxxxxxxx xxxxxxxxx z xxxxx x xxxxxxxxxx xxxxxxxxxxx potřebě, xxx xx xxxx xxxxxx xxxx být upraveny.
Varianta 2 - xxxxx xxxxxx x xxxxxxxx
Xxxx xxxxxxxx xx znamenala xxxxxxxxxxxx xxxxxxx xxxxxxxx x xxxxx xxxxxx xxxxxxxx podle xxxxxxxxxxx xxxx, když xx xxxxxxxxx x prokazování xxxxxxxxx inspektora xx xxxxxxxx xxxxxxxxx xxxxx xxxxxxx xxxxxx xxxxxxx xxxxxxxx. Dále by xxxxx x xxxxxxxxx xxxxxxxx xxxxxxxxx zajištění x xxxxxxx xxxxxxxx xxxxxxxxx xxx, xxx xxxxx xxxxxxxxxx dostatečný xxxxxxx pro xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxx x xxxxxx xxxxxxxx a účinných xxxxxxxx v xxxxxx xxx xxxxxxxx xxxxxxxx xxxxxxxx přípravků, xxxxx xxxxxxxxx xxxxxxxxx na xxxxxx xxxxxx, xxxxxxxx x xxxxxxxxxx. Blíže xxx xxxxxxxxxx xx xxxxxxxx xxxxx.
3. Vyhodnocení xxxxxxx x xxxxxxx
Xxxxxx xxxxxx xxxxxxxx spočívajících x xxxxxxxx nařízení xx xxxxxx x xxxxxxx látkám xxx xxxxxxx léčivé přípravky, xxxxxxxxx xxxxxxxxxxx Státního xxxxxx pro xxxxxxxx xxxxx x Generálního xxxxxxxxxxx xxx x xxxxxxxx xxxxxxxxxxxxx x xxxxxxxxxxx xxxxxxxxx inspektorů xxx xxxxxxxxx xxxxxxxxx xxxxxxxx x x xxxxxxxxxxxxxxx právních xxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxx přípravků xxxxxxx xxxxxxxxxxx, přičemž xxxxxxx xxxxxx xxxxxx xxxxxxxx xxxx xxx xxxxxxx x vysvětleny. X xxxxxx xxxxxx xxxxx xxxxxxxxxxx xxxxxxxxxxxx a xxxxxxxxxxx nákladů x xxxxxxx xxxxxxx x xxxxxx 3.1 až 3.3 xxxxxxxx ke xxxxx xxxxxxx xxxxxxxx xxxxxxxx, x to x xxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x k opatřením xxxxxxxxxx k xxxxxxx xxxxxxxxx xxxxxxxx přípravků.
3.1 Xxxxxxxxxxxx nákladů x xxxxxxx
3.1.1. Xxxxxxxx nařízení xxx xxxxxxxx hodnocení xxxxxxxxx xxxxxxxx xxxxxxxxx
Xxxxx xxx x xxxxxxxx xxxxxxxx xxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxx č. 536/2014 xxxx xxx xx xxxxxx Xxxxxxxx xxxx, xxx x členských xxxxx. Přínosem xxxxxx xxxxxxxx xx však xxxx x xxxxxxxx xxx xxxxxxx xxxxx xxx xxxxxxxxxxxx spolupráce xxx xxxxxxxxx společných xxxxxxxxxx. Přínosem xx xxxxxx xxxx být xxxxxxxxx x xxxxxxxxx xxxxxxxxx klinických xxxxxxxxx x xxxxx xxxx Xxxxxxxx xxxx x xxxxxxxx zavedení xxxx xxxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxx a xxxxxxxxx, xxxxxxxxxxxxx Xxxxxxxx xxxx xxx zadavatele ze xxxxxxx zemí x xxx xxxxxxxx xxxxxxxxxx xxxxxx odlivu xxxxxxxxxx x Evropské xxxx, xxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx, xxxxx xx xxxxx xxxxx xxxxxxxxx x Xxxxxxxx xxxx xxxxxxx xxxxxxxxxxxxx xxxxx řádově x xxxxxxx xxx dříve, xxx xxxx xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxxx. Xxxxxxxxx xxxxxxxx xx x důsledku xxxxxxxxxxx x účinnějšího xxxxxxxxx xxxxxxxx xxx xxxxxxxxxx xxxxxxxxxxx x xxxxxx xxxxxxxxxx xxxxxxxxx xx xxxxxxxx xxxxx xxxx xxx xxxxxxxxxxxx léčby xxxxxxxxxxx léčivými xxxxxxxxx, xxxx xxxxxxx xxxxxxxxx xxxxxxxxxx nových a xxxxxxxxxxxxxx léčivých přípravků xxx pacienty a xxxxxxxxx xxxxxxxx podmínek xxx xxxxxxx xxxxxxxx xxxxxxxxx zdraví jak x členských xxxxxxx, xxx x xxxx Xxxxxxxx xxxx. Xxxxxxx xxxxx xxxxxxxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxx x xxx x xxxxxx xxxxxxxxx xx xxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx xxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx, kteří xxxxxxxxx xx provedení xxxxxxxxxx xxxxxxxxx x xxxxxx místě xxxxxxxxxx xxxxxxxxx finanční xxxxxx. Xxxxxxx xx se x dostupnost xxxxxxxx xxxxx xxx xxxxxxxx, xxxxx zadavatel je xxxxxxx hradit nejen xxxxxxxxx, ale xxxx xxxxxxxxxx xxxxxxxxx, xxx xx xxxxxx standardní xxxxx, jindy hrazena xxxxxxxxxxx. Xxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx xx xxxx xxxxxxxx x xxxxxxx xxxxxxx xxxxxxxxxx míst jak xx xxxxxx zadavatelů (x xxxxxxxxxxxxxxx xxxxxxxxxxx xx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx), xxxxxx xxx x na xxxxxx xxxxxxxxx klinických xxxxxxxxx, xxx. u xxxxxxxxxxxxx xxxxxxxxxxx služeb, kdy xx náklady na xxxx místa mohly xxx xxxxx ze xxxxxxxxx finančních xxxxxx xx xxxxxx.
Xx se xxxx xxxxxxxxxx xxxxxxx xxxxxxxxxxxxx v xxxxxxxx xxxxxxxx xxxxxxxxxx úvazků, xxxx jsou následující:
- xx xxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx 32 xxxxxx xxx xxxxx 8 xxxxxx etické xxxxxx). Xxxx xxxxx zabezpečit xxxx xxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxx (5), xxxxxxxxxxxx xxxxxxxxxxxxx hodnocení (2), xxxxxxxxxxxx bezpečnostních dat xxxxxxxxxx xxxxxxxxx (2), xxxxxxxxxx (5), xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx (2) x xxxxxxxxxx xxxxxxxxx xxxxxxxxx-xxxxxxxxxxxxx x xxxxxxxxxxxxxxxxx xxxxxx xxx činnost xxxxxx komise - xxx xxxxx 8 xxxxxx xxxxxx xxxxxx - 16 úvazků). Xxxx xxxxxx budou xxxxxxxx kryty x xxxxxxx xxxxxx za xxxxxxxx xxxxxxxxx (xxxxxx xxxxxx). Xxx xxxxxxxx xxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxx xxxxxx xxxxxx xxxx xxxxxxxxx orgánu Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx xxxx xxxxxxxxx x xxxxx xxxxxxxx xxxxxxxxxx z xxxxxx xxxxxxxxxxxx x XX xxxxx, x xxxxx xxxx kryto x xxxxxx xxxxxx xx xxxxxxxx xxxxxxxxx xx xxxxxxxxxxx xxxxxxx klinické xxxxx;
- xx straně Xxxxxxxxxxxx xxxxxxxxxxxxx vznikne xxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxxx x xxxxxxx x xxxxxxxxx xxxxxxxxxx xxxxxxxxx. Bude třeba xxxxxxxxxx 1 pozici xxxxxxxx xxxxxxxxx x 1 xxxxxx xxxxxxxxx xxxxxxxxx. Xxxxxxx na Xxxxxxxxxxxx xxxxxxxxxxxxx xxx xxxx spočívat ve xxxxxxxxx xxxxxxxxx (x xxxxxxx xx xxxxxx xxxxx x xxxxx xxxxxxxx) právní xxxxx xxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxx xxxxx xxxxxx xxxxxxxx referentem xxxxxxxxxxxxxxx xx xxxxxxxxxx xxxxxxxx. Xxxx na xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxx xxxxxxx x xxxxxxx xxxxxx xxxxxx xxxx xxxxxx xxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx, naopak xxxxxxx xxxx agenda xxxxxxxxx x odvolávání xxxxx xxxxxx xxxxxx orgánu Xxxxxxxx xxxxxx pro xxxxxxxx xxxxx ministrem xxxxxxxxxxxxx.
3.1.2. Xxxxxxxx xxxxxxxxx x omezení xxxxxxxxx xxxxxxxx přípravků
Navrhovaná xxxxxx xxxxxx xxxxxxxxxxx x xxxxxxxx x omezení xxxxxxxxx léčivých xxxxxxxxx xxxxxx xxx xxxxxxxx xxxxxx, dopady xx xxxxxxxx slabé, xxxxx xx xxxxxxxxxx xxxxxxxxxx x xxxxxxxxxxx menšiny x xxxxxx na xxxxxxx xxxxxxxxx. Navrhovaná xxxxxx úprava xxxxxxx xxxxxx mít xxxxx xx xxxxxxxxxxx xxxxxxxxxxxxxxxxxxx Xxxxx xxxxxxxxx, územní xxxxxxxxxxx xxxxx (obce, xxxxx), xxxxxxxxxxxx, xxxxx xxxxxxxxxxx xxxxxx a xx xxxxxx x xxxxxx diskriminace.
Předpokládá xx xxxxxxxx xxxxx xx xxxxxx xxxxxxxx x xxx xxxxxxx, xx xxxxx upraveny xxx xxxxxxxxxx x zavedeny xxxx xxxxxxxxxxxxxxx xxxxxxx xxxxx, xxxxxxxxxx x xxxxxxxxxxxxx xxx pro xxxxx identifikace hrozby xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx potřeby pacientů x České republice Xxxxxxx xxxxxxx xxx xxxxxxxx xxxxx a xxxx xxxxxxxxxxxxxxx procesy xxxxxxxx xxxxxxxx xxxxxx xxxxxx Xxxxxxxxxxxxx xxxxxxxxxxxxx. Xxxxxxxx dopad v xxxxx xxxxxx bude xxxxxxxxxxxx navýšením xxxxxxxxxx xxxxxx, xxxxxxx xx xxxxxxxxx nebude xxxxxx x xxxx xxx 4 xxxxxxxx xxxxxx xxx osoby podílející xx xx xxxx xxxxxxxx.
4 pracovní xxxxxx xxxxx spočívat xx 2 xxxxxxxxxx xxxxxxxx xx Státním xxxxxx xxx kontrolu xxxxx (xxxxxx xxxxxxxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxxxxxxx Xxxxxxxxxxxx), x ve 2 xxxxxxxxxx xxxxxxxx na Xxxxxxxxxxxx zdravotnictví. Xxxxxxx xx Ministerstvu zdravotnictví xxxx xxxxxxxx ve xxxxxxxxx xxxxxxxxx (x xxxxxxx na xxxxxxx xxxxxxxx řešení) právní xxxxx agendy xxxxxxxx xxxxxxxxxx právnického xxxxxxxx x xxxxxxx xxxxxxx xxxxx agendy xxxxxxxx xxxxxxxxxx xxxxxxxxxxxxxxx xx xxxxxxxxxx vzdělání. Xxxxxxxx xxxxx na xxxxxx xxxxxxxx tak xxxx xxxxxxxxx.
Xxxxxxxxx dopad xxxxxxxxxx xxxxxx úpravy xx xxxxxxx veřejné rozpočty, xxxxxxx xx prostředky xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxx xxxxxx odhadovat. X ohledem xx xx, xx se xxxxx o xxxxxxxxx xxxxx xxxxx xx xxxxxxx prostředí, xx xxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxx, která xx částečně xxxxxxxxxxxx x prostředků xxxxxxxxx xxxxxxxxxxx xxxxxxxxx, xxx xxxxxxxxxxxx, že xxxxxx xxxx navrhovaná xxxxxx xxxxxx mít xxxx. Xxxxxx xx čerpání xxxxxxxxxx x xxxxxxxxx xxxxxxxxxxx pojištění xxx xxxxxxxxxxxx xxxxx pozitivní - bez vynucených xxxxxx xx stávající xxxxxxxxxx x medikace, xxxxx obvykle xxxxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx xxxxx xxxx xxxxx léčebných xxxxxxx. Xx se xxxx xxxxxx xx xxxxxxxxxxxxx xxxxxxxxx Xxxxx republiky, xxxxxxxxx dopadů na xxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx podnikatelské subjekty, xxx xxxxxxxxxxxx xxxxx xxxxxxxxx xxxx, xxxxx xx xxxxx významně xxxxxxxxxxxxx transparentností systému xxxxxxxx x vysokou xxxxx xxxx předvídatelnosti, xxxxxxxxxxxx z xxxxx xxxxxxx podnikatelského xxxxxx. Xxxxxxx xxxxx xxxx xxx x xxxxx xxxxxxx xxxxxxxx xxxx xxxxxx xxxxxxxxxxxxx.
Xxxxxxxxxx právní xxxxxx představuje xxxxx xx xxxxxxx xxxxxxxxxxxxx xxxxxxxx x xxx, xx xxxxxx novou xxxxxxxxxx povinnost xxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxx, xx hodlají xxxxxxxxxxxx mimo území Xxxxx republiky xxxxxx xxxxxxxxx, který xx xx xxxxxxx léčivých xxxxxxxxx xxxxxxxxxx reexporty. Xxxxxxxxx však xxxx xxxxxx, xxxxxxxxxx všechny xxxxxxxx xxxxxxxx xxxxxxxxxxxx, xxx xxx xxxxxx xxxxx xxxx a xxxxxx xx xxxxx xxx xxxxx xxxxxxxx xxxxxxxxxxxx xx xxxxxxxxxx xxxxxxxx přípravků, xxx xxxxx xxxxxxxxxx skupiny xxxxxxxx x xxxxxxxx xxxxxxxxx. Xxxxx xxxxx xx přitom v xxxxxxx x účelem xxxxxxxxxx xxxxxx xxxxxx xxxxxx na nezbytně xxxxxx xxxx x xxxxxxxx xxxx, kterým xx zajištění xxxxxxxxxxx xxxxxxxxxxx léčivých přípravků xxx potřeby pacientů x Xxxxx xxxxxxxxx x xxxxxxxxx hrozící xxxxxx nedostupnosti x xxxxxx xxxxxx xxxxxxxxxx xxxxxxxxx.
Xxxxxxxxx xxxxx xxxx xxx xxxxxxxxxx xxxxxx xxxxxx xxxxxxx xx xxxxxxxx, xxxxxxx specifickou xxxxxxx xxxxxxxx, xxxxxx xxxxxxx dostupnost xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxxx xxxxxxx xxxx distribucí xxxx xxxxx Xxxxx xxxxxxxxx.
3.1.3 Xxxxxxx xxxxxx xxxxxxxxxxxx xxxxxxx x xxxxxxx x xxxxxxxxx 3.1.1 x 3.1.2.
Xxx xxxxxxxxxx xxxxxxxxx xxxxxx xxxxxx xxxxx x xxxxxxxxx xxxxxxxxx s xxxxxxxxx xxxx xxxxx xxxxxxx počet úvazků XXXX x to x xxxxxxxx xxxxx 34 xxxxxx. X xxxxxxxxxx xxxxxx xxxx xxxxxxxx xxxxxxxx, a xx v letech 2016 xx 2018 - x závislosti xx xxxxx xxxxxxxxxxxxx xxxxxxx x xxxxx xxxxxx xxxxxx xxxxxx.
Xxxxxx xxxxxx xxxxx by xxx být xxxxxxxx (xxxxx xxxxxxx xxxxxx xxxxx xxxxxxxxx xxxxxx xxxxxx), x proto xxxxx xxxxxx x xxxxxxxxx zvyšováním xxxxxx (xxx přiložená tabulka).
Bude xx xxxxxx x xxxx xxxxxx:
Xxxxxxxxxxxxx posuzovatel (xxxxxx 5) - x xxxx 2016 xx počítá x xxxxxxxxx 4 xxxxxx, xxxx bude xxxxxxx xx náročnosti nového xxxxxxx xxxxxxxxxx, xxx. xx xxxxxxxxxx xxxxxxxxxxx xxxxx x xxxxxxxxxx, xx xxxx xxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxx xxxxxxxxx států v xxxxxxx, xx ČR xxxx xxxxxxxx státem xxxxxxxxxxx, xx xxxxxxxxxx xxxxxxxxxx odpovědí, x xx xxxxx xxxxxxxx xxxx xxxxxxxxxx, jak xx nařízení xxxx xxxxxxxxx. Zároveň xx xxxxx xxxxxxx xx xxxxxxxx xxxxx xxxxxxx x xxxxxx inovativními xxxxxxxx přípravky, jejichž xxxxxxxxxx je náročnější x xxxxxxxx xxxx xxxx.
Xxxxxxxxxxx xxxxxxxxxxxxx hodnocení (2 xxxxxx) - 1 úvazek x xxxx 2016, xxxxx x roce 2017 - xxxx xxxxxxxxx Xxxxx xxxxx 1 xxxxxxxxxxxxx + xxxxxxxx xx částečný úvazek. X xxxxxxxx xxxx xxxx xxxxxx nezahrnuje xxxxxxxxxxx xxxxxxxxx xxxxxx, xxx xxxxxx x xxxxxxx xxxxxxxxx státu xxxxxxxxxx xxx postupu xxxxx xxxxxxxx možné, xxxxx xxxxxxx xxxxxx xxxxx xxxxxxxxxxx zpráv xxx Xxxxx xxxxxx xxxxxxxxxxx přípravku, xxx xxxx xxxxxxxxx x xxxxxxxx preklinického xxxxxxxxxxxx.
Xxxxxxxxxxx xxxxxxxxxxxxxx dat klinických xxxxxxxxx = xxxxxxxxxxx xxxxxxxx části xxxxxxxxxxx (1 xxxxxx) - xx zajištění xxxxxx xx xxxxxxxx se 2 xxxxxx xx xxxx 2016 (1 xxxxxx již xx x xxxxxxxxxxx). Xxxxxxxxxxxx xxxx xxxxx nejprve xxxxxxxx x xxxxxx xxxxxxxxxxx xxxxx, xxxx xxxxxx školením xx xxxxxxxxxxxx xxxxxxx x Xxxxxxxx xxxxxx xxxxxxxx (xxxx jen XXX). Xxxxx xx o xxxxx agendu, která xx nyní v xxxxxxxx xxxxxx xxxxxx xxxxxxxx xxxxxxx group xxx XXX. Xxxxxxxxxxxx xxxxx xxxxxx xxxxxxxxxxxx xxxxxxxxxxxx xxxxxxx x xxxxxxxxxx xxxxxxxxx z XxxxxXxxxxxxxx databáze a xxxxxxxxxxxxx x kolegy x ostatních xxxxxxxx xxxxxxx.
Xxxxxxxxx správné xxxxxxxx xxxxx (5 xxxxxx) - xxx rok 2016 se xxxxxx xx 2 xxxxxx, xxxx xxxx xxxxxxx xx xxxxxxxxxxx potřebách. Xxxxxxxxxxxxxxx xxxx xxxxxxx xxxxxxx xxxxx než 5. Nutnost navýšení xxxxxxx xxxxx z xxxxxxxxx xxxxxxxxx xxxxxxx xxx xxxxxxxxx xxxxxxxxxx, xxxxxxx aktivní xxxxxxxx xxxxx vykonávat právě xxxxxxxxxx správné xxxxxxxx xxxxx, ale xxxxxxx x x xxxxxxxxx xx xxxxx při xxxxxxxxxx xxxxxxxxxxxx kontrolách x xxxxxxxxx xxxxxxxxx xxxxx, xxxxxxxx a xxxxxxxxxxxxxx XXX. Xxx xxxxx cca 375 xxxxxxx o povolení xxxxxxxxxx xxxxxxxxx/xxx a xxx 1600 „xxxxxxxx“ xxxxxxxxxx xxxxxxxxx v xxxxx xxxx xx xxxxxxxx xxxxx xxxxxxxxxx xxxxxxxx nedostačující. X xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx je xxxxx xxxxx, kterou nelze xxxxxx xxxxxxxxxxx xxxxxxxx.
Xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx (3 xxxxxx) - pro xxx 2016 se xxxxxx s 1 xxxxxxx, x xxxxxx xxx x xxxx 2017 x 1 x roce 2018. Xxxxxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxxx členskými xxxxx x xx území XX x xxxxxxxxx xxxxxxxxxxxxxxxx xxxxxxxx (např. xxxxxxx xxxxxxx xx.), xxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxx xx xxxxxxx, xxxxxx xxxx xxx xxxxxxxxxx xx xxxxx XX.
Xxxxxxxxxx xxxxxxxxxxxxx xxxxxx xxxxxxxx etické xxxxxx (4 úvazky). X xxxxxx úvazky je xxxxx xxxxxxx xxx xxx xxx 2016. Xxxx pracovníci budou xxx za xxxx xxxxxxxx xxxxxxxxx zázemí xxxx zahájením xxxxxxxx xxxxxx xxxxxx jako xxxxxxxxx orgánu Xxxxxx, xxxxxxx přípravu xxxxxxxxx, xxxxxxxx pracovních xxxxxx, xxxxxxxxx xxxxxxxxxx xxx xxxxx etické komise (xxxxxxxxx xxxxxxxxx externistů), xxxxxxxxx koordinačních xxxxxxx x SP pro xxxxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxx. Dále budou xxxxxxxxxxx xxxxxxxx xxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxx xxxxxxxxxxx xxxxxxx x xxxxxxxx x etické xxxxxx. X dalšími xxxxxx xx nutno xxxxxxx x návaznosti xx potřebu zvýšení xxxxx xxxxxx xxxxxx xxxxxx v průběhu xxxxxxxxxxx xxxxxx x x xxxxxxxxxx na xxxxx xxxxxxxxxxxxx xxxxxxx. (xxx xxxxx 8 xxxxxx xxxxxx xxxxxx - 16 úvazků - xx xxxx 2019 xx 2020 - podle xxxxxxxxxx xxxx xxxxxx xxxxxxxxx xxxxxxxx č. 536/2014).
|
počty xxxxxxxxxx xxxxxx, xxxxxxxxxxxx xx XXXX x souvislosti x xxxxxxxx nařízení 536/2014/EU |
||||||
|
2016 |
2017 |
2018 |
32 xxxxxx |
|||
|
4 |
XX |
1 |
XX |
|||
|
1 |
XXX |
1 |
XXX |
|||
|
1 |
XXXXX |
|||||
|
2 |
XXX |
2 |
XXX |
1 |
XXX |
|
|
1 |
XXXX |
1 |
XXXX |
1 |
XXXX |
|
|
4 |
XXXX |
8 |
XXXX |
4 |
XXXX |
|
|
13 |
13 |
6 |
||||
xxxxxxx:
xxxxxxxxxxxxx xxxxxxxxxxx (XX) - celkem 5
xxxxxxxxxxx xxxxxxxxxxx xxxxx (XXX) - xxxxxx 2
xxxxxxxxxxxx xxxxxxxxxxxxxx dat KH (XXXXX) - xxxxxx 1
xxxxxxxxxx xxxxxxx xxxxxxxx xxxxx (INS) - xxxxxx 5
xxxxxxxxxxxx XX (XXXX) - xxxxxx 3
xxxxxxxxxxxx centra EK - (KOEK) - 4 (xx xxxxx xx xxxxxxxx xxxxx xxxx xxxxxxxx xxxxxx XX, xxxxx xx xxxxx xxxxxxxxx xxxxxxx xxxx xxxxxxxxxxxxxx
(xxxxxxxxx, pracovní xxxxxxx atd.) xxx xxxxx skupiny XX xxxxxxxx zřízeny, xxx xxxxx začít xxxxxxxx xx xxxx xxxxxx xxxxxxxxx
xxxxxxxxxxxx xxxxxx EK - (XXXX) – 12 každá xxxxxxx XX xx měla xxx 2 xxxxxx xx xxxxxxxxx administrativních xxxxxxx xxxxxxxxxxx s XX
xxxxx xx xxxxxxxxxxx xxxxxxxx x xxxxxxx 12 KOEK xx xxxxxxxxx xxxxxxx skupin XX
xxxxx xxxxxx xxxxxxxxxx xx SÚKL pro xxxxxxxxx opatření xxx xxxxxxxx xxxxx.xxxxxxxxxx, 2016
2 xxxxxx
2 xxxxxxxxxxxx reexportů
34 xxxxxx
2 xxxxxxxx xxxxxx xxx XX - xxxxxxxx x xxxxxxx xxxxxxxx xxxx xxxxxxxx x xxxxxxx.
Xxxxx se xxxx xxxxxx agend xxxxxxxxxxxxx z právní xxxxxx xxxxxxxx omezující xxxxxxxxx reexporty, pro xxxxxx xxxxxxxxx je xxxxx xxxxxxx x xxxxxxxxx x 2 xxxxxx xx SÚKL x o 2 xxxxxx xx XX. Xxxxx xxxxxxx xxxxxxxxx x xxxxxxxxxxxxx nedostupnosti xxxxxxxx xxxxxxxxx, XX xxxxxxx xxxxxxxx xxxxxx xxxxxxxx s xxxxxxxx xxxxxxx x opatření xxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxx. X xxxxxxxxxxx x xxxxx xxxxxxxxxxxxx xx xxxxxxx xxxxxxxx xxxxxxx x xxxxxxx xxxxxxxx xxxxxxxxxxx, xxxxxxxx xxxxxxxxx xx otázkou xxxxxxxxxxx x bude xxxxxxxxx xxxxx xxxxxxxxxx xxxx xxxxx institucemi, x xx x x xxxxxxx xx xxxxx xxxx zákonem.
Mzdové xxxxxxx:
Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx - platová xx. 13
Xxxxxxxxxxxx xxxxxxxxxxxxxx dat/klinické xxxxx dokumentace - xxxxxxx xx. 13
Xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx - xxxxxxx tř. 13
Xxxxxxxxxx xxxxxxx klinické xxxxx - xxxxxxx tř. 13
Xxxxxxx xxxxxxxxxxxxx xxxxxx xxxxxx xxxxxx - xxxxxxx xx. 13
Xxxxxxxxxxxx - xxxxxxx xx. 12
Xxxxxxxx na xxxxxx xxxxxxxxx XX - xxxxxxx tř. 13
Právník xx oblast xxxxxxxxx XX - xxxxxxx xx. 13
Posuzovatel xxx xxxxxx xxxxxxxxx SÚKL - xxxxxxx xx. 13
Xxxxxxxxxxxxx roční xxxxxxxx xxxxxxx xxxx xxxxxxx xxxx
|
Xxxxxxx třídy |
Mzdové xxxxxxx |
xxxxxx |
Xxxxxx /xxx |
Xxxxxxxx xxxxxxx mzdy XXXX |
Xxxxxxx xxxxxxx - xxxxxxx, xxxxxxxxxxx xxxxxxx, xxxxxxxxxx, … xxx 50 000/xxx |
|
|
4 farmaceutičtí xxxxxxxxxxxx |
13 |
20 990-26 220 Xx |
23 600 Xx |
1 132 800 Xx |
1 529 280 Kč |
200 000 |
|
1 xxxxxxxxxxx posuzovatel XXX |
13 |
20 990-26 220 Xx |
23 600 Xx |
283 200Xx |
382 320 Xx |
50 000 |
|
1 klinický xxxxxxxxxxx (xxxxxxxxxxxx xxxx - XXXXx) |
13 |
20 990-26 220 Xx |
23 600 Xx |
283 200 Xx |
382 320 Xx |
50 000 |
|
2 xxxxxxxxxx XXX |
13 |
20 990-26 220 Xx |
23 600 Xx |
566 400 Xx |
764 640 Xx |
100 000 |
|
1 xxxxxxxxxxx XX |
12 |
19 360-24-180 Kč |
21 770 Xx |
261 240 Xx |
352 674 Xx |
50 000 |
|
1 vedoucí + 3 xxxxxxxxxxxx xxxxxx xxxxxx |
13, 12 |
20 990-26 220 Xx19 360-24-180 Xx |
23 600 Xx21 770 Xx |
283 200 Xx261 240 Xx |
382 320 Xx352 674 Xx |
200 000 |
|
2 xxxxxxxxxxxx xxx xxxxxx xxxxxxxxx |
13 |
20 990-26 220 Xx |
23 600 Xx |
566 400 Xx |
764 640 Kč |
100 000 |
|
15 xxxxxx - xxxxxxx xxxxxxx xx xxxx úvazky xxx 5 000 000 Xx/xxx 2016 |
3 637 680 Kč |
4 910 868 Xx |
750 000 Xx |
|||
Xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxx na XX xxxx xxxxxxxxxx výše. Xxxxxxxx se xxxxxxx x xxxxx stávajícího xxxxx xxxxxxxxxxxxx.
Xxxxxxxx xx xxxxxxx v rámci xxxxxxxx výdajů xx xxxxx x počtu xxxx kapitoly Xxxxxxxxxxxx xxxxxxxxxxxxx. Xxxxxxxxxx xxxxx x xxxxxxx oblasti xx xxxxxxxxx.
Xxx xxxxxxxxx xxxx xxxxxx - xxxxx xxxxxxxx xxxxxxx xx rok 2016 x 2017 (počítače, xxxxxxxx, xx.) - 2016 xxx 750 xxx. Kč; 2017 1,5 xxxxxxx Xx (xxxxxxxx xxxxxxx xxx xxxxxxx etických xxxxxx + xxxxxx xxxxxx).
Xxxxxx xxxxxxx xx vedoucího xxxxxxxxxxxxx centra etické xxxxxx x xxxxxxxxxxxx xxxxxx xxxxxx - xxx 2016 xxx 2 xxxxxxx; xxxxxxx xx vybavení xxxxx xxxxxx xxxxxx xxxxxx x xxxxxx provoz - vybavení xxx 3 xxxxxxx/xxx (xxx xxxxx xxxxx skupin xxxxxx xxxxxx - xxxxx náklady) - xxxxxxx x příjmu xx xxxxxxx xxxxxx xxxxxx.
Xxxxxxx budou hrazeny x vlastních prostředků Xxxxxx, nezíská-li xxxxxxx x XX xxxxx.
X xxxx 2016 a xxxx by xx xxxx x xxxxxxx xx xxxxxxxxxx, školení (x EMA xx x xxxx xxxxxxxx xxxx xxxxxxxx xx xxxxxxxxxx Xxxxxxxx komise xx.) cca 2 xxxxxxx/xxx.
3.2 Xxxxxxx
3.2.1. Adaptace xxxxxxxx x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx léčivých xxxxxxxxx
Xxxxxxx xxxxxxx xx xxxxxxxxx nového xxxxxx xxxxxxxxxx hodnocení xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx x založení x xxxxxxxxx fungování xxxxxxx XX a xxxxxxxx XX. Xxxxxxx xx xxxx xxxxxxxx xxxxx xxxxxxx x xxxxxxxxxx Evropské xxxx. Xxxxxxx xxxxx budou xxxxxxxxxx xxxxxx xxxxxxxx xx xxxxxx a xxxxxxxx Xxxxxxxx xxxx, xxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xx xxxxxx xxxxxxxxx xxxxx, zajištění dostatečných xxxxxxxx xxxxxx, XX xxxxxxx xxx komunikační xxxxxxxxx na xxxxx Xxxxx xxxxxxxxx a xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxx činnost xxxxxx xxxxxx. Xxxxxxx xx xxxxx xxx z xxxxx xxxxxxx x xxxxxx XX xxxxx, xxxxx by xxxx xxxxxxxx prostředky získány, x xxxxx xxxxxx xxxxxxx stát. Xx xxxxxxxx xxxxxxx xx xxxxxx se samofinancováním, xxx. xxxxxxx xxxxxx xx xxxxxxxxx žádostí x xxxxxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxx x xxxxxxxx xxxxxxxxxx xxxx a xxxxxxxxxx xxxxxxx nad xxxxxxxxxx xxxxxxxxxxx xx xxxx xxxxxx xxxxxxxx nároky xx xxxxxxx funkčnosti XX systému x xxxxxxx etické komise.
V xxxxxxxxxxx x xxxx xxxxxxxx xxxxxxx xxxxxxx, xxxx. xxxxxxxxxxxxxxx, xxxxxxx Xxxxxx ústav xxx xxxxxxxx léčiv x xxxxxxxxxxx xxxxxxxxxx, xxx x uplynulých letech xxxx xxxxxxx náklady xx xxxxxx x xxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx, x xx xxxxxx xxxxxxxx xxxxxxxxxxxxx se xxxxxxxxxx xxxxxxxxxxxxxx agend, xxxxxxxxx v souvislosti x xxxxxxxxx xx xxxxxxxxxxxxx x xxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxxx xxxx členskými xxxxx, Xxxxxxxxx xxxxxx x xxxxxxxxxxxx xxxxxxxx, xxx xx 75 - 80 % x xxxxxxxxxxxxxxxx zdrojů.
Pokud xx xxxx xxxxxx xxxxxxxxxx xxxxxxxxx v xxxxxxxxxxx x xxxxxxxxx nařízením, xxx xxxxxx xxxxxxx xxxxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxx x xxxxxxx x xxxxxxxxx x xxxxx xxxxxxx xxxxxxx xxxxxxxx xxxxxx (xxxxxxxxx z důvodu xxxxxxxxx xxxxxxxx xxxx x xxxxxxxx xx xxxxxxxxxxx 65 xxx xx 21 dnů, x xx xxx xxxxxxxx přerušování), xxxxxxx xxxx xxx xxxx. xxxxxxxx předpokládá zřízení xxxxxxxxxx xxxxxxxxxxxxxx portálu (xxx xxxxx odstavec), xxxxx prostřednictvím a xxxxx xxxx xxxxxxxxxxxxxxx xxxx xxxxx předkládat xxxxxxx x xxxxxxxx xxxxxxxxx x Xxxxxx xxxxx xxx kontrolu xxxxx tedy xxxx xxxxxxxx (xxxxxx) xxxxxx, xxxxxx xx do xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxx xxxxxxx. Xxxxxxx xxxxxxxx xxxxxxx xxxxxxxx xx xxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx léčiv xxxxxxx xxxxxxxxx, x xx nejen xx xxxxxxx, ale x xxxxxxxx provoz, xxxxxx xxx., xxxx xxxxxxxxx xxxx xxxxxxx xxxxx xxxxxxxxxxx, xxx bude xxx průběžný charakter. Xxxxxxxx x xxxx, xx existence xxxxxxxxxx xxxxxxx je předpokládána xxxxxxxxx, pak Státní xxxxx pro xxxxxxxx xxxxx xxxx xxxxxxx x své vůli xxxxxxxxxx, že se xx evropského xxxxxxx xxxxxxxxx a xxxxxxx xxxx xxxxxxxx x xxxxxxxx podobě jako xxxxxxx, xxxxx by xx xxxxxxxxx xxxxxxxxx xxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx, xxxx. xxxx XX, x xxxxxxx klinických xxxxxxxxx.
Xxxx nejen v xxxxxxxxxxx x xxxxxxxxx xxxxxx x xxxxxxx xx xxxxx xxxxxxx xxxxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxx, xxx xxxxxxxx x x xxxxxxx xx administrativní xxxxxxxxx xxxxxxxx xxxxxx xxxxxx, bude xxxxx Xxxxxx xxxxx xxx xxxxxxxx xxxxx xxxxx x technické zabezpečení, xxx xxxx xxxxxxx xxxxxxxxxx (počítače x xxxxxxxxxxx technika, xxxxxxxx xxxxxxx xxxx.), xxx xxxxxx xxxxxxxx xxxxxxxxx xx xxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx.&xxxx; Xxxxxxxx xxxxxxxxxx xxxxxxxx xxx bez xxxxxx na xxxxxxxx x xxxxxx o xxxxxxxx xxxx spojena x finančními náklady. Xxxxxxxx xx xxxxx xxxxxxx státní xxxxxxxx xx xxxxxxx, Státní xxxxx xxx xxxxxxxx xxxxx xxxxxxxx hradit xxxx xxxxxxx x xxxxxxxxxx prostředků plynoucích x náhrad xxxxxx. Xx xxxx xxxxxxxxxx, xx pokud xx xxxx prostředky xxxxxx x xxxxxxxxx, xxxx xxx xxxxxxxx s xxx, že veškeré xxxxxxx xxxxx kryty x xxxxxxxxxxxx xxxxxx.
Xxxxxxxxx xxxxxx xxx xxxxxxxx xx portál a xxxxxxxx EU - xxx jen xxxxx xxxxxxxx, x tuto xxxxxx xxxxx xxxx xxxx ani zadávací xxxxxxxxxxx xxx xxxxxx x databázi EU x xxxx xxxxx xxxxx, jakou xxxx (xxxxx xxxxx) xxxxxxxxxxx xxxxxxxxx xxxx xxxxxxxxx. X toho xxxxxxx, xx lze xxx xxxxx xxxxxxxxx xxxxxxx xx xxxxxx jednotlivých xxxxxxxxx xxxxx - xxxxxx bude třeba xxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx v ČR, xxxxx xxxxxxxxx xxxxxx xxx technické xxxxxxxxx x xxxxxxxx + xxxxxxxxxxx xxxxxx na xxxxx XX (xxxxxxxxxxx xxxxxx xxx komunikaci Xxxxx, xxxxxx komise, xxxxxxx, xx.) - xxx xxxxxxxxx xxxxxxx xxx 30 xxxxxxx Xx, xxxxx xxxx xxxxxx Xxxxx x xxxxxxxxx xxxxxxxxxx, nezíská-li xxxxxxx x EU xxxxx.
Xxxxxxxx x 32 xxxxxx xx straně Xxxxxxxx xxxxxx pro xxxxxxxx xxxxx xxx xxxxxx klinického xxxxxxxxx.
Xxxxxx xx xxxxxxxxxx xxxxxxxx
Xxxxxx xx xxxxxxxxxx
- Xxxxxx XX x xxxxxxxx xxxxxxxxxxx xxxxxxxxxxx by xxxx zadavatelům xxxxxxxx xxxxxx xxxxx; xxxx xx předpoklad, že xx xx měly xxxxxx xxxxxxx na XX - to xx xxxxxxx, protože xxxxxxxx dává xxxx xxxxxxxxxx xxx xx xxx xxxxxxxxxx x xxxxxxxx legislativě, xxxxx xxxxxxxx xx xxxxxxxx xxxx xxxxxxxxx nemusí x xxxxxxxx xxxxxx xxxxxxxx xxxxxxx.
- Nařízení xxxxx xxxxxxxx xxxxxxxxx xxx. xxxx xxxxxxxxx. Xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxx xxxxxxxxx připomínek, xxxx klinické hodnocení xxxxxxxxx nebo považováno xx xxxxxxx (xxx xxxx, x které xxxxx posuzování xx xxx stane). Xxxxxxxx xxxx umožněno xxxxx 1x, což je xxx x xxxxxx xxxx, xxx na xxxxxxxxx xxxxxxxx xx „xxxxxxxxxx“ x xxxx xx xxxxxxx xxxxxxxxxx xxxxxxx podruhé či xxxxxxxx nejasnosti x xxxxxxxxxx. Xx xxx xxxxxx xxxxx, xxx xxxx, xx xx xxxxxxxxxxx bude xxxxxxxxxxx xxx part I xxxxx 1 xxxxxxx xxxx = xxxxxxx xxxx xxxxxxxxx. Xxx xx xxxxxxxx xxxxxxxxxxx xx xxxxxxxx stanoven xx 12 xxxxxxxxxxxx xxx (xxxx x xxxxx xxx. 10, xxx může být x méně xxxxxxxxxx xxx). Xxxx xxxx xxxxxxxxx dostat xxxx xxxx, xxxxx xx xxxxxx x xxxxxxx xx xxxxxxx xxx (xxxxxxxx xxxx xx xxxxxxxx xxx xxxxxxxxxx - xxxxx x xxxxx). Xx xxxx x xxxxx vést x xxxxxxxxx xxxxxxxxxx xxxxxxxxx, jejich xxxxxxxxxxxxx x opětovnému xxxxxxxxxx, xxx xx xxxxx xxxxx x dalším xxxxxxxx xxxxxxxxxx x xxxxxxxx xxxxxxx x xxxxxxxx xxxxxx.
- Výhodou xxxx xxx xxxxxxxxxx, xxxxx xxxxxxx xxxxxxxxxxxxxx xxxxxxxx hodnocení (x XX xxx 90-95%) x mají xxxx xxxxxx v XX (xx xxxx asi 80-85% x xxxxxxxxxxxxxxxx XX), v xxxxxxxx xxxx xxxxxxx každé xxxxxx xxxxxx, xxx xx xxxx xxxxxxxxx. Xxxxxx xx xxx xx xxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxx xx. xxx part II.
- Xxxxxxxxxx xxxxxxxx xxxx xxxxxx xxxxxxxxxx jako xxxxxxxx, xxxxxxxxxxxx xx xxxxx x doznačování xxxxxxxxxxx xxxxxxxx xxxxxxxxx. Xxxxx xxxxxxxxxxx xx xxxx xxxx „xxxxx“ xx straně xxxxxxx x pomoci nekomerčním xxxxxxxxxxx s xxxxxxxxx xxxxxxxxxxx - je xxxxxxx, xxxxx xxxxxxxx xx xx xxxxxx x novém systému xxx.
- S ohledem xx skutečnost, xx xxxxx xxxx xxx xxxxxx XX, xxx xxxxxxxx XX, xxxxx xxxxx dopady identifikovat.
Pro xxxxxxxxx uvádíme, kdo xxxx xxx zadavatelem:
- Xxxxxxxxxxxxx společnosti
- Xxxxxxxxxxxxx xxxxxxxxxxx služeb (xxxxxx x soukromoprávní)
- Vysoké xxxxx
- Odborné společnosti
CRO (XxxxxxxxXxxxxxxxXxxxxxxxxxxx) –xxxxxxxxxxx, xxxxx x oblasti klinických xxxxxxxxx xxx xxxxxxxxxx xxxxxxxxx x xxxxxx xxxxxxxx xx XXXX, xxxxxxxx xxxxxxxx, často xxxxxxxxx xxxxxxx s xxxxx klinického xxxxxxxxx x xx xxxxxxxxxxxx, xxxxxxxxxx klinického xxxxxxxxx, xxxxxxx x farmakovigilanční xxxxxxx (xxxxxx xx xxxxxxx xxxx zadavatelem x XXX; xxxxxxxxx xxxxxx rozsah xxxxxxxx, xxxxx xxx něho XXX xxxx a xxxxxx xxx i xxxxxxxxxx)
- Xxx xxxxxxxx xxxxx xxxxxxx x xxxxxxxx xxxxxxxxxx hodnocení xxxxxxxxxxx současně xxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxxxxxxxxxxx portálu XX. Xx pravděpodobné, že xxx xxxx X (xxxx I xxxxxxxxxxx) xxxx zajišťovat zadavatel xxx xxxxxxx xxxxxxx xxxxx xxx; xx xx týká xxxx XX (části XX xxxxxxxxxxx, xxxxx xx xxxxxxxx xxxxx xx xxxxxxxxxxx xxxxxxxxx státu, xxxxx xxxx xxxxxxxx, xxxx-xx xxxx xxxxxxxxx x jednat s xxxxx xxxxxxxx xxxxxx xxxx „xxxxxxxxx xxxxx“ xxx pro part X, x xxx xxxxxxx xx xx xxx byly xxxx XXX.
- Co xx xxxx xxxxxx xxxxx xxxxxxxx - monitoring, xxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx, xxxxxxxxxxxx…. Xx xx mohlo xxx xxxxxx, jako xxxxxxxx
Xxxxx xx xxxx míst xxxxxxxxxx xxxxxxxxx
- Xxxx xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxx xxxxx pro xxxxxxxxxx xxxxxxxxxxx klinická xxxxxxxxx xxxxxxxxxxxxxxx (tyto xxxxxxxxxxx se xxxxxxxx xxx xxxx, xxxxxxx xxxx. společnosti xx xxxx); xxxxxxxx xxxxxxxxx xxxx X (1.podání xxxxxxx) - xxxx; xxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx mohou xxxxxxx x vydání certifikátu, xxx není xx xxxxxx xxxxxxx xxxxxxxxx; xxxxx to xxxxxxxxx xxxxxxx xxxxxxxxxx
- Xxxxxxxx xxxxxxxxx xxxxxxxx přípravků xxxx xxxxxxxxx x xxxxxxxxxxxxx poskytovatelů xxxxxxxxxxx xxxxxx
- Xxxxxxxx na xxxxx místa xxxxxx xxx žádný xxxxx
- Xxxxxxx nákladů xx xxxxxxxxx xxxxxx - xxxxxxxx xxxxxx, xxxxxx xx být xxxxxxxxx xxxxxxxxx
Xxxxx xx xxxx xxxxxxxxxxxx
- Xxxxxxx xxxxxxxxxxxx x oblasti xxxxxxxxxx xxxxxxxxx nedozná xxxx, xxxxxxxx xxxxxxxx xx xxxxxx xxx dopad xx xxxx oblast
- Xxxxxx x průběhu xxxxxxxxxx xxxxxxxxx - xxx x xxxxxxxx xxxx xxxxx dle XXX (XXX X6 - XXX = XxxxXxxxxxxxXxxxxxxx), xxxxxxxxxx xx xxxx xxxxxxx zprávy x xxxxxxx x xxxxxx xxxxx xxxxxxxxxx xxxxxxxxx etické komisi, xxxxx klinické xxxxxxxxx xxxxxxxxx
- Xxxxxxxx odměny xx xxxxxxxxx xxxxxxxxxx xxxxxxxxx - ¨náklady xxxxxx xxxxxxxxx - xxxxxxxx xx xxxxxx xxx xxxx či xxxx xx změnám
Dopady xx xxxxxxxxxx xxxxxxxxxx
- xxxxxxx nebyly xx xxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx. X xxxxxxxx době xx xxxxxxxxxx xxxxxxxxxx XXXX x této xxxxxxx (xxxxxxxxx o klinických xxxxxxxxxxx, xxxxxxxxxxxx x xxxxxxxxxx xxxxxx x xxxxxxxxx xxxxxxxxx, zajištění xxxxx informovanosti). Xxxx xxxxxxxxxx XXXX předpokládá x nadále. Xxxxxx xxxx , xxx xx xxxxxxxxxx xxxxxxxxxx xxxxxxxx do činnosti xxxxxxxx xxxxxx.
- nařízení xxxxxx xxx finanční xxxxxx xxxxx na xxxxxxxxxx xxxxxxxxxx
Xxxxx xx xxxx xxxxxx správy, xxxxx XXXX x Xxxxxxxxxxxx zdravotnictví, xxxxxxxx xxxxxxxxxxx x xxxxxxx
XXXX (Xxxxxx úřad xxx xxxxxxxx xxxxxxxxxx)
- Posuzování xxxxxxx o xxxxxxx xxxxxxx xxxxxxxxxxxxxxxx radiofarmaka x KH - xxxx xxxxxxxx xxxx
XXX
- Xxxxxxxxxx xxxxxxx x xxxxxxx xxxxxxx hodnoceného xxxxxxxx xxxxxxxxx x xxxxxxx XXX v XX - jako xxxxxxxx xxxx
XXXX
Xxxxxxxxxx žádostí x možnost xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxxxxx xxxxxxxx xxxxxxx x XX - xxxx činnost xxx xxxxxx výzkumu xx xxxxxxxx xxxxxxxxxx, xxxxx xxxxxx žádáno; XXXX xxxxxx xxxxxxx x lidskými xxxxxxxxxxxxx xxxxxxx xxx má, xxxxxxx xxxxxx xxxxxx x výzkum xx xxxxxx xxxxxxxx subjektů, xx tohoto xxxxxxxxxx xx xxxx xxxxxxxx (xxx zákona x xxxxxxxxxxxxx xx.) i xxxxxxxxxxxx xxxxxxxxxxxxx
3.2.2. Opatření xxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxx přípravků
Pokud xxx x navrhovanou xxxxxx xxxxxx spočívající x xxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx, předpokládá xx xxxxx xxxxxxx xxxxxxxxx xx zavedením režimu xxxxxxxxx x xxxxxxxxxxxxx xxxx, xxx xxxx xxxxxxxxx xxxxxxx xxxxxxxx x České republice, x xxxx x xxxxxxxxxx xxxxxxxx x xxxx xxxxxxxxx, kdy xxxxxxxxxx xxxxxxxx přípravků xx xxxxxxxxx xxxxxxx xx xxxxx xxxxx xxxxxx xxxxxxxxxx. Xxxx xxxxxxx xxxxx xxxxxx x rámci xxxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx léčiv a Xxxxxxxxxxxx xxxxxxxxxxxxx.
Xxxxxxxx x 4 xxxxxxxx úvazky xxxx spočívat ve 2 pracovních xxxxxxxx xx Xxxxxxx xxxxxx xxx xxxxxxxx léčiv (xxxxxx xxxxxxxxxxxx odůvodněných xxxxxxx xxxxxxxxxxx Ministerstvu), x xx 2 xxxxxxxxxx úvazcích xx Xxxxxxxxxxxx xxxxxxxxxxxxx. Xxxxxxx xx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxx spočívat xx xxxxxxxxx zajištění právní xxxxx xxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxx x zároveň xxxxxxx xxxxx xxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxxxxxxx xx xxxxxxxxxx vzdělání.
Pokud se xxxx xxxxxx xx xxxxxxxxxx xxxxxxxx:
Xxxxxx xx xxxxxxxx xxxxxxxxxx o xxxxxxxxxx
Xxx xxxx být xxxxxxxxx - xxxxxxx xxxx xxxxxxxxx xxxxx, xxxxx xxxxxxxx xxxxxxxxxx §26 odstavec 4 xxxxxx x xxxxxxxx
- Xxxxxxxxxx právní xxxxxx xxxxxxx upřesnění stávající xxxxxxxxxx držitelů xxxxxxx x §33 zákona x xxxxxxxx xxxxxxxxxx xxxxxxxxx o xxxxxxxx xxxxxxxxxxx xxxxxxxx xx xxx x České xxxxxxxxx. Xxxx xxxx xxxxxxx xxxxxxxxxx xxxx xxxxx x xxxxxxxxxxxx xxxxxxxxxxx v elektronické xxxxxx, xxx xxxx xxxx xxxx pravidelně x xx xxxxxxxxxxxxx xxxxxx xxxxxxxx Ústavu xxxx informační xxxxx, xxxxx xxxxxxxxx informaci x množství léčivého xxxxxxxxx, xxxx xxxxxxxxx xxxxx, xxxxxx držitelem xx xxx x Xxxxx xxxxxxxxx.
- Tyto xxxxx pak xxxxx xxxxxxx Ústavu xxx xxxxx xx zdrojů xxxxxxxxx xxx xxxxxxxxxx xxxxx xxxxx na xxxx v Xxxxx xxxxxxxxx, xx vztahu x xxxxxxxxx nahraditelnosti xxxxxx xxxxxxxx xxxxxxxxx x x posouzení xxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx, pokud xx xxx xxxxxx xx xxxxxxx xxxxx §77c xxxxx x xxxxxxxx.
- Xxxxxx xxxxxx xxx xxxxxxx xxxxx xxxxxxx x xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxxxx xxx xxxxxxx pacientů x XX.
Xxxxxx na xxxxxxxxxxxx
Xxx může být xxxxxxxxxxxxx:
- Xxxxxxx povolení x xxxxxxxxxx xxxxx xxxxxx Xxxxxxx xxxx xxxxxxxxxx xxxxxxxxx autoritou x xxxxxxxx státě XX
- Xxxxxxxxxxxx xxxxx, x xxxxxxx xxxxxxxx xxxxxxxxx uvedených xx xxxxxxx xxxxx §77c xxxxxx o xxxxxxxx, xxxxxxxxxx distribuci xx xxxxxxxxx xxxxxxxxxxxxxxx elektronického xxxxxxxxx. Xxxxx xxxxxx xx 15 xxx xx jeho xxxxxxx xxxxxx OOP xxxxx §77d xxxx moci xxxxxxxx xxxxxxx.
- Xxxxxxx xxxxxxxxxxxx xxxxxxxxxxxx léčivé xxxxxxxxx xxxxxx xxxxxxxx xxxxxxx xx xxx xxxxxxxx touto xxxxxxx, xxx nedojde x xxxxxxx administrativní xxxxxx xxxxxxx se xxxxxxxxxxx xxxxxxx.
- Xxxx xxxxxxxxxxxx, xxxxx xxxxxxxx, xxxxxxxx x minimálním xxxxxxx, xx lékáren x xxxxxxxxx se xx xxxxxxxxxx xxxxxxxx přípravků xxxxxxxx xx xxx x České xxxxxxxxx xx xxxxxxxxx, xxx xxxx muset xxxxxxx xxxxx aktivity xxxxxxxxxxxxx xxxxxxxx. Xxxxxxx jim xxxxx a v x xx xxxxx xxxx xxxx xxxxxxxx xxxxx pro xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx x xxxxx republice, xxxxxxx do xxxxxxx.
Xxxxxx xx „xxxxxxx“ - xx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx lékárenské péče
Kdo xxxx xxx „xxxxxxxx“: Xxxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxx xxxxxx č. 372/2011 Sb., xxxxxx o xxxxxxxxxxx xxxxxxxx
- Navrhovaná právní xxxxxx xxxxxxxxx xxxxxxxx xxxxx xxxx zákonné xxxxxxxxxx, nebude xxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxxxxxxxx xxx xxxx xxxxxx.
- Xxxx xx xxxxxxxx xxxxx xxxxxxxxxx zejména xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxx xx xxxxxxxx
- Pro xxxxxxxx xxxx xxxxxxxx xxxxxxxxx xxxxx a xxxxxxx dostupnosti xxxxxxxx xxxxxxxxx xxx xxxxxxx, xxx xxxxxx xxxxxxxxxx xxxxxxx xxxxxx zkvalitnění xxxxxxxxx xxxx, bez xxxxxxxx xxxxxx xxxxxxxx xxxxx.
3.3 Přínosy
3.3.1.Adaptace xxxxxxxx x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx přípravků
Zjednodušení xxxxxxx podávání x xxxxxxxxxx žádostí o xxxxxxxx xxxxxxxxxx xxxxxxxxx x založení funkčního xxxxxxx EU a xxxxxxxx XX xx xxxx celkově xxxxxxx xxxxxxx nákladů xxxxxxxxxx x xxxxxxxx vyšší xxxx xxxxxxxxxxxx. Zadavatel xxxx mít x xxxxxxxxx jednotnou xxxxxx xxx xxxxxxx členské xxxxx, xx kterých xx xxxx xxxxxxxx xxxxxxxxx xxxxxxxx, x xxxxxx xxxxxx xxxxxxxxxx xxxxxxx xx xxx xxx xxxxxxxxx x xxxxxxxxx. Xx by xxxx vést k xxxx xxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx na xxxxx Xxxxxxxx xxxx x xxx i x České xxxxxxxxx.
X xxxxxxxx výše xxxxxxxxx xx mělo xxx xxxxxxx možnosti zajištění xxxxxxxxxx a xxxxxxxxxxxx xxxxx xxx xxxxxxxx, xxxxxxx finančních xxxxxx xxx poskytovatele zdravotních xxxxxx, xxx xx xxxxxxxx xxxxxxxxx probíhala, xxxxxxx prestiže xxxxxx xxxxxx x xxxxxxxxx xxxxxxxxx x xxxxxxxxxxxx xxxxxxx.
Xxxx xxxxxxxx x xxxxx xxxxxx xx xxxxxxxxx harmonizace v xxxxx Evropské unie, xxxxx xx xxxx xxxxxxxx xxxxxxxxx xxxxxxx xxx xxxxxxx xxxx. Xxxxxxx xxxxxx xxx xxx xxxxxxx x xxxxxxx xxxxxxxxxx léčivých xxxxxxxxx x xxxxxxxx x tomu, že xx osvědčil x xxxxxxxxxxx x xxxxx xxxxxxxx xxxxxxxxxx uznávání xxxxxxxxxx je xx xxxxxx xxxxxx, xxx xxxxx xxxxx xxxxxx xxx xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx s xxxxxxx xx xxxx xxxxxxxxx.
Xxxxxxxx nového režimu xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx xxxxx xxxxxxx xxxxxxxxxx xxxxx, x xx x xxxx xxxxxx, xx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxx komisí xxxxx dosavadní xxxxxx xxxxxx xxxxx xxxxxxxxxxxxx&xxxx; xxxxxxxxxxx xxxxxx, x xxxxx xx xxxxxxxx xxxxxxxxx má provádět x v němž xx x xxxxxxx, xxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxx ovlivnění xxxxx xxxxxxxx xxxxxx x x xxx související xxxxx korupční rizika, xxx jaký xxxxxxxxxxx x xxxxxx xxxxxx xxxxxx xxxxxxxx xxxxxx xxxxxx komise x xxxxxx xxxxxx, které xxxxxxx xxxxxx xxxxxx xxxxxx xxxxxxxxxx, xxxx xxxxx xxxxxx komise, x xx xx xxxxxxxxxxxx xxxxxx, má xxxxx xxxxxxxxxx právní xxxxxx jmenovat a xxxxxxxxx xxxxx ministr xxxxxxxxxxxxx.
3.3.2. Xxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxx přípravků
Přínosem xxxxxxxxxxxxx xxxxxx xxxxxx na xxxxx xxxxxxxxx opatření xxxxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx pro xxxxxxxx x Xxxxx xxxxxxxxx, x tím xxxxxxxx xxxxxxxx xxxxxxx xxxxxx zdraví.
Zavedení vícestupňového xxxxxxx regulace xxxxxx xxxxxxxx xxxxxxxxx je xxxxxxxx xx shromažďování x xxxxxxxxxxxxx xxxxx x xxxxxxxxxx a xxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx se xxxxxxxx xx xxxx subjektů, x xx jak xx xxxx, xxxxx xxxxxx přípravky xxxxx xxxxxx dodávají, xxx x od xxxx, xxxxx xx od xxxxxx xxxx přijímají, x xxxxxxx xxxxx xxxxxxxx xxxxxx xx xxx xxx odpovídat xxxxxxxxx xxxx xxxxxxx xxxxxx a xxxxxx. Xxx tak x xxxxx xxxxxxx křížovým xxxxxxxx, xxxxx jsou x xxxx xxxxxxxx xxxxxxxxxxxx obdobně xxxx xx tomu x xxxxxxx účetnictví, kdy xxxxx „xx xxxx“ xxxxxxxx údaj „dal“ . Údaje x xxxxxx vyvážených xxxxxxxx xxxxxxxxx je xxx xxxxx xxxxxxxxx za xxxxxxxxx a xxxxxxx xxxxxx falšování xx xxxxx xxx teoretická. X této souvislosti xx xxxxx xxxxxxxxxxx, xx dosud nebyly xxxxxxxx xxxxxx závažné xxxxxxx, xxx xx xxxxxx xxxxxxxxx xxxx xx skutečnosti fakticky xxxxxxxx mimo Xxxxxx xxxxxxxxx, x xxxxxx xx jejich dodávky xxxx xxxxxxxx vykazovány xx xxxxx Xxxxx xxxxxxxxx. Xxxxxxx takového xxxxxxxxxx jednání je xxxxxxx sběrem x xxxxxxxxx xxxxxxxxxxxxxx rozhodných xxxxx x xxxxxxxxxx x spotřebě xxxxxxxx xxxxxxxxx výrazně ztížena xx téměř xxxxxxxxx. Xxxxxxxx regulace xxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxxx xxxxxx korupčních xxxxx.
3.4 Xxxxxxxxxxx nákladů x přínosů xxxxxxx
3.4.1. Xxxxxxxx xxxxxxxx x xxxxxxxxxx hodnoceních xxxxxxxxx xxxxxxxx xxxxxxxxx
Xxxxxxxxxxx xxxxxxx x přínosů bylo xxxxxxxxx x xxxxx xxxxxxxxxxxx xxxxxxx xxxxxx, xxx je uvedeno xxxx.
3.4.2. Opatření xxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxx přípravků
Vyhodnocení xxxxxxx x xxxxxxx xxxx xxxxxxxxx x xxxxx xxxxxxxxxxxx xxxxxxx xxxxxx, xxx xx xxxxxxx xxxx.
3.4.3. Xxxxxxxx xxxxxxxx xx xxxxxx x xxxxxxx látkám xxx xxxxxxx xxxxxx xxxxxxxxx
Xxxxxxx xxxxxxxxx xx xxxxxxxx xxxxxxx xxxxx xxxxxx x léčivech tak, xxx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx Xxxxxx x xxxxxxxxx xxxxxxxxx (XX) č. 1252/2014.
3.4.4. Součinnost Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx x Xxxxxxxxxxx xxxxxxxxxxx xxx
Xxxxxxxx 1 xxxxxxxxxxx ve xxxxx xxxxxx o léčivech xx xx xxxxxx, xx xxxxxxx rychlé xxxxxx xxxxxxxx, x xxxxxx xx inspiruje xxx xxxxxxx xxxxxxx xxxxx, x xx xxxxxxxxx xxxxxxxxxxx §8 xxxxxx x. 226/2013 Xx.
Xxxxxxxx 2 spočívající x přijetí doprovodné xxxxxx zákona x Xxxxx xxxxxx Xxxxx xxxxxxxxx k xxxxxx xxxxxx novely zákona x léčivech by xxxxxxxx xxxx xxxxxx xxxxxx, avšak xxxxxx xx spadala do xxxxxxxxxx xxxxxx resortu, x xxxxx by xxxx omezeny xxxxxxxx xxxx xxxxx, pokud xx si přijetí xxxxxx xxxxx xxxxx xxxxxxxxxx.
Xxxxxxxx 3 xxxxxxxxxxx xx vyčkání xxxxxxxxxx xxxxxxxxxx xxxxxx x Xxxxx správě Xxxxx xxxxxxxxx xx xxx xxxxxxx nedostatek, že xx xxxxxxxx xx xxxxxxx xxxxxxxxxxx eventuální xxxxxxx novelizace xxxxxx č. 17/2012 Sb. xxx xxxxxxxx xxxxxxxxx xxxxxxxxxx obou xxxxxx xxxxxx správy xx velmi xxxxxxx xxxx, xxxxxxx trhu x xxxxxx xx xxx x Xxxxx xxxxxxxxx nebyla xxxxxxxxxx xxxxxx.
3.4.5. Prokazování při xxxxxxxxx činnosti x xxxxxx xxxxxxxxx xxxxxxxxx x zabrání xxxxxxxx xxxxxxxxx
Xxxxxxxx 1 xxxx xxxxxxx x xxxxxx xxxxxxxxx xxxxxxxx. Xxxxxx xxxx přijetí by xxxx za následek xxxxxxxxxxx pro praxi xxxxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxx, xxxxx xxxxxxxx xxxxxx xxxxxxx především xx straně xxxxxxxxxxxxxx xxxxxxxx, pro xxxxx xx xxxxxxxx právní xxxxxx xxxxxx činnosti xxxxx xxxxxxx a xxxx xx komplikacím x průběhu xxxxxxxxx xxxxxxxx x k xxxxxxx ztrátám xxx xxxxxxxxxxx kontrolách. Xxxxxxxxx xxxxxxxx či xxxxxxxx xxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxx xxxxxxxxx, se xxxxxxx xxxxxxxxx neoprávněné xxxxx, xxxxxxxxxxx xxxxxxxx xxxxxx xxx možné xxxxxxxxxx xxxxxxxxxx léčivých xxxxxxxxx, x xxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxx xx xxxxxx xxxxxxxxx xxxx. Xxxxx xxxxxxx xxxxxxxx xxxxxxxx přípravků xxxxxxxxxxx xxx osoby, kterým xxxx zabrány, xxxxxx xxxxxxxxxx dopad, který xxxx xxxxxxx efekt xxxxxxxxxxx dalšímu xxxxxxxxxxx x xxxxxxxxxxx xxxxxxxx.
Xxxxxxxx 2 xx přinesla xxxxxxxxx xxxxxx prokazování xxxxxxxxxx xxx xxxxxxxxx xxxxxxxxx činnosti x xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxx přípravků xxx, aby xxxx xxxxxxxxxx i xxx xxxxxx xxxxxxx, xxx xx xxxxxxxx, že x xxxx xxxxxxxxx xxxxx, xxxxx x xxxx xxxxxx xxxxx xxxxxx xxxxxxxxx. Xxxx xxxxxxxx představuje účinnější xxxxxx xxxxxxx xxxxxxxx x xxxx společnosti xxxx dopady xxxxx xxxxxxxx xxxxxxxxx, jejichž xxxxxx, xxxxxxxx x xxxxxxxxxx xxxxxx xxxxxxxxx x průběhu xxxxxxxxx xxxxx léčiva x xxxxxxxxxxx xxx velmi xxxxxx riziko pro xxxxxx xxxxxxxx x xxxxxxxx xxxx náklady xxx systém xxxxxxxxx xxxxxxxxxxx xxxxxxxxx, v xxxxxxxxx xxxxxxxxx x xxxxxxxxxx xxxxxxx xx xxxxxx pacientů.
4. Xxxxx xxxxxx
4.1 Xxxxxxxxx pořadí xxxxxxx x xxxxx xxxxxxxxxxxxxx xxxxxx
4.1.1. Xxxxxxxx xxxxxxxx xxx xxxxxxxx xxxxxxxxx xxxxxxxxx léčivých xxxxxxxxx
Xxxxxxxxx xxxxxxxx x xxxxxxxxxxx jednotlivých variant xxxx xxxxxxxxx, xxx xx xxxxxxx xxxx.
4.1.2. Xxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx
Xxxxxxxxx xxxxxxxx x xxxxxxxxxxx jednotlivých xxxxxxx xxxx xxxxxxxxx, jak xx xxxxxxx výše.
4.1.3. Xxxxxxxx xxxxxxxx xx xxxxxx x léčivým xxxxxx pro xxxxxxx xxxxxx xxxxxxxxx
Xxxxxxxxxxx xxxxxxxxx xx xxxxxxxx xxxxxxx xxxxx xxxxxx o xxxxxxxx xxx, xxx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx Xxxxxx x přenesené xxxxxxxxx (EU) č. 1252/2014.
4.1.4. Xxxxxxxxxx Státního xxxxxx xxx xxxxxxxx xxxxx x Generálního ředitelství xxx
Xxxxxxxxxxx variantou xx xxxxxxxx 1 xxxxxxxxx xx změně zákona x xxxxxxxx. Xxx x xxxxxxxxxxxx, x xxxxxx xxxxxxxxxxxxxxxx xxxxxx xxxxxxxx, když xxxxx xx při xxxxx xxxxxxxxxxx xxxxxxx xxxxxx xxx xxxxxxxxx xxxxxxx xxxxxxx řádem, xxxxx x xxxxx xxxxxx xxxxxx a xxxxxxxx xx. Xxxx varianta xxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxx xxxxxx xxxxxx správy x xxxxxxxx tak xxxxxxx xxxxxxx xxxx Xxxxx xxxxxxxxx x současně xxxx EU xxxx xxxxxxx léčiv, xxxxx xxxxxxxxxxxx xxxx kvalitou xxxxxxx xxxxxxxxxx x xxxxxx XX.
4.1.5. Xxxxxxxxxxx xxx inspekční xxxxxxxx x právní xxxxxxxxx xxxxxxxxx x zabrání xxxxxxxx přípravků
Doporučenou xxxxxxxxx xx xxxxxxxx 2, xxxxxx by xxxx xxx dosaženo xxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx při xxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxx by xx xxxx xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxx a xxxxxxx xxxxxxxx přípravků xxx, xxx byly xxxxxxxxxx x pro xxxxxx situace, xxx xx xxxxxxxx, xx x nimi xxxxxxxxx xxxxx, xxxxx x xxxx xxxxxx xxxxx xxxxxx oprávněny. Xxxxxx xx xxx již xxxxxxxxxxxxx xxx praxi xxxxxxxxxxxx xxxxxxxxxx právní xxxxxx, která xx xx xxxxxx xx xxxxxxxxxxxxx xxxxxxxxx xxxxx xxxxxxx x xxxx xx xxxxxx x xxxxxxxxxxx x průběhu xxxxxxxxx činnosti a xxxxxxxxxx xxxxxxxxxxxxx časovému xxxxxxx xxxxxxxxxxx xxxxxxx.
Xxxxxxxxx xxxxxxxx či xxxxxxxx xxxxxx padělky xxxxxxxx xxxxxxxxx xxxx léčivé xxxxxxxxx, xx xxxxxxx xxxxxxxxx xxxxxxxxxxx osoby, xxxxxxxxxxx xxxxxxxx zdravotní xxxxxx xxx možné xxxxxxx x jejich xxxxxxxx. Xxxxx zabrání xxxxxxxx léčivých xxxxxxxxx xxxxxxxxxxx xxx xxxxx, xxxxxx xxxx zabrány, xxxxxx ekonomický dopad, xxxxx xxxx posílit xxxxx zabraňující xxxxxxx xxxxxxxxxxx x neoprávněné xxxxxxxx.
5. Xxxxxxxxxxxx xxxxxxxxxx xxxxxxxx x xxxxxxxxxx
Xxxxxxx xxxxxxxxxx xx xxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxx, xxxxx xxx x xxxxxxxx xxxxxxxx x xxxxxxxxxx hodnoceních xxxxxxxxx xxxxxxxx přípravků, xxxx xxxxxxxxx Xxxxxx xxxxx xxx xxxxxxxx xxxxx, xxxxx xx již xxxxx xxxxxxxxxxx xxxxx xxxxxx o xxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx správním xxxxxx xxx xxxxxx xxxxxxxx léčiv, xxxxxx xxxxxxxxxx x xxxxxxx xxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx přípravků. Xxxxxx xxxxx xxx xxxxxxxx léčiv xx xxxxxxx xxxx jiné xxxxxxx xxxxxxxxxx x xxxxxxx xxxxxxx, účinnosti x xxxxxxxxxxx léčiv, x to i xx xxxxxx x xxxxxxxxxx xxxxxxx xxxxxxxxx xxxxx x Xxxxxxxx xxxx.
Xxxxxx xxxxxxxxxxx xx xxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxx, pokud xxx x opatření xxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx, budou xxxxxxxxx Ministerstvo zdravotnictví x Xxxxxx xxxxx xxx kontrolu xxxxx. Xxxxxxxxxx xxxxxxxx bude xxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxx xxxxxxxx xxxxxx xxxxxxxxxxxxx, x xxxx xxx xxxxxxx xxxxxxxxxxx podmínek xxxxxxxxxxxxxxx xxxxxxx opatření xxxxxxxxxxxx distribuci xxxxxxxx xxxxxxxxx xxxxxxxxx xx xxxxx xxxxxxx xxxx xxxxx Xxxxx xxxxxxxxx. Xxxxxxxxxxxx optimálního xxxxxxxxx xxxxxx xxxxxxx xx xxxxxxx xxxxxxxxx xxxxxxxx x aktuálních dat x xxxxxx, xxxxxx xxxxxxxx xxxxxxxxxx a xxxxxxxxxxxxx, xxxxxxxx x xxxxxxxxxx xx takovém xxxxxxxxx vyhodnocování operativní xxxxxx xxxxxxxxxxx xxxxxxxx. Xxxxxxxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxx xxxxxx xx porušení xxxxxxxxxxx povinností.
6. Xxxxxxx xxxxxxxxx regulace
Přezkum xxxxxxxxx xxxxxx xxxxxx x xxxxxxxx xxxxx x xxxxx xxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx a Xxxxxx xxxxx pro xxxxxxxx xxxxx ve xxxxxxxxxx x dotčenými xxxxxxxx, x xx x xxxxxxxx xxxxxxxxx xxxx xxxxxx xxxxxx x xxxxxxx x xxxxxxxx xxxxxxxxxx cílů xxxxxxxxxxx xxxxx xxxxxx xxxxxxx. Xxxxx xxxxxxx xx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxxx xx Komise, xxxxx xx ustanovením čl. 97 xxxxxxxx x. 536/2014 xxxxxx xxxxxxx xxxxxxxxxxx xxxxxx nařízení.
Navrhovatel xx 2 letech od xxxxxxxxx xxxxxx úpravy xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxx pro pacienty.
Pro xxxxxxxxx naprosto přesných xxx pro účinný xxxxxxx xxxxxxxx xxxx xxxxx z xxxxxxx, xxx xx bylo xxxxxxxxxx x přijetí xxxxxxxx x xxxxxxx xxxxxxxxx léčivých xxxxxxxxx, xxxxxxx xxxxxxxxxxxxx. Zejména xxxx xxxxxxxxx, xxxxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx opatření xxxxxxxx, x jaký xxxxxxxxx xxxxx DDD xxxxxx xxx v nich xxxxxxx. Xxxxxx xxxx x každém xxxxxxx xxxxxxxxxxx, xxx x xx xxxx míry xxxxxxx opatření xxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxxxxx léčivých přípravků xxx xxxxxxxx v Xxxxx republice a xxxx xxxxxxxx xxxx xxxxxxxxxxx xxxx xxxxxxxx xxxxxxxx a po xxxx xxxxxxx xx xxxxxxxxxxx jednotlivých xxxxxxxx xxxxx x xxxx xxxxxx xxxxxx opatření.
Kromě xxxxxxxxxx vyhodnocení účinnosti xxxxxxx xxxxxxxxx xxxxxxxx xxx xxxxxxxx budou xxxxxxxxxxx jeho důsledky xxx xxxxxxxxxxxx léčivých xxxxxxxxx, xxxxxxx jedním xx xxxxxxxxx xxxxxxxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxxx, xxxxx xx x xxxxxxx xxxxxxxxx opatření xxxx x xxxxxxxxxx xxxxxxx xxxxxx xx xxxxxxxxx, a xxxxxxxxxx xxxxxxxxxx objemu xxxxxxx, xxxxx x xxxxxxxx xxxxxxx xxxxxxxx byly xxxxx xx xxxxxxxxx xxxxxx xx xxx x České xxxxxxxxx. Xx xxxxxxx vyhodnocení xxxxxxxxxxxx xxxxxxx xxx xxxx provedeno xxxxxxxx xxxxxxxxxxx celého období xxxxxx účinnosti právní xxxxxxxx omezující xxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxx bude xxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxx xxxx xxxxxxxx xxxxxxxx xxxxxxxxx, které xxxx xxxxxxxx xxxxxx xxxxxxxxxxxxx, x přijatými opatřeními xxxxxxxxx x omezení xxxxxxxxx xxxxxxxx xxxxxxxxx, xxx xxxxx xxx xx xxxxxxxx rozhodných xxxxx objektivně xxxxxxxxx, xxx xxxxxxxx vícestupňový xxxxxx xxxxxxxx vývozu xxxxxxxx xxxxxxxxx x xxxx xxxxx jednotlivě x xx xxxx xxxxxxx nadále xxxxxxxx xxxxxxxxxxx xxxxxxx x xxxxxxx xxxxxxx zajistit xxx xxxxxxxx x Xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx.
7. Xxxxxxxxxx x xxxxxx xxx
Xxxxx zákona byl x průběhu xxxxxxxx xxxxxxxx xxxxxxxxxxx x xxxxxxxxx xxxxxxxxx subjekty. Xxx oblast xxxxxxxx xxxxxx x xxxxxxx xxxx se přípravy xxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxx xxx multicentrické xxxxxxxx xxxxxxxxx a Xxxx etických komisí. Xxxxxxxxxxx x xxxxxxxxxxxxxx xxxxxxx x možností xxxxxxxxxx byli zástupci xxxxx etických komisí xxx multicentrická hodnocení x xxxxxxxx místních xxxxxxxx xxxxxx xxxxxxxxxxx xx xxxxxxx Fóra xxxxxxxx xxxxxx. Xxxxxxxxxxx xxxx x xxxxxxxxxx xxxxxxxxxx s xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xx xxxxxxxx xxxxxxxx xxxxxx. Xx xxxxxx možnosti xxxxxxxxx xxxxxx xxxxxxx xxxxxxx xxxx xxxx xxxxxxxx zadavatelé xxxxxxxxxxxxxxx Xxxxxxxx xxxxxxxxxxxx průmyslu, Xxxxxxxx generických přípravků, xxxxxxxx Asociace xxxxxxxxxx xxxxxxxxx xxxxxxxxxx, Xxxxxxxx xxxxxxxxxx xxxxx. Ministerstvo xxxxxxxxxxxxx xxxx xxxxxx xxxxxxxxxxxx s Ministerstvem xxxxxxx x Xxxxxxxxxxxxx xxxxxxxxxxxxx.
Xxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx k xxxxxxx xxxxxxxxx léčivých xxxxxxxxx xxxx xxxxxxxxx xxxxxxxxxxxx x xxxxxxxxxxxx xxxxxxxx xxxxxxxxxx x xxxxxxxxxx, xxxxx hledali možnosti xxx zamezit xxxxx xxxxxxxx xxxxxxxxx xx xxxxxxx xxxxxxxx xx xxx v České xxxxxxxxx xx xxxxxxxxx x xxxxxx x Xxxxxxxx inovativního průmyslu.
Návrh xxxxxx xxxxxx o xxxxxxxx xxx v xxxxx meziresortního xxxxxxxxxxxxxx xxxxxx v xxxxxxx x xx. 8 Xxxxxxxxxxxxxx xxxxxxxx vlády xxxxxxxxx s xxxxxxxxx xxxxxxxxxxxxxx xxxxx.
8. Kontakt xx xxxxxxxxxxxx XXX
Xxxxx x příjmení: MUDr. Xxxxx Xxxxxxx
Xxxxxx: xxxxxxx xxxxxxxx xxxxxxxxxx hodnocení
Útvar: Xxxxx xxxxxxxxxx, xxxxxxxx xxxxxxxxxx hodnocení XXXX
Xxxxxxx: 272 185 817; 724 917 141
e-mail: xxxxx.xxxxxxx@xxxx.xx
Xxxxx x xxxxxxxx: Xxx. Apolena Xxxxxxxx
Xxxxxx: xxxxxxx xxxxx xxxxxx
Xxxxx: Xxxxx dozoru Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx
Xxxxxxx: 272 185 706
x-xxxx: xxxxxxx.xxxxxxxx@xxxx.xx
X. Xxxxxxxxxx xxxxxxx xxxxxxxxxx právní xxxxxx x ústavním xxxxxxxx Xxxxx republiky, x xxxxxxxxxxxxx smlouvami x x předpisy Xxxxxxxx xxxx, judikaturou xxxxxxxx xxxxxx Evropské xxxx a obecnými xxxxxxxx xxxxxxxx xxxxx Xxxxxxxx unie
Navrhovaná xxxxxx xxxxxx odpovídá xxxxxxxxx xxxxxxx a xxxxxxxx xxxx Xxxxx xxxxxxxxx, xxxxxxx xxxxxxxxx zákonu č. 1/1993 Sb., Xxxxxx České xxxxxxxxx, xx xxxxx xxxxxxxxxx xxxxxxxx, x xxxxxxxx předsednictva Xxxxx xxxxxxx xxxx č. 2/1993 Sb., x vyhlášení Listiny xxxxxxxxxx práv a xxxxxx jako xxxxxxxx xxxxxxxxx pořádku České xxxxxxxxx, které se xxxxxxxx x xxxxxxxxxxxxx xxxxxx zákona.
Navrhovaný systém xxxxxxxx xxxxxxxx xxxxxxxxx xxxx x xxxxxxx x mezinárodními xxxxxxxxx, xxxxxxx xx Xxxxx xxxxxxxxx vázána.
Navrhovaná xxxxxx xxxxxx je x xxxxxxx x Xxxxxxx x xxxxxxx xxxxxxxx xxxx a xxxxxxxxxx xxxxxx. Xxxxxxxxx xxxxxx xx xxxxxxxxxxx proces x xxxxx xxxxxxxxx xxxxxxxx, xxxxx xxxxxxxx xxxxxxxx xx xxxxxxxxxxx xx postupů xxxxxxxxxxx xxxxxxxx řádem a xxxxxxx x přestupcích, xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxx xxxxx xxxxxxxxx, stanovena jsou x kritéria xxxxxxxxxx x vymezena xxxxxxx xxxx xxxxx.
Xxxxxxxxxx právní xxxxxx xx xxxxxx x xxxxxxx x Xxxxxxx x xxxxxxxx xxxxxxx x biomedicíně, xxxxxxxxx xxx č. 96/2001 Sb. m. s. Xxxxx x xxxxxxx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxx jiné xxxxxxxxxx xxxxxxxxxx čl. 3 Xxxxxx, podle kterého xxxxxxx xxxxxx, xxxxxx xx zřeteli xxxxxxxxx xxxxxxx x dostupné xxxxxx, učiní xxxxxxxxxxxx xxxxxxxx, xxx x xxxxx xxx jurisdikce xxxxxxxxx xxxxxx dostupnost xxxxxxxxx xxxx xxxxxxxx xxxxxxx. Zajištění zdravotní xxxx patřičné kvality xxxxxx xxxxxxxx xxxxxxxxx xxxxxx xxxxxxxx x Xxxxx xxxxxxxxx v xxxxxxx léčivých xxxxxxxxx, xxx xxxx nebyly xxxxxxxxxxxxx mimo Xxxxxx xxxxxxxxx na xxxx xxxxxxxxxx xxxxxxxxxx potřeb xxxxxxxx v Xxxxx xxxxxxxxx.
Xxxxx xxx x xxxxx xxxxxxxxx xxxxxxx, xxx distributor léčivých xxxxxxxxx xxxx xxxxx xxx xxxxxxx x x xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx xxxx xxxxxxxx xxxxxxxxx x Xxxxx republice xxxx xxxxxx xxxxxxxxxx xx xxxxxxxxx, xxxxx hovořit x xxx, že xx xxx bylo xxxxxxx xxxx xxxxx xxxxxxxx x xxxxxxxxxx xxxxx hospodářskou činnost xx smyslu čl. 26 xxxx. 1 Xxxxxxx xxxxxxxxxx xxxx x xxxxxx, když xxxx x čl. 26 xxxx. 2 Xxxxxxx xx xxxxxxxxxx xxxxxxx, že xxxxx xxxx xxxxxxxx xxxxxxxx x xxxxxxx xxx xxxxx xxxxxxxx xxxxxxxx. Xxxxxx podnikatel xxx získá xxxxxxxxx, xx xxx x Xxxxx xxxxxxxxx, pokud xxx o zásobování xxxxxxxx xxxxxxxx xxxxxxxxx, xxxx naplněn, x xxxxx tímto směrem xxx xxxx xxxxxxx xxxx xxxxxxxxxxxxxx xxxxxxxx. Xxxxx právo podnikat xx xxxxx xxxxxxxxx x právem práva xxxxxx na ochranu xxxxxx a na xxxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxx x článku 31 Xxxxxxx xxxxxxxxx taktéž xx práv xxxxxxxxxxxxx, xxxxxxxxxx x xxxxxxxxxx. Xxxxx podnikat xxx xxxxxx xxx vykonáváno xxx, že xx xxxx výkon xxxxxxx xxxxxxxx xxxxxxxx xxxxxx xx xxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxx xxxxx.
Xxxxxxxxxx xxxxxx xxxxxxxx léčivých xxxxxxxxx není x xxxxxxx x mezinárodními xxxxxxxxx, xxxxxxx je Xxxxx republika xxxxxx.
Xxxxxxxxxx xxxxxx xxxxxx xxxxxxx x xxxxxxxx Evropského xxxxxxxxxx a Xxxx (XX) č. 536/2014, xxxxx xxxxxxxx na podmínky x Xxxxx xxxxxxxxx, xxxxxxx respektuje xxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxx x upravuje xxx xx xxxxxxxxxxx, xxxxx jsou xxxxxxxx xxxxxxxxx xxxxx xxxxxxx xxxx je xx xxxxxxxxx je xxxxxxx.
Xxxxxxxxxx xxxxxx by x xxxxxxx xxxxxxx horizontu xxxx xxxxxxx k xxxxx míře xxxxxxxxxx xxxxx občanů xx xxxxxxx xxxxxx x xx xxxxxxxxx xxxxxxxxx xxxx zakotveného x článku 31 Xxxxxxx xxxxxxxxxx xxxx a xxxxxx xxx, že by xxxx výrazně xxxxxxx x xxxxxxx xxxxxx xxxx xxxxxxx, kdy xx byl na xxxx Xxxxx republiky xxxxxxxxxx léčivých xxxxxxxxx xxxxxxxxx jejich nadměrným xxxxxxx.
Xxxxxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxxx, transparentnosti, xxxxxxxxx, odůvodněnosti, xxxxxxxxxxxx, xxxxxxxxxx xxxxxxxxx, xxxxxxxxx x xxxxxxxxxx xxxxxxxxx xxxxx xxxxxxxxxxxx navrhované xxxxxx úpravy s xxxxxx Xxxxxxxx unie, xxx xxxxxxx xx xxxxx přijmout xxxxxxxxxxxx xxxxxxxx xxxxxxx přeshraničnímu xxxxxxx x důvodu xxxxxxx xxxxxx a xxxxxx xxxx. Xxxxxx xxxxxxxx xxxx být xxxxxxxxxxxxxx, zejména xxxx xxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx. X xxxxxx xxxxxxxx xxxx xxx xxxxxxxx xxxxxxx xxxxxxxx xxxxxx odůvodněné. Xx základě xxxxxxxxx xxxxxxxx navrhovaná xxxxxx xxxxxx xxxxx podmínkám xxxxxxxx.
Xxxxxxxxx xxxxxx s xxxxxxxx xxxxxxxxx napříč xxxxxxxxx státy Evropské xxxx je xxxxxxxxxx x souladu xx xxxxxxx xxxxxxx xxxxxx xxxxx (xx. 34 x 35 Xxxxxxx x fungování Xxxxxxxx xxxx), xxxxx xxxxxxxxxxx xxxxx xx xxxxxxxxxx xxxxxx jednotného xxxxxxxxx xxxx Evropské unie. Xxxxx xxxxxxxx přípravků xxxx x konečném xxxxxxxx xxxx xxx x některých xxxxxxxxx xxxxxxxx akutní xxxxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xx trhu v Xxxxx xxxxxxxxx. Za xxxxxxxxxxx xxxxxxxxx péče x xx zdraví xxxxxx xxxx přitom xxx xxxxx Xxxxxxxx xxxx xxxxxxxxx xxxxxxx xxxxx. Xxxxxxxxxx xxxxxx xxxxxx je xxxxx x xxxxxxx x xxxxxx Evropské unie, xxx xxxxxxx xxx xxxxxxxx příslušná xxxxxxxx xx xxxxxx ochrany xxxxxx x xxxxxx xxxx, x xxxxx xxxxxx xx právě xxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx přípravků xxx xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx.
Xxxxxxxxxx xxxxxxx xxxxx XX x xxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxx xxxxxxxx xx xxxxxx xxxxxxx rizika xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxx xxxxxx xxxxxxxxx, xxxxxxx xx xxxxxx Xxxxxx xxxx xxxxxxx x nich xxxxxxxxxx xx rozpor x xxxxxx Xxxxxxxx xxxx. Xxxxxxxx xxxx xx strany Xxxxxx xxxxxxxx plošnost xxxxxxxxx xxxxxxxx x xxxxxx xxxxxx xx xxxxxxxx xxxxxxx pohybu zboží. Xx základě analýzy xxxxxxx z xxxxxxxx xxxx (zejména Xxxxxxxxx) xxxx xxxxxxx x xxxxxx, že xxxxxxxxxx xxxxxx, xxxxx xxxxxxx xx xxxxxxxxx xxxxxxx xxxxxxxx přípravků, xxxxx xxxx xxxxxxxx nedostupností, x x možnosti xxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xx tomto xxxxxxx xxxx xxxxxxx xxxxxxx xxxx, xx v xxxxxxx s xxxxxx Xxxxxxxx xxxx. Regulace xxxxxx léčivých přípravků xx xxxxxxxxx jako xxxxxxxxxxxx, xxxxxxx z xxxxxxxx xxxxx x xxxxxxxx xxxxxxxxxxx konkrétních xxxxxxxx xxxxxxxxx na xxxx, xxxxxxx xxxxxx xx xxxxxxxx xxxxxxxxxxxxx x xxxxx xxxxxxxx xxxx xxxxxxxxxxxxx. Plně xxxxxxxxxx xxxxxxxxxx Evropského xxxxxxxx xxxxx, xxxxxx xx xxxxxxxx xxxxxx xxxxxxxx přijmout opatření xxxxxxx x xxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx pro xxx xxxxxx x xxxxxxxx xxx xxxxxx xxxxxxxx xxxxxxx pohybu xxxxx. Xxxxxxxx xxxxxx xxxxxx xxxxxxxx xxxx xxxxxxxx xxxxx x xxxxxx xxxxxxx omezující xxxxxxxx xxxxxxxx xxxxxxxxx na Xxxxxxxxx, xxxxx byla xx xxxxxx EK xxxxxxxx za úpravu xxxxxxxxx xxxxx pohyb xxxxx, protože xxxxxxxxxxxxx xxxxxxxx xxxxxxx, vztahující xx na xxxxxxx xxxxxxxx xxxxxx přípravky, xxxxxxx, protože xxxxxx xxxxxx xxxxxxx, ale xxxx xxxxxxxx xxxxxxxxxx x xxxxxx dostatečně xxxxxxxxxx. V poslední xxxx xx xxxxx xxxxxxxxx x Xxxxxx, xxx vstoupila x xxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx reexport x xxxxxx xxxxx EU x xxxxxxxx x xxxx, xx x xxxxx xxxxxxxx omezujících xxxxxxxx xxxx x Xxxxxx činěna četná xxxxxxxx k xxxx xxxxxxx, xxxxxx tak xxxxx, xx se xxxx xx reexport xxxxxxxx xxxxxxxxx x Xxxxx xxxxxxxxx xx xxxxxxxx xxxxxxxxxx opatření x sousedním státě xxxxx zvýší.
Ostatní členské xxxxx, xxxxx reexport xxxxxxxx xxxxxxxxx omezují, xxxxxxxxx xxxxxxxxxx článku 81 xxxxxxxx 2001/83/ES x xxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxx přípravků pro xxxxxxxx xxx xxxx.
Xxxxxxxx xxxxxxxx Xxxxxx v xxxxxxxxx pravomoci (XX) č. 1252/2014 xx xxx 28. května 2014 xxxxxxxxxx směrnici Xxxxxxxxxx xxxxxxxxxx a Rady 2001/83/XX, xxxxx jde x xxxxxx a xxxxxx xxxxxxx výrobní xxxxx pro xxxxxx xxxxx xxx humánní xxxxxx xxxxxxxxx, se xxxxxxxxx xxxxxxxx platná xxx xxxxxx látky xxx humánní xxxxxx xxxxxxxxx. Xxxxx xxxxxx xx xxx přispět x xxxxxxxx xxxxxxxx xxxxxx xxxxxxxx x xxxxxxxxxx Xxxxx republiky.
Předkládaný xxxxx zákona xxxx x xxxxxxx x xxxxxxxxxxx xxxxxxxx orgánů Xxxxxxxx xxxx x xx x xxxxxxx x obecnými zásadami xxxxx Evropské xxxx (xxxx. xxxxxx xxxxxx xxxxxxx, proporcionality a xxxxxx xxxxxxxxxxxx).
X. Xxxxxxxxxx xxxxxx xxxxxxxxxxxx xxxxxx xx xxxxxx x xxxxxx diskriminace
Navrhovaná xxxxxx xxxxxx xxxxxxxxxx xxxxx xxxxxxxxxx, xxxxx xx xxxx v xxxxxxx xx xxxxxxx diskriminace.
Navrhovaná xxxxxx xxxxxx xxxx xxxxxxxxxxxxx xxx xxxxxxxxxx xxxxxx na xxxxxxx xxxx x xxx x xxxxxx x xxxxxxxxxxxx jednoho x xxxxxxx, xxxxx xxxxx xxxxxxxxxxx ani xxxxxxxxxxxx xxxxx z xxxxxxx x xxxxxxxxx xxx xxx xxxxxxx xxxxxxxx.
X. Xxxxxxxxxx xxxxxx navrhovaného xxxxxx xx vztahu x xxxxxxx xxxxxxxx x osobních xxxxx
Xxxxxxxxxx xxxxxx xxxxxx xxxxxxxxx xxxx zpracování xxxxxxxx xxxxx. Xxxxxxxxxxx xxxxxx xxxxxxx xxxx měněno xxx existující xxxxxxxxxx xxxxxxxx xxxxx. Xxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxx xxxxx xxxxxxxxxx xxx xxxxxxxxx xxxxxxxx xxxxxxxx údajů.
Navrhovaná xxxxxx úprava xxxxxxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxx x xxxx xx xxxxxx xxx xxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxx x xxxxxx xxxxxx. Xxxxx xxx x xxxxxxxxxx xxxxx x ustanovení §33 xxxx. 2, §77 xxxx. 1 xxxx. x) x §82 xxxx. 3 xxxx. x), změna xxxxxxx x podstatě pouze x xxx, že xxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxx, xxxxxx xxxxx xxxxxxxx, xxxxx xxxx, xx základní xxxxxx xx xxxx xxxxxxxx xxxxx v xxxxxx, xxxx xxxxxxx xxxxx x xxxxxxxxxxx xxxxxxxxxx Xxxxxx v xxxxxxx xxxxxxxx, xx. xx xxxxxxxx, xxxxx rozsah xxxxxx údajů, xxxx xxxx xxxxxxx x xxxxxxxxx, zůstane xxxxxx xxxx dosud. Pokud xxx o ustanovení §53x až §53x, §54 a §55, xxxxxxxx se xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx, opět xxxxxx xxxxxxxxxxxxx údajů, včetně xxxxx xxxxxxxx, xxxxxxx xxxxxx, xxxx dosud xx x xxxxxxxxxx §51 x xxxx. xxxxxxxxx xxxxxx xxxxxx. Xxxxx xxx x xxxxx x ustanovení §101 xxxx. 1, xxxxx xxxxxxx pouze x xxx, xx xxxxxxxx inspektora xx xxxx xxxx xxxxxxxxx xxxxxxxxxx x tehdy, xxxx xxxx xxxxxxxxx xxxxxxx xxxxxxxxx podle xxxxxx xxxxxxxx předpisů xxx podle zákona x xxxxxxxx x xxxxxx již muset xxxxxxxxxx xxxxxxxxxxxx osobě xxxxxxx xxxxxxxx k xxxxxxxxxx xxxxxxxx xxxxxxxx xx hoc. Xxxxx xx vyvolána xxxxxxxx xxxxxxxxxx xxxxxxx x xxxxxxxxxxx xxxxxxxxxx, x xx xxx xxxxxx xx ryze formální xxxxxxxxxx, xxxxxxxxx, xxxxx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxx x určitém xxxxxxx xxxxx vykonává, x xx xxxxxx poskytovaných xxxxxxxx xxxxx xxxxx xxxx xxxx.
X. Xxxxxxxxxx xxxxxxxxxx xxxxx (CIA)
Navrhovaná xxxxxx úprava xxxxxxxxx xxxxxx xxxxxxxxxx xxxxx. Xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxx xx xxxxxxx xxx v xxxxxxxxxxxx xxxxxxx, xxx se xxxxxxxxx varianty xxxxxx, x xx xxx x xxxxxxx xxxxxxxxxx xxxxxxxxx léčivých přípravků, xxx x v xxxxxxx xxxxxxxx xxxxxx xxxxxxxx přípravků. Xxxxxxxxxx xxxxx xx svým xxxxxxxx xxxxxxxxx cílům, x xxxxxxx xxxxxxxx xx xxxxxxxxxx. Xxxxx xx o legislativní xxxxxxxxx xxxxxxx xxxxxxxxx x xxxxxxxxxxxxx xxxxxx xxxxxxxxxxxxx léčivých xxxxxxxxx xxx xxxxxxx xxxxxxxx x České xxxxxxxxx x přijímání příslušných xxxxxxxx xxxxxxxxxxx xxxxx xxxxxxxx přípravků xxxx xxxxx Xxxxx xxxxxxxxx. Xxxxxxxxxx xxxxxx sice xxxxxxxxx xxxxxxxxx Státního xxxxxx xxx xxxxxxxx xxxxx x Ministerstva xxxxxxxxxxxxx x k xxxx jim xxxxxxx xxxxxxxxx pravomoci, xxxxx x kontextu těmto xxxxxxx již xxxxxxxx x xxxxxxxxxxx pravomocím xx nejedná x xxxxxx xxxxxxxx xxxxxxxxx, xxxxx by xxxxxxxxxxxxx xxxxxxxxxx korupční xxxxxx.
XXXXXXXX ČÁST
K §1 xxxx. 1 (xxxxxxxx xxxxxxxx xxx xxxxx)
Xx xxxxxxxx xxx xxxxx x. 2 se xxxxxxxx odkaz xx Xxxxxxxx Evropského xxxxxxxxxx x Rady (XX) č. 536/2014 xx xxx 16. xxxxx 2014 x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx léčivých přípravků x o xxxxxxx xxxxxxxx 2001/20/XX a Xxxxxxxx Xxxxxx v xxxxxxxxx pravomoci (EU) č. 1252/2014 xx dne 28. května 2014 xxxxxxxxxx xxxxxxxx Evropského xxxxxxxxxx x Xxxx 2001/83/XX, pokud jde x zásady a xxxxxx xxxxxxx xxxxxxx xxxxx xxx účinné xxxxx xxx xxxxxxx xxxxxx přípravky.
K §5 xxxx. 16:
Xxxxxxxx xxxxxxxx 16 xx §5 xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxx léčivé xxxxx xxxxxxx xxxx xxxxxxx xxxxxxxx je xxxxxxxxxx xxx, xx x xxxxxxxxx právní xxxxxx xxxxxx xxxxxxxx chybí, xxx xxxxxxx xxxxxxxxx xxxx, kdy xxxx xxxxxx, xx xx xxxxx xxxxxxx xxxxxx x xxxxxx xxxxxx xxxxxxx. Xxxxx xxxx xxxxxxxx napravuje xxxxxxxxxxxxx xxxxxxxxxxx xxxxxxxx 2001/83/ES (xx. 46x). K xxxxxxxx definice bylo xxxxxxx nařízení Xxxxxx x xxxxxxxxx pravomoci (XX) č. 1252/2014 xx xxx 28. xxxxxx 2014 xxxxxxxxxx směrnici Xxxxxxxxxx parlamentu x Xxxx 2001/83/XX, pokud xxx x xxxxxx x pokyny xxxxxxx xxxxxxx xxxxx xxx xxxxxx látky xxx xxxxxxx xxxxxx přípravky. Xxxxxxxx x něm xx xxxxxxxxxxx xxxxx xxxxx xxxxx xxxxx xxx xxxxxx xxxxx xxx humánní xxxxxx xxxxxxxxx, x tudíž xxxxxxxx xxxxxxx x xxxxxxxxxxx odstavci 16 xxxx xxx x xxxxxx xxxxxxx xxxxxxxxx xxxxxx xxxxx x xxxxxxxxx xx x xx veterinární xxxxxx xxxxxxxxx x xxxxxxxxx xxxxxx xxxxxxxxx.
X §11 xxxx. g):
Zrušuje xx xxxxxxxxxx o xxxxxx xxxxxx xxxxxx x xxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxxxx xxxxxxxxx hodnocením, xxxxx x takovým xxxxxxxxxx xxxxxxxx č. 536/2014 xxxxxxxxx. Xxxxxx etických xxxxxx je xx xxxxxxxxxxxx xxxxxxxxx xxxxxxx, xxxxxxxxxx pro xxxxxxxx xxxxxx vyplývající z xxxxxxxx xxxx mimo xxxx zajištění xxxxxxxxxxxx xx zadavateli, xxxxxxxxxxx, xxxxx klinického hodnocení, xxxxxxxxxx xxxxxxxxxxxx. Xxxxxxxx xxxxxx xxxxxxxx xxxxxx x České xxxxxxxxx, xxx jejich zřizovateli xxxx poskytovatelé zdravotních xxxxxx, xxxxx jsou xxx i xxxxx xxxxxxxxxx xxxxxxxxx, xxxxxxx xxxxxxxxxxx jsou xxxxxxxxxx, xxxxx xxxx xxxxxx x xxxxx příslušné xxxxxx xxxxxx, je xxxxx v xxxxxxx x xxxxxxxxx xxxxxxxx. Xxxxxxxxxx právní xxxxxx xxxxxxxxx ustavit xxxxxxx xxxxxx xxxx xxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx, x xx x x xxxxxx, xx v xxxxxxx s xxxxxxxxx č. 536/2014 xxxx xxxxxx xx xxxxxxxxx xxxxxxxxxx xxxxxxxxx, významných xxxx x xxxxx xxxxx xxxxxxx x dohledem xxx xxxxxxxxx xxxxxxxxxx xxxxx xxxxx xxx Xxxxxx xxxxx xxx xxxxxxxx léčiv xx xxxxx xxxxxxx xxxxxx, x x xxxx xxxxxx xxxx xxxxxxx xxxxxxx xxxxxx xxxxxx x xxxxxx xxxxx. Xxxx xxx xxxxxxxxx xxxxxxxx požadavek xxxxxxx x čl. 86 xxxxxxxx x. 536/2014 x xxxxxxxxx xxx, že xx xxxxxx xxxxxxx xxx nařízení xxx xxxxxxxx xxxxx xxxxx xxxxxxxx xx členský xxxx.
Xxxxxxx xx xxxxxx xxxxx xxxx xxxxxxxxxx xxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx x xxxxxx opatření xxxxxx xxxxxx omezujícího xxxx zakazujícího xxxxxxxxxx xxxxxxxx přípravku do xxxxxxxxx. Xxxxxxxx může xxx xxxxxx xxxxx x xxxxxxxxxxxx případech. Xxxxxxxx xxxxxx xxxxxxxx xxxxxx xxxxxx k xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxxx xxxxxxxxx x xxxxx xxxxxxxxxx §77x.
X §11 písm. h:
Stávající xxxxxxxxxx §11 xxxx. x) se xxxxxxxx xxx, xxx xx xxxxxxxxxxx xxxxxxxxx s xxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxx x) xxxx x) x xxxxxx xxx bude pokrývat xxx xx xxxxxxx, xxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxx xxxxxxxxxx xxxxx xxxxxx specifických xxxxxxxxxx.
X §11 písm. x):
Xx xxxxxx xxxxxxxxx xxxxxxxxxxxxxxxx x xxxxxxxxxxxxxxxx postupu xxx xxxxxxx xxxxxxxxx xx do §11 xxxxxx x xxxxxxxx xxxxxxxx xxxxxxx x), xx kterém xx xxxxxxxx xxxxxxxx Xxxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx (formou xxxxxxxx xxxxxx xxxxxx), při xxxxxxx xxxxxxxxxx xx xxxx v České xxxxxxxxx by mohlo xxxxxxxxx nebezpečí xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxxxxxx xxxxxxxxxxx služeb x Xxxxx xxxxxxxxx.
X §13 xxxx. 2 xxxx. a) xxx 1:
Xxxxxxxxx Státního xxxxxx xxx xxxxxxxx léčiv xx xxxxxxxxx o xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxxx.
X §13 odst. 2 xxxx. x) xxx 3:
Xxxxxxxx xx, xxx xxxxxxxxxxx, xxxxxxx xx xxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx praxí, xxx xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxx klinické xxxxx, mohly xxx xxxxx xxxxxxxxxxxxx xxxxxxxx x dalším xxxxxx, x xx xxxxxxxxx xxxxxxxxxxx. Xxx xxxxxxxxxx xxxxxxxx xxxxxxxx je xxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxx xxxxxxxxxxxx x oblasti legislativy x xxxxxxx klinické xxxxx, kterou xxxx x xxxxxxx klinického xxxxxxxxx xxxxxxx xxxxxxxxx. Xxxxxxxx xxxxxxxxx praxí xx xxxxxx xxxxxx xxxxxxxxxx etických x xxxxxxxxx xxxxxxxxx xx xxxxxxx při xxxxxxxxxx, xxxxxxxxx, xxxxxxxxxx, sledování, xxxxxx, zaznamenávání a xxxxxxx xxxxxxxxxx hodnocení x při xxxxxxxxxxx xxxxx x xxxx, xxx xx zajistilo, xx xxxx xxxxxxxx xxxxx, xxxxxxxxxx x xxxxxxx života subjektů xxxxxxxxx a xx xxxxx xxxxxxx x xxxxxxxxx xxxxxxxxx xxxx xxxxxxxxxx x xxxxxxxx. Xxxxxxxx správné xxxxxxxx xxxxx jsou xxxxxxxxxxx xxxxxxxxxx xxxxxxxx (xxxxxxxx xx dokument ICH X6 Xxxxxxxxxxx konference xxx xxxxxxxxxxx technických xxxxxxxxx na xxxxxxxxxx xxxxxxxxx xxxxx - xxxxxxxxx Xxxxxxxxxxxxx Xxxxxxxxxx xx XxxxxxxxxxxxxxxXxxxxxxxxXxxxxxxxxxxxxxxXxxxxxxxxxxxxxXxxxxxxxxxxxxxxxxxXxxxx Use-zkr. XXX, xxx xxxx xxxxxxxx regulačních xxxxxxx x xxxxxxxxxxxxxxx xxxxxxxx Xxxxxx, Japonska x XXX). Tento xxxxxxxx xxxxxxx Xxxxxxxxxxx konferencí xxx xxxxxxxxxxx technických xxxxxxxxx xx registraci xxxxxxxxx xxxxx 1.5.1996, xxxx stanoví xxxxxxxx xxxxxxx xxxxxxxx xxxxx, x našem právním xxxx jsou xxxxxxxxxx x xxxxxxxxx x xxxxxxxxxx právním xxxxxxxx.
X §13 xxxx. 2 xxxx. x):
Xxxxxxxx se xxxxxxxxx kompetence Státního xxxxxx xxx xxxxxxxx xxxxx x ohledem xx xxxxx xxxx xxxxxxxxx. Xxxxxxxxx xxxxxx xxxxxxxxx xxx xxxxxxxxxx, xxx ohlašovací režim xxx xxxxxxxx xxxxxxx x xxxxxxxx hodnocení. Xxx xxxxxxxx xx xxxx xxxxxx již xxx o xxxxxx xxxxxxxxxx.
X §13 odst. 2 xxxx. x):
Xx xxxxxxx xxxx xxxxxxxx xxxxxxxxxx Xxxxxx bude xxxxx xxxxxx xx xxxxxxx x xxxxxxx, xxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxx nebo xxxxxx, xxxxxxxx na xxxx. Xxxxxxxx xxxxxxxx Xxxxxx xxxx xxxxxxxx podporovat xxxxxxxxx dostupnosti xxxxxx xxxxxx xx xxxx x České xxxxxxxxx. Xxxxxxxxxx xxxxxxxx nebudou xxxxxxxx zdlouhavým xxxxxxxx xxxxxxxxx xxxxxx, který xxx xx xxxxxxxxxxx xxxxxxxxxxxxxxx zátěž, xxxxxxxxxx xxxxxxx a xxxxxxx xx xxxxxxxxxxx, neboť xxxxxx x xxxxx xxxxx závady v xxxxxxx není xxxxx xxxxxxxxxx xx xxxxxxxx xxxxxxxxxx. Rozhodování Xxxxxx xxx xxxxxx xxxxxxxxxx xx systematicky xxxxxxxx xx ustanovení §23 xxxx. 2, xxx xxxxxxxxxxxx xxxxx xxxxxxxx x xxxxxx se xxxxxxx x xxxxxxx, xxxxx xxxxxxxxxx Xxxxx xxx §13 xxxx. 2 xxxx. x) xxxxx.
X §13 odst. 3 xxxx. x) x x):
Xxxxxxxx xx xxxxxxxxx Xxxxxxxx ústavu xxx xxxxxxxx léčiv xx xxxxxxx xxxxxxx xxxxxxx na xxxx x xxxxxxxx xxxxxxxxx xxxxxxxxxxx pro Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxx §77x.
X §16 xxxx. 2 písm. x) xxx 1:
Xxxxxxxxx Ústavu xxx xxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxx x xxxxx xx rozšiřuje x xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxxx.
X §19x:
X xxxx xxxxxxxxx §19x xx xxxxxxxxx právní xxxxxx xxxxxxxxxx Státního xxxxxx xxx xxxxxxxx xxxxx x Xxxxxxxxxx xxxxxxxxxxxx xxx a xxxxxx xxxxxxxxx xxxx xxxxxx xxxxxx tak, aby xxxx být xxxxxxx xxxxxxx xxxxx směrnice Xxxxxxxxxx xxxxxxxxxx x Xxxx 2011/62/EU. Jejich xxxxxxxxxx se vztahuje xxx xx xxxxxxx xxxxxx, xxx x xx xxxxxxx xxxxxxxxxx xx xxxxxxxxx, x xx rovněž xx xxxxxx monitorování takových xxxxxxx xxxxxxxxxx xx xxxxxxx xxxx xxxx. xx xxxxxx xxxxxxxxx xxxxxxxxx. Xxxxxxx xx xx vždy x xxxxxxxxxx xxxxxxxxx xx xxx, x xxxxxxx x xxxxxx xxxxxxxxxxxx. Xxx vložení xxxxxx xxxxxxxxxx xxx maximálně xxxxxx již xxxxxx xxxxxx xxx, a xxxxx xxxxxxxxxx x Xxxxxxxxxx xxxxxxxxxxxx xxx xxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx, xxxx xx xxxx x xxxxxx č. 226/2013 Sb., o xxxxxxx xxxxx x xxxxxxxxxxx xxxxxxx na xxx. Xxxxxxx xx xxxxxxxx stanoví xxxxxxx x povinnosti xxxxxxxxxxxx xxxxxxxxx x daňovém xxxx xxx, xxx Xxxxxx xxxxx pro xxxxxxxx léčiv xxxx xx Xxxxxxxxxxx ředitelství xxx xxxxxx xxxxxxxx xxxxxxxxx.
X §21(Xxxxxxxx XXXX, xx. 49 xxxxxxxx):
X §21 se xxxxxxxx xxxxxxxx 1 x xxxx důvodu, že xxxxxxxxxxxx, kdo se xxxx xxxx xxxxxxxxxxx, xx xxxxxxxxx řeší x §54 xxxx. 1 x xx x xxxxxxxxxx xx xxxxxxxxx xxxxxxxxx xxxxxxxxx.
X §33 xxxx. 2:
Xx xxxxxx xxxxxxxxx xxxxxxxxxxxxx potřebných xxx xxxxxxx dostupnosti xxxxxxxx xxxxxxxxx xx xxxx x XX xx nutné xxxxxxxx, xxx Xxxxxx xxxxx xxx kontrolu xxxxx xxxx xxxxxxxx s xxxxxxxxxx a xxxxxxxxx xxxxx umožňujícími získat xxxxxxx xxxxxxx o xxxxxxxxx xxxxxxxx xxxxxxxxxxx x xxxxxx objemu xx trhu x Xxxxx republice.
Získané informace xx držitelů xxxxxxxxxx x xxxxxxxxxx xxxxx xxxxxxx k xxxxxxxxxx xxxxxxxxxxx dostupnosti jednotlivých xxxxxxxx přípravků a xxxxxxxx xxxxxxxxxxxx podkladů xxx xxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx Xxxxxxxxxxxxx zdravotnictví xxxxx §11 xxxx. q) x xxxxx xxxxxxxxx xxxxxxxx Xxxxxxxxxxxx zdravotnictví xxxxx §11 xxxx. x). Xxxxxxxxxx xxxxxxxxxx xxxx Státnímu xxxxxx xxx kontrolu xxxxx xxx mají xxxxxxx x xxxxxxxx stanoveny xxxxx xxxxxxxxx distribučního xxxxxxx (distributoři xxxxxxxx xxxxxxxxx x provozovatelé xxxxxxxxx x výdeji xxxxxxxx xxxxxxxxx). Xxxxxx xxx nejsou xxxxxxx xxxxx dostatečné x xxxx, xxx xxxx xxxxx účinně x xxxx zasáhnout xxxxx xxxxxxxxx distribuci xxxxxxxxxxx xxxxxxxx xxxxxxxxx x Xxxxx xxxxxxxxx. Xxxxxxxx xxxxxxxxxx držitelů xxxxxxxxxx x xxxxxxxxxx xxxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx léčiv xxxxx x xxxxxxx údaje x objemu xxxxxxxx xxxxxxxxx xxxxxxxxxx xx xxx xxxxxxx xxxxxxx xxxxx x xxxxxx x xxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxxx. Xxxxxxxx komplexnějších údajů xxxxxx xxxxxxxxxx xxxxx xxxx možné přesněji xxxxx rozsah xxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx a také xxxxxxxx xxxxxxxx xxxxxxxx, xxxxx xxxxxx xxxxxxxxxxxxx xxxxxx léčivých xxxxxxxxx xxx xxxxxxxx v Xxxxx xxxxxxxxx. X xxxxxxxx xxxxxxxxx právní xxxxxxx x účinnější xxxxxxxxxxxxxx xxxxxxx xxx xxxxxxxx xxxx zákonné xxxxxxxxxx xx xxxxxxxxx, xxx xxx xxxxxx xxxxx, xxxxxx interval x xxxxxx jejich xxxxxxxxxxx formou xxxxxxx xxxxxxxx prováděcím právním xxxxxxxxx. Navrženou právní xxxxxxx je xxxxxxx xxxxxxxx xxxxxxxxx xxx XXXXXX týkající se xxxxxxx xxxxxxxx xxxxxxxxx x xxxx údaje xxxxxxxx xx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxx regulační xxxxxxx xxxxxx, xx. xxx xxx ÚSKVBL, tak x xxx SÚKL. Xxxx xx xxxxx xxxxxxxx xxxxxxx xxxxx xxxxxxx xxxxxxx xx xxxx i nad xxxxx xxxx pravidelně xxxxxxxxxxxxx.
Xxxxxxxxxxxx xxxxxxx xx xxxxx s ohledem xx veliké objemy x xxxxxxx xxxxxxxxx xxx, xxxxxxxx to xxxxxx efektivní xxxxxxxxxx x tím dává xxxxxxx efektivně x xxxx reagovat xx xxxxx xxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx na xxxx. Xxxxx by xxxx xx Xxxxx xxxxxxxxxx v xxxx, xxxx. v xxxxxxx xxxxxxxx, musel xx xx Xxxxx xxxxxx xxxxxxxxx xx jednotné xxxxxx, xxx je xxx xxxx xxxxx xxxxxxxxx, xxxxxxxxxx a xxxxxx xxxxx. X xxxxxxx na xxxxxxx xxxx, kterou má Xxxxx xx zpracování xxxxxxx o xxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxx xxxxxxx x xxxxxx xxxxxxxx xxxxxx xxxxxx xx XX, xx xxxx xxxxx, než xxxxxxxxxxxx xxxxxx použitelná. Xxxxxx xx xxxxx xxxx x xxxxx, že xxxxxxx jsou povinně xxxxxxxx xxxxxxxx x xxxxxxxxxx x xxxxxxxxx, xxxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx, SW a xxxxxxxxxxxxx formu xxx, xxxxx xxx jako xxxxxx při jejich xxxxxx poskytuje xxxxxxx xxxxxxxxxx a xxxxxxxxxx xxxxxxx x xxxxxxxxxxx xxx včasné x xxxxx xxxxxx povinností xxx xxxxxxxxx jinými xxxxxxxxxxxx zákona x xxxxxxxx.
X §33 xxxx. 3 xxxx. a):
Jedná xx xxxxx x xxxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxx úpravy xxxx xxxxx xxxxxx obsahu, xxx je již xxx xxxxxxxxxx xxxxxxxx xxxxx držitel rozhodnutí x xxxxxxxxxx povinen xxxx xxxxxxxx x xxxxxxxxx xxxxxxxx xxxxxxxxx xx distribuce nebo xx xxxxxxx. Xxxxxxxx xxxx „xxxxxxxxxx xxxx xxxxxxx“ nahrazeny pojmem „xx xxx x Xxxxx xxxxxxxxx“.
X §34 xxxx. 2:
Xxxxx x xxxxxxxx v současném xxxxx xxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx po xxxxxxxxxxx xxxxxxxxxx. X ohledem xx xxxxxxxxxx, xx x prodloužení xxxxxxxxxx xxxxxxx xxxxxx v xxxxxx xxxxxxxxxxxxxxxx xxxxxxx, xx prakticky nemožné xxxxxxxx xxxxxx léčivého xxxxxxxxx x nutně xxx dochází x xxxxxxxx x xxxxxxxxx xx xxxxx xxx x tím xx xxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx pro xxxxx xxxxxxxx. Xxxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxx x xxxxxxx xxxx xxxxxxxxxx v xxxxxxxxxx §35 odst. 2 x xxxxxxx xxxxxxxxxx x §36 xxxx. 4.
Xxx o formální xxxxxxxxxxx úpravu, ke xxxxx xx xxxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxxxx materie xxxxxx.
X §51 xx 59:
Xxxxx x xxxxxxxxxxxx §51 xx 59 jsou xxxxxxx pro náležitou xxxxxxxx nařízení č. 536/2014 xx xxxxxx x xxxxxxxx, xxxxx představují xxxxx xxxxx úpravu xxxxxxxxxx xxxxxxxxx humánních xxxxxxxx xxxxxxxxx, xxxxx xxxxxxxx xx xxxxxxxx xxxxxx xxxxxxxxxx x xxxxxxxx č. 536/2014. X xxxxxx xxxxxxxxxxxx se xxxxxxxxx xxxxxxxxxx ta xxxxxxxxxx, xxxxx byla x zákoně x xxxxxxxx xxxxxxxxxxxx transpozičními xx xxxxxx xx xxxxxxxx 2001/20/ES x xxxxx xxxx xxxxxxx xxxxx x xxxxxxxx č. 536/2014 xxxx která xx xxxxxxxxx č. 536/2014 xxxxxxx, a xxxx xx x těchto xxxxxxxxxxxx upravují ty xxxxxx xxxxxx, xxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx, xxx xx xxxxxxx, xxxxx xxxxxxxx xxxxxxx xxxx x xxxxxx úpravě.
K §51:
V xxxxx ustanovení xx x xxxxxxxxxx xxxxxxxxx xx čl. 4 až 9, čl. 15 až 24 x čl. 83 xxxx. 1 xxxxxxxx x. 536/2014 xxxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx.
X odstavci 1 (Preambule (18), (19); Xxxxxxxx XX, čl. 7 xx 9; Xxxxxxxx XXX čl. 15 xx 24 xxxxxxxx) xx xxxxxxxx xxxxxxxx xxxxxxxxx Státního xxxxxx xxx kontrolu léčiv x xxxxxxx klinického xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx. Xx to xxxxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxx o xxxxxxxx významné xxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxxx dohledu xxx xxxxxxxx xxxxxxxxxx xxxxxxxxx (Xxxxxxxx XXXX, čl. 77, čl. 78). Veškeré úkony xxxxxxxxx x souvislosti x xxxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx (Kapitola XX xxxxxxxx č. 536/2014), xxxxxxx x xxxxxxxx významné xxxxx xxxxxxxxxx xxxxxxxxx (Xxxxxxxx XXX nařízení č. 536/2014) x xxxxxxxxx xxxxxxx (Kapitola XIII xxxxxxxx č. 536/2014) xx xxxxxxxx xx xxxxxxx xxxxx, za xxxxx Xxxxxx xxxxx xxx xxxxxxxx xxxxx vybírá xxxxxxx xxxxxxx. (Xxxxxxxx XXX, čl. 86 a 87)
X xxxxxxxx 2 (Xxxxxxxxx (69); Xxxxxxxx XX, čl. 83 = Xxxxxxx xxxxxxxxx místo) xx xxx xxxxxxx xxxxxxx xx čl. 83 xxxx. 1 xxxxxxxx x. 536/2014, xxxxx x xxxxxxxxx xxxxxxx xxxxxxxxxxx x xxxxx xxxxxxxx xxxxxx xxxxxxxxx xxxxx xxxxx jedno xxxxxxx xxxxxxxxx místo.
V xxxxxxxx 3 (Xxxxxxxx XX, čl. 5 xx 8 xxxxxxxx) xx xxxxxxxx, xxx xxxxxxxx xxxxxxxxx svěřenou xxxxxxxxx xxxxx xx Xxxxxx xxxxxxxxx. X důvodu xxxxxxxxxxxx xx x xxxxxxxxxxxx xxxxxxxxx xxxxxxxx 3 upravuje xxxxxxxxx x případě, xxxx xx Xxxxx republika xxxxxxxx xxxxxx xxxxxxxxxxx, xxxxxxxxx v xxxxxxx, xxxx xx Xxxxx xxxxxxxxx xxxxxxxx členským xxxxxx x xxxxxxxxx xxx xxxxxxxxx xxxxx XX xxxxxxxxx xxxxxx, xxxxxxxxxx xx xxxxx x xxxxxxxxx xxxxx. X odstavci 4 xx upravuje obecná xxxxxxxxx xxx xxxxxxxx xxxxxxxxxx xx členský xxxx.
X §52 (Xxxxxxxx X, čl. 34 xxxxxxxx):
X xxxxx ustanovení x xxxxxxxx 1 (Xxxxxxxx V, čl. 29 xxxx. 7 a 8 xxxxxxxx) se xxxxxxx xx ustanovení čl. 29 odst. 7 xxxxxxxx č. 536/2014, xxxxx xxxxxxxx členskému xxxxx, xxx xx xxxx xxxxxxx řádu xxxxxxxxx, aby kromě xxxxxxxxxxxxx souhlasu uděleného xxxxxxx xxxxxxxxxxx zástupcem xxxxxx x xxxxxx x klinickém xxxxxxxxx xxxxxxx i xxxxxxxxx, xxxxx xx xxxxxxx xxxxxxx si xxxxx x xxxxxxxx xxxxxxx xxxxxxx informace. X xxxxxxxx to xxxxxxx, xx bude xxxxxxxxx xxx xxxxxxxxx xxxxx xxxxxxx informovaného souhlasu xxxxxxx xxxxxxxxxxx xxxxxxxxx x xxxxxx xxxxxxxxx xxxxx, vyjadřující, xx xxxxxxx získaných xxxxxxxxx xx zkoušejícího a xxxxxxxxx x informacích xxx xxxxxxxx přizpůsobených xxxx nezletilého, vůli xxxxxxxxxxx zúčastnit xx xxxxxxxxxxx klinického xxxxxxxxx. X odstavcích 2 x 3 je xxxxxxxxxx xxxxxxx xxxx čl. 34 xxxxxxxx x. 536/2014, která xxxxxxxx xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxx xxxxxxx osobám, xxxxx jsou x xxxxxxx podřízenosti xxxx xxxxxxxx xxxxxxxxxx. X xxxxxxxxxx na xxxx xxxxxxxxxx xx xxxxxxx, xx xxxxxxxx hodnocení xxx provádět x xxxxxxxxx xxxxxx subjektů xxxxxxxxx xxx xxxxx, xxxxx xxxxxxxx xxxxxxx xxxxxxxxx důvody, xx xxxxxxx xxxxxxx xxx xxxxxxxx, xx účast x klinickém xxxxxxxxx xxxx xxx xxx xxxx xxxxxxxx xxxxxxxxx xxxxx léčebný xx xxxxxxxxxxx xxxxxx, xxxxx xxxxxxx nad xxxxxxxxxxxxx xxxxxx a zátěží. Xxx xx xxxxxxxx xxxxxxx xxxxxxxx xxxxxx xxxx xx xxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx (xxxx. xxxxxxxxxx hodnocení xxxxxxxxxxxxxxxxx nebo farmakokinetiky), xxxxx pro zúčastněné xxxxxxxx xxxxxxxxx nemají xxxxx přínos. Za xxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx se xxxxxx xxxxxxxx xxxxx xxxxxxxxxxx xx ve xxxxx, xxxxxxxxxxxxx detenci xxxx xx výkonu trestu xxxxxx xxxxxxx, xxxx xxxxx xxxxxxxxxx x xxxxxxxx ústavní xxxx (xxxx. v xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxx sociální xxxx, xxxxxxxx xxxxxxxxxxx xxxxxxx péči nahrazující xxxx rodičů, xx.) x rovněž xxxxx, xxxxxxx xxxxxxxxxxx xxxx xxxxxxx soudem (např. xxxxx, xxxxx nesmí xxxxxxxx xx xxxx xxxxxxxx). Xxxxxxxx x xxxx, že Xxxxx xxxxxxxxx xxxxxxxxxx důvod x xxxxxxxxxxxx těchto xxxx xxxxxx xxxxxxxxxx x xxxxxx xx xxxxxxxxx xxxxxxxxx, xxx xxxxxxxx chápe jejich xxxxxxxxx, stanovuje xxxxxxxxxx xxxxxxxx xxx jejich xxxxx v xxxxxxxxx xxxxxxxxx. Xxxxxxx xxxxxxxxxx xxxxxxxxxxxxx souhlasu xxx xxxxxxxx i xx xxxxxxx xxxxxxxxxx v xxxxxx o zdravotních xxxxxxxx.
X §53 (Xxxxxxxxx (18); Xxxxxxxx I, xx. 2 (11):
Úpravu xxxxxxxx a činnosti xxxxxx komise xxxxxxxx č. 536/2014 ponechává x xxxxxxxxxx xxxxxxxxx xxxxx. Xxxxx xxxx ustanovení xxxxxxx x xxxx, xxx xx, xx xx x současné xxxxxx xxxxxx osvědčilo, xxxx v xxxx xxxxxx xxxxxx xxx xxxxx xxxxxxxxxxx využito.
V xxxxxxxx 1 je xxxxxxxxx xxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx xxxxxxx etickou xxxxxx jako svůj xxxxx. Xxxxxx xxxxxxxxxx xxxxxx xxxxxx vychází x následujících xxxxxxxxx xxxxxxxxxxx xxxxxxxxx č. 536/2014: 1) Xx xxxxxxxxx xxxxxxxxxx xxxxxxxxx, významných xxxx xxxxxxxxxx xxxxxxxxx x další xxxxx xxxxxxx x dohledem xxx klinickým hodnocením xxxx pouze xxxxx xxxxxx pro Xxxxxx xxxxx pro xxxxxxxx xxxxx ve xxxxx xxxxxxx xxxxxx, x xxxx xxxxxx xxxxxx xxxxxx, xxx z xxxx platby byla xxxxxxx xxxx jiné xxxxxxx etické komise x xxxxxx členů x xxxx xxxxxxxxx xxxxxxxxxxx technické xxxxxx xxxxxx xxxxxx. 2) Xxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxx požadavek uvedený x čl. 9 xxxxxxxx x. 536/2014, xxxxx xxxxxxxx, aby osoby xxxxxxxxxx xxxxxx xxxxxx xxxxxxx xx zadavateli, xxxxx xxxxxxxxxx xxxxxxxxx, xxxxxxxxx xxxxxxxxxxxx a xxxxxxx financujících xxxxxxxx xxxxxxxxx x xxxxxx xxxxx xxxxxxxx xx xxxxxx xxxxx, xxxxx xx mohly xxxxxxxx xxxxxx nestrannost.
V xxxxxxxx 2 (Xxxxxxxx XX, čl. 4, 6 x 7, čl. 8 odst. 4 a Xxxxxxxx XXX xxxxxxxx) xx xxxxxxxxx působnost xxxxxx xxxxxx. Podle článku 4 xxxxxxxx x. 536/2014 xxxxxx xxxxxxx provádí xxxxxx komise x xxxxxxx s xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx, x xxxxx xxxxxx xxxxxx xxxxxxxx x xxxxxxxx 2 xx xxxxxxxxx xxxxxxxx xxxxx tohoto článku xxxxxxxx.
X odstavci 3 xx xxxxxxxxx Státnímu xxxxxx xxx xxxxxxxx xxxxx povinnost xxxxxxxx xxxxxxxx xxx xxxxxxx xxxxxx xxxxxx (xxxx xxx xxxx).
X xxxxxxxx 4 je stanoveno, xx xxxxxx xxxxxx xxxx ustanovena xx xxxxxxx Xxxxxxx xxxxxxx Xxxxxxx xxxxxxx xxx xxxxxxxx léčiv po xxxxxxxxxx souhlasu Ministerstva xxxxxxxxxxxxx. Jednací xxx, xxxxxxxxxx činnost etické xxxxxx, přijme sama xxxxxx xxxxxx xxx xxxxxxxxxxx xxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx.
X §53a
V xxxxxxxx 1 se xxxxxxx xxxxxxx etické xxxxxx x jednotlivých xxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxx xxxxxx. Xxxx se xxxxxxx xxxxxxxxx na xxxxxxx xxxxxxxxxxxx xxxxxx, xxxxx xxxxxxx z xxxxxxxxx xxxxxxx klinické xxxxx (XXX E6) x x Xxxxxxxxx xxxxxxxxx, xxx xxx xxxxxxxxx xxxx zásadní xxx xxxxxxxxx xxxxxxxxxx xxxxxxx, x xxxx x klinických hodnocení xxxxxxxxx léčivých přípravků xx účasti xxxxxxxx xxxxxxxx. Xxxxxxx xx x xxxxxxxx 1 xxxx xxxxxxx flexibilně xxxxxxxx xx xxxxxxxx xxxxxxx v xxxx xxxxxxx xxxxxxxxx xxxxxxx Xxxxxxx xxxxxx xxxxxx. Xxxxxxxxx xxxxx xxxx xxxxxxxxxxx xx xxxxxxxx xxx xxxxxxxx nařízení č. 536/2014, xxxxx xxxxxx x přechodným xxxxxxx x xxxxx 3 xxx. V prvním xxxx xxxxxxxxxxx xxxxxx xxxx xxxxxxxxx xxxxx, xxx předloží žádost x xxxxxxxx xxxxxxxxxx xxxxxxxxx dle xxxxxxxx č. 536/2014 xxxx xxx xxxxxxxx xxxxxx xxxxxxxxxxx. X následujících xxxx xxxxxx bude xxxxxxxxxxx xxxxxxx o povolení xxxxxxxxxx xxxxxxxxx xxx xxx x xxxxxxx x požadavky xxxxxxxx č. 536/2014, xxx běžící xxxxxxxx xxxxxxxxx xxxxxxxxx xx xxxxxxxx xxxx xxxxxxx účinnosti xxxxxxxx č. 536/2014 xxxxx plnit xxxxxxxxx stále xxx xxxxxxxx xxxxxx xxxxxx xxxxxx, xxxx. předkládání x schvalování významných xxxx xxxxxxxxxx hodnocení Xxxxxxx xxxxxxx pro xxxxxxxx xxxxx a xxxxxxxx xxxxxxxx, xxxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxxx. Xxxxx xxxx xxxxx xxxxxxxxx xxxxxxxxxx xxxxxxx etických komisí, xxx xxxxxxx xxx xxxxxxxxx nového xxxxxxx xxxxxxxxxx v xxxx xxxxxx zákona. V xxxxxxx 3 xxxxxx xxxxxxxxxxx xxxxxx xxxx xxxxxxx xxxxx xxxxx xxxxxx xxxxxx xxxxxx xxx Xxxxxxx ústavu xxx xxxxxxxx léčiv xxx xxxxxxxx xxxxxxx, xxxx xx xxxxxx, xx xxxxx skupin xxxxxx xxxxxx xx xxxxxxx (xxxxxxx xxx 3 skupiny) x xx xxxxx přechodného xxxxxx (za 3 xxxx xx xxxxxx xxxxxxxxx xxxxxxxx č. 536/2014) xxxxxx xxx stejný. Xxxxxxxxx potřebu xxxxxx xxxxx xxxxxx v xxxx xxxxxxx vycházející xxxxxx x xxxxx xxxxxxxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxxx hodnocení x Xxxxx republice (xxxx-xx xxxxxx xxxxx xxxxxxxxxx xxxxxxxxx xx xxxxx nebo naopak xxxxx než v xxxxxxxx době). Xxxxxx xxxxxx xxxxxx xxxx xxxxxxxxx i počet xxxxx etické komise, xxxxx bude na xxxxxxx xxxxxxxx xxx xx 12-15 členů x xxxxx xxxxxxx, xxx xxxxx xxxx xxxxxx, že xx xxxx xxxxxx počet xxxxxxx xx xxxxxx.
X xxxxxxxx 2se xxxxxxx, xx xxxxx etické xxxxxx xxxxxxx x xxxxxxxx ministr xxxxxxxxxxxxx. Xxxxxxxxxx xxxxxx xxxxxxxx xx zaručuje xxxxxxxxxxx xxxxxxxxxxx xxxxxx komise xx Xxxxxxx xxxxxx xxx xxxxxxxx léčiv, xxxxx xxxx prostřednictvím xxxxx kmenových zaměstnanců xxxxxxxxxx pouze xxxx xxxxxxxxx-xxxxxxxxxxx xxxxxx x xxxxxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxx komise. Xxxxxxxxxxx Xxxxxxxx xxxxxx pro xxxxxxxx xxxxx xxxxxxxxxxx xxxxxxx xxxxxx xxxxxx xxxxxxx xxxxx xxxxxx xxxxxx, xxxxxxx xxxxxxxxx xx xxxxxxx xxxxxx xxxxxxxxxx xxxxxxx xxxxxx xxxxxx x xxxxxxx xx podílet xx xxxxxxxxxxx xxxxxx xxxxxx. Xxxxxx úkolem bude xxxxxxxxx schůzek, xxxxxx xxxxxx z xxxxxxx, xxxxxxxxx xxxxxxxxx stanovisek xxxxxx komise Xxxxxx, x hlavně xxxxxxx xxxxxxxxxx xxxxxxxxxxx lhůt. Xxxxxxxxx xxxxxxxxxxxx členů xxxxxx xxxxxx vychází xx xxxxxxxx xxxxx xxxxxxxxx orgánů Evropské xxxxxx xxxxxxxx (XXX), xxxxxxx jsou xxxx. Xxxxx pro moderní xxxxxxx (XXX), Výbor xxx xxxxxxx xxxxxx xxxxxxxxx (XXXX) xx., xxx xxxxxxx xxxxx xx xxxxxxxxxxx, xxxxxxxxx x xxxxxxxxxx xxxxxxx xx Xxxxxxxx xxxxxx xxxxxxxx, xxx xxxxxxx xxxxxxx a xxxxxxxxxxx xx nezávislé.
Dále xx x tomto odstavci xxxxxxxx základní požadavek xx xxxxxxx xxxxxxx xxxxxx komise a xxxxxx xxxxxx xxxxxxxx x xxxxxxxxxxxxx, jakožto xxxxxx nezávislé xxxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxx xxxxxx.
X odstavci 3 xx xxxxxxx požadavek xx xxxxx xxxxxx xxxxxx x xxxxxxx x požadavky čl. 9 xxxxxxxx x. 536/2014, xxx xxxx zajištěna xxxxxx xxxxxxxxxxx xx xxxxxxxxxx, xxxxxxxxxxxx x xxxxxxx xxxxxxxxxx xxxxxxxxx, xxxxxxx xx stanoven xxxxxxxxx xx xxxxxxxxxx x xxxxxxx xxxxxxxxxx xxxxxxxxx.
Xxxxxxxx 4 vychází x xxxxxxxxx xxxxxx xxxxxx, xxxxx nedoznává xxxxxxxx xxxxxxxxxxx xxxx, xxxxx odstranění xxxxxxxxxx xxxxxxxxx xx písemný xxxxxxx xxxxx xxxxxx xxxxxx s xxxx xxxxxxxxx x etické xxxxxx, x xxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx správné xxxxxxxx xxxxx, xxxxxxx xxxxxxxxxx xxxxxxxx č. 536/2014 xxxxxxxx.
Xxxxxxxx 5 pak xxxxxx xxxxxx xxxxxx komise xxxxxxxxxx xxxxxxxxxxx x xxxxxxxxxxx x xxxxxxxxxxxxx, xxxxx se xxxxx x souvislosti xx xxxx členstvím x xxxxxx xxxxxx.
Xxxxxxxx 6 xxx xxxxxxxxx tomu, xxx xxxxxx xxxxxx xxxxxx xxxx taková xxxxx, xxxxx xx xxxxxxxxx xxxxxxxxx spočívajícího x xxx, xx xxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx, xxxxxxxxxx x xxxxxxxx 5. Pokud xx xxxx xxxxxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxxx, xxxx xxxxxxxx x xxxxxx xxxxxx xxxxxxx xxxxx xx xxxxxx.
X §53b a §53x
Xxxx xxxxxxxxxx xxxxxxx xxxxxxxxx xx xxxxxxx xxxxxx xxxxxx, xxxxx xxxxxxxxx x nařízení č. 536/2014 a xxxxxxx xxxxxxxx xxxxx XXX X6. Obě xxxxxxxxxx xxxxxxx xx xxxxxxxxxxx, xx xx každé xxxxxxx o klinické xxxxxxxxx xxxx xxxxxxxxx xxxxxxxxxxx, xxxxx xxxx xxx dvě xxxxxxxxxx xxxxx –xxxxxxxxxxx, xxxxxxxx xx aspektů, na xxx se xxxxxxxx xxxx X xxxxxxxxx xxxxxx, xxxxx xx xxxxxxxx xxx všechny xxxxxxx XX (Protokol, Xxxxxxxxxxxx´xXxxxxxxx, farmaceutická xxxxxxxxxxx xx.), x xxxxxxxxxxx, xxxxxxxx se xxxxxxx, xx xxx xx xxxxxxxx xxxx XX xxxxxxxxx zprávy, xxxxx xx xxxxxxxxx a xxxxxxxx xx xxxx xx konkrétnímu XX (Xxxxxxxxx xxx pacienta, xxxxxxxxxxx xxxxxxx, xxxxxx xxxxxxxxxxxx, xxxxx xxxxxxxxxx xxxxxxxxx, xxxxxxxxx xxxxxxxxx xx.). Xxxxxxxxxxx, xxxxxxxx xx xxxxxxx, na xxx se vztahuje xxxx X nebo xxxx XX xxxxxxxxx xxxxxx xxxx xxxxx xxxxxxxxx xxxxxxxxxx a xx x x xxxxxxx xxxxxx, xxx. 2 xxx. Xxx xxxxxx část bude xxxxxxxxx vypracovat xxxxxxxxx xxxxxx (náležitosti xxxxx xxxxxxxxx xxx rozhodnutí Xxxxxxxx xxxxxx a Xxxxxxxx xxxxxx xxxxxxxx (XXX), xxxx xx xx nich pracuje x rámci xxxxxxxxxxxx xxx EMA). X xxxxx xxxxxxxxx xxxxxx xxxx xxxxxx xxxxx xxxxxxxxx jeho žádosti, xxxxx xxxx xxxxxxxxx xxxxxxxxxx, x xx xxxxxxxxxxxxxxx portálu. Závěrečné xxxxxxxxxx xx xxxxxxx xxxx bude vydáno xx xx xxxxxx xxxx xxxxxx xxxxxxxx xx xxxxxxx, xx xxx se xxxxxxxx xxxx X x xxxx XX xxxxxxxxx xxxxxx. Vše bude xxxxxx xxxxxx xxxxxxxxxxxxx, xxx. xxxxxxxxx zpráva x xxxxxxxxxx x xxxxxxxxxx, na jejich xxxxxx xx xxxx x xxxxx xxxxxxxxxxxx xxx Evropské xxxxxx xxxxxxxx xxxxxxx.
Xxxxxxxxxx §53x x odstavci 1 xxxxxxx xxxxxxxxxx xxxxxx xxxxxx x požadavky xxxxxxx xxxxxxxx xxxxx XXX X 6 x Xxxxxxxxx xxxxxxxxx xx zajištění xxxxxxx xxxx, xxxxxxxxxxx x xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx do xxxxxxx x xxxxxxxxx xxxxxxxx xxxxxxxxx. Xxxxxxx xxxxxxxx xxxxxxxxx respektovat x xxxxxxxxxxxx xxxxxxxxxxx stanovisko xxxxxx xxxxxx, xxx xx xxxxxxx v Xxxxxxxx II, článku 8 xxxx. 4 xxxxxxxx x. 536/2014.
Xxxxxxxxxx §53x x xxxxxxxx 2 xxxxxxx x xxxxxxxxx Xxxxxxxx XXXX xxxxxxxx č. 536/2014, xxxxxxx klinické xxxxx XXX X 6 a Xxxxxxxxx xxxxxxxxx, xxxxx vyžadují xxxxxx xxxxxx xxxxxx xxx xxxxx xxxxxxxxxx xxxxxxxxx, ke xxxxxx xxxx souhlas. Xxxxxx xx xxxxxxxx xx xxxxxxx xxxxxxxxx xxxxx x xxxxxxx klinického xxxxxxxxx v xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx nebo hlavním xxxxxxxxxxx, je-li určen (XXX X 6, xxxx 4.10.1: „Xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx xxxxx xxxxxx xx xxx XXX/XXX annually, xx more xxxxxxxxxxxxxxxxxxxxx xx xxx XXX/XXX.“, xxx IRB/IEC xx xxxxxx InstitutionalReviewBoard/Independent EthicsCommittee). Xxxxx xxxx x xxxxxxxxxx dohled xx Xxxxxxx ústavem pro xxxxxxxx xxxxx, neboť Xxxxx xxxx xxxxxxxxx xxxxxx nad xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxx klinické xxxxx, případně na xxxxxxx získaných informací xx zpráv x xxxxxxxxxxx přípravku, xxxxxxx xxxxxxxxxx změn xxxxxxxxxx xxxxxxxxx x x xxx xxxxxxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxx x xxxxxx xxxxxxxxx x xxxxxx xxxxxxxx xxxxxxxxx x daném xxxxxxxxx xxxxxxxxx, případně x xxxx úřední xxxxxxxx Xxxxxx (xxxxxxxxxx x xxxxx xxxxxxx ClinicalTrialsFacilitation Xxxxx (XXXX), XxxxxxxxxxxxXxxxxxxxXxxxxxxxx (XXX), Committeeformedicinalproductsforhuman xxx (XXXX) x jiných).
Ustanovení §53x v xxxxxxxx 3 vychází x xxxxxxxxx Xxxxxxxx XX článek 10, x xxxx článku 5 odst. 7 xxxxxxxx č. 536/2014 x xx správné xxxxxxxx xxxxx ICH X6, xxxxxx 3.2.6 (Xx IRB/IEC xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx xx specialareasforassistance.)
Ustanovení §53x x xxxxxxxx 4 xxxxxxxxx etické xxxxxx xxxxxxxxx xxxxxxxxx xxxx xxxxxxx x xxxxxxx x xxxxxxxxx xxxxxxxx č. 536/2014 x Xxxxxxxx xxxxx. (více xxx xxxx).
Xxxxxxxxxx §53b x xxxxxxxx 5 xxxxx, xx xxxxxxxxxx xxxxxxxx xxxxxx komise xxxxx xxxxxxxxx xxxxx xxxxxxxxxx xxxxxxx (ICH X6, xx. 3.2.2 The XXX/XXX shouldperformitsfunctionsaccording xx xxxxxxxxxxxxxxxxxxxxxxxxxx), xxx xx xxxx xxxxxxxx xxxxxxxx x harmonizovaný xxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxx. Xxxxxxxx xxxxxx xxxxxxx xxxx xxxx, xxx xxxxx skupiny xxxxxx xxxxxx nakládat x hlášením zadavatelů, xxxxxxx xxxx xxxxxxx xxxxxxxxxxx xxxxxx - Xxxxxxxx XXX, Xxxxxxxx XXXX čl. 53 xxxxxxxx, xxx je uvedeno, xx je xxxxxxxxx xxxx xxxxxxxxx „xxxxxxxx xxxxxxxx státům“, tzn. xxxxxxx xxxxxxxxxxxx xx xxxxxxxxx hodnocení x Xxxxx republice (Ústav x xxxxxx xxxxxx), xxxxx se xxxxxxx xxx x xxxxxx xxxxxxxxxxxxx; dále xxx xxxxx xxxxxxxxxxx Xxxxxxxxxxxx´xXxxxxxxx, x v xxxxxxxxxx xxxx xxx Xxxxxxxx XXXX, čl. 52 z xxxxxxx xxxxxxxx od xxxxxxxxx; xxxxx hlášení xxxx xxxxxxxx etická xxxxxx xx zkoušejících, xxxxx x xxxxxx x xxxxxxx klinického xxxxxxxxx x xxxx xxxxxxx závažných odchylek xx xxxxxxxxx (Xxxxxxxx XXX, čl. 53 xxxxxxxx). Xxxx xxxxxxxx xxxxxx xxxx x xxxxxxxxx xxxxxxxxxx xxxx etickou xxxxxx x Xxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxx xxxxxx. Xxxxxxxx postupy xxxxx xxxxxxxxxx xxxxxxxx pro xxxxxxxxxx činnosti xxxxxx xxxxxx xxxxxxxxxxx z xxxxxxxxx xxxxxxxx č. 536/2014, x xxxxxxxxx xxxxxxxxxxx xxxxxxxx.
Xxxxxxxxxx §53x v xxxxxxxx 1 x 2 xxxxxxx x xxxxxxxxx xxxxxxxx č. 536/2014 kapitoly XX xxxxxx 4 x xxxxxxxxx xxxxxxxx xxxxxxxx. Xxxx xxxxxxxx specifikují xxxxxxxx xxxxxx komise xx xxxxxxxxx xxxxxxxxxxx, xxxxxxxx xx xxxxxxx, xx xxx xx xxxxxxxx xxxx I xxxxxxxxx xxxxxx, jak xxx povolení žádosti x xxxxxxxx hodnocení, xxx xxx povolení xxxxxxx x xxxxxxxxx xxxxx xxxxxxxxxx hodnocení. Xxxxxx xxxxxxxxx vychází xx xxxxxxxx xxxxx; xxxxxx xxxxxx xxxx xxxxxxxxx (Xxxxxxxx XX, čl. 6 písm. x) xxx x + Příloha č. I, písm. D) xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx, xxxx xx xxxxxx zdůvodnění, proč xxxxxxxxx xxxx dané xxxxxxxx hodnocení xxxxxxxx (xxxx. nemají být xxxxxxxxx xxxxxxxx hodnocení, xxxxx xxxxxx vědecký xxxxxx, xxxx. xxxxxxx xxx xxxxx xxxxxxxxx, xxxx jsou obsolentní, xxx. sledovaná léčba xx xxx překonaná x xxxx xxxxx xx x xx xxxxxx) x xxxxxxxxxx xxxxxxxxxx xxxxxxxxx, xxxx xx xxxxxx xxxxxxxx xxxxxx (bude-li xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxx či xxxxxxxxxxxxx, s xxxxxxxxxxx xxxxxxxxx x xxxxxxx xxxx, xxxxx-xx xx x fázi X xx VI klinického xxxxxxxxx dle xxxxx xxxxxx léčivého xxxxxxxxx, xxxx-xx xxxxxxx placebo xxxx xxxxxxx xxxxxxxxxx, xxxxx-xx se o xxxxxxxx xxxxxxxxx xxxxxxx xx mezinárodní, xxxxxxxxx, xxxxxxxxx, duble-dummy xx.). Xx xxxxxxx xxxxx xxxxxxxxx informací pak xxxxxxx poměr přínosů x rizik xxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxx xxxxxx x xxxxxxxxx xxxxxxxxx.
Xxxxxxxxxx §53c x xxxxxxxx 3 xx 5 upravují zajištění xxxxxxxxx dokumentace, xxxxxxxx xx xxxxxxx, xx xxx xx vztahuje xxxx XX hodnotící xxxxxx pro xxxxx Xxxxx xxxxxxxxx. X xxxxxx xxxxxxxxxx se xxxxxxx xx současné xxxxx x ponechává xx i nadále xxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxx xx xxxxx xxxxxxxxx státu (xxxxxxxxx xxx pacienty, pojištění xxxxxxxxxx x xxxxxxxxxxxx, xxxxxxxxxxx xxxxxxxxxxxx, xxxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx, xxxxxxxxx xxxxxxxxx kompenzací x xxxxx x xxxx…) x působnosti xxxxxx xxxxxx.
Xxxxxxxxxx §53x x xxxxxxxx 6 xxxxxx odpovědnost xx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxx xxxxxx.
Xxxxxxxxxx§53x x xxxxxxxx 7 x 8 xxxxx xxxxx xxxxxxxx, x xxxxxx xxxxxxxxx xxxx xxxxxxx xxxxxx xxxxxx xxx xxxxxxxxx stanovisko x xxxxxxx xxxxx xxxx xxxxxxxxxxx. X xxxx vychází x xxxxxxxxx Xxxxxxxx XX článku 4 xxxxxxxx x. 536/2014, xxx xx xxxxxxxxx xxx xxxxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxxx lhůt pro xxxxxx přezkum. Xxxx xxxxxxxxxx xx xxxxxx x následujících xxxxx: 1. xxxxxxxx = xxxxxxxx xxxxx xxxxxxxxxxx xx formální stránce, 2. xxxxxxxxx - xxx xxxx I xxxxxxxxxxx (pro xxxxxx xxxxxx - Xxxxxxxx, Xxxxxxxxxxxx´xXxxxxxxx - posouzení x xxxxxxxxxxx xxxxxx xxxxxxxxx zprávy = xxxxxxxx přezkumu x xxxxxxx xxxxx. xxxxxxxxxx, 3. vypořádání připomínek xx. odpovědi xxxxxxxxxx, 4. kompilace xxxxxxx xxxxxxxxx xxxxxx x xxxxxxxxxx (xxxxxxxx/xxxxxxxx x xxxxxxxxx/xxxxxxxxx). To xxxx xxxxxxxxxx úkony, xx xxxxx xx xxx xxxxxxxxx č. 536/2014 timeline, xxx. xxx. čas xxx xxxxxx xxxxxxxxxx/xxxxxxxx. Xxxxx xxxxxx xxxx xxxxxx pro xxxxxxxxx xxxxxxxxxxx, týkající xx xxxxxxx, xx xxx xx vztahuje xxxx X xxxxxxxxx xxxxxx, xxx x xxxxxxxxxxx, xxxxxxxx se xxxxxxx, xx něž se xxxxxxxx část XX xxxxxxxxx xxxxxx klinického xxxxxxxxx. Xxx Xxxxxxxx XX čl. 4 xxxxxxxx x. 536/2014 je xxxxxx xxxxxxx xxxxxxxxx xxx xxx xxxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx, tak x xxx posouzení xxxxxxx x povolení xxxxxxxx xxxxx.
Xxxxxxxxxx §53c x xxxxxxxx 9 xxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx, xxxxx xxxx etická xxxxxx xxxxxxx Xxxxxx, xxxxxxxxx uchovávání xxxxxxx x xxxxxxxx xxxxxx xxxxxx po xxxx 5 let.
K závaznosti xxxxxxxxxx xxxxxx xxxxxx xx uvádí, xx xxx dikce nařízení, xxxxx xxxx xxxxxxxxxx XX xxxxxxxxx, xxx Xxxxx xxxxxx x xxxxxxxx xxxxxxxxx xxxxxxx. Xxxxxxxxx xxxxxxxxx nařízení xxxxxxxx, lze xx xxxx xxxxxxx. Xxxxxx xxxxxx sama x xxxx xxxxxx xxxxxxx xxxxx rozhodnutí. Xxxxxxxxxx x xxxxxxx x xxxxxxxx xxxxxxxxxx hodnocení xxxx povolení xxxxxxxx xxxxx xxxx xxxxxxx Xxxxx, a xx x režimu xxxxxxxxx xxxxxx. Xxxx xxxx xxxxx xx odvolat xxxxx rozhodnutí, xxxxx xx bude xxxxxxxx xx provedeném xxxxxxx xxxxxxxx etické xxxxxx, x xxxxx smyslu xx stanovisko etické xxxxxx xxxxxx odborného xxxxxxxx pro xxxxxxxxxx. Xxxxxxxx xxxxxx bude xxx možnost xxxxxx xxxxx závěrům xxxxxx xxxxxx prostřednictvím xxxxxxxx xxxxx xxxxxxxxxx Xxxxxx.
Xx xx xxxx xxxxxxxx xxxxxxxxxx xxxxxxx komisí xx xxxxxxx xxxxxxxx, x tímto počítá xxxxxxxx. Xxxxxx vydávání xxxxxxxxxx je přitom xxxxxxxxxxxxxx v xxxxxxxxxx §53x.
X §54 (Xxxxxxxx XXXX, xx. 49 x 50, Xxxxxxxx XX, xx. 73 xxxxxxxx):
Xxxxxxxxxx xx xxxxxx xxxxxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxxxx. Čl. 49 xxxxxxxx x. 536/2014 xxxxxxxxx xxxxxxx xxxx x xxxx, xxx xxxxx, xxx může xxx podle xxxx xxxxxxxxxxxxxx právních xxxxxxxx xxxxxxxxxxx xx xxxxxxx xxxxxxxxxxx. Podle navrhované xxxxxx xxxxxx xxxxxxxxxxx x hlavním xxxxxxxxxxx xxxx být xxxxx xxxxx xxxx xxxxx xxxxx xxxxxxxxx podmínky xxxxxxxxx xxxxxxx č. 95/2004 Sb., xx xxxxx xxxxxxxxxx xxxxxxxx, xxx xxxxx xxxxxx xxxxxxxxxxxxxx xxxxxxxx, xxxxx má xxxxxxxx xxxxxxx xxxxxxxx x xxxxxxxxxx x xxxx x xxxxxxxx x xxxxxxxxxxx xx stavy, xx xxxxxxx léčbu xx zaměřuje xxxx xxxxxxxx hodnocení x xx xxxxxxxx xxxxxxx xxxxxxxx xxxxx.
Xxxxxxxx 2 xxxxxxx z požadavku čl. 50 xxxxxxxx x. 536/2014 xx místa xxxxxxxxxx hodnocení. Xxxxx xxxxxxxxxx xxxxxxxxx mohou xxx xxx x xxxxxxxxxxxxx zdravotních služeb xx xxxxxxxxxxxxxx zařízeních, xx. takových xxxx, xxxxx xxxx xxxxx xxxxxx oprávněny x xxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxx zákona č. 372/2011 Sb., xx znění xxxxxxxxxx xxxxxxxx, a xxxxxx xxxxxxxx bude posuzována xxxxxxxxxx xxx každé xxxxxxxx xxxxxxxxx se xxxxxxxxxxx xxxxxxxxx na xxxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxxxx potřebné x xxxxxxxxx daného xxxxxxxxxx xxxxxxxxx.
Xxxxxxxx 3 x 4 xxxxxxxxx xxxxxxxxxxx či xxxxxxxxxxxx xxxxxxxxx xxx místa xxxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx xxxxx, vydaný Xxxxxxx. Xxxxxxx xxxxxxx xx xxxxxxxxxx znění xxxxxx x xxxxxxxx x xxxxxxxx praxe, x xxxxxxxx pro xxxxxxxx xxxxxxx x odstavci 3 xxxxxxxxx xxxxxx xxxxx xxxxxxxxxx, x xx z důvodu, xx xx xxxxx x xxxxx x xxxxxxxx xxxxxxxxx, která xxxxxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx (xxxxx xxxxxx xxxxxxx) xxxx xxxxxxxx xxxxxxxxx xxx xxxxxxxxx xxxx xxxxxxxxxxxxx xxxxxxx xxx xxxxxxxxxx xxxxxxxx xxxxxxxxx (xxxxxxxxxxxxxxx xx farmakokinetická xxxxxxxx xxxxxxxxx).
X §55 (Xxxxxxxxx (26); Kapitola XX, xx. 26 xxxxxxxx x. 536/2014):
X tomto xxxxxxxxxx xxx x xxxxxxxx čl. 26 a 69 nařízení č. 536/2014, xxxxx xxxxx xx měl členský xxxx xxxxx xxxxxxxx xxxxxxxxx na xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx a xxxx xx xxx xxxxx xxxxx xxxxxxxxx xxxxxxxxx x označení xx xxxxx. X §55 xx xxxxxxx x té xxxxxx, xx xx xxxxxxxxx x xxxxxxxxxxx klinického xxxxxxxxx, xx kterými xxxxxxxx do styku xxxxxxx xxxxxxxxx, xxxx xxx předloženy v xxxxxxx. Xxxx xxxx xxx xxxxxxxxx x xxxxxxxxx xxx xxxxxxxx, xxxxx pacienta, návod xxx užívání xxxxxxxx xxxxxxxx x xxxxx x xxxxxxxxx zdravotnického xxxxxxxxxx. Xxxxxxxxx na xxxxx xxxxx xxxxxxxxx xx xxxxxx x xxx dokumenty, x xxxxx xx x xxxxxxx xx xxxxxxx xxxxxxxxx daného xxxxx xxxxx xxxxx při xxxxxxx xxxxxxxx xx xxxxxxx xxxxxx x xxxxx xxxxxxxxxxxx, xxxxxxxxx xxxxxxxx smlouvy. Xxxxxxx xxxxxxxxx z xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xx xxxxxxxxxxx x xxxxxxx, xxxxxxxxxxx xxxx angličtině. Xxxxx jde o xxxxx xxxxxxxxx xxxxxxxxx x xxxxxxxx xx xxxxx xxxxxxxx přípravků xxx xxxxxxxx xxxxxxxxx, xxxxx se xxxxxx xxx, xx tímto xxxxxxx xx xxxxxxx, xxxx-xx x xxxxxxxxxx Xxxxxxxx xxxxxx pro xxxxxxxx léčiv x xxxxxxxx xxxxxxxxxx hodnocení xxxxxxx xxxxx. Xxxxxxx xxxxxxxx xxxxxxxxxxxxx obalu xxxxxxx xx skutečnosti, xx x případech xxxxxxxxxxxxx klinických xxxxxxxxx, xxxxx mají xxxxxxx xxxxx xxxxx počet xxxxxxxx (xxxxxx oblasti xxxxxxxx xxxxxxxxxx) by xxxx xxxxxxxxxxxx nárokem x zátěží pro xxxxxxxxxx, xxx x xxxxxxxxx, které xxxxxx xxxxx, zajišťoval xxxx xxxxxxxx xx xxxxx x xxxxxx jazyce. Xxxxxxxxxxxx xxxxxxxx xx xxxxx hodnoceného xxxxxxxx xxxxxxxxx xxxxxxxx xx xxxxxxxxx cyklu xxxxxxxx xxxxxxxxx a xxxxxx xx českých xxxxxxx xx v xxxxx xxxxxxx mohlo xxxx x xxxxxxxxx Xxxxx xxxxxxxxx x xxxxxxxxxx xxxxxxxxx, x xxxx xx xxxxxxxxxxxxxx české xxxxxxxx v přístupu x xxxxx vzácným xxxxxxx přípravkům. Bezpečnost xxxxxxxx hodnocení xxxx xxx xxxxxxxxx xxxxxxxxxx xx xxxxx xxxx xxxxxxxxx x xxxxx, xxxxx xxxx xxxxx x přípravkem x xxxxxxxxxxxx xxxxx distribuován xxxxxxxxxxx x xx xxxxx povinni se x ním xxxxxxxx, xxx xxxx xxxxxxx xxxxxxxx správné používání x xxxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxxxxx.
X §56 (Xxxxxxxx XXXX, xx. 59 xxxx. 3; Xxxxxxxx XX, xx. 61 xxxx. 5 xxxx. b), xx. 68; Kapitola XXXXX, xx. 90 x 92 xxxxxxxx x. 536/2014):
X tomto xxxxxxxxxx se xxxxxxxxx xxxxxxxx xx ustanovení čl. 59 odst. 3 xxxxxxxx x. 536/2014, xxxxx vyžaduje, xxx xxxxxxx xxxx zajistil, xx za xxxxxx xxxxxxx x xxxxxxxxx xxxxxxxxx budou moci xx xxxx území xxxxxxxx neregistrované pomocné xxxxxx xxxxxxxxx. X xxxxxxxx 2 xx xxxxxxx xxxxxxxxx xxxxxx xxxxxx, xxxxx xx xxxxxxxxx xxx, xx xx xxxxxxxx xxxxx xxxxxxx za stanovených xxxxxxxx použít v xxxxx klinického xxxxxxxxx x takové zdravotnické xxxxxxxxxx, xxxxx xxxxx xxxxxxxxx xxxxxxxxx stanovené xxxxxxx x xxxxxxxxxxxxxx xxxxxxxxxxxx. Xxxxx xxxxxxxxx xxxxxxx x xxxxxxxxxx xxxxx zajistit xxxxxxxx x xxxxxxxxxx xxx, xxxxxxxxx z xxxxxxxxxx xxxxxxxxx. Toto xx xxxxxxxxx xxxx. xxxxx xxxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxx xxxx zdravotnického xxxxxxxxxx xx xxxxx xxxxxxxxxxxx státech (xxxxxxx xxxxx XX i 3. xxxx) x xxx x ve xxxxx xxxxxxx klinického xxxxxxxxx. X klinických xxxxxxxxx, xxxxx jsou xxxxxxxx na sledování xxxxxx xxxxxxxx, jejíž xxxxxx xx xxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx, x xxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx xx xxxxxx xx třetí zemi (xxxx. USA) xx xxxxxxxx požadavkem xxxxxxxxxx, xxx xxxxxxx zúčastněné xxxxx xxxxxxxxx xxxxxxx, xxx xxxxxx zdravotnický xxxxxxxxxx xxx, aby xxxxxxxx měření xxxxxx xxxxxxxxx rozdílností jednotlivých xxxxxxxxxxxxxx xxxxxxxxxx. Xxxxxxxxx xxxxxxxx xxxxxxxxxxxxxx prostředku xx xxxxxxxxx příslušnou xxxxxxxxx země zadavatele x xxxxxxxxx nemá xxxxx xxxxx xxxxxxxxxxxx xxxxxxxxxx xx xxxxx Xxxxxxxx xxxx použít xxxxx než x xxxxx xxxxxxxxx xxxxxxxxx, x xx xxxxxxx x ohledem na xxxxxxxxxx, xx mnohdy xxx xxxx výrobcem xxxxxx zdravotnického xxxxxxxxxx. Xxxxxx pro xxxxx xxx xxx nehrozí, xxxxx xxxxxxxxxxxxx xxx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxx xxxxx xxxxxxxxxxxx xxxxxxxxxx vrácen xxxxxxxxxx, a xxxx xx xxxxxx vyskytovat x Xxxxx xxxxxxxxx.&xxxx; X xxxxxxx, že xx xxxx xxxxxx xxxxxx akceptována, xxxxx xxxxxxxxx Xxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx, xxxxxxxx xxxx xxxxxxxx xxxxxxxx xxx xxxxxxxxxxx xxxxxxxx x České xxxxxxxxx. (Xxxxxxxxx xxxx xxx xxxx. použití glukometru xxxxxxxxxxx x xxxxxxxxxxx xx 3. xxxx (XXX), který nebude xxxx klinické hodnocení x České republice xxxxxxxx. Xxxx xxxxxxxx xxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxx možnost xxxxx xxxxx xxxxxxxxx xxxxxxxxxx, který xx xxxxxxxx xxxxxxxxxx xxxx xxx xxxxxxxx x xxx české xxxxxxxx, x to x xxxxxx, že xxxxxxxxx xxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxxxx bude xx xxxx xxxxxxxx xxxxxx xxxxxxxxxxx x xxxxxxx x Xxxxx xxxxxxxxx, xxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxx dostupnost na xxxx x České xxxxxxxxx xxxx xxxxxxxxx xxxxxxxxxxx tohoto zdravotnického xxxxxxxxxx, xxx jeho xxxxxxx v xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxxxx xxx. Xxxxx xxxxxxxxx může xxx zdravotnický xxxxxxxxxx xxxxxxxx xxx xxxxxxxxxx xxxxxx, např. vzorek xxxx xxxxxxxxx xx xxxxxxxxx nádobky, xxxxx xxxxxxx jeho xxxxxxxx x potřebné xxxxxxx xx odběru vzorku, xx jeho xxxxxx xx xxxxxxxxxxxxxx xxxxxxxxxx x xxxxxxxxx. Xxxxxxx xxxxxxxx zdravotnického xxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxx léků po xxxxxx xxxxxxxxxx, xxx xxxxxx xxxxxx xxxxx xxxxxx pacientů x xxxxx xxxxxxxxx xxxxxxxxx x xxx i xxxxxxx xxxxx xxxxx xxxxxxxxxxxxxxx xxxxxxx xxxxxxxxxx).
X xxxxxxxx 2 xx xxxxxxxx nekomerční xxxxxxxxxx, xxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxxx zřízený xxxx xxxxxxxx státem xxxx xxxxxxx samosprávným xxxxxx, xxxxxxx xxxxxx xxxxx nebo xxxxxxx xxxxxxxx xxxxxxxxx, xxxx xx vytváří prostor xxx to, aby xxxxxxx xxxx byly x xxxxxxxxx xxxxxxx xxxxxxxxx xxxx xxxxxx xxxxxxxxx, jak x xxxx xxxxxxx xxxxx xxxxxx xxxxxxxxx xxxxxxxx.
X xxxxxxxxxx 3 xx 5 xx xxx x souladu x xxxxxxxx právními xxxxxxxx xxxxxxx, xxx xxxxxxxxx xxxxxxxxx spolu x xxxxxxxxxxx xxxxxxx x xxxxxxxx klinického hodnocení xxxxxxxx xxxxxxxx či xxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxx. Xxx o xxxxxxxxxxxx ustanovení čl. 92 xxxxxxxx x. 536/2014, xxxxx něhož xxxxx xxxxxxxxx není xxxxxxx xxxxxxxx xxxxxxxxx států xxxxxxxxxx svou xxxxxxxxx xxxxxxxx a xxxxxxxxxxx xxxxxxxxxxxxx x xxxxxxxxxxx xxxxxxxxx xxxx. X xxxxxxx xx xxxxxxxx xxxxx dané xxxxxxxxx, xxx jejich xxxxxxxxxx xx xxxxxx xxxxxxxxx xxxxx xxxx k xxxxxxxxxx xxxxxxx xxxxxxxx x klinickým hodnocením (xxxxxxxxx xxx xxxxxxxx xxxxxxxxx xxxxxxxx klinického xxxxxxxxx) xxxx v xxxxxx xxxxxxxx xxxxxxx xxxxx zajištění xxxxxxxxx xxxxxxxxxxx xxxxxx xx xxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx léčiv, xxx xx x xxxxxxxx xxxxxxxx vedlo x xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx xx xxxxx Xxxxx xxxxxxxxx.
X xxxxxxxx 6 xx x xxxxxxx x xxxxxxxxx nařízení č. 536/2014, preambule (11) xxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx klinického xxxxxxxxx x xxxxxxxxxxxxxxxxxx x xxxxxxxxxxx klinických xxxxxxxxx prováděných xxxxxxxxxxxx xxxxxxxxxx, xxxx xx xxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxx hodnocení x validita získaných xxx.
X §57 (Kapitola XXX, čl. 42 xxxxxxxx č. 536/2014):
Toto xxxxxxxxxx x xxxxxxx x čl. 42 xxxx. 3 xxxxxxxx x. 536/2014 xxxxxxxx, aby Xxxxxx ústav xxx xxxxxxxx xxxxx xxx xxxxxxx podmínek xxxxxxxxxxx x tomto xxxxxxxx xxxxxxx se xxxxxxxxxxx xxxxxx, xxxxx níž xxxx zadavatel podezření xx závažné xxxxxxxxxxx xxxxxxxxx xxxxxx hlásit xxxxx xxxxxxxx xxxxx Xxxxxx. X případě xxxxxxxx xxxxxx xxxxxx xxx xxxxxx xxxxxxxxx xx závažné xxxxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxx xxxxx xxxxxxxxxx Ústav. Xxxxxxxx č. 536/2014 přímo xxxxxxxxx xxxx xxxxxxxxx xxxxxxxxx xxxxx.
X §58 (Xxxxxxxx XII, xx. 76 nařízení č. 536/2014):
Xxxx xxxxxxxxxx xx xxxxxxxxxxxx článku 76 xxxx. 1 xxxxxxxx č. 536/2014, stanovující členským xxxxxx xxxxxxxxx xxxxxxxx, xxx byly xxxxxxxx xxxxxxx xxxxxxx xxxxxxxx xxxxx (újmy majetkové x xxxxxxxxxxx), xxxxxx xxxxxxx xxxxxxxxx xxxxx x xxxxxxxxxxx s xxxxxx x klinickém xxxxxxxxx xxxxxxxxxx xx xxxxxx území, x xx v podobě xxxxxxxxx, xxxxxx nebo xxxxxxx úpravy, xxxxx xx xxxxxxxxxx, pokud xxx o xxxx, x přiměřená xxxxxx x xxxx xxxxxx.
X xxxxx xxxxxxxxxx se xxxxxxxx stanoví, že xxxxxxx-xx xxxxxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx či xxxxxxxxx xxxx, x xx xxxxxxx xx xxxxxx xxxx xx zdraví, xx xxxxxxxxx xxxxxxx xx nahradit x xxxxxxx s xxxxxx xxxxxxxx předpisy, přičemž xx odkazuje xxxxxxxxx xx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxx.
Xxxxxxxx xxxx xxxx xxxxxxxx xxxxxx xxxxxxx xxxxxxxx xxxxx xxxxxxxx xxx xxxxxxxxxx xxxxxxxxxx. X xxxxxxxxx č. 81 xxxxxxxx x. 536/2014 se xxxxxx x nutnosti xxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxx, xx členské xxxxx x xxxxxx xxxxx xxxxxxx xxxxxxxxx xxxxxxxx. Xxxxxxx opatřením pro xxxxxxx výzkumu xxxxxxxxxxxx xxxxxxxxxx je xxxx xxxxxxxxxx ustanovení xxxxxxx x xxxxxxxx 3, xxxxx využívá xxx xxxxxxx xxxxxxxxxxx podmínek xxxxxxxxx stávajícího pojištění xxxxxx xxxxxxxx. Xxx xx zároveň vytvářejí xxxxxxxxxxx xxx xx, xxx xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxx xxxxxx diskriminováni x xxxx xxxxx xxxxxxxxx xxxx xxxxxxxx xxxxxxxxxx.
X §59 (Xxxxxxxx I, xx. 2 definice (20); Xxxxxxxx XI, xx. 74 xxxxxxxx x. 536/2014):
Xxxxxxxxxx se xxxxxxx jako xx xxxx x xxxxxx č. 268/2014 Sb., x xxxxxxxxxxxxxx xxxxxxxxxxxx a x xxxxx zákona č. 634/2004 Xx., x xxxxxxxxx xxxxxxxxxx, ve xxxxx xxxxxxxxxx xxxxxxxx, xxxxxxx xxxx moci xxxxxxxxx, xxxxx xxxxxx xxxxxxxxx xx formuláři xxxxxxxx xxxxxxx xxxx xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxx, xx xxxxxxxxx xxxxx. Jedná xx x ustanovení xxxxxxxxx x xxxxxxxxxx §30 xxxx. 5 xxxxxxxxx xxxx, xxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx subjektu xxxxxxxxxxx xx cizí xxxx. Xxxxxxxxxx xxxxxx xx xxxx xxxxxxxxxx xxxxxxxxxx xxxxxx zmocnění, xxx je vyjádřeno xxxxxxxxx xxxxxxxxx.
Xxxx xxxxxxxx, xxxxx xxxx sebou xxxxxxx xxxxxxx xxxxx, xx jehož xxxxxxx xxxx xxxxxxxxx xxxxx xxxxx vůči Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx, bude xxxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxxxx, kterým xxxxxx xxxx xxxxx xxxxx x povolení xxxxxxxxxx xxxxxxxxx, x xx xxxxx xxxxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx. Xxxxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx, xxxx xxxxxxxxx xxxxxxxx xxxxxxxxxx. Xxxxxxxxxx, xx xxxxxxxx do xxxxxx evropského xxxxxxx xxxxx xxxxxxxxxx některé xxxxxx Evropské xxxx, x xx xx xx řádné xxxxxxxxxxxx xxxxxxxx xxxx tento xxxxxx xxxxxx xxxxxxxxxxxx x xxxxxxxxx, že xxxxxxx zneužití xxxxxxxxxxxx xxxxxxxxx bude xxxxxxxxx.
Xxxxx, x xxxxx xxxx xxxxxxxxxx xxxxxxxxx xxxxxxx, xxxx nastaveny nařízením x xxxx xxxxxx xxxxxx a xxxxxxx xxxxxxxxx řízení xxx xxxxxxxx xx xxxx xxxxx 1x pro xxxxxxxx xxxxxxxxxxx a xx xx 5 xxxxxxxxxxxx xxx (x 1x xxx doplnění xx xxxxxxx odborných xxxxxxxxxx, x to xxxxx xx xxxx 12 kalendářních xxx). Xxxxxxxxxx xxxxxx xxxxxx xx xxxxx x xxxxxxx xx xxxxxxxxx xxxxxx xxxxxxx smluvního xxxxxxxx, xxx xxxx xxx jako xxxxxxx xx důkazem x xxxxxxxxx xxxxxxxxx zastoupení. Xxxxxxxx x tomu, xx xxxxxxxxxx mezi xxxxxxxxxxxx xxxxxxxx x xxxxxxxxxx xx bude xxxxxxxxxx pouze xxxxxxxxxxxxxxx xxxxxxxxxxxxx portálu, jeví xx navržený způsob xxxxxxxxx zmocnění jako xxxxxxxxxx x xxx xxxxxxxxxx formalismu.
K §60 xxxx. 3 xxxx. x), který xx xxxxxxxx.
Xxxx 1. ledna 2013 xxxxx xxxxxxxxx xxxxx č. 359/2012 Sb., kterým xx xxxx zákon xx xxxxxxx xxxxxx xxxxx týrání. Xxxxx xxxxxxxxxxx znění §15 xxxx. 3 xxxx. x) zákona xx xxxxxxx zvířat xxxxx xxxxxx xx xxxxxxxxxx xxxxxx xxxxxx, xxxxx xxxxxxxx ochranu pokusných xxxxxx, xxxxxxxxxx xx xxxxxxx, kdy xxxx xxxxxxx xxxxxxx xxxxxxx xxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxx xxxxxxxxxx veterinárního léčivého xxxxxxxxx. Od 1. xxxxx 2013 tedy xxxxx xxxxxxxxx xx xxxxxxxxxxx xxxxxxxx xxxxxx xxxxxx xxxxxxxxxx x xxxxxxxxx (souhlasu) xxxx xxxxxxxxxxx xxxxxxxx xxxxxx xx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxx xxxxxxxxxx veterinárního xxxxxxxx xxxxxxxxx.
X §62 xxxx. 1, §64 xxxx. x) a x) x §66 xxxx. 4:
Obsah xxxxxxxxxxx xxxxxxxxxx upravujících výrobu xxxxxxxx xxxxxxxxx, xxxxx xxxxxxxxx x xxxxxx xxxxxx výroby xxxxxxxxxxx xxxxxxxx xxxxxxxxx, xx xxxxx xx xxxxxxx x nařízením. Xxxxxxxx xxxxxxxx xxxxxx úpravu xxxx xxxxxxx x xx. 61.
X §70 xxxx. 1:
X textu xxxxxxxx 1 xx xxxxxxxx „xxxxx použitelné xxxxxxxx Evropské xxxx“, x xx proto, xx xxxx vydáno xxx xxxxxxxx nařízení Xxxxxx v přenesené xxxxxxxxx (XX) č. 1252/2014 xx dne 28. xxxxxx 2014 doplňující xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Rady 2001/83/ES, xxxxx jde x xxxxxx x pokyny xxxxxxx výrobní xxxxx xxx účinné xxxxx xxx xxxxxxx léčivé xxxxxxxxx, xxxxx xxxxxxxx xxxxxxxx výrobní xxxxx xxx xxxxxx xxxxx. Xxxx xxxxxxxx je xxxx xxxxx xxxxxxxxxx, xxxxxxx je xxxxxx, xxx bylo navázáno xx xxxxxxxxxxxx xxxxxx xxx, xxxxxxx x xxxxxxx xx xxxxxxxxxx xxxxxxxxx xxxxxx xx xxxx xxxxxxxx.
X §70 xxxx. 7:
Xxxxx nové xxxxxx v doplňovaném xxxxxxxx 7 xx, xxx u xxxxxxxx xxxxx xxxxxxxxxxxxx xx xxxxxxx xxxx, které xx používají při xxxxxxxx xxxxxxxx xxxxxxxxx, xxx xxxxxx jejich xxxxx, a aby xxxx vyrobeny v xxxxxxx xx správnou xxxxxxx xxxxx pro xxxxxx látky odpovídající xxxxxxx standardům xxxxxxxxxx Xxxxxx.
X §77 xxxx. 1 písm. x):
Xxxxx xxxxxxxxx xxxxxx xxxxxx xx xxxxxx x xxxxxx xxxxxxxxxxx xxxxx x xxxxxxxxxxxxxxx léčivých xxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxx Xxxxxxxx xxxxxx xxx kontrolu xxxxx. X hlediska xxxxxxxxx xxxxxx jistoty a xxxxxxxxx xxxxxxxxxxxxxx nápravy xxx xxxxxxxx xxxx xxxxxxx povinnosti je xxxxxxxxx, xxx xxx xxxxxx údajů, časový xxxxxxxx x xxxxxx xxxxxx xxxxxxxxxxx xxxxxx xxxxxxx stanoven xxxxxxxxxx xxxxxxx předpisem.
K §77 xxxx. 1 xxxx. x):
Xxxx je výslovně xxxxxxxxx xxxxxxxxx distributora xxxxxxxxxx x souladu x xxxxxxxxx obecné xxxxxx xxxxxxx podle §77x. Dále je x xxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxxx při xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxxxx požadovanou dodávku xxxxxxxxxxxxxx léčivého xxxxxxxxx xx 48 hodin xx obdržení xxxx xxxxxxxxx.
X §77 odst. 1 písm. x):
Xxxxxxx xx nová oznamovací xxxxxxxxx xxxxxxxxxxxx x xxxxxxxxx, xxx xxxxx xxxxxxxxxxxx xxxx xxxxx Xxxxx xxxxxxxxx xxxxxx xxxxxxxxx, xxxxx xx xxxxxx na xxxxxxx xxx §77x.&xxxx; Xx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxx být Xxxxxxxxxxxxx xxxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxx xxxxxx, xxxxxx xxxx včas xxxxxx xxxxxxxx xxx, že xxxxxxx x akutní xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxx xxxxxxxxxxx konkretizaci xxxxxxxxxx xx x xxxxxx xxxxxxxx uvedeno, xx xxxxxxxx o xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxx, xxxxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxxxx, název xxxxx xxxxxxxxxx a xxxxx xxxxxxxxx distribuce xxxxxxxx xxxxxxxxx. Xxxxxx xxxxx xxxxxxxxx x xxxxxxxx x způsob xxxxxx xxxxxxxxxxx xxxxxx xxxxxxxx přitom xxxxxxx xxxxxxxxx právní xxxxxxx.
Xxxxxxxxxxxx xxxxxxx je nutné x xxxxxxx xx xxxxxx objemy x xxxxxxx získaných xxx, xxxxxxxx to xxxxxx xxxxxxxxx xxxxxxxxxx x xxx dává možnost xxxxxxxxx a xxxx xxxxxxxx na xxxxx xxxxxxxxxx xxxxxx léčivého xxxxxxxxx xx xxxx. Xxxxx xx xxxx xx Xxxxx přicházela x xxxx, xxxx. x různých xxxxxxxx, xxxxx xx xx Xxxxx xxxxxx zpracovat xx xxxxxxxx podoby, xxx xx xxx xxxx možné xxxxxxxxx, xxxxxxxxxx x učinit xxxxx. S ohledem xx xxxxxxx xxxx, xxxxxx xx Xxxxx xx xxxxxxxxxx xxxxxxx x vývozu xxxxxxxx xxxxxxxxx a xxxxxxxx xxxxxxx podnětu x xxxxxx xxxxxxxx obecné xxxxxx xx XX, xx jiná forma, xxx xxxxxxxxxxxx xxxxxx xxxxxxxxxx. Xxxxxx je xxxxx xxxx x xxxxx, xx xxxxxxx xxxx xxxxxxx xxxxxxxx xxxxxxxx x xxxxxxxxxx x xxxxxxxxx, xxxxxxxxxxxx xxxxxx xxxxxxxxx počítače, XX x xxxxxxxxxxxxx xxxxx xxx, která xxx xxxx xxxxxx xxx jejich xxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxx x dokumentace pro xxxxxx x xxxxx xxxxxx xxxxxxxxxx jim xxxxxxxxx jinými xxxxxxxxxxxx xxxxxx x léčivech.
K §77x:
Xxxxx xxxxxx xxxxxxxxxx Xxxxx xxxxxxxx xxxxxxxxx xxxxxxx xx xxxx x léčivými xxxxxxxxx, x to xxxxxxx xx xxxxxx xxxx xxxxxxx objemu xxxxxxx xxxxxxxx xxxxxxxxx xx xxx x Xxxxx xxxxxxxxx podle §33 xxxx. 2 a xxxxxxx xxxxxxxx přípravků xxxxxxxxxxxx xx xxxxxxxxx xxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx. Xx xxxxxxx xxxx xxxxxxx pak Xxxxx sděluje Ministerstvu xxxxxxxxxxxxx xxxxxxxxx x xxxxxxx xx xxxx xxxxxxxxxxx x xxxxx xxxxxxxx xxxxxxxxx, xxx xxxxxxx xxxxxxxxxx xx xxxx x České xxxxxxxxx xx xxxxx xxxxxxxxx nebezpečí jejich xxxxxxxxxxxxx při xxxxxxxxxxx xxxxxxxxxxx služeb xxxxxxxxx x Xxxxx xxxxxxxxx.
Xx xxxxxxxxxxx sdělení xxxxxxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx Ústavem Xxxxxxxxxxxx zdravotnictví xxxx xxxxxx xxxxxxxx xxxxxxxxx (xxxxxx xxxxxxxxx jsou xx xxxxxx xxxxxxxxxx xxxxxx xxxxxxxx xxxxxx xxxxxx), xxx xxxxxxx xxxxxxxxxx xx trhu x Xxxxx xxxxxxxxx xx xxxxx xxxxxxxxx xxxxxxxxx xxxxxx nedostupnosti xxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx x Xxxxx xxxxxxxxx. Xxxxx xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx xx xxxxx xxxxxxxxxxxxx xxxxxxxxx. Seznam xx xxxxxxxx aktualizován x zveřejňován. Xx xxxxxx seznamu je xxxxxxxxx xxxxxx xxxxxxxxx, xxxxx xxxx xxxxxxxxxxxx xxxxxxx xxxxxxxxxx odpovídajících xxxxxxxxx xxxxxxxxxx, xxxxxxx xx xxx xxxxxxx xxxxxxxx x České xxxxxxxxx xxxxxxxx, x xxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxx přípravku xx xxxx ohrozit xxxxxxxxxx x xxxxxxxx xxxxx xxxxxxxx x Xxxxx xxxxxxxxx x xxxxxx xxxxxxx xx xxxxxxx xxxxxx obyvatelstva x xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx.
Xx xxxxxx xx s xxxxxxx xx xxxxxxxx, xx xxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xx mohl xxxxxxx dostupnost x xxxxxxxx léčby xxxxxxxx x Xxxxx republice x xxxxxx dopadem xx ochranu xxxxxx xxxxxxxxxxxx, xxxxx xxx xxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx, xxx xxxxxx xx xxxxxx terapeutické xxxxxxxx. Přímý dopad xx xxxxxxx xxxxxx xxxxxxxxxxxx může xxx x xxxxxxxxxx léčivého xxxxxxxxx xxxxxxxx k xxxxx jiné než xxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxx. Podmínkou xx, xxx léčivý xxxxxxxxx xxxxx v xxxx xxxx xxxxxxxxxxxx xxxxxxx xxxxxxxxxx odpovídajících xxxxxxxxx xxxxxxxxxx, xxxxxxx xx xxx potřeby pacientů x Xxxxx xxxxxxxxx xxxxxxxx.
Xxxxxxxx xxx xxxxxxxxx xxxxxxxxxx lze nalézt x xxxxxxx „xxxxxxxx xxxxxx“ x „xxxxxxxx xxxxxxx xxxxxxxxxx xxxxxx xxxxxxxx“ užitých x xxxxxxxxxx §77d xxxx. 2. Xxxxxxxx x xxxxxxx jazyce xxxxxxx x určitému datu, xxxxxxx s xxxxxxx xx zajištění účelu x xxxxxxxxxx x xxxxxxxx xxxxxxxxxx xxxxx xx xxxxxx, xx xxx xx v xxxxxxx jazyce myšleno x xxxx, xx xxxxxxx je hrozba xxxxxxxxxxxxx xxxxxxxxxxx. Zhoršení xxxxxxx xxxxxxxxxx xxxxxx xxxxxxxx přitom xxxxxxxxxxx xxxxxxx, že dostupnost xxxx xxxxxxxxx. Xxx xxxxxxxxx účelu x xxxxxx předkládané xxxxxxxx xx xxxxxx xxxxxxx, xx xxxxxxx reexportu xxxx muset xxx xxxxxxx ve xxxxxx, xxx xxxxx jsou xxxxxx xxxxxx xxxxxxxxx xx xxxx xxx, xxx xx xxxx xxxxx xxxxxx x xxxxxxxxx ČR.
Léčivé xxxxxxxxx xxxxx xx xxxxxxx, xxxxx se xxxx xxxxxxxx xxxxxxxxxxxx. Xxxxx xxxxxxx důvody xxx xxxx xxxxxxxx na xxxxxx, bude seznam xxxxxxxxxxxx x xxxx xxxxxxxxx x něj xxxx vyřazen. Xxx xxxxxxxx pokud bude xxxxxx přípravek kritéria xxxxxxxx, může být xx seznamu dlouhodobě, x xx proto, xx potřeba xxxxxxxx x XX xx xxxxxx dlouhodobá xx xxxxx xxxxxx, a xxxxx xx xxxxx xxxx xxxxxxxxxx xxxxx xxxxxxxx zajistit. Xxx xxxxxxxxxxx xxxxxxx xxxx xxxx xxxxx prokázat, xx xxxxxxxx xxx xx, aby xxxxxx xxxxxxxxx xxxx xx xxxxxxx zůstat, xxxx xxxxx xxxxxxxx. Xxxxxxxxx xx xxxx, že xxxxxxxx uvedení xxxxxxxx xxxxxxxxx xx xxxxxxx xxxx xxxxxxxxxxx znamenat xx, xx xxxx xxxxxx xx xxxxxxx xxxxx.
Xxxxxxxxxx xxxx xxxxx xxxxxx xxxxxxxxxxxxx xxx xxxxxxx xxxxxx xxxxxxxxx, xx xxxxxxxx xxx xxxxxxxx xxxx xx xxx xx xxxxxx xx xxxxxxxxxxx léčivému xxxxxxxxx a konkrétní xxxxxxx.
X §77x:
Xxxxxx xxxxx xxx xxxxxxxx xxxxx xx základě zákona x léčivech xxxxxxxxxxx xx držitelů xxxxxxxxxx x xxxxxxxxxx, xxxxxxxxxxxx x lékáren xxxxx x xxxxxxxxx, xxxx. xxxxxxxx xxxxxxxx léčivých xxxxxxxxx, z xxxxx xxx xxxxxx xxxxxxxxx x dostupnosti léčivých xxxxxxxxx xx trhu x Xxxxx xxxxxxxxx. Xxxx xxxxx, xxxxx xx xxxxx x xxxxxx xxxxxxxxx na xxxxxxx, pravidelně xxxxxxxxxxx xxx, xxx xxxx x xxxxxxx xxxxxxxx xxxxxxxxxxxx x xxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx xx xxxxxxxxx xxxxx xxxxx tohoto xxxxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxxx k xxxxxx xxxxxxxx podle ustanovení §77x. Podnět musí x xxxxxxxxxx xx xxxxxxxx xxx xxxxxx xxxxxxxx obecné povahy Xxxxxxxxxxxxx zdravotnictví xxx §77x obsahovat xxxxx xxxxxxxxxxx xxxxxxxxxxxxx xxxxx x odůvodnění veřejného xxxxx.
Xxxxxxxxxxxx xxxxxxxxxxxxx xx xxxxxxx §11 xxxx. x) xxxx xxxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxxxx léčivých xxxxxxxxx x případě, xx x) xx jedná x léčivý přípravek xxxxxxxx na xxxxxx xxxxxx xxxxx §77x, xxxxxxxxxx xx xxxxx x xxxx, že xxxxxxxx zásoba předmětného xxxxxxxx xxxxxxxxx xxx xxxxxxxxx potřebu xxxxxxxx x Xxxxx republice, xxx je xxxxxx xxxxxxx z údajů xxxxxxxxxxxxx xxxxxxx xx xxxxxxxx rozhodnutí o xxxxxxxxxx, distributorů x xxxxxxx x souladu x tímto zákonem x xxxxxx vyhodnocení, x x) veřejný xxxxx xx ochraně xxxxxx xxxxxxxxxxxx a xx xxxxxxxxx dostupnosti xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx převažuje xxx xxxxxxxxxxxxx xxxxxx xx uskutečnění jejich xxxxxxxxxx xx xxxxxxxxx.&xxxx; Xxxx xxxxxxxx xxxx xxx xxxxxxx kumulativně, xx. všechny xxxxxxx.
Xxxxxxxx xxxxxxxxx xxx vydání xxxxxxxx xxxxxx povahy xxx xxxxxx xxxxxxxxxx xx xxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxx xxx §77c xxxxxx x xxxxxxxx.
Xxxxx se xxxxx x vymezení xxxxxxxxxxxxx, xxxx xx xxxxxxxxx xx nejobjektivněji. Xxxxxxxx se xx xxxxxxx xxx, že xxxxxxxx zásoba xxxxxxxxxxx xxxxxxxx přípravku xxx xxxxxxxxx xxxxxxxxxx aktuální xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx. Xxxxxxxx xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx xx xxxxx transparentně vymezit, xxx xx důvodem xxx xx, aby xxxx xxxxxxx byly x každém konkrétním xxxxxxx řádně odůvodněny. X každého léčivého xxxxxxxxx xxxx xxx xxxxxxxxx s xxxxxxx xx frekvenci xxxxxxx xx xxxxxxx, xxxxxxxxx xxxxxxx xxxxxxxx a xxxx xxxxx x xxxxxxxxxxxx, xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxxx xx xxxxxxx x xxxxx balení xxxxxxxx xxxxxxx oprávněnými k xxxxxx, včetně xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxx xxxxx České xxxxxxxxx x xxxxxxxxxx xxxxxx.
Xxxxx xxxx. c) xxxx xxx xxxxxxx xxx podmínka xxxxxxxxx xxxxx xx ochraně xxxxxx xxxxxxxxxxxx a xx xxxxxxxxx dostupnosti xxxxxxxx xxxxxxxxx xxx xxxxxxxx xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx. X xxxxxxxxxx xxxxxxx xxxx být xxxxx xxxxxxxxxx, xx xxxxx xxxxxxxxxx xxxxxxx xxxxx xxxxxxxxx xxx individuálním xxxxxx xx xxxxxxxxxxx xxxxxxxxxx xx xxxxxxxxx.
Xx xx xxxx formy xxxxxxxx xxxxxx povahy, xxxxxx xxxxxx xxxxxxxx xxxxxx xxxxxx xx xxxxxxxx x xxxxxxxxxxxx §171 x xxxx. xxxxxx x. 500/2004 Xx., xxxxxxx xxx (xxxx xxx „xxxxxxx xxx“). Návrh opatření x samotné xxxxxxxx xx xxxxxxxx oznamovat xxxxx xxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx. Xxxxx xxxxxx xxxxxx xxxxxxxx x xxxxxxxxxx §25 xxxxxxxxx xxxx xxxxx, xx patnáctým xxxx xx xxxxxxxx xx xxxxxxxxx považuje xx xxxxxxxxx. Xxxx xxxxx xxx xxxxxx xxxxxxxx xx navrhuje upravit xxxxxxxxx v xxxxx 5 xxx xxx, xxx xxxxx xxx xxxxxxxxxx xxxxxxxx k xxx xxxxxxxxxx návrhu.
Platí xxxxxx úprava, xx xxxxxxx xxxxx xxxxx xxxxxxx xxxxx, xxx x xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx. Xxxxxxxxx xx xxxxxx xxxx xxxxxxx lhůta 5 xxx pro uplatnění xxxxxxxxxx k xxxxxx xxxxxxxx xxxxxx povahy xxx dne xxxx xxxxxxxxxx tak, aby xxxxxxxxxxx x xxxxxxx xxxxxxxxxx xxxxx xxxxx xx xxxxxx xxxx xxxxxx k xxxxxx xxxxxxxx na následující xxxxxxxx xxx.
Xxxxx opatření xx xxxxxxx xxxxxxxxxxxx x lze x xxxx xxxxxxxx xxxxx xxxxxxx připomínky. Xxxx xxxxx xxxxxx xxxxxx, xx xxxxxxx, xxxxx xxxxx, xxxxxxxxxx nebo xxxxx xxxxx být xxxxxxxxx obecné xxxxxx xxxxx xxxxxxx, může x návrhu uplatnit x xxxxxxxxx xxxxxx (x Ministerstva xxxxxxxxxxxxx) xxx písemné xxxxxxxxxx. Xxxxxxxxxxxx xxxx bude xxxxxxx xx xxxxxxxxxxxx xxxxxxx jako podkladem xxx xxxxxxxx obecné xxxxxx a vypořádat xx x xxxx x jeho xxxxxxxxxx. Xxxxxxxxxx §175 xxxx. 2 správního xxxx xxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxx, xxxxx xx mohly xxxxxxx xxxxxxxxxx námitky, se xxxxxxxxx. Xxxxxxxx xxxxxx xxxxxxxxx dnem x xxx stanoveným.
Co se xxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxx, platí xxxxxx xxxxxx dle xxxxxxxxxx §173 xxxx. 2 správního řádu, xxxxx xxxxxxx v xxx, xx xxxxx xxxx xxxx možné xxxxx opravný xxxxxxxxxx. Xxx ustanovení §174 xxxx. 2 xxxxxxxxx xxxx xxxxxx xxxxxxxx xxxxxx xxxxxx s xxxxxxxx xxxxxxxx xxx xxxxxxxx x xxxxxxxxxx xxxxxx. Xxxxx xxxxxxxx xxxxxx povahy xxxxxxxx xxxxxxxx xxxxxx procesní xxxxxx xxxxx xx xxxxxxxx xxxxxxxxxx, x xx x xxxxxx x zrušení opatření xxxxxx xxxxxx xxx xxxxxxxxxx §101a x xxxx. xxxxxx č. 150/2002 Sb., soudního xxxx xxxxxxxxx. Návrh xx zrušení xxxxxxxx xxxxxx xxxxxx xxx xxxxx do 3 xxx od xxxxxx xxxx xxxxxxxxx x xxxx xxx xxxxx xxxxx, xxx tvrdí, xx xxx xxx xxxxxxx na svých xxxxxxx.
Xxxxx xx jedná x časovou xxxxxxxx xxxxxxxx, lze xxx xxxxxxx xxxxxxx xxxxxxxx, xxxxx xxxx xxxxxxxx xxxxxxxxxx. Za xxxxx xxxxxx x x xxxxxx xxxxxxxxx transparentnosti xxxxxx xxxxxxx xx xxxxx xxxxxxxxxx vyhodnocovat xxxxxx přetrvávání xxxxxxxx xxxxxx povahy.
Za účelem xxxxxxxxx možnosti efektivního xxxxxxxxx x xxxxxxx, xx xx Ministerstvo xxxxxxxxxxxxx x rámci xxx xxxxxxxx xxxxx x xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxx Xxxxxx xxxxx pro xxxxxxxx xxxxx x xxxxxxxxxx údajů x xxxxxxx podle §77x.
X §80 odst. 1:
Xxxxxxxx xx úprava ohledně xxxxxxxxxxxxxxx identifikačních znaků x xxxxxxxxxxxxxx xxxxxxx.
X §82 xxxx. 3 xxxx. x):
Xxxxx xxxxxxxxx xxxxxx xxxxxx je xxxxxx x způsob xxxxxxxxxxx xxxxx x xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxx formou xxxxxx Xxxxxxxx ústavu xxx xxxxxxxx xxxxx. Z xxxxxxxx xxxxxxxxx xxxxxx xxxxxxx x xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx xxx xxxxxxxx xxxx xxxxxxx xxxxxxxxxx xx xxxxxxxxx, xxx xxx rozsah xxxxx, xxxxxx interval x xxxxxx xxxxxx xxxxxxxxxxx formou xxxxxxx xxxxxxxx xxxxxxxxxx právním xxxxxxxxx.
Xxxxxxxxxxxx xxxxxxx je xxxxx x xxxxxxx xx xxxxxx objemy x xxxxxxx xxxxxxxxx xxx, xxxxxxxx xx xxxxxx xxxxxxxxx xxxxxxxxxx x xxx dává xxxxxxx xxxxxxxxx x xxxx reagovat na xxxxx xxxxxxxxxx daného xxxxxxxx přípravku xx xxxx. Pokud xx xxxx na Xxxxx xxxxxxxxxx x xxxx, xxxx. x různých xxxxxxxx, musel xx xx Ústav xxxxxx xxxxxxxxx do xxxxxxxx xxxxxx, xxx xx xxx bylo možné xxxxxxxxx, xxxxxxxxxx x xxxxxx závěr. X xxxxxxx xx xxxxxxx xxxx, kterou má Xxxxx na xxxxxxxxxx xxxxxxx o xxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxx xxxxxxx x xxxxxx xxxxxxxx xxxxxx xxxxxx xx XX, xx xxxx xxxxx, než xxxxxxxxxxxx xxxxxx použitelná. Rovněž xx nutné xxxx x potaz, xx xxxxxxx xxxx xxxxxxx xxxxxxxx xxxxxxxx a xxxxxxxxxx x xxxxxxxxx, xxxxxxxxxxxx rovněž xxxxxxxxx xxxxxxxx, SW a xxxxxxxxxxxxx xxxxx dat, xxxxx jim jako xxxxxx xxx jejich xxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxx a xxxxxxxxxxx xxx xxxxxx x xxxxx plnění xxxxxxxxxx xxx uložených xxxxxx xxxxxxxxxxxx xxxxxx o xxxxxxxx.
K bodům 37 a 38
X §82 xxxx. 4:
Xxxxxxxxxx xxxxxxx xx požadavky xxxxx.
X §101 xxxx. 1:
Xxxxxx ústav pro xxxxxxxx xxxxx je xxxxxxxx xxxx xxxxxxxxx xxxxx xxxxx xxxxx xxxxxxxx xxxxxxxx, které xxxxxxx xxx xxxxx xxxxxxx. Xxxxxxxx Xxxxxx xxxxx xxx xxxxxxxx xxxxx vykonává xxxxx xxxxxx právních předpisů:
zákon č. 378/2007 Sb., x léčivech - xxxxxx XX,
xxxxx č. 296/2008 Sb., x lidských xxxxxxx a xxxxxxx - xxxxxx XX,
xxxxx č. 167/1998 Sb., x návykových xxxxxxx&xxxx; - xxxxxx XX,
xxxxx č. 123/2000 Sb., x xxxxxxxxxxxxxx xxxxxxxxxxxx - xxxxxx XX (xx 1. xxxxx 2015 xxxxx č. 268/2014 Sb.),
xxxxx č. 372/2011 Sb., x xxxxxxxxxxx xxxxxxxx - xxxxxx XX,
xxxxx č. 40/1995 Sb., x xxxxxxxx xxxxxxx - rezort XXX,
xxxxx č. 102/2001 Sb., x xxxxxx bezpečnosti xxxxxxx - rezort XXX,
xxxxx č. 634/1992 Sb., x ochraně xxxxxxxxxxxx - rezort XXX,
xxxxx č. 265/1991 Sb., x xxxxxxxxxx xxxxxx Xxxxx xxxxxxxxx x oblasti xxx x xxxxx č. 526/1990 Sb., o xxxxxx - xxxxxx XX,
xxxxx č. 477/2001 Sb., x obalech - xxxxxx MŽP,
zákon č. 78/2004 Sb., x nakládání x xxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxx - rezort XXX,
xxxxx č. 272/2013 Sb., x xxxxxxxxxxxx xxxx - xxxxxx MZ.
Pouze x xxxxxxxxx x xxxxxx xxxxxx xx xxxxxxxx, xx xx xxxxxxxxxx xxxxxxxxx xxx xxxxxx xxxxxxxx průkazem. U xxxxxxx xxxxx xxxxxxxx xxxxxxxx, x xxxxx xxxxxxxxxx x xxxxxxx xxxxxxxxxx xxxxx, xx xxxx xx 1.1.2014 xxxxxxxxxx xxxxxxxxxx písemným xxxxxxxxx vystaveným ad xxx. Xxx některých xxxxxxxxxx se xxxxxxxxxx xxxxxxxx xx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx xxxxxxx xxxxxx xxxx. xx kontrolu xxxxxxxxxx uložených zákonem x léčivech a xxxxxxx x xxxxxxxx xxxxxxx. X xxxxxxx xxxxxxx xx musí xxxxxxxxxx prokazovat xxx xxxxxxxxxx xxxxxxxx (xxxxx xxxxxx x xxxxxxxx), xxx x pověřením (xxxxx zákona o xxxxxxxx xxxxxxx).
X ohledem xx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxx Státního ústavu xxx xxxxxxxx xxxxx x x zajištění xxxxxx jistoty xxxxxxxxxxxxxx xxxx xx xxxxxxxx xxxxx xxxxxxxxxx xxx, xxx xxxxxxxx xx xxxxxxxx xxxx xxxxxxxx xxxxx průkazu inspektora x xxx se xxxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx léčiv xxx všech xxxxxxxxxx xxxxxxxxxxxx xxxxx právních xxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxx typem xxxxxxxx, x xxx xx xxxxxx xxxxxxxxxx, x xx xxxxx x xxxxxxx s xxxxxxxxxx xxxxx. Xxxxxxx x §22 xxxx. 1 xxxxxx o xxxxxxxx xx xxxxxxxx xxxxxxxxxxxx xxxxxxx „xxxxxxxxxx“ pro xxxxxxxxxxx Státního xxxxxx xxx kontrolu xxxxx x Ústavu xxx xxxxxx xxxxxxxx veterinárních xxxxxxxxxxxx x xxxxx, xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx, xxxxxxxxxx xxxxxx xx xx měla xxxxxxxxx x xx xxxxxxxxxx Xxxxxx pro xxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxx x xxxxx.
X §101 xxxx. 5 xxxx. x):
Xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxx a xxxxxxx xxxxxxxx xxxxxxxxx jsou x současném xxxxx xxxxxx x xxxxxxxx xxxxxxxx neprovázaně, nejasně x x xxxxxxx xxxx pouze xxx xxxxxxx klamavého označení xxxxxxxx xxxxxxxxx, v xxxxxxxx xxxxx x xxxxxxxxxx situacích zůstávají xxxxxxxxx. X xxxxx xx xxxxxx xxxxx xxxxxxx xxxxxxxxx případy, xxx Xxxxxx xxxxx xxx xxxxxxxx léčiv xxxxxx, že x xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx, xxxxx x xxxx nejsou podle xxxxxx oprávněny. Typicky xx xxxxx x xxxxxxx, xxx xxxx xxxxxx xxxxxxxxx vydávány xx xxxxxxxxx. Léčivé xxxxxxxxx xxxx xxxxxx xxxxxx xxxxxxxxxx xxxxxx x z xxxxxx xxxxxxx veřejného zdraví xx nezbytné, xxx x nimi xxxx xxxxxxxxx xxx xxxxxxx xxxxxxxx, který xxxxx xxxxxxxx, x aby xxxxxx zacházení xxxxxxxxxxxxx xxxxx xx xxxxx, xxxxx jsou k xxxx oprávněny. X xxxxxx xxxxxx xx x xxxxxx xxxxxx xxxxxx xxxxxxxxxx postup Xxxxxx při xxxxxxxxxxx, xxxxxxxxxx x xxxxxxxxxxxx xxxxxxxx xxxxxxxxx u xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxx x léčivy. Xxxx xx dosavadní právní xxxxxx rozšiřuje o xxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx.
X§103 odst. 6 xxxx. d):
Zpřesnění x xxxxxxxx stávajícího xxxxx ustanovení tak, xxx xxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxx, xxxxx xxxxxxxxx s xxxxxxxx xxxxxxxxx.
K §105 xxxx. 2:
Xxxxxxxx xx xxxxxxx r), x) a x), xxxxx xxxxxxxx správní xxxxxxx xxxxxxxxxxxx xxx xxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxx přípravku distributorem xxx xxxxxxxxxx §77 xxxx. 1 xxxx. x) (obdobně xxxx xx již xxxxxxxxx x držitelů rozhodnutí x xxxxxxxxxx), xxxxxxxxxx xxxxxxxxx distribuce xxx xxxx xxxxxxxxxx xxxxxxxxxx §77 odst. 1 xxxx. q) x xxxxxxxx xxxxxxxx obecné xxxxxx xxxxxxxx xxx xxxxxxxxxx §77x.
X §105 xxxx. 5:
X zájmu xxxxxxxxx xxxxxxxxxx nastaveného xxxxxxx sledování x xxxxxxxxxxxxx hrozby xxxxxxxxxxxxx xxxxxxxx přípravků xx xxxx xxx potřeby xxxxxxxx x České xxxxxxxxx se zavádí xxxxxxx xxxxxx xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxxxxx x neposkytnutí xxxxx x objemu xxxxxxx xxxxxxxx přípravku xxxxxxxxx xx trh x České republice xxxxx §33 odst. 2.
K bodům 46 až 65
X §105 xxxx. 6 x 7, §106 xxxx. 3, §107 xxxx. 1 x 2, §108 odst. 5, 8 x 11:
X čl. 94 xxxxxxxx xx xxxxxx xxxxxxxx xxxxxx xxxxxxxx xxxxxx xx porušení xxxxxx nařízení x xxxxxxxx veškerá xxxxxxxx xxxxxxxx x xxxxxx xxxxxxxxxxx, přičemž xxxxxxxxx xxxxxx xxxx xxx xxxxxx, xxxxxxxxx a xxxxxxxxxx. Xxxx se xxxxx xxxxxxxx zákon x léčivech x xxxxxxxx xxxxxxxx xxxxxxxxxxx x neplnění xxxxxxxxxx xxxxxxxxxxx xxx xxxxxxxxx, xxx xxxxx xxxxxxx xxxxxxx v této xxxxxxx stávající právní xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx v zákoně x xxxxxxxx.
X §107 xxxx. 1:
Xxx xxxxxx xxxxxxxxxxx xxxxxxx léčivého xxxxxxxxx xxxxxxxxxxxxx xxx xxxxxxxxxx §77 odst. 1 xxxx. x) xx xxxxxxx (obdobně, xxxx xx xxx xxxxxxxxx x xxxxxxx xxxxxxxxxxxx xxxxxxx držitelů xxxxxxxxxx x xxxxxxxxxx) xxxxxx xx 20 xxx. Xx, pro xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxx xxxx xxxxxxxxxx xxxxxxxxxx §77 xxxx. 1 xxxx. x) xx xxxxxxx xxxxxx xx 5 xxx. Xx a xxx případ porušení xxxxxxxx xxxxxx xxxxxx xxxxxxxx xxx ustanovení §77x se stanoví xxxxxx xx 20 xxx. Xx.
Xxxxx jde x výši xxxxxx, xx xxxxx xxxxxxxxxxx, xx xxxxxxxx xxxxxxx xxxxxx x xxxxxxxx č. 70/2013 Sb., xxxx xxxxxxxxxxx x tomu, xx xxxxx hranice pokut x tomto xxxxxx xxxx v xxxxxxx xxxxxxx, x xxxxx xxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxx x xxxxxx xxxxxx: „ …xx úměrně xxxx xxxxxxxx xxxxxx x xxxxx xxxxxxx xxxxx xx xxxxxxxx správních xxxxxxx x ostatních xxxxxxxxx xxxxxxxxxx xxxxxxx x léčivech. X xxxxxxxxx přistupuje poznatek x xxxxxxxxx xxxxx, xxxxx xxxxxxxx o xxx, xx xxxxxxxxx xxxx xxxxxx za xxxxxxxxxxx xxxxxxx xx x xxxxx případech xxx xxxx účinkem. X xxxxx xx xxxxxxx, xx xxx xxxxxxx xxxxxxxxxxxxx xxxxx xxxxxxxxxxxxx xxxxxx xxxxxxx x xxxxxxxxx výše xxxxx pokuty výraznou xxxxxxxx xxxx, což xx xxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx i xxxxxxxxxx účel xxxx xxxxxxx xxxxxx. Xxxxxxxxx xxxxxxx xxxxx x xxxx xxxxxxx xxxxxx xxxxxxxxxx xx xxxxxxxxxx xxxxxx x xxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxx Xxxxxxxx xxxx. Navýšením xxxxxx xx xxxxx xxxxxxx xxxxxxxxx xxxxxx odrazující xxxxx xx xxxxxxxxxxxx xxxxxxxx, xxx xx xxxx xxxxxxxx xxxx xxxx xx snížení xxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxx x této xxxxxxx. X xx xxxxxxxxxxx xxxxxxx xxxxx xxxxxxx xxxxx tyto xxxxx xxxxxxxxxx výše, xxxxx je xxxxxxxxx x xxxxxx xxxxxxxx xxxxxxxxxx, xxxx xxxxxxxxx x xxxxxx č. 634/1992 Sb., x ochraně spotřebitele, xx xxxxx pozdějších xxxxxxxx, x xxxx xx xx xxxxxxx xxxxxxx xxxxxxx xxxxxxxxx xxxxx xxxxxxx xxxxx xx xx xxxx 50 000 000 Xx.“.
Xxxx předkládanou xxxxxxx xxxxxx xx xxxxx xxxxx xxxxx xxxxxxxxx Xxxxxxxxxxx Xxxxx republiky xxxxxxxxxxx, x x xxxxxx zachovat a xxxxxxxx. Tomu odpovídají x navrhované xxxxx xxxxxxx xxxxx xx xxxxxxxx nově xxxxxxxxxxx xxxxxxxxx xxxxxxx.
Xxxxxxx xxxxxxx xxxxxxxxxxx v xxxxxxxxxxx xxxxxxx xxxxxxxx přípravku xxxxx §77 xxxx. 1 xxxx. x), xxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxx Xxxxx xxxxxxxxx xxxxx §77 xxxx. 1 xxxx. q) xxxx x xxxxxxxxxx léčivého xxxxxxxxx xxxx území Xxxxx xxxxxxxxx v xxxxxxx x xxxxxxxxx xxxxxx xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx vydaným xxxxx §77x by natolik xxxxxxxx celý xxxxxx x souhrn xxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxx xxxxxxxx v Xxxxx xxxxxxxxx, xx xx xx xxxxx xxxxxxxxx možnosti, aby xxxxx za xxxxxx xxxxxxx xxxxxxx xxxx xxxxx xxxxxx xxxxxx x xxxxxxxx xxxxx xxxx podle xxxxxx x xxxxxxxx, xxxxxx xx již podle xxxxxxxxx xxxxxx xxxxxx xxxxxx 20 000 000 Xx.
Xxxxx xxx x nově xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxxxx x xxx, že xxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxxxx xxxxx x xxxxxx dodávek xxxxxxxx přípravku uvedeného xx xxx v Xxxxx xxxxxxxxx podle §33 xxxx. 2, xxx xxxx xxxxxxxxx x xxxxxxx xxxxxxx xxxxxx, jakého xx xxxxx xxxxxxxxx právní xxxxxx xxxx xxxxxxxx xxxxxxxxxxx xxxxx §77 xxxx. 1 písm. x) nebo provozovatel xxxxxxxxx x xxxxxx xxxxxxxx xxxxxxxxx xxxxx §82 xxxx. 3 xxxx. d). Xx xxxxx xxxxx xxxxxxxxxx, xxx xxxx horní xxxxx xxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx o xxxxxxxxxx xxxxxxxxxx výši xxxxx sazby xxxxxxxxx xxxxxxxxx xxxxxxx spáchaným xxxxxx xxxxxxx.
Xxxxx xxx x xxxxxxx xxxxxxx x xxxxxxx xxxxxxxxxx xxxxxxxxx humánních léčivých xxxxxxxxx, xx xxxxx x xxxx xxxx xxxxxxxxx, že xxxx xxxxxx xxxx, xxx xxxxx toho, xx xxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxx vyjádřené v xxxxxx o xxxxxxxx, xxxx xx xxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxx již v xxxxxxxx č. 536/2014, tj. x xxxxx xxxxxxxxxxx xxxxxxxx Xxxxxxxx unie. Xxx xxxxxxxxx horní xxxxxxx možných xxxxx xx xxxxxx protiprávní xxxxxxx se xxxxx xxxxxxxxx xxxxxxxxx xxxxxx xxxx.
X §107 odst. 2:
Xxx xxxxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxx xxxxxxxx dle ustanovení §11 xxxx. x) xx xxxxxxx xxx xxxxxxx udělení xxxxxx xxxxxxxxxxx v zákazu xxxxxxxx.
X §108x x §108x:
X xxxxxx právní xxxxxxx xx v xxxxxx upravují xxxxxxxx xxx uložení xxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxx xxxxxxxxx x výslovně se xxxxxxx stanoví, že xxxxxxxxxx takového léčivého xxxxxxxxx se stává xxxx.
X §112 xxxx. 6:
Xxxx xxxxxxxx xxxxxxxx 6 zakotvuje xxxxxxxx xxxxx rozhodnout o xxxxxxx xxxxxxxxxx xx xxxxxxxxxx účtu Státního xxxxxx xxx xxxxxxxx xxxxx xx xxxxxxxx xxxx xxxxxxxx xxxxxxxx Xxxxx republiky xxx Xxxxxxxxxxxx zdravotnictví.
K bodům 68 až 72
X §114 xxxx. 1, 2 x 4:
Xxx xx xxxxx xxxxx o xxxxxxxxxxxx xxxxxxxxxx úpravu xxxxxxxxxxxx xxxxxxxxxxxx ustanovení x xxxxxx prováděcího xxxxxxxx xxxxxxxx xxx, xxx xx zákon xxxxxxxx xxxxxxxxxxx. Xxxxxx se xxxxxxxxxx xx xxxxxxxxxx, xx xxx x xxxxxxxxxx §114 xxxx. 1 zákona o xxxxxxxxxxx působnost Ministerstva xxxxxxxxxxxxx k xxxxxx xxxxxxxx x x xxxxxxxxxx §114 odst. 2 zákona x xxxxxxxxx xxxxxxxxx Ministerstva xxxxxxxxxxxxx x Xxxxxxxxxxxx xxxxxxxxxxx x vydání xxxxxxxx.&xxxx; Xx dohodě xxx xxxxx k xxxxxxxxx xxxxxxxx vyhlášky x xxxxxxx xxxxxxxx xxxxx tak, xx xxx oblast xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxx xxxxxxxx přesune xx xxxxx Ministerstva xxxxxxxxxxx.
X §114 odst. 2:
X xxxxx xxxx xxx xxx x xxxxxxxxxxxx xxxxxxxxx xxxxx x xxxxxx zmocňovacího xxxxxxxxxx, xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxx xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx přípravků xxxx nahrazována zmocňovacími xxxxxxxxxxxx xxxxxx.
Xxxxxxxxx ustanovení xxxx upravena xxx, xxx xxxxxxxxxxxx xxxxxxxxxx článku 98 xxxxxxxx x. 536/2014.
X důvodu xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxx se xxxxxxxx stanoví, xx xxxxx o xxxxxx xxxxxx xx xxxxxx xxxxxxxxx na xxxxx xxxxxx komise.
Jedná xx x xxxxxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxx x souladu xx xxxxxxxx Evropského xxxxxxxxxx x Xxxx (XX) 2015/1535 xx xxx 9. září 2015 o postupu xxx poskytování informací x oblasti technických xxxxxxxx x xxxxxxxx xxx služby xxxxxxxxxx xxxxxxxxxxx, x platném xxxxx.
K čl. V (Xxxxxxxx):
Xxxxxx účinnosti xxxxxx se xxxxxxxxx xxxxxxxx xx xxxxxx xx xxxxxx xxxxxxxx xxxxxxxxxx novely xxxxxx.
Xx xxxx, ustanovení xxxxxxx xxxxxxxx nového xxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx léčivých xxxxxxxxx xx xxxx nabýt xxxxxxxxx xxxxxxxxx 6 xxxxxx xx xxx xxxxxxxxxx xxxxxxxx Komise x Úředním xxxxxxxx Xxxxxxxx xxxx xxxxx čl. 82 xxxx. 3 xxxxxxxx x. 536/2014, xxxxxxx xxx, xxx xxxx xxxx xxxxxxxx xxxxxxxxxx, xxxxxx Ministerstvo xxxxxxxxxxxxx xxxxxx sdělení xx Sbírce xxxxxx.
Xx xxxxx, xxxxxxxxxx xxxxxxxx xx jmenování xxxxx xxxxxx xxxxxx, Xxxxxxx, xxxxxxxxx řádu xxxxxx xxxxxx x xxxxxxxxxx xxxxxxx xxxxxx xxxxxx, xx měla xxxxx xxxxxxxxx xxx prvním xxxx xxxxxxxxxxxx xxxxxx xx xxx xxxxxxxxxx xxxxxxxx Komise x Xxxxxxx věstníku Xxxxxxxx xxxx xxxxx čl. 82 xxxx. 3 xxxxxxxx x. 536/2014, neboť xxxxxx xxxxxx xxxx xxx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxx xxxxx xxxxxxxx a xxxx xxxxx, xxx s xxxxxxx x xxxxxxxxxx xxxxxx xxxxxx xxxx xxxxxxxx až v xxx nabytí účinnosti xxxxxxxx č. 536/2014.
Xx třetí, xxxxxxxxxx ohledně omezení xxxxxxxxx léčivých xxxxxxxxx xx xxxx nabýt xxxxxxxxx xxxxxx dnem xxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxxxxxx xx xxx xxxxxxxxx xxxxxx, neboť xxxxxxxxxx xxxxxxx xxxxxxxxx x xxxxxxxxxxxxx xxxxxx xxxxxxxxxxxxx léčivých xxxxxxxxx xxx xxxxxxxx xxxxxxx xxxxxxxx v Xxxxx xxxxxxxxx a xxxxxxxxx xxxxxxxxxxx opatření omezujících xxxxxxxxxx léčivých xxxxxxxxx xx xxxxxxxxx v xxxx xxxxxxxxx, xxx xxxxxxxxxxx xxxxxx xxxxxx xxxxxxx takových opatření xxxxxxxxxx, xx xxxxxxxx xxxxxx xxx přípravy, x xx zejména xx xxxxxx xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxxxxxxx x příslušných správních xxxxx.
Xx čtvrté, xxxxxxx xxxxxxxxxx xxxxxxxx v xxxxxx zákona by xxxx nabýt účinnosti xx xxxxxxxx, x xxxx je xx xxxxx, xxx xxxxxx xxxxxxxxx xxxxxx xxxx xxxxxxxxxxxx měsíce xxxxxxxxxxxxx xx xxx vyhlášení xxxxxx.
X Praze xxx 13. xxxxx 2016
předseda xxxxx
Xxx. Xxxxxxxx Xxxxxxx x. x.
xxxxxxx xxxxxxxxxxxxx
XXXx. Xxxxxxxxx Xxxxxxx, MBA, x. r.
XXXXXXXXX XXXXXXX XXXXXX XXXXXXXX XXXXXXXX X XXXXXXXX XX
Xxxxxxxxx xxxxxxx x xxxxxx novely xxxxxx x. 378/2007 Xx., o léčivech x x xxxxxxx xxxxxxxxx xxxxxxxxxxxxx zákonů (xxxxx o léčivech)
|
Navrhovaný xxxxxx xxxxxxx (resp. xxxx právní předpis) |
Odpovídající xxxxxxx EU |
|
|
Ustanovení (část, §, odst., xxxx. xxxx.) |
Xxxxx x. |
Xxxxxxxxxx (xx., xxxx., xxxx., xxx., xxxx.) |
|
Xx. 2 odst. 1 |
||
|
Xx. 83 |
||
|
Xx. 4 |
||
|
Xx. 8 xxxx. 1 |
||
|
Xx. 1 bod 22 |
||
| §51 | ||
|
Xxxxxxxx XX, xx. 4 |
||
|
Kapitola XX, xx. 9 |
||
|
Xxxxxxxx XX čl. 83 |
||
|
Xxxxxxxx XX, xx. 2, xxxx. 2, xxx 12 |
||
|
Xxxxxxxx XX, čl. 5 |
||
|
Xxxxxxxx II, xx. 2, xxxx. 2, xxx 12 |
||
|
Kapitola II, xx. 6, odst. 5 x 7 |
||
|
Xxxxxxxx XX, xx. 7 |
||
|
Kapitola XX, xx. 8 |
||
|
Xxxxxxxx X, xx. 34 |
||
|
Kapitola X, čl. 2, xxx 11 |
||
|
Xxxxxxxx II, xx. 4 |
||
|
Xxxxxxxx II, xx. 9 |
||
|
Xxxxxxxx II, xx. 8 odst. 4 |
||
|
XXX X6 |
||
|
Xxxxxxxx XX, xx. 9 |
||
|
XXX X6 |
||
|
Xxxxxxxx XX, xx. 4 |
||
|
Xxxxxxxx XX, čl. 8 xxxx. 4 |
||
|
Xxxxxxxx XX, xx. 6 |
||
|
Xxxxxxxx XX, xx. 4 |
||
|
Xxxxxxxx XX, xx. 7 |
||
|
Kapitola XX, xx. 28, xxxx. x) |
||
|
Xxxxxxxx XX, xx. 7, odst. 1 xxxx. x) |
||
|
Xxxxxxxx XXX, xx. 20 |
||
|
Kapitola XX, xx. 4 |
||
|
Xxxxxxxx I, xx. 4 |
||
|
Kapitola X, xx. 2, xxx 15 a 16 |
||
|
Kapitola XXXX, xx. 49 |
||
|
Xxxxxxxx XX, xx. 73 |
||
|
Xxxxxxxx XXXX, xx. 50 |
||
|
Xxxxxxxx XX, xx. 26 |
||
|
Xxxxxxxx XXXX, xx. 59 xxxx. 3 |
||
| 32014R0536 |
Xxxxxxxx XVIII, xx. 92 |
|
|
Xxxxxxxx XX, xx. 61, xxx 5x |
||
|
Xxxxxxxx X, xx. 68 |
||
|
Xxxxxxxx XVIII, xx. 90 |
||
|
Xxxxxxxxx 81 |
||
|
Kapitola XXX, xx. 42 odst. 3 |
||
|
Xxxxxxxx XII, xx. 76 |
||
|
Xxxxxxxx I, čl. 2, xxx 20 |
||
| §64 písm. b) |
Xx. 8 xxxx. 1 |
|
|
Xx.1 |
||
|
Xx.1 |
||
|
Xx. 94 |
||
|
Xx. 8 xxxx. 1 |
||
|
Xx. 15 |
||
|
Xx. 35 |
||
|
Čl. 36 |
||
|
Xx. 37 xxxx. 1 |
||
|
Xx. 37 odst. 5 |
||
|
Xx. 37 xxxx. 6 |
||
|
Xx. 38 xxxx. 1 |
||
|
Xx. 37 odst. 4 |
||
|
Xx. 41. xxxx. 3 |
||
|
Xx. 42 odst. 1 |
||
|
Xx. 47 |
||
|
Xx. 49 |
||
|
Čl. 52 |
||
|
Xx. 54 xxxx. 1, 2 |
||
|
Xx. 55 |
||
|
Xx. 56 |
||
|
Xx. 57 |
||
|
Xx. 58 |
||
|
Xxxxxxxx XXX, čl. 76 xxxx. 1, 2 |
||
|
Čl. 94 |
||
|
Xx. 94 |
||
|
Xx. 28 xxxx. 1 |
||
|
Čl. 41 xxxx. 1 |
||
|
Čl. 47 |
||
|
Xx. 49 |
||
|
Xx. 54 xxxx. 1 |
||
|
Xx. 58 |
||
|
Xx. 73 |
||
|
Čl.94 |
||
|
Čl. 28 xxxx. 1 |
||
|
Čl. 41 odst. 1 |
||
|
Xx. 47 |
||
|
Xx. 49 |
||
|
Čl. 54 xxxx. 1 |
||
|
Xx. 58 |
||
|
Xx. 73 |
||
|
Xxxxx xxxxxxxx EU (xxx Celex) |
Název předpisu XX |
|
XXXXXXXX EVROPSKÉHO XXXXXXXXXX X RADY (XX) x. 536/2014 xx xxx 16. dubna 2014 x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx a x xxxxxxx xxxxxxxx 2001/20/XX |
|
|
XXXXXXXX XXXXXX x přenesené xxxxxxxxx (XX) x. 1252/2014 xx xxx 28. xxxxxx 2014 xxxxxxxxxx směrnici Xxxxxxxxxx xxxxxxxxxx a Rady 2001/83/XX, pokud xxx x zásady x xxxxxx správné xxxxxxx xxxxx pro xxxxxx xxxxx xxx xxxxxxx xxxxxx xxxxxxxxx |
|
| 32004L0027 |
XXXXXXXX EVROPSKÉHO XXXXXXXXXX X XXXX x. 2004/27/XX xx xxx 31. xxxxxx 2004, xxxxxx xx xxxx směrnice 2001/83/XX x xxxxxx Společenství xxxxxxxxx se xxxxxxxxx xxxxxxxx xxxxxxxxx |
Xxxxx textu www.psp.cz


